金属活动性顺序以前是钾钠钙现在怎么是钾钙钠?
 eagle032022-10-04 11:39:541条回答
eagle032022-10-04 11:39:541条回答以前 我们在中学学的金属活动性顺序表是钾钠钙镁铝,现在中学课本怎么变成了钾钙钠镁铝,到底是为什么?

已提交,审核后显示!提交回复
共1条回复
 波拉利思888 共回答了15个问题
波拉利思888 共回答了15个问题 |采纳率86.7%- 楼上根本什么都不懂
一个判决是第一电离能,也就是气态原子失去电子的难易
一个是电极电势,考虑到了离子水化热
就是这样了,信不信随你 - 1年前
相关推荐
- 只有排在金属活动性顺序.金属才能把排在.金属从.里置换出来
 goodcell1年前1
goodcell1年前1 -
 eeLJH 共回答了18个问题
eeLJH 共回答了18个问题 |采纳率88.9%只有排在金属活动性顺序(靠前的)金属才能把排在(靠后的)金属从(其盐溶液)里置换出来.
不过Na放在水里会和水反应生成氢氧化钠和氢气.
2Na+2H2O=2NaOH+H2
K也是.
作为了解记住就可以.1年前查看全部
- 下列金属中,金属活动性最弱的是( )
下列金属中,金属活动性最弱的是( )
A. Cu
B. Fe
C. Ca
D. Ag 醴陵2381年前1
醴陵2381年前1 -
 冰凉夏宇 共回答了15个问题
冰凉夏宇 共回答了15个问题 |采纳率93.3%解题思路:根据金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,进行分析比较.由根据金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,则可知金属活动性大小为:Ca>Fe>Cu>Ag,所以D符合题意.
故选D.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 熟记金属活动性顺序,并且要学会应用.1年前查看全部
- (2008•郴州)为探究铁、铜、银的金属活动性顺序,下列各组试剂不可以的是( )
(2008•郴州)为探究铁、铜、银的金属活动性顺序,下列各组试剂不可以的是( )
A.Fe、Ag、Cu(NO3)2
B.Fe、Cu、AgNO3
C.Fe、CuSO4、AgNO3
D.Fe、Cu、Ag、HCl 阮仲容1年前1
阮仲容1年前1 -
 浪漫qq99 共回答了21个问题
浪漫qq99 共回答了21个问题 |采纳率76.2%解题思路:在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,位置在前的金属能把位于其后的金属从其盐溶液中置换出来.A、把铁伸入硝酸铜溶液中,能置换出铜,说明铁在铜前,把银伸入硝酸铜溶液中,无变化,说明铜在银前,故A正确;
B、把铁和铜伸入硝酸银中,都能置换出银,说明铁和铜在银的前面,铜与硝酸银能反应生成硝酸铜,把铁伸入生成的硝酸铜溶液中,能置换出铜,说明铁在铜的前面,故B正确;
C、把铁伸入硫酸铜中,能置换出铜,说明铁在铜前,把生成的铜伸入硝酸银中,能置换出银,说明铜在银前,故C正确;
D、把铁、铜、银伸入盐酸中,只有铁表面冒气泡,说明铁在氢前,铜和银在氢后,铜和银与生成的氯化亚铁都不反应,故无法证明铜和银的活动性,故D错误,
故选D.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 某同学在探究铝、铁、铜的金属活动性顺序时,将铝片和和铁片分别插入硫酸铜溶液中,一段时间后取出,铁片上有红色金属析出,铝片
某同学在探究铝、铁、铜的金属活动性顺序时,将铝片和和铁片分别插入硫酸铜溶液中,一段时间后取出,铁片上有红色金属析出,铝片没有反应.出现上述现象的原因是?
 青涩木瓜1年前1
青涩木瓜1年前1 -
 wuzhiyan120 共回答了29个问题
wuzhiyan120 共回答了29个问题 |采纳率89.7%fe+CusO4==fecl2+Cu
铁表面生成了CU
fecl2+Al=Fe+ALCl3
又因为 铝片 表面有一层致密的氧化膜
阻碍反映进行1年前查看全部
- 1、只要选用三种药品进行试验就可以得出Cr Al Cu三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是____
1、只要选用三种药品进行试验就可以得出Cr Al Cu三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是_______________.
2、归纳比较金属活动性强弱的方法两种_______、_______. 八卦不犯法1年前1
八卦不犯法1年前1 -
 cornchang 共回答了16个问题
cornchang 共回答了16个问题 |采纳率87.5%1. HCl CuSO4 Al2(SO4)3
2.金属从酸中置换出氢气的能力强弱
金属与盐的置换反应
金属还原性氧化性的强弱(得失电子的难易程度)
金属氧化物的水溶液的碱性强弱1年前查看全部
- 在金属活动性中,只有—— 金属(除k、Ca、Na)才能把酸中的 —— 置换反应
 雨中酒1年前1
雨中酒1年前1 -
 晨吉嘶喊 共回答了11个问题
晨吉嘶喊 共回答了11个问题 |采纳率100%活泼金属··H+(氢离子)1年前查看全部
- 下列叙述正确的是( )A.HClO可以使有色物质漂白,所以具有氧化性物质可作漂白剂B.Na的金属活动性比Mg强,故可用
下列叙述正确的是( )
A.HClO可以使有色物质漂白,所以具有氧化性物质可作漂白剂
B.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3,见光会分解,故有时在实验室看到的浓硝酸呈黄色
D.因为SO2具有较强还原性,所以不能用浓硫酸来干燥它 yologocn1年前1
yologocn1年前1 -
 宝贝vs天天 共回答了18个问题
宝贝vs天天 共回答了18个问题 |采纳率83.3%解题思路:A.具有氧化性的物质不一定能做漂白剂;
B.Na与MgCl2溶液反应生成氢氧化镁和氢气;
C.硝酸分解生成二氧化氮,二氧化氮溶于水;
D.二氧化硫与浓硫酸不反应.A.具有氧化性的物质不一定能做漂白剂,如浓硫酸,一般来说,用作漂白剂的物质通常可生成氧气,故A错误;
B.Na性质活泼,可与水反应,钠与MgCl2溶液反应生成氢氧化镁和氢气,故B错误;
C.硝酸分解生成红棕色二氧化氮,二氧化氮溶于水导致浓硝酸呈黄色,故C正确;
D.二氧化硫与浓硫酸不反应,同种元素相邻化合价,氧化剂和还原剂之间不发生氧化还原反应,故D错误.
故选C.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;硝酸的化学性质;二氧化硫的化学性质;钠的化学性质.
考点点评: 本题考查较为综合,涉及物质的漂白性、钠、硝酸以及二氧化硫的性质,为高考常见题型,侧重元素化合物知识的综合理解和运用的考查,有利于学习良好的科学素养的培养,难度中等,注意相关基础知识的积累.1年前查看全部
- 金属活动性较弱的金属能和浓H2SO4 浓HNO3反应吗?
金属活动性较弱的金属能和浓H2SO4 浓HNO3反应吗?
既然浓H2SO4 浓HNO3有强氧化性,那么它们能和Cu,Hg,Pt,Ag反应吗?
若能写出反应的方程式.
对了,还有稀HNO3 zdlawcn1年前2
zdlawcn1年前2 -
 薪水调查 共回答了23个问题
薪水调查 共回答了23个问题 |采纳率95.7%Cu+2H2SO4(浓)加热==CuSO4+SO2(g)+2H2O
Cu+4HNO3(浓)==Cu(NO3)2+2NO2(g)+2H2O
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO(g)+4H2O
Ag+2HNO3(浓)==AgNO3+NO2(g)+H2O
3Ag+4HNO3(稀)==3AgNO3+NO(g)+2H2O
就知道这些了.1年前查看全部
- 化学题,速度给答案谢谢!根据金属活动性顺序。判断下列反应是否发生?写出化学方程式1.铜跟硝酸根溶液 2.锌跟氯化铜溶液
化学题,速度给答案谢谢!
根据金属活动性顺序。判断下列反应是否发生?写出化学方程式1.铜跟硝酸根溶液 2.锌跟氯化铜溶液 3.汞跟稀盐酸溶液 4.铜跟硝酸汞溶液
 家住层城邻汉苑1年前1
家住层城邻汉苑1年前1 -
 maomao850711 共回答了19个问题
maomao850711 共回答了19个问题 |采纳率89.5%1.Cu+2AgNO3===2Ag+Cu(NO3)22.Zn+CuCl2===Cu+ZnCl23.不反应4.Cu+Hg(NO3)2====Hg+Cu(NO3)21年前查看全部
- Zn FeSO4 CuSO4 为啥不能比较金属活动性?
Zn FeSO4 CuSO4 为啥不能比较金属活动性?
Q:仅用 Zn、FeSO4溶液、CuSO4溶液能比较锌、铁、铜三种金属的活动性吗?
A:不能(标答)
……可是我觉得可以啊
先将锌放入硫酸亚铁溶液中置换出铁,再将置换出的铁放进硫酸铜溶液中,这样就能证明 Zn > Fe > Cu 呀!请帮忙解释一下吧 Vip_暖暖1年前5
Vip_暖暖1年前5 -
 大众气质o 共回答了14个问题
大众气质o 共回答了14个问题 |采纳率92.9%你这样只是想法上可以实现.如果是给你一点锌粉,FeSO4溶液,CuSO4溶液呢?你怎么做?只能是将锌粉分别加到两种溶液中,可以证明锌比铁和铜活泼,不能证明锌比铁活泼,因为无法将锌置换出的铁分离提纯出来.
懂了吧?化学是一门实验科学,做题目的时候得结合实际情况多考虑考虑,这样才会有提高.加油加油!1年前查看全部
- YZ为两种金属元素,若电解Y2+和Z2+共存的溶液时,Y先析出,则两种金属活动性强弱为?
 lingwang10221年前1
lingwang10221年前1 -
 老瘾哥 共回答了22个问题
老瘾哥 共回答了22个问题 |采纳率77.3%Y先析出,说明Y2+得电子的能力比较强,金属性就比较弱,所以Z2+>Y2+1年前查看全部
- Ca的金属活动性比Na强,但为什么与水反应时Na剧烈些?
 海藻长发1年前3
海藻长发1年前3 -
 爱琴疯子 共回答了19个问题
爱琴疯子 共回答了19个问题 |采纳率94.7%因为反应产物,Ca最后变成氢氧化钙,而氢氧化钙的溶解度不大,所以产生氢氧化钙浑浊液,在Ca表面附着,使钙和水的接触面积减少,从而降低反应速度.
所以钠比钙在水中的反应要剧烈1年前查看全部
- 水果电池正负极的选择和金属活动性有什么关系?是活动性强的做正极,还是弱的?
 定不下心的人1年前2
定不下心的人1年前2 -
 wenglp 共回答了21个问题
wenglp 共回答了21个问题 |采纳率81%这是作原电池的一种家用方法,
原理是活泼的失去电子,
所以负极活动性强,而正极可以不是金属,常见的是碳棒,
因为失去的电子是与离子溶液放生反应的.1年前查看全部
- 怎样探究金属活动性顺序(最好详细点 )
怎样探究金属活动性顺序(最好详细点 )
是实验探究题 43238891年前3
43238891年前3 -
 后花溪 共回答了20个问题
后花溪 共回答了20个问题 |采纳率90%如:将铁片放入CuSO4和ZnSO4两个溶液中,发现Cu被置换,而Zn无法被置换,所以活泼性就是:Zn>Fe>Cu1年前查看全部
- 验证Fe Cu Ag的金属活动性顺序可行的方案是
验证Fe Cu Ag的金属活动性顺序可行的方案是
每种方案所需试剂如下:
(1)Fe CuSo4溶液 Ag
(2)FeCl2溶液、Cu、AgNo3溶液
(3)Fe Cu AgNo3 溶液
(4)Fe Cu 稀盐酸 AgNo3溶液
(5)FeSo4溶液 Cu Ag
可行的方案是_______(不分单项多项)
我自己觉得是1 2 4 yell_green1年前1
yell_green1年前1 -
 微笑汇场2004 共回答了21个问题
微笑汇场2004 共回答了21个问题 |采纳率100%确实是1,2,41年前查看全部
- 下列不能判断锌,铜,银的金属活动性的是
下列不能判断锌,铜,银的金属活动性的是
A:铜,银,硫酸锌.B:硫酸铜,银,锌 C:铜,锌,稀硫酸,硝酸银.D:稀硫酸,铜,锌,银. 黑花黄1年前1
黑花黄1年前1 -
 木木刘 共回答了13个问题
木木刘 共回答了13个问题 |采纳率100%A 铜和银,都不能置换出锌 B可以,锌能置换铜,银不能 C,可以,锌能和稀硫酸反应生成氢气,铜不能,D,不能,铜和银都不能和 稀硫酸反应,只有锌能 ,1年前查看全部
- 下列金属中,金属活动性最强的是( )
下列金属中,金属活动性最强的是( )
A. Zn
B. Mg
C. Fe
D. Cu huizhi11年前4
huizhi11年前4 -
 zhouwenwen 共回答了21个问题
zhouwenwen 共回答了21个问题 |采纳率81%解题思路:常见金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、H、Cu、Hg、Ag、Pt、Au,根据常见金属的活动性顺序,可知选项中给出的金属Mg的活动性最强,故选B.
点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序完成此题,可以依据金属活动性顺序进行.要求同学们熟记金属活动性顺序.1年前查看全部
- 为何有个别金属活动性顺序强的金属,他的金属性却不强?
为何有个别金属活动性顺序强的金属,他的金属性却不强?
Sn Pb winsafe1年前5
winsafe1年前5 -
 inmager 共回答了22个问题
inmager 共回答了22个问题 |采纳率81.8%小公鸭 说反了,金属活动性是溶液中金属单质失去电子得到低价金属阳离子的性质,金属性是气态金属原子失去电子的性质.
金属性:SnPb.
金属性取决于金属元素本身的性质,而金属活动性质还受到溶液的影响.例如Li离子的水合能特别大,Li+/Li的电极电势绝对值大,因此在金属活动性中在Na之前(标准值(Li+/Li)(-3.045 V),(Na+/Na)(-2.710 9 V)).至于金属性,Li比Na弱许多.
参考数据(标准电极电势,单位V):
Sn(II)-(0) Sn2++2e-=Sn -0.1375
Pb(II)-(0) Pb2++2e-=Pb -0.1262
注意Pb在溶液中的金属活动性不是如下反应决定的:
Pb(II)-(0) PbCl2+2e-=Pb+2Cl- -0.2675 .
而
Sn(IV)-(II) Sn4++2e-=Sn2+ 0.151 >0,溶液中单质Sn涉及的自发置换反应只能把Sn氧化为Sn2+而不会成为Sn4+.1年前查看全部
- 在短周期的元素中,填写下列空白①金属活动性最强的元素在周期表中位置是__,其原子的结构示意图为__,非金属活动性最强的单
在短周期的元素中,填写下列空白
①金属活动性最强的元素在周期表中位置是__,其原子的结构示意图为__,非金属活动性最强的单质的电子式是_.由以上2种元素形成的化合物含有的化学建是_,用电子式表示出该化学建的形成过程_.⑵元素最高价氧化物的水化物,碱性最强的是_,酸性最强的是_(写化学式),由以上2种物质的水溶液发生反应的离子方程式为_ 点点寒冰1年前3
点点寒冰1年前3 -
 扬家 共回答了16个问题
扬家 共回答了16个问题 |采纳率100%第三周期第IA族,+11电子层为2、8、1;F2的电子式;离子键;就是NaF的形成过程.
NaOH,HClO4,H+ + OH- =H2O1年前查看全部
- 比较金属活动性的方法有哪些
 156433581年前1
156433581年前1 -
 楚楚湘儿 共回答了16个问题
楚楚湘儿 共回答了16个问题 |采纳率93.8%与酸反应
看从氧化物中提取难易程度1年前查看全部
- 如何证明铁的金属活动性比铜强
 娃哈哈1fk1年前3
娃哈哈1fk1年前3 -
 Premo_light 共回答了14个问题
Premo_light 共回答了14个问题 |采纳率100%1:把铁片插入硫酸铜溶液中,铁片上置换出一层红色的铜.
2:铁片和铜片用导线连接,插入稀硫酸中,铁片溶解,铜片上产生气泡.
3:铁片插入稀硫酸中产生气泡,铁片被溶解;铜插入稀硫酸中无反应.1年前查看全部
- (12分)某化学兴趣小组为了探究铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行了如下探究活动:
(12分)某化学兴趣小组为了探究铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行了如下探究活动:
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀的致密氧化膜。铬能与稀硫酸反应,生成氢气和硫酸铬(CrSO 4 )
【提出猜想】对这三种金属的活动性顺序提出了如下猜想:
猜想①:Cr>Al>Cu猜想②:Cr>Cu>Al 猜想③:Al>Cr>Cu 猜想④:Al>Cu>Cr
【讨论交流】根据已学的金属活动性顺序和已查阅的资料分析,肯定不能成立的是猜想 和猜想 (填序号)。
【实验设计及过程】请将表中的内容填写完整。
【实验反思】实验操作 实验现象 实验结论 室温下,将大小相同并打磨光亮的铬片、铝片、铜片分别浸入盛有体积相同、 相同的稀硫酸的试管中。 铬片表面产生气泡缓慢,铝片表面产生气泡较快,铜片表面 。 猜想
(填序号)成立。
(1)将金属片投入稀硫酸前应先打磨金属片的目的是 。
A.除去金属表面氧化物,有利于直接反应
B.使金属表面光亮,便于观察现象
C.使金属表面温度升高,提高反应温度
(2)有同学提出探究金属活动性强弱还可以依据“金属与金属化合物溶液是否发生置换反应”来判断。为了验证甲、乙、丙三种金属的活动性依次减弱,某同学设计了如下方案:①把甲放入乙的化合物溶液中②把乙放入丙的化合物溶液中③把甲放入丙的化合物溶液中你认为该方案中的 (填序号)没有必要做。 lanchongdouzi1年前1
lanchongdouzi1年前1 -
 puchenyang 共回答了9个问题
puchenyang 共回答了9个问题 |采纳率100%【讨论交流】②(1分) ④(1分)
【实验设计与过程】溶质质量分数(2分)没有气泡(2分)③(2分)
【实验反思】(1)A(2分) (2)③(2分)
【交流讨论】根据金属活动性顺序表,可判断金属铝的活动性比铜强,铜不能与酸发生置换反应,据此及题中信息对所提供的猜想进行评价;
【实验设计及过程】为利用金属与酸反应放出氢气的速度对比金属的活动性强弱,必须使实验中所有反应条件相同,使对比具有科学性;并根据实现中出现的现象,对金属活动性进行判断,从而得出猜想正确的评价是;
【实验反思】(1)金属铝能与氧气在常温下反应生成氧化铝,为进行实验需要除去表面的氧化铝保护层;
(2)分析所设计的三个方案所能得到的结论,综合各结论判断其中某方案不需进行也可以得出金属活动性关系,该方案即为不必要做的实验.1年前查看全部
- 为探究镁、铝、铜、银的金属活动性顺序,化学兴趣小组设计了下图三个实验(所有金属均已打磨,其形状、大小相同,所用稀硫酸的溶
 为探究镁、铝、铜、银的金属活动性顺序,化学兴趣小组设计了下图三个实验(所有金属均已打磨,其形状、大小相同,所用稀硫酸的溶质质量分数及体积相同):
为探究镁、铝、铜、银的金属活动性顺序,化学兴趣小组设计了下图三个实验(所有金属均已打磨,其形状、大小相同,所用稀硫酸的溶质质量分数及体积相同):
(1)小组同学认为,通过实验Ⅰ和Ⅱ可以比较镁和铝的金属活动性,他们依据的实验现象是______.
(2)一段时间后,取出实验Ⅲ中的铜片,观察到其表面有银白色物质,说明______.
(3)小组中有同学认为,上述实验方案不足以得出四个金属的活动性顺序.该小组设计了一个补充实验,则补充实验需选用下列哪组试剂后可以达到实验目的?______(填字母序号).
A.铝片和硫酸铜溶液B.镁片和硫酸铜溶液C.银和硫酸溶液
(4)实验前,对各金属片进行打磨的目的是______. zhuxuan3131年前1
zhuxuan3131年前1 -
 共回答了17个问题
共回答了17个问题 |采纳率76.5%解题思路:根据金属与酸反应产生气泡的速率可以判断金属的活动性强弱,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.据此分析有关的问题.(1)由于金属与酸反应产生气泡的速率可以判断金属的活动性强弱,所以,通过实验Ⅰ和Ⅱ可以比较镁和铝的金属活动性,依据的实验现象是:Ⅱ中试管产生气泡的速度快.
(2)一段时间后,取出实验Ⅲ中的铜片,观察到其表面有银白色物质,说明铜能将银从其溶液中置换出来,铜比银活泼.
(3)通过上述实验,能比较出镁比铝活泼,铜比银活泼,但不能比较铝与铜的活泼关系,则补充实验是铝片和硫酸铜溶液的反应,达到实验目的.
(4)由于金属的表面有金属氧化物,实验前,对各金属片进行打磨的目的是除去金属表面的氧化物.
故答为:(1)Ⅰ中试管产生气泡的速度快;(2)铜比银活泼;(3)A;(4)除去金属表面的氧化物.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 金属活动性顺序的应用主要表现在两个方面:一是只有排在氢前面的金属才能与酸反应,生成氢气和盐(位置越靠前,反应越剧烈),二是金属与盐溶液的反应时,只有排在前面的金属才能将排在它后面的金属从它的盐溶液中置换出来.1年前查看全部
- (2013•莆田)我国第四套人民币硬币中使用到镍(Ni)、铜、铁等金属.某兴趣小组决定探究Ni、Fe、Cu的金属活动性顺
(2013•莆田)我国第四套人民币硬币中使用到镍(Ni)、铜、铁等金属.某兴趣小组决定探究Ni、Fe、Cu的金属活动性顺序.
(1)【查阅资料】
镍能与盐酸或稀硫酸反应,生成可溶于水的正二价镍盐,并放出氢气.
①写出镍与盐酸反应的化学方程式______.
②结合所学知识,______(填“能”或“不能”)直接比较出Ni、Fe的金属活动性强弱.
(2)【探究实验】(所用金属片均已用砂纸打磨.)
(3)【迁移应用】实验步骤 实验现象 实现结论 
相同浓度的NiSO4铁片表面有固体析出,铜片表面______. 三种金属活动性由强到弱的顺序为______.
用镍片、硫酸亚铁溶液和______溶液通过实验也能判断Fe、Ni、Cu的金属活动性顺序. 穿zz的猫王1年前1
穿zz的猫王1年前1 -
 fengxianle 共回答了7个问题
fengxianle 共回答了7个问题 |采纳率85.7%解题思路:根据金属活动性顺序表进行判断,氢前边的金属会与稀硫酸、盐酸反应产生氢气,且活动性越强,产生的气泡速率越快;但氢后边的金属不会与稀硫酸、盐酸反应产生氢气;位于前边的金属会把后边的金属从其盐溶液中置换出来,Zn的活动性比Cu的强,然后利用题干叙述的内容,从中提取有用的信息,完成这三种金属的活动性探究.(1)①根据查阅的资料,Ni显正二价,故与盐酸反应时生成二价镍盐,同时生成氢气,反应的方程式为:Ni+2HCl=NiCl2+H2↑;
②镍和铁都能与盐酸或稀硫酸反应,并放出氢气,因此根据二者产生气泡的速率快慢比较二者的活动性强弱;
(2)因为镍和铁都在氢的前面,故铜不能置换出镍,观察到的现象是:没有明显现象;铁可以置换出镍,因此三种金属活动性由强到弱的顺序为:Fe、Ni、Cu;
(3)金属和盐溶液发生置换反应的规律是排在前面的金属能把排在后面的金属从其盐溶液中置换出来,所以利用金属和盐溶液的置换反应进行验证.
故可选择中间的金属与其它两种金属的盐溶液能否发生置换反应进行验证:在两只试管中分别放入打磨光亮的镍片,再加入硫酸亚铁溶液和硫酸铜溶液中;现象为:在硫酸亚铁溶液中的镍片没有变化,在硫酸铜溶液中的镍片表面出现红色物质;
故答案为:(1)①Ni+2HCl=NiCl2+H2↑;②不能;
(2)没有明显现象;Fe、Ni、Cu;
(3)硫酸铜溶液.点评:
本题考点: 金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是对金属活动性顺序的考查,运用实验探究金属的活动性顺序,考查了实验探究的过程,注重学生运用实验分析实验能力的培养,可依据氢前边的金属会与稀硫酸、盐酸反应产生氢气,但氢后边的金属不会与稀硫酸、盐酸反应产生氢气,位于前边的金属会把后边的金属从其盐溶液中置换出来进行分析.1年前查看全部
- 在金属活动性顺序中,只有排在氢之前的金属才能置换出酸中氢( )?原子,离子还是元素?
在金属活动性顺序中,只有排在氢之前的金属才能置换出酸中氢( )?原子,离子还是元素?
标准答案是:元素!为什么? 娃哈哈tmc1年前3
娃哈哈tmc1年前3 -
 马富强 共回答了19个问题
马富强 共回答了19个问题 |采纳率84.2%元素
酸是指的宏观物质,元素也是宏观概念,宏观对应宏观,微观对应微观,就是我们常说的物质对元素,分子对原子,不知你这下明白了吗.
例如:我们饮用的营养液都说的是含有多种营养元素,没说是营养原子、离子.1年前查看全部
- (2014•海淀区模拟)下列事实不能用金属活动性解释的是( )
(2014•海淀区模拟)下列事实不能用金属活动性解释的是( )
A.生活中可用铝制的水壶烧水
B.镀锌铁制品破损后,镀层仍能保护铁制品
C.工业上常用热还原法冶炼铁,用电解法冶炼钠
D.电解法精炼铜时,其含有的Ag、Au杂质沉积在电解槽的底部 lrglovezly1年前1
lrglovezly1年前1 -
 kelvinbing 共回答了25个问题
kelvinbing 共回答了25个问题 |采纳率92%解题思路:根据能体现金属活动性强弱的有:原电池的正负极,电解池的离子析出顺序,金属冶炼方式,与水反应的激烈程度,置换反应等.A.铝的表面能生成一层致密的氧化膜,阻碍了反应的进一部进行,所以可用铝制的水壶烧水,与题意无关,故A错误;
B.镀锌铁制品破损后,活泼性较强的锌作原电池的负极,活泼性较弱铁作原电池的正极,符合题意,故B正确;
C.根据金属的活动性强弱选择合适的冶炼方法,一般来说,活泼金属用电解法,较活泼金属用热还原法,不活泼金属如Hg、Ag等用热分解法冶炼,符合题意,故C正确;
D.利用电解法进行粗铜提纯时粗铜应作阳极,精铜作阴极得到电子,阴极与电池的负极得到电子,这几种金属的活动性顺序为Zn>Fe>Cu>Ag>Pt,因此在电解过程中Ag、Pt不会失去电子,而是形成阳极泥,符合题意,故D正确;
故选:A.点评:
本题考点: 常见金属的活动性顺序及其应用.
考点点评: 本题考查了金属活动性强弱的比较,常见的方法有:原电池的正负极,电解池的离子析出顺序,金属冶炼方式,与水反应的激烈程度,置换反应等..1年前查看全部
- 为什么金属活动性强的金属可以把金属活动性弱的金属从它的盐溶液中置换出来
为什么金属活动性强的金属可以把金属活动性弱的金属从它的盐溶液中置换出来
我说的是为什么,丛反应的实质来讲
天啊,我的意思是,什么粒子和什么粒子,怎么怎么结合,之类的 huangjiehue1年前4
huangjiehue1年前4 -
 Perception_memor 共回答了14个问题
Perception_memor 共回答了14个问题 |采纳率100%金属活动性越强,则其单质越容易失去电子成为离子;
金属活动性越弱,则其离子越容易得到电子变回单质;
本质上就是弱金属性的离子吸引电子的能力强,抢走了强活动性金属单质的电子;
这属于一个氧化还原反应.1年前查看全部
- 查阅资料:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但在加热条件下可以与浓硫酸反应
 查阅资料:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但在加热条件下可以与浓硫酸反应,其化学方程式为:
查阅资料:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但在加热条件下可以与浓硫酸反应,其化学方程式为:
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
反应生成的SO2是密度比空气大、易溶于水,有刺激性气味的有毒气体
现以铜、浓硫酸为原料,在加热条件下制取二氧化硫,用如图所示实验装置进行实验,发生装置为______,考虑到二氧化硫有毒,收集装置用C,二氧化硫气体应从______(填长或短)导管进入,另一端通入氢氧化钠溶液中加以吸收. fan_lily_12161年前1
fan_lily_12161年前1 -
 zd6jbh9 共回答了21个问题
zd6jbh9 共回答了21个问题 |采纳率95.2%解题思路:制取装置包括加热和不需加热两种,以铜、浓硫酸为原料,在加热条件下制取二氧化硫,用如图所示实验装置进行实验,发生装置为B;考虑到二氧化硫有毒,收集装置用C,二氧化硫气体应从长管进入,因为二氧化硫的密度比空气的密度大.以铜、浓硫酸为原料,在加热条件下制取二氧化硫,用如图所示实验装置进行实验,发生装置为B;考虑到二氧化硫有毒,收集装置用C,二氧化硫气体应从长管进入,因为二氧化硫的密度比空气的密度大,故答案为:B、长;
点评:
本题考点: 常用气体的发生装置和收集装置与选取方法.
考点点评: 本考点主要考查了气体的制取装置和收集装置的选择,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- 下列事实不能证明甲的金属活动性比乙强的是( )
下列事实不能证明甲的金属活动性比乙强的是( )
A.自然界中甲元素只以化合物形式存在,乙元素有单质形式存在
B.甲能与盐酸反应而乙不能
C.甲能从乙的盐溶液中置换出乙
D.化合物中甲元素显+3价而乙元素显+2价 卢欣刚1年前1
卢欣刚1年前1 -
 旷野冰狼 共回答了14个问题
旷野冰狼 共回答了14个问题 |采纳率85.7%解题思路:A、根据金属的存在状态可以比较金属的活动性;
B、根据金属能否与酸反应可以比较金属的活动性;
C、根据金属能否与盐溶液的反应可以比较金属的活动性;
D、根据化合价不能比较金属的活动性.A、自然界中甲元素只以化合物形式存在,乙元素有单质形式存在,说明了甲比较活泼,乙比较稳定,故A不符合题意;
B、甲能与盐酸反应而乙不能,说明了甲活泼性比较乙强,故B不符合题意;
C、甲能从乙的盐溶液中置换出乙,说明了甲活泼性比较乙强,故C不符合题意;
D、根据化合价无法比较金属的活动性,故D符合题意.
故选:D.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 比较两种金属的活动性强弱有多种方法,可以根据金属活动性顺序来比较,也可以根据与氧气等物质反应的难易程度判断.1年前查看全部
- 一道化学金属活动性顺序题有X Y Z三种金属它们发生如下的反应:X放入Z的溶液中能得到Z,Y放到X的盐溶液中得到X,Y放
一道化学金属活动性顺序题
有X Y Z三种金属它们发生如下的反应:X放入Z的溶液中能得到Z,Y放到X的盐溶液中得到X,Y放入Z的盐溶液中得到Z,三种金属的活动的顺序由强到弱排列为___________ 清清qingqing1年前8
清清qingqing1年前8 -
 实用kk 共回答了21个问题
实用kk 共回答了21个问题 |采纳率85.7%yxz
X放入Z的溶液中能得到Z 可以知道 X比Z的 金属性强 x>z
Y放到X的盐溶液中得到X 可以知道 y比x 金属性强 y>x
所以 y>x>z1年前查看全部
- 简要说明实验方法:(1)比较常温常压下,水和空气的分子间隔大小; (2)比较铁和铜的金属活动性.
 lvcc02211年前1
lvcc02211年前1 -
 同在cc 共回答了16个问题
同在cc 共回答了16个问题 |采纳率87.5%﹙1﹚相同质量比体积
﹙2﹚将铁放入硫酸铜溶液中1年前查看全部
- 为了验证铁和铜的金属活动性顺序强弱,可以设计以下方法【简要概述、现象和结论】
为了验证铁和铜的金属活动性顺序强弱,可以设计以下方法【简要概述、现象和结论】
(1)选用两种金属和一种试剂
(2)选用一种金属和一种试剂 赶紧点的吧1年前1
赶紧点的吧1年前1 -
 plumage168 共回答了14个问题
plumage168 共回答了14个问题 |采纳率92.9%1 选用两种金属和一种试剂
FE CU 加入稀盐酸中 FE会反应 有气泡 CU不反应
2选用一种金属和一种试剂
FE加入CUSO4里面 有红色的铜单质产生1年前查看全部
- (2009•宣武区一模)“金银铜铁锡”俗称五金.在这五种金属中,金属活动性最弱的是( )
(2009•宣武区一模)“金银铜铁锡”俗称五金.在这五种金属中,金属活动性最弱的是( )
A.铁
B.金
C.银
D.铜 xiaoheigrr1年前1
xiaoheigrr1年前1 -
 huangshihao001 共回答了15个问题
huangshihao001 共回答了15个问题 |采纳率100%解题思路:根据已有的知识进行分析,在金属活动性顺序中,锡>铁>铜>银>金.锡>铁>铜>银>金,活动性最弱的是金,观察选项,故选B.
点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序,完成此题,可以依据已有的知识进行.1年前查看全部
- 某班同学做验证铁、铜、银的金属活动性顺序的实验,用到的药品有铁丝、铜丝、银丝、稀硫酸和硫酸铜溶液.实验结束后,化学兴趣小
某班同学做验证铁、铜、银的金属活动性顺序的实验,用到的药品有铁丝、铜丝、银丝、稀硫酸和硫酸铜溶液.实验结束后,化学兴趣小组的同学欲对该实验的废液进行探究,请你一起参与.
【提出问题】废液中含有什么物质?
【交流表达】
(1)小明通过观察,认为废液中一定含有硫酸铜.他观察到的现象是.
(2)小红通过分析,认为废液中一定含有硫酸亚铁,她的依据是:
【作出猜想】小华认为废液中还可能含有硫酸.
【实验验证】
(1)小华测得废液的pH小于7,证明废液中含有硫酸.用pH试纸测定溶液pH的方法:(2小明取少量废液,向其中滴加氢氧化钠溶液,也得到了相同的结论.小明的实验现象是.
通过分析与实验,同学们得出废液中含有硫酸亚铁、硫酸铜和硫酸
【拓展应用(主要是这一问)】
若反应后的废液用氢氧化镁来处理(氢氧化镁只和硫酸反应).100g废液需要氢氧化镁11.6g,求废液中硫酸的溶质质量分数 ziye0211年前1
ziye0211年前1 -
 绝世oo889 共回答了14个问题
绝世oo889 共回答了14个问题 |采纳率92.9%1)用玻璃棒沾取少量试液,滴道白瓷版上的ph试纸上,比色.
2)滴入氢氧化钠,不产生沉淀.
Mg(OH)2 58
11.6g 0.2 mol
可反应 0.2 mol H2SO4 98g/mol
合 19.6g
19.6%1年前查看全部
- 有关金属活动性的问题已知溶液中含有H+,Cu2+,Fe3+,现往溶液中加Fe粉;能根据金属活动性,得出Fe与各离子反应先
有关金属活动性的问题
已知溶液中含有H+,Cu2+,Fe3+,现往溶液中加Fe粉;能根据金属活动性,得出Fe与各离子反应先后顺序吗?请叙述理由.
金属活动性是 (高)…Zn Fe …Pb (H) Cu … (低)
或者,能根据反应的电极电势判断吗?(电极电势是体现反应的热力学还是动力学问题?原题又是体现反应的热力学还是动力学问题?) 嘻哈女孩1年前3
嘻哈女孩1年前3 -
 o13829928133 共回答了20个问题
o13829928133 共回答了20个问题 |采纳率95%在氧化还原反应中,首先是还原性最强的与氧化性最强的发生反应,而此反应中铁离子的氧化性强于铜离子,所以首先铁与铁离子反应生成亚铁离子,该反应完成后,如果铁有剩余,再与铜 离子反应生成单质铜.
氧化性强弱顺序 金属阳离子:Fe3+、Cu2+、(H+)1年前查看全部
- (2013•南岗区一模)张南同学为了验证铝、铜、银的金属活动性顺序,设计了如下实验方案:将铝丝、银丝分别插入到硝酸铜溶液
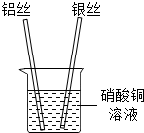 (2013•南岗区一模)张南同学为了验证铝、铜、银的金属活动性顺序,设计了如下实验方案:将铝丝、银丝分别插入到硝酸铜溶液中,如图,根据实验现象可以判断出三种金属的金属活动性强弱顺序.请回答下列问题.
(2013•南岗区一模)张南同学为了验证铝、铜、银的金属活动性顺序,设计了如下实验方案:将铝丝、银丝分别插入到硝酸铜溶液中,如图,根据实验现象可以判断出三种金属的金属活动性强弱顺序.请回答下列问题.
(1)判断铝的活动性比铜强的现象是______;若没有观察到预期现象,其原因是______(不考虑硝酸铜溶液).
(2)上述实验中发生反应的化学方程式为______;由此实验得出三种金属的活动性顺序为______. NICOLE_MAOMAO1年前1
NICOLE_MAOMAO1年前1 -
 mitchboy 共回答了19个问题
mitchboy 共回答了19个问题 |采纳率89.5%解题思路:根据在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来分析现象及结论.(1)铝的活动性比铜强,因此会置换出硫酸铜中的铜,现象为:铝的表面附着一层红色的固体;若铝没有除锈,表面有一层致密的保护膜,就不会和硫酸铜发生反应,因此观察不到预期现象;
(2)铝与硝酸铜反应生成硝酸铝和铜,反应的化学方程式为:2Al+3Cu(NO3)2=2Al(NO3)3+3Cu;由于在银的表面不会出现一层红色的固体,说明银的活动性比铜弱,因此三种金属的活动性顺序为:铝>铜>银;
故答案为:(1)铝的表面附着一层红色的固体;铝没有除锈,表面有一层致密的保护膜;(2)2Al+3Cu(NO3)2=2Al(NO3)3+3Cu;铝>铜>银.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行分析,还要注意化学方程式的书写.1年前查看全部
- 为研究锌和铝的金属活动性,某研究小组进行了如下探究。
为研究锌和铝的金属活动性,某研究小组进行了如下探究。
(1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出锌与盐酸反应的化学方程式 。
(2)小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是
。
(3)小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。
【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl 3 为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】假设a:该灰黑色沉淀可能含有 ;
假设b:该灰黑色沉淀可能含有AlCl 3 ;
假设c:该灰黑色沉淀可能含有难溶于酸的物质。
【设计并完成实验】取灰黑色沉淀分别进行如下实验。
【得出结论】由实验①可判断假设c (填“成立”或“不成立”),再集合②和③可得出该灰黑色沉淀的成分是 。实验编号 实验操作 实验现象 ① 加入适量稀盐酸 有微量气泡,固体全部溶解,得到澄清溶液 ② 加入适量蒸馏水 固体部分溶解 ③ 加入适量无水乙醇 固体部分溶解
(4)你认为①中小明的实验能否比较锌和铝的金属活动性强弱? (填“能”或“不能”),分别从 设计方法和操作可行性的角度,具体说明理由
。 fanzidan1年前1
fanzidan1年前1 -
 风凌乱 共回答了12个问题
风凌乱 共回答了12个问题 |采纳率75%(1)Zn+2HCl==ZnCl 2 +H 2 ↑ (2)未去膜的铝片表面有氧化铝(氧化膜),氧化铝先与盐酸反应 (3)铝 (或铝和氯化铝),不成立 ,铝和氯化铝 (4)不能 小明的实验方案中未控制金属的纯度...1年前查看全部
- (2013•丽水)某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去氧化膜的镁条、铝条分别与相同体积、相同质量分
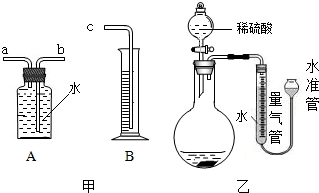 (2013•丽水)某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去氧化膜的镁条、铝条分别与相同体积、相同质量分数的稀硫酸反应,测定两种金属与稀硫酸反应得到相同体积氢气所需要的时间.
(2013•丽水)某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去氧化膜的镁条、铝条分别与相同体积、相同质量分数的稀硫酸反应,测定两种金属与稀硫酸反应得到相同体积氢气所需要的时间.
(1)利用图甲中A、B仪器可以组装一套实验室测量氢气体积的装置,该装置导管的连接顺序是______.
(2)图乙中量气管和水准管也可以用来测量氢气体积,为了准确地测量氢气体积,在读取量气管中液面读数的过程中,应注意______(填字母编号).
A、读数时视线与凹液面最低处相平
B、读数前应上下移动水准管,待两管液面相平再读数
C、保持水准管静止,待水准管中液面不再上升时再读数. bridget_tsi1年前1
bridget_tsi1年前1 -
 aicgliu 共回答了15个问题
aicgliu 共回答了15个问题 |采纳率73.3%解题思路:(1)根据氢气不易溶于水,通过排水法把水排入量筒内,量筒内水的体积就是收集到氢气的体积分析;
(2)在测量氢气体积时,为了使测量更为准确,要注意上下移动水准管,使左右两管的液面相平,以使量气管中的气压与大气气压相等,读数时视线应与左管内凹液面最低处相平,以减少观察误差.(1)利用等量代替的方法,量筒内水的体积就是收集到氢气的体积可知该装置导管的连接顺序是:b接c;
(2)读数时,要注意视线应于量气管凹液面的最低处保持水平;每次读数前应上下移动水准管,待两管液面相平再读数是为了防止水的压强造成的误差;故选AB.
故答案为:(1)b接c;(2)AB.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了量气的方法,关键是把握实验原理和操作方法,注重压强知识的运用及读数的方法.1年前查看全部
- (2010•青岛)某化学兴趣小组为探究铁、铜、锌、银的金属活动性顺序,设计了下图所示的三个实验(其中金属均已打磨,且形状
 (2010•青岛)某化学兴趣小组为探究铁、铜、锌、银的金属活动性顺序,设计了下图所示的三个实验(其中金属均已打磨,且形状、大小相同;所用盐酸的溶质质量分数、用量也相同).下列判断中,错误的是( )
(2010•青岛)某化学兴趣小组为探究铁、铜、锌、银的金属活动性顺序,设计了下图所示的三个实验(其中金属均已打磨,且形状、大小相同;所用盐酸的溶质质量分数、用量也相同).下列判断中,错误的是( )
A.通过上述三个实验,不能判断出四种金属的活动性顺序
B.若增加一个铜锌活动性比较的实验,则可判断出四种金属的活动性顺序
C.通过实验①和③的反应剧烈程度,可以判断出铁和锌的金属活动性强弱
D.通过实验的反应现象,可以判断出铜和银的金属活动性强弱 幻魔狼1年前1
幻魔狼1年前1 -
 charlesdhu 共回答了14个问题
charlesdhu 共回答了14个问题 |采纳率85.7%解题思路:根据金属活动性顺序可知锌的活动性比铁的活动性强且都排在氢的前面,因此根据题意可知:锌的金属活动性比铁强;铜的活动性比银的活动性强,因此铜放入硝酸银溶液中会将银置换出来,从而得出铜的活动性比银强;铁的活动性比铜的活动性强,但是,题目中没有设计实验验证.实验①、③中的铁和锌都能与酸反应产生气泡,活动性越强反应越剧烈,锌的金属活动性比铁强,答案C正确;实验②中铜放入硝酸银溶液中会将银置换出来,从而得出铜的活动性比银强,答案D正确;该实验得出结论有锌的金属活动性比铁强,铜的活动性比银强,却没有设计铁的活动性比铜强的实验,因此答案A正确;B答案增加一个铜、锌活动性实验的比较,能得出锌的活动性比铜强的结论,却仍没有设计铁的活动性比铜强的实验,B答案不正确.
故选B.点评:
本题考点: 金属活动性的探究;金属活动性顺序及其应用.
考点点评: 金属活动性顺序的应用主要表现在两个方面:一是只有排在氢前面的金属才能与酸反应,生成氢气和盐(位置越靠前,反应越剧烈),二是金属与盐溶液的反应时,只有排在前面的金属才能将排在它后面的金属从它的盐溶液中置换出来.1年前查看全部
- 根据金属活动性顺序分析,下列描述或判断正确的是( )
根据金属活动性顺序分析,下列描述或判断正确的是( )
A. 金属钾能与硫酸锌溶液发生化学反应得到金属锌
B. 金属铁与硫酸溶液反应后所得溶液的质量比原溶液的质量增大
C. 在常温下,铝比镁更容易与氧气发生化学反应
D. 金属铜与氯化银反应得到金属银 哥伦比亚树蛙1年前1
哥伦比亚树蛙1年前1 -
 jian841128 共回答了24个问题
jian841128 共回答了24个问题 |采纳率87.5%解题思路:A、钾的活动性大于锌的,但应考虑钾的金属活动性太强,它与水反应生成氢氧化钾和氢气;
B、金属铁与硫酸溶液反应生成硫酸亚铁和氢气;
C、根据金属活动性顺序“K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au”可知,金属活动性:Mg>Al;
D、氯化银不溶于水,所以金属铜与氯化银反应不能得到金属银.A、钾与水反应生成氢氧化钾与硫酸锌反应生成氢氧化锌沉淀和硫酸钾,而不会生成金属锌,故A错误;
B、利用假设法,假设由56克铁与硫酸反应,则生成2克氢气;根据质量守恒定律,则溶液的质量增加了54克,故“金属铁与硫酸溶液反应后所得溶液的质量比原溶液的质量增大”说法正确,故B正确;
C、在常温下,铝比镁更容易与氧气发生化学反应,说法错误,因为金属活动性:Mg>Al,故C错误;
D、因为较活泼的金属能把比它活动性差的金属从它对应的盐溶液中置换出来,而氯化银不溶于水,所以“金属铜与氯化银反应得到金属银”,说法错误,故D错误.
故选B.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 熟记金属活动性顺序“K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au”及其应用原则,学会处理实际问题.1年前查看全部
- (1)应用金属活动性顺序能帮助我们进一步学习金属性质.已知下列各组物质间均能发生置换反应.
 (1)应用金属活动性顺序能帮助我们进一步学习金属性质.已知下列各组物质间均能发生置换反应.
(1)应用金属活动性顺序能帮助我们进一步学习金属性质.已知下列各组物质间均能发生置换反应.
A.Fe 和CuSO4 溶液B.Mg和MnSO4 溶液C.Mn和FeSO4 溶液
①写出B反应的化学方程式______.
②Mn、Fe、Mg、Cu四种金属的活动性由强到弱的顺序______.
③图是等质量的稀硫酸分别与等质量的镁、铁、锌三种金属反应,生成氢气质量与反应时间之间关系图,其中表述正确的是______
A.反应结束后,生成氢气质量相同
B.反应结束后,稀硫酸有剩余
C.反应结束后,镁、铁一定有剩余,锌可能有剩余
D.三种金属中镁的反应速率最快
(2)电化学腐蚀是金属腐蚀的主要原因.当两种活泼性不同的金属在潮湿的环境中接触时,因形成原电池,活泼性强的金属首先被腐蚀.利用这一原理,为了保护轮船的钢质外壳,通常在行驶的轮船外壳上连接______.(填“铜板”、“锌板”). 张杰5211年前1
张杰5211年前1 -
 小妖精jie 共回答了16个问题
小妖精jie 共回答了16个问题 |采纳率87.5%解题思路:(1)①根据金属与盐的反应规律,写出B反应的化学方程式;
②根据Mn、Fe、Mg、Cu四种金属及其化合物间可发生的反应,推断Mn、Fe、Mg、Cu四种金属活动性由强至弱的顺序;
③根据镁、铁、锌三种金属的活泼性以及与硫酸的反应分析;
(2)根据题意,找出比铁活泼的金属.(1)①由题意可知:B反应的化学方程式 Mg+MnSO4═Mn+MgSO4;
②由题意可知:Fe 和CuSO4 溶液、Mg和MnSO4 溶液、Mn和FeSO4 溶液均能发生反应,得出金属的活泼性的强弱是分别是:Fe>Cu,Mg>Mn,Mn>Fe;所以四种金属的活泼性强弱是:Mg、Mn、Fe、Cu;
③由图象可知,产生的氢气的质量相同,则酸全部参加反应;与酸反应生成等质量的氢气,需要金属的质量关系为锌>铁>镁;在金属活动性顺序中,镁>锌>铁,故镁反应最快,观察选项,故选ACD;
(2)由题意可知,当两种活泼性不同的金属在潮湿的环境中接触时,因形成原电池,活泼性强的金属首先被腐蚀.为了保护轮船的钢质外壳,需要连接活泼性强于铁的金属,所以应连接锌板.
故答为(1)①Mg+MnSO4═Mn+MgSO4;②Mg、Mn、Fe、Cu;③ACD;(2)锌板.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 熟练掌握金属活动性顺序及其应用,在金属活动性顺序中,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- 金属活动性与耐腐蚀性有什么关系吗
 mylovekk1年前1
mylovekk1年前1 -
 xiaosong1130 共回答了12个问题
xiaosong1130 共回答了12个问题 |采纳率100%有的,一般来说,金属活动性强的金属很容易和其他物质起反应,尤其是氧化性物质以及酸,因此当然不耐腐蚀,而活动性差的金属很不容易起反应,这也是为什么金银可以做货币以及电极等的原因.不过例外是铝、铁和冷的浓酸反应表面会起一层致密的氧化膜,阻止反应继续发生.这种情况下反而“耐腐蚀”了1年前查看全部
- (2006•朝阳区一模)如图所示是探究铜、铁、银三种金属活动性顺序的实验设计,请回答:
 (2006•朝阳区一模)如图所示是探究铜、铁、银三种金属活动性顺序的实验设计,请回答:
(2006•朝阳区一模)如图所示是探究铜、铁、银三种金属活动性顺序的实验设计,请回答:
(1)观察到的实验现象是______;
(2)从中可以得到的实验结论为______. 研究烟酒生1年前1
研究烟酒生1年前1 -
 明天是晴天 共回答了19个问题
明天是晴天 共回答了19个问题 |采纳率84.2%解题思路:根据金属活动顺序表中铁、铜、银的金属活动性强弱去作答.位置在前的金属可以把位于其后的金属从其盐溶液中置换出来.(1)由于铜、铁、银这三种金属的金属活动性由强到弱的顺序为铁>铜>银.所以,将铁丝、银丝插入到硫酸铜的溶液中.观到达的现象是:铁丝表面覆盖一层红色物质,银丝表面无现象,溶液由蓝色逐渐变为浅绿色;
(2)由上述实验可知,由于铁能置换出硫酸铜中的铜,银不能置换出硫酸铜中的铜.从中可以得到的实验结论为:三种金属活动性由强到弱的顺序为:铁、铜、银.
故答为:(1)铁丝表面覆盖一层红色物质,银丝表面无现象,溶液由蓝色逐渐变为浅绿色;(2)三种金属活动性由强到弱的顺序为:铁、铜、银.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- X、Y、Z、W是四种不同的金属,某同学为比较金属活动性的强弱,进行如下实验.(能发生置换反应的记“√”,不能反应的记为“
X、Y、Z、W是四种不同的金属,某同学为比较金属活动性的强弱,进行如下实验.(能发生置换反应的记“√”,不能反应的记为“-”,无标记的表示未做该实验.)这四种金属的活动性顺序是( )
X Y Z W 盐酸 √ - - Z的硝酸盐 √ - W的硝酸盐 √ -
A.X>W>Y>Z
B.X>Y>W>Z
C.W>X>Y>Z
D.Y>W>Z>X 一只背着壳的蜗牛1年前1
一只背着壳的蜗牛1年前1 -
 simagood 共回答了19个问题
simagood 共回答了19个问题 |采纳率78.9%解题思路:要比较金属活动性的强弱可以结合图表,然后根据金属活动顺序表判断(金属活动顺序表中一般位置越后的金属,金属性越弱,原子的还原性越弱)、与酸反应的程度和根据物质间的置换反应来判断即可.首先根据X、Y、Z、W是四种不同的金属,其中X、可以和盐酸反应,说明X金属活动性强于Y、Z和W,所以排除CD项;
然后根据Y能置换出Z的硝酸盐中的Z,说明,Y的金属活动性强于Z,Y>Z;又Y不能置换出W的硝酸盐,说明W>Y;综合以上分析得到:X>W>Y>Z
故选A点评:
本题考点: 金属活动性顺序及其应用;金属活动性的探究;金属的化学性质.
考点点评: 本题是结合图标来考查学生的判断金属的活动性强弱,通过此题我们可以总结出判断金属活动性强弱的方法如下:①依金属活动顺序表判断 ②根据金属单质与水或酸反应置换出氢的难易判断③根据物质间的置换反应来判断.1年前查看全部
- 验证 铁 镁 铜的金属活动性控制什么不变
验证 铁 镁 铜的金属活动性控制什么不变
讲3中金属插入装有稀硫酸的试管中,除了控制的金属体积,溶液的体力,质量分数一样外还需要控制什么? 申酉戍亥1年前1
申酉戍亥1年前1 -
 tina_sang 共回答了27个问题
tina_sang 共回答了27个问题 |采纳率96.3%反应温度.插入金属与溶液的接触面积1年前查看全部
- 原电池中如何比较金属活动性强弱
 小媚儿1年前1
小媚儿1年前1 -
 上树的pig 共回答了15个问题
上树的pig 共回答了15个问题 |采纳率80%1、原电池中,作为正负极的选择
负极反应:失去电子,金属越活泼,越容易失去电子,作为负极
正极反应:得到电子.
所以,金属活动性越强,越容易失去电子,作为负极.
2、金属电极与氢电极组成电池
金属离子/金属电极,与H+/H2组成电池的二极,若金属活动性强于H2的,与氢电级组成电池时,作为负极,电极电势为负值.
金属活动性弱于H2的,作为电池正极,电极电势为正值.1年前查看全部
- 金属活动性的比较比较Fe、Cu、Ag的金属活动性,将三种金属片用导线两两连接,插入稀硫酸中为什么不行呢?
 余向秋1年前2
余向秋1年前2 -
 ee机遇安徽 共回答了15个问题
ee机遇安徽 共回答了15个问题 |采纳率93.3%铁的金属性可以利用原电池原理分别和铜、银连接鉴别活泼性,实际上氧化还原反应中是铁和硫酸制取氢的反应;而铜、银的活泼性比氢弱,故铜银两种金属的导线相连时,两种金属都排在氢后面两个电极都相当于不活泼电极.1年前查看全部
- 一种物质在自然界中常以游离的方式存在它的金属活动性强还是弱?
 葫芦兄弟三娃1年前3
葫芦兄弟三娃1年前3 -
 xiaoliyoyo15 共回答了15个问题
xiaoliyoyo15 共回答了15个问题 |采纳率93.3%很弱 能以游离态存在说明它很稳定不易被氧化 故金属性很弱1年前查看全部
- 人类的生活和生产都离不开金属.下面对金属的利用不是由金属活动性决定的是( )
人类的生活和生产都离不开金属.下面对金属的利用不是由金属活动性决定的是( )
A. 用铁回收含银废液中的银
B. 用锌与稀硫酸反应制取氢气
C. 古代金银制品能保存至今
D. 用铝合金制作门窗框架 gny3331年前1
gny3331年前1 -
 pzj1517 共回答了18个问题
pzj1517 共回答了18个问题 |采纳率94.4%解题思路:在金属活动性顺序中,氢前的金属能与酸发生置换反应,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,据此进行分析判断.A、用铁回收含银废液中的银,是利用铁能将位于其后的银从其盐溶液中置换出来,是由金属活动性决定的,故选项不符合题意.
B、用锌与稀硫酸反应制取氢气,是利用氢前的金属能与酸发生置换反应生成氢气,是由金属活动性决定的,故选项不符合题意.
C、用金、银制首饰是利用这两种金属化学性质稳定,不易与氧气反应的性质,是由金属活动性决定的,故选项不符合题意.
D、用铝合金制作门窗框架是利用其密度小、易于加工等性质,不是由金属活动性决定的,故选项符合题意.
故选:D.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题难度不大,考查了金属活动性顺序的应用,理解金属活动性顺序的应用及其应用是正确解答本题的关键.1年前查看全部
大家在问
- 1谁能告诉我怎样才能快速学会“三角函数”
- 2听1段材料,回答1-2题。 1. Who went to the concert? [
- 3化学中石灰乳是什么
- 4— How many &
- 5有梅,其实七兮.求我庶士.迨其吉兮.有梅,其实三兮.求我庶士,迨其今兮 诗句的意思是什么?
- 6取3.2g某物质R在4.8g氧气中恰好完全燃烧,生成3.6g水和4.4g二氧化碳,则R含有C、H、O三种元素.怎么算
- 7在《敬业与乐业》中,作者说;“苦乐全在主观的心,不在客观的事”,你是否赞同作者的观点?试举例说明.
- 8英语翻译---We just saw John at the bookstore.---That’s strange;
- 9我热爱,但却无法追求 作文
- 10对括号部分提问:1 I hope to understand (Beijing Opera)ne
- 11一个修路队,原来计划每天修400米,15天可以完成任务.结果12天完成任务,实际 每天修多少米?用比例解
- 12在直角三角形ABC中,∠C=90°,∠A=60°,AC=3cm,将△ABC绕点B转至△A‘B‘C‘的位置
- 13文言文理解一日,见二虫斗草间,观之欲浓,忽有庞然大物,拔山倒树而来,盖以癞蛤蟆————————————方啥意思?鞭啥意思
- 14现代汉语的动词与形容词能否充当主语?
- 15英语同义句转换(在线等)Please give the camera to the man.Please give th
