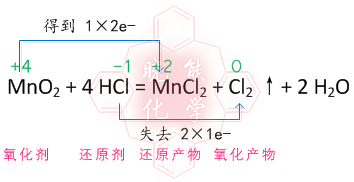
MnO2+4HCl=(加热)MnCl2+2H2O+Cl中谁是还原剂?MnCl2中的Mn是正几价?
 科技活动发2022-10-04 11:39:543条回答
科技活动发2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 glidingroc 共回答了20个问题
glidingroc 共回答了20个问题 |采纳率85%- 反应后化合价升高为还原剂,降低为氧化剂.HCl是还原剂,Mn是+2价
- 1年前
 卟囡怖钕 共回答了484个问题
卟囡怖钕 共回答了484个问题 |采纳率- 还原剂是HCl。
在盐酸中有一半是还原剂,另一半起酸的作用。
MnCl2中的Mn是正2价 - 1年前
 iamluyang 共回答了7个问题
iamluyang 共回答了7个问题 |采纳率- 高还失
在氧化还原反应中,化学价升高的为还原剂且丢失电子
MnO2是还原剂
Cl只有-1价 所以MnCl2中的锰为+2价 - 1年前
相关推荐
- 实验室用17.4g的MnO2与100mL足量的浓盐酸制取氯气:MnO2+4HCl (浓)
实验室用17.4g的MnO2与100mL足量的浓盐酸制取氯气:MnO2+4HCl (浓)
MnCl2+Cl2↑+2H2O△ .
(1)求生成氯气的体积(标准状况).
(2)求参加反应的HCl的物质的量.
(3)假设反应后溶液的体积不变(仍为100mL),求生成的MnCl2的物质的量浓度. kekexili881年前1
kekexili881年前1 -
 汤水中的鼠标 共回答了22个问题
汤水中的鼠标 共回答了22个问题 |采纳率81.8%解题思路:n(MnO2)=[17.4g/87g/mol]=0.2mol,反应方程式为MnO2+4HCl (浓)
MnCl2+Cl2↑+2H2O,根据方程式计算相关物理量.△ .n(MnO2)=[17.4g/87g/mol]=0.2mol,
MnO2+4HCl (浓)
△
.
MnCl2+Cl2↑+2H2O
1 411
0.2mol n(HCl)n(MnCl2)n(Cl2)
(1)n(Cl2)=0.2mol,V(Cl2)=0.2mol×22.4L/mol=4.48L,
答:生成氯气的体积为4.48L.
(2)n(HCl)=4×n(MnO2)=4×0.2mol=0.8mol,
答:参加反应的HCl的物质的量为0.8mol.
(3)n(MnCl2)=n(MnO2)=0.2mol,
c(MnCl2)=[0.2mol/0.1L]=2mol/L,
答:生成的MnCl2的物质的量浓度为2mol/L.点评:
本题考点: 化学方程式的有关计算;物质的量浓度的相关计算.
考点点评: 本题考查化学方程式的相关计算,题目难度不大,注意相关基础知识的积累.1年前查看全部
- 实验室制备CL2MnO2+4HCl(浓)==MnO2+Cl2+2H2O 的反应其中不正确的是 A.还原剂是HCL,氧化剂
实验室制备CL2MnO2+4HCl(浓)==MnO2+Cl2+2H2O 的反应其中不正确的是 A.还原剂是HCL,氧化剂是MnO2 B.每
实验室制备CL2MnO2+4HCl(浓)==MnO2+Cl2+2H2O 的反应其中不正确的是
A.还原剂是HCL,氧化剂是MnO2
B.每生成1molCL2,转移电子的物质的量为2mol
C.每消耗1molMnO2,起还原剂作用的HCl为4mol
D.转移电子的物质的量为1mol时,生成标况下的Cl2的体积为11.2L 雨汀爱栀子1年前2
雨汀爱栀子1年前2 -
 向欣 共回答了20个问题
向欣 共回答了20个问题 |采纳率95%这个肯定选C啊.起还原剂作用的HCL是2mol.另外2mol是酸性
有问题请追问1年前查看全部
- 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)⇌MnCl
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)⇌MnCl2+Cl2↑+2H2O.现将23.2g含MnO2的质量分数为75%的软锰矿石与200克36.5%的浓盐酸(过量)完全反应(杂质不参加反应).把反应后所得溶液稀释成400ml.计算(保留3位有效数字):
(1)生成的Cl2的体积(标准状况).
(2)参加反应的HCl的物质的量.
(3)稀释后溶液Cl-的物质的量浓度是多少. 我缺钱ing1年前1
我缺钱ing1年前1 -
 百日缘 共回答了13个问题
百日缘 共回答了13个问题 |采纳率69.2%解题思路:(1)根据质量分数计算软锰矿中二氧化锰的质量,再根据n=mM计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积;(2)根据方程式计算参加反应的HCl的物质的量;(3)计算HCl总质量,根据n=mM计算HCl总物质的量,根据氯原子守恒,可知n(Cl-)=n总(HCl)-2n(Cl2),根据c=nV计算稀释后液中Cl-的物质的量浓度.(1)23.2g含MnO2的质量分数为75%的软锰矿石中MnO2的物质的量为:[23.2g×75%/87g/mol]=0.200mol,则:
MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O
1 1
0.2mol n(Cl2)
所以n(Cl2)=0.2mol,故V(n(Cl2)=0.2mol×22.4L/mol=4.48L,
答:标准状况下生成的Cl2的体积为4.48L;
(2)由方程式可知,参加反应的HCl的物质的量为0.200mol×4=0.800mol,
答:参加反应的HCl为0.800mol;
(3)HCl总质量=200g×36.5%,HCl总物质的量=[200g×36.5%/36.5g/mol]=2mol,根据氯原子守恒,可知n(Cl-)=n总(HCl)-2n(Cl2)=2mol-0.2mol×2=1.6mol,稀释后液中Cl-的物质的量浓度=[1.6mol/0.4L]=4.00mol/L,
答:稀释后液中Cl-的物质的量浓度为4.00mol/L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查根据方程式的计算,旨在考查学生对基础知识的理解掌握,(3)中注意利用原子守恒进行解答,难度中等.1年前查看全部
- 实验室用17.4g的MnO2与100mL足量的浓盐酸制取氯气:MnO2+4HCl (浓)
实验室用17.4g的MnO2与100mL足量的浓盐酸制取氯气:MnO2+4HCl (浓)
MnCl2+Cl2↑+2H2O△ .
(1)求生成氯气的体积(标准状况).
(2)求参加反应的HCl的物质的量.
(3)假设反应后溶液的体积不变(仍为100mL),求生成的MnCl2的物质的量浓度. lcb12241年前3
lcb12241年前3 -
 51act 共回答了19个问题
51act 共回答了19个问题 |采纳率84.2%解题思路:n(MnO2)=[17.4g/87g/mol]=0.2mol,反应方程式为MnO2+4HCl (浓)
MnCl2+Cl2↑+2H2O,根据方程式计算相关物理量.△ .n(MnO2)=[17.4g/87g/mol]=0.2mol,
MnO2+4HCl (浓)
△
.
MnCl2+Cl2↑+2H2O
1 411
0.2mol n(HCl)n(MnCl2)n(Cl2)
(1)n(Cl2)=0.2mol,V(Cl2)=0.2mol×22.4L/mol=4.48L,
答:生成氯气的体积为4.48L.
(2)n(HCl)=4×n(MnO2)=4×0.2mol=0.8mol,
答:参加反应的HCl的物质的量为0.8mol.
(3)n(MnCl2)=n(MnO2)=0.2mol,
c(MnCl2)=[0.2mol/0.1L]=2mol/L,
答:生成的MnCl2的物质的量浓度为2mol/L.点评:
本题考点: 化学方程式的有关计算;物质的量浓度的相关计算.
考点点评: 本题考查化学方程式的相关计算,题目难度不大,注意相关基础知识的积累.1年前查看全部
- 下列反应盐酸作为还原剂的是:A.MnO2+4HCl(浓)= MnCl2+Cl2+2H2O B.碳酸钙与盐酸反应
下列反应盐酸作为还原剂的是:A.MnO2+4HCl(浓)= MnCl2+Cl2+2H2O B.碳酸钙与盐酸反应
下列反应盐酸作为还原剂的是:
A.MnO2+4HCl(浓)= MnCl2+Cl2+2H2O
B.碳酸钙与盐酸反应
c.2HCl+Zn=ZnCl2+H2
D.2KKMnO4+16HCL=2KCl+2MnCl+5Cl2+8H2O kiryu1年前4
kiryu1年前4 -
 流水妹妹 共回答了16个问题
流水妹妹 共回答了16个问题 |采纳率100%选A、D,其中都有氯由-1升到0价
B不是氧化还原的反应;C中HCl中氢化合价降低,所以是氧化剂.1年前查看全部
- 题一:实验室可用下列方法获取氧气 ①MnO2+4HCl(浓)=△==MnCl2+Cl2↑+2H2O ②KMnO4+16H
题一:实验室可用下列方法获取氧气 ①MnO2+4HCl(浓)=△==MnCl2+Cl2↑+2H2O ②KMnO4+16HCl(浓)===2MnCl2=2KCl+5Cl2↑+8H2O ③历史上曾用地康法制取氯气 4HCl+O2==CuCl2 -450°==2Cl2+2H2O (等号中间的是反应条件) 比较以上三个反应,排出氧化剂的氧化能力从强到弱的顺序是____ 答案是KMnO4>MnO2>O2 题二:某温度下,将Cl2通入NaOH溶液中,反应得到NaCl,NaClO,NaClO3的混合溶液,经测定NaClO与NaClO3的物质的量浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为多少?或者把思路写一下
 andy100_81年前1
andy100_81年前1 -
 xdk2640 共回答了11个问题
xdk2640 共回答了11个问题 |采纳率100%答一:由于还原剂都是HCl,氧化剂的氧化性强弱可由反应条件的苛刻程度看出,KMnO 4 在常温下就能反应,而MnO 2 要在加热条件下才反应,O 2 却要在450 ○ 和催化剂的条件下才会反应,所以由强到弱顺序为 KMnO 4 >MnO 2 >O 2 答二:Cl 2 +2NaOH=NaCl+NaClO 10Cl 2 +20NaOH=10NaCl+10NaClO 9NaClO=6NaCl+3NaClO 3 n(NaCl):n(NaClO、NaClO 3 )=16:4=4:11年前查看全部
- 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.现将17.4gMnO2与200克36.5%的浓盐酸(过量)完全反应.把反应后所得溶液稀释成400ml.计算(保留3位有效数字要求写出计算过程):(相对原子质量Mn:55O:16H:1Cl:35.5)△ .
(1)生成的Cl2的体积(标准状况).
(2)参加反应的HCl的物质的量.
(3)稀释后溶液Cl-的物质的量浓度是多少? lonser1年前1
lonser1年前1 -
 woodplay 共回答了18个问题
woodplay 共回答了18个问题 |采纳率88.9%解题思路:(1)盐酸过量,二氧化锰完全反应,n(MnO2)=[17.4g/87g/mol]=0.2mol,结合反应的方程式计算.
(2)n(MnO2)=[17.4g/87g/mol]=0.2mol,由方程式可知参加反应的HCl的物质的量;
(3)根据Cl元素守恒计算反应后溶液中的n(Cl-),根据c=[n/V]计算浓度.n(MnO2)=[17.4g/87g/mol]=0.2mol,n(HCl)=[200g×36.5%/36.5g/mol]=2mol,
(1)MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O
1mol 1mol
0.2molx
x=0.200mol,
故生成的氯气的体积为0.2 mol×22.4L•mol-1=4.48L.
答:生成的Cl2的体积为4.48L;
(2)MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O
1mol 4mol
0.200mol y
y=0.800mol,
答:参加反应的HCl的物质的量为0.800mol;
(3)n(HCl)=[200g×36.5%/36.5g/mol]=2mol,生成0.2molCl2,
由Cl元素守恒可知反应后溶液中n(Cl-)=2mol-0.2mol×2=1.6mol,
则c=[n/V]=[1.6mol/0.4L]=4.00mol/L,
答:稀释后溶液Cl-的物质的量浓度是4.00mol/L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查学生根据方程式的计算、物质的量浓度等,侧重于学生的分析能力和计算能力的考查,为高频考点,难度不大,注意基础知识的掌握.1年前查看全部
- 实验室常用以下方法制取氯气:MnO2+4HCl(浓) △ .MnCl2+Cl2↑+2H2O用双线桥
实验室常用以下方法制取氯气:MnO2+4HCl(浓) △ .MnCl2+Cl2↑+2H2O用双线桥
在标准状况下生成Cl2为11.2L时,参加反应的HCl的物质的量为_____,被氧化HCl的质量为_____________ onerainbow1年前1
onerainbow1年前1 -
 CQKDLUCY 共回答了31个问题
CQKDLUCY 共回答了31个问题 |采纳率93.5%1年前查看全部
- 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)MnCl2
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O.现将23.2g含MnO2的质量分数为75%的软锰矿石与足量10mol/L浓盐酸完全反应(杂质不参加反应).把反应后所得溶液稀释成200ml.计算:
(1)生成的Cl2的体积(标准状况).
(2)参加反应的浓盐酸的体积.
(3)稀释后溶液中MnCl2的物质的量浓度. 风中_蔷薇1年前1
风中_蔷薇1年前1 -
 185910033 共回答了20个问题
185910033 共回答了20个问题 |采纳率90%解题思路:(1)根据质量分数计算软锰矿中二氧化锰的质量,再根据n=[m/M]计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积;
(2)根据方程式计算参加反应的HCl的物质的量,再根据V=[n/c]计算参加反应的浓盐酸的体积;
(3)消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2),根据c=[n/V]计算稀释后液中MnCl2的物质的量浓度.(1)23.2g含MnO2的质量分数为75%的软锰矿石中MnO2的物质的量为:[23.2g×75%/87g/mol]=0.2mol,则:
MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O
1 1
0.2mol n(Cl2)
所以n(Cl2)=0.2mol,故V(n(Cl2)=0.2mol×22.4L/mol=4.48L,
答:标准状况下生成的Cl2的体积为4.48L;
(2)由方程式可知,参加反应的HCl的物质的量为0.2mol×4=0.8mol,故参加反应的浓盐酸的体积为[0.8mol/10mol/L]=0.08L,
答:参加反应的浓盐酸的体积是0.08L;
(3)消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2)=0.2mol,将反应后所得溶液稀释成200mL,稀释后液中MnCl2的物质的量浓度为[0.2mol/0.2L]=1mol/L,
答:稀释后液中MnCl2的物质的量浓度为1mol/L.点评:
本题考点: 化学方程式的有关计算;物质的量浓度的相关计算;氯气的实验室制法.
考点点评: 本题考查根据方程式的计算、常用化学计量数的有关计算,比较基础,旨在考查学生对基础知识的理解掌握.1年前查看全部
- 检查化学反应方程式1.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H
检查化学反应方程式
1.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O_
离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
2.钠在氯气中燃烧:2Na+Cl2 2NaCl
铁在氯气中燃烧:2Fe+3Cl2 2FeCl3
铜在氯气中燃烧:Cu + Cl2 CuCl2
氢气在氯气中燃烧:H2 + Cl2 2HCl
3.氯气和水反应:Cl2 + H2O = HCl + HClO
离子方程式:Cl2 + H2O = H++Cl- + HClO
4.次氯酸光照分解:2HClO 2HCl + O2↑
5.氯水中通二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl
6.氯气与氢氧化钠:Cl2+2NaOH=NaCl+NaClO+H2O
离子式:Cl2+2OH-=Cl-+ClO-+H2O
7.工业生产漂白粉:2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 + 2H2O
8.漂白粉漂白原理:Ca(ClO)2 + CO2 + H2O =CaCO3↓ + 2HClO
9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2 + 2HClO
10.氯气通入溴化钾溶液:Cl2+2KBr=Br2+2KCl
离子方程式:Cl2+2Br- = Br2 + 2Cl-
氯气通入碘化钾溶液:Cl2 + 2KI = I2 + 2KCl
离子方程式:Cl2 + 2I- = I2 + 2Cl-
溴水和碘化钾溶液反应:Br2 +2KI = I2+2KBr
离子方程式:Br2 +2I- = I2+2Br-
11.氯化钠和硝酸银:AgNO3+NaCl=AgCl↓+NaNO3
离子方程式:Ag++Cl-=AgCl↓
溴化钠和硝酸银:AgNO3+NaBr=AgBr↓+NaNO3
离子方程式:Ag++Br-=AgBr↓_
碘化钠和硝酸银溶液:AgNO3+NaI=AgI↓+NaNO3
离子方程式:Ag++I-=AgI↓_
1.硫在空气中燃烧:S+O2SO2 硫与氢气加热:S+H2H2S
2.二氧化硫与水:SO2+H2OH2SO3 二氧化硫与氧化钙:SO2+CaO=CaSO
3、少量SO2与氢氧化钠:2NaOH+SO2=Na2SO3+H2O
离子式:2OH-+SO2= SO32-+H2O
过量SO2与氢氧化钠:NaOH+SO2=NaHSO3
离子方程式:OH-+SO2= HSO3-
3.SO2通入过量的澄清石灰水:Ca(OH)2+SO2=CaSO3↓+H2O
过量的SO2通入澄清石灰水:Ca(OH)2+2SO2=Ca(HSO3)2
4.二氧化硫与硫化氢:SO2 + 2H2S=3S↓+2H2O
5.SO2的催化氧化:2SO2 + O2 2SO3
6.亚硫酸钠和硫酸反应:Na2SO3+H2SO4=Na2SO4 +SO2↑+H2O
7.Na2SO3与氧气反应:2Na2SO3+O2=2Na2SO4
8.三氧化硫和水反应:SO3+H2O=H2SO4
9.三氧化硫与氧化钙:SO3+CaO= CaSO4
10.三氧化硫与氢氧化钙:Ca(OH)2+SO3=CaSO4↓+H2O
11.铜与浓硫酸反应:Cu + 2H2SO4 (浓) CuSO4 + 2H2O+SO2 ↑
12.碳与浓硫酸反应:C + 2H2SO4(浓) 2H2O+CO2↑+2SO2↑
1.氮气和氧气反应:N2 + O2 2NO
2.工业合成氨:N2 + 3H2 2NH3
3.一氧化氮与氧气反应:2NO + O2 =2NO2
4.NO2溶于水:3NO2 + H2O = 2HNO3 + NO
5.氨气溶于水:NH3+H2ONH3·H2O氨水显弱碱性(电离式):NH3·H2ONH4++OH-
6.浓氨水受热分解_ NH3·H2O NH3↑+H2O
7.氨气和氯化氢:HCl + NH3 = NH4Cl
8.氨的催化氧化4NH3 +5O2 4NO +6H2O
9.氯化铵受热分解:NH4ClNH3+HCl
10.碳酸氢铵受热分解:NH4HCO3 NH3 ↑+ H2O↑ + CO2 ↑
11.硝酸铵和NaOH:NH4NO3+NaOHNaNO3 + NH3↑+H2O
离子式:NH4++ OH-NH3↑+H2O
12.实验室制氨气:2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑ + 2H2O
13.浓硝酸与铜反应:4HNO3(浓)+Cu Cu(NO3)2+2NO2↑+2H2O
离子方程式:4H++2NO3-+Cu Cu2++2NO2↑+2H2O
14.稀硝酸与铜反应:8HNO3(稀)+3Cu 3Cu(NO3) 2+2NO↑+4H2O
离子方程式:8H++2NO3-+3Cu 3Cu2++2NO↑+4H2O
15.硝酸见光分解:4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)
16.NH4+的检验离子方程式:NH4++ OH-NH3↑+H2O
17.NO2、O2混合气通入水中无剩余气体:4NO2 + O2 + 2H2O = 4HNO3
18.NO、O2混合通入水中无剩余气体:4NO + 3O2 + 2H2O = 4HNO3 ztzn021年前1
ztzn021年前1 -
 yejiayuan1984 共回答了22个问题
yejiayuan1984 共回答了22个问题 |采纳率86.4%2.二氧化硫与水:SO2+H2OH2SO3 二氧化硫与氧化钙: SO2+CaO=CaSO,最后这个少了3,其他的一些少了气体符号,沉淀符号的有几个,反应条件基本没有写的,这些药注意,其他应该没有问题1年前查看全部
- 用下列反应制取氯气:MnO2+4HCl(浓) △ . MnCl2+Cl2↑+H2O该反应的氧化剂是______,还原剂是
用下列反应制取氯气:MnO2+4HCl(浓) △ . MnCl2+Cl2↑+H2O该反应的氧化剂是______,还原剂是__...
用下列反应制取氯气:MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O△ .
该反应的氧化剂是______,还原剂是______;在标准状况下,收集到2.24L Cl2时,消耗氧化剂______mol,被氧化的还原剂的质量______g.
 不定指标1年前1
不定指标1年前1 -
 新用户注册已存在 共回答了20个问题
新用户注册已存在 共回答了20个问题 |采纳率95%MnO2+4HCl=MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,MnO2作氧化剂,Cl元素的化合价升高,HCl作还原剂,
产生的氯气在标况下的体积为2.24L,其物质的量为[2.24L/22.4L/mol]=0.1mol,
MnO2+4HCl=MnCl2+Cl2↑+2H2O中,由MnO2~Cl2↑可知,MnO2物质的量为0.1mol,
Cl元素的化合价升高,则HCl为还原剂,由2HCl~Cl2↑可知,还原剂的物质的量为0.1mol×2=0.2mol,其质量为0.2mol×36.5g/mol=7.3g
故答案为:MnO2;HCl;0.1;7.3.1年前查看全部
- MnO2和浓盐酸反应生成氯气:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
MnO2和浓盐酸反应生成氯气:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
(1)氧化剂是______,还原产物是______.
(2)若有71g氯气生成,则转移的电子的物质的量为______mol,有______mol HCl被氧化.
(3)下列物质能使干燥的蓝色石蕊试纸先变红再褪色的是______(填序号)
①氯气②液氯③新制氯水④敞口放置的久置氯水⑤盐酸⑥加了醋酸的漂白粉溶液. lushuiping1年前1
lushuiping1年前1 -
 WJHL 共回答了15个问题
WJHL 共回答了15个问题 |采纳率100%解题思路:反应MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,盐酸同时起到酸性的作用,结合元素化合物的变化解答该题.(1)Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,生成物中Cl2为氧化产物,MnCl2为还原产物,故答案为:MnO2;MnCl2;(2)n(Cl2)=71g71g/mol=1mol,由Cl元素化合价可知转移...
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力以及氯气的性质的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.1年前查看全部
- Ⅰ、书写以下反应的化学方程式(1)实验室制取氯气:MnO2+4HCl(浓) △
Ⅰ、书写以下反应的化学方程式
(1)实验室制取氯气:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O△ .MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O△ .
(2)实验室制取氨气:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O△ .2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O△ .
(3)浓硫酸与木炭粉在加热条件下反应:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O△ .C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O△ .
(4)铝与烧碱溶液反应:______
(5)铜与浓硫酸的反应:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O△ .Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O△ .
Ⅱ、书写以下反应的离子方程式
(1)氢氧化钡与稀硫酸反应的离子方程式:______
(2)氧化铝与稀硫酸反应的离子方程式:______
(3)二氧化碳与足量氢氧化钠溶液反应的离子方程式:______
(4)金属钠投入水中反应的离子方程式:______
(5)向氯化铁溶液加入足量铁粉后发生反应的离子方程式:______. huang198305211年前1
huang198305211年前1 -
 樱桃木01 共回答了17个问题
樱桃木01 共回答了17个问题 |采纳率82.4%解题思路:Ⅰ、(1)二氧化锰和浓盐酸反应制取氯气;
(2)氯化铵和氢氧化钙共热制取氨气;
(3)浓硫酸和C反应生成二氧化碳、二氧化硫和水;
(4)Al与烧碱反应生成偏铝酸钠和氢气;
(5)Cu与浓硫酸反应生成硫酸铜、二氧化硫和水;
Ⅱ、(1)反应生成硫酸钡和水;
(2)反应生成硫酸铝和水;
(3)反应生成碳酸钠和水;
(4)反应生成NaOH和氢气;
(5)反应生成氯化亚铁.Ⅰ、(1)二氧化锰和浓盐酸反应制取氯气,反应为MnO2+4HCl(浓)△. MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)△. MnCl2+Cl2↑+2H2O;(2)氯化铵和...
点评:
本题考点: 离子方程式的书写;化学方程式的书写.
考点点评: 本题考查化学反应和离子反应的书写,明确发生的化学反应为解答的关键,侧重基础知识的考查,注意物质的性质及反应,题目难度不大.1年前查看全部
大家在问
- 1已知P是三角形ABC所在平面外一点,D.E分别是三角形PAB.三角形PBC的重心.
- 2低头与昂首答案32.概括本文的中心论点.(2分) 33.第③段画线句运用了什么论证方法?有什么作用?(3分) 34
- 3标准区域地质图的图面内容及其所包含的地质信息
- 4西北地区多内流河、内流胡的原因是距海远,为什么?
- 5下图 植物——食草昆虫——蛙——蛇——鹰 是一条食物链 那么植物——食草昆虫——蛙——蛇 算另一条吗?
- 6我用微笑,继续骄傲 如何用英文写出来?
- 7想起为了祖国的解放事业而献身的先烈你会用哪些词语来形容他们
- 81-2-3+4+5-6-7+8+9-10-11+12+...+2001-2002-2003+2004
- 9动圆P与定圆B:X^2+Y^2-4Y-32=0相内切且过点A(0,-2)
- 10在正方体ABCD-ABCD中,O为下底面ABCD的中心,E,F,G分别为DC,BC,CC1的中点. (1)求直线BD与A
- 11初一下册英语题what time is it?回答能用
- 12在直径是10米的花坛边缘修一条宽0.5米的环形小路,这条环形小路的面积是多少?
- 13怎样对待家庭作业
- 14(2002•河北)向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热充分反应后过滤,向滤液中插入薄铁片,有气泡产生.则以下
- 15有Fe,HCl,FeCl3,KOH,CaO,CO2六种物质,写出5个它们两两之间发生反应的化学方程式,并指出反应类型.(