肼是强还原剂,与氧化剂反应时放出大量的热,N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)
 xj40282022-10-04 11:39:541条回答
xj40282022-10-04 11:39:541条回答肼是强还原剂,与氧化剂反应时放出大量的热,如:
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-642.2 kJ/mol
因此,肼可以作为火箭推进剂.根据以上信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼并说明理由_____________________________.
不能 因为△H>0,△S

已提交,审核后显示!提交回复
共1条回复
 龙飞凤舞3 共回答了23个问题
龙飞凤舞3 共回答了23个问题 |采纳率91.3%- △G>0 另外它的平衡常数K极小所以不行
- 1年前
相关推荐
- 碘量法测铜的时候,碘离子起到的作用是还原剂、配位剂和沉淀剂,碘离子是怎么起到配位剂的作用的
 shangyes1年前1
shangyes1年前1 -
 ab1243 共回答了14个问题
ab1243 共回答了14个问题 |采纳率78.6%生成I3-离子1年前查看全部
- 下列反应中必须加入还原剂才能进行的是 A.Cl 2 →Cl - B.Zn→ Zn 2 + C.H 2 →H 2
下列反应中必须加入还原剂才能进行的是
A.Cl 2 →Cl - B.Zn→ Zn 2 + C.H 2 →H 2 O D.CuO→CuCl 2  oushukun1年前1
oushukun1年前1 -
 天放阁 共回答了12个问题
天放阁 共回答了12个问题 |采纳率83.3%A
1年前查看全部
- 亚硝酸(HNO2)既可做氧化剂也可做还原剂
亚硝酸(HNO2)既可做氧化剂也可做还原剂
当它在反应中作氧化剂时,可能生成的产物是( )
A.N2 B.NH3 C.N2O3 D.NO2
为什么
B错那意思就是说在NH3中N显+3价,H显-1价,那在NH4+中为什么N又显-3价呢?到底在NH3中N显+3价还是显-3价?预言家Mt - 魔法师 五级 说是+3,大浪淘沙留真金 - 千总 四级 说是-3 和你去看雪1年前3
和你去看雪1年前3 -
 kxgd 共回答了22个问题
kxgd 共回答了22个问题 |采纳率77.3%亚硝酸(HNO2)的N是正三价做氧化剂化合价降低 所以C D错
已知NH3中N显-3价 因为亚硝酸是弱氧化剂 不可能一下就从+3价降到—3价 所以B错 选A1年前查看全部
- 甲乙丙短周期元素电子总数相等.甲乙为双分子原子,丙为原子乙在高温时作还原剂,用化学方程式表示它在工业
甲乙丙短周期元素电子总数相等.甲乙为双分子原子,丙为原子乙在高温时作还原剂,用化学方程式表示它在工业
上的用途 磐石2891年前1
磐石2891年前1 -
 daqingwa01 共回答了14个问题
daqingwa01 共回答了14个问题 |采纳率100%打半天不小心关了,懒的再打了
甲:CO 乙:N2 丙:Si
甲主要用其还原性和可燃性,冶金
乙用其惰性,保护气
丙单晶硅作半导体,集成电路需要.光纤.有机硅塑料.1年前查看全部
- 两条关于氧化还原反应的判断题在氧化还原反应中,氧化剂失电子总数一定等于还原剂得电子的总数.为什么不是对的?任何一种元素由
两条关于氧化还原反应的判断题
在氧化还原反应中,氧化剂失电子总数一定等于还原剂得电子的总数.
为什么不是对的?
任何一种元素由化合态变为游离态时的反应都是发生氧化反应
什么叫游离态 573331年前2
573331年前2 -
 denverya 共回答了21个问题
denverya 共回答了21个问题 |采纳率85.7%第一个 应该是氧化剂得电子总数等于还原剂失电子总数(升失氧降得还若说剂两相反)
第二个 游离态是指一元素不与其他种元素化合,而能单独存在的状态.元素以单质形态存在则为游离态.例如2H2+O2=2H2O
这里H2和O2都是游离态,也都变成化合态了,但是其中:
H2被O2氧化了(化合价升高为+1),O2被H2还原了(化合价降低为-2)所以可能被氧化也可能被还原1年前查看全部
- 讲了什么氧化剂还原剂.还有氧化反应还原反应.氧化性还原性.氧化产物还原产物.失电子得电子等等.但总是搞不清楚他们到底对应
讲了什么氧化剂还原剂.还有氧化反应还原反应.氧化性还原性.氧化产物还原产物.失电子得电子等等.但总是搞不清楚他们到底对应的是氧化剂的性质还是还原剂的性质.求学长们列清楚一些.
 niubuchicao1年前1
niubuchicao1年前1 -
 杨洪宇 共回答了16个问题
杨洪宇 共回答了16个问题 |采纳率93.8%请记住:
氧化剂发生还原反应,得电子,化合价降低,有氧化性,被还原,生成还原产物;
还原剂发生氧化反应,失电子,化合价升高,有还原性,被氧化,生成氧化产物.1年前查看全部
- 请用双线桥或单线桥分析下列氧化还原反应中电子转移情况,并指出氧化剂和还原剂:
请用双线桥或单线桥分析下列氧化还原反应中电子转移情况,并指出氧化剂和还原剂:
①MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O氧化剂:______ 还原剂:______
②2KClO3═2KCl+3O2↑ 氧化剂:______ 还原剂:______. 771658801年前1
771658801年前1 -
 bingling32 共回答了18个问题
bingling32 共回答了18个问题 |采纳率94.4%解题思路:①化合价升高元素是Cl,所在反应物HCl是还原剂,化合价降低的是Mn元素,所在反应物MnO2是氧化剂,结合化合价的变化判断;
②反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,转移电子数为12.①化合价升高元素是Cl,所在反应物HCl是还原剂,化合价降低的是Mn元素,所在反应物MnO2是氧化剂,化合价升高的Cl元素失2mol电子,化合价降低的Mn元素得到2mol电子,电子转移情况为:
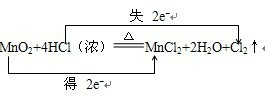 ,
,
故答案为: ;MnO2;HCl;
;MnO2;HCl;
②反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,氧化剂和还原剂都是KClO3,转移电子数为12,用双线桥表示其电子转移情况为: ,
,
故答案为: ;KClO3;KClO3.
;KClO3;KClO3.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,侧重于基本概念、电子转移表示方法的考查,难度不大,注意对基础知识的理解掌握.1年前查看全部
- 下列各反应中,水作还原剂的是( ) A.2H 2 +O 2 点燃 . 2H 2 O B.2F 2 +2H 2
下列各反应中,水作还原剂的是( ) A.2H 2 +O 2
2H 2 O点燃 . B.2F 2 +2H 2 O═4HF+O 2 C.SO 3 +H 2 O═H 2 SO 4 D.2Na+2H 2 O═2NaOH+H 2 ↑  荒原色野狼1年前1
荒原色野狼1年前1 -
 宝贝猫眯 共回答了13个问题
宝贝猫眯 共回答了13个问题 |采纳率92.3%A.2H 2 +O 2
点燃
.
2H 2 O中,水为生成物,则水不是还原剂,故A错误;
B.2F 2 +2H 2 O═4HF+O 2 中,水中O元素的化合价升高,则水作还原剂,故B正确;
C.SO 3 +H 2 O═H 2 SO 4 中,各元素的化合价没有变化,则不属于氧化还原反应,水为反应物,故C错误;
D.2Na+2H 2 O═2NaOH+H 2 ↑中,水中H元素的化合价降低,则水为氧化剂,故D错误;
故选B.1年前查看全部
- 还原剂,并且标一下氧化能力和还原能力的大小顺序,还有哪些是强氧化剂哪些是弱氧化剂
还原剂,并且标一下氧化能力和还原能力的大小顺序,还有哪些是强氧化剂哪些是弱氧化剂
全一点, redish1年前2
redish1年前2 -
 miscellanea 共回答了18个问题
miscellanea 共回答了18个问题 |采纳率100%常见的氧化剂是在化学反应中易得电子被还原的物质.
(1)典型的非金属单质如F2、O2、Cl2、Br2、I2、S等(其氧化性强弱与非金属活动性基本一致).
(2)含有变价元素的高价化合物,如KMnO4 KClO3 H2SO4 HNO3 MnO2 等.
(3)金属阳离子如:Fe3+、Cu2+、(H+)(在金属与酸、盐溶液的置换反应,如反应Fe+CuSO4=FeSO4+Cu中,实质上是Cu2+离子氧化Fe原子,Cu2+作氧化剂,Fe是还原剂)
常见的还原剂是在化学反应中易失电子被氧化的物质.
(1)典型的金属单质如:K、Ca、 Na、Mg等(其还原性强弱与金属活动性基本一致)
(2)某些非金属单质及其化合物如:H2、C、CO.
(3)有变价元素的最低价态化合物如:H2S、HI、HBr、HC
(4)非金属阴离子如:S2-、I-、Br-、Cl-
1、由金属活动性顺序表:还原性K>Ga>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au【单质,H为H2】 氧化性由强到弱(大到小):Au>Pt>Ag>Hg>Cu>(H)>Pb>Sn>FeZn>Al>Mg>Na>Ga>K【离子】(把上面的反过来加上离子符号,注意离子符号不好输入我没加,一定要加上)2、还原性:Cl>Br>Fe离子(+2价)> I 【除Fe外,其余为单质】 氧化性:ClFe ,还原性:S1年前查看全部
- (1)火箭推进器中盛有强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水(H 2 O 2 ),当它们混合反应时,即产
(1)火箭推进器中盛有强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水(H 2 O 2 ),当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应时,放出256kJ的热量.请写出该反应的热化学方程式:______.
(2)工业上由金红石(TiO 2 )制取单质Ti,涉及到的步骤为:TiO 2 →(步骤Ⅰ)TiCl 4
(步骤Ⅱ)TiMg.800℃.Ar
写出步骤Ⅱ中TiCl 4 →Ti的化学反应方程式______.
已知:①C(s)+O 2 (g)=CO 2 (g)△H=-393.5kJ-mol -1
②2CO(g)+O 2 (g)=2CO 2 (g)△H=-566kJ-mol -1
③TiO 2 (s)+2Cl 2 (g)=TiCl 4 (s)+O 2 (g)△H=+141kJ-mol -1
则反应TiO 2 (s)+2Cl 2 (g)+2C(s)=TiCl 4 (s)+2CO(g)的△H=______kJ-mol -1 . 巴雅1年前1
巴雅1年前1 -
 南美漂流瓶 共回答了16个问题
南美漂流瓶 共回答了16个问题 |采纳率100%(1)强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水(H 2 O 2 ),当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热;已知0.4mol液态肼与足量液态双氧水反应时,放出256kJ的热量;则1mol液态肼完全反应放出热量为:640KJ;标注物质聚集状态和对应焓变,热化学方程式为:N 2 H 4 (l)+2H 2 O 2 (l)=N 2 (g)+4H 2 O(g)△H=-640KJ/mol
故答案为:N 2 H 4 (l)+2H 2 O 2 (l)=N 2 (g)+4H 2 O(g)△H=-640KJ/mol;
(2)工业上由金红石(TiO 2 )制取单质Ti,涉及到的步骤为:TiO 2 →(步骤Ⅰ)TiCl 4
Mg.800℃.Ar
(步骤Ⅱ)Ti
步骤Ⅱ中TiCl 4 →Ti的化学反应方程式为:TiCl 4 +2Mg=MgCl 2 +Ti;
依据盖斯定律结合热化学方程式计算:
①C(s)+O 2 (g)=CO 2 (g)△H=-393.5kJ?mol -1
②2CO(g)+O 2 (g)=2CO 2 (g)△H=-566kJ?mol -1
③TiO 2 (s)+2Cl 2 (g)=TiCl 4 (s)+O 2 (g)△H=+141kJ?mol -1
①×2-②+③得到:TiO 2 (s)+2Cl 2 (g)+2C(s)=TiCl 4 (s)+2CO(g)的△H=-80KJ/mol;
故答案为:TiCl 4 +2Mg=MgCl 2 +Ti;
TiO 2 (s)+2Cl 2 (g)+2C(s)=TiCl 4 (s)+2CO(g)的△H=-80KJ/mol;1年前查看全部
- 硫化氢和二氧化硫反应,氧化剂______,还原剂_______;氧化产物______,还原产物_______;发生氧化反
硫化氢和二氧化硫反应,氧化剂______,还原剂_______;氧化产物______,还原产物_______;发生氧化反应的是________,被还原的元素是_______.
还有高锰酸钾加热制取氧气的反应,非常急,
解释一下硫元素是+4价的降了还是-2价的升了? 异乡浪子1年前3
异乡浪子1年前3 -
 qq猫 共回答了18个问题
qq猫 共回答了18个问题 |采纳率88.9%二氧化硫、硫化氢、硫、硫、硫化氢、硫
高锰酸钾、高锰酸钾、氧气、二氧化锰、高锰酸钾、氧
硫化氢和二氧化硫反应是归中反应,硫元素+4价的降了,-2价的也升了1年前查看全部
- 下列有关氧化还原反应的叙述正确的是( ) A.金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂 B.化合物
下列有关氧化还原反应的叙述正确的是( ) A.金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂 B.化合物中某元素处于最高价只能被还原 C.失电子越多的还原剂,其还原性越强 D.某元素在反应中由化合物转化为单质,该元素一定被氧化  qinke20051年前1
qinke20051年前1 -
 xyh95002 共回答了10个问题
xyh95002 共回答了10个问题 |采纳率100%A、金属单质在氧化还原反应中只能作还原剂,非金属单质可能作还原剂也可能作氧化剂也可能既作氧化剂又作还原剂,如:Cl 2 +H 2 O=HCl+HClO,氯气既氧化剂又作还原剂,故A错误;
B、处于最高价态的元素只能得电子不能失电子,所以只有氧化性,故B正确;
C、还原剂的还原性与失电子的难易程度有关,与失电子的多少无关,故C错误;
D、某元素在反应中由化合物转化为单质,该元素可能被氧化也可能被还原,如:2Na 2 O 2 +2H 2 O=4NaOH+O 2 ↑中,氧元素的化合价既有升高的也有降低的,所以氧元素既被氧化又被还原,故D错误;
故选B.1年前查看全部
- 氧化性物质就是氧化剂吗?还原性物质就是还原剂吗?
 gufeng41年前3
gufeng41年前3 -
 潇湘雀 共回答了17个问题
潇湘雀 共回答了17个问题 |采纳率88.2%不一定啊,一种物质的氧化性还是还原性,是直接看它的化合价的,是可以确定的,而且同一种物质可能同时具有氧化性和还原性,如二氧化硫,我们知道硫有-2、0、+4、+6这些价态.二氧化硫中的四价为中间价态,那它就具有氧化性和还原性.只有当某种元素处于最高或最低价态时,才能说只有氧化性或者还原性.
而氧化剂或者还原剂就跟你选取的反应有关了.只有在一个反应中,化合价下降的物质,才能叫氧化剂,只有在这个反应中,化合价上升的物质,才能叫还原剂.
离开了某个特定反应,物质就没有所谓的氧化剂或者还原剂的区别,但是有氧化性和还原性、
所以两对概念没有任何联系.1年前查看全部
- 氧化剂和还原剂换底公式log3^6/llog3^2能不能直接写成log3^6—log3^2
 884299741年前2
884299741年前2 -
 rn002sunan 共回答了21个问题
rn002sunan 共回答了21个问题 |采纳率85.7%不可以.因为 logA+logB=logA*B.logA-logB=logA/B.而logA/logB是无法简化的.这个式子log3^6/log3^2倒是可以这样简化:6log3/2log3=31年前查看全部
- 发射宇宙飞船的火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2),当它们混合时,即产生大量的氮气
发射宇宙飞船的火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2),当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热,写出该反应的化学方程式______,该反应用于火箭推进器的优点是______.
 臻锋1年前3
臻锋1年前3 -
 liuliju 共回答了20个问题
liuliju 共回答了20个问题 |采纳率85%解题思路:根据偏二甲肼和双氧水反应水生成氮气和水蒸气进行分析;根据化学方程式所表现出的信息进行分析第二个空.液态肼和过氧化氢反应会生成水蒸气和氮气,故答案为:N2H4+2H2O2=4H2O↑+N2↑
因为从液态肼和双氧水反应的化学方程式可以看出,生成物只有水和氮气,不会造成粉尘等污染,故答案为:产物无污染.
故答案为:N2H4+2H2O2=4H2O↑+N2↑;产物无污染.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生对所学知识在特殊环境下的应用.学生需充分考虑特定因素,才能正确答题.1年前查看全部
- 现有一未配平的氧化还原反应:KClO3+PH3+H2SO4→K2SO4+H3PO4+H2O+X(1)该反应的还原剂是__
现有一未配平的氧化还原反应:
KClO3+PH3+H2SO4→K2SO4+H3PO4+H2O+X
(1)该反应的还原剂是______.
(2)已知0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式是______.
(3)根据上述反应可推知______(填写序号).
A.氧化性:KClO3>H3PO4
B.氧化性:H3PO4>KClO3
C.还原性:PH3>X
D.还原性:X>PH3. 什么名字可以用1年前1
什么名字可以用1年前1 -
 乐乐的心情 共回答了14个问题
乐乐的心情 共回答了14个问题 |采纳率100%解题思路:(1)P元素的化合价由-3价升高为+5价,含元素化合价升高的物质为还原剂;
(2)设X中Cl的化合价为x,利用化合价的变化计算转移电子数;
(3)氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性.(1)P元素的化合价由-3价升高为+5价,含元素化合价升高的物质为还原剂,则PH3为还原剂,故答案为:PH3;
(2)设X中Cl的化合价为x,则0.2mol×(5-x)=1mol,解得x=0,则X的化学式是Cl2,故答案为:Cl2;
(3)氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,Cl元素的化合价降低,P元素的化合价升高,则KClO3为氧化剂,Cl2为还原产物,还原剂为PH3,氧化产物为H3PO4,则氧化性为KClO3>H3PO4,还原性为PH3>X,故答案为:AC.点评:
本题考点: 氧化还原反应;氧化性、还原性强弱的比较.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念及规律性知识的考查,题目难度不大.1年前查看全部
- 什么时候必须要加入氧化剂或者还原剂这种题目,还不是很会.比如:下列变化一定需要加入氧化剂才能进行的是 A cu²+→CU
什么时候必须要加入氧化剂或者还原剂这种题目,还不是很会.比如:下列变化一定需要加入氧化剂才能进行的是 A cu²+→CU B HCO3失一个电子→co2 C cl2→clo失一个电子 D NA→NA得一个电子 请把思考过程写出来.
 巧克力shiro1年前1
巧克力shiro1年前1 -
 yearnyang 共回答了19个问题
yearnyang 共回答了19个问题 |采纳率94.7%需要加入氧化剂,氧化剂得电子,而选项要失电子才行,失电子价态升高,所以你得找选项中有价态升高的C
氧化还原反应中有得必有失,价态有高比有降,简单记:
高---- ---失--- -氧
(价态) 被氧化
低------得 -还1年前查看全部
- 常见氧化剂和还原剂1常见氧化剂:(1)活泼的非金属单质(2)含高价元素的含氧酸(3)含高价元素的盐(4)含高价元素的氧化
常见氧化剂和还原剂
1常见氧化剂:(1)活泼的非金属单质(2)含高价元素的含氧酸(3)含高价元素的盐(4)含高价元素的氧化物(5)过氧化物;2常见的还原剂(1)活泼的金属单质(2)某些非金属单质(3)元素处于低价态物质…各举三例哈,谢谢大家~
 黑玫瑰01年前1
黑玫瑰01年前1 -
 dy787mbf 共回答了18个问题
dy787mbf 共回答了18个问题 |采纳率72.2%1.)Br2、F2、Cl2; 2.)HClO、HCLO、浓硝酸 3.)KMnO4、NH4NO3、KNO3
4.)MnO2、SO3
5)H2O2、金属过氧化物
1)K、Na、Li
2)c、Si、H2
3)so2、co、No
我是学化学的,应该都对吧,嘻1年前查看全部
- 氧化剂具有氧化性还是还原性,分别说明氧化剂还原剂,氧化性还原性是什么?
 karl19881311年前1
karl19881311年前1 -
 joanna_0080151 共回答了15个问题
joanna_0080151 共回答了15个问题 |采纳率100%一个诀窍; 失升还被氧化 得降氧被还原
解;失电子化合价上升具有还原性被氧化是还原剂
你自己推下一句!加油!1年前查看全部
- 如何判断化学反应中什么物质是氧化剂或是还原剂
 迎柳豆豆1年前4
迎柳豆豆1年前4 -
 wanghuachong666 共回答了25个问题
wanghuachong666 共回答了25个问题 |采纳率88%要判断物质是否是氧化剂或还原剂,前提要在氧化还原反应中
氧化物被还原,得到电子,化合价下降,发生还原反应,得到还原产物
还原剂被氧化,失去电子,化合价上升,发生氧化反应,得到氧化产物
例如:C+O2=点燃=CO2,其中C为还原剂,因为它从0到+2,O2为氧化剂,因为它从0到-21年前查看全部
- 碳还原出比它更强的还原剂举个例哪个还原产物比碳的还原性强
 longkui5201年前2
longkui5201年前2 -
 幽远冰原 共回答了16个问题
幽远冰原 共回答了16个问题 |采纳率100%SiO2+2C=Si+2CO↑
CO的还原性比C强1年前查看全部
- 下列反应哪些是氧化还原反应?哪些不是?是氧化还原反应的,指出哪些物质是氧化剂?哪些物质是还原剂?
下列反应哪些是氧化还原反应?哪些不是?是氧化还原反应的,指出哪些物质是氧化剂?哪些物质是还原剂?
(1)H3PO4+2NaOH=NaHP4+2H2O
(2)HgCL2+2NaO=HgO+H2O+2NaCL
(3)Cu+HgCL2=CuCL2+Hg
(4)2FeCL3+SnCL2=2FeCL2+SnCL4
(5)4NH3+5O2=Pt=4NO+6H2O
麻烦各位将化合价的变化,是什么反应写清楚点! javehtp1年前2
javehtp1年前2 -
 wqj1008 共回答了13个问题
wqj1008 共回答了13个问题 |采纳率92.3%判断是不是氧化还原反应要从是否有化合价升降着手,有化合价升降的就是氧化还原反应.而氧化剂的化合价会降低,还原剂的化合价会升高.
1、没有化合价升降,不是氧化还原反应;
2、没有化合价升降,不是氧化还原反应;
3、铜从0价升高到+2价,汞从+2价降低到0价,所以是氧化还原反应,还原剂Cu,氧化剂HgCl2;
4、铁从+3价降低到+2价,锡从+2价升高到+4价,所以是氧化还原反应,其中还原剂SnCl2,氧化剂FeCl3;
5、氮元素从-3价升高到+2价,氧元素从0价降低到-2价,所以是氧化还原反应,其中还原剂NH3;氧化剂O2;1年前查看全部
- SO2做氧化剂和作还原剂的方程式,越多越好
 zsp10061年前1
zsp10061年前1 -
 zz好多哦 共回答了15个问题
zz好多哦 共回答了15个问题 |采纳率86.7%so2+h2s=s+h2o
kmno4+so2+h2so4=k2so4+mnso4+h2o1年前查看全部
- 还原剂可以还原任何氧化物?如题还有各还原剂的性质...
 3841zz291年前2
3841zz291年前2 -
 ling-er 共回答了14个问题
ling-er 共回答了14个问题 |采纳率71.4%错1年前查看全部
- 还原剂为什么发生氧化反应.氧化剂量为什么发生还原反应?
 ndpbln1年前6
ndpbln1年前6 -
 艾城故事 共回答了26个问题
艾城故事 共回答了26个问题 |采纳率100%物质失电子的作用叫氧化反应;得电子的作用叫还原.狭义的氧化指物质与氧化合;还原指物质失去氧的作用.氧化时氧化值升高;还原时氧化值降低.氧化、还原都指反应物(分子、离子或原子).氧化也称氧化作用或氧化反应.
还原剂:在氧化还原反应里,失去电子或有电子对偏离的物质.还原剂失去电子自身被氧化变成氧化产物,如用氢气还原氧化铜的反应,氢气失去电子被氧化变成水.还原剂在反应里表现还原性.还原能力强弱是还原剂失电子能力的强弱,如钠原子失电子数目比铝电子少,钠原子的还原能力比铝原子强.含有容易失去电子的元素的物质常用作还原剂,在分析具体反应时,常用元素化合价的升降进行判断:所含元素化合价升高的物质为还原剂.
氧化剂:氧化还原反应里得到电子或有电子对偏向的物质.氧化剂从还原剂处得到电子自身被还原变成还原产物.氧化剂和还原剂是相互依存的.1年前查看全部
- 盐酸在做反应物时,既做氧化剂,又做还原剂的化学反应式
 绮萃1年前2
绮萃1年前2 -
 hcg2 共回答了27个问题
hcg2 共回答了27个问题 |采纳率85.2%2HCl=通电=H2↑+Cl2↑1年前查看全部
- 氢气还原氧化铁中氢气是还原剂吗
 祝梁1年前1
祝梁1年前1 -
 YYsjm 共回答了19个问题
YYsjm 共回答了19个问题 |采纳率94.7%是的,
Fe的化合价由+3降低为0价,得电子,发生氧化反应,铁就是氧化剂,H2从0价升高到+1价,所以是还原剂1年前查看全部
- 氧化还原反应是有元素化合价发生改变的化学反应,氧化还原反应的本质是______.在氧化还原反应中,还原剂______电子
氧化还原反应是有元素化合价发生改变的化学反应,氧化还原反应的本质是______.在氧化还原反应中,还原剂______电子,本身发生______反应.Na2O2中氧元素化合价为-1价,根据氧化还原反应的知识可以推知Na2O2既有______性又有______性.Na2O2和KMnO4的H2SO4溶液反应,生成Na2SO4,MnSO4,K2SO4,O2和水,在这个反应中氧化剂为______,还原剂为______.
 想有个名字1年前1
想有个名字1年前1 -
 memphis_d 共回答了22个问题
memphis_d 共回答了22个问题 |采纳率86.4%解题思路:氧化还原反应的实质为电子转移,还原剂失去电子,被还原;处于中间价态的微粒,既能失去电子也能得到电子;Na2O2和KMnO4的H2SO4溶液反应为5Na2O2+2KMnO4+8H2SO4=5Na2SO4+2MnSO4+K2SO4+5O2↑+8H2O,Mn元素的化合价降低,过氧化钠中O元素的化合价升高,以此来解答.氧化还原反应的实质为电子转移,还原剂失去电子,被还原,发生还原反应;Na2O2中氧元素化合价为-1价,既能失去电子也能得到电子,则既有氧化剂也有还原性;Na2O2和KMnO4的H2SO4溶液反应为5Na2O2+2KMnO4+8H2SO4=5Na2SO4+2MnSO4+K2SO4+5O2↑+8H2O,Mn元素的化合价降低,过氧化钠中O元素的化合价升高,所以氧化剂为KMnO4,还原剂为Na2O2,
故答案为:电子转移;失去;还原;氧化;还原;KMnO4;Na2O2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意元素化合价与微粒性质的关系,题目难度不大.1年前查看全部
- 下列反应属于氧化还原反应,且水既不是氧化剂又不是还原剂的是( )
下列反应属于氧化还原反应,且水既不是氧化剂又不是还原剂的是( )
A.2Na+2H2O=2NaOH+H2↑
B.2F2+2H2O=4HF+O2↑
C.CaO+H2O=Ca(OH)2
D.Cl2+H2O=HCl+HClO 五脚猪A1年前1
五脚猪A1年前1 -
 chenkongdefeng 共回答了21个问题
chenkongdefeng 共回答了21个问题 |采纳率95.2%解题思路:含元素化合价变化的反应为氧化还原反应,水既不是氧化剂又不是还原剂,则水中H、O元素的化合价不变,以此来解答.A.水中H元素的化合价降低,水为氧化剂,故A不选;
B.水中O元素的化合价升高,水为还原剂,故B不选;
C.没有元素的化合价变化,不属于氧化还原反应,故C不选;
D.只有Cl元素的化合价变化,为氧化还原反应,且水既不是氧化剂又不是还原剂,故D选;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化剂、还原剂判断的考查,注意从化合价角度分析,题目难度中等.1年前查看全部
- 关于氧化还原反应的化学题过氧化钠和水反应生成氢氧化钠和氧气,在这个反应中,水的作用是什么?是氧化剂还是还原剂?还是什么都
关于氧化还原反应的化学题
过氧化钠和水反应生成氢氧化钠和氧气,在这个反应中,水的作用是什么?是氧化剂还是还原剂?还是什么都不做? 看图1年前3
看图1年前3 -
 fangkangzhen 共回答了12个问题
fangkangzhen 共回答了12个问题 |采纳率83.3%什么都不做.它的反应原理是:过氧化钠和水反应生成双氧水和氢氧化钠,然后双氧水再分解生成氧气1年前查看全部
- 过氧化钠和二氧化碳反应,氧化剂和还原剂分别是什么拜托各位了 3Q
 zsscool1年前1
zsscool1年前1 -
 悲伤的苹果 共回答了20个问题
悲伤的苹果 共回答了20个问题 |采纳率85%氧化剂和还原剂都是过氧化钠,这是个歧化反应
满意请采纳1年前查看全部
- 在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,氧化剂和还原剂的物质的量之比为( )
在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,氧化剂和还原剂的物质的量之比为( )
A.1:2
B.2:1
C.1:1
D.3:2 zy123zy1年前1
zy123zy1年前1 -
 世界的人 共回答了18个问题
世界的人 共回答了18个问题 |采纳率100%解题思路:在3S+6KOH=K2SO3+2K2S+3H2O反应中,S元素化合价分别由0价升高为+4价,被氧化,降低为-2价,被还原,反应中硫既作氧化剂又作还原剂,根据还原产物与氧化产物的化学计量数进行判断.在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,氧化产物为K2SO3,硫元素由0价降低为-2价,被还原,还原产物为K2S,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数可知,氧化剂和还原剂的物质的量之比为2:1,
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应概念与计算,侧重于学生的分析能力和计算能力的考查,为高频考点,难度不大,根据化合价判断氧化剂与还原剂、还原产物与氧化产物是关键,判断后也可根据电子转移守恒计算氧化剂与还原剂的物质的量之比.1年前查看全部
- 分子电子数为36 双原子还原剂分子电子数为36 就是原子序数之和为36 XY 双原子分子 是一种高温还原剂请问是什么?
 篱东菊翁1年前3
篱东菊翁1年前3 -
 ygaiqq 共回答了18个问题
ygaiqq 共回答了18个问题 |采纳率77.8%CaS 把 挨个试出的这个 就这个有还原性1年前查看全部
- 在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )
在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )
A.2F2+2H2O=4HF+O2
B.C+H2O
CO+H2△ .
C.2Na+2H2O=2NaOH+H2↑
D.Cl2+H2O=HCl+HClO 心肝宝贝是我1年前1
心肝宝贝是我1年前1 -
 大ll007 共回答了13个问题
大ll007 共回答了13个问题 |采纳率100%解题思路:H2O中H元素的化合价为+1价,O元素的化合价为-2价,如水既不是氧化剂也不是还原剂,则H和O的化合价不变化.A.反应中O的化合价升高,水为还原剂,故A错误;
B.反应中,水中H元素的化合价降低,则水作氧化剂,故B错误;
C.反应中,水中H元素的化合价降低,则水作氧化剂,故C错误;
D.反应中,水中H和O元素的化合价不变,所以水既不作氧化剂又不作还原剂,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应及氧化还原反应中水的作用,明确元素的化合价变化是解答的关键,难度不大.1年前查看全部
- 二氧化碳和碳反应中什么是氧化剂或还原剂?
二氧化碳和碳反应中什么是氧化剂或还原剂?
如题,或说明电子转移情况 raidas201年前1
raidas201年前1 -
 heatwade 共回答了17个问题
heatwade 共回答了17个问题 |采纳率94.1%CO2中的C化合价降低了,CO2是氧化剂;C化合价升高了,C是还原剂
C+CO2=2CO(条件:加热)
转移的电子是2mol1年前查看全部
- 指出2na2o2+2h2o=4naoh+o2氧化剂还原剂氧化产物还原产物
 我杯茶1年前2
我杯茶1年前2 -
 syftyzt 共回答了23个问题
syftyzt 共回答了23个问题 |采纳率78.3%氧化剂还原剂都是Na2O2;
氧化产物是NaOH;
还原产物是O2;1年前查看全部
- 同一种物质既作氧化剂又作还原剂的反应两个
 sha沙1年前1
sha沙1年前1 -
 小小小喇叭花 共回答了15个问题
小小小喇叭花 共回答了15个问题 |采纳率100%双氧水分解,电解水1年前查看全部
- 14.SiO2与碳在高温下可发生反应:SiO2+3C=SiC+CO↑在这一反应中氧化剂与还原剂的质量之比为:
14.SiO2与碳在高温下可发生反应:SiO2+3C=SiC+CO↑在这一反应中氧化剂与还原剂的质量之比为:
帮帮忙
 毛利小四郎1年前1
毛利小四郎1年前1 -
 快乐小竹 共回答了14个问题
快乐小竹 共回答了14个问题 |采纳率100%在这个反应种,化合价有变化的就只有C,原来的0价变为CO +2价(被氧化),和SiC -4价(被还原).
再根据生成物的SiO2+3C=SiC+2CO↑的物质的量之比为1:2.得到氧化剂与还原剂的质量之比为1:2(氧化剂和还原剂都是碳)1年前查看全部
- 下列反应中,HCl作还原剂的是( ) A.NaOH+HCl═NaCl+H 2 O B.Zn+2HCl═ZnCl 2 +
下列反应中,HCl作还原剂的是( ) A.NaOH+HCl═NaCl+H 2 O B.Zn+2HCl═ZnCl 2 +H 2 ↑ C.MnO 2 +4HCl(浓)
MnCl 2 +2H 2 O+Cl 2 ↑△ . D.CuO+2HCl═CuCl 2 +H 2 O  BOBO山东后援会1年前1
BOBO山东后援会1年前1 -
 sw27 共回答了17个问题
sw27 共回答了17个问题 |采纳率88.2%A、NaOH+HCl═NaCl+H 2 O反应中,氯元素化合价不变,所以HCl不是还原剂,故A错误;
B、Zn+2HCl═ZnCl 2 +H 2 ↑反应中,氯元素的化合价不变,氢元素的化合价降低,所以HCl是氧化剂,故B错误;
C、MnO 2 +4HCl(浓)
△
.
MnCl 2 +2H 2 O+Cl 2 ↑反应中,氯元素的化合价升高,氢元素的化合价不变,所以HCl是还原剂,故C正确;
D、CuO+2HCl═CuCl 2 +H 2 O反应中,氯元素的化合价不变,氢元素的化合价不变,所以HCl不是还原剂,故D错误;
故选C.1年前查看全部
- 判断氧化剂与还原剂?氯化铁中有+3价的铁元素,所以氯化铁是氧化剂.那为什么二氧化硫中有+4价的硫元素却即可以做氧化剂又可
判断氧化剂与还原剂?
氯化铁中有+3价的铁元素,所以氯化铁是氧化剂.那为什么二氧化硫中有+4价的硫元素却即可以做氧化剂又可以做还原剂? onlyhanyan1年前5
onlyhanyan1年前5 -
 雪rr嫩 共回答了14个问题
雪rr嫩 共回答了14个问题 |采纳率85.7%氧化剂和还原剂的判断一般是在具体的化学反应中来说的,在化学反应中,只要有升价此物质即为还原剂,有降价即为氧化剂.(如H2+O2).
如果单从物质判断,那么就要判断此元素是否还可以升价(还原性)或降价(氧化性)
如Cl元素,最高价为+7 ,最低位-1价,当Cl处于+1,+3,+5价时(2价Fe也是),均具有氧化性和还原性,因为均可再升或再降.当元素处于最低或最高价时,没有氧化性(不能再降)和还原性(不能再升).1年前查看全部
- 化学反应中、(无机物)当一种还原剂和二种氧化剂同时相遇时是先和氧化性强的反应在紧接着和氧化性弱的反应也就是说反应可以同时
化学反应中、(无机物)当一种还原剂和二种氧化剂同时相遇时是先和氧化性强的反应在紧接着和氧化性弱的反应也就是说反应可以同时存在但不是同时发生、还是反应不能同时存在先和氧化性强的反应、反应完强氧化剂在和弱氧化剂反应?
有机物反应 是 可以同时存在但不同时发生 还是不能同时存在二个反应? 馋裤1年前3
馋裤1年前3 -
 周鸣 共回答了17个问题
周鸣 共回答了17个问题 |采纳率100%从微观讲,反应肯定是同时都会发生的,只是反应速率有快慢,而且反应平衡会向与强氧化剂的反应倾斜,所以最终产物优先是被强氧化剂氧化的产物1年前查看全部
- 5KClO3+6P=3P2O5+5KCl方程中,反应中氧化剂和还原剂的个数之比是多少?
 hsb03071年前1
hsb03071年前1 -
 lemon七七 共回答了13个问题
lemon七七 共回答了13个问题 |采纳率92.3%质量比为692.5:186,分子个数比为6:5.是不1年前查看全部
- 关于铜和浓硫酸的反应这个反应中氧化剂还原剂和氧化产物还原产物分别是什么?
 zoujuan1年前3
zoujuan1年前3 -
 理查德泰森123 共回答了17个问题
理查德泰森123 共回答了17个问题 |采纳率88.2%氧化剂浓硫酸,还原剂铜
氧化产物硫酸铜,还原产物二氧化硫
Cu+2H2SO4(浓)=加热=CuSO4+SO2↑+2H2O1年前查看全部
- 处理废弃重铬酸钾,能不能用醋酸提供H+,用乙醇做还原剂?
 天地独白1年前3
天地独白1年前3 -
 XXX笑嘻嘻 共回答了21个问题
XXX笑嘻嘻 共回答了21个问题 |采纳率81%不行.弱酸性条件下重铬酸钾氧化性降低,同时乙醇还原性不强,即使乙醇大大过量也不能保证重铬酸钾彻底反应.
一般处理方法是在pH维持在2.5左右用亚硫酸氢钠之类的还原剂处理,反应完成后用碱调整pH到7~9以沉淀氢氧化铬1年前查看全部
- 既可以做还原剂又可以做燃料的是什么
 axjm19871年前4
axjm19871年前4 -
 紫色的阳光 共回答了14个问题
紫色的阳光 共回答了14个问题 |采纳率100%CO、H2、1年前查看全部
- 二价铁怎样变成0价铁?加强还原剂吗?怎样用CO、C、H2、Al写化学方程式?
 Oo夜妆oO1年前2
Oo夜妆oO1年前2 -
 耄耋饕餮等饿 共回答了15个问题
耄耋饕餮等饿 共回答了15个问题 |采纳率93.3%二价铁具有氧化性,要还原成0价铁(铁单质),就必须用还原剂将其还原.想你上面写的CO、C、H2、Al都可以做还原剂.
FeO+CO=Fe+CO2
2FeO+C=Fe+CO2
FeO+H2=Fe+H2O
四氧化三铁:3Fe3O4+8Al=9Fe+4Al2O3;其中Fe3O4中既有三价铁,也有二价铁,这个也是比较有名的铝热反应.1年前查看全部
- 一种氧化剂和多种还原剂发生反应时,为什么是还原性强的先反应
 happy小垭1年前2
happy小垭1年前2 -
 xxx5000 共回答了20个问题
xxx5000 共回答了20个问题 |采纳率75%还原性即失电子能力,还原性越强说明失电子能力越强,那麼当然先反应咯1年前查看全部
- 谁可以和我说下强氧化性,又还原性,氧化剂,还原剂,什么关系?
 心绪万千1年前1
心绪万千1年前1 -
 dd王7 共回答了15个问题
dd王7 共回答了15个问题 |采纳率86.7%升失氧,被氧化,作还原剂显还原性.如金属单质,容易失电子.价态只能从0到正数所以多作为还原剂
相反对应降得还.口诀
还原剂强弱不是影响很大.氧化剂强弱是重点多看看.1年前查看全部
- 有关氧化还原反应的 氧化还原反应中遵守以强制弱原则 就是氧化性强的做氧化剂 氧化性弱的做还原剂 那
有关氧化还原反应的 氧化还原反应中遵守以强制弱原则 就是氧化性强的做氧化剂 氧化性弱的做还原剂 那
有关氧化还原反应的
氧化还原反应中遵守以强制弱原则 就是氧化性强的做氧化剂 氧化性弱的做还原剂 那过氧化氢与二氧化硫反应反应生成硫酸 为什么它们可以反应啊 还有高中的化学方程式是不是可以自己推出来感到作业中有好多没见过的方程式 请讲的通俗一点 伟大ll手电筒1年前1
伟大ll手电筒1年前1 -
 形只影单的美美 共回答了18个问题
形只影单的美美 共回答了18个问题 |采纳率88.9%等式两边看化合(he)价的变化化合价升高失去电子被氧化是还原剂(绅士养花还原剂)H2O2有较强氧化(也有一定还原性)性,SO2有还原性反应中S+2价做还原剂升高到+6价生成H4SO4 H2O2中两氧合成过氧根离子表现-2价(就当每个-1价)氧化剂降到-2价(你应该是高一吧,高一好生学习吧)1年前查看全部
大家在问
- 1前进2步 后退2步 英语怎么讲?
- 2—Is she Maria?—No, she ____. [ ] A.
- 3与浓氨水反应产生白烟的一定是浓盐酸吗
- 4x^3+8x+103=0如何解方程
- 5在空间中,是否存在既不平行在空间中,是否存在既不平行又不相交的两条直线?(提示:
- 6一个原来处于平衡状态的杠杆,如果再作用一个力后,杠杆仍然平衡,则此力是( )
- 7Her father‘s face (turns) a little red.括号中词的词性
- 8(-7)+(+6)+(+9)+(-4)的计算过程
- 9甲数是乙数的1又1/3倍,甲数与乙数的比是(),乙数和甲数的比是()
- 10已知m为整数,如果二次三项式x^2-mx-15的整数范围内能够分解为两个一次因式的乘积,那么m=____(至少写出两个不
- 11请问游标卡尺的读书原理,是为什么可以这样读,不要告诉我读数方法.
- 12颜真卿用笔匀而藏锋,内刚劲而外温润,字的曲折出圆而有力. 请问用英语要怎么翻译这句话?
- 13秦始皇对经济发展的作用
- 14绷字组词多组几个!
- 15“片“是( )结构,它的笔顺是( ),“凹”是( )结构,它的笔顺是( ).
