轨道式电磁炮的炮弹速度是与电压有关还是电流.
 rbb1213132022-10-04 11:39:541条回答
rbb1213132022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 龙行千里123 共回答了21个问题
龙行千里123 共回答了21个问题 |采纳率90.5%- ——★1、电流的三个效应是:电流的热效应;电流的电磁效应;电流的化学效应.
——★2、电磁炮做功的是电磁场,利用了电流的电磁效应,因此,电磁炮的各种性能,都与电流有关.
——★3、电压是产生电流的条件,但起作用的却是电流啊. - 1年前
相关推荐
- 写出NO+,NO,NO-分子或离子的分子轨道式,指出它们的键级,其中哪个有磁性?
 136336895731年前1
136336895731年前1 -
 372516143 共回答了23个问题
372516143 共回答了23个问题 |采纳率82.6%NO具有磁性1年前查看全部
- XeF的分子轨道式怎么写啊?
 说服10191年前1
说服10191年前1 -
 cxlcbh 共回答了21个问题
cxlcbh 共回答了21个问题 |采纳率100%由于Xe、F是不同周期的元素,写分子轨道式时写价组态就可以了,以Xe的5s5p与F的2s2p成键.即:
1σ2,2σ2,3σ2,1π4,2π4,4σ11年前查看全部
- 分子轨道式 和 分子基态时的电子组态 表达有什么异同?具体问题如图 为什么参考答案要是第二种?
 yy斗机的狼1年前1
yy斗机的狼1年前1 -
 枫飘渺 共回答了21个问题
枫飘渺 共回答了21个问题 |采纳率95.2%这个问题非常好!第一种表示法是对同种元素双原子分子而言,在第一种情况中,可以认为1s-1s、2s-2s、2p-2p组合成建,因为他们之间的能量差最小、匹配最大.因为NF分子不是单质双原子分子,因此在成键时不可能完完全全按1s-1s、2s-2s、2p-2p组合成建,因为能量差啊!所以肯定要先将各自的s/p态如2s2p的混杂即杂化!然后在重叠成建!因此第一种刻画是有问题的!第二种比第一种合理!
只要肯登攀,化学并不难!
祝进步!1年前查看全部
- 哈雷彗星绕太阳的轨道式一太阳为一个焦点的椭圆,它离太阳的最近距离是R1,速率是V!,它离太阳的最远时的
哈雷彗星绕太阳的轨道式一太阳为一个焦点的椭圆,它离太阳的最近距离是R1,速率是V!,它离太阳的最远时的
速率是V2,求它离太阳最远时的距离 fclock1年前1
fclock1年前1 -
 y_rl 共回答了17个问题
y_rl 共回答了17个问题 |采纳率94.1%根据开普勒第二定律:
V1*R1=V2*R2
答案不必多说了吧?1年前查看全部
- 一氧化氮NO 分子轨道式和成键是怎么样的机理?是双键还是三键?请具体回答一下!
 luojing10241年前0
luojing10241年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 如何判断分子轨道式中有无单电子比如说,下列分子或离子的分子轨道式中,无单电子的是()A O2- B F2 C O2 D
如何判断分子轨道式中有无单电子
比如说,下列分子或离子的分子轨道式中,无单电子的是()
A O2- B F2 C O2 D O2+ E F2+ 41544791年前1
41544791年前1 -
 dmgyz 共回答了17个问题
dmgyz 共回答了17个问题 |采纳率76.5%除了B 还有C吧 氧气分子也是无单电子的1年前查看全部
- 请问N2+的分子轨道式怎么写?2S22P4的原子轨道角度分布图怎么画?
 打碎了就盛开1年前2
打碎了就盛开1年前2 -
 yy8309 共回答了15个问题
yy8309 共回答了15个问题 |采纳率80%σ1s2 σ'1s2 σ2s2 σ'2s2 π2py2 π2pz2 σ2s1
2s2 2p4 .原子轨道中s是球状,在原点那里一球,p轨道三方向x,y,z三个方向的哑铃状排列1年前查看全部
- 驱动140吨小车我是平行移动,是采用轨道式滚轮,传动方式是轴连式,采用两台减速机同步行走,请问一下因该
驱动140吨小车我是平行移动,是采用轨道式滚轮,传动方式是轴连式,采用两台减速机同步行走,请问一下因该
因该需要选用多大扭力和功率的减速器,补充:减速器的速比是1:500的 溺黑1年前1
溺黑1年前1 -
 tevz 共回答了12个问题
tevz 共回答了12个问题 |采纳率91.7%这和速度有关,加速时间也有关.启动力F-f=ma; a=(v2-v1)/t.其中m—质量(kg),f--摩擦阻力(牛顿);a--加速度(米/秒²),t--加速时间(秒),v2--小车运动速度(米/秒),v1--初速度为0.加速度所经过的路程S=1/2(at²),做功W=FS.功率P=W/t,(千瓦),扭力Tb=9550xPxη/n(牛*米),其中η-效率;n-转/分.1年前查看全部
- 什么是轨道式的吊挂方式?我想知道美术馆是用什么方式吧画挂在墙上的?有人说是轨道式的吊挂方式,如果大家有什么更好的悬挂方式
什么是轨道式的吊挂方式?
我想知道美术馆是用什么方式吧画挂在墙上的?有人说是轨道式的吊挂方式,如果大家有什么更好的悬挂方式也请提点一下! 奥博翻译1年前2
奥博翻译1年前2 -
 janeatzhou 共回答了14个问题
janeatzhou 共回答了14个问题 |采纳率100%挂画的轨道其实就是滑道应该跟玻璃滑道差不多的.1年前查看全部
- 有没有分子轨道式方面的高人啊?题目是氮气分子轨道式:[KK(σ2s)2(σ*2s)2(л2py)2(л2pz)2(σ2p
有没有分子轨道式方面的高人啊?
题目是氮气分子轨道式:[KK(σ2s)2(σ*2s)2(л2py)2(л2pz)2(σ2p)2] 为什么(σ2s)2 (л2py)2 (л2pz)2是强成键的,构成了氮气分子中的三重键,而(σ2p)2是弱成键,(σ*2s)2是弱反键的啊?2p轨道的键性就弱一点吗?反键(σ*2s)2的能量要高啊,为什么是弱反键呢?搞不懂! Nightkid131年前1
Nightkid131年前1 -
 guckicghkhgcgch 共回答了16个问题
guckicghkhgcgch 共回答了16个问题 |采纳率81.3%由能级交错引起的.
很复杂,不是几句话能说清楚的,建议你找老师当面问,结合能级图比较容易理解.1年前查看全部
- 雷士轨道式金卤灯70W相当于led轨道射灯多少瓦
 稀吾1年前1
稀吾1年前1 -
 sanse1 共回答了20个问题
sanse1 共回答了20个问题 |采纳率90%现有LED还不能完全替代70W的金卤灯,35W金卤灯 LED替代基本没问题了.
35W-40W这样的LED与LED光照相当.当然这是要看品牌和芯片质量的!
我用过的LED替代品大概就这功率.1年前查看全部
- 电子排布式怎么写还有什么原子轨道式啊各种式写法归纳一下
 lanshilidong1年前2
lanshilidong1年前2 -
 cxd1372266 共回答了16个问题
cxd1372266 共回答了16个问题 |采纳率87.5%电子排布:首先电子按按顺序填充各个能级:1s-2s-2p-3s-3p-4s-3d-4p-5s-4d-5p-6s-4f.
s p d f 四个能级所容纳电子数分别为2,6,10,14
注意上面是填充顺序,最后的书写顺序是把填充后的各个能级按1s-2s-2p-3s-3p-3d-4s-4p.这样的顺序去写1年前查看全部
- 下列说法不正确的是( )A.若把HF分子写成H2F分子,违反了共价键的饱和性B.若把碳的轨道式写成 则违反了
下列说法不正确的是( )
A.若把HF分子写成H2F分子,违反了共价键的饱和性
B.若把碳的轨道式写成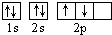 则违反了泡里不相容原理
则违反了泡里不相容原理
C.若把Be的基态电子排布式写成1s22s12p1则违反能量最低原理
D.若把氧的轨道式写成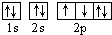 则违反了洪特规则
则违反了洪特规则  ckq0001年前1
ckq0001年前1 -
 醉他300年 共回答了15个问题
醉他300年 共回答了15个问题 |采纳率86.7%解题思路:A、F原子最外层7个电子,能再接纳1个电子形成8电子结构,即只能形成一个共价键;
B.泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态 相反的电子;
C.电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低;
D.洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同.A、F原子最外层7个电子,能再接纳1个电子形成8电子结构,即只能形成一个共价键,所以HF分子写成H2F分子,违反了共价键的饱和性,故A正确;
B.泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态 相反的电子;洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,所以把碳的轨道式写成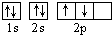 则违反了洪特规则,故B错误;
则违反了洪特规则,故B错误;
C.电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,把Be的基态电子排布式写成1s22s12p1则违反能量最低原理,故C正确;
D.洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,所以把氧的轨道式写成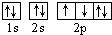 则违反了洪特规则,故D正确;
则违反了洪特规则,故D正确;
故选B.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查能量最低原理、泡利不相容原理、洪特规则的定义,难度不大,注意基础知识的积累.1年前查看全部
- “氢原子中的电子式在做确定的轨道运动,轨道式量子化的”错在哪里?
 fgdn1年前1
fgdn1年前1 -
 秋末之蝉 共回答了20个问题
秋末之蝉 共回答了20个问题 |采纳率90%作为实物微观粒子的电子,具有波粒二象性,不确定原理说明它没有固定的运动轨迹.因此不能说是做确定额轨道运动.
解释一下不确定性原理:反映了微观粒子不同于宏观物体的运动特性:微观粒子的某些物理量(如位置和动量,或方位角和角动量)不可能被同时测得.1年前查看全部
- NH4CLl为什么有配位键N的轨道式↑↓ ↑ ↑ ↑ 3个H和未满的2p轨道补满,然后再如何?剩下一个H怎么排?cl是不
NH4CLl为什么有配位键
N的轨道式↑↓ ↑ ↑ ↑ 3个H和未满的2p轨道补满,然后再如何?剩下一个H怎么排?cl是不是提供空轨道和2s的孤对电子结合?
求大神告知,小弟感激不尽 iilihua1年前2
iilihua1年前2 -
 dtcai1129 共回答了15个问题
dtcai1129 共回答了15个问题 |采纳率100%是NH4+中含有配位键,是氮原子提供2s上的孤对电子,H+提供空轨道形成,因为这种成键方式不符合中心原子提供空轨道的规律,所以它不是配合物.
NH4+和Cl-之间是离子键,无配位键.1年前查看全部
- 在分子和离子中如何快速判断σ键?也就是怎样从轨道式上看出,最好讲细点.
 tyxa_11年前2
tyxa_11年前2 -
 liming261400 共回答了25个问题
liming261400 共回答了25个问题 |采纳率96%简单分子、离子的结构与其a娃 花
‘卜 羔 :
0 弓l 吾
简单分子、离子的结构与稳定性对从使化学专业的中学教师、大专院校低年级教师
及大学低年级学生来说非常重要 杂化轨道理论从成键角度成功地解释了化合物的空间
结构与稳定性.但对非结构化学专业人员来说,要准确判断给定分子的杂化类型和参加
杂化的具体原子轨道是较为困难的 本文利用价电子对互斥理论对AB (n-2~7)分子
或离子中心原子 的 轨道杂化进行讨论,并将其结果列于表中.使读者在应用时,只
器求H{中心原子的价电子对数或知道中心原子的配位数及中心原子的价电子层结构.查
丧就可得到所需的数据
1 步骤
肆悼忤法是先利用价电子对互斥理论确定分子或离子空间构型;其次.确定中心原
子的价电子层结构;再次.根据分子或离子的空间构型及价电子层结构来确定其具体杂
化方式或类型.
1. 1 确定分子或离子AB 的空间构型
Ⅲ价电子对互斥理沧来确定分子或离子空间构型的关键是确定价电子层电子对数和
若出现几种可能构型时.确定哪种为其最稳定的构型
1
1.1 1 价层电子对数一{ (中心原子价层电子数+配位原子或离子提供的电子±
离于的电荷敦)
注 :.第六主族元素作配体时.认为不提供电子;作为中心原子时,提供6十电子.
b.分子的电荷靛为零.
C. 若离子带负电荷,取“+”号,离子带正电荷,取.一” 号
d. 若价电子对数出现小数.按进位整数处理.
1. 1.2 最稳定构型的确定
严格按{仃电子对互斥理论处理.不难确定“ .
例如:PCI
1
价层电子对数一÷ (5d-3 0)一4
,
电于对构型:正四面体
非1年前查看全部
大家在问
- 1牛顿的故事,100字左右
- 2数学题找规律 3,2,3,3,3,5,3,7,3,( )
- 3宝贵的 比 更 阳光 是 金子 连词成句子
- 4比较,牛顿环的圆环形干涉条纹 和 迈克尔逊干涉仪的圆环形干涉条纹,有何异,有何同.
- 5△ABC的外角∠CBD、∠BCE的平分线相交于点F,若∠A=68,求∠DBC+∠BCE的度数
- 6You say is right .I believeYousay It .i can try Myself Jump
- 71.5X8.4+3X10分之3+25X10%= 4.5÷(24又7分之5-2.5%X800= 7.5X5分之4-5.5X
- 8求下列微分方程的通解 y〃+y′=x+1
- 9懂生物或医学的请进!我已经不止一次看到这样一段话:内脏器官工作时间:晚上9-11 点为免疫系统(淋巴)排毒时间,此段时间
- 10飞船在轨道上飞行,速度怎么计算GMm/r²=mv²/r v=根号下(GM/r) 由这个式子可得速度与
- 11请别伤害我(指内心伤害)怎么翻译
- 12( )a purple tie 是用with?in?还是?
- 13一段抹不掉的回忆 作文
- 14可爱的小鸭子 作文
- 15阅读下面的文字,完成16—19题。
