价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称
 想游水的鸟2022-10-04 11:39:541条回答
想游水的鸟2022-10-04 11:39:541条回答 价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:
价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:| 等电子体类型 | 代表物质 | 空间构型 |
| 四原子24电子等电子体 | SO3 | 平面三角形 |
| 四原子26电子等电子体 | SO32- | 三角锥形 |
| 五原子32电子等电子体 | CCl4 | 四面体形 |
| 六原子40电子等电子体 | PCl5 | 三角双锥 |
| 七原子48电子等电子体 | SF6 | 八面体形 |
 根据上述信息,回答下列问题:
根据上述信息,回答下列问题:(1)写出分子或离子的空间构型:IO3-______、SiO32-______
(2)由第一、二周期元素组成,与氧化性最强的单质分子互为等电子体的分子有N2H4______、______(写两种);
(3)如图是六方最密堆积(Be、Mg、Zn)的晶胞图之一,如果金属镁的密度是ρ g/cm3,且假设镁原子是互相接触的刚性小球,
镁的相对原子质量为M,阿伏加德罗常数为NA,则镁原子的半径为
| 3 |
| ||||
| 3 |
| ||||

已提交,审核后显示!提交回复
共1条回复
 cityhunter_ray 共回答了18个问题
cityhunter_ray 共回答了18个问题 |采纳率88.9%- 解题思路:(1)价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体,等电子体的结构相似,由表格信息分析;
(2)由元素周期表可知氧化性最强的为F2,根据等电子体的概念分析;
(3)镁原子的半径为rcm,晶胞底面为平行四边形,其各边长为a=2r,然后求出其面积,由图可知平行四面体的高度等于两个四面体的高度和,再求出晶胞的体积,根据ρ=[m/V]待人已知数据求得r的值.(1)已知价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体,等电子体的结构相似,IO3-与SO32-互为等电子体,由表格信息可知二者的空间构型为三角锥形;SO3与SiO32-互为等电子体,由表格信息可知二者的空间构型为平面三角形;
故答案为:三角锥形;平面三角形;
(2)同周期从左到右单质的氧化性增强,同主族从上到下单质的氧化性减弱,所以氧化性最强的为第二周期第VIIA族氟元素的单质F2,由第一、二周期元素组成而且与F2互为等电子体的有N2H4、H2O2、C2H6;
故答案为:H2O2;C2H6;
(3)设镁原子的半径为rcm,晶胞底面为平行四边形,其各边长为a=2r,所以平行四边形的面积为S=a•asin60°=
3
2a2,
晶胞中平行四面体的h=2×边长为a的四面体的高=2×
6
3a=
2
6
3a,所以V(晶胞)=S×h=
3
2a2×
2
6
3a=
2a3=8点评:
本题考点: “等电子原理”的应用;判断简单分子或离子的构型;晶胞的计算.
考点点评: 本题考查了等电子体以及晶胞的计算,明确等电子体的概念以及晶胞体积与密度、相等原子质量的关系是解本题关键,难度较大,注意晶胞的边长不是金原子直径,题目难度较大. - 1年前
相关推荐
- 请按要求填空:(1)某元素原子的价电子构型为3d104s2,它属于第______周期,第______族,______区元
请按要求填空:
(1)某元素原子的价电子构型为3d104s2,它属于第______周期,第______族,______区元素,元素符号是______,某元素原子的价电子构型为3d54s1,它属于第四周期,d区元素,元素符号是______.
(2)d3+的3d亚层为半充满,其基态原子的电子排布式为______,e+的k、l、m层全充满,e的元素符号是______,其基态原子的电子排布式为______
(3)已知下列元素在周期表中的位置,写出它们最外层电子的排布式和元素符号:
①第4周期Ⅳb族______;
②第5周期Ⅶa族______.
(4)①cac2中c22-与o22+互为等电子体,o22+的电子式可表示为______ 1mol o22+中含有的π键数目为______.
②乙炔与氢氰酸反应可得***(h2c=ch-c≡n).***分子中碳原子轨道杂化类型有______;分子中处于同一直线上的原子数目最多为______. vv卡1年前1
vv卡1年前1 -
 笨笨小 共回答了21个问题
笨笨小 共回答了21个问题 |采纳率95.2%解题思路:(1)价电子构型为3d104s2,应位于第4周期ⅡB族,价电子构型为3d54s1,应为第4周期ⅥB族;
(2)D3+的3d亚层为半充满,则基态原子的价电子排布为3d64s2,应为铁元素,E+的K、L、M层全充满,应为Cu元素;
(3)第4周期ⅣB族为Ti元素,第5周期ⅦA族为I元素;
(4)O22+的电子式与C22-相似,含有O≡O键,结合价层电子对判断杂化类型.(1)价电子构型为3d104s2,应位于第4周期ⅡB族,为Zn元素,位于周期表ds区,价电子构型为3d54s1,应为第4周期ⅥB族,为Cr元素,
故答案为:4;ⅡB;ds;Zn;Cr;
(2)D3+的3d亚层为半充满,则基态原子的价电子排布为3d64s2,应为铁元素,其基态原子的电子排布式为[Ar]3d64s2,E+的K、L、M层全充满,应为Cu元素,基态原子的电子排布式为[Ar]3d104s1,
故答案为:[Ar]3d64s2;Cu;[Ar]3d104s1;
(3)第4周期ⅣB族为Ti元素,最外层电子的排布式为3d24s2,第5周期ⅦA族为I元素,最外层电子的排布式5s25p5,
故答案为:Ti,3d64s2;I,5s25p5;
(4)①O22+的电子式与C22-相似,电子式为 ,含有O≡O键,含有的π键数目为2,
,含有O≡O键,含有的π键数目为2,
故答案为: ,2;
,2;
②H2C=CH-C≡N中C原子分别形成3个δ键和2个δ键,则碳原子轨道杂化类型有sp杂化、sp2 杂化,分子中处于同一直线上的原子数目最多为3,
故答案为:sp杂化、sp2 杂化;3.点评:
本题考点: 位置结构性质的相互关系应用;原子结构与元素周期律的关系;共价键的形成及共价键的主要类型;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查较为综合,涉及原子核外电子的排布、元素在周期表中的位置的判断以及杂化类型等知识,侧重于学生的分析能力的考查,难度中等,注意相关基础知识的积累.1年前查看全部
- 碳sp2杂化问题乙烯模型中 C是经sp2杂化的C的价电子有4个 3个优先进入sp2杂化轨道 剩下的一个为什么是进入p轨道
碳sp2杂化问题
乙烯模型中 C是经sp2杂化的
C的价电子有4个 3个优先进入sp2杂化轨道 剩下的一个为什么是进入p轨道而不是s轨道? zhengxianq1年前3
zhengxianq1年前3 -
 英雄2005 共回答了15个问题
英雄2005 共回答了15个问题 |采纳率86.7%碳的最外层电子只有1个S轨道和3个P轨道,由1个S轨道和2个P轨道进行杂化形成3个SP2轨道,杂化后S轨道已经不存在了.1年前查看全部
- 甲醛的分子空间构型为什么是平面三角形,不符合ABm型的分子如何用价电子理论模型确定其分子空间构型,如COCL2
 daisy6661年前2
daisy6661年前2 -
 报月听风 共回答了20个问题
报月听风 共回答了20个问题 |采纳率100%H提供1个电子,O不提供,C有4个,4+1*2+0=6=3对,所以是sp2杂化,平面三角形结构.(算的时候中心原子的价电子和周围的配体提供的电子加起来,配体的H和卤素及烷基等提供1个,O和S原子提供0个;中心原子的价电子B、Al3个,C、Si4个,N、P5个,O、S6个,卤素7个,稀有气体元素8个)1年前查看全部
- 化学中的核外电子排布图 核外电子排布式 结构示意图 价电子构型 都怎么区别
 想唱歌的小哑巴1年前2
想唱歌的小哑巴1年前2 -
 fwq850129 共回答了11个问题
fwq850129 共回答了11个问题 |采纳率100%核外电子轨道排布式 如 1s2 2s2 2p6 3s1就能代表你说的所有的了!这个比画圈圈啊啥的好得多了!3S1就是价电子构型啊!可以给出该元素的所有结构化学的信息!1年前查看全部
- C原子的价电子是2s22p2,按电子排布规律,2个s电子是已配对的,只有2个p电子未成对
C原子的价电子是2s22p2,按电子排布规律,2个s电子是已配对的,只有2个p电子未成对
C电子排布为 1s2 2s2 2p2
为什么2个p电子需要配对?C原子的2个p电子本身不配对么? zjf72261年前1
zjf72261年前1 -
 yuki04 共回答了16个问题
yuki04 共回答了16个问题 |采纳率81.3%从P轨道开始,填充电子的时候要先满足每个亚层里都有之后,多余的电子才能进行配对,而且是自旋相反的.1年前查看全部
- 价电子跃迁和原子外层电子跃迁有什么区别?
 dreamingcheng1年前3
dreamingcheng1年前3 -
 小咪豆 共回答了15个问题
小咪豆 共回答了15个问题 |采纳率80%在主族,价电子=原子外层电子
对於过渡元素,价电子有可能是内层d,f轨道上的原子1年前查看全部
- 用四个量子数表示铌的各价电子的运动状态
用四个量子数表示铌的各价电子的运动状态
RTRTRTRTRTRTRT kookoo9301年前1
kookoo9301年前1 -
 痞子鑫 共回答了14个问题
痞子鑫 共回答了14个问题 |采纳率92.9%一般原子都是4个量子数形成完全力学量,主量子数n,角动量量子数l(在华学里,l=0对应s,l=1对应p,l=2对应d,l=3对应f,以此类推),角动量z轴的投影量子数m,自旋量子数s1年前查看全部
- 电子排布式的书写规律和价电子排布书写规律是什么,顺便说一下价电子到底是什么,不要复制黏贴的,我是高二学生,请讲的能让我听
电子排布式的书写规律和价电子排布书写规律是什么,顺便说一下价电子到底是什么,不要复制黏贴的,我是高二学生,请讲的能让我听懂,
 vivianyouyou1年前1
vivianyouyou1年前1 -
 robin4587 共回答了13个问题
robin4587 共回答了13个问题 |采纳率61.5%电子排布式:圆圈表示原子核,+m表示质子数,弧线表示电子层,按2n²等规律排布电子
价电子:参与成键的电子,主族元素价电子为最外层电子,副族元素还包括最外d亚层电子.1年前查看全部
- 亚汞离子为什么比汞离子稳定 价电子能看出吗
 xx无人诉1年前1
xx无人诉1年前1 -
 全部乱说 共回答了17个问题
全部乱说 共回答了17个问题 |采纳率88.2%汞原子外层价电子为4f14 5d10 6s2,因为存在6s2惰性电子对效应,所以汞原子特别稳定,因此汞是位子的液态金属.Hg2+失去6s2电子,稳定性减弱;而正一价Hg有一个6s电子,二聚后共用一个电子,此时两个原子都有6s2电子,结构稳定,Hg22+1年前查看全部
- 石墨中碳原子的四个价电子都参加成键吗
 菜蕊1年前1
菜蕊1年前1 -
 好聊之凉风有信 共回答了28个问题
好聊之凉风有信 共回答了28个问题 |采纳率96.4%不是的,只有三个成键.
在石墨晶体中,同层的碳原子以sp2杂化形成共价键,每一个碳原子以三个共价键与另外三个原子相连(排列方式呈蜂巢式的多个六边形)每个碳原子均会放出一个电子,那些电子能够自由移动.1年前查看全部
- 电子轨道排布式与价电子排布有什么区别?
电子轨道排布式与价电子排布有什么区别?
价电子是不是只写出最后两个能级的排布啊? 城河街1年前2
城河街1年前2 -
 铁身gg 共回答了19个问题
铁身gg 共回答了19个问题 |采纳率89.5%电子轨道排布式是写所有的电子排布式 价电子排布是最外层电子的排布1年前查看全部
- 美的价电子比铝少能不能说明镁比铝还原性强?
 九月茶花1年前1
九月茶花1年前1 -
 监狱里的女人 共回答了20个问题
监狱里的女人 共回答了20个问题 |采纳率85%不可以.在元素周期表上失电子的能力就是它的金属性的强弱.左下角金属性最强,就是失去电子的能力最强.右上角还原性最强就是得到电子的能力最强(稀有气体除外)1年前查看全部
- 外层电子与价电子的关系
 szwy6281年前1
szwy6281年前1 -
 peking怡口连 共回答了14个问题
peking怡口连 共回答了14个问题 |采纳率85.7%最高主量子数(n) 被占据的壳层----价层;其中的电子---价电子.1年前查看全部
- 价电子 化合价 最外层电子数的关系
 ldsophia1年前1
ldsophia1年前1 -
 cncncf 共回答了9个问题
cncncf 共回答了9个问题 |采纳率100%价电子 = 最高化合价
对于主族元素,价电子 = 最高化合价 = 最外层电子数
对于副族元素,情况不一定.很多副族元素的次外层有些电子也是价电子.例如26号的Fe,它的最外层电子数是2,但它的最高化合价是3.1年前查看全部
- 写出23V的核外电子排布式,并写出5个价电子四个量子数
 yan01011年前2
yan01011年前2 -
 流泪的洋狗狗 共回答了16个问题
流泪的洋狗狗 共回答了16个问题 |采纳率75%V
1s2 2s2 2p6 3s2 3p6 3d3 4s2
①n=3,l=2,m=0,ms = 1/2
②n=3,l=2,m=0,ms = -1/2
③n=3,l=2,m=1,ms = 1/2
④n=4,l=0,m=0,ms = 1/2
⑤n=4,l=0,m=0,ms = -1/21年前查看全部
- fe的价电子的电子排布式3d6 4s23d的〇不应该是6个吗?但是实际是5个,为什么?
 呦0哎呦喂1年前3
呦0哎呦喂1年前3 -
 jeepion 共回答了13个问题
jeepion 共回答了13个问题 |采纳率84.6%3D64S2最外层有二个电子容易变成正二价铁离子、也可以生成正三价铁离子1年前查看全部
- 怎样根据价电子排布判断该元素是在主族还是副族?
 yuanleya1年前1
yuanleya1年前1 -
 千与千寻1 共回答了13个问题
千与千寻1 共回答了13个问题 |采纳率100%一般而言,主族元素的内层电子均达到饱和(空轨道填充滞后例外),最外层只有不发生能级交错的 s 和 p 亚层轨道填充电子,所以只需看最外层价电子构型,不涉及d 和f 亚层轨道的都是主族元素,只需注意少数例外:稀有气体不属于主族,钯的最外围是 4d10 电子构型等于最外层有十八个电子等.而副族和第八族元素的内层电子多未饱和(只有铜族,锌族,钯等例外),最外围价电子构型均涉及 d 和 f 亚层轨道电子.1年前查看全部
- 价电子为2次外层电子数为18的元素是什么/
 荷花湾妮子1年前3
荷花湾妮子1年前3 -
 行运超人 共回答了26个问题
行运超人 共回答了26个问题 |采纳率88.5%Zn
2 8 18 21年前查看全部
- 什么是基态原子的价电子,c的价电子的排布式为?
 coolzhao1年前1
coolzhao1年前1 -
 冷雪琪 共回答了18个问题
冷雪琪 共回答了18个问题 |采纳率83.3%基态与激发态对应,指的就是能量最低的状态,基态中没有电子接受能量受到激发.
价电子就是能够参与到反应中的外层电子,有的时候是最外层,有的时候还会有倒数第二层第三层的.
C的价电子是2S2 2P2 表示的是2S亚层有2个电子 2P亚层有2个电子 1S不属于价电子,所以不用写.
如果问的是C的基态电子排布就要写成 1S2 2S2 2P2,后面的2都是写成右上角角标的形式.1年前查看全部
- 价电子排布.什么是价电子排布?价电子排布和电子排布式有什么区别?价电子排布是如何得出的.
 czkq1年前2
czkq1年前2 -
 聊版专用gg4 共回答了17个问题
聊版专用gg4 共回答了17个问题 |采纳率94.1%价电子排布就是最外电子层电子排布,只需要写出最外层电子排布情况即可;而电子排布式要把所有的电子全部写出来才行.特别注意的是主族元素的价电子排布和主族序数相等1年前查看全部
- 钯最外层电子数是十八个?看它的价电子排列第四层是十八个,没第五层,不是违背了最外层电子最多是八个了?那它是易得电子还是失
钯最外层电子数是十八个?
看它的价电子排列第四层是十八个,没第五层,不是违背了最外层电子最多是八个了?那它是易得电子还是失电子? stephen2141年前2
stephen2141年前2 -
 诱篮 共回答了21个问题
诱篮 共回答了21个问题 |采纳率90.5%我们化学老师说,最外层电子数最多为8 谁说钯的最外层为18?电子在每能级的排布 2,8,18,18,0 最外层为0个电子 因为它的价层轨道是31年前查看全部
- 19到36号元素的名称,符号,和电子排布式,价电子排布
 tangtiti1年前1
tangtiti1年前1 -
 chao_phi 共回答了12个问题
chao_phi 共回答了12个问题 |采纳率91.7%钾 K [Ar]4S1
钙 Ca [Ar]4S2
钪 Sc [Ar]3d14S2
钛 Ti [Ar]3d24S2
钒 V [Ar]3d34S2
铬 Cr [Ar]3d54S1
锰 Mn [Ar]3d54S2
铁 Fe [Ar]3d64S2
钴 Co [Ar]3d74S2
镍 Ni [Ar]3d84S2
铜 Cu [Ar]3d104S1
锌 Zn [Ar]3d104S2
镓 Ga [Ar]3d104S24p1
锗 Ge [Ar]3d104S24p2
砷 As [Ar]3d104S24p3
硒 Xe [Ar]3d104S24p4
溴 Br [Ar]3d104S24p5
氪 Kr [Ar]3d104S24p6
大部分情况下最外层的就是价电子,但像铜等副族元素例外1年前查看全部
- 是半径大的原子容易失电子还是价电子少的原子容易失电子?原子半径大价电子就少吗?价电子位于哪层?
 archor011年前3
archor011年前3 -
 DFTV上海 共回答了24个问题
DFTV上海 共回答了24个问题 |采纳率83.3%价电子位于最外层.
半径大且最外层价电子少的院子容易失电子.
半径越大,最外层电子少的越容易失电子,最外层电子多的得电子越难.
周期表:金属,从上往下,金属性越强.非金属,从上往下,非金属性越弱.这个对原子半径的理解估计会容易些
半径大的不一定失电子:比如Br2、I2都比H2半径大,但得电子,H2容易失电子.
失电子都是最外层电子少的原子.1年前查看全部
- 大学无机概念!原子的外层电子构型与原子的价电子排布是有区别吗?
 shangguansanguo1年前1
shangguansanguo1年前1 -
 zz浪子321 共回答了27个问题
zz浪子321 共回答了27个问题 |采纳率96.3%电子构型是指所有电子的排布 例如Fe 1S2 2S2 2P6 3S2 3P6 3d6 4S2 最外层电子构型是指只最外层电子的排布 例如Fe 4S2 价电子构型是指能够参与形成化学键的电子层的排布 例如Fe 有+3价 所以3d层电子参与成键 电子构型为3d6 4S21年前查看全部
- 关于甲醛分子sp2杂化的问题我们都知道甲醛HCHO是SP2杂化,在此我有个问题,C的价电子排布是2S2 2P2,也就是有
关于甲醛分子sp2杂化的问题
我们都知道甲醛HCHO是SP2杂化,在此我有个问题,C的价电子排布是2S2 2P2,也就是有2个电子在S轨道,2个在P轨道.形成SP2杂化时,需要参与的是一个S轨道的电子和2个P轨道的电子,形成了平面的正三角形结构,可此时还剩下一个S轨道的电子,为什么我看到的解释是一个P轨道垂直于SP2杂交轨道形成的平面?不是剩一个S轨道电子么?怎么成P轨道的去了? aaa26001年前1
aaa26001年前1 -
 jiayz1983 共回答了20个问题
jiayz1983 共回答了20个问题 |采纳率85%C原子的价轨道为2s和3个2p,其中s填有2电子,2个p轨道各填一个,还有一个是空轨道2pz,杂化时s和两个p(px,py)重组成三个sp2轨道,pz不参与杂化,垂直于sp2平面.杂化后每个轨道上填一个电子,形成四个共价键.
如有不明欢迎追问.1年前查看全部
- 麻烦各位详细说明为什么有时候价层电子不等于价电子
 janeliu13141年前1
janeliu13141年前1 -
 小艾tracy 共回答了12个问题
小艾tracy 共回答了12个问题 |采纳率91.7%因时间关系,现摘录网友的精彩文章作为回答:
①当最外层电子数小于四时,易失去电子,呈现正价,此时最外层电子数有几个便是正几价
当最外层电子数大于四时,易得到电子,呈现负价,此时化合价为8-最外层电子数
x05
x05
x05
x05
②价电子数是能与其它原子相互作用形成化学键的电子.主族元素的价电子就是主族元素原子的最外层电子;过渡元素的价电子不仅是最外层电子,次外层电子及某些元素的倒数第三层电子也可成为价电子.
③一个概念,价层电子指原子核外电子中能与其他原子相互作用形成化学键,跟元素化合价有关的电子,又称价电子.顾名思义,价电子表明原子价数的电子.主族元素的价电子就是主族元素原子的最外层电子;过渡元素的价电子不仅是最外层电子,次外层电子及某些元素的倒数第三层电子也可成为价电子.电子在原子中处于不同的能级状态,粗略说是分层分布的,故电子层又叫能层.电子层可用n(n=1、2、3…)表示,n=1表明第一层电子层(K层),n=2表明第二电子层(L层),依次n=3、电子层4、5时表明第三(M层)、第四(N层)、第五(O层).电子在原子核外排布时,要尽可能使电子的能量最低.一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的.这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、 3d、4p、5s、4d、5p.1年前查看全部
- 什么决定原子是否会形成化学键?除了稀有气体以外的原子都会与其他原子形成化学键来提高稳定性和降低势能。那么究竟是价电子,还
什么决定原子是否会形成化学键?
除了稀有气体以外的原子都会与其他原子形成化学键来提高稳定性和降低势能。那么究竟是价电子,还是原子的稳定性,还是它们的势能可以决定原子是否会形成化学键?答案请尽量简明一点, lzhua09061年前4
lzhua09061年前4 -
 topbest 共回答了18个问题
topbest 共回答了18个问题 |采纳率88.9%价电子一般体现原子的化学性质,也就是稳定性
成键的过程中会发生势能的变化
所以我觉得应该是价电子决定是否会形成化学键1年前查看全部
- 价电子一般只包含s和p?价电子不是最外层电子数吗?跟电子亚层什么关系?又为什么只包含s和p亚层?
 qazys1年前1
qazys1年前1 -
 皱眉 共回答了15个问题
皱眉 共回答了15个问题 |采纳率100%价电子不只是最外层电子数
价电子是外层原子轨道上的电子,与电子亚层的关系:(1)对于主族元素的原子,价电子是最外层电子,只包含s和p亚层,如第IA、IIA价电子是ns1-2,第IIIA-0族是ns2np1-6(2)对于过渡元素,包括次外层的d电子,如Fe价电子:3d64s21年前查看全部
- 当出现5g电子后,成单电子最多的元素可能的价电子构型为
 12011379112ii11年前1
12011379112ii11年前1 -
 yc8333 共回答了21个问题
yc8333 共回答了21个问题 |采纳率76.2%1S2 2S2 2P6 3S2 3P6 4S2 3D10 4P6 5S2 4D10 5P6 6S2 4F14 5D10 6P6 7S2 5F14 6D10 7P6 8S2 5G7 价电子的话就是 8S2 5G71年前查看全部
- 1.金属的导电性是因为金属晶体内存在自由移动的价电子,而其导热性是因为存在自由移动的金属阳离子?
1.金属的导电性是因为金属晶体内存在自由移动的价电子,而其导热性是因为存在自由移动的金属阳离子?
2.晶体中存在离子的一定是离子晶体?
3.在相同条件下甲跟稀硝酸反应有硝酸铵生成,而乙没有,为什么能证明甲还原性比乙强?
4.下列能与铝粉组成铝热剂的是?
A.Cr2O3 B.MnO2 C.MgO D.V2O5
答案c但是什么物质才能做铝热剂?
5怎样制备单质钠?用电解食盐水不行?
6.苯酚溶液中滴加FeCl3溶液有什么颜色变化?
4.下列(不)能与铝粉组成铝热剂的是? 93291年前3
93291年前3 -
 CXR1103 共回答了17个问题
CXR1103 共回答了17个问题 |采纳率94.1%1.金属的导电性是因为金属晶体内存在自由移动的价电子,而其导热性是因为存在自由移动的金属阳离子?
金属导电是因为金属原子会失去电子形成可自由移动的电子,所以可以导电;但是金属导体的热传导主要是通过电子的运动,而绝缘体的热传导主要依靠格波的传导.
2.晶体中存在离子的一定是离子晶体?
错误,比如金属晶体,也有离子,但是金属晶体.
3.在相同条件下甲跟稀硝酸反应有硝酸铵生成,而乙没有,为什么能证明甲还原性比乙强?
硝酸中N是+5价的,甲将+5价的N还原为-3价的,有强的还原性;乙没有说明乙不能将N还原为-3价,所以还原性差,、
有个前提,甲和乙中不能有-3价的N
4.下列能与铝粉组成铝热剂的是?
A.Cr2O3 B.MnO2 C.MgO D.V2O5
答案c但是什么物质才能做铝热剂?
铝热反应是铝粉把某些金属氧化物当中的金属置换出来的反应.该反应将会放出大量的热.其中铝粉和金属氧化物作为铝热剂,镁条和氯酸钾作为引燃剂.
这些常见的可以和铝粉作为铝热剂的金属氧化物有:氧化铁、氧化亚铁、四氧化三铁、五氧化二钒、三氧化二铬、二氧化锰
答案是除了C
5怎样制备单质钠?用电解食盐水不行?
电解熔融氯化钠,不行,NA的活泼型太强,电解只能生成NAOH.
6.苯酚溶液中滴加FeCl3溶液有什么颜色变化?
变紫,生成配位离子,基本的显色反应之一1年前查看全部
- ⅤA族元素的价电子构型是?卤素按氟、氯、溴、碘的顺序排列,其结构或性质的变化规律是( ) A.原子半径依次增大 B.原子
ⅤA族元素的价电子构型是?
卤素按氟、氯、溴、碘的顺序排列,其结构或性质的变化规律是( )
A.原子半径依次增大 B.原子最外层电子数递增
C.各单质的化学活泼性依次增强 D.各单质与水反应的剧烈程度递增
E.各单质的颜色逐渐变浅。
17、能使碘化钾淀粉溶液变蓝的是( )
A.NaCl B.NaBr C.KF D.NaI E.氯水
18、下列卤化物中最稳定的是( )
A.NaF B.NaCl C.NaBr D.NaI E.KBr
19、下列各组溶液中不能发生化学反应的是( )
A.氯水和溴化钠 B.氯水和碘化钾
C.溴水和氯化钠 D.溴水和碘化钾
E.溴水和碘化钠
20、在含有溴化钾和碘化钾的混合液中通入过量氯气,然后将溶液蒸干,并将剩余残渣灼热最后留下的物质是( )
A.KCl B.KBr C.KI D.KBr和 KI E.碘 shenxiaomin1年前2
shenxiaomin1年前2 -
 DuFake 共回答了22个问题
DuFake 共回答了22个问题 |采纳率86.4%ⅤA族元素的价电子构型是ns2np3
1.A
B原子最外层电子数不变
C.各单质的化学活泼性依次减弱
D.各单质与水反应的剧烈程度依次减弱
E.各单质的颜色逐渐变深
2.E Cl2+2KI=2KCl+I2
3.A
4.C F Cl Br I
5.A 溴可气化、碘可升华1年前查看全部
- 74号元素的价电子构型为什么是5d4 6s2,而不是5d5 6s1呢
 坚持ff1年前1
坚持ff1年前1 -
 种子416讨力 共回答了15个问题
种子416讨力 共回答了15个问题 |采纳率93.3%一个电子轨道上能装2个电子,在同一亚轨道上的电子旋转方向相反,能量较低.一般在电子充足的情况下,电子将低能量轨道填充满才会填充下一个轨道.所以大部分情况下低层亚轨道都是满的,即2电子,74号元素如果是5d5 6s1在d层轨道的单电子能量太高,不如5d4 6s2稳定1年前查看全部
- 分子结构问题(高手进)①乙烯每个C原子的3个价电子占据3个杂化轨道,1个价电子占据1个2p轨道这句话怎么不对呢②能提供孤
分子结构问题(高手进)
①乙烯每个C原子的3个价电子占据3个杂化轨道,1个价电子占据1个2p轨道
这句话怎么不对呢
②能提供孤对电子与某些金属离子形成配位键的物质有什么特点
哥几个细一点答
thanks chenlan99661年前3
chenlan99661年前3 -
 dirkshab 共回答了16个问题
dirkshab 共回答了16个问题 |采纳率100%①乙烯是sp2型杂化,为平面三角形结构(对于一个C),既然是杂化,就必然不能说一个价电子占据一个2p轨道了,因为有一个垂直于分子平面的2p轨道就没有参与杂化,每一个碳的三个价电子中的两个形成C-H西格玛键,另一个形成C-C西格玛键.另外,垂直于分子平面的两个p轨道还会形成定域π键(不是离域的,ssln1994这位朋友好似对定域离域没有概念).明显,三个杂化轨道中的每一个有三分之二的p成分,三分之一的s成分..你那句话的错误是显而易见的.
②你的问法很奇怪,是想了解配合物的特点吗?1年前查看全部
- 下列表达式错误的是( ) A.甲基的电子式: B.碳原子的价电子轨道表示式: C.硫离子的核外电子排布式:1s 2 2
下列表达式错误的是()
A.甲基的电子式: 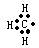
B.碳原子的价电子轨道表示式: 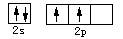
C.硫离子的核外电子排布式:1s 2 2s 2 2p 6 D.碳-14原子:14 6C  jp_yin1年前1
jp_yin1年前1 -
 c7tc 共回答了26个问题
c7tc 共回答了26个问题 |采纳率100%C
1年前查看全部
- 书上说除了氦气的稀有气体有8个价电子,也说它们没有价电子,到底是怎么样的?
书上说除了氦气的稀有气体有8个价电子,也说它们没有价电子,到底是怎么样的?
是不是同种元素在不同的化学反映中有不同的价电子????
是不是同种元素在不同的化学反映中有不同的价电子????那为什么说氧有2个价电子??? 芷凝51年前2
芷凝51年前2 -
 xcxq0203 共回答了18个问题
xcxq0203 共回答了18个问题 |采纳率83.3%对于一确定的化学元素,起价电子是确定的,不管在那种化学反应.除了稀有气体和过渡元素外,最外层电子既是价电子,即可以在化学反应中参与得失或偏向的电子.1年前查看全部
- (1)为什么有些原子结构示意图的M电子层最多有8个价电子,而有些原子结构示意图的M电子层最多有18个价电子?如钙 +20
(1)为什么有些原子结构示意图的M电子层最多有8个价电子,而有些原子结构示意图的M电子层最多有18个价电子?如钙 +20 2 8 8 2 溴 +35 2 8 18 7 (2)为什么有些原子结构示意图的M电子层最多有8个价电子,而有些原子结构示意图的M电子层最多有18个价电子?如铯 +55 2 8 18 8 2 钫 +87 2 8 18 32 18 8 1
 威威超浓缩1年前4
威威超浓缩1年前4 -
 99zhaoycd 共回答了14个问题
99zhaoycd 共回答了14个问题 |采纳率100%首先,价电子是指与化合价有关的电子.对主族元素而言,指最外层电子.M层最多可容纳的电子数为18个,但最外层电子数不超过8个.所以~1年前查看全部
- 杂化轨道 AmBn型 的公式 是 n +中心原子的价电子?
杂化轨道 AmBn型 的公式 是 n +中心原子的价电子?
和为2 则sp ; 为3 则sp2;为4 则sp3 nslin38291年前1
nslin38291年前1 -
 why为什么 共回答了18个问题
why为什么 共回答了18个问题 |采纳率88.9%不对.你算一下 CO2 中 C 的杂化方式就明白了.应该是 sp,你算出来是 sp21年前查看全部
- 写出价电子构型为[Ar]4s1的元素在周期表中的位置(周期、族、区)、元素符号,所形成硫酸盐的主要键型、该盐在水中溶解度
写出价电子构型为[Ar]4s1的元素在周期表中的位置(周期、族、区)、元素符号,所形成硫酸盐的主要键型、该盐在水中溶解度大小和水化离子的颜色.
 liangzaihome1年前2
liangzaihome1年前2 -
 唐广宁 共回答了19个问题
唐广宁 共回答了19个问题 |采纳率84.2%最外层是第四层,且是1个电子,就是第四周期第一个主族的s区钾元素;
硫酸钾主要是离子键,溶解度较大,水化离子无色;
有问题请追问!1年前查看全部
- 写出价电子构型为[Ar]3d104s2的元素在周期表中的位置(周期,族,区),元素符号,指
写出价电子构型为[Ar]3d104s2的元素在周期表中的位置(周期,族,区),元素符号,指
写出价电子构型为[Ar]3d104s2的元素在周期表中的位置(周期、族、区)、元素符号,指出该元素所形成氧化物的键型,在水中溶解度大小, zhouhuanhai1年前3
zhouhuanhai1年前3 -
 Fangfang81 共回答了29个问题
Fangfang81 共回答了29个问题 |采纳率93.1%第四周期,第2副族,ds区,Zn;氧化物离子键,溶解度极小;1年前查看全部
- 根据等电子原理,下列分子或离子与SO有相似结构的是 PCL5 CCL4 NF3 NO3- (是不是看价电子结构啊)
根据等电子原理,下列分子或离子与SO有相似结构的是 PCL5 CCL4 NF3 NO3- (是不是看价电子结构啊)
晕··这个题目就是 SO 废墟上的精灵1年前2
废墟上的精灵1年前2 -
 龙形飞影 共回答了18个问题
龙形飞影 共回答了18个问题 |采纳率94.4%貌似你打错了,没有SO这个物质的,看选项原题应该是SO3吧.
根据等电子原理,原子数相等,电子数(或最外层电子数)相同的分子或离子为等电子体,且具有相似的结构.所以可以直接排除PCl5和CCl4.
再看一下电子数.S的最外层电子比N多一个,因此NO3-中原子最外层电子数和SO3是相同的.所以应该选NO3-.NO3-和SO3一样都是分别以N和S为中中心的平面正三角形结构.1年前查看全部
- 如何根据价电子判断元素在周期表中的位置?
 没有鸡蛋的人1年前3
没有鸡蛋的人1年前3 -
 忘情另 共回答了13个问题
忘情另 共回答了13个问题 |采纳率100%对于主族元素和前三周期的元素.价电子数等于主族数.层数等于周期数1年前查看全部
- 确定下面每一个原子的价电子,例如,一个原子有两个价电子,写2. Li Mg Kr H
 蜜儿_1年前1
蜜儿_1年前1 -
 icefire1002 共回答了17个问题
icefire1002 共回答了17个问题 |采纳率100%Li 1;Mg 2;Kr 8;H 1.1年前查看全部
- 价电子构型怎么写?特别是主量子数n不同时,如4d105s2.怎么写?怎样区分是最外层与内层电子?
 碧落溪纱1年前1
碧落溪纱1年前1 -
 cfhygjt 共回答了26个问题
cfhygjt 共回答了26个问题 |采纳率69.2%先填低能量再填高能量 利用两个原理(泡利原理和鸿特规则)
怎样区分是最外层与内层电子 5s2就是最外层 4d10是内层电子
就是依据低能量排满才轮到高能量级1年前查看全部
- 成共价键的原子总是趋于稳定(即8个价电子)的吗?为什么?
成共价键的原子总是趋于稳定(即8个价电子)的吗?为什么?
难道原子自己想稳定?
........
请说说为什么成共价键的原子总是趋于稳定... 无家可归的候鸟1年前2
无家可归的候鸟1年前2 -
 露申辛夷 共回答了14个问题
露申辛夷 共回答了14个问题 |采纳率92.9%不一定.
也有很多缺电子或多电子化合物是稳定存在的.
比如BF3中的B原子,它只有6个电子.
至于为什么趋于稳定,这是能量最低原理的要求,大自然的普遍原理.1年前查看全部
- 离子价电子排布记得在网上查时,有说亚铁离子是从最外层开始失电子,那其他过渡金属是不是都是这样?为什么?不是最外层能量不是
离子价电子排布
记得在网上查时,有说亚铁离子是从最外层开始失电子,那其他过渡金属是不是都是这样?为什么?不是最外层能量不是最少的啊. jian606_11171年前1
jian606_11171年前1 -
 oumeng215 共回答了14个问题
oumeng215 共回答了14个问题 |采纳率92.9%不太好讲,要看该能级的电离能,个人见解;亚铁离子从稳定性而言我觉得先失去最外层似乎不是稳定的,但是可这样认为,这样的失去电子可能是因为在溶液中水合导致.若先失去外层电子,水合后的亚铁离子应该能量比水加上亚铁离子低很多.其他的也是类似分析.对于金属离子得失电子我尚未见到什么很有力的证据能说明一定是如何进行的,只能猜测其可能的.最外层的能量不能说“少”只能说是绝对值较小,正常情况下能级是和负的电子所在层的平方呈反比(这只是浅显的说),这对应的能量事实上就是电离能,详细写说明的话就是当电子能量大于这个电离能的情况,电子的能谱变成连续的,将不受到原子核库仑力的束缚.一般来说就是上述规律,但是伴随着电子的屏蔽、钻穿、能级交错,以及相对论效应,上述命题就不是完全正确的了.1年前查看全部
- 铬的价电子构型为3d54s1,而不是3d44s2,这主要决定与( )
铬的价电子构型为3d54s1,而不是3d44s2,这主要决定与( )
a、洪特规则
b、能量最低理论
c、泡利不相容原理 alic_80131年前1
alic_80131年前1 -
 天空之乘 共回答了20个问题
天空之乘 共回答了20个问题 |采纳率95%a 价电子在充满和半充满的时候更稳定.3d是10个,4s是2个 5个 1个 更稳定1年前查看全部
- 高中化学关于电子气理论的疑问.化学书上说电子气是金属原子脱落下来的价电子形成的,也就是说电子气是金属的价电子脱落下来的.
高中化学关于电子气理论的疑问.
化学书上说电子气是金属原子脱落下来的价电子形成的,也就是说电子气是金属的价电子脱落下来的.参考书上说金属键的本质是金属原子脱落下来的价电子形成金属阳离子,金属阳离子与自由电子间存在的相互作用.而金属阳离子的运动状态是在一定范围内震动,而自由电子可以在整个金属中移动.但书上说解释金属良好的导电性时,可以形象的用电子气在电场中定向移动解释金属良好的导电性.可是电子气不是脱落下来的价电子么?而价电子不是形成金属阳离子么?而金属阳离子不是只能在一定范围内震动么?怎么又可以定向移动了? zhangpeilei1年前1
zhangpeilei1年前1 -
 寒之心 共回答了15个问题
寒之心 共回答了15个问题 |采纳率93.3%楼主问的应该是个语文题:“而价电子不是形成金属阳离子么?而金属阳离子不是只能在一定范围内震动么?怎么又可以定向移动了?”再读一遍原文“金属键的本质是金属原子脱落下来的价电子形成金属阳离子,金属阳离子与自由电子间存在的相互作用.而金属阳离子的运动状态是在一定范围内震动,而自由电子可以在整个金属中移动.” 价电子不是金属阳离子,金属原子失去价电子,剩下的原子核和内层电子为金属阳离子 掉下的价电子为自由电子,自由电子在金属内部的自由移动就是金属导电的原因.而金属阳离子只能在一定范围内震动.1年前查看全部
- 请问焰色反应的物理机制是什么?以上各位老师提示我是原子外围电子(即价电子)的跃迁而致,但我想再次请问:为什么不同价态的同
请问焰色反应的物理机制是什么?
以上各位老师提示我是原子外围电子(即价电子)的跃迁而致,但我想再次请问:为什么不同价态的同一种元素(如二价的铜和一价的铜)在焰色反应中显示为同一种颜色?《也正是因为这一点:我们可以用焰色反应来鉴定物质中是否含有该元素》我想:不同价态的同一种元素的外围电子分布是不同的,因此发生跃迁时能级变化也是不同的,因此焰色的颜色也应是不同的.这与实验不符.是否是因为原子内层电子的跃迁而致,或者甚至是原子核内部的能级发生跃迁而致的呢? duee8101年前1
duee8101年前1 -
 whtievivi 共回答了27个问题
whtievivi 共回答了27个问题 |采纳率92.6%焰色反应的物理过程是化学物质先汽化,然后分解为单个的原子,所以从本质上说,焰色反应是金属元素的性质.楼主所说的二价的铜和一价的铜在焰色反应中都变成了铜原子,所以显示的颜色相同.1年前查看全部
- spdf怎么书写11.18号元素价电子构型?写在纸上.是写成spdf形式
 cywb1年前0
cywb1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1(2012•嘉定区二模)化学方程式书写正确,且属于置换反应的是( )
- 2六(3)班的同学订阅了三种刊物,其中80%的人订了《小学生作文》,75%的人订了《小灵
- 3我是小红的妈妈英语怎么说?
- 4一个无盖的长方体木箱,长0.8米,宽0.5米,高0.4米.做5个木箱至少需要木板多少平方米
- 5i have too much homework to do ,so i can't go out to play in
- 6国外客户要去度假,用英语怎样表达祝福呢?
- 7人与动物之间和谐相处的故事50字左右
- 8谁能告诉我关于电场力、电势能、电势差的公式
- 9请问铝和氧生成氧化铝是不是氧化还原反应?
- 10一批同学搬一堆砖,每人搬8块,还剩14块,每人搬9块,其中1人只要搬6块,这批同学有多少人?砖有多
- 11It will be just a dream forever…中文是什么意思?
- 12下列关于组成生物体的主要化学元素的说法,错误的是( )
- 13a+b-2b+[3a-2(b+2a)+5b] 其中a=2分之1b=-1化简求值
- 14已知sinA+sinB=sin225°,cosA+cosB=cos225° 求cos(A-B)及cos(A+B)的值
- 15英语翻译则货敝身压,敝:则狼已啮片肉而去,而:乘其不能为力之际,际:窃尝一脔,窃:脔:亦黠而可笑也,黠:而:共7个,
