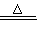k2FeO4 中铁元素的化合价
 focusdoll2022-10-04 11:39:543条回答
focusdoll2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 给我一支烟311 共回答了13个问题
给我一支烟311 共回答了13个问题 |采纳率84.6%- 高铁酸钾 铁元素是+6价 一般+6价的高铁都具有很好的消毒作用
- 1年前
 gfk55 共回答了406个问题
gfk55 共回答了406个问题 |采纳率- +6,高铁酸钾,K+1 O-2
- 1年前
 抹点清凉油 共回答了82个问题
抹点清凉油 共回答了82个问题 |采纳率- 6 这是高铁酸盐
- 1年前
相关推荐
- 在碱性环境下将Fe2O3 与KClO3按1:1混合恰好完全反应可制得K2FeO4.求离子方程式
 matinas1年前0
matinas1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2006•苏州模拟)高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、吸附、
(2006•苏州模拟)高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌、灭藻的新型、高效的多功能水处理剂.干燥的高铁酸钾在198℃以下是稳定的,受热易分解为氧化铁、金属氧化物和氧气.根据以上信息,下列说法正确的是( )
A.高铁酸钾是一种氧化物
B.高铁酸钾是一种含氧元素的混合物
C.高铁酸钾中铁元素的化合价为+3价
D.保存高铁酸钾时应注意防潮避热 漫山飘叶1年前1
漫山飘叶1年前1 -
 至尊便便 共回答了15个问题
至尊便便 共回答了15个问题 |采纳率80%解题思路:A、氧化物是只含有两种元素且其中一种元素是氧元素的化合物.
B、根据高铁酸钾化学式的含义、纯净物与混合物的特征进行分析判断.
C、根据在化合物中正负化合价代数和为零,结合高铁酸钾的化学式进行解答.
D、根据题意,干燥的高铁酸钾在198℃以下是稳定的,受热易分解为氧化铁、金属氧化物和氧气,据此进行分析判断.A、高铁酸钾是由钾、铁、氧三种元素组成的化合物,不属于氧化物,故选项说法错误.
B、高铁酸钾中含有氧元素,是由高铁酸钾一种物质组成的,属于纯净物,故选项说法错误.
C、钾元素显+1价,氧元素显-2价,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6,故选项说法错误.
D、由题意,干燥的高铁酸钾在198℃以下是稳定的,受热易分解为氧化铁、金属氧化物和氧气,可推测保存高铁酸钾时应注意防潮避热,故选项说法正确.
故选:D.点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;有关元素化合价的计算.
考点点评: 本题难度不大,掌握化学式的含义、氧化物的特征、纯净物与混合物的判别方法等并能灵活运用是正确解答本题的关键.1年前查看全部
- Feso4+k2o2-k2Feo4+k2o+k2so4+o2
Feso4+k2o2-k2Feo4+k2o+k2so4+o2
拜托能帮我配平一会吗 打到美日hh1年前1
打到美日hh1年前1 -
 shqyets 共回答了13个问题
shqyets 共回答了13个问题 |采纳率100%2FESO4+4K2O2=2K2FEO4+K2SO4+O21年前查看全部
- 高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌、灭藻的新型
高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌、灭藻的新型、高效的多功能水处理剂.干燥的高铁酸钾在198℃以下是稳定的,受热易分解为氧化铁、金属氧化物和氧气.根据上述信息,请回答下列问题:
(1)高铁酸钾的物理性质是______;
(2)保存高铁酸钾时应注意______;
(3)试完成高铁酸钾与水反应的化学方程式.
4K2FeO4+10H2O═4Fe(OH)3↓+8KOH+______. silverbrick1年前1
silverbrick1年前1 -
 nanhaiyu123 共回答了26个问题
nanhaiyu123 共回答了26个问题 |采纳率92.3%解题思路:(1)紫色粉末属于高铁酸钾的物理性质;
(2)高铁酸钾受热时容易分解,保存时要注意防潮避热;
(3)根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式.(1)颜色、状态属于高铁酸钾的物理性质;
(2)因为高铁酸钾在水中或受热的情况下不稳定,容易发生化学反应,所以保存高铁酸钾时应注意防潮避热;
(3)高铁酸钾与水反应,利用质量守恒定律中关于各元素原子数在反应前后不变的知识对产物中的物质进行确定即可,反应前有4×2﹦8个K,反应后也有8×1﹦8个K,反应前有4×1﹦4个Fe,反应后也有4×1﹦4Fe个,反应前有10×2﹦20个H,反应后也有4×3+8×1﹦20个H,反应前有4×4+10×1﹦26个O,反应后有4×3+8×1﹦20个O,缺6个O,故为3O2,其化学方程式为:4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+3O2.
故答案为:(1)紫色粉末;(2)防潮避热;(3)3O2↑.点评:
本题考点: 化学性质与物理性质的差别及应用;质量守恒定律及其应用.
考点点评: 解答本题要掌握化学方程式的书写方法,能够正确的区分物质的物理性质和化学性质及分析题中信息进行解题的能力,只有这样才能对问题做出正确的判断.1年前查看全部
- 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.利用Fe(NO2)3、NaClO和KOH等为
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.利用Fe(NO2)3、NaClO和KOH等为原料制备高铁酸钾的生产流程如下:

已知:NaOH和NaClO的混合液是通过氯气和烧碱溶液反应制取的.
(1)第①步所加人的混合液中仅含三种溶质,除NaOH和NaClO外,还含有______ (填化学式)
(2)写出第①步中Na0H、NaC10与Fe(NQ3)3发生反应的离子方程式:______
(3)Fe(NO2)3溶液的浓度对产品的产率有较大的影响,现要配制1000mL5mol.L-Fe(NO3)3溶液,需要的玻璃仪器有量筒、烧杯、______、______、______.第③步说明此温度下K2FeO4的溶解度______(填“>”、“<”或“=”)Na2FeO4的溶解度.
(4)若第②步所加NaOH溶液中含有160g NaOH.实验结束后,将第②、③步所得滤液以及第④步所得洗涤液全部收集,恰好可得8L混合液,测得其中Na+浓度为2.5mol.L-,则理论上制得的纯K2FeO4的质量为______.(假定各步均恰好反应完全) 兵爷爷1年前1
兵爷爷1年前1 -
 szmay2007 共回答了21个问题
szmay2007 共回答了21个问题 |采纳率95.2%解题思路:硝酸铁溶液中加入氢氧化钠和次氯酸钠反应得到氯化钠高铁酸钠的混合溶液,加入氢氧化钠蒸发浓缩冷却结晶,过滤洗涤得到高铁酸钠固体,在固体中加入饱和氢氧化钾溶液过滤得到高铁酸钾粗产品,经过重结晶洗涤干燥得到较纯的K2FeO4;
(1)第①步所加人的混合液中仅含三种溶质,除NaOH和NaClO外,还应含有NaCl;
(2)第①步中Na0H、NaC10与Fe(NQ3)3发生反应生成高铁酸盐和氯离子;
(3)依据溶液配制的步骤和过程分析判断需要的玻璃仪器;
(4)第②步所加NaOH溶液中含有160g NaOH物质的量为4mol,恰好可得8L混合液,测得其中Na+浓度为2.5mol.L-1,钠元素物质的量=8L×2.5mol/L=20mol,依据氯元素守恒可知,第一步含有钠元素16mol,结合化学方程式中定量关系,每生成3molClO-离子,同时生成3molNaCl,即每2molFe3+参加费用的NaClO为3mol,NaOH为10mol,同时有3molNaCl混在原氢氧化钠和次氯酸钠呵呵溶液中,原Fe(NO3)3为2mol;则K2FeO4为2mol;硝酸铁溶液中加入氢氧化钠和次氯酸钠反应得到氯化钠高铁酸钠的混合溶液,加入氢氧化钠蒸发浓缩冷却结晶,过滤洗涤得到高铁酸钠固体,在固体中加入饱和氢氧化钾溶液过滤得到高铁酸钾粗产品,经过重结晶洗涤干燥得到较纯的K2FeO4;
(1)第①步所加人的混合液中仅含三种溶质,除NaOH和NaClO外,还应含有NaCl;
故答案为:NaCl;
(2)第①步中Na0H、NaC10与Fe(NQ3)3发生反应生成高铁酸盐和氯离子,反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(3)依据溶液配制的步骤和过程分析判断需要的玻璃仪器,要配制1000mL5mol.L-Fe(NO3)3溶液,需要的玻璃仪器有量筒、烧杯、1000ml容量瓶、胶头滴管、玻璃棒;第③步是Na2FeO4转化为K2FeO4,说明此温度下K2FeO4的溶解度小于Na2FeO4;
故答案为:1000ml容量瓶、胶头滴管、玻璃棒;<;
(4)第②步所加NaOH溶液中含有160g NaOH物质的量为4mol,恰好可得8L混合液,测得其中Na+浓度为2.5mol.L-1,钠元素物质的量=8L×2.5mol/L=20mol,依据氯元素守恒可知,第一步含有钠元素16mol,结合化学方程式中定量关系,每生成3molClO-离子,同时生成3molNaCl,即每2molFe3+参加费用的NaClO为3mol,NaOH为10mol,同时有3molNaCl混在原氢氧化钠和次氯酸钠呵呵溶液中,原Fe(NO3)3为2mol;则K2FeO4为2mol,质量=2mol×198g/mol=396g;
故答案为:396g;点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质提纯的理解应用,实验基本操作,物质性质的分析应用,注意离子方程式书写方法和化学方程式计算,掌握基础是关键,题目难度中等.1年前查看全部
- 高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌、灭藻的新型
高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌、灭藻的新型、高效的多功能水处理剂。干燥的高铁酸钾在198℃以下是稳定的,受热易分解为氧化铁、金属氧化物和氧气。根据上述信息,请回答下列问题:
(1)高铁酸钾的物理性质是;
(2)保存高铁酸钾时应注意 ;
(3)试完成高铁酸钾与水反应的化学方程式。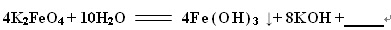
 独自站在悬崖边1年前1
独自站在悬崖边1年前1 -
 刘崇一 共回答了16个问题
刘崇一 共回答了16个问题 |采纳率87.5%1年前查看全部
- (2014•莆田模拟)高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用.
(2014•莆田模拟)高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用.
(1)K2FeO4常用做高效水处理剂,其两种作用分别是______.[已知:FeO42-+3e-+4H2O⇌Fe(OH)3+5OH-]
(2)制备K2FeO4可以采用湿式氧化法,流程如图: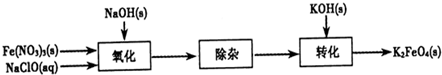
①完成氧化工序的离子方程式:□ClO-+□Fe3+□______═□FeO42-+□Cl-+□______.
②除杂工序目的是除去Na2FeO4溶液中的杂质,除去的杂质主要有______(写化学式).
③转化工序控制在某温度下进行,则该温度下溶解度:Na2FeO4______K2FeO4(填“>”、“<”或“=”).
(3)实验室模拟工业电解法制取K2FeO4,装置如图.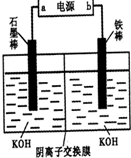
①此装置中电源的负极是______(填“a”或“b”).
②阳极的电极反应式为______.
(4)已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2实验测得K2FeO4溶液浓度与温度和pH的关系分别如图: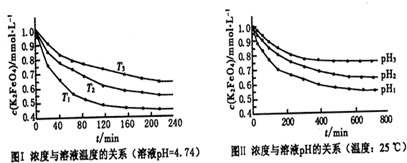
①由图I可得出的结论:该反应的△H______ 0(填“>”、“<”或“=”).
②图Ⅱ中pH1______pH3(填“>”、“<”或“=”). ggg91年前1
ggg91年前1 -
 yxhbol 共回答了19个问题
yxhbol 共回答了19个问题 |采纳率89.5%解题思路:(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
(2)①反应中ClO-是氧化剂,还原产物是Cl-,根据元素守恒,可知反应式中需要补充OH-和H2O.根据化合价升降法配平方程式;
②根据反应物和生成物确定杂质;
③沉淀向溶解度更小的方向转化;
(3)①活泼金属做阳极,金属失电子;
②阳极上铁失电子生成FeO42-;
(4)①温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小;温度越高FeO42-浓度越小,正向反应是吸热反应;
②pH越小,氢离子浓度越大,然后根据平衡移动解题.(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
故答案为:杀菌消毒、吸附悬浮物;
(2)①反应中Fe3+→FeO42-,铁元素化合价由+3价升高为+6价,化合价总升高3价,ClO-→Cl-,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故Fe3+系数为2,ClO-系数为3,由铁元素守恒可知 FeO42-系数为2,由氯元素守恒可知Cl-系数为3,根据钠元素守恒可知OH-系数为10,由氢元素守恒可知H2O系数为5,配平离子方程式:3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5 H2O,故答案为:3、2、10OH-、2、3、5H2O;
②根据反应物和生成物确定杂质为NaNO3、NaCl,故答案为:NaNO3、NaCl;
③沉淀向溶解度更小的方向转化,K2FeO4的溶解度更小,故答案为:>;
(3)①活泼金属做阳极,金属失电子,则b为正极,a为负极,故答案为:a;
②阳极上铁失电子生成FeO42-,1mol铁失去6mol电子,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
(4)①由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应,故答案为:>;
②pH越小,氢离子浓度越大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,由图知pH1<pH3,故答案为:<.点评:
本题考点: 制备实验方案的设计;反应热和焓变;电解原理;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查学生阅读题目获取信息的能力、氧化还原反应、电解原理的应用,电极反应,电极产物的判断和化学平衡移动等,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力,注意基础知识的全面掌握.1年前查看全部
- 化学是使人类进步的关键.(1)绿色净水剂含①高铁酸钾(K2FeO4)、②聚合硫酸铁([Fe2(OH)n(SO4)3-n/
化学是使人类进步的关键.
(1)绿色净水剂含①高铁酸钾(K2FeO4)、②聚合硫酸铁([Fe2(OH)n(SO4)3-n/2]m,简称聚铁),其中高铁酸钾与水反应生成的红褐色氢氧化物______(填化学式)对水中的杂质有絮凝作用.
(2)为减少“温室效应”带来的负面影响,法国化学家Paul Sabatier提出CO2甲烷反应.该反应使CO2和H2在催化剂作用下生成CH4和H2O,试写出该反应的化学方程式:CO2+4H2
CH4+2H2O点燃 .CO2+4H2.
CH4+2H2O点燃 .
(3)德国INTEGRAL公司因研究出无辐射冷却技术而荣获德国环境大奖,他们用水和冰组成的物质代替传统的氟利昂或氨做冷却剂.该致冷剂______(填字母序号)
A.电解能生成氢气和氧气B.对环境不产生任何污染C.化学性质和水不同
(4)在温度超过374℃、压强超过22.1MPa下的水就是超临界水.用超临界水、空气氧化处理聚氯乙烯(C2H3Cl)n的反应中,生成两种自然界中常见的氧化物______、______(写化学式)和HCl. obaliu1年前1
obaliu1年前1 -
 cp_010 共回答了14个问题
cp_010 共回答了14个问题 |采纳率78.6%解题思路:(1)根据高铁酸钾的化学式、质量守恒定律,结合初中化学中带颜色的物质进行分析判断红褐色氢氧化物的化学式.
(2)结合题中给出的反应物和生成物及条件写出反应的化学方程式即可.
(3)根据水的组成及性质进行分析解答.
(4)根据质量守恒定律、氧化物的特征进行分析判断.(1)根据高铁酸钾的化学式、质量守恒定律,初中阶段所见的红褐色物质可能是铁的氢氧化物,而该反应的反应物是高铁酸钾和水,故红褐色氢氧化物是Fe(OH)3.
(2)根据题中给出的反应物CO2和H2,生成物是CH4和H2O,反应条件是催化剂,该反应的化学方程式为CO2+4H2
点燃
.
CH4+2H2O.
(3)水电解能生成氢气和氧气,水由氢、氧两种元素组成,水排入空气中不会破坏环境.
(4)根据化学反应前后元素的种类不变、生成物是氧化物,故生成的两种自然界中常见的氧化物是CO2、H2O.
故答案为:
(1)Fe(OH)3;
(2)CO2+4H2
点燃
.
CH4+2H2O;
(3)AB;
(4)CO2、H2O.点评:
本题考点: 质量守恒定律及其应用;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不是很大,主要考查了质量守恒定律的综合应用及化学方程式的书写,灵活运用质量守恒定律是正确解答本题的关键.1年前查看全部
- (2007•常德)高铁酸钾(K2FeO4)是一种具有氧化、凝聚、杀菌等功能的新型、高效水处理剂.高铁酸钾中铁元素的化合价
(2007•常德)高铁酸钾(K2FeO4)是一种具有氧化、凝聚、杀菌等功能的新型、高效水处理剂.高铁酸钾中铁元素的化合价是( )
A.+2
B.+3
C.+4
D.+6 blcu_ljh1年前1
blcu_ljh1年前1 -
 xwx1022 共回答了19个问题
xwx1022 共回答了19个问题 |采纳率89.5%解题思路:根据在化合物中正负化合价代数和为零,结合高铁酸钾(K2FeO4)的化学式进行解答本题.钾元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价.
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化合价的方法即可正确解答本题.1年前查看全部
- (2010•广州一模)新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中
(2010•广州一模)新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.工业上制备K2FeO4的常用方法有两种.
方法Ⅰ:次氯酸盐氧化法,工艺流程如图.
(1)完成“氧化”过程中反应的化学方程式:
______FeCl3+______NaOH+______NaClO→______ Na2FeO4+______d+______d其中氧化剂是______(填化学式).
(2)“转化”过程中发生反应的化学方程式为______.
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用______溶解,然后______.
方法Ⅱ:电解法.以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH.
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为______. 铃目星语1年前1
铃目星语1年前1 -
 于尚黔 共回答了17个问题
于尚黔 共回答了17个问题 |采纳率76.5%解题思路:(1)反应中NaClO是氧化剂,还原产物是NaCl,根据元素守恒,可知反应式中需要补充NaCl和H2O.根据化合价升降法配平方程式.
(2)由工艺流程可知,“氧化”过程除杂后的滤液中含有Na2FeO4,“转化”过程的产物为K2FeO4,故“转化”过程是在加入KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4.
(3)由题目信息可知,K2FeO4可溶于水,在中性或酸性溶液中能分解,在碱性溶液中稳定,在分离提提纯的时候就要在碱性环境中进行,要防止引入新杂质,所以需要将K2FeO4粗产品在稀KOH溶液中溶解,然后加入饱和KOH溶液,冷却结晶.
(4)由题目信息可知,铁为阳极电解氢氧化钠溶液,生成FeO42-,由元素守恒还生成水.(1)反应中FeCl3→Na2FeO4,铁元素化合价由+3价升高为+6价,化合价总升高3价,NaClO→NaCl,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故FeCl3系数为2,NaClO系数为3,由铁元素守恒可知 Na2FeO4系数为2,由氯元素守恒可知NaCl系数为2×3+3=9,根据钠元素守恒可知NaOH系数为9+2×2=13,由氢元素守恒可知H2O系数为5,配平方程式为2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O;
反应中NaClO→NaCl,氯元素化合价由+1降低为-1价,NaClO是氧化剂,还原产物是NaCl.
故答案为:2、10、3、2、9NaCl、5H2O;NaClO.
(2)“转化”过程是在加入KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH.
故答案为:Na2FeO4+2KOH=K2FeO4+2NaOH.
(3)由题目信息可知,K2FeO4可溶于水,在中性或酸性溶液中能分解,在碱性溶液中稳定,在分离提提纯的时候就要在碱性环境中进行,要防止引入新杂质,所以需要将K2FeO4粗产品在稀KOH溶液中溶解,然后加入饱和KOH溶液,冷却结晶,过滤.
故答案为:稀KOH溶液;再加入饱和KOH溶液,冷却结晶,过滤.
(4)由题目信息可知,铁为阳极电解氢氧化钠溶液,生成FeO42-,阳极电极反应式为Fe+8OH--6e-=FeO42-+4H2O.
故答案为:Fe+8OH--6e-=FeO42-+4H2O.点评:
本题考点: 制备实验方案的设计;氧化还原反应方程式的配平;电解原理.
考点点评: 考查方程式的书写、基本的实验操作、阅读题目获取信息能力等,难度中等,需要学生具备综合运用知识及题目信息分析问题、解决问题能力.对于这类题目,需要搞清楚每一步反应物、生成物,清楚工艺流程原理.1年前查看全部
- 已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2实验测得K2FeO4
已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2实验测得K2FeO4溶液浓度与温度和pH的关系分别如图:
①由图I可得出的结论:该反应的△H —— 0(填“>”、“<”或“=”).
②图Ⅱ中pH1—— pH3(填“>”、“<”或“=”).
解析为什么

 yan12sh34j561年前1
yan12sh34j561年前1 -
 everman 共回答了15个问题
everman 共回答了15个问题 |采纳率93.3%△H>0.随着温度增高,FeO42-浓度越来越低,反应右移,吸热
pH1<PH3,酸越多,反应越向右移,FeO42-浓度越低,故<1年前查看全部
- (1)常见的绿色净水剂、消毒剂有:①高铁酸钾(K2FeO4)②聚合硫酸铁([Fe2(OH)n(SO4)3-n/2]m,简
(1)常见的绿色净水剂、消毒剂有:①高铁酸钾(K2FeO4)②聚合硫酸铁([Fe2(OH)n(SO4)3-n/2]m,简称聚铁)③二氧化氯(ClO2),这3种物质中共含有______(填数字)种非金属元素,高铁酸钾与水反应生成一种红褐色的氢氧化物______(填化学式),该物质对水中的杂质有絮凝作用.ClO2制备方法较多,我国科学家探索的新方法是:氯气(Cl2)和固体亚氯酸钠(NaClO2)反应生成一种常见的盐和ClO2,反应方程式为______.
(2)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于大规模集成电路生产、陶瓷工业等领域.工业上从铝土矿中获得物质X,从空气中获得氮气,再将物质X、N2和碳在一定条件下反应制得AlN和CO.氮化铝陶瓷属于______(填“金属材料”或“无机非金属材料”).物质X的化学式______,经估算,AlN中N元素质量分数______(填“大于”或“小于”)NH4NO3中N元素质量分数.
(3)叠氮化钠(NaN3)被广泛应用于汽车安全气囊.汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,反应方程式为______.汽车尾气中有毒的CO和NOx经特殊的催化装置后,转化为两种无色无味无毒的常见气体是______、______. dong8291年前1
dong8291年前1 -
 ξ潴↘头 共回答了13个问题
ξ潴↘头 共回答了13个问题 |采纳率84.6%解题思路:(1)根据化学式的意义分析物质的组成元素,找出非金属元素;根据质量守恒定律分析物质,根据反应物、生成物写出反应的方程式;
(2)根据材料的分类判断氮化铝陶瓷的类别;根据质量守恒定律推断X的化学式,根据化学式的特点估算化合物中元素的质量分数;
(3)根据反应物、生成物写出反应的方程式,根据质量守恒定律推断气体.(1)由化学式的意义可知,在K2FeO4、([Fe2(OH)n(SO4)3-n/2]m、ClO2三种物质中有O、H、S、Cl、四种非金属元素;由质量守恒定律可知,高铁酸钾与水反应生成一种红褐色的氢氧化物是 Fe(OH)3;氯气(Cl2)和固体亚氯酸钠(NaClO2)反应生成一种常见的盐和ClO2,由质量守恒定律可知,常见的盐是氯化钠,反应的方程式是:Cl2+2NaClO2=2ClO2+2NaCl;
(2)由材料分类的知识可知,氮化铝陶瓷属于无机非金属材料;由于物质X、N2和碳在一定条件下反应制得AlN和CO,由质量守恒定律可知,物质X的化学式是 Al2O3,在AlN中,每两个氮原子与两个铝原子结合;在NH4NO3中,每两个氮原子与三个氧原子和四个氢原子结合,经估算,AlN中N元素质量分数小于 NH4NO3中N元素质量分数;
(3)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,反应方程式为:2NaN3=2Na+3N2↑;汽车尾气中有毒的CO和NOx经特殊的催化装置后,转化为两种无色无味无毒的常见气体,由质量守恒定律及气体的性质可知:气体为 CO2、N2.
故答为:(1)4,Fe(OH)3,Cl2+2NaClO2=2ClO2+2NaCl;(2)无机非金属材料,Al2O3,小于;(3)2NaN3=2Na+3N2↑,CO2、N2.点评:
本题考点: 物质的元素组成;化学式的书写及意义;元素的质量分数计算;书写化学方程式、文字表达式、电离方程式;常用燃料的使用与其对环境的影响.
考点点评: 本题将化学知识与生活紧密联系起来,体现了生活中处处有化学.解题时,认真审题,根据题意,将问题与有关的化学知识有机地联系起来,即可解答.1年前查看全部
- (2006•龙岩)高铁酸钾(K2FeO4)是一种集氧化、吸附、杀菌、灭藻的新型、高效的多功能水处理剂.高铁酸钾中铁元素(
(2006•龙岩)高铁酸钾(K2FeO4)是一种集氧化、吸附、杀菌、灭藻的新型、高效的多功能水处理剂.高铁酸钾中铁元素(Fe)化合价为( )
A.+2
B.+3
C.+4
D.+6 fly099191年前1
fly099191年前1 -
 ForU战神 共回答了19个问题
ForU战神 共回答了19个问题 |采纳率84.2%解题思路:根据在化合物中正负化合价代数和为零,结合高铁酸钾(K2FeO4)的化学式进行解答本题.钾元素显+1价,氧元素显-2价,
设铁元素的化合价是x,
根据在化合物中正负化合价代数和为零,
可得:(+1)×2+x+(-2)×4=0,
则x=+6价.
故选:D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化合价的方法即可正确解答本题.1年前查看全部
- 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.利用Fe(NO2)3、NaClO和KOH等为
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.利用Fe(NO2)3、NaClO和KOH等为原料制备高铁酸钾的生产流程如下:

已知:NaOH和NaClO的混合液是通过氯气和烧碱溶液反应制取的.
(1)第①步所加人的混合液中仅含三种溶质,除NaOH和NaClO外,还含有______ (填化学式)
(2)写出第①步中Na0H、NaC10与Fe(NQ3)3发生反应的离子方程式:______
(3)Fe(NO2)3溶液的浓度对产品的产率有较大的影响,现要配制1000mL5mol.L-Fe(NO3)3溶液,需要的玻璃仪器有量筒、烧杯、______、______、______.第③步说明此温度下K2FeO4的溶解度______(填“>”、“<”或“=”)Na2FeO4的溶解度.
(4)若第②步所加NaOH溶液中含有160g NaOH.实验结束后,将第②、③步所得滤液以及第④步所得洗涤液全部收集,恰好可得8L混合液,测得其中Na+浓度为2.5mol.L-,则理论上制得的纯K2FeO4的质量为______.(假定各步均恰好反应完全) 123456abc1年前1
123456abc1年前1 -
 水平21 共回答了19个问题
水平21 共回答了19个问题 |采纳率89.5%解题思路:硝酸铁溶液中加入氢氧化钠和次氯酸钠反应得到氯化钠高铁酸钠的混合溶液,加入氢氧化钠蒸发浓缩冷却结晶,过滤洗涤得到高铁酸钠固体,在固体中加入饱和氢氧化钾溶液过滤得到高铁酸钾粗产品,经过重结晶洗涤干燥得到较纯的K2FeO4;
(1)第①步所加人的混合液中仅含三种溶质,除NaOH和NaClO外,还应含有NaCl;
(2)第①步中Na0H、NaC10与Fe(NQ3)3发生反应生成高铁酸盐和氯离子;
(3)依据溶液配制的步骤和过程分析判断需要的玻璃仪器;
(4)第②步所加NaOH溶液中含有160g NaOH物质的量为4mol,恰好可得8L混合液,测得其中Na+浓度为2.5mol.L-1,钠元素物质的量=8L×2.5mol/L=20mol,依据氯元素守恒可知,第一步含有钠元素16mol,结合化学方程式中定量关系,每生成3molClO-离子,同时生成3molNaCl,即每2molFe3+参加费用的NaClO为3mol,NaOH为10mol,同时有3molNaCl混在原氢氧化钠和次氯酸钠呵呵溶液中,原Fe(NO3)3为2mol;则K2FeO4为2mol;硝酸铁溶液中加入氢氧化钠和次氯酸钠反应得到氯化钠高铁酸钠的混合溶液,加入氢氧化钠蒸发浓缩冷却结晶,过滤洗涤得到高铁酸钠固体,在固体中加入饱和氢氧化钾溶液过滤得到高铁酸钾粗产品,经过重结晶洗涤干燥得到较纯的K2FeO4;
(1)第①步所加人的混合液中仅含三种溶质,除NaOH和NaClO外,还应含有NaCl;
故答案为:NaCl;
(2)第①步中Na0H、NaC10与Fe(NQ3)3发生反应生成高铁酸盐和氯离子,反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(3)依据溶液配制的步骤和过程分析判断需要的玻璃仪器,要配制1000mL5mol.L-Fe(NO3)3溶液,需要的玻璃仪器有量筒、烧杯、1000ml容量瓶、胶头滴管、玻璃棒;第③步是Na2FeO4转化为K2FeO4,说明此温度下K2FeO4的溶解度小于Na2FeO4;
故答案为:1000ml容量瓶、胶头滴管、玻璃棒;<;
(4)第②步所加NaOH溶液中含有160g NaOH物质的量为4mol,恰好可得8L混合液,测得其中Na+浓度为2.5mol.L-1,钠元素物质的量=8L×2.5mol/L=20mol,依据氯元素守恒可知,第一步含有钠元素16mol,结合化学方程式中定量关系,每生成3molClO-离子,同时生成3molNaCl,即每2molFe3+参加费用的NaClO为3mol,NaOH为10mol,同时有3molNaCl混在原氢氧化钠和次氯酸钠呵呵溶液中,原Fe(NO3)3为2mol;则K2FeO4为2mol,质量=2mol×198g/mol=396g;
故答案为:396g;点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质提纯的理解应用,实验基本操作,物质性质的分析应用,注意离子方程式书写方法和化学方程式计算,掌握基础是关键,题目难度中等.1年前查看全部
- 高铁酸钾(K2FeO4)是一种比氯气、臭氧、高锰酸钾更强的多功能水处理剂,被广泛应用于各种净水过程,高铁酸钾中铁元素的化
高铁酸钾(K2FeO4)是一种比氯气、臭氧、高锰酸钾更强的多功能水处理剂,被广泛应用于各种净水过程,高铁酸钾中铁元素的化合价为( )
A.+2
B.+3
C.+6
D.+7 神aa英1年前1
神aa英1年前1 -
 鹰盟-艳露凝香 共回答了16个问题
鹰盟-艳露凝香 共回答了16个问题 |采纳率81.3%解题思路:根据在化合物中正负化合价代数和为零,进行解答.根据在化合物中正负化合价代数和为零,可得高铁酸钾中铁元素的化合价为:(+1)×2+x+(-2)×4=0,
则x=+6.
故选C.点评:
本题考点: 化学式的书写及意义;常见元素与常见原子团的化合价;有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.1年前查看全部
- 可以回答最好了.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂下列反应可制取它 2Fe(OH)3+3CL+10
可以回答最好了.
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂下列反应可制取它 2Fe(OH)3+3CL+10KOH=(条件0到30 摄氏度)2K2FeO4+6KCL+8H2O
下列说法正确的是:A.该反应是置换反应 B.钾元素化合价降低 C.氢氧化铁发生还原反应 D.CL2是氧化剂 (可以说清理由更好) csaifen1年前5
csaifen1年前5 -
 gift69 共回答了16个问题
gift69 共回答了16个问题 |采纳率93.8%这是个氧化还原反应,铁元素化合价升高,发生氧化反应,氯气化合价降低发生还原反应,充当氧化剂.
应选D1年前查看全部
- 氯气 氢氧化铁 氢氧化钾 这三种物质怎么生成高铁酸钾(K2FeO4)要化学方程式!急,
 woaini45891年前1
woaini45891年前1 -
 清驰 共回答了18个问题
清驰 共回答了18个问题 |采纳率94.4%3氯气2氢氧化铁10氢氧化钾1年前查看全部
- 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如下图所示.
我们的图是KOH
电解过程中X极有气体生成,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色
1)电解过程中,X极是_________极,电极反应是__________________.
(2)生成高铁酸根(FeO42-)的电极反应式为_________________.
(3)当电路中转移了0.3mol电子时溶液增重 g
重点回答(2)(3) Polaris821年前1
Polaris821年前1 -
 帅哥哥0000 共回答了11个问题
帅哥哥0000 共回答了11个问题 |采纳率90.9%X极与电源负极相连,它明显是阴极,在此发生物质得到电子被还原的反应.Y极则是阳极,在此发生物质失去电子被氧化的反应.
阴极(X)电极反应式 2H2O + 2e = H2 + 2OH-阳极(Y)电极反应式 Fe + 8OH- = (FeO4)2- + 4H2O + 6e电解总反应式 Fe + 2H2O + 2OH- = 3H2 + (FeO4)2-,根据方程式可以算出传递电子数6mol时,溶液增重50g.
则传递0.3mol电子时溶液增重2.5g1年前查看全部
- 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、O3、ClO2氧化性更强,且没有二次污染.高铁酸钾与
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、O3、ClO2氧化性更强,且没有二次污染.高铁酸钾与水反应的化学方程式是:4K2FeO4+10H2O=4X↓+8KOH+3O2↑.以下有关高铁酸钾的说法正确的是( )
A.高铁酸钾属于氧化物
B.高铁酸钾应密封、防水保存
C.高铁酸钾中铁显+3价
D.X的化学式是Fe(OH)2 arrowfisher1年前1
arrowfisher1年前1 -
 zyx9988 共回答了22个问题
zyx9988 共回答了22个问题 |采纳率95.5%解题思路:根据高铁酸钾的组成和性质来分析物质的类别及物质的保存,利用高铁酸钾的化学式及化学方程式来分析元素的化合价及物质的化学式.A、高铁酸钾是K、Fe、O三种元素组成的,而氧化物中只有两种元素组成,则高铁酸钾不属于氧化物,故A错误;
B、因高铁酸钾与水反应,则高铁酸钾应密封、防水保存,故B正确;
C、高铁酸钾中K元素的化合价为+1价,O元素的化合价为-2价,根据化合物中正负化合价的代数和为零,则铁元素的化合价为+6价,故C错误;
D、由化学方程式4K2FeO4+10H2O=4X↓+8KOH+3O2↑,根据质量守恒定律可知X的化学式为Fe(OH)3,故D错误;
故选B.点评:
本题考点: 有关化学式的计算和推断;空气中常见酸碱盐的质量或性质变化及贮存法;从组成上识别氧化物;有关元素化合价的计算;质量守恒定律及其应用.
考点点评: 本题考查的知识点较多,学生应能利用化学式判断物质的类别、保存及物质中元素的化合价,能根据化学方程式和质量守恒定律来推断物质的化学式.1年前查看全部
- (2006•太原)高铁酸钾(K2FeO4)是一种高效多功能水处理剂,它与水反应不可能生成( )
(2006•太原)高铁酸钾(K2FeO4)是一种高效多功能水处理剂,它与水反应不可能生成( )
A.氧气
B.碳酸钾
C.氢氧化钾
D.氢氧化铁 咖菲-猫1年前1
咖菲-猫1年前1 -
 zetaplusc1 共回答了23个问题
zetaplusc1 共回答了23个问题 |采纳率87%解题思路:由题意:高铁酸钾(K2FeO4)与水反应,反应物中的元素种类为:钾元素、铁元素、氧元素、氢元素;根据质量守恒定律的“元素守恒”可知,生成物中也应为这四种元素,不能多也不能少.故可知答案.氧气含有氧元素,可能生成;碳酸钾含有碳元素,反应物中无碳元素,根据质量守恒定律的“元素守恒”不可能生成;氢氧化钾含有的元素,反应物中含有,可能生成;氢氧化铁含有的元素,反应物中含有,可能生成.
故选B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题是运用化学中的基本思想质量守恒思想,通过有关化学方程式有效地寻找出解题方法,从而培养了学生的创新思维能力.1年前查看全部
- 高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.
(1)FeO42-与水反应的方程式为:4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2,K2FeO4在处理水的过程中所起的作用是______和______.
(2)将适量K2FeO4配制成c(FeO42-)=1.0×10-3mol•L-1(1.0mmol•L-1)的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ.题(1)中的反应为FeO42-变化的主反应,该反应的△H______0.
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是______(填字母).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4-⇌H++FeO42-的电离平衡常数表达式为K=c(H+).c(FeO42−) c(HFeO4−) ,其数值接近______(填字母).c(H+).c(FeO42−) c(HFeO4−)
A.10-2.5;B.10-6;C.10-7;D.10-10
(5)25℃时,CaFeO4的Ksp=4.536×10-9,若要使100mL,1.0×10-3mol•L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量为______mol,[完全沉淀后溶液中残留的c(FeO42- )为______.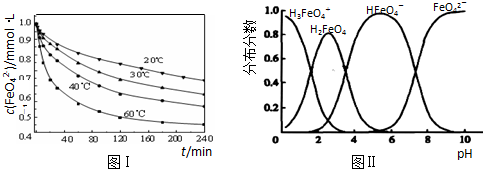
 一个和两个1年前1
一个和两个1年前1 -
 shirex 共回答了17个问题
shirex 共回答了17个问题 |采纳率88.2%解题思路:(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
(2)温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小;温度越高FeO42-浓度越小,正向反应是吸热反应;
(3)根据图象的内容来分析图象所描述的意义;
(4)平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
(5)根据溶度积常数计算.(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
故答案为:杀菌消毒、吸附悬浮物;
(2)由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应;
故答案为:>;
(3)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B.根据图片知,改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小,故正确;
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故错误;
D.根据图片知pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当,故正确;
故选BD;
(4)HFeO4-⇌H++FeO42-的电离平衡常数表达式为K=
c(H+).c(FeO42−)
c(HFeO4−),根据图象知,等HFeO4-和FeO42-
浓度相等时,溶液中氢离子浓度接近中性,所以K接近10-7,
故答案为:
c(H+).c(FeO42−)
c(HFeO4−),C;
(5)25℃时,CaFeO4的Ksp=4.536×10-9,若要使100mL1.0×10-3mol•L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量=
KSP
c(FeO42−)×0.1L=
4.536×10−9
1.0×10−5mol/L×0.1L=4.536×10-5,[完全沉淀后溶液中残留的c(FeO42- )为 1×10-5mol/L,
故答案为:4.536×10-5,1×10-5mol/L.点评:
本题考点: 体积百分含量随温度、压强变化曲线;化学平衡常数的含义;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了溶度积常数、电离平衡等知识点,难度中等,难点是溶度积常数的有关计算,当溶液中离子浓度为1×10-5mol/L时认为离子完全沉淀,为易错点.1年前查看全部
- K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于净化自来水并杀菌消毒
 shanshan1laichi1年前1
shanshan1laichi1年前1 -
 gasg548e 共回答了19个问题
gasg548e 共回答了19个问题 |采纳率100%4K2FeO4 + 10H2O = 8KOH + 4Fe(OH)3 + 3O2↑1年前查看全部
- 高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过了高锰酸钾,是一种集氧化、吸附、凝集、杀菌、灭藻于一
高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过了高锰酸钾,是一种集氧化、吸附、凝集、杀菌、灭藻于一体的新型高效的多功能水处理剂.干燥的高铁酸钾在198℃以下是稳定的,受热易分解为氧化铁、金属氧化物和氧气.根据上述信息,请回答下列问题:
(1)高铁酸钾的物理性质有______,化学性质有①______,②______.
(2)高铁酸钾的用途______.
(3)保存高铁酸钾时应注意的事项是______. ll的温暖1年前1
ll的温暖1年前1 -
 逸之狐 共回答了18个问题
逸之狐 共回答了18个问题 |采纳率100%解题思路:(1)根据物理性质包括:颜色、状态、气味、味道、熔点、沸点、硬度、密度、导电性、导热性、延展性、溶解性、挥发性等,从题中筛选信息即可;化学性质是通过化学变化表现出来的性质.
(2)根据题中信息分析其用途;
(3)高铁酸钾受热时容易分解,保存时要注意防潮避热;(1)高铁酸钾是一种具有紫色光泽的微细结晶粉末属于高铁酸钾的物理性质,故填:紫色、结晶粉末;由它的氧化性超过了高锰酸钾,可知高铁酸钾的化学性质有:具有氧化性;高铁酸钾受热易分解为氧化铁、金属氧化物和氧气,所以高铁酸钾的化学性质有受热易分解.
(2)根据题中信息“它的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水质净化剂”可知,它可用于自来水消毒和凝聚剂,故填:自来水消毒和凝聚剂;
(3)因为高铁酸钾受热易分解为氧化铁、某金属氧化物与氧气,所以保存高铁酸钾时应注意避免高温,故填:避免高温.
故答案为:(1)紫色、结晶粉末;具有氧化性;受热易分解;(2)自来水消毒和凝聚剂;(3)避免高温.点评:
本题考点: 化学性质与物理性质的差别及应用.
考点点评: 解答本题能够正确的区分物质的物理性质和化学性质,及分析题中信息进行解题的能力,只有这样才能对问题做出正确的判断.1年前查看全部
- FeCl3与KClO在强碱性条件下反应可制取高铁酸钾(K2FeO4)离子方程式 怎样判别是否加氢氧根
 顿顿香1年前2
顿顿香1年前2 -
 sunshinecn 共回答了16个问题
sunshinecn 共回答了16个问题 |采纳率75%2Fe3+ +3CLO-+10OH-=2FeO42-+3CL-+5H2O
先根据等号两边元素化合价升降平衡配好FeCl3与KClO K2FeO4 前面的的系数,根据守恒可以知道产物中还有氯离子.
要知道,等号两边不仅仅是得失电子守恒,还有电荷守恒.
加入氢氧根之前,等号左边的电荷为+2X3-3=3 右边为-2X2-3=-7
要两边相等,所以等号左边要加入10个带负电的氢氧根,所以左右两边都为-7,电荷守恒1年前查看全部
- 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
(1)已知:4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用有______.同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=______的溶液.
(2)高铁酸钾有以下几种常见制备方法:
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为______.干法 Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 湿法 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 电解法 制备中间产物Na2FeO4,再与KOH溶液反应
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:______.
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为______.
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH放电时负极材料为______,正极反应为:______.放电 充电
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000L,含有2.0×l0-4 mol•L-lK2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为______mol. ghm8007181年前1
ghm8007181年前1 -
 jun6249397 共回答了17个问题
jun6249397 共回答了17个问题 |采纳率82.4%解题思路:(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;依高铁酸根离子水解平衡移动的影响因素解答;
(2)①Fe2O3、KNO3、KOH混合加热发生氧化还原反应,Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,N元素化合价由+5价降低到+3价,依据氧化还原反应得失电子守恒规律计算;
②由信息可知,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,根据元素守恒还应生成H2O,反应中FeO42-→FeO43-,铁元素化合价由+6价降低为+5价,总共降低1价,Fe3+→FeO43-,铁元素化合价由+3价升高为+5价,总共升高2价,化合价升降最小公倍数为2,所以FeO42-系数为2,Fe3+系数为1,根据铁元素守恒确定FeO43-系数,根据电荷守恒确定OH-系数,根据氢元素守恒确定H2O系数,检查氧元素守恒,据此写出氧化还原反应方程式;
③电解时阳极Fe失电子发生氧化反应,被氧化生成高铁酸根离子;
(3)放电时,为原电池,依据3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,锌化合价升高,发生氧化反应,做负极,高铁酸根离子在正极得到电子,发生还原反应生成氢氧化铁;放电 充电
(4)依据溶度积规则,当Qc=Ksp达到沉淀溶解平衡,要产生沉淀则Qc>Ksp,据此解答.(1)K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质;4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2↑,增大溶液中的氢氧根离子浓度,能够使平衡逆向移动,抑制高铁酸根离子的水解,所以同浓度的高铁酸钾在pH为11.50的水溶液中最稳定;
故答案为:杀菌消毒、吸附悬浮物;11.50;
(2)①Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,Fe2O3做还原剂;N元素化合价由+5价降低到+3价,
KNO3做氧化剂,设氧化剂物质的量为xmol,还原剂物质的量为ymol,要使氧化剂得到电子总数等于还原剂失去电子总数,x×(5-3)=y×2×(6-3),解得x:y=3:1;
故答案为:3:1;
②由信息可知,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,根据元素守恒还应生成H2O,反应中FeO42-→FeO43-,铁元素化合价由+6价降低为+5价,总共降低1价,Fe3+→FeO43-,铁元素化合价由+3价升高为+5价,总共升高2价,化合价升降最小公倍数为2,所以FeO42-系数为2,Fe3+系数为1,根据铁元素守恒确定FeO43-系数为3,根据电荷守恒确定OH-系数8,根据氢元素守恒确定H2O系数为4,反应离子方程式为2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
故答案为:2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
③电解时阳极Fe失电子发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;
故答案为:Fe+8OH--6e-═FeO42-+4H2O;
(3)放电时,为原电池,依据3Zn+2K2FeO4+8H2O
放电
充电3Zn(OH)2+2Fe(OH)3+4KOH,锌化合价升高,发生氧化反应,做负极,高铁酸根离子在正极得到电子,发生还原反应生成氢氧化铁,电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3+5OH-;
故答案为:Zn;FeO42-+4H2O+3e-═Fe(OH)3+5OH-;
(4)设加入Ca(OH)2的物质的量为xmol,则溶液中钙离子浓度为x×10-3mol/L,含有2.0×l0-4 mol•L-lK2FeO4的废水中的c(FeO42-)=2.0×l0-4 mol•L-l,
Qc=x×10-3mol/L×2.0×l0-4 mol•L-l=Ksp=4.54×l0-9;
解得:x=2.27×10-2;
故答案为:2.27×10-2.点评:
本题考点: 铁盐和亚铁盐的相互转变;氧化还原反应;化学电源新型电池;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题为综合题,考查了氧化还原反应方程式的书写及配平、电极反应式的书写、溶度积规则的应用,题目难度较大,明确物质的性质及题给信息、熟悉化合物中各元素化合价、沉淀溶解平衡规律是解本题关键,氧化还原方程式的书写是难点.1年前查看全部
- K2FeO4是生活中的新型净水剂,可用NaCLO、Fe(OH)3和KOH制取,其反应的化学方程式为
 linyuaner1年前1
linyuaner1年前1 -
 阿慧617 共回答了12个问题
阿慧617 共回答了12个问题 |采纳率66.7%反应式如下:2Fe(OH)3 + 3NaClO + 4KOH → 2K2FeO4 + 3NaCI + 5H2O,即得到高铁酸钾,氯化钠和水.1年前查看全部
- (2009•香坊区一模)高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、杀菌
(2009•香坊区一模)高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、杀菌、灭藻的新型、高效的多功能水处理剂.干燥的高铁酸钾在198℃以下是稳定的,受热易分解为氧化铁、金属氧化物和氧气.根据上述信息,请回答下列问题:
(1)高铁酸钾的物理性质是有紫色光泽的晶体有紫色光泽的晶体.
(2)保存高铁酸钾时应注意避免潮湿和受热避免潮湿和受热.
(3)写出高铁酸钾受热分解的化学方程式4K2FeO4
2Fe2O3+4K2O+3O2↑4K2FeO4△ .
2Fe2O3+4K2O+3O2↑.△ .  ylin1181年前1
ylin1181年前1 -
 夕城美朱 共回答了10个问题
夕城美朱 共回答了10个问题 |采纳率100%(1)高铁酸钾的物理性质有:有紫色光泽的晶体.故填:有紫色光泽的晶体.
(2)保存高铁酸钾时应注意避免潮湿和受热.故填:避免潮湿和受热.
(3)高铁酸钾受热分解的化学方程式为:4K2FeO4
△
.
2Fe2O3+4K2O+3O2↑.1年前查看全部
- (2010•平谷区一模)高铁酸钾(K2FeO4)是一种新型高效水处理剂.下列关于该物质的叙述,正确的是( )
(2010•平谷区一模)高铁酸钾(K2FeO4)是一种新型高效水处理剂.下列关于该物质的叙述,正确的是( )
A.它是一种氧化物
B.组成中含有两种非金属元素
C.它是一种混合物
D.K2FeO4中铁元素的化合价为+6 embraceor1年前1
embraceor1年前1 -
 昨天的风0609 共回答了15个问题
昨天的风0609 共回答了15个问题 |采纳率80%解题思路:A、根据氧化物的组成特点,由高铁酸钾的化学式K2FeO4,判断该物质是否属于氧化物;
B、由高铁酸钾的化学式K2FeO4,判断组成元素中属于非金属元素的种类;
C、根据高铁酸钾的化学式K2FeO4,由物质组成的组成,判断物质分类;
D、利用化合物中各元素化合价代数和为0,由K、O元素的化合价,可计算其中铁元素的化合价.A、氧化物是由两种元素组成且含有氧元素的化合物,根据高铁酸钾的化学式K2FeO4,高铁酸钾由K、Fe、O三种元素组成,该物质不属于氧化物;故A不正确;
B、根据高铁酸钾的化学式K2FeO4,高铁酸钾由K、Fe、O三种元素组成,其中只有O元素一种非金属元素;故B不正确;
C、根据高铁酸钾的化学式K2FeO4,高铁酸钾由K、Fe、O三种元素组成的化合物,而非混合物;故C不正确;
D、设化合物K2FeO4中铁元素的化合价为x,依据化合物中各元素化合价代数和为0,有(+1×2)+x+(-2×4)=0,解得x=+6;故D正确;
故选D.点评:
本题考点: 有关元素化合价的计算;从组成上识别氧化物;纯净物和混合物的判别;元素的简单分类.
考点点评: 根据化合物中各元素化合价代数和为0,利用化合物的化学式可计算其中未知的元素化合价.1年前查看全部
- (2011•上海)高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是( )
(2011•上海)高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是( )
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 我只是ff啊1年前1
我只是ff啊1年前1 -
 wzlshui 共回答了16个问题
wzlshui 共回答了16个问题 |采纳率100%解题思路:根据高铁酸钾的化学式 K2FeO4,从物质所含元素的化合价来分析氧化性还原性问题,利用离子的水解产物的性质来分析净水原因.高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质,
故选:A.点评:
本题考点: 重要的氧化剂;常见的生活环境的污染及治理.
考点点评: 本题考查净水剂的净水原理,明确强氧化性及离子水解是解答的关键,并明确具有强氧化性的物质,能使蛋白质变性,从而起到杀菌消毒的作用来解答.1年前查看全部
- 高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂.
高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂.

(1)高铁酸钾具有强氧化性的原因是______.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为______,______.
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法.
①干式氧化的初始反应是2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2mol Na2FeO4时转移电子______mol.
②湿式氧化法的流程如图:
上述流程中制备Na2FeO4的化学方程式是______.
(4)高铁电池是正在研制中的可充电电池,图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有______、______.
(5)探究高铁酸钾的某种性质.
【实验1】将适量K2FeO4固体分别溶解于pH为 4.74、7.00、11.50的水溶液中,配得FeO42-浓度为1.0mmol•L-1(1mmol•L-1=10-3mol•L-1)的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,结果见图2(注:800min后,三种溶液中高铁酸钾的浓度不再改变).
【实验2】将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42-浓度为0mmol•L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2.则
①实验1的目的是______;
②实验2可得出的结论是______;
③高铁酸钾在水中的反应为4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2↑.由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是______. 8227love1年前1
8227love1年前1 -
 majcos 共回答了19个问题
majcos 共回答了19个问题 |采纳率84.2%解题思路:(1)高铁酸钾中的铁是正6价,处于高价态,具有强氧性;
(2)高铁酸钾是具有强氧性,还原产物铁离子水解生成氢氧化铁胶体,吸附杂质的作用;
(3)①2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是正2价变为正6价,所以每生成2mol Na2FeO4时转移电子10mol;
②Fe(NO3)3被NaClO氧化成Na2FeO4;
(4)高铁电池由图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定等优点;
(5)①在其它条件相同的情况下研究在FeO42-不同PH溶液中的稳定性;
②研究温度改变,FeO42-的稳定性;
③用平衡移动的原理解释.(1)高铁酸钾中的铁是正6价,处于高价态,具有强氧性,故答案为:其中的铁元素为+6价,易得电子;
(2)高铁酸钾是具有强氧性,还原产物铁离子水解生成氢氧化铁胶体,吸附杂质的作用,故答案为:高铁酸钾有强氧化性,能杀菌消毒;产生的Fe(OH)3有吸附性,有絮凝作用;
(3)①2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是正2价变为正6价,所以每生成2mol Na2FeO4时转移电子10mol,故答案为:10;
②Fe(NO3)3被NaClO氧化成Na2FeO4,故答案为:2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;
(4)高铁电池由图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定等优点,
故答案为:放电时间长;工作电压稳定;
(5)①在其它条件相同的情况下研究在FeO42-不同PH溶液中的稳定性,故答案为:研究在FeO42-不同PH溶液中的稳定性(或反应的速率);
②研究温度改变,FeO42-的稳定性,故答案为:温度越高,FeO42-越不稳定(或与水反应的速率越快);
③用平衡移动的原理解释,pH=11.50的溶液中OH-离子浓度大,使平衡向左移动,故答案为:pH=11.50的溶液中OH-离子浓度大,使平衡向左移动.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学电源新型电池.
考点点评: 本题考查元素化合物知识结合化学反应的速率以及平衡的移动等知识的综合考查,难度大,学生不容易接受.1年前查看全部
- 高铁酸钾(K2FeO4)是一种集氧化、吸附、杀菌、灭藻、去浊、脱色、除臭为一体的新型高效水处理剂.下列关于该物质的叙述正
高铁酸钾(K2FeO4)是一种集氧化、吸附、杀菌、灭藻、去浊、脱色、除臭为一体的新型高效水处理剂.下列关于该物质的叙述正确的是( )
A. 它是一种氧化物
B. K2FeO4中铁元素的化合价为+6价
C. 它是一种混合物
D. 该物质含有两种非金属元素 WSL5301年前4
WSL5301年前4 -
 叮铃鱼 共回答了20个问题
叮铃鱼 共回答了20个问题 |采纳率95%解题思路:可以根据高铁酸钾的化学式进行相关的判断,氧化物是指含有两种元素且其中一种是氧元素的化合物,根据化合价规则即可求得高铁酸钾中铁元素的化合价.A、高铁酸钾含有钾、铁、氧三种元素,不是氧化物,故A错误;
B、根据化合物中各元素正负化合价的代数和为零,设铁元素的化合价为x,则有(+1)×2+x+(-2)×4=0,解得x=+6,故B正确;
C、高铁酸钾是纯净物不是混合物,故C错误;
D、高铁酸钾含有氧这一种非金属元素,故D错误;
故选B.点评:
本题考点: 物质的简单分类;从组成上识别氧化物;纯净物和混合物的判别;物质的元素组成;有关元素化合价的计算.
考点点评: 本题主要考查了氧化物的概念以及化合价规则,完成此题,可以依据已有的知识进行.1年前查看全部
- 近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的
近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂.高铁酸钾在水处理过程中涉及到的化学过程正确的有:①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应( )
A. ①②③④
B. ①③④⑥
C. ②③④⑤
D. ②③⑤⑥ 湖底草生长1年前1
湖底草生长1年前1 -
 liushupei2008 共回答了25个问题
liushupei2008 共回答了25个问题 |采纳率92%解题思路:高铁酸钾具有强氧化性,可致蛋白质发生氧化而变性,高铁酸钾被还原生成Fe3+,水解生成具有吸附性的Fe(OH)3胶体而达到净水作用.高铁酸钾具有强氧化性,可致蛋白质发生氧化而变性,则不涉及蛋白质的盐析,故②错误;
高铁酸钾被还原生成Fe3+,水解生成具有吸附性的Fe(OH)3胶体而达到净水作用,涉及胶体聚沉、盐类水解,不涉及颜色反应,则⑤错误,
所以涉及的有①③④⑥,
故选B.点评:
本题考点: "三废"处理与环境保护;胶体的重要性质;氨基酸、蛋白质的结构和性质特点.
考点点评: 本题考查高铁酸钾的性质以及反应原理,题目难度不大,解答该题的关键是把握相关物质的性质及应用,学习中注意积累.1年前查看全部
- (2009•香坊区一模)高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、杀菌
(2009•香坊区一模)高铁酸钾(K2FeO4)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、杀菌、灭藻的新型、高效的多功能水处理剂.干燥的高铁酸钾在198℃以下是稳定的,受热易分解为氧化铁、金属氧化物和氧气.根据上述信息,请回答下列问题:
(1)高铁酸钾的物理性质是______.
(2)保存高铁酸钾时应注意______.
(3)写出高铁酸钾受热分解的化学方程式4K2FeO4
2Fe2O3+4K2O+3O2↑△ .4K2FeO4.
2Fe2O3+4K2O+3O2↑△ . 孔最1年前1
孔最1年前1 -
 lxxx586780 共回答了16个问题
lxxx586780 共回答了16个问题 |采纳率81.3%解题思路:高铁酸钾的颜色、光泽、状态等性质不需要通过化学变化表现出来,属于物理性质;
干燥的高铁酸钾在较低温度下是稳定的;
根据反应物和生成物及其质量守恒定律可以书写化学方程式.(1)高铁酸钾的物理性质有:有紫色光泽的晶体.故填:有紫色光泽的晶体.
(2)保存高铁酸钾时应注意避免潮湿和受热.故填:避免潮湿和受热.
(3)高铁酸钾受热分解的化学方程式为:4K2FeO4
△
.
2Fe2O3+4K2O+3O2↑.点评:
本题考点: 化学性质与物理性质的差别及应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题要能够区分物理性质和化学性质的区别,同时书写化学方程式时要注意遵循质量守恒定律.1年前查看全部
- 铁是重要的金属元素,用途极广.(1)高铁酸钾(K2FeO4)具有很强的氧化性,常用作净水剂,对环境无不良影响,被人们称为
铁是重要的金属元素,用途极广.
(1)高铁酸钾(K2FeO4)具有很强的氧化性,常用作净水剂,对环境无不良影响,被人们称为“绿色化学”试剂.工业上,可用铁作阳极,电解KOH溶液制备K2FeO4,其阳极的电极反应式为______.
(2)某高效净水剂可由Fe(OH)SO4聚合得到.工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为______.
(3)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol
高炉炼铁过程中发生的主要反应为:
[1/3]Fe2O3(s)+CO(g)⇌[2/3] Fe(s)+CO2(g)△H=a kJ/mol,则a=kJ/mol.
已知该反应在不同温度下的平衡常数如下表:
在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时v正______v逆(填“等于”、“大于”或“小于”).经过l0min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v(CO2)=______.欲提高上述反应中CO的平衡转化率,可采取的措施是______;温度/℃ 1000 1115 1300 平衡常数 4.0 3.7 3.5
A.提高反应温度B.移出部分CO2C.加入合适的催化剂D.减小容器的容积
(4)一定温度下的难溶电解质在水溶液中达到溶解平衡时.已知下表数据,对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是______.
A.向该溶液中加少量铁粉不能观察到红色固体析出物质 Fe(OH)2 Cu(OH)2 Fe(OH)3 Ksp/25℃ 8.0×10-16 2.2×10-20 4.0×10-38 完全沉淀时的PH值 ≥9.6 ≥6.4 3~4
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,可得到纯净的CuSO4溶液
D.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀. zhqi86861年前1
zhqi86861年前1 -
 月夜的忘忧 共回答了21个问题
月夜的忘忧 共回答了21个问题 |采纳率85.7%解题思路:(1)铁失去电子,在碱性溶液中生成高铁酸根离子,同时有水生成;
(2)此反应为氧化还原反应,反应物中既有氧化剂又有还原剂,依据化合价升降相等配平即可;
(3)依据热化学方程式计算,反应焓变;依据计算得到浓度商和该温度下平衡常数比较判断反应进行方向,依据平衡常数计算生成二氧化碳,结合反应速率概念计算二氧化碳的化学反应速率;欲提高上述反应中CO的平衡转化率,需要反应正向进行;
(4)A.因为Fe3+的氧化性强于Cu2+,所以投入少量铁粉,先发生的反应是:2Fe3++Fe=3Fe2+;
B.Cu2+、Fe2+、Fe3+发生水解,因此它们的物质的量会减少;
C.溶液中混有CuCl2;
D.根据Ksp的大小判断溶解性.(1)铁失去电子,在碱性溶液中生成高铁酸根离子,同时有水生成,阳极的电极反应式为Fe-6e-+8OH-═FeO42-+4H2O,故答案为:Fe-6e-+8OH-═FeO42-+4H2O;
(2)FeSO4→Fe(OH)SO4 ,Fe由+2变为+3,故FeSO4为还原剂,NaNO2→NO,N由+3变为+2,故NaNO2为氧化剂,稀硫酸既不做氧化剂也不做还原剂.FeSO4→Fe(OH)SO4 和NaNO2→NO化合价升降相等,故FeSO4和NaNO2化学计量数相等,依据原子守恒配平可得:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
故答案为:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑;
(3)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol
依据盖斯定律①×[1/3]-②得到高炉炼铁过程中发生的主要反应为:[1/3]Fe2O3(s)+CO(g)⇌[2/3] Fe(s)+CO2(g)△H=-9.5 kJ/mol,则a=-9.5kJ/mol
在一个容积为:10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,Q=
1mol
10L
1mol
10L=1<K=4,说明费用正向进行,v正>v逆;
设反应一氧化碳物质的量为x
[1/3]Fe2O3(s)+CO(g)⇌[2/3] Fe(s)+CO2(g)
起始量 (mol) 1 1
变化量(mol) x x
平衡量(mol)1-x 1+x
[1+x/1−x]=4
x=0.6
经过l0min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v(CO2)=
0.6mol
10L
10min=0.006mol/L•min;
欲提高上述反应中CO的平衡转化率,应使平衡正向进行;
A.反应是放热反应,提高反应温度,平衡逆向进行,一氧化碳转化率减小,故A不符合;
B.移出部分CO2平衡正向进行,一氧化碳转化率增大,故B符合;
C.加入合适的催化剂,改变反应速率不改变化学平衡,一氧化碳转化率不变,故C不符合;
D.反应前后气体体积不变,减小容器的容积增大压强,平衡不变,一氧化碳转化率不变,故D不符合;
故选B.
(4)A.因为Fe3+的氧化性强于Cu2+,所以投入少量铁粉,先发生的反应是:2Fe3++Fe=3Fe2+,不能观察到红色固体析出,故A正确;
B.因为Cu2+、Fe2+、Fe3+对应的碱全是弱碱,所以这三种离子在溶液中都会发生水解,因此它们的物质的量会减少,故B正确;
C.加入氯水,可以把亚铁离子全氧化成三价,但它的还原产物Cl-肯定还在溶液中,而且在调节pH时加入的试剂也会在溶液中有所保留,所以得到的溶液中不可能只含CuSO4一种溶质,故C错误;
D.从表格中可以看出,Fe(OH)3的Ksp是最小的,所以它最先出现沉淀,故D正确;
故选C.点评:
本题考点: 电解原理;化学平衡常数的含义;化学平衡的影响因素;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了电解原理,化学平衡影响因素,平衡常数、反应速率概念分析应用,热化学方程式和盖斯定律计算,沉淀溶解平衡的理解应用,掌握基础是关键,题目难度中等.1年前查看全部
- K2FeO4 能净水的原因
 专品女人61年前5
专品女人61年前5 -
 hanxiucao123 共回答了20个问题
hanxiucao123 共回答了20个问题 |采纳率95%高铁酸钾中铁为正六价,具有强氧化性,可以杀菌消毒,而且还可以氧化水中的有机废物.它的还原产物是铁离子,铁离子易水解,水解得到的氢氧化铁类似于氢氧化铝,具有很大的表面积,能够吸附杂质.
希望对你有所帮助!1年前查看全部
- 按要求完成下列方程式.(1)Fe(OH)3与KClO在强碱性条件下制取K2FeO4的离子方程式______.(2)与Mn
按要求完成下列方程式.
(1)Fe(OH)3与KClO在强碱性条件下制取K2FeO4的离子方程式______.
(2)与MnO2•Zn电池类似,K2FeO4•Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为______.
(3)用氯仿(CHCl3)与双氧水反应制光气(COCl2)的化学方程式______.
(4)用惰性电极电解AlCl3溶液的离子方程式______.
(5)向NH4Fe(SO4)2溶液中滴加Ba(OH)2溶液至铁离子恰好沉淀的离子方程式______. qsmx1年前1
qsmx1年前1 -
 zfz7852 共回答了15个问题
zfz7852 共回答了15个问题 |采纳率93.3%解题思路:(1)Fe(OH)3与KClO在强碱性条件下发生氧化还原反应生成K2FeO4、氯化钾和水,根据化合价升降相等配平并写出反应的离子方程式;(2)K2FeO4•Zn成碱性电池中,Zn为负极,则为K2FeO4正极,+6价的铁得到电子生成氢氧化铁,据此写出电极反应式;(3)CHCl3中碳为+2价,COCl2中碳为+4价,故H2O2中氧元素化合价由-1价降低为-2价,生成H2O,由电子转移守恒与原子守恒可知可知,CHCl3、H2O2、COCl2、H2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成;(4)惰性电极电解氯化铝溶液,阳极氯离子放电生成氯气、阴极水电离的氢离子得到电子生成氢气,同时生成的氢氧根离子与铝离子反应生成氢氧化铝沉淀;(5)当铁离子恰好生成氢氧化铁沉淀时,NH4Fe(SO4)2与氢氧化钡的物质的量之比为2:3,铵根离子没有参与反应.(1)次氯酸根离子具有强氧化性,能够将氢氧化铁氧化成FeO42-,FeO42-中铁元素的化合价为+6价,氢氧化铁中铁的化合价为+3价,铁化合价升高了3价,次氯酸根离子中Cl盐酸的化合价为+1价,被还原变成-1价的氯离子,化合价降低了2价,化合价变化的最小公倍数为6,则氢氧化铁的计量数为2、次氯酸根离子的计量数为3,然后根据观察法配平,该反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-;
(2)K2FeO4•Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,负极为锌失电子发生氧化反应,电极反应Zn-2e-+2OH-=Zn(OH)2;依据产物和电子守恒写出正极反应:FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-,
故答案为:FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-;
(3)CHCl3中碳为+2价,COCl2中碳为+4价,故H2O2中氧元素化合价由-1价降低为-2价,生成H2O,由电子转移守恒与原子守恒可知可知,CHCl3、H2O2、COCl2、H2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成,故反应方程式为CHCl3+H2O2=HCl+H2O+COCl2,
故答案为:CHCl3+H2O2=HCl+H2O+COCl2;
(4)惰性电极电解氯化铝溶液时,阳极放电的为氯离子,氯离子失去电子生成氯气,阴极氢离子得到电子生成氢气,生成的氢氧根离子与氯离子反应生成氢氧化铝沉淀,反应达到离子方程式为:2Al3++6Cl-+6H2O=3H2↑+2Al(OH)3↓+3Cl2↑,
故答案为:2Al3++6Cl-+6H2O=3H2↑+2Al(OH)3↓+3Cl2↑;
(5)向NH4Fe(SO4)2溶液中滴加Ba(OH)2溶液至铁离子恰好沉淀,此时铵根离子没有参与反应,NH4Fe(SO4)2与Ba(OH)2的物质的量之比为2:3,反应生成硫酸钡沉淀和氢氧化铁沉淀,反应的离子方程式为:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓,
故答案为:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓.点评:
本题考点: 离子方程式的书写;电极反应和电池反应方程式.
考点点评: 本题考查了离子方程式、化学方程式的书写,电极反应式的书写,题目难度中等,试题题量稍大,知识点较多,考查较为综合,注意掌握离子方程式、化学方程式的书写原则,明确电解原理及其应用方法,试题培养了学生的分析、理解能力及灵活应用所学知识都能力.1年前查看全部
- K2FeO4_Zn原电池,碱性环境,K2FeO4为正极,为什么是生成三价铁,而不会继续放电成二价的高中原电池题
K2FeO4_Zn原电池,碱性环境,K2FeO4为正极,为什么是生成三价铁,而不会继续放电成二价的高中原电池题
K2FeO4_Zn原电池,碱性环境,K2FeO4为正极,为什么是生成三价铁,而不会继续放电成二价的 缠绵过后温情脉脉1年前1
缠绵过后温情脉脉1年前1 -
 明白一点什么 共回答了16个问题
明白一点什么 共回答了16个问题 |采纳率93.8%三价铁需要被还原成二价铁,如与铜单质、铁粉等反应.本题中没有还原剂啊.1年前查看全部
- 铁酸钾(K2FeO4)做水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式为
 拉拉拉拉1年前2
拉拉拉拉1年前2 -
 什么时候了都 共回答了16个问题
什么时候了都 共回答了16个问题 |采纳率68.8%高铁酸钾(K2FeO4)是一种集氧化.吸附.杀菌.灭藻.去浊.脱色.除臭为一体选B A:它是一种氧化物 错,它由三种元素组成,不可能是氧化物.B:K21年前查看全部
- 高铁酸钾{K2FeO4}受热分解为氧化铁,金属氧化物,氧气.
 KierKafka1年前1
KierKafka1年前1 -
 abc近距离 共回答了15个问题
abc近距离 共回答了15个问题 |采纳率93.3%4K2FeO4 === 2Fe2O3 + 4K2O + 3O2
等号上面写 加热1年前查看全部
- 用K2FeO4代替氯气处理饮用水,有杀菌消毒作用且不会形成致癌物但无净水作用,这一说法对吗?
 zhxh9191年前2
zhxh9191年前2 -
 益母草1 共回答了16个问题
益母草1 共回答了16个问题 |采纳率100%不对吧.那个物质是强氧化剂,被还原后生成的Fe3+可以水解出Fe(OH)3胶体吸附水中杂质沉降从而起到净水作用1年前查看全部
- 高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是( )
高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是( )
A. 有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B. 有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C. 有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D. 有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 回忆烟草的味道1年前1
回忆烟草的味道1年前1 -
 人间不系舟 共回答了18个问题
人间不系舟 共回答了18个问题 |采纳率94.4%解题思路:根据高铁酸钾的化学式 K2FeO4,从物质所含元素的化合价来分析氧化性还原性问题,利用离子的水解产物的性质来分析净水原因.高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质,
故选:A.点评:
本题考点: 重要的氧化剂;常见的生活环境的污染及治理.
考点点评: 本题考查净水剂的净水原理,明确强氧化性及离子水解是解答的关键,并明确具有强氧化性的物质,能使蛋白质变性,从而起到杀菌消毒的作用来解答.1年前查看全部
- 用次氯酸钠,氢氧化钾,氢氧化铁制取K2FeO4的方程式
 箭之寒气1年前1
箭之寒气1年前1 -
 如果你认识王庄 共回答了24个问题
如果你认识王庄 共回答了24个问题 |采纳率91.7%3NaClO+4KOH+2Fe(OH)3==3NaCl+2K2FeO4+5H2O1年前查看全部
- (2005•荆州)高铁酸钾是一种亲型、高效、多功能的“绿色”水处理剂,其化学式为K2FeO4,已知其中K元素为+1价,O
(2005•荆州)高铁酸钾是一种亲型、高效、多功能的“绿色”水处理剂,其化学式为K2FeO4,已知其中K元素为+1价,O元素为-2价,则Fe元素的化合价为( )
A.+2
B.+4
C.+5
D.+6 tom51681年前1
tom51681年前1 -
 q68040967 共回答了16个问题
q68040967 共回答了16个问题 |采纳率87.5%解题思路:已知K元素为+1价,O元素为-2价,根据在化合物中,各元素的化合价代数和为零即可求得Fe元素的化合价.在K2FeO4中K元素为+1价,O元素为-2价;
则设铁元素化合价为x,
则(+1)×2+x+(-2)×4=0;
解得:x=+6;
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.1年前查看全部
- 高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂.高铁酸钾是具有紫色光泽的粉末;干燥的高铁酸钾在198℃以下是稳
高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂.高铁酸钾是具有紫色光泽的粉末;干燥的高铁酸钾在198℃以下是稳定的,在受潮或受热时都易发生分解.根据上述信息,请回答下列问题.
(1)高铁酸钾的物理性质是有紫色光泽的粉末有紫色光泽的粉末.
(2)高铁酸钾在保存时应注意避免受潮,受热受潮,受热.
(3)高铁酸钾与水反应的化学方程式如下,请在方框内填入化学计量数,在横线上填写化学式.
4K2FeO4+10H2O═4Fe(OH)3↓+8KOH+3O23O2↑. yu6275272951年前1
yu6275272951年前1 -
 liaodl1975 共回答了20个问题
liaodl1975 共回答了20个问题 |采纳率90%(1)物质的颜色、光泽、状态等方面的性质不需要通过化学变化表现出来,属于物理性质.故填:有紫色光泽的粉末.
(2)高铁酸钾在受潮或受热时都易发生分解,所以高铁酸钾在保存时应注意避免受潮,受热.故填:受潮,受热.
(3)根据质量守恒定律可知,高铁酸钾和水反应生成氢氧化铁、氢氧化钾和氧气.故填:3O2.1年前查看全部
- 高铁酸钾(K2FeO4)是一种新型的自来水处理剂,有强氧化性,可消毒杀菌,其还原产物能吸附水中杂质
高铁酸钾(K2FeO4)是一种新型的自来水处理剂,有强氧化性,可消毒杀菌,其还原产物能吸附水中杂质
这句话那里错了 筱簃1年前2
筱簃1年前2 -
 心痛到无以复加 共回答了14个问题
心痛到无以复加 共回答了14个问题 |采纳率100%印象中,因为正6价的铁有强氧化性,因而可以用来杀菌消毒,不记得它能吸附水中杂质啊······另外,十二水硫酸铝钾(明矾)的水解产物氢氧化铝能吸附水中杂质,但不能杀菌消毒.1年前查看全部
- 高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂.高铁酸钾是具有紫色光泽的粉末;干燥的高铁酸钾在198℃以下是稳
高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂.高铁酸钾是具有紫色光泽的粉末;干燥的高铁酸钾在198℃以下是稳定的,在受潮或受热时都易发生分解.根据上述信息,请回答下列问题.
(1)高铁酸钾的物理性质是有紫色光泽的粉末有紫色光泽的粉末.
(2)高铁酸钾在保存时应注意避免受潮,受热受潮,受热.
(3)高铁酸钾与水反应的化学方程式如下,请在方框内填入化学计量数,在横线上填写化学式.
4K2FeO4+10H2O═4Fe(OH)3↓+8KOH+3O23O2↑. 宁静之声1年前1
宁静之声1年前1 -
 同在A组的 共回答了9个问题
同在A组的 共回答了9个问题 |采纳率88.9%解题思路:(1)物质的物理性质是指不需要通过化学变化表现出来的性质.
(2)高铁酸钾的热稳定性差,遇水容易发生化学反应.
(3)根据质量守恒定律可以确定物质的化学式.(1)物质的颜色、光泽、状态等方面的性质不需要通过化学变化表现出来,属于物理性质.故填:有紫色光泽的粉末.
(2)高铁酸钾在受潮或受热时都易发生分解,所以高铁酸钾在保存时应注意避免受潮,受热.故填:受潮,受热.
(3)根据质量守恒定律可知,高铁酸钾和水反应生成氢氧化铁、氢氧化钾和氧气.故填:3O2.点评:
本题考点: 化学性质与物理性质的差别及应用;空气中常见酸碱盐的质量或性质变化及贮存法;有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题主要考查高铁酸钾的性质和化学方程式的书写等方面的知识,物质之间发生化学变化时都遵循质量守恒定律.1年前查看全部
- 新型净水剂-高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2F
新型净水剂-高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O
②Na2FeO4+2KOH═K2FeO4+2NaOH.下列说法不正确的是( )
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中氧化产物与还原产物物质的量之比为2:9
C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒
D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol 天寒地动1年前1
天寒地动1年前1 -
 YoungD 共回答了18个问题
YoungD 共回答了18个问题 |采纳率100%解题思路:反应2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O中,Fe元素化合价升高,由+3价升高到+6价,被氧化,Cl元素化合价由+1价降低到-1价,被还原,NaClO为氧化剂,FeCl3为还原剂,Na2FeO4+2KOH═K2FeO4+2NaOH为复分解反应,元素化合价没有发生变化,以此解答.A.反应①Fe和Cl元素化合价发生变化,为氧化还原反应,反应②元素化合价没有发生变化,为复分解反应,故A正确;
B.反应2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O中,NaClO为氧化剂,FeCl3为还原剂,由方程式可知,氧化产物与还原产物物质的量之比为2:3,故B错误;
C.由化合价代数和为0的原则可知K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒,故C正确;
D.反应2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O中,Fe元素化合价升高,由+3价升高到+6价,则若有2mol FeCl3发生反应,转移电子的物质的量为6 mol,故D正确.
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意从元素化合价的角度认识氧化还原反应中物质所表现出的性质,明确元素的化合价为解答该类题目的关键,难度中等.1年前查看全部
- ()FeSO4+()K2O2=()K2FeO4 +()K2O+()K2SO4+()O2
 结_合1年前2
结_合1年前2 -
 獬豸guer 共回答了21个问题
獬豸guer 共回答了21个问题 |采纳率100%FeSO4+4K2O2K2FeO4+2K2O+K2SO4+O2 这里变价的东西不少……首先是铁+2到+6氧-1到0 -1到-2(因为硫酸根没有变,所以剩下的氧都是来源于过氧化钾)然后 发现FeO4的问题 氧从-1到-2 有4个 所以转移电子4个Fe从+2 到+6 转...1年前查看全部
- 高铁酸钾(K2FeO4)是一种集氧化、吸附、杀菌、灭藻、脱色、除臭等为一的新型高效水处理剂.下列关于该物质的说法正确的是
高铁酸钾(K2FeO4)是一种集氧化、吸附、杀菌、灭藻、脱色、除臭等为一的新型高效水处理剂.下列关于该物质的说法正确的是( )
A.高铁酸钾是由2个钾原子、一个铁原子和4个氧原子构成的
B.高铁酸钾是一种混合物
C.高铁酸钾中含有两种金属元素
D.高铁酸钾分子是由6个原子构成的 qq521425q1年前1
qq521425q1年前1 -
 一定是猪 共回答了16个问题
一定是猪 共回答了16个问题 |采纳率87.5%解题思路:A、根据物质的构成进行分析;
B、根据混合物的概念进行分析;
C、由高铁酸钾的化学式K2FeO4,判断组成元素的种类;
D、根据分子的构成分析.A、宏观物质不能说是由几个原子构成的,应说一个高铁酸钾分子是由2个钾原子、一个铁原子和4个氧原子构成的,故A不正确;
B、根据高铁酸钾是由一种物质组成的,是一种纯净物;故B不正确;
C、根据高铁酸钾的化学式K2FeO4,高铁酸钾由K、Fe、O三种元素组成的化合物,含有两种金属元素;故C正确;
D、一个高铁酸钾分子是由7个原子构成的;故D不正确.
故选:C.点评:
本题考点: 化学式的书写及意义;纯净物和混合物的判别;元素的简单分类.
考点点评: 本题主要考查了物质的分类和化学式的意义,完成此题,可以依据已有的知识进行.1年前查看全部
大家在问
- 1乳酸菌在无氧呼吸生成乳酸时消耗氢?反应式
- 2汤姆会拉小提琴,但拉得不好.(译为英语)
- 3数学,三角恒等变换,有过程待解释
- 4《次北固山下》这首诗体现了诗人怎样的思想感情?哪两句集中体现了这种感情?
- 5七位数前再加一个数字,不考虑其他因素,可以排出几个号码
- 6they concern.他们忧虑.有这个用法吗?
- 72007又2008分之2007除以2007用简便算法
- 8一道关于比例的应用题``甲,乙,丙三人在一条跑道上赛跑,当甲跑到终点时,乙离终点12米,丙离终点36米;当乙跑到终点时,
- 9乳酸菌在无氧呼吸中是催化剂吗想这个反应,C6H12O6 =( 乳酸菌) 2C3H6O3 是无氧呼吸吗?
- 10不能用勒夏特列原理解释的是在溴水中存在如下平衡:Br2+H2O⇌HBr+HBrO,当加入NaOH溶液后颜色变浅NaOH不
- 11介绍AliceName:Alice Date of birth :March 2nd Age:14 likes :bas
- 12甲乙分别从AB两地同时相向而行在距A90千米第一次相遇甲在距A地50千米处与乙第二次相遇两地相距多少千米
- 13下列各组溶液中的离子能大量共存于ph=12的条件下的是( )
- 14(1)苹果原价是每克p元,按8折优惠出售,用式子表示现场 (2)一个长方体包装盒的长和宽都是a厘米
- 15给人一缕阳光,会拥有一轮太阳含义是什么