1,电镀铬 等这些用英文怎么说?
 candy242022-10-04 11:39:541条回答
candy242022-10-04 11:39:541条回答1,电镀铬 2,镀仿金 3,喷白漆 4,镍拉丝 5,镀锆金 6,镀沙铬 这些用英文怎么说?...

已提交,审核后显示!提交回复
共1条回复
 samtong0228 共回答了21个问题
samtong0228 共回答了21个问题 |采纳率95.2%- 1.Chromium electroplating.
2.plating imitation gold.
3.sprayed white paint.
4.brushed nickel.
5.zirconium gold plating.
6.chrome plating sand. - 1年前
相关推荐
- 电镀铬阳极(铅锡阳极)带电入槽形成的钝化膜是什么,化学方程式是什么
电镀铬阳极(铅锡阳极)带电入槽形成的钝化膜是什么,化学方程式是什么
若不带电入槽,形成氧化膜的化学方程式是什么 yvonnediao1年前2
yvonnediao1年前2 -
 hj3356 共回答了23个问题
hj3356 共回答了23个问题 |采纳率100%带电入槽时阳极形成不影响导电的疏松的二氧化铅膜,而直接放进去可能形成影响导电的致密的铬酸铅.
Pb+2H2O-----PbO2+4H+
Pb+2H2O+CrO4(2-)-------PbCrO4+O2+4H+1年前查看全部
- 电镀铬与稀硫酸反应方程式如题,哪位知道电镀铬在稀硫酸中反应在电镀铬表面会生成什么产物,最好有化学反应方程式~~谢谢大家了
电镀铬与稀硫酸反应方程式
如题,哪位知道电镀铬在稀硫酸中反应在电镀铬表面会生成什么产物,最好有化学反应方程式~~谢谢大家了
产物颜色是什么样的呢?谢谢~~ 夏夜的桂花茶1年前1
夏夜的桂花茶1年前1 -
 鱼22子 共回答了13个问题
鱼22子 共回答了13个问题 |采纳率92.3%2Cr+3H2SO4=Cr2(SO4)3+3H2↑1年前查看全部
- 电镀广泛地应用于工业生产中.在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+ Fe3+
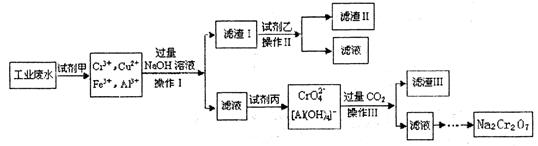
电镀广泛地应用于工业生产中.在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+ Fe3+和Al3+等,且酸性较强.为回收利用铬元素,此工业废水通常采用如下流程处理:

已知:(1)铬元素有以下循环过程:
(2)Cu(OH)2能溶于氨水:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答下列问题:
(1)加入试剂甲的目的:______
(2)试剂乙的名称:______,试剂丙的化学式:______
(3)上述操作Ⅰ、Ⅱ、Ⅲ相同,则进行该实验操作所需要的主要玻璃仪器有______
(4)滤渣I的主要成分为______(写化学式).
(5)在铬元素循环过程的反应①中每反应掉1mol H2O2同时消耗H+数目为:[8/3]×6.02×1023[8/3]×6.02×1023
(6)铬元素循环过程的反应⑥的离子方程式:______;废水处理流程中生成滤渣III的离子方程式:______. 一缕清风1001年前1
一缕清风1001年前1 -
 wendia 共回答了17个问题
wendia 共回答了17个问题 |采纳率88.2%解题思路:(1)根据废水的成分和加入试剂甲以后废水的成分来回答;
(2)试剂Ⅰ可以将氢氧化铜沉淀溶解掉;试剂丙可以将CrO2-氧化为CrO42-;
(3)过滤实验操作所需要的主要玻璃仪器有烧杯、漏斗、玻璃棒;
(4)根据氢氧化钠和各个离子之间的反应以及反应的产物来回答;
(5)根据重铬酸根和双氧水在酸性环境下的反应来回答;
(6)铬酸根在酸性条件下可以转化为重铬酸根,向四羟基合铝酸根中通入过量二氧化碳会生成氢氧化铝和碳酸氢钠.(1)在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+ Fe3+和Al3+等,加入试剂甲以后废水的成分含有Cr3+、Cu2+、Fe3+和Al3+,由此可见试剂甲将亚铁离子氧化为三价铁离子,故答案为:将Fe2+氧化成Fe3+;
(2)向含有Cr3+、Cu2+、Fe3+和Al3+的溶液中加入过量的氢氧化钠,生成的沉淀即滤渣Ⅰ有氢氧化铜和氢氧化铁,滤液是根据题意信息Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,所以试剂Ⅰ可以将氢氧化铜沉淀溶解掉,应为氨水,根据铬元素的循环过程,可知试剂丙可以将CrO2-氧化为CrO42-,实现三价铬到CrO42-的转化,所以试剂丙是氯气,
故答案为:氨水;Cl2;
(3)操作I、II、III均实现了固体和液体的分离,是过滤的过程,过滤实验操作所需要的主要玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
(4)向含有Cr3+、Cu2+、Fe3+和Al3+的溶液中加入过量的氢氧化钠,生成的沉淀即滤渣Ⅰ有氢氧化铜和氢氧化铁,
故答案为:Cu(OH)2、Fe(OH)3;
(5)重铬酸根和双氧水在酸性环境下的反应实质是:Cr2O72-+3H2O2+8H+=7H2O+3O2↑+2Cr3+,每反应掉1mol H2O2同时消耗
H+的物质的量为[8/3]mol,数目为:[8/3]×6.02×1023,故答案为:
[8/3]×6.02×1023;
(6)铬酸根在酸性条件下可以转化为重铬酸根,即2CrO42-+2H+=Cr2O72-+H2O,向四羟基合铝酸根中通入过量二氧化碳会生成氢氧化铝和碳酸氢钠,即2H2O+A1O2-+CO2=Al(OH)3↓+HCO3,
故答案为:2CrO42-+2H+=Cr2O72-+H2O;2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-.点评:
本题考点: "三废"处理与环境保护;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题是一道综合知识题目,考查学生分析和解决问题的能力,难度较大.1年前查看全部
- 电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr 3 +,同时还含有少量的Cu 2+ 、Fe 2+ Fe 3
电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr 3 +,同时还含有少量的Cu 2+ 、Fe 2+ Fe 3+ 和Al 3+ 等,且酸性较强。为回收利用铬元索,此工业废水通常采用如下流程处理:
已知: (1)铬元素有以下循环过程: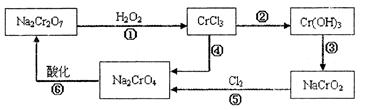
(2)Cu(OH) 2 能溶于氨水: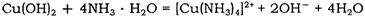
请回答下列问题:
(1) 加入试剂甲的目的:________________
(2) 试剂乙的名称:________ ,试剂丙的化学式:________________
(3) 上述操作I、II、III相同,则进行该实验操作所需要的主要玻璃仪器有________________
(4) 滤渣I的主要成分为________________(写化学式)。
(5) 在铬元素循环过程的反应①中每反应掉1 mol H 2 O 2 同时消耗H + 数目为:______________
(6) 铬元素循环过程的反应⑥的离子方程式:_____________________________;
废水处理流程中生成滤渣III的离子方程式 : _______________________ 有乐的的1年前1
有乐的的1年前1 -
 zjwzssbzt 共回答了13个问题
zjwzssbzt 共回答了13个问题 |采纳率84.6%1年前查看全部
大家在问
- 1钢化中空玻璃9mm+6A+6mm是什么意思?
- 2初三的二元一次方程的配方法大概怎么解,求学霸解释
- 3f(x)=ax^2+bx+c(a>b>c),f(1)=0,g(x)=ax+b.
- 4化学题,急,在线等 已知K2HPO4溶液中,HPO42-的水解程度大于电离程度,对于平衡:HPO42-+H2O≈H3O+
- 5读ji的字有哪些
- 6HandWash中文是什么意思洗衣机表面旋钮上的hand我60多岁了,自己查字典,好像是手洗得意思,那我明明要洗衣机洗的
- 7( )霆万钩 ( )光闪闪 ( )雪消融 ( )锁云笼 ( ) 光万道 ( )薄西山 ( )阔天空
- 83×5=15 ( )是( )的倍数 ( )是( )的因数?
- 9用方框中的词或词组的适当形式填空
- 10下列有关人体免疫的叙述正确的是( )
- 11英语完形阅读怎么提高?完形有时候会20错9啊,阅读也会抽风,英语想考过130的.另外谁能帮归结一下完形常用易错的单词词组
- 12《观刈麦》中深刻反映农民艰辛劳动的诗句
- 13寻找英语答案· Protein is crucial for tissue repair,building and pr
- 14今天是小明的生日,妈妈从超市买回一个大蛋糕,小明吃了整个的1/3,妈妈吃了剩下的1/2,爸爸吃的是妈妈的4/5,蛋糕还有
- 15今有A、B两个港口,A在B的上游60千米处.甲、乙两船分别从A、B两港同时出发,都向上游航行.甲船出发时,有一物品掉落水

