O2的微粒数是3.01x10*23,则O2的物质的量是多少?
 你追我赶12022-10-04 11:39:541条回答
你追我赶12022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 goushi511go 共回答了16个问题
goushi511go 共回答了16个问题 |采纳率100%- 3.01*10^23/(6.02*10^23)=0.5mol
- 1年前
相关推荐
- 核外电子数相同、所显电性和所带电量也相同的微粒称为等电子等质子体.下列各组内的两种微粒属于等电子等质子体的是( )
核外电子数相同、所显电性和所带电量也相同的微粒称为等电子等质子体.下列各组内的两种微粒属于等电子等质子体的是( )
A.Na+和Mg2+
B.O2-和Mg2+
C.F-和Cl-
D.Na+和NH4+ PPCCQQ1年前1
PPCCQQ1年前1 -
 uu酸奶 共回答了25个问题
uu酸奶 共回答了25个问题 |采纳率80%解题思路:根据右上角电荷数和元素种类确定核外电子数,所显电性和所带电量.A、Na+ 所带电量为1个正电荷,Mg2+所带电量为2个正电荷,故A不符合题意;
B、O2-和Mg2+所显电性不同,前者显负电性,后者显正电性,故B不符合题意;
C、F-和Cl-核外电子数不同,前者为10个电子,后者为18个电子,故C不符合题意;
D、Na+和NH4+核外电子数都为10个,都呈正电性,所带电量都为一个正电荷,故D符合题意;
故选D点评:
本题考点: 原子的定义与构成.
考点点评: 本题主要考查了微粒中质子数和电子数的确定,给出的微粒,会根据微粒的构成情况确定质子数和电子数.1年前查看全部
- 构成人体的微粒主要是a分子b原子c离子d分子,离子
 kz8161年前1
kz8161年前1 -
 清扬531 共回答了16个问题
清扬531 共回答了16个问题 |采纳率93.8%这个应该不难理解
人体中含有大量分子,比如说氨基酸,蛋白质,甘油,脂肪酸之类的之类的
当然体液中也存在大量离子,比如说体液中含有Na+和Cl-,血红蛋白中含有Fe2+
所以答案理所当然选D1年前查看全部
- 用恰当的化学用语填空:(1)保持二氧化碳化学性质的微粒是______; (2)五个五氧化二磷分子______;(3)用
用恰当的化学用语填空:
(1)保持二氧化碳化学性质的微粒是______;(2)五个五氧化二磷分子______;
(3)用于配制生理盐水的溶质是______; (4)三个铝离子______. 猪八戒爱上黎明1年前1
猪八戒爱上黎明1年前1 -
 qlof6 共回答了17个问题
qlof6 共回答了17个问题 |采纳率88.2%解题思路:(1)二氧化碳是由二氧化碳分子构成的,保持二氧化碳化学性质的微粒是二氧化碳分子.
(2)分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字.
(3)用于配制生理盐水的溶质是氯化钠,写出其化学式即可.
(4)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字.(1)二氧化碳是由二氧化碳分子构成的,保持二氧化碳化学性质的微粒是二氧化碳分子,其分子符号为:CO2.
(2)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则五个五氧化二磷分子可表示为:5P2O5.
(3)用于配制生理盐水的溶质是氯化钠,其化学式为:NaCl.
(4)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故三个铝离子可表示为:3Al3+.
故答案为:(1)CO2;(2)5P2O5;(3)NaCl;(4)3Al3+.点评:
本题考点: 化学符号及其周围数字的意义.
考点点评: 本题难度不大,主要考查同学们对常见化学用语(分子符号、化学式、离子符号等)的书写和理解能力.1年前查看全部
- 1mol物质微粒的质量=原子真实质量*阿伏加德罗常数
 mm饿鬼1年前3
mm饿鬼1年前3 -
 tongtong_2004 共回答了12个问题
tongtong_2004 共回答了12个问题 |采纳率91.7%1mol的物质微粒的个数等于阿伏伽德罗常数,每个微粒的真实质量乘以总数量就等于总质量.1年前查看全部
- 某微粒结构示意图如图所示,下列说法错误的是( )
某微粒结构示意图如图所示,下列说法错误的是( )
 A. 该微粒核外有三个电子层
A. 该微粒核外有三个电子层
B. 该微粒是金属元素的原子
C. 该微粒在化学反应中容易得到一个电子
D. 该微粒的核电荷数为17 txmalin1年前6
txmalin1年前6 -
 龙之兄弟 共回答了25个问题
龙之兄弟 共回答了25个问题 |采纳率92%解题思路:根据原子结构示意图可知道该原子的质子数、电子数、电子层数及最外层电子数,并能利用最外层电子数判断出元素的种类.由原子结构示意图可知该元素①质子数是17,②电子层数是3,③最外层电子数是7,④由于最外层电子数大于4,所以该元素是非金属元素.
故选B.点评:
本题考点: 原子结构示意图与离子结构示意图;核外电子在化学反应中的作用.
考点点评: 微粒结构示意图中,质子数等于核外电子数时,微粒为原子;原子结构中,最外层电子数大于4时,元素为非金属元素.1年前查看全部
- 某微粒的结构示意图为: 下列有关该离子的说法,其中错误的是( ) A.该粒子为阳离子 B.该粒子的原子核内有16个
某微粒的结构示意图为: 
下列有关该离子的说法,其中错误的是( )A.该粒子为阳离子 B.该粒子的原子核内有16个质子 C.该粒子已经达到相对稳定结构 D.该粒子核外有三个电子层  lkllm1年前1
lkllm1年前1 -
 鱼儿不相信眼泪 共回答了24个问题
鱼儿不相信眼泪 共回答了24个问题 |采纳率87.5%A、该核内质子数为16,核外电子数为18,即:质子数<核外电子数,所以该粒子为阴离子,故B说法错误;B、根据原子结构示意图可以知道,该原子的核内为16个质子,故B说法正确;C、最外层电子数为8(只有一个电子层...1年前查看全部
- 不显电性的一组微粒是( )A.原子、中子、电子B.原子核、原子、分子C.中子、电子、原子D.中子、分子、原子
 wjt001年前1
wjt001年前1 -
 benny1230 共回答了19个问题
benny1230 共回答了19个问题 |采纳率94.7%解题思路:分子和原子对外不显电性,原子是由原子核和核外电子组成的,原子核带正电,电子带负电,原子核是由质子和中子组成的,质子带正电,中子不带电.分子和原子都不显电性,但是组成原子的原子核带正电,其中原子核是由带正电的质子和不带电的中子组成的.
故选D.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;原子的定义与构成.
考点点评: 本题考查了学生对物质内部结构以及带电情况的了解,是一道基础性的题目,相对比较简单.1年前查看全部
- 现有下列四种因素:①温度和压强 ②所含微粒数 ③微粒本身大小 ④微粒间的距离,其中对气体物质体积有显著影响的是( )
现有下列四种因素:①温度和压强 ②所含微粒数 ③微粒本身大小 ④微粒间的距离,其中对气体物质体积有显著影响的是( ) A.①②③ B.①③④ C.①②④ D.①②③④  ww货1年前1
ww货1年前1 -
 羊汤花卷 共回答了17个问题
羊汤花卷 共回答了17个问题 |采纳率94.1%对于气体来说,温度和压强不同,气体分子之间的距离不同,而微粒本身大小远小于微粒间的距离,则微粒本身大小可忽略不计,微粒数目越多,则体积越大,
所以影响气体体积的因素主要有:温度和压强、所含微粒数以及微粒间的距离,
故选C.1年前查看全部
- H2是氢元素的一种微粒吗元素不是一类原子吗
 dncjw1231年前2
dncjw1231年前2 -
 tian7859 共回答了19个问题
tian7859 共回答了19个问题 |采纳率89.5%元素是宏观角度
微粒原子是微观角度
微粒有很多,分子原子电子质子……1年前查看全部
- 几种微粒具有相同的核电荷数,则他们的核外电子数一定相等 这句话为什么是错的?
几种微粒具有相同的核电荷数,则他们的核外电子数一定相等 这句话为什么是错的?
核外电子数不是等于核电荷数吗 52jie1年前1
52jie1年前1 -
 nhsyl 共回答了15个问题
nhsyl 共回答了15个问题 |采纳率100%不对啦,你忘了离子哦!
离子也是微粒
离子的核外电子个数不等
比如说:铁原子和铁离子
核电荷数当然不等于电子数了!
解析如上,1年前查看全部
- (2014•南海区模拟)下列溶液中微粒浓度关系一定正确的是( )
(2014•南海区模拟)下列溶液中微粒浓度关系一定正确的是( )
A.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+)
B.0.1mol/L的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
C.0.1mol/L的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
D.室温下,氢氧化钠与氯化铵的混合溶液中pH=7,则有c(Cl-)=c(NH4+)+c(Na+) 风雨1411411年前1
风雨1411411年前1 -
 hanooly 共回答了24个问题
hanooly 共回答了24个问题 |采纳率100%解题思路:A.酸碱的强弱未知,反应后不一定呈中性;
B.NH4+水解,溶液呈酸性;
C.从质子守恒的角度判断;
A.根据溶液的电荷守恒判断.A.酸碱的强弱未知,反应后不一定呈中性,如为强酸强碱,则c(OH-)=c(H+),如为弱酸强碱,则c(OH-)<c(H+),如为强酸弱碱,则c(OH-)>c(H+),故A错误;
B.NH4+水解,且水解程度较小,溶液呈酸性,则存在c(NH4+)>c(SO42-)>c(H+)>c(OH-),故B正确;
C.根据质子守恒可知,溶液中应存在c(OH-)=c(H+)+c(HS-)+2c(H2S),故C错误;
D.氨水与氯化铵的pH=7的混合溶液中存在c(Cl-)+c(OH-)=c(NH4+)+c(H+),因c(OH-)=c(H+),则c(Cl-)=c(NH4+),故D正确;
故选BD.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;盐类水解的应用.
考点点评: 本题考查离子浓度的大小比较,题目难度中等,本题注意弱电解质的电离以及盐类水解原理的把握,注意电荷守恒、质子守恒以及物料守恒的应用.1年前查看全部
- 1mol的微粒数约等于6.02*10^23个?
 sypl20031年前1
sypl20031年前1 -
 barbaraandjie 共回答了17个问题
barbaraandjie 共回答了17个问题 |采纳率76.5%是的,1mol=6.02*10^23个.1年前查看全部
- 对Mg和Mg2+两种微粒的认识不正确的是( )A.这两种微粒都可构成物质B.它们属于同种元素C.它们具有
对Mg和Mg2+两种微粒的认识不正确的是( )A.这两种微粒都可构成物质B.它们属于同种元素C.它们具有
对Mg和Mg2+两种微粒的认识不正确的是( )
A.这两种微粒都可构成物质
B.它们属于同种元素
C.它们具有相同的化学性质
D.它们在一定的条件下可以相互转化
 xxb13961年前1
xxb13961年前1 -
 gongyiyi 共回答了6个问题
gongyiyi 共回答了6个问题 |采纳率83.3%A、原子、离子都是构成物质的粒子,Mg和Mg2+两种微粒都可构成物质,故选项说法正确.
B、元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同,镁原子失去2个电子形成镁离子,Mg和Mg2+两种微粒的核内质子数相同,属于同种元素,故选项说法正确.
C、元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,镁原子失去2个电子形成镁离子,它们的最外层电子数不同,不具有相同的化学性质,故选项说法错误.
D、Mg和Mg2+两种微粒之间在一定的条件下可以相互转化,故选项说法正确.
故选:C.1年前查看全部
- 氨水中含氮微粒中最多的微粒是什么啊?
 假装偶然81491年前3
假装偶然81491年前3 -
 21ctman 共回答了14个问题
21ctman 共回答了14个问题 |采纳率92.9%氨水中含氮微粒中最多的微粒是NH3
解析:
氨气在水中溶解度很大达到1:700,但是溶解不等于反应,氨气在水中大部分以NH3分子形式存在.
氨溶于水发生的反应:NH3 + H2O =可逆= NH3·H2O =可逆= NH4+ + OH-
反应都是可逆的微弱的,即只有少量的NH3反应了,大部分仍以NH3分子形式存在(气味)
(氨水中含有的微粒为:分子:NH3·H2O、H2O、NH3;离子:H+(极少)、OH-、NH4+)1年前查看全部
- 如图22所示,质量为m带电量为 -q 的微粒(重力不计),在匀强电场中的A点时速度为v,方向与电场线垂直,在B点时速度为
如图22所示,质量为m带电量为 -q 的微粒(重力不计),在匀强电场中的A点时速度为v,方向与电场线垂直,在B点时速度为2v,已知A、B两点间距离为d,求:
①A、B两点间电压?
②电场强度大小和方向?
结果我知道 只是不知道怎么算

 1216497481年前2
1216497481年前2 -
 小石头1999 共回答了10个问题
小石头1999 共回答了10个问题 |采纳率90%①A、B两点间电压
m(2V)²/2 - mV²/2=W=qU
U={m(2V)² - mV²}/2q
②电场强度大小
W=qU=Eqdcosa 没给夹角?1年前查看全部
- 在分子,原子,质子,中子,电子,原子核中 能直接构成物质微粒; 能保持物质化学性质;
 不可能不爱你1年前1
不可能不爱你1年前1 -
 c122039 共回答了23个问题
c122039 共回答了23个问题 |采纳率95.7%分子,原子能直接构成物质,离子也行
分子,原子能保持物质的化学性质,后面的不行,因为原子是保持物质化学性质的最小粒子1年前查看全部
- 根据下列微粒的结构示意图判断,表示阴离子的是( )
根据下列微粒的结构示意图判断,表示阴离子的是( )
A.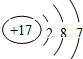
B.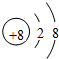
C.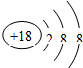
D.
 半佛僧人1年前1
半佛僧人1年前1 -
 naruto0912 共回答了15个问题
naruto0912 共回答了15个问题 |采纳率73.3%解题思路:根据当核电荷数=质子数=核外电子数,为原子;当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;进行解答.由微粒结构示意图可知:
A.核电荷数=质子数=核外电子数=17,为原子.故A不符合题意;
B.核电荷数=质子数=8<核外电子数=10,为阴离子.故B符合题意;
C.核电荷数=质子数=核外电子数=18,为原子.故C不符合题意;
D.核电荷数=质子数=核外电子数=19,为原子.;故D不符合题意.
故选B.点评:
本题考点: 原子结构示意图与离子结构示意图.
考点点评: 本题考查学生根据当核电荷数、质子数与核外电子数的关系辨别微粒种类方法的掌握与应用的能力.1年前查看全部
- 下列微粒中,与Ne原子的核外电子数相同的是 A Cl- B Na C、F- D、K+
下列微粒中,与Ne原子的核外电子数相同的是 A Cl- B Na C、F- D、K+
为什么,核外电子怎么算 Christine031年前2
Christine031年前2 -
 gongminmin 共回答了20个问题
gongminmin 共回答了20个问题 |采纳率100%C
前20号元素的核外电子数自己是必须记住的
Ne核外电子数是10,CL核外有17个电子,然后带一个负电荷,即得一电子,核外电子数18个,NA核外电子数11个,F核外电子数本来是9个的,但带一个负电荷,即得一电子,所以是10个,K核外电子数是20 ,带一正电荷,即失一电子,所以是191年前查看全部
- 如图所示,质量为m,带电量为+q的微粒以速度v与电场方向成30°角进入互相垂直的匀强电场
 510174861年前1
510174861年前1 -
 thinkfly 共回答了24个问题
thinkfly 共回答了24个问题 |采纳率83.3%我觉得不可能做匀变速直线运动.速度大小变化则洛伦兹力要变化,电场力不变,则合力方向不可能始终与速度共线.所以我觉得题目是不是有些问题.1年前查看全部
- 化学的微粒数怎么算
 少将8881年前2
少将8881年前2 -
 相约80 共回答了21个问题
相约80 共回答了21个问题 |采纳率81%1mol纯净物含有6.02乘十的23次方个组成该物质的最小粒子 比如1mol氧气(32g)就含有6.02乘十的23次方个氧分子1年前查看全部
- 干冰、铜、氯化钠、金刚石,说出这些物质是由什么微粒构成的?
 鬼小哥1年前1
鬼小哥1年前1 -
 我本是一介书生 共回答了20个问题
我本是一介书生 共回答了20个问题 |采纳率85%干冰:二氧化碳分子
铜:铜原子
氯化钠:氯离子、钠离子
金刚石:碳原子1年前查看全部
- CO2分子晶体中,微粒间存在的作用力有__________.
 姜伟1年前2
姜伟1年前2 -
 kaluoji 共回答了12个问题
kaluoji 共回答了12个问题 |采纳率83.3%分子间力(也叫范德瓦尔斯力),再有就是C-O的极性共价键和C-C的非极性键了,最主要的还是分子间力1年前查看全部
- 下列说法正确的是( )A. 摩尔是表示物质数量的单位B. 摩尔是表示物质多少的单位C. 摩尔是既能表示物质所含微粒数的
下列说法正确的是( )
A. 摩尔是表示物质数量的单位
B. 摩尔是表示物质多少的单位
C. 摩尔是既能表示物质所含微粒数的数量,又能表示物质质量的具有双重意义的单位
D. 摩尔是巨大数目的微粒集合体,表示物质的量的国际单位 哎呀不好了1年前1
哎呀不好了1年前1 -
 huadabj 共回答了11个问题
huadabj 共回答了11个问题 |采纳率100%解题思路:A、摩尔是物质的量的单位;
B、摩尔是物质的量的单位;
C、物质的量表示物质所含微粒数的多少,质量的单位是g;
D、1mol任何物质含有约6.02×1023个微粒,摩尔是物质的量的国际单位.A、摩尔是物质的量的单位,不是物质数量的单位,故A错误;
B、摩尔是物质的量的单位,不是表示物质多少的单位,故B错误;
C、物质的量表示物质所含微粒数的多少,质量的单位是g,不是摩尔,故C错误;
D、科学上把含有6.02×1023个微粒的集体作为一个单位,称为摩尔,它是表示物质的量(符号是n)的单位,故D正确;
故选D.点评:
本题考点: 物质的量的单位--摩尔.
考点点评: 本题考查了物质的量的单位-摩尔,题目难度不大,侧重于对物质的量与摩尔的理解和区别.1年前查看全部
- 下列溶液中微粒的关系正确是( ) A.相同浓度的NaX和NaY两种盐溶液,若c(X - )=c(Y - ),则酸性HX
下列溶液中微粒的关系正确是( ) A.相同浓度的NaX和NaY两种盐溶液,若c(X - )=c(Y - ),则酸性HX>HY B.氨水和盐酸混合后溶液呈酸性,溶液中可能存在:c(NH 4 + )>c(Cl - ) C.在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H + )分别是1.0×10 -a mol/L和是1.0×10 -b mol/L,在此温度时,水的离子积为
1.0×10 -(a+b)D.常温下,0.1 mol/L酸HA pH=3,0.1 mol/L 碱BOH pH=13,则盐BA溶液的pH<7  limhao1年前1
limhao1年前1 -
 问荆 共回答了23个问题
问荆 共回答了23个问题 |采纳率87%A.相同浓度的NaX和NaY两种盐溶液,若c(X - )=c(Y - ),说明酸HX和HY的电离程度相同,酸性HX=HY,故A错误;
B.氨水和盐酸混合后溶液呈酸性,则c(H + )>c(OH - ),溶液中存在c(H + )+c(NH 4 + )=c(Cl - )+c(OH - ),则c(NH 4 + )<c(Cl - ),故B错误;
C.硫酸中水电离出来的c(H + )=c(OH - )=1.0×10 -a mol/L,硫酸铁溶液中水电离出来的c(H + )是1.0×10 -b mol/L,则硫酸中c(H + )是1.0×10 -b mol/L,则Kw=c(H + )×c(OH - )=1.0×10 -a ×1.0×10 -b =1.0×10 -(a+b) ,故C正确;
D.常温下,0.1 mol/L酸HApH=3,说明HA没有完全电离,为弱酸,0.1 mol/L 碱BOHpH=13,说明BOH完全电离,为强碱,盐BA为强碱弱酸盐,水解呈碱性,则pH>7,故D错误.
故选C.1年前查看全部
- 下列溶液中微粒浓度关系正确的是.
下列溶液中微粒浓度关系正确的是.
A:PH=2的一元酸和PH=12的一元强碱等体积混合:c(OH-)=C(H+)
B:0.1mol/L的硫酸铵溶液中:c(NH4+)>c(SO4 2-)>c(H+)
C.0.1mol/L的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
请解释每个选项. xiaoguoguo1年前2
xiaoguoguo1年前2 -
 hailan 共回答了18个问题
hailan 共回答了18个问题 |采纳率100%选B
A.PH=2的一元酸可能是强酸也可能是弱酸,如果是强酸,则结论正确;如果是弱酸,那么PH=2的弱酸其浓度大于0.01mol/L,与PH=12的一元强碱等体积混合后生成的是盐和酸的混合物,而且酸的剩余量一般很多,此时C(H+)>C(OH-)
B.
(NH4)2SO4不水解时C(NH4+)=2C(SO42-),水解反应发生十分微弱,所以肯定有c(NH4+)>c(SO4 2-),水解生成H+量很少,无法与盐电离的离子相比,所以c(NH4+)>c(SO4 2-)>c(H+)
C.
式子本来要体现的意义是来源守恒,水电离出的OH-应该与电离出的H+的所有去向之和相等,但H2S中有两个H,所以应该是C(OH-)=C(H+)+C(HS-)+2C(H2S)1年前查看全部
- 1摩尔是6.02乘10^23个微粒的粒子集合体
 gemini羽衣1年前1
gemini羽衣1年前1 -
 绿Q小舟 共回答了19个问题
绿Q小舟 共回答了19个问题 |采纳率84.2%错,是约等于1年前查看全部
- 由于固体,液体内部微粒是紧密堆积,所以改变温度和压强时对其体积影响不大
由于固体,液体内部微粒是紧密堆积,所以改变温度和压强时对其体积影响不大
这句话对吗? tt袋袋1年前1
tt袋袋1年前1 -
 红色的小灯 共回答了19个问题
红色的小灯 共回答了19个问题 |采纳率94.7%基本上可以这么说.但是我还要补充:由于固体与液体之间的斥力与吸引力都比较大,所以改变温度和压强时对其体积影响不大.1年前查看全部
- 硫酸 微粒组成稀硫酸H2SO4是离子化合物,不是原子构成,那是什么构成的?H2SO4分子应该是由原子构成的,分子由原子构
硫酸 微粒组成
稀硫酸H2SO4是离子化合物,不是原子构成,那是什么构成的?H2SO4分子应该是由原子构成的,分子由原子构成的吗.这到底该怎么讲 hzxsj1691年前4
hzxsj1691年前4 -
 从不QQ只版聊 共回答了15个问题
从不QQ只版聊 共回答了15个问题 |采纳率93.3%完全错了.稀硫酸是分子化合物,也就是说他的晶体结构是分子晶体,依靠分子作用力即范德瓦尔斯力.
离子化合物由正负离子之间的离子键构成的.
原子晶体由共价键组成.
这里指的是结构组成,不是指里面有没有原子1年前查看全部
- (2011•碑林区模拟)如图所示,在一空间电场中有一条竖直电场线上有C、D两点,将某带电微粒,从C点由静止释放,微粒沿竖
 (2011•碑林区模拟)如图所示,在一空间电场中有一条竖直电场线上有C、D两点,将某带电微粒,从C点由静止释放,微粒沿竖直电场线下落,到达D点时,速度为零,下列说法正确的是( )
(2011•碑林区模拟)如图所示,在一空间电场中有一条竖直电场线上有C、D两点,将某带电微粒,从C点由静止释放,微粒沿竖直电场线下落,到达D点时,速度为零,下列说法正确的是( )
A.沿竖直电场线由C到D,电场强度是逐渐减小的
B.沿竖直电场线由C到D,电场强度是逐渐增大的
C.C点电势,可能比D点电势高,也可能比D点低
D.微粒从C运动到D的全过程,电势能的增加量等于重力势能的减小量 buaimeili1年前1
buaimeili1年前1 -
 FIFAFIFA 共回答了27个问题
FIFAFIFA 共回答了27个问题 |采纳率92.6%解题思路:由题意可知,带点微粒受两个力:重力和电场力.由微粒到达D点时,速度为零可判断出电场力的方向,根据电场力做的功,判断电势能的变化.通过带电质点初末速度为零可比较出两点的电场强度.沿电场线方向电势逐渐降低.A、B,由题意可知,带点微粒受两个力:重力和电场力,由于质点运动过程中初末速度均为零,因此质点所受电场力向上,而且先加速后减速,故在C点,重力大于电场力,在D点电场力大于重力,在CD之间某点重力等于电场力,合外力为零,且此时速度最大,因此沿CD方向电场强度是增大的,故A错误,B正确;
C、沿电场线方向电势逐渐降低,当带电粒子带正电时,电场方向向上,C点的电势比D点低;当带电粒子带负电时,电场方向向下,故C点的电势比D点高,故C正确;
D、微粒从C运动到D的全过程中,重力势能减小,电场力做负功,电势能增大,而动能变化量为零,根据能量守恒定律得知,电势能的增加量等于重力势能的减小量.故D正确.
故选BCD.点评:
本题考点: 电势能;电势.
考点点评: 解决带电粒子在复合场中的运动,要正确进行受力分析,确定其运动状态,然后依据相关规律求解.1年前查看全部
- 在一个电中性的原子中,一定含有的微粒是( )
在一个电中性的原子中,一定含有的微粒是( )
A. 质子、中子、电子
B. 质子、中子
C. 质子、电子
D. 中子、电子 拉度酱油1年前2
拉度酱油1年前2 -
 哈哈哈haha 共回答了18个问题
哈哈哈haha 共回答了18个问题 |采纳率83.3%解题思路:根据原子为电中性以及质子带正电、中子不带电、核外电子带负电来解答.根据原子呈电中性以及质子带正电、中子不带电、核外电子带负电可知,
原子中一定含有质子和电子,不一定有中子,如氢的一种同位素氕,它只有1个质子和1个电子构成.
故选C.点评:
本题考点: 原子构成.
考点点评: 本题主要考查了原子的构成以及组成粒子的电性,难度不大,根据课本知识即可完成.1年前查看全部
- 为什么在电场中不带电微粒,不受电场力作用.但带电物体能吸引不带电微粒.
 xuanku1001年前3
xuanku1001年前3 -
 xnlsgl 共回答了23个问题
xnlsgl 共回答了23个问题 |采纳率87%“但带电物体能吸引不带电微粒”中的微粒是指较大微粒即多分子组成的微粒,或者是单个分子、原子,这些微粒都能够因附近带电体的电场作用,组成自身的原子的核外电子及原子核的平均位置发生偏移,成为一侧带正电另一侧带负电的结构,两侧异种电荷因与带电体的微小距离差,使这微粒受相反方向的电场力的合力不为零,因而才使这微粒能受带电体的作用.如果是不带电的亚原子粒子,如中子,就不会受带电体的作用.
但在两极板间形成的均匀电场中,就是微粒有正负电位置中心的偏移,也不会受电场力的作用,因为这时,均匀电场对微粒的正电侧和负电测作用力总是相平衡的,合力为零.不带电的亚原子粒子当然就更是合力为零的情况了.1年前查看全部
- 用微粒的观点解释下列现象碘受热升华和凝华;打气筒里的空气加压时体积明显减小,给水加压时体积无明显变化;水电解生成氢气和氧
用微粒的观点解释下列现象
碘受热升华和凝华;打气筒里的空气加压时体积明显减小,给水加压时体积无明显变化;水电解生成氢气和氧气
化学题 fyh_10301年前1
fyh_10301年前1 -
 天tian1026 共回答了15个问题
天tian1026 共回答了15个问题 |采纳率86.7%1、碘受热升华:
碘受热,碘分子的运动更加剧烈(初一教过的吧、),于是碘分子之间的距离增大,原本的固体的密度就减小、就升华为气体.、
2、打气筒里的空气加压时体积明显减小,给水加压时体积无明显变化:
空气的分子之间的间隙比较大(就是说密度比较小、)那么它们之间的空隙就比较容易被挤压变小(体积减小);而水的分子间隙比较小不容易被压缩.
3、水电解生成氢气和氧气:
水通直流电的时候,水分子(分子式H2O、),就拆分成氢原子和氧原子(H和O),然后氢原子和氧原子又自由组合,组成氢气和氧气(H2和O2)、
就是这样~~1年前查看全部
- 氢和氧形成的十电子微粒,3Q
 leonn8051年前1
leonn8051年前1 -
 握镰刀的猫 共回答了13个问题
握镰刀的猫 共回答了13个问题 |采纳率100%水(H2O) 氢氧根 H3O+1年前查看全部
- 保持水的化学性质的最小微粒是( )
保持水的化学性质的最小微粒是( )
A. 水分子
B. 氢原子
C. 氧原子
D. 氢原子和氧原子 心乱如麻的ii21年前2
心乱如麻的ii21年前2 -
 zzyyu530 共回答了18个问题
zzyyu530 共回答了18个问题 |采纳率88.9%解题思路:根据分子是保持物质化学性质的最小粒子考虑本题.分子是保持物质化学性质的最小粒子,水是由水分子构成,所以保持水的化学性质的最小微粒是水分子.
故选:A.点评:
本题考点: 分子的定义与分子的特性.
考点点评: 解答本题关键是要知道分子是保持物质化学性质的最小粒子,原子是化学变化中的最小粒子.1年前查看全部
- 氯化钠溶于水中得到的溶液中含有的微粒有(些符号)
 a5040110561年前1
a5040110561年前1 -
 dicysong140 共回答了13个问题
dicysong140 共回答了13个问题 |采纳率92.3%分子:H2O
离子:Na+ Cl- H+ OH-
望采纳o亲!1年前查看全部
- 在化学的一个实验中,用红墨水和酒精做实验,证明微粒间有空隙的实验中,为什么要先加墨水,再加酒精?
在化学的一个实验中,用红墨水和酒精做实验,证明微粒间有空隙的实验中,为什么要先加墨水,再加酒精?
先把墨水加入长试管,再加入酒精,摇晃,发现总体积变小的一个实验 jessiepan1年前3
jessiepan1年前3 -
 yao_yongh 共回答了29个问题
yao_yongh 共回答了29个问题 |采纳率89.7%以为红墨水的密度比酒精大,刚刚加进去总体体积变化不会
太快(这主要是老师让你们发现两液体好像是不会变小的),
之后摇晃,总体积就立即变小1年前查看全部
- 某微粒的核外电子排布式为1s22s22p63s23p6,下列关于该微粒的说法正确的是( )
某微粒的核外电子排布式为1s22s22p63s23p6,下列关于该微粒的说法正确的是( )
A. 它的质子数一定是18
B. 它的原子和37Cl可能互为同位素
C. 它的单质一定是强还原剂
D. 可以确定该微粒为Ar haoxianyi1年前1
haoxianyi1年前1 -
 nhxlb 共回答了25个问题
nhxlb 共回答了25个问题 |采纳率88%解题思路:A、某微粒的核外电子排布式为1s22s22p63s23p6,可知该微粒含有18个电子,该微粒可能是原子也可能是离子、原子团;
B、若为原子,则该原子的质子数为18,为氯原子;
C、氯气具有强氧化性;
D、该微粒可能是原子也可能是离子、原子团,不能确定该微粒.A、某微粒的核外电子排布式为1s22s22p63s23p6,可知该微粒含有18个电子,该微粒可能是原子也可能是离子、原子团,因此不能确定质子数,故A错误;
B、某微粒的核外电子排布式为1s22s22p63s23p6,可知该微粒含有18个电子,若为原子,则该原子的质子数为18,为氯原子,可能和37Cl互为同位素,故B正确;
C、氯气具有强氧化性,故C错误;
D、该微粒可能是原子也可能是离子、原子团,不能确定该微粒,故D错误;
故选B.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查了核外电子排布式为1s22s22p63s23p6的微粒,即18电子微粒,根据常见的18电子微粒分析即可,题目难度不大.1年前查看全部
- 比较金刚石和石墨的结果,下列说法正确的是() A.它们是同一种物质,只是内部微粒的排列不同 B.它们的物理性质有很大的差
比较金刚石和石墨的结果,下列说法正确的是() A.它们是同一种物质,只是内部微粒的排列不同 B.它们的物理性质有很大的差异 C.由于它们内部微粒排列规则不同,所以金刚为石晶体,石墨非晶体 D.金刚石是单晶体,石墨是多晶体 请回答者析下.
 WangXu99901年前2
WangXu99901年前2 -
 dghpkj 共回答了19个问题
dghpkj 共回答了19个问题 |采纳率89.5%a同一种元素形成的多种单质互为同素异形体.例如金刚石和石墨是碳的同素异形体.许多元素都能形成同素异形体,形成方式有:(1)分子里原子个数不同,如氧气和臭氧;(2)晶体里原子的排列方式不同,如金刚石和石墨;(3...1年前查看全部
- APP待处理 ? ? 在无限的宇宙的永恒岁月中,生命只是一个顷刻化为乌有的微粒.我们每一个人都应尽
APP待处理 ? ? 在无限的宇宙的永恒岁月中,生命只是一个顷刻化为乌有的微粒.我们每一个人都应尽
APP待处理
? ? 在无限的宇宙的永恒岁月中,生命只是一个顷刻化为乌有的微粒.我们每一个人都应尽情地去追逐自己的梦想,我们每一个人都应该将有限的生命,活出无限的精彩. +++ ++ + + +++ 如果问题是这样的话可以找/官-方:95O-4O88-5511 /处/理
 伊涵60131年前1
伊涵60131年前1 -
 小鼠哥 共回答了22个问题
小鼠哥 共回答了22个问题 |采纳率100%真的是真理!1年前查看全部
- 那个是错的:1.物质永远在做运动 2.分子是保持化学性质不变的最小微粒
 血性男儿1年前1
血性男儿1年前1 -
 mendieta 共回答了15个问题
mendieta 共回答了15个问题 |采纳率100%分子是保持物质化学性质的最小微粒(化学书上的概念)
自然界中的物质是在永远不停运动的(物理定义)
所以全队的1年前查看全部
- C D 微粒分别指 硫离子 钠离子 写出他们的元素符号
C D 微粒分别指 硫离子 钠离子 写出他们的元素符号
为什么不是写成 S Na 要写成 S2- Na2- 狮心1年前2
狮心1年前2 -
 三哥不是男人 共回答了18个问题
三哥不是男人 共回答了18个问题 |采纳率94.4%因为离子是带电荷的原子或原子团,必须把它们所带的电荷写在右上角.S2-,Na+1年前查看全部
- 这个说法是否与"原子是化学变化中的最小微粒"相矛盾?
这个说法是否与"原子是化学变化中的最小微粒"相矛盾?
仁爱版九年级化学课本:"在化学变化中原址可以得到或失去电子转换成离子,离子也可以通过失去或得到电子转换成原子",这种说法是否与"原子是化学变化中的最小微粒"相矛盾?请高手解释谢谢!
希望高手说明详细原因,非诚勿扰,谢谢! yingxinfaye1年前6
yingxinfaye1年前6 -
 我爱海布里 共回答了16个问题
我爱海布里 共回答了16个问题 |采纳率81.3%刚才打错了,望见谅;我完全同意上面二楼的回答:只要原子的核电荷数(或原子核)不发生变化,就还是原来的原子,只是在化学变化中原子得失电子而变成离子而已,况且离子是带电的原子(或原子团),它本质上还是同种元素的原子嘛!1年前查看全部
- 静电喷涂物理工作时静电喷涂的喷枪或喷盘、喷杯,涂料微粒部分接负极,工件接正极并接地!为什么工件接正极了,还要接地呀?接地
静电喷涂物理
工作时静电喷涂的喷枪或喷盘、喷杯,涂料微粒部分接负极,工件接正极并接地!
为什么工件接正极了,还要接地呀?接地不是正极的正电荷被和中和了吗?那涂料怎么被工件吸附呢? wscyl1年前3
wscyl1年前3 -
 zyh24 共回答了19个问题
zyh24 共回答了19个问题 |采纳率100%你见过哪的静电喷涂 在工件上加正电?
都是在喷枪或者是涂料上加上负电.
之所以会吸附,是因为高压的喷枪靠近工件,同性相斥,
工件表面的负电荷就会从接地跑出去,工件就带上了正电.
这个效应叫做 静电感召.
一楼二楼,回去补习一下高中物理,不要在这里胡说八道.1年前查看全部
- 为什么熔点:W〉I2〉Hg〉O2?要有化学理论分析,关于微粒间作用力的,
 cc者1年前1
cc者1年前1 -
 舟行天下 共回答了19个问题
舟行天下 共回答了19个问题 |采纳率100%理论分析很难,因为有两个金属晶体混在里面.
金属晶体的熔沸点相差较大
本题可以这样分析“
W、I2是固体,Hg是液体、O2是气体.
所以W、I2肯定最高,Hg次之,O2最低
W是钨,灯丝的主要成分,I2易升华,所以W>I21年前查看全部
- 高二化学【急】高分追加]下列各组微粒半径比值最小的是A.O2-/F- B.Al3+/S2- C.Na/Na+ D.S/C
高二化学【急】高分追加]
下列各组微粒半径比值最小的是
A.O2-/F- B.Al3+/S2- C.Na/Na+ D.S/Cl
【答案】:B
我想知道详细的过程和原因,谢谢. 爱兮1年前1
爱兮1年前1 -
 那一刀的疼痛 共回答了21个问题
那一刀的疼痛 共回答了21个问题 |采纳率85.7%AB比较,铝离子和氧离子的电子数相同,但铝的质子数多,电子对离子半径有扩大作用,而质子则有收缩作用,所以铝比氧的小.同理硫比氟的大,比值最小.C选项,只相差一个电子,半径比更接近1,而且用上述法分析,电子数与质子数只差1,作用效果不明显.同理D中质子数只差一,也不明显,1年前查看全部
- 干冰不经过液态而直接变为气态二氧化碳,这一变化属于?变化,在此变化过程中,微粒间的间隙变?了
 1963971年前5
1963971年前5 -
 314426613 共回答了20个问题
314426613 共回答了20个问题 |采纳率85%干冰不经过液态而直接变为气态二氧化碳,这一变化属于(物理)变化,在此变化过程中,微粒间的间隙变(大)了.
这种现象叫做升华.1年前查看全部
- 短周期中单核10电子微粒有哪些?【急】
短周期中单核10电子微粒有哪些?【急】
短周期中多核10电子的分子和离子有哪些?
短周期中单核10电子微粒有哪些? 依影随行1年前1
依影随行1年前1 -
 jy2873725 共回答了17个问题
jy2873725 共回答了17个问题 |采纳率94.1%10电子微粒:
单核:Ne、N(3-)、O(2-)、F-、Na+、Mg(2+)、Al(3+)
二核:HF、OH-
三核:H2O、NH2(-)
四核:NH3、H3O+
五核:CH4、NH4(+)1年前查看全部
- 如图所示,两平行金属板水平放置并接到电源上,一个带电微粒P位于两板间恰好平衡,现用外力将P固定住,然后使两板各绕其中点转
如图所示,两平行金属板水平放置并接到电源上,一个带电微粒P位于两板间恰好平衡,现用外力将P固定住,然后使两板各绕其中点转过较小的角度α角,如图虚线所示,再撤去外力,则带电微粒P在两板间( )
 A. 保持静止
A. 保持静止
B. 水平向左做匀加速直线运动
C. 向左下方匀加速运动
D. 不知α角的值无法确定P的运动状态 leo0804x1年前2
leo0804x1年前2 -
 qinjiafu 共回答了19个问题
qinjiafu 共回答了19个问题 |采纳率89.5%解题思路:带电微粒P在水平放置的A、B金属板间的电场内处于静止状态,说明处于平衡状态,竖直向上的电场力大小等于重力的大小,当两平行金属板A、B分别以O、0′中心为轴在竖直平面内转过相同的较小角度α,然后释放P,此时P受到重力、电场力,合力向左,故P做向左的匀加速直线运动.初位置时,电场力和重力平衡,设电场强度为E,初状态极板间距是d,旋转α角度后,极板间距变为dcosα,所以电场强度E′=[E/cosθ].而且电场强度的方向也旋转了α,由受力分析可知,竖直方向仍然平衡,水平方向有电场力的分力,所以微粒水平向左做匀加速直线运动;故B正确,A、C、D错误.
故选:B.点评:
本题考点: 匀强电场中电势差和电场强度的关系;电容器.
考点点评: 考查了已知受力求运动,正确受力分析,由牛顿第二定律判断运动情况,解决本题的关键是确定新场强与原来场强在大小、方向上的关系.1年前查看全部
- 初三生物题(急)单选题1、人体内消化脂肪的器官、所需要的酶、消化的终产物、吸收器官分别是( ) A 胆囊、胆汁、脂肪微粒
初三生物题(急)
单选题
1、人体内消化脂肪的器官、所需要的酶、消化的终产物、吸收器官分别是( ) A 胆囊、胆汁、脂肪微粒、胃 B 肝脏、胆汁、甘油和脂肪酸、小肠
C 小肠、胆汁、甘油和脂肪酸、小肠 D 小肠、肠脂肪酶和胰脂肪酶、甘油和脂肪酸、小肠
2.下列食物的有机成分中,只能在小肠里被消化的是( )
A 淀粉 B 麦芽糖 C 蛋白质 D 维生素
3.能消化蛋白质的器官是( ) A 口腔和小肠 B 胃和小肠 C 小肠 D 口腔
4.小肠绒毛不能直接吸收的营养物质是( )
A 氨基酸 B 麦芽糖 C 维生素 D 脂肪酸 bjlm20001年前8
bjlm20001年前8 -
 Tangel1120 共回答了19个问题
Tangel1120 共回答了19个问题 |采纳率78.9%1.D
2.B(A C排除,维生素可以在胃被吸收很小一部分)
3.B(胃虽然能分泌胃蛋白酶,但是量太少,可以忽略,也可以算能消化.看出题者的意图选B还是C)
4.B(其余3个都可以.脂肪分解产物就是甘油和脂肪酸,脂肪分解都在小肠了,吸收难道还跑到大肠)1年前查看全部
大家在问
- 1——What do you think of the reference book?
- 2I will not go with you until the work( )finish
- 3Mom __(like)eating bananas ,but i like it ()中填什么
- 4已知点A(1,1)而且F1是椭圆x^2/9+y^2/5=1的左焦点,P是椭圆上任意一点,求|PF1|+|PA|的最大值和
- 5一道化学热量计算题管道煤气的主要成分是H2、CO和少量的甲烷.相应的热化学反应方程式为:2H2(g)+O2(g)=2H2
- 6已知:网格小正方形的边长为1,点A、点B在平面直角坐标系中的位置如图所示,将△AOB先沿x轴正方向平移3个单位,再沿y轴
- 7青奥与我同行 作文
- 8白桦树()地响,木杈()地晌,青蛙()地叫,啄木鸟()地啄,甲虫()地叫,河水()地流.
- 996-3.56-6.44 (简便计算)
- 10科学探究是奇妙的过程,某同学在进行实验探究时,向一种无色液体中加入一种白色块状固体,立即产生一种无色无味的气体。
- 11已知等差数列{an}的前n项和为Sn=(a+1)n2+a,某三角形三边之比为a2:a3:a4,则该三角形最大角为____
- 12流年·碎碎念 作文
- 13我按时到达了火车站用英语怎么说
- 14某炼油厂根据计划,每季度供应合同单位汽油15万吨、没有12万吨、重油12万吨.该厂从A、B两处运回
- 15关于“挑战”的作文400字
