50mL 0.6mol•L-1NaOH溶液,含NaOH的物质的量为( )
 zhangjianjian2022-10-04 11:39:543条回答
zhangjianjian2022-10-04 11:39:543条回答A. 0.03 mol
B. 0.04 mol
C. 0.05 mol
D. 0.06 mol

已提交,审核后显示!提交回复
共3条回复
 名称好难取啊 共回答了22个问题
名称好难取啊 共回答了22个问题 |采纳率81.8%- 解题思路:根据n=cV计算氢氧化钠的物质的量.
50mL0.6mol•L-1NaOH溶液,含NaOH的物质的量为0.05L×0.6mol/L=0.03mol,故选A.
点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的有关计算,比较基础,旨在考查学生对基础知识的理解掌握. - 1年前
 daisy741031 共回答了1345个问题
daisy741031 共回答了1345个问题 |采纳率- NAOH的物质的量=浓度X 体积=0.6X0.05=0.03mol
- 1年前
 爬网的猫 共回答了14个问题
爬网的猫 共回答了14个问题 |采纳率- n=cV=0.6mol/L * 0.05mL=0.03mol
- 1年前
相关推荐
- 在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol•L-1,若不考虑反应过程中溶液体积的变化,则10s内生成
在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol•L-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A. 0.02mol•L-1•min-1
B. 1.8mol•L-1•min-1
C. 0.18mol•L-1•min-1
D. 1.2mol•L-1•min-1 ifacku1年前1
ifacku1年前1 -
 亮亮97 共回答了18个问题
亮亮97 共回答了18个问题 |采纳率88.9%解题思路:根据v=[△c/△t]计算v(H2SO4),发生反应:2Al+3H2SO4=Al2(SO4)3+3H2↑,利用速率之比等于化学计量数之比计算v[Al2(SO4)3],注意单位换算.10s末硫酸的浓度减少了0.6mol•L-1,则v(H2SO4)=[0.6mol/L/10s]=0.06mol/(L.s),
发生反应:2Al+3H2SO4=Al2(SO4)3+3H2↑,速率之比等于化学计量数之比,故v[Al2(SO4)3]=[1/3].v(H2SO4)=[1/3]×0.06mol/(L.s)=0.02mol/(L.s),
即v[Al2(SO4)3]=0.02mol/(L.s)=1.2mol/(L.min),
故选D.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 本题考查化学反应速率的有关计算,比较基础,注意对速率定义式及化学反应速率规律的理解.1年前查看全部
- 反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol•L-1,对此反应速率的表示,正确
反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol•L-1,对此反应速率的表示,正确的是( )
A.用A表示的反应速率为0.4 mol•L-1•min-1
B.分别用B、C、D表示的反应速率其比值为1:2:3
C.在2 min末的反应速率,用B表示是0.3 mol•L-1•min-1
D.在这2 min内用B和C表示的反应速率都是逐渐减小的 lanapper1年前1
lanapper1年前1 -
 周六皮 共回答了24个问题
周六皮 共回答了24个问题 |采纳率87.5%解题思路:A、A为固体,浓度不变,不能用单位时间内浓度变化量表示反应速率;
B、速率之比等于化学计量数之比;
C、2min内,B的浓度减少0.6mol/L,用B表示的2min内平均速率是0.3 mol•L-1•min-1;
D、随反应进行反应物的浓度降低,反应速率减慢,生成物的浓度变化量逐渐减少.A、A为固体,浓度不变,不能用单位时间内浓度变化量表示反应速率,故A错误;
B、速率之比等于化学计量数之比,用B、C、D表示的反应速率其比值为3:2:1,故B错误;
C、2min内,B的浓度减少0.6mol/L,用B表示的2min内平均速率是0.3 mol•L-1•min-1,不是2min末的即时速率,故C错误;
D、随反应进行反应物的浓度降低,反应速率减慢,生成物的浓度变化量逐渐减少,故2 min内用B和C表示的反应速率都是逐渐减小,故D正确;
故选D.点评:
本题考点: 化学反应速率和化学计量数的关系.
考点点评: 本题考查化学反应速率的有关问题,注意固体或纯液体的浓度一般视为常数,故增加或减少固体或纯液体的量,化学反应速率不变,一般也不用固体或纯液体来表示反应速,化学反应速率为一段时间内平均速率,不是即时速率.1年前查看全部
- 500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=0.6mol•L-1,用石墨作电极电解此溶液
500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=0.6mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是( )
A.原混合溶液中c(K+)为0.2 mol•L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol•L-1 月下空想忆1年前1
月下空想忆1年前1 -
 征婚交友2 共回答了17个问题
征婚交友2 共回答了17个问题 |采纳率94.1%解题思路:电解硝酸钾和硝酸铜混合溶液时,阳极上氢氧根离子放电生成氧气,阴极上先铜离子放电生成铜单质,当铜离子完全析出时,氢离子放电生成氢气,根据得失电子守恒计算铜的物质的量,再结合电荷守恒计算钾离子的浓度,据此分析解答.电解硝酸钾和硝酸铜混合溶液时,阳极上氢氧根离子放电生成氧气,阴极上先铜离子放电生成铜单质,当铜离子完全析出时,氢离子放电生成氢气,气体的物质的量=[2.24L/22.4L/mol]=0.1mol;
每生成1mol氧气转移4mol电子,每生成1mol氢气转移2mol电子,每生成1mol铜转移2mol电子,
所以根据转移电子守恒得铜的物质的量=[0.1mol×4−0.1mol×2/2]=0.1mol,
则铜离子的物质的量浓度=[0.1mol/0.5L]=0.2mol/L,
根据电荷守恒得钾离子浓度=0.6mol•L-1-0.2mol/L×2=0.2mol/L,
A.根据分析知,原混合溶液中c(K+)为0.2 mol•L-1,故A正确;
B.转移电子的物质的量=0.1mol×4=0.4mol,故B错误;
C.根据以上分析知,铜的物质的量为0.1mol,故C错误;
D.当电解硝酸铜时溶液中生成氢离子,当电解硝酸钾溶液时,实际上是电解水,所以电解后氢离子的物质的量为氧气的4倍,为0.1mol×4=0.4mol,则氢离子浓度=[0.4mol/0.5L]=0.8mol/L,故D错误;
故选:A.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,明确离子放电顺序是解本题关键,结合转移电子守恒、电荷守恒来分析解答,难度中等.1年前查看全部
- 反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol•L-1,对此反应速率的表示,正确
反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol•L-1,对此反应速率的表示,正确的是( )
A.A的浓度减少了0.8mol•L-1
B.分别用B、C、D表示的反应速率其比值为1:1:1
C.在2min末的反应速率,用B表示是0.3mol•L-1•min-1
D.在这2min内用B和C表示的反应速率都是逐渐减小的 sy_20071年前1
sy_20071年前1 -
 熊人黑三 共回答了19个问题
熊人黑三 共回答了19个问题 |采纳率89.5%解题思路:A.根据变化的浓度之比等于化学计量数之比;
B.速率之比等于化学计量数之比;
C.2min内,B的浓度减少0.6mol/L,用B表示的2min内平均速率是0.3 mol•L-1•min-1;
D.随反应进行反应物的浓度降低,反应速率减慢,生成物的浓度变化量逐渐减少.A.变化的浓度之比等于化学计量数之比,所以经2min,B的浓度减少0.6mol•L-1,A的浓度减少了0.8mol•L-1,故A正确;
B.速率之比等于化学计量数之比,用B、C、D表示的反应速率其比值为3:2:1,故B错误;
C.2min内,B的浓度减少0.6mol/L,用B表示的2min内平均速率是0.3 mol•L-1•min-1,不是2min末的即时速率,故C错误;
D.随反应进行反应物的浓度降低,反应速率减慢,生成物的浓度变化量逐渐减少,故2min内用B和C表示的反应速率都是逐渐减小,故D正确;
故选AD.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 本题考查化学反应速率的计算与影响因素等,注意变化的浓度之比等于化学计量数之比等于速率之比,化学反应速率为一段时间内平均速率,不是即时速率.1年前查看全部
- (2012•崇明县二模)一定量的氢气在氯气中燃烧,所得混合物冷却后用500mL 0.6mol•L-1的NaOH溶液恰好完
(2012•崇明县二模)一定量的氢气在氯气中燃烧,所得混合物冷却后用500mL 0.6mol•L-1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,参加反应的氢气和所用氯气的物质的量之比为( )
A.3:1
B.3:2
C.2:3
D.3:4 axddax1年前1
axddax1年前1 -
 wach5928 共回答了20个问题
wach5928 共回答了20个问题 |采纳率95%解题思路:氢气与氯气反应,用NaOH吸收气体,所得的溶液中含有NaClO,故氢气与氯气反应,氯气有剩余,根据电子转移守恒计算氯气与氢氧化钠反应生成NaCl,根据钠离子守恒,溶液中n(NaOH)=n(NaCl)+n(NaClO),据此计算溶液中n(NaCl),进而计算HCl与NaOH反应生成的NaCl,再根据H原子守恒计算n(H2),根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO),故2n(Cl2)=n(NaOH),据此计算解答.溶液中含有NaClO的物质的量为0.05mol,故氯气与氢氧化钠反应生成NaCl的物质的量为[0.05mol×1/1]=0.05mol,根据钠离子守恒,溶液中n(NaOH)=n(NaCl)+n(NaClO)=0.5L×0.6mol/L=0.3mol,故溶液中n(NaCl)=0.3mol-0.05mol=0.25mol,故HCl与NaOH反应生成的NaCl的物质的量为0.25mol-0.05mol=0.2mol,故n(HCl)=0.2mol,故n(H2)=[0.2mol/2]=0.1mol,氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO),故2n(Cl2)=n(NaOH)=0.3mol,所以n(Cl2)=0.15mol,故参加反应的氢气和所用氯气的物质的量之比为0.1mol:0.15mol=2:3,
故选:C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,难度中等,清楚发生的反应是关键,注意利用守恒法进行计算,可以简化计算.1年前查看全部
- 用0.6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为
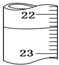 用0.6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
用0.6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
A.22.30 mL
B.23.65 mL
C.22.35 mL
D.23.70 mL gracerose8631年前1
gracerose8631年前1 -
 小鹿8058 共回答了17个问题
小鹿8058 共回答了17个问题 |采纳率94.1%解题思路:根据滴定管的结构和精确度以及测量的原理分析.滴定管的零刻度在上面,滴定管中的液面读数为22.35mL,故选C.
点评:
本题考点: 计量仪器及使用方法;中和滴定.
考点点评: 本题考查滴定管的示数,难度不大,注意知识的积累.1年前查看全部
- 硫酸钾、硫酸铝和硫酸的混合溶液中,其pH=1,c(Al3+)=0.3mol•L-1,c(SO42-)=0.6mol•L-
硫酸钾、硫酸铝和硫酸的混合溶液中,其pH=1,c(Al3+)=0.3mol•L-1,c(SO42-)=0.6mol•L-1,则c(K+)为( )
A.0.15mol•L-1
B.0.2mol•L-1
C.0.3mol•L-1
D.0.4mol•L-1 残存的良知1年前1
残存的良知1年前1 -
 武术人生 共回答了19个问题
武术人生 共回答了19个问题 |采纳率73.7%解题思路:混合溶液pH=1,则c(H+)=0.1mol/L,根据电荷守恒有c(H+)+3c(Al3+)+c(K+)=2c(SO42-),据此计算c(K+).混合溶液pH=1,则c(H+)=0.1mol/L,且c(Al3+)=0.3mol•L-1,c(SO42-)=0.6mol•L-1,
根据电荷守恒有c(H+)+3c(Al3+)+c(K+)=2c(SO42-),
故c(K+)=2c(SO42-)-c(H+)+3c(Al3+)=2×0.6mol/L-0.1mol/L-3×0.3mol/L=0.2mol/L,
故选B.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的有关计算,难度不大,电解质混合溶液中经常利用电荷守恒进行离子浓度计算.1年前查看全部
- 将0.5L 0.1mol•L-1Fe2(SO4)3溶液与1L0.6mol•L-1氨水溶液完全混合并过滤,溶液总体积不变,
将0.5L 0.1mol•L-1Fe2(SO4)3溶液与1L0.6mol•L-1氨水溶液完全混合并过滤,溶液总体积不变,则所得溶液的pH与下列选项符合的是( )
A.等于0.3mol•L-1氨水溶液的pH
B.等于0.2mol•L-1氨水溶液的pH
C.大于0.3mol•L-1氨水溶液的pH
D.小于0.2mol•L-1氨水溶液的pH 我爱胖胖8151年前1
我爱胖胖8151年前1 -
 我是锦绣 共回答了23个问题
我是锦绣 共回答了23个问题 |采纳率95.7%解题思路:两溶液混合后,发生反应Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,0.5L 0.1mol•L-1Fe2(SO4)3溶液中n(Fe3+)=2×0.5L×0.1mol•L-1=0.1mol,1L0.6mol•L-1氨水中n(NH3)=1L×0.6mol•L-1=0.6mol,由方程式可知氨水有剩余,反应后溶液为氨水、硫酸铵的混合溶液,计算混合液中氨水的浓度,硫酸铵抑制氨水的电离,据此解答.两溶液混合后,发生反应Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,0.5L 0.1mol•L-1Fe2(SO4)3溶液中n(Fe3+)=2×0.5L×0.1mol•L-1=0.1mol,1L0.6mol•L-1氨水中n(NH3)=1L×0.6mol•L-1=0.6mol,由方程式可知,0.1molFe3+完全反应,消耗0.3molNH3,剩余0.3molNH3,反应后溶液为氨水、硫酸铵的混合溶液,氨水的浓度为[0.3mol/1.5L]=0.2mol/L,硫酸铵抑制氨水的电离,故混合溶液的pH值小于0.2mol•L-1氨水溶液的pH值,
故选D.点评:
本题考点: pH的简单计算.
考点点评: 本题考查溶液pH值的判断、电离平衡等,难度中等,注意铵根离子抑制一水合氨的电离是主要因素,硫酸铵水解呈酸性是次要因素.1年前查看全部
- 在2A(g)+B(g)⇌3C(g)+4D(g)反应中,B的物质的量浓度2S内由1.1mol•L下降至0.6mol•L,下
在2A(g)+B(g)⇌3C(g)+4D(g)反应中,B的物质的量浓度2S内由1.1mol•L下降至0.6mol•L,下列各物质的反应速率中正确的是( )
A.v(A)=0.5 mol•L-1•s-1
B.v(B)=0.3 mol•L-1•s-1
C.v(C)=0.8 mol•L-1•s-1
D.v(D)=1 mol•L-1•s-1 沧海风月1年前1
沧海风月1年前1 -
 云丹rr 共回答了15个问题
云丹rr 共回答了15个问题 |采纳率86.7%解题思路:根据v=[△c/△t]计算v(B),再根据速率之比等于化学计量数之比计算v(A)、v(C)、v(D).B的物质的量浓度2S内由1.1mol•L下降至0.6mol•L,则v(B)=[1.1mol/L−0.6mol/L/2s]=0.25mol/(L•s),
A.v(A)=2v(B)=2×0.25mol/(L•s)=0.5mol/(L•s),故A正确;
B.v(B)=0.25mol/(L•s),故B错误;
C.v(C)=3v(B)=3×0.25mol/(L•s)=0.75mol/(L•s),故C错误;
D.v(D)=4v(B)=4×0.25mol/(L•s)=1mol/(L•s),故D正确;
故选AD.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 本题考查化学反应速率的计算,难度较小,化学反应速率计算可用定义法,也可用化学计量数法,本题两种方法同时运用,根据情况选择合适的方法.1年前查看全部
- 把7.4gNaHCO3和Na2CO3•10H2O的混合物溶于水制成100mL溶液,其中Na+浓度为0.6mol•L-1,
把7.4gNaHCO3和Na2CO3•10H2O的混合物溶于水制成100mL溶液,其中Na+浓度为0.6mol•L-1,若把这种混合物加热至恒重时,其质量应减少______.
 绿洲之星1年前1
绿洲之星1年前1 -
 lym_7_124 共回答了17个问题
lym_7_124 共回答了17个问题 |采纳率94.1%解题思路:碳酸氢钠受热分解成碳酸钠、氧气和水,Na2CO3•10H2O加热失去结晶水变成碳酸钠,所以固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体Na2CO3的物质的量,进而计算Na2CO3质量,总质量减去碳酸钠的质量即为减少的质量.100mL溶液中c(Na+)=0.6mol/L,则n(Na+)=0.1L×0.6mol/L=0.06mol,固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒可知n(Na2CO3)=[1/2]n(Na+)=0.03mol,则m(Na2CO3)=0.03mol×106g/mol=3.18g,故固体混合物加热到质量不变为止,减少的质量为7.4g-3.18g=4.22g;
故答案为:4.22g.点评:
本题考点: 钠的重要化合物;化学方程式的有关计算.
考点点评: 本题考查混合物的计算,难度不大,明确碳酸氢钠和十水碳酸钠加热分解得到的产物是解题关键,注意依据钠元素质量守恒进行计算.1年前查看全部
- 4A(s)+3B(g)═2C(g)+D(g),经2min后B的浓度减少0.6mol•L-1.对此反应速率的表示正确的是(
4A(s)+3B(g)═2C(g)+D(g),经2min后B的浓度减少0.6mol•L-1.对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4mol•L-1•min-1
B.分别用B、C、D表示反应速率,其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3mol•L-1•min-1
D.在2min内的反应速率,用C表示是0.3mol•L-1•min-1 linyibo991年前1
linyibo991年前1 -
 qq304696110 共回答了24个问题
qq304696110 共回答了24个问题 |采纳率83.3%解题思路:A.化学反应速率表示单位时间内浓度的变化量,固体或纯液体的浓度一般视为常数,一般也不用固体或纯液体来表示反应速;
B.不同物质表示的速率之比等于其化学计量数之比;
C.化学反应速率为一段时间内平均速率,不是即时速率;
D.浓度变化量之比等于其化学计量数之比,据此计算△c(C),再根据v=[△c/△t]计算v(C).A.物质A是固体,浓度不变,不能用A表示该反应的反应速率,故A错误;
B.不同物质表示的速率之比等于其化学计量数之比,则v(B):v(C):v(D)=3:2:1,故B正确;
C.2min末的反应速率为即时速率,用B表示速率0.3mol/(L∙min),是2min内的平均速率,故C错误;
D.2min内△c(C)=[2/3]△c(B)=0.4mol/L,故2min内的v(C)=[0.4mol/L/2min]=0.2mol•L-1•min-1,故D错误.
故选B.点评:
本题考点: 化学反应速率和化学计量数的关系.
考点点评: 本题考查对化学反应速率的理解及有关计算,难度不大,注意固体或纯液体的浓度一般视为常数,故增加或减少固体或纯液体的量,化学反应速率不变,一般也不用固体或纯液体来表示反应速,化学反应速率为一段时间内平均速率,不是即时速率.1年前查看全部
- 在一密闭容器中,可逆反应:aA(g)+bB(g)⇌cC(g)达平衡后,测得此时C的浓度为0.6mol•L-1若保持温度不
在一密闭容器中,可逆反应:aA(g)+bB(g)⇌cC(g)达平衡后,测得此时C的浓度为0.6mol•L-1若保持温度不变,将容器的容积压缩为原来的一半,当重新达平衡后,C的浓度是0.8mol•L-1下列说法正确的是( )
A.物质A的转化率增大了
B.平衡向正反应方向移动
C.物质c的质量分数增加了
D.a+b<c 贴身管家1年前1
贴身管家1年前1 -
 bb821120 共回答了19个问题
bb821120 共回答了19个问题 |采纳率100%解题思路:假定平衡不移动,将气体体积压缩到原来的一半,C的浓度为1.2mol/L,实际达到新平衡后,C的浓度为0.8mol/L<1.2mol/L,说明压强增大,平衡向逆反应移动,则a+b<c,A的转化率减小,据此结合选项解答.假定平衡不移动,将气体体积压缩到原来的一半,C的浓度为1.2mol/L,实际达到新平衡后,C的浓度为0.8mol/L<1.2mol/L,说明压强增大,平衡向逆反应移动,
A.平衡向逆反应移动,A的转化率减小,故A错误;
B.由上述分析可知,平衡向逆反应方向移动,故B错误;
C.平衡向逆反应方向移动,混合气体总质量不变、C的质量减小,故C的质量分数减小,故C错误;
D.压强增大,平衡向逆反应移动,故a+b<c,故D正确,
故选:D.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查化学平衡的影响因素,难度不大,根据C的浓度变化判断平衡移动方向是解题的关键.1年前查看全部
- 一定量的氢气在氯气中燃烧,所得混合物冷却后用500mL 0.6mol•L-1的NaOH溶液恰好完全吸收,测得溶液中含有N
一定量的氢气在氯气中燃烧,所得混合物冷却后用500mL 0.6mol•L-1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,参加反应的氢气和所用氯气的物质的量之比为( )
A. 3:1
B. 3:2
C. 2:3
D. 3:4 46除以21年前1
46除以21年前1 -
 kcb11 共回答了14个问题
kcb11 共回答了14个问题 |采纳率92.9%解题思路:氢气与氯气反应,用NaOH吸收气体,所得的溶液中含有NaClO,故氢气与氯气反应,氯气有剩余,根据电子转移守恒计算氯气与氢氧化钠反应生成NaCl,根据钠离子守恒,溶液中n(NaOH)=n(NaCl)+n(NaClO),据此计算溶液中n(NaCl),进而计算HCl与NaOH反应生成的NaCl,再根据H原子守恒计算n(H2),根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO),故2n(Cl2)=n(NaOH),据此计算解答.溶液中含有NaClO的物质的量为0.05mol,故氯气与氢氧化钠反应生成NaCl的物质的量为[0.05mol×1/1]=0.05mol,根据钠离子守恒,溶液中n(NaOH)=n(NaCl)+n(NaClO)=0.5L×0.6mol/L=0.3mol,故溶液中n(NaCl)=0.3mol-0.05mol=0.25mol,故HCl与NaOH反应生成的NaCl的物质的量为0.25mol-0.05mol=0.2mol,故n(HCl)=0.2mol,故n(H2)=[0.2mol/2]=0.1mol,氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO),故2n(Cl2)=n(NaOH)=0.3mol,所以n(Cl2)=0.15mol,故参加反应的氢气和所用氯气的物质的量之比为0.1mol:0.15mol=2:3,
故选:C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,难度中等,清楚发生的反应是关键,注意利用守恒法进行计算,可以简化计算.1年前查看全部
大家在问
- 1一头用绳子栓着鼻子的牛,栓牛的绳子长4m,另一端被个顶的房子一脚的“o”房子长8m,
- 2《桃花源记》→用简洁的文字写出“渔人”的行踪.
- 3Short Tons 在一个数据图上看到的有关煤炭产量的short tons 翻译成美吨还是翻译成短期产量阿?
- 4请问“起始”和“启始”都分别是什么意思?在可以互换使用吗?
- 5苹果.梨.桔子共500千克,苹果和梨的比是3比2,桔子是梨的8分之5.桔子比梨少多少千克
- 6红磷和氧气产生化学反应生成五氧化二磷后,因为氧气被消耗,所以集气瓶内压强减小,水才会从导管另一头被吸至集气瓶内,约占瓶子
- 7怎么改间接叙述句这位父亲心中只有一个念头:“儿子在等着我!”改间接叙述句
- 8用动物特征来比喻某种人的三字格短语
- 9古代著名诗人王之涣的诗句:“羌笛何须怨杨柳,春风不度玉门关.”其中“春风”指的是
- 10_______ have taken place in our country. [
- 11take the bus,by bus有什么区别'在句子中的位置,英语,需要自己写!
- 12我和书的故事 作文
- 13(2013•黄州区模拟)下列材料表示是为植物生命活动受多种植物激素调节的作用机理及示意图.
- 14是第四道 《人与自然》这篇文章的第一道.
- 15(2014•白云区一模)平行四边形的对角线( )
