主族非金属元素是不是原子的氧化性越强,其阴离子的还原性就越强
 silder19802022-10-04 11:39:541条回答
silder19802022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 飞雪少爷 共回答了15个问题
飞雪少爷 共回答了15个问题 |采纳率93.3%- 不是的 单质的氧化性越强 对应阴离子的还原性越弱.
例如Cl2氧化性强 Cl-还原性弱 - 1年前
相关推荐
- A.B.C.D.E.F都是短周期元素,原子序数依次增大,A.B处于同一周期,B.F.处于同一主族,
A.B.C.D.E.F都是短周期元素,原子序数依次增大,A.B处于同一周期,B.F.处于同一主族,
A.B.C.D.E.F都是短周期元素,原子序数依次增大,A.B处于同一周期,B.F.处于同一主族,C.B可按原子个数比2:1和1:1分别行成两种离子化合物甲和乙,A原子的最外层电子数比次外层电子层多3个,E是地壳中含量最高的金属元素.G是用量最大的金属. (题目) 问题 A元素周期表中的位置 乙的电子式 A.B.C.D.E.F五种元素的原子半径由小到大的是(用元素符号填)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式 写出一个单质E高温下生成单质G的化学方程式B和F的氢化物沸点较高的是, 主要原因是什么 jordan07111年前6
jordan07111年前6 -
 ad666123 共回答了20个问题
ad666123 共回答了20个问题 |采纳率90%第二周期ⅤA
乙是Na2O2,电子式打不出来,自己点上点儿就行了
O、N、S、Al、Mg、Na
2Al + 2OH- + 2H2O = 2Al3+ + 3H2↑
2Al + Fe2O3 =(高温) Al2O3 + 2Fe
H2O;分子间有氢键1年前查看全部
- 为什么同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱?
为什么同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱?
而同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强; 蠢就一个字1年前3
蠢就一个字1年前3 -
 bigger_369852 共回答了14个问题
bigger_369852 共回答了14个问题 |采纳率92.9%主要考虑和氢元素结合的能力,非金属性越强,和氢结合的越紧密,不容易电离出氢离子
这种表现以卤族元素最为典型
氟非金属性最强,氟化氢水溶液(氢氟酸)中电解出的氢离子少,其余是以氟化氢分子存在,所以是弱酸
氯的非金属性较氟弱的多,氯化氢水溶液中,基本没有氯化氢分子,几乎全部是氢离子和氯离子,所以它是强酸
类推到碘,碘的非金属性最差,和氢结合的松散,受热,光照均会分解,所以其水溶液中氢离子最多,酸性也最强.
不同主族,不符合此规律1年前查看全部
- 同族元素原子的最外层电子数一定相同这句话为什么是错的?一定要是同主族的么.
同族元素原子的最外层电子数一定相同这句话为什么是错的?一定要是同主族的么.
为什么VIII族和同副族元素原子的最外层电子数一定相同这句话不对?39号元素电子排布不是2 8 18 11 这样子排么?22号元素2 8 8 4 40号元素2 8 18 8 4最外层电子不都是4个么? 玻璃星心1年前2
玻璃星心1年前2 -
 meteoric 共回答了18个问题
meteoric 共回答了18个问题 |采纳率94.4%你没看到特例
VIII B族中的Ni族,Ni是2,8,16,2;Pd是2,8,18,18;Pt是2,8,18,32,17,1,同族三个元素最外层电子数都不一样1年前查看全部
- 元素周期表同主族同周期元素性质递变规律和元素周期律的内容及实质是什么?
 咸菜691年前1
咸菜691年前1 -
 玄水 共回答了24个问题
玄水 共回答了24个问题 |采纳率83.3%同周期元素,从左至右金属性递减,非金属性递增.同主族元素从上之下金属性逐渐增强,非金属性逐渐渐弱1年前查看全部
- 下列叙述中正确的( )A. 同周期中,ⅦA族元素的原子半径最大B. 周期表中元素除了主族就是副族C. ⅥA族元素的原子
下列叙述中正确的( )
A. 同周期中,ⅦA族元素的原子半径最大
B. 周期表中元素除了主族就是副族
C. ⅥA族元素的原子,其半径越大,越容易得到电子
D. 元素周期表中从ⅢB族到ⅡB族这10个纵列的元素都是金属元素 lgz_qq1年前1
lgz_qq1年前1 -
 乖十一 共回答了14个问题
乖十一 共回答了14个问题 |采纳率92.9%解题思路:A.同周期自左而右原子半径减小;
B.元素周期表包含主族、副族、零族、第Ⅷ族;
C.同主族自上而下原子半径增大,失去电子能力增强;
D.过渡元素都是金属元素.A.同周期自左而右原子半径减小,同周期中,ⅦA族元素的原子半径最小,故A错误;
B.元素周期表包含7个主族、7个副族、1个零族、1个第Ⅷ族,故B错误;
C.同主族自上而下原子半径增大,原子核对核外电子吸引能力减弱,得电子能力减弱,失去电子能力增强,故C错误;
D.元素周期表中从ⅢB族到ⅡB族这10个纵列为过渡元素,都是金属元素,故D正确,
故选D.点评:
本题考点: 元素周期表的结构及其应用;元素周期律的作用.
考点点评: 本题考查元素周期表与元素周期律,比较基础,注意整体把握元素周期表的结构、理解元素周期律.1年前查看全部
- 为什么元素周期表第二主族后是第三副族而不是第一副族拜托各位大神
 冬天稻草人1年前1
冬天稻草人1年前1 -
 巍巍的宝宝 共回答了21个问题
巍巍的宝宝 共回答了21个问题 |采纳率81%这是核外电子排布规律所决定的1年前查看全部
- X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少1.下列说法正确的是( )
A. 元素非金属性由弱到强的顺序为X<Y<Z
B. Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C. 3种元素的气态氢化物中,Z的气态氢化物最稳定
D. 原子半径由大到小的顺序为Z>Y>X hdljason1年前1
hdljason1年前1 -
 phoebeym 共回答了20个问题
phoebeym 共回答了20个问题 |采纳率75%解题思路:X、Y、Z是3种短周期元素,X原子的最外层电子数是其电子层数的3倍,则X有2个电子层,最外层电子数为6,故X为氧元素;X、Y位于同一族,故Y为硫元素;Y、Z处于同一周期,Z原子的核外电子数比Y少1,则Z原子的核外电子数为15,故Z为磷元素,结合元素周期律解答.X、Y、Z是3种短周期元素,X原子的最外层电子数是其电子层数的3倍,则X有2个电子层,最外层电子数为6,故X为氧元素;X、Y位于同一族,故Y为硫元素;Y、Z处于同一周期,Z原子的核外电子数比Y少1,则Z原子的核外电子数为15,故Z为磷元素,
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,所以非金属性P<S<O,即Z<Y<X,故A错误;
B.Y为硫元素,最高价氧化物对应水化物的化学式可表示为H2SO4,故B错误;
C.非金属性P<S<O,非金属性越强,氢化物越稳定,所以氢化物稳定性Z<Y<X,故C错误;
D.同周期自左而右原子半径减小,同主族自上而下原子半径增大,所以原子半径P>S>O,即Z>Y>X,故D正确,
故选D.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查结构与位置关系、元素周期律等,难度不大,推断元素是关键,突破口为X原子的最外层电子数是其电子层数的3倍,注意对元素周期律的掌握.1年前查看全部
- 有人提出H放在元素周期表第四主族的原因
有人提出H放在元素周期表第四主族的原因
H在元素周期中排钟第一主族,也有人提出排在第七主族或第三主族 lqq19791年前1
lqq19791年前1 -
 ee进城 共回答了20个问题
ee进城 共回答了20个问题 |采纳率100%最高正价与最低负价的绝对值相等1年前查看全部
- 元素周期表中第一主族可以说是第一族吗?
 小猪和gg兔1年前3
小猪和gg兔1年前3 -
 cym015 共回答了21个问题
cym015 共回答了21个问题 |采纳率81%解析:
必然不可以,第Ⅰ主族(ⅠA族),所含元素:H,Li,Na,K,Rb,Cs,Fr
其中H元素属于非金属元素,有正价也有负价,而其余6种都是金属,只有正价,它们对应的氧化物的水化物都呈强碱性,所以称为碱金属.
而同时还存在 第Ⅰ副族(ⅠB族),所含元素:Cu,Ag,Au
他们在化学性质上截然不同,不能归为一类.1年前查看全部
- 1、写出25元素基态原子的电子排布式指出它属于第几周期、第几族?主族还是副族?核外有多少个成单电子?
1、写出25元素基态原子的电子排布式指出它属于第几周期、第几族?主族还是副族?核外有多少个成单电子?
2、应用Le Chatelier原理预测下列平衡在改变平衡条件时,反应(该反应位吸热反应)的移动方向.
AgCl(s)+2CN-(aq)≈[Ag (CN)2] -(aq)+Cl(aq)△Hm=+21kl•mol-1
(1)加入NaCN(s)时,反应的移动方向.
(2)降低体系温度时,反应的移动方向.
3、判断下列各组分子之间存在何种形式的分子间的作用力,如有氢键请指出是分子间氢键还是分子内氢键.
(1)CO2和CCl4;
(2)NH3与N2;
(3)H2O与H2O.
4、HAc—NaAc为例说明缓冲溶液的缓冲作用机理.
5、根据杂化轨道理论指出下列分子的空间构型及杂化类型.
CH3Cl
NH3
BBR3
能回答几题都可以, 只想活到三十岁1年前2
只想活到三十岁1年前2 -
 黄朝斌 共回答了15个问题
黄朝斌 共回答了15个问题 |采纳率100%1、锰Mn 1s2 2s2 2p6 3s2 3p6 3d5 4s2
属于第四周期,第四副族
核外有25个成单电子
2、1)加入了CN-,则反应向正反应方向移动
2)降低体系温度时,反应向逆反应方向移动
3、1)范德华力
2)范德华力
3)氢键 水是分子间氢键
4、在缓冲溶液中的质子转移平衡及其大量Ac-(来自NaAc)存在而引起平衡移动的总结果可用下式表示
HAc+H2O H3O+ + Ac-
NaAc Na+ + Ac-
由上式可知,在HAc-NaAc缓冲溶液中,存在大量的HAc和Ac-,且二者是以质子转移平衡互相联系存在于溶液中,当在该溶液中加入少量强酸时,Ac-(抗酸成分)与H3O+结合生成HAc,使上述平衡向左移动.当在该溶液中加入少量强碱时,H3O+(由抗碱成分HAc解离)与OH-结合生成H2O,使上述平衡向右移动.当该溶液稍加稀释时,HAc解离度增大,上述平衡向右移动.因此,缓冲溶液中的pH值不至于因外加少量强酸、强碱,或稍加稀释而发生明显的改变.
5、1)正四面体 不等性杂化
不等性,因为Cl原子和H原子不一样,所以使得中心原子的4个sp3杂化轨道中有一个和其它3个有差异.只有CH4、CCl3、BF3等价层电子对完全等效的分子才是等性杂化.等性与否不是只看有没有孤对电子.即使都是成键电子对,如CH3Cl中,由于这4对成键电子对的性质不完全一样,有一个即Cl的那个和其他3个不同,也是不等性的.
2)三角锥 由上,等性杂化
3)平面 等性杂化1年前查看全部
- 甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A. X+2
B. X+4
C. X+8
D. X+18 susan_lzy1年前8
susan_lzy1年前8 -
 超级可爱吉娃娃 共回答了22个问题
超级可爱吉娃娃 共回答了22个问题 |采纳率86.4%解题思路:由元素周期表结构,对于处于ⅠA、ⅡA元素而言,不同周期相邻主族的元素的原子序数差值不同,对于处于其他主族元素而言,不同周期相邻主族的元素的原子序数差值也不同.由元素周期表结构可知,对于处于同一主族不同周期的元素,原子序数相差可能为2、8、18、32等,不可能相差4.
故选B.点评:
本题考点: 元素周期表的结构及其应用.
考点点评: 本题考查学生元素周期表的结构知识,可以根据所学内容来回答,难度不大.1年前查看全部
- 元素X,Y,Z原子序数之和为36,Y,Z同一周期,X,Z同一主族,X最外层电子数是Y最外层电子数的3倍,XYZ是?
 厕所里的大象1年前2
厕所里的大象1年前2 -
 期待着美丽的一天 共回答了22个问题
期待着美丽的一天 共回答了22个问题 |采纳率100%首先大致确定3个元素的位置.显然x最外层电子要么是3要么是6,假如x是B的话,z不能为H,因为这样Y就没了;那么如果z为Al,y为Na,加起来为29,不够.
这样把x稍稍后挪就行,取x为o,那么z为s,y为Mg,加起来刚好为36.1年前查看全部
- 有人建议把H元素排在元素周期表的7主族.下列事实能支持这观点的是1.H原子得到一个电子就可以达到稳定状态2.H分子的结构
有人建议把H元素排在元素周期表的7主族.下列事实能支持这观点的是1.H原子得到一个电子就可以达到稳定状态2.H分子的结构式为H-H3.与碱金属元素形成离子化合物M+〔:H〕-.4.分子中原子间的化学键都属于非极性键
 liuliu012011年前1
liuliu012011年前1 -
 hyfdlong 共回答了22个问题
hyfdlong 共回答了22个问题 |采纳率86.4%答案是1
因为第七主族的元素最外层有七个电子,得一个电子后达到8电子稳定状态.
2:氧气的分子式是o-o,第六主族元素,因此不能说.H分子的结构式为H-H所以就加到第七主族去.
答案三解释的是H为什么放在第一主族.
4简直荒谬,氧分子之间也是非极性键,元素的位置和分子的极性毫无关系.1年前查看全部
- A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D最外层
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D最外层电子数之比为2:3。试回答下列问题:
(1)E元素在周期表中的位置是_____________;
(2)已知101KPa时,A单质的燃烧热为285.8kJ/mol,请写出A单质完全燃烧生成液态水时的热化学方程式:___________________;
(3)E单质在足量D单质中燃烧生成的化合物的电子式是_____________;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于________化合物(填“离子”或“共价”):
②X与Y的水溶液相混合发生反应的离子方程式为__________________;
(5)化合物E 2 F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为:__________________________。 νolīn1年前0
νolīn1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- ABCD为短周期元素,原子序数依次增大,AC及BD分别是同一主族,B、D两元素的原子核中质子数之和是A、C两元素的原子核
ABCD为短周期元素,原子序数依次增大,AC及BD分别是同一主族,B、D两元素的原子核中质子数之和是A、C两元素的原子核中质子数之和的两倍.四种元素单质中有两种气体、两种固体,ABCD各是什么元素?
跟我的结果一样,但下面有一小问说ABD可形成18电子和10电子的两种微粒,Ne、He、Na怎么形成微粒啊 魔女0491年前3
魔女0491年前3 -
 被溅起的水花 共回答了16个问题
被溅起的水花 共回答了16个问题 |采纳率87.5%因为ABCD为短周期元素,原子序数依次增大,AC及BD分别是同一主族
所以设A有x个质子所以C有x+8个质子.B有y个质子,D就有y+8个质子.
所以根据B、D两元素的原子核中质子数之和是A、C两元素的原子核中质子数之和的两倍
所以有等式2*(x+x+8)=y+y+8
解得2x+4=y x3时y为第3周期元素,那么D就是第4周期的元素了和题目不符
分别把x=1,2,3 代入原方程.
当X=1时 有 A:H B: C C: F D:Si AC不同主族 舍去
当x=2时 有A:He B: O C: Ne D:S 有3种气体了 所以舍去
当x=3时,有A:Li B: He C: Na D:Ne 完全符合
所以A:Li B: He C: Na D:Ne
这样子是吗,那你给的条件还不齐,
所以根据你给的条件
形成ABD可形成18电子和10电子的两种微粒
那肯定不能是稀有气体元素了
根据我们做过那么多题,10电子的微粒常见的有CH4 NH3 H2O HF 当然还有一些离子.18电子的微粒有HCl H2S PH3 H2O2这些分子
在这里面找出共同点, 那就是H
所以肯定有H 和H同一主族的还有Li Na 如果是Li的话 你再去分析一下 发现他们质子数的2倍是8,那么肯定不行了.所以就只能是Na
那么11+3=14 14*2=28
你已经有1种气体和一种固体了 所以你还缺少一种气体和一种固体
那么就只有N族元素和O族元素可以选了
最后算出的肯定是O和S
因为你没给出下一问嘛,所以就直接这样设了(当时也没想那么多)
因为这个比较特殊
根据题目可以知道ABCD的位置
A B
C D
或者
A
B
C D
第一个就是一开始求的了
第2个 一看就看出来了
A是在第一周期,况且右边还有元素 那么肯定不可能是He了
所以A :H C:Na
再根据要求你就可以推出(1+11)*2=x+x+8 x=8
那么进而求出B:O D;S
有时候做题就是这样的,可以从后面的问题得到一些关于前面题目的信息.1年前查看全部
- 居里夫人发现了放射性元素镭(Ra),因而获得诺贝尔化学奖,已知镭原子核内有88个质子,与Ca处于同一主族。下列说法不正确
居里夫人发现了放射性元素镭(Ra),因而获得诺贝尔化学奖,已知镭原子核内有88个质子,与Ca处于同一主族。下列说法不正确的是()。
A.镭位于周期表中第七周期IIA族 B.镭的硫酸盐难溶于水 C.镭的碳酸盐可溶于水 D.镭的氢氧化物为强碱  am16781年前1
am16781年前1 -
 chunzi1226 共回答了13个问题
chunzi1226 共回答了13个问题 |采纳率92.3%C
答案C
CaCO 3 BaCO 3 均难溶于水,RaCO 3 也难溶于水1年前查看全部
- 短周期元素X,Y,Z,W原子序数依次增大,它们原子的最外层电子数和为14.X与Z同主族,Y与W同主族,且X的原子半径小于
短周期元素X,Y,Z,W原子序数依次增大,它们原子的最外层电子数和为14.X与Z同主族,Y与W同主族,且X的原子半径小于Y.判断一下它们是那些元素/////
 Tracyxu1年前2
Tracyxu1年前2 -
 来碗牛肉面SM 共回答了15个问题
来碗牛肉面SM 共回答了15个问题 |采纳率86.7%短周期元素X,Y,Z,W原子序数依次增大,且X的原子半径小于Y,而同一周期,随核电荷的递增,原子半径逐渐减小,所以说明X为氢H,
又因为它们原子的最外层电子数和为14.X与Z同主族,Y与W同主族,
所以Z为钠Na,Y为氧O,W为硫S1年前查看全部
- 已知A、B、C、D、E为五种短周期不同主族的元素,其原子序数依次递增.A、E两种原子最外层电子数之和是B原子最外层电子数
已知A、B、C、D、E为五种短周期不同主族的元素,其原子序数依次递增.A、E两种原子最外层电子数之和是B原子最外层电子数的2倍;C、E两种原子最外层电子数之和是D原子最外层电子数的2倍.A、E形成的化合物甲分子中电子总数为18,D原子核外最外层电子排布式为nsnnpn+2.请回答下列问题
(1)B、C、D三种元素的第一电离能较大的是______(填写元素符号)
(2)A单质与C单质在一定条件下可化合为乙,室温下,向pH=a的乙的水溶液中加入等体积pH=b的甲的水溶液,且a+b=14,充分作用后,溶液的pH______7(填“>”“<”或“=”),该溶液中各种离子浓度由大到小的顺序为______.
(3)A、B两元素也可形成多种化合物,其中相对分子质量最小的分子为丙.用D的单质和丙可以构成原电池,电池用多孔的惰性电极浸入浓KOH溶液,在X极通入化合物丙,Y极通入D的单质,则X极的电极反应式为______.
(4)工业生产E元素单质的化学方程式为2NaCl+2H20
2NaOH+Cl2↑+H2↑电解 .2NaCl+2H20.
2NaOH+Cl2↑+H2↑电解 .
(5)常温常压下,由A、B、D可组成液态物质J.现有2.3gJ与足量的D的单质充分反应,生成标准状况下2.24L BD2气体和2.7gA2D液体,同时放出68.35kJ的热量,该反应的热化学方程式为______. 紫之枫1年前1
紫之枫1年前1 -
 skywalker2007 共回答了14个问题
skywalker2007 共回答了14个问题 |采纳率92.9%解题思路:由D原子核外最外层电子排布式为nsnnpn+2,可推出n=2,因s能级最多容纳2个电子,所以D原子核外最外层电子排布式为2s22p2+2,D为O元素;C、E两种原子最外层电子数之和是D原子最外层电子数的2倍,即C、E两种原子最外层电子数之和为12,所以C、E处于第5和第7主族,因C原子序数小于O元素,所以C为N元素,E为F或Cl元素,由A、E形成的化合物甲分子中电子总数为18,可推出E为Cl元素,A为H元素;由A、E两种原子最外层电子数之和是B原子最外层电子数的2倍,可知B最外层电子数为(1+7)÷2═4,即B为C元素.A、B、C、D、E分别为:H、C、N、O、Cl元素.
(1)根据电离能的变化规律考虑;
(2)A单质与C单质在一定条件下可化合为乙,乙为NH3,甲为HCl,pH=a的乙的水溶液中c(H+)为10-a,c(OH-)=10a-14,
pH=b的甲的水溶液,c(H+)=10-b,因a+b=14,则-b=a-14,即氨水中c(OH-)和盐酸中c(H+)相等,二者等体积混合碱过量.得到一水合氨和氯化铵的混合液,根据电离大于水解判断溶液酸碱性及离子浓度大小关系;
(3)C、H组成的相对分子质量最小的为甲烷,即丙为甲烷,甲烷燃料电池中,甲烷作负极燃料;
(4)工业生产氯气采用电解饱和食盐水法;
(5)根据燃烧产物的量及燃料的质量计算出燃料的最简式,进而判断出J物质,由此写出热化学方程式.根据以上分析推断出具体元素A、B、C、D、E分别为:H、C、N、O、Cl元素.
(1)同周期电离能从左到右有增大的趋势,但N元素P轨道为半充满状态,较稳定,所以第一电离能反而比O的要大,故答案为:N;
(2)A单质与C单质在一定条件下可化合为乙,乙为NH3,甲为HCl,pH=a的乙的水溶液中c(H+)为10-a,c(OH-)=
10a-14,
pH=b的甲的水溶液,c(H+)=10-b,因a+b=14,则-b=a-14,即氨水中c(OH-)和盐酸中c(H+)相等,二者等体积混合碱过量.
得到一水合氨和氯化铵的混合液,根据电离大于水解判断溶液显碱性,
所以c(NH4+)>C(Cl-),c(OH-)>c(H+),
因弱电解质电离是微弱的,所以c(Cl-)>c(OH-),即离子浓度大小关系:
c(NH4+)>C(Cl-)>c(OH-)>c(H+),
故答案为:>c(NH4+)>C(Cl-)>c(OH-)>c(H+);
(3)甲烷燃料电池中,甲烷失电子变成二氧化碳,因碱性介质,二氧化碳与碱反应生成CO32-,
负极反应式为:CH4-8e-+10OH-=CO32-+7H20,故答案为:CH4-8e-+10OH-=CO32-+7H20;
(4)工业生产氯气采用电解饱和食盐水法,化学方程式为:2NaCl+2H20
电解
.
2NaOH+Cl2↑+H2↑
故答案为:2NaCl+2H20
电解
.
2NaOH+Cl2↑+H2↑
(5)2.7g为H2O的质量,2.24L 为CO2气体,
则n(H2O)=[2.7g/18g/mol]=0.15mol,n(CO2)=[2.24L/22.4L/mol]=0.1mol,
则n(H)=2n(H2O)=0.3mol,即m(H)=0.3g,
m(C)=0.1mol×12g/mol=1.2g,
根据质量守恒定律可得:
m(有机物J)=m(C)+m(O)+m(H),
则m(O)=2.3g-1.2g-0.3g=0.8g,
因此,n(O)=[0.8g/16g/mol]=0.05mol,
所以,有机物J中,n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,
故有机物J的分子式为C2H6O,2.3gJ的物质的量为:[2.3g/46g/mol]=0.05mol,则1molJ燃烧放出热量为:
68.35kJ÷0.05mol=1367KJ/mol.故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367KJ/mol.点评:
本题考点: 原子结构与元素周期律的关系;元素电离能、电负性的含义及应用;热化学方程式;化学电源新型电池;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题综合考察了元素推断、元素周期律、离子浓度大小比较、反应式的书写等内容,难度较大.关键是元素推断,D原子核外最外层电子排布式为nsnnpn+2是解题突破口.对于电离能的大小关系,要注意特殊性.1年前查看全部
- 前五周期中同主族两种元素原子的核外电子数的差值可能为 A 6,B12,C26,D30
 cctu1年前1
cctu1年前1 -
 kangta0808 共回答了19个问题
kangta0808 共回答了19个问题 |采纳率94.7%c 8+18=26 相邻的可能差为2 8 181年前查看全部
- 下列说法中,错误的是( )A.元素周期表中有7个主族,7个副族B.稀有气体元素原子的最外层电子数均为8个C.氢是原子半
下列说法中,错误的是( )
A.元素周期表中有7个主族,7个副族
B.稀有气体元素原子的最外层电子数均为8个
C.氢是原子半径最小的元素
D.氧元素位于第2周期ⅥA族 永远忘记xy1年前1
永远忘记xy1年前1 -
 wenbing1212 共回答了17个问题
wenbing1212 共回答了17个问题 |采纳率94.1%解题思路:A.元素周期表有7个主族、7个副族、1个第VIII族、1个O族;
B.稀有气体元素的原子的最外层不都含有8个电子;
C.原子的电子层数越少,其原子半径越小;
D.主族元素中,原子核外电子层数与其周期数相等,最外层电子数与其族序数相等.A.元素周期表有7个主族、7个副族、1个第VIII族、1个O族,7个周期,3个短周期,故A正确;
B.稀有气体元素的原子中,He原子最外层电子数是2,故B错误;
C.原子的电子层数越少,其原子半径越小,H原子电子层数最少,所以其原子半径最小,故C正确;
D.主族元素中,原子核外电子层数与其周期数相等,最外层电子数与其族序数相等,O原子核外有2个电子层、最外层电子数是6,所以O元素位于第二周期第VIA族,故D正确;
故选B.点评:
本题考点: 元素周期表的结构及其应用.
考点点评: 本题考查了元素周期表结构,明确元素周期表的排列顺序、元素在周期表中的位置等知识点即可分析解答,易错选项是B,注意规律中的异常现象,题目难度不大.1年前查看全部
- 判断 同一主族的元素从上到下,金属性成周期性变化.这句话正确吗
 iamyiqun1年前2
iamyiqun1年前2 -
 一个人去兴隆沙 共回答了9个问题
一个人去兴隆沙 共回答了9个问题 |采纳率88.9%金属性这个说法不是很严谨啊1年前查看全部
- A与B为同周期相邻.B与C为同主族相邻的短周期元素,三者的最外层电子数之和为17则A()B()C()(写出所有可能)
 吴性坚1年前3
吴性坚1年前3 -
 石城清风 共回答了18个问题
石城清风 共回答了18个问题 |采纳率88.9%因为三个元素的相邻关系,所以设B的最外层电子数为y,则有2y+(y-1)=17,解得y=6.
短周期为前三周期.
只有一组答案:A(氮)B(氧)C(硫)1年前查看全部
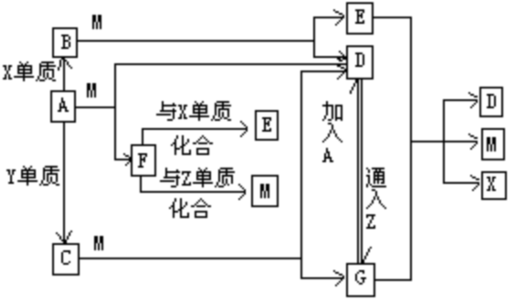
- 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离
 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:
(1)戊离子的结构示意图为______.
(2)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键的物质的结构式______;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为______.
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为______.
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:______.
(5)按如图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:NaCl+H2O
NaClO+H2↑电解 .NaCl+H2O.将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是______.
NaClO+H2↑电解 . longyan1111年前1
longyan1111年前1 -
 zxcdxj 共回答了13个问题
zxcdxj 共回答了13个问题 |采纳率92.3%甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝,则X为NH3,甲为H,乙为N;甲、丙处于同一主族,结合原子序数可知,丙为Na;戊的负一价阴离子与丙的阳离子差8个电子,戊的负一价阴离子核外电子数为18,则戊为Cl;氯气与氨气反应生成氮气,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1,则Y为NH4Cl、Z为HCl;丁的单质既能与丙(Na)元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z(HCl)的水溶液反应生成盐N,丁为两性金属,则丁为Al元素,故L为NaAlO2;丙、戊组成化合物M为NaCl,用石墨作阳极、铁作阴极,电解氯化钠水溶液,生成氢气、氯气与氢氧化钠,氯气与氢氧化钠反应生成氯化钠与次氯酸钠,
(1)Cl-的结构示意图为: ,故答案为:
,故答案为: ;
;
(2)H、N两元素形成的化合物中,既含有极性键又含有非极性键的物质为N2H4,其结构式为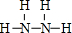 ,负极反应氧化反应,N2H4在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为N2H4+4OH--4e-=N2↑+2H2O,
,负极反应氧化反应,N2H4在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为N2H4+4OH--4e-=N2↑+2H2O,
故答案为: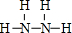 ;N2H4+4OH--4e-=N2↑+2H2O;
;N2H4+4OH--4e-=N2↑+2H2O;
(3)氯气与氨气反应生成的NH4Cl和HCl的物质的量之比为2:4,则NH3与Cl2反应的化学方程式:4NH3+3Cl2═N2+2NH4Cl+4HCl,在反应中氨气做还原剂,氯气做氧化剂,被氧化的物质氨气只占反应掉的一半,被氧化的物质氨气与被还原的物质氯气物质的量之比=2:3,
故答案为:2:3;
(4)将少量的盐酸滴入过量NaAlO2溶液中发生反应的离子方程式为AlO2-+H++H2O═Al(OH)3↓,
故答案为:AlO2-+H++H2O═Al(OH)3↓;
(5)电解饱和氯化钠溶液,反应的方程式为:2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑,同时发生反应Cl2+2NaOH=NaCl+NaClO+H2O,故该电解池中发生反应的总反应方程式为:NaCl+H2O
电解
.
NaClO+H2↑,电解后得到NaClO溶液,显碱性,且具有强氧化性,滴入酚酞溶液中,观察到溶液变红后褪色,
故答案为:NaCl+H2O
电解
.
NaClO+H2↑;溶液变红后褪色.1年前查看全部
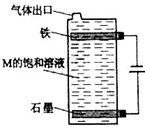
- 已知A是应用最为广泛的金属,X,Y为短周期同一主族的元素的单质,B和C是两种黑色化合物.A.B.C与有关物质之间的相互转
已知A是应用最为广泛的金属,X,Y为短周期同一主族的元素的单质,B和C是两种黑色化合物.A.B.C与有关物质之间的相互转化关系如图所示,其中每一方格内的字母表示一种反应物或生成物,反应加入或生成的水已略去.
填写下列空白:
(1)物质的化学式:A______,B______,C______.
(2)写出反应的化学方程式:
B+M:______
C+M:______
(3)写出E与G反应的离子方程式:______. xl19821年前1
xl19821年前1 -
 彪廉ss3 共回答了16个问题
彪廉ss3 共回答了16个问题 |采纳率87.5%A是应用最为广泛的金属,则A为Fe,X,Y为短周期同一主族的元素的单质,分别与Fe反应生成的B、C是两种黑色化合物,则X、Y分别为O2、S中的一种,则对应B、C分别Fe3O4、FeS中的一种,且A、B、C都与M反应,考虑M属于酸,...1年前查看全部
- 同周期,同主族的离子的氧化性,还原性怎样变化?
 眉飞舞1年前1
眉飞舞1年前1 -
 ruowei2005 共回答了16个问题
ruowei2005 共回答了16个问题 |采纳率81.3%同周期,从左到右,金属性减小,非金属性增强
所以,阳离子的氧化性增强,阴离子的还原性减弱
同主族,从上到下,金属性增强,非金属性减弱
所以,阳离子的氧化性减弱,阴离子的还原性增强1年前查看全部
- 最高正价与最高化合价的关系,与主族序数与什么关系?
 OK0881年前1
OK0881年前1 -
 whx0512 共回答了15个问题
whx0512 共回答了15个问题 |采纳率93.3%主族元素的最高化合价就是最高正价.
主族最高正价=主族元素的最外层电子=价电子数=主族序数
例如:硫元素,最高正价是+6,该元素原子的最外层电子为6,价电子数为6,主族序数为6,即第VIA族.
希望我的回答能对你的学习有帮助!1年前查看全部
- (14分)有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化
(14分)有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A 2 B,A 2 B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出五种元素的名称:A B C D 。
(2)用电子式表示离子化合物A 2 B的形成过程:
(3)写出下列物质的电子式:
D元素形成的单质 ;B与E形成的化合物 ;
A、B、E形成的化合物 ;D、E形成的化合物 。 enjoyit1年前0
enjoyit1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 与元素有关的化学题A B C D 四种元素,A元素所处的周期数,主族序数.原子序数均相等,B的原子半径是其所在主族中最小
与元素有关的化学题
A B C D 四种元素,A元素所处的周期数,主族序数.原子序数均相等,B的原子半径是其所在主族中最小的,B的最高价氧化物的水化物的化学式是HB03,C 元素原子的最外层电子数比此外层少2个,D的阳离子与C的阴离子具有相同的电子层排布,两元素可形成化合物D2C (1)B元素的名称是?(2)A B 形成的化合物的化学式为?B元素在元素周期表中的位置是?(3) C 元素的符号是?C 的最高价氧化物的化学式是? Google测试员52431年前2
Google测试员52431年前2 -
 青山流云 共回答了23个问题
青山流云 共回答了23个问题 |采纳率95.7%(1)氮 (2)NH3 第二周期第ⅥA族 (3)S H2SO4 补充:上面写错了 (3) S SO31年前查看全部
- LiBH4是一种储氢材料,属于离子化合物.下列有关说法正确的是 A,LiBH4中B的化合价是—3 B,B与Al同主族,均
LiBH4是一种储氢材料,属于离子化合物.下列有关说法正确的是 A,LiBH4中B的化合价是—3 B,B与Al同主族,均为金属元素 C,LiBH4中存在离子键和共价键 D,Li的离子半径大于H离子半径 主要A和C不太懂
 牧师裘1年前1
牧师裘1年前1 -
 fantastic_ooo 共回答了16个问题
fantastic_ooo 共回答了16个问题 |采纳率100%A B的化合价是+3,Li是+1,而H是-1
C 正确,B-H是共价键1年前查看全部
- 已知短周期元素ABCD四种元素的核电核数依次递增,AC在同一主族,BD也在同一主族,AB不同周期.XY均是由ABCD四种
已知短周期元素ABCD四种元素的核电核数依次递增,AC在同一主族,BD也在同一主族,AB不同周期.XY均是由ABCD四种元素组成的类型相同的盐,能互相作用,产生有毒气体Z.X与Y作用的离子方程式是
 alibutterfly1年前1
alibutterfly1年前1 -
 卡门的欣赏者 共回答了14个问题
卡门的欣赏者 共回答了14个问题 |采纳率85.7%ABCD顺序是:H,O,S,钠
XY:亚硫酸氢钠,
硫酸氢钠离子方程式:2(H)+(SO 3)2 - = H2O + SO2 ↑1年前查看全部
- 前三周期同主族两种元素原子的核外电子数的差值不可能为()
前三周期同主族两种元素原子的核外电子数的差值不可能为()
A10 B8 C16 D18 花花_3121年前1
花花_3121年前1 -
 LIONYANG0809 共回答了20个问题
LIONYANG0809 共回答了20个问题 |采纳率90%在吗?
原子的核外电子数的差值就是质子数的差,也就是元素序数的差
IA可差2,8,10
0族可差8,16
其它族差8
所以选D
下列化合物中,阴离子半径小于阳离子半径的是()A.NaCl B.LiCl C.KF D.NaBr
Na+电子层是2,8 Cl-是2,8,8 所以阴离子大
Li+电子层是2,同上也是阴离子大
K+是2,8,8,F-是2,8所以阳离子半径大
Br-的半径比Cl-还大
所以选C1年前查看全部
- 请问原子失电子顺序的规律是什么,包括主族和副族原子
 addictqueen1年前3
addictqueen1年前3 -
 snow998 共回答了15个问题
snow998 共回答了15个问题 |采纳率80%失电子即表现还原性.对于元素来说,同一周期的元素,非金属性从左到右递增,金属性从左向又递减.对于同一主族的元素,随着原子序数递增,非金属性递减,金属性递增.不过这个规律主要对主族元素和第四周期副族元素成立.比如...1年前查看全部
- 若某元素原子最外层电子数为1,则一定在第一主族对吗?
 j123123us1年前12
j123123us1年前12 -
 弄个名字好难 共回答了17个问题
弄个名字好难 共回答了17个问题 |采纳率100%错误的.因为除了主族元素之外,还有副族元素.你看看可以元素周期表,有个IB族,金Au和银Ag最外层就是一个电子.1年前查看全部
- A、B、C、D、E是元素周期表中的短周期主族元素,且原子序数依次增大.已知A与B不在同周期,A与C同主族B原子最外层电子
A、B、C、D、E是元素周期表中的短周期主族元素,且原子序数依次增大.已知A与B不在同周期,A与C同主族B原子最外层电子数是其电子层数的两倍,A、C、E原子最外层电子数之和为6D的氧化物具有两性,下列说法正确的是()
A.A、B只能形成一种化合物.B.离子半径:CE.DD.元素C、D的最高价氧化物对应水化物之间不能发生反应. fgmgupiao1年前2
fgmgupiao1年前2 -
 maggie_1983 共回答了20个问题
maggie_1983 共回答了20个问题 |采纳率95%A:氢
B:碳
C:钠
D:铝
E:硅
所以正确答案是C1年前查看全部
- 第一主族的金属单质与水反应一定比第二主族的金属单质强烈
第一主族的金属单质与水反应一定比第二主族的金属单质强烈
麻烦举个反例啦,谢谢喽 176621年前2
176621年前2 -
 鱼笑儿 共回答了16个问题
鱼笑儿 共回答了16个问题 |采纳率100%不一定,根据金属活动性顺序表,K,Ca,Na.那么Ca比Na的金属性更强,所以和水反应更剧烈.1年前查看全部
- 化学元素周期表中,第二主族后为什么是第三副族呢?有什么缘由吗?为什么这样排啊?
 purelove1291年前1
purelove1291年前1 -
 -Yan- 共回答了16个问题
-Yan- 共回答了16个问题 |采纳率87.5%因为这些元素(Sc Y)特征价态为+31年前查看全部
- (19分)有关元素X、Y、Z、W的信息如下 元素 有关信息 X 所在主族序数与所在周期序数之差为4 Y 最高价氧化物对应
(19分)
有关元素X、Y、Z、W的信息如下请回答下列问题:元素 有关信息 X 所在主族序数与所在周期序数之差为4 Y 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 Z 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 W 地壳中含量最高的金属元素
(1)W的单质与Y的最高价氧化物对应的水化物反应的离子方程式为 。
铜片、碳棒和ZX 3 溶液组成原电池,写出正极发生的电极反应方程式
_______________________________________________。
(2)向淀粉碘化钾溶液中滴加几滴ZX 3 的浓溶液,现象为_____________________,相关反应的离子方程式为_______________________________。
(3)以上述所得WX 3 溶液为原料制取无水WX 3 ,先制得WX 3 ·6H 2 O晶体,主要操作包括__________________________,在_____________________条件下加热WX 3 ·6H 2 O晶体,能进(4)一步制取无水WX 3 ,其原因是(结合离子方程式简要说明)_______________________________。 4759409511年前0
4759409511年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- A,B分别为3周期和4周期的同一主族的不同元素的原子,原子核内质子数等于中子数.(1)若A为二主族元素原子
 秀哉1年前2
秀哉1年前2 -
 泉州之水 共回答了17个问题
泉州之水 共回答了17个问题 |采纳率88.2%1.A是镁,x=24,B是钙,y=20 2.A是硅,m=14,B是锗(Ge),n=64选C 1个氘原子(D)中子数有1个,1个He原子种子数有2个 等物质的量时,1个D2分子有2个,1个He有2个 所以D2中子数>4He中子数 选B Na2O2 阳离子2个Na+,阴离子有1个...1年前查看全部
- 主族原素在周期表的位置,取决于该原素原子的?
主族原素在周期表的位置,取决于该原素原子的?
A相对原子质量和质子数B电子层数和最外层电子数C最外层电子数和次外层电子数D次外层电子数和电子层数 古谚2271年前2
古谚2271年前2 -
 寒一非 共回答了15个问题
寒一非 共回答了15个问题 |采纳率80%A1年前查看全部
- a,b,c,d,e是短周期元素,周期表中a与b,b与c相邻,c与e同主族,a与c的最外层电子数之比为2:3,b的最外层电
a,b,c,d,e是短周期元素,周期表中a与b,b与c相邻,c与e同主族,a与c的最外层电子数之比为2:3,b的最外层电子数比c的最外层电子数少一个,常见化合物d2c2与水反应生成c的单质,且溶液使酚酞溶液变红.
1.e的元素符号是:
2.a,b,c的氢化物稳定性顺序为:
b的氢化物和b的最高价氧化物的水化物反应生成z,则z中的化学键类型为:
z的化合物类型为:(填共价化合物或离子化合物)
3.写出d2c2与ac2反应的化学方程式:
d2c2与水反应生成c的单质的离子方程式: 重庆英语9221年前2
重庆英语9221年前2 -
 另类情感 共回答了21个问题
另类情感 共回答了21个问题 |采纳率90.5%a:C,b:N,c:O,d:Na,e,S,z:NH4NO3
1.e的元素符号是:S
2.a,b,c的氢化物稳定性顺序为:H2O>NH3>CH4
b的氢化物和b的最高价氧化物的水化物反应生成z,则z中的化学键类型为:共价键和离子键
z的化合物类型为:离子化合物 (填共价化合物或离子化合物)
3.写出d2c2与ac2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑
d2c2与水反应生成c的单质的离子方程式:2Na2O2+2H2O=4NaOH+O2↑1年前查看全部
- 原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数
原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数
原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数是电子层数的3倍。E和其他元素既不在同周期也不再同主族,D的最高价氧化物对应的水化物为强酸,且BCD的最高价氧化物对应的水化合物两两混合均能发生反应生成盐和水。则ABCDE分别为哪几种元素_________. 脏ル1年前2
脏ル1年前2 -
 cafe5420 共回答了24个问题
cafe5420 共回答了24个问题 |采纳率87.5%首先,你要把原题写清楚吧 这才能解题
等你1年前查看全部
- 现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外
现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。请回答下列问题:
(1) 元素B在周期表中的位置______________。
(2) A 2 C比A 2 E沸点高的原因是____________________________。
(3)写出同时含A、B、C、E四种元素的三种盐的化学式 、 、 。
(4)A 2 C的电子式为 ,C和D形成的一种化合物与A 2 C发生氧化还原反应,该反应的离子方程式为
(5)B元素的最高价氧化物的水化物与其氢化物反应的离子方程式
(6)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。 kmrqc1年前0
kmrqc1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 甲,乙是周期表中相邻两个主族的两种元素,若甲的原子序数为x,则乙的为
 jlphxm1年前6
jlphxm1年前6 -
 ljq19840321 共回答了19个问题
ljq19840321 共回答了19个问题 |采纳率89.5%选A
其实很好推算的.假设甲乙为同周期,则乙的原子序数可能为x+1或者x-1
而假若不是在同一周期的话,分别减去或者加上n个8就可以了.
x-1-8-8=x-171年前查看全部
- 下列说法正确的是 A.Li是最活泼金属,F是最活泼非金属 B.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族
下列说法正确的是
A.Li是最活泼金属,F是最活泼非金属 B.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 C.X 2+ 的核外电子数目为18,则X在第四周期第ⅡA族 D.Mg(OH) 2 碱性比Ca(OH) 2 强  曹小月1年前1
曹小月1年前1 -
 wallimn 共回答了23个问题
wallimn 共回答了23个问题 |采纳率91.3%C
1年前查看全部
- 有这个规律吗?同一主族的元素的氧化物的化学性质相似.(不讨论氢)
 tintin31661年前1
tintin31661年前1 -
 睿智子 共回答了29个问题
睿智子 共回答了29个问题 |采纳率89.7%有,如氧化锂,氧化钠,氧化钾都能和水反应;1年前查看全部
- ABCD四种短周期元素的原子序数依次增大,AD同主族,BC同周期,AB组合成的化合物甲为气态.
 yan-he1年前1
yan-he1年前1 -
 penghuall 共回答了21个问题
penghuall 共回答了21个问题 |采纳率90.5%问题不够清楚,不过先给你个大概的可能吧,你再把题看看做相应的处理;常温下为气体的,NH3、CO、CO2、HF、CH4、H2S、HCl;再根据ABCD的顺序,A很可能就是H,而B可能就是C、N、F、S、Cl、中的一个;我们的常识D也很可能就是K,Na,极为可能就是Na吧!1年前查看全部
- 化学元素周期表中0族和VIII族算不算主族或副族?
 chen8312031年前5
chen8312031年前5 -
 无名指戒指 共回答了19个问题
无名指戒指 共回答了19个问题 |采纳率84.2%现行中学教材中的元素周期表一般是长式元素周期表,主族分为第ⅠA族、第ⅡA族、第ⅢA族、第ⅣA族、第ⅤA族、第ⅥA族、第ⅦA族;副族分为第ⅠB族、第ⅡB族、第ⅢB族、第ⅣB族、第ⅤB族、第ⅥB族、第ⅦB族;另外元素周期表中由左向右数第8、9、10纵行,称为第Ⅷ族,由左向右数第18纵行称为0族,所以0族不属于主族也不属于副族.
列为一族.
第VIII族元素在周期系中是特殊的一族,它包括4、5、6三个周期的九种元素,它们是铁
、钴、镍、钌、铑、钯、锇、铱和铂.
第VIII族元素在周期系中位置的特殊性是与它们之间性质的类似和递变关系相联系的.
在九种元素中,虽然也存在着一般的垂直相似性,如铁、钌、锇,但水平相似性如铁、
钴、镍则更为突出.因此,为了便于研究,通常把这九种元素分成两组,把位于第4周期
的铁、钴、镍三种元素称为铁系元素,其余六种元素则称为铂系元素.由于镧系收缩的
缘故,位于第5周期的钌、铑、钯与位于第6周期的锇、铱、铂非常相似而与第4周期的铁
、钴、镍差别较大.铂系元素被列为稀有元素,和金、银一起称为贵金属.
1.铁系元素
铁、钴、镍三种元素的最外层都有两个4s电子,只是次外层的3d电子数不同,分别为6、
7、8,它们的原子半径十分相似,所以它们的性质很相似.
由于第一过渡系列元素原子的电子填充过渡到第Ⅷ族时,3d电子已经超过5个,所以它们
的价电子全部参加成键的可能性减少,因而铁系元素已经不再呈现出与族数相当的最高
氧化态.
一般条件下,铁的常见氧化态是+2和+3,与强氧化剂作用,铁可以生成不稳定的+6氧化
态的高铁酸盐.
一般条件下,钴和镍的常见氧化态都是+2,与强氧化剂作用,钴可以生成不稳定的+3氧
化态,而镍的+3氧化态则少见.
我们从物理性质、化学性质、用途三个方面来介绍铁系元素的通性.
⑴物理性质
铁系元素的原子半径、离子半径、电离势等性质基本上随原子序数的增加而有规律地变
化.但镍的原子量比钴小,这是因为镍的同位素中质量数小的一种占的比例大.
铁系元素单质都是具有金属光泽的白色金属.钴略带灰色.它们的密度都比较大,熔点
也比较高,它们的熔点随原子序数的增加而降低,这可能是因为3d轨道中成单电子数按
Fe、Co、Ni的顺序依次减少(4、3、2),金属键依次减弱的缘故.
钴比较硬而脆,铁和镍却有很好的延展性.它们都表现有铁磁性,它们的合金是很好的
磁性材料.
2化学性质
由铁系元素的标准电极电势看,它们都是中等活泼的金属.它们的化学性质表现在以下
几个方面:
①在酸性溶液中,Fe、Co和Ni分别是铁、钴、镍离子的最稳定状态.空气中的氧能把酸
性溶液中的Fe氧化成Fe,但是不能氧化Co和Ni成为Co和Ni.
由值看出,高氧化态的铁(Ⅵ)、钴(Ⅲ)、镍(Ⅳ)在酸性溶液中都是很强的氧化剂
.
②在碱性介质中,铁的最稳定氧化态是+3、而钴和镍的最稳定氧化态仍是+2; 在碱性介
质中把低氧化态的铁、钴、镍氧化为高氧化态比在酸性介质中容易.低氧化态氢氧化物
的还原性按Fe(OH)2、Co(OH)2、Ni(OH)2的顺序依次降低.
例如:向Fe的溶液中加入碱,能生成白色的Fe(OH) 2的沉淀,但空气中的氧立即把白色
的Fe(OH)2氧化成红棕色的Fe(OH)3沉淀:
在同样条件下生成的粉红色的Co(OH) 2则比较稳定,但在空气中放置,也能缓慢地被空
气中的氧氧化成棕褐色的Co(OH) 3:
而在同样条件下生成的绿色的Ni(OH) 2最稳定,根本不能被空气中的氧所氧化.
由此可见,Fe(OH)2的还原性最强,也最不稳定,Ni(OH)2的还原性最差,也最稳定.这
是由它们在碱性介质中的标准电极电势的大小决定的.
③铁系元素易溶于稀酸中,只有钴在稀酸中溶解得很慢.它们遇到浓硝酸都呈“钝态”
.铁能被热的浓碱液侵蚀,而钴和镍在碱溶液中的稳定性比铁高.
④在没有水汽存在时,一般温度下,铁系元素与氧、硫、氯、磷等非金属几乎不起作用
,但在高温下却发生猛烈反应.
⑶用途
铁、钴、镍主要用于制造合金.铁是重要的基本结构材料,铁合金用途广泛.钴的合金
具有很高的硬度,镍是不锈钢的主要成分之一,由于镍不与强碱作用,实验室中常用镍
坩埚熔融碱性物质.镍粉还可做氢化反应的催化剂.1年前查看全部
- 高中化学有关电子排布的问题Tl是同Al同一主族.其外电子为2 8 18 32 18 8 3.那么Tl+(离子,带一个单位
高中化学有关电子排布的问题
Tl是同Al同一主族.其外电子为2 8 18 32 18 8 3.
那么Tl+(离子,带一个单位正电荷)的最外层电子数为什么是二.而不是8呢? 赤壁虫H1年前1
赤壁虫H1年前1 -
 一战净妖氛 共回答了14个问题
一战净妖氛 共回答了14个问题 |采纳率100%原子核最外层为3个电子,TI+为正一价,说明最外层失去一个电子,因此最外层电子数=3-1=2
(原子核失去电子是从最外层开始的)1年前查看全部
- 最外层为三的元素,一定位于第三主族,为什么
 peiwenpeng1年前3
peiwenpeng1年前3 -
 looking4murong 共回答了21个问题
looking4murong 共回答了21个问题 |采纳率95.2%一定位于第三主族
副族元素电子回填1年前查看全部
大家在问
- 1一班二班共99人,一班调进3人二班调走4人,这时二班是一班的80%多8人,问一二班共几人?
- 2高一化学如何看转移了多少电子?如 K2Cr2O7+14HCL===2KCL+2CrCl3+Cl2+7H2O 中 为何Cr
- 3工业炼铁的原理是?不是化学方程式
- 4从一个袋子中摸球,摸到白球的可能性为五分之四,因为此袋子中一定有4个白球.是对的还是错的?
- 5请问:日字头加九字底的这个字怎么拼?
- 6750毫升等于几分之几立方分米
- 7田字加丁字怎么念,这个字是左右结构.
- 8求分析下eigen这个单词的词根词源,
- 9五年级下册语文第一课课题是什么?
- 10一个圆柱的底面积不变,高扩大3倍,它的体积扩大______倍;如果高不变,底面半径扩大3倍,它的体积扩大______倍.
- 11我们全班同学,在深入开展“人生的意义在于奉献”讨论后,经过大家的努力,使班级面貌发生很大变化.
- 12一个字中的偏旁和部首一样吗?
- 13i can only afford to pay 100 a week in rent的意思
- 14般字加什么部首是一个字
- 15连说带唱的叫(rua pu)的英文怎么拼?
