重晶石熔化克服什么作用力
 lynn颜子2022-10-04 11:39:544条回答
lynn颜子2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 醴陵19 共回答了10个问题
醴陵19 共回答了10个问题 |采纳率100%- 重晶石的主要成分为:BaSO4 它是一种典型的离子化合物
重晶石熔化后破坏了BaSO4 中的离子键
离子键实质上是一种静电作用力
重晶石熔化克服作用力是——阴阳离子间的静电作用力 - 1年前
 yuku007067 共回答了6个问题
yuku007067 共回答了6个问题 |采纳率- 范德华力
- 1年前
 ttplayxu 共回答了12个问题
ttplayxu 共回答了12个问题 |采纳率- 共价键
- 1年前
 水饺年华 共回答了32个问题
水饺年华 共回答了32个问题 |采纳率- Ba2+和SO42-之间的离子键
- 1年前
相关推荐
- (2010•合肥一模)工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等.高温煅烧还
(2010•合肥一模)工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等.高温煅烧还原法的工艺流程可简单的表示如下:

已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ•mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s)△H=-1473.2kJ•mol-1
Ba(s)+S(s)=BaS(g)△H=-460kJ•mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是______.
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为______
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有______. justsoso1231年前1
justsoso1231年前1 -
 突然的人们 共回答了23个问题
突然的人们 共回答了23个问题 |采纳率95.7%解题思路:(1)依据平衡移动影响因素分析,同时通入空气使C燃烧提供热量;
(2)依据碳酸钡溶度积,需要增加碳酸根离子使碳酸根离子浓度和钡离子浓度乘积大于溶度积形成碳酸钡沉淀;
(3)与高温煅烧还原法相比,(用饱和Na2CO3溶液的)沉淀转化法的优点是节能环保;(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温,平衡正向进行,应采取的措施是加入过量的炭,同时通入空气;
故答案为:加入过量的炭,同时通入空气;
(2)在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法是将适量饱和Na2CO3溶液加入BaSO4沉淀中,充分搅拌,静置、弃去上层清液,如此操作,反复多次直到BaSO4全部转化为BaCO3;
故答案为:将适量饱和Na2CO3溶液加入BaSO4沉淀中,充分搅拌,静置、弃去上层清液,如此操作,反复多次(直到BaSO4全部转化为BaCO3);
(3)由于高温煅烧要消耗大量能源,还能产生空气污染物,所以与高温煅烧还原法相比相比,(用饱和Na2CO3溶液的)沉淀转化法的优点主要有节约能源,无污染物生成,节能环保;
故答案为:节能,环保等.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;化学平衡的影响因素.
考点点评: 本题考查沉淀的转化,工艺流程的优缺点比较,理解沉淀转化的实质是解题关键,题目难度不大.1年前查看全部
- 重晶石常与什么矿伴生
 wcow1年前1
wcow1年前1 -
 copper007 共回答了19个问题
copper007 共回答了19个问题 |采纳率89.5%重晶石是钡的最常见矿物,它的成分为硫酸钡.产于低温热液矿脉中,如石英-重晶石脉,萤石-重晶石脉等,常与方铅矿、闪锌矿、黄铜矿、辰砂等共生.1年前查看全部
- 重晶石,绿矾,白磷,明矾的化学式为?
 arhoo1年前3
arhoo1年前3 -
 藤迹 共回答了19个问题
藤迹 共回答了19个问题 |采纳率84.2%重晶石:BaSO4
绿矾:FeSO4·7H2O
白磷:P4
明矾:KAl(SO4)2·12H2O1年前查看全部
- 石膏,熟石膏,重晶石,明矾,绿矾,蓝矾,芒硝的化学式,
 达修1年前3
达修1年前3 -
 liwo99 共回答了15个问题
liwo99 共回答了15个问题 |采纳率80%绿矾硫酸亚铁1年前查看全部
- 帮我写出物质的化学式1、萤石2、生石膏3、重晶石4、天青石
 hnlyzjw1年前3
hnlyzjw1年前3 -
 鹏居隐者 共回答了25个问题
鹏居隐者 共回答了25个问题 |采纳率84%1.萤石:CaF2
2.生石膏:CaSO4·2H2O【熟石膏是2CaSO4·H2O】
3.重晶石:BaSO4
4.天青石:SrSO41年前查看全部
- 工业上制备BaCl 2 的工艺流程图如下图某研究小组在实验室用重晶石(主要成分BaSO 4 )对工业过程进行模拟实验。
工业上制备BaCl 2 的工艺流程图如下图某研究小组在实验室用重晶石(主要成分BaSO 4 )对工业过程进行模拟实验。 
查表得:
BaSO 4 (s)+4C(s) 4CO(g)+ BaS(s) △H1=+571.2kJ ·mol -1 ①
4CO(g)+ BaS(s) △H1=+571.2kJ ·mol -1 ①
BaSO 4 (s)+2C(s) 2CO 2 (g)+BaS(s) △H2 =+ 226. 2kJ·mol -1 ②
2CO 2 (g)+BaS(s) △H2 =+ 226. 2kJ·mol -1 ②
(1)气体用过量的NaOH溶液吸收,得到硫化钠。Na 2 S水解的离子方程式为_________。
(2)向BaCl 2 溶液中加入AgNO 3 和KBr,当两种沉淀共存时 ____________. [ Ksp ( AgBr) = 5.4×10 -13 ,Ksp ( AgCl) = 2. 0×10 -10 ]
____________. [ Ksp ( AgBr) = 5.4×10 -13 ,Ksp ( AgCl) = 2. 0×10 -10 ]
(3)反应C(s) +CO 2 (g) 2CO( g)的△H=__________kJ·mol -1 。
2CO( g)的△H=__________kJ·mol -1 。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是_________。 homeandhomeyy1年前1
homeandhomeyy1年前1 -
 守与助 共回答了24个问题
守与助 共回答了24个问题 |采纳率83.3%1年前查看全部
- 下列物质不能和NaOH反应的下列物质不能和NaOH发生反应的是 ( ) A.阿司匹林 B.重晶石 C.氢氧化铝 D.小苏
下列物质不能和NaOH反应的
下列物质不能和NaOH发生反应的是 ( ) A.阿司匹林 B.重晶石 C.氢氧化铝 D.小苏打 请说明理由 charm21年前4
charm21年前4 -
 喜秦玉 共回答了18个问题
喜秦玉 共回答了18个问题 |采纳率83.3%选B
原因:A的阿司匹林是2(乙酰氧基)苯甲酸,可以在强碱条件下水解.
C是两性氢氧化物,既可以和强酸反应也可以和强碱反应.
D是酸式盐,可以电离出氢离子与氢氧根结合成水1年前查看全部
- 化学俗名的化学式芒硝、生石膏、熟石膏、重晶石、绿矾、明矾、蓝矾等的化学式是?请一一列出来,谢谢!
 6446888711年前5
6446888711年前5 -
 red_army1 共回答了18个问题
red_army1 共回答了18个问题 |采纳率88.9%芒硝:(mángxiāo,mirabilite),十水硫酸钠的俗称,化学式为Na2SO4‧10H2O
生石膏 :指天然的二水石膏(含两个水分子).生石膏---CaSO4·2H2O(高中阶段认为是2H2O,其实只要>或=2都行.一般所称石膏可泛指石膏和硬石膏两种矿物.石膏为二水硫酸钙(Ca〔SO4〕•2H2O)
熟石膏:指由生石膏经加工而成的含半个水分子的石膏,亦称半水石膏.熟石膏--- 2CaSO4·H2O.
重晶石 : 英文名称2:barium sulfate 分子式:BaSO4 分子量:233.39 化学成分:BaO:65.7%,SO3:34.3%.成分中有Sr、Pb和Ca类质同像替代.
绿矾: 英文名称2:green vitriol 技术说明书编码:2536 CAS No.:7782-63-0 分子式:FeSO4·7H2O .
明矾,又称钾铝矾、铝明矾、钾矾、白矾、生矾,化学式为KAl(SO4)2‧12H2O
蓝矾:五水硫酸铜,化学式为CuSO4·5H2O(是纯净物),为蓝色晶体,其分子式的量为249.68.是无水硫酸铜吸水后形成的.1年前查看全部
- 硫酸盐在生产生活中有广泛应用。Ⅰ.工业上以重晶石(主要成分BaSO 4 )为原料制备BaCl 2 ,其工艺流程示意图如下
硫酸盐在生产生活中有广泛应用。
Ⅰ.工业上以重晶石(主要成分BaSO 4 )为原料制备BaCl 2 ,其工艺流程示意图如下:
某研究小组查阅资料得:
BaSO 4 (s)+4C(s) 4CO(g)+BaS(s)△H 1 =+571.2kJ•mol -1 ①
4CO(g)+BaS(s)△H 1 =+571.2kJ•mol -1 ①
BaSO 4 (s)+2C(s) 2CO 2 (g)+BaS(s)△H 2 =+226.2kJ•mol -1 ②
2CO 2 (g)+BaS(s)△H 2 =+226.2kJ•mol -1 ②
(1)用过量NaOH溶液吸收气体,得到硫化钠。该反应的离子方程式是 。
(2)反应C(s)+CO 2 (g) 2CO(g)的△H= 。
2CO(g)的△H= 。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看, ;
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温。
(4)该小组同学想对BaSO 4 在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO 4 在水中的沉淀溶解平衡曲线如图所示。
该小组同学提出以下四种观点:
①当向含有SO 4 2- 的溶液中加入Ba 2+ 使SO 4 2- 沉淀完全,则此时SO 4 2- 在溶液中的浓度为0
②加入Na 2 SO 4 可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO 4 沉淀生成
其中正确的是 (填序号)。
Ⅱ.某燃料电池以CaHSO 4 固体为电解质传递H + ,其基本结构如图所示,电池总反应可表示为2H 2 +O 2 ═2H 2 O。
请回答:
(5)H + 由 极通过固体酸电解质传递到另一极(填a或者b)。
(6)b极上发生的电极反应是 。 水风言1年前1
水风言1年前1 -
 xlycrkb 共回答了22个问题
xlycrkb 共回答了22个问题 |采纳率86.4%27.(12分,每空2分)
Ⅰ.(1)H 2 S+2OH - =2S 2- +H 2 O
(2)+172.5 kJ•mol -1
(3)使BaSO 4 得到充分的还原,提高BaS的产量
(4)④
Ⅱ.(5)a
(6)O 2 +4e - +4H + ═2H 2 O
1年前查看全部
- 重晶石(BaSO 4 )是重要的化工原料,制备氢氧化钡晶体[Ba(OH) 2 ·8H 2 O]的流程如下: (1)写出煅
重晶石(baso 4 )是重要的化工原料,制备氢氧化钡晶体[ba(oh) 2 ·8h 2 o]的流程如下: (1)写出煅烧重晶石(baso 4 )是重要的化工原料,制备氢氧化钡晶体[ba(oh) 2 ·8h 2 o]的流程如下:

(1)写出煅烧时发生反应的热化学方程式:____________________________。
(2)写出氢氧化钡晶体与氯化铵晶体混合反应的化学方程式:_____________________。
(3)为检测煅烧时产生的co,可将煅烧产生的气体通入pbcl 2 溶液中,出现黑色沉淀和产生一种***能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:_____。
(4)向baso 4 沉淀中加入饱和na 2 co 3 溶液,充分搅拌,弃去上层清液,如此处理多次,可使baso 4 全部转化为baco 3 。发生的反应可表示为:
baso 4 (s)+co 3 2 - (aq) baco 3 (s)+so 4 2 - (aq)
baco 3 (s)+so 4 2 - (aq)
现有0.20 mol baso 4 ,加入1.0l 2.0mol?l -1 饱和na 2 co 3 溶液处理,假设c(so 4 2 - ) 起始 ≈0
平衡时,k=4.0x10 -2 ,求反应达到平衡时发生转化的baso 4 的物质的量。(写出计算过程结果保留2位有效数字)
(5)试从平衡的角度解释baso 4 可转化为baco 3 的原因:________________________。
 cxjyf1年前1
cxjyf1年前1 -
 bootz 共回答了15个问题
bootz 共回答了15个问题 |采纳率93.3%(17分)
(1)BaSO 4 (s) + 4C(s)="BaS(s)" + 4CO(g)△H="+571.2" kJ?mol -1
(4分,其中:方程式2分,ΔH 2分,错漏单位扣1分,状态错漏0分。其他计量数,合理即给分)
(2)Ba(OH) 2 ·8H 2 O +2NH 4 Cl=BaCl 2 +2NH 3 ↑+10 H 2 O (2分,写Ba(OH) 2 反应给0分)
(3)CO +PbCl 2 +H 2 O=Pb↓+CO 2 ↑+2HCl (2分)
(4)设发生转化的BaSO 4 的物质的量为xmol,则平衡时c(SO 4 2 - )为x mol?L -1 (1分)
BaSO 4 (s)+CO 3 2 - BaCO 3 (s)+SO 4 2 -
BaCO 3 (s)+SO 4 2 -
起始浓度(mol?L -1 ): 2.0 0
转化浓度(mol?L -1 ): x x
平衡浓度(mol?L -1 ): (2.0—x) x (1分)
K= =
= =4.0×10 -2 (2分,其中列式、代入数值各1分)
=4.0×10 -2 (2分,其中列式、代入数值各1分)
x = 7.7×10 -2 (2分,单位、有效数字错漏合扣1分)
答:发生转化的BaSO 4 的物质的量为7.7×10 -2 mol
(5)BaSO 4 沉淀中存在沉淀溶解平衡:BaSO 4 (s) Ba 2+ (aq) + SO 4 2 - (aq) (1分),加入饱和碳酸钠溶液,CO 3 2 - 浓度增大,使Q c (BaCO 3 )=c(Ba 2+ )×c(CO 3 2 - )>K sp (BaCO 3 ) ,形成碳酸钡的过饱和溶液,因此析出BaCO 3 沉淀(1分),c(Ba 2+ )减小,使BaSO 4 沉淀向溶解方向移动,BaSO 4 转化为BaCO 3 (1分)。(合理即给分)
Ba 2+ (aq) + SO 4 2 - (aq) (1分),加入饱和碳酸钠溶液,CO 3 2 - 浓度增大,使Q c (BaCO 3 )=c(Ba 2+ )×c(CO 3 2 - )>K sp (BaCO 3 ) ,形成碳酸钡的过饱和溶液,因此析出BaCO 3 沉淀(1分),c(Ba 2+ )减小,使BaSO 4 沉淀向溶解方向移动,BaSO 4 转化为BaCO 3 (1分)。(合理即给分)
试题分析:(1)硫酸钡与焦碳在高温下发生氧化还原反应,生成硫化钡和一氧化碳,硫元素由+6降为—2价,碳元素由0升为+2价,根据化合价升降总数相等配平,则该反应为;BaSO 4 (s)+4C(s)=BaS(s)+4CO(g);将已知反应编号为①②③,观察发现,②×2+③—①可得重晶石与焦碳的反应式,根据盖斯定律,BaSO 4 (s)+4C(s)=BaS(s)+4CO(g)的焓变=②的焓变×2+③的焓变—①的焓变=[—221×2—460—(—1473.2)]kJ/mol=+571.2 kJ/mol;(2)铵盐与强碱能发生复分解反应,生成盐、氨气和水,由此推断:Ba(OH) 2 ·8H 2 O +2NH 4 Cl=BaCl 2 +2NH 3 ↑+10 H 2 O;依题意,一氧化碳被氧化成二氧化碳,碳元素由+2升为+4价,则CO是还原剂,由此推断氯化铅是氧化剂,被还原为黑色的单质铅,根据化合价升降总数相等配平,该反应为CO +PbCl 2 +H 2 O=Pb↓+CO 2 ↑+2HCl;(4)设发生转化的BaSO 4 的物质的量为xmol,则平衡时c(SO 4 2 - )为x mol?L -1 (1分)
BaSO 4 (s)+CO 3 2 - BaCO 3 (s)+SO 4 2 -
BaCO 3 (s)+SO 4 2 -
起始浓度(mol?L -1 ): 2.0 0
转化浓度(mol?L -1 ): x x
平衡浓度(mol?L -1 ): (2.0-x)x (1分)
K= =
= =4.0×10 -2 (2分,其中列式、代入数值各1分)
=4.0×10 -2 (2分,其中列式、代入数值各1分)
x = 7.7×10 -2 (2分,单位、有效数字错漏合扣1分)
答:发生转化的BaSO 4 的物质的量为7.7×10 -2 mol。
(5)BaSO 4 沉淀中存在沉淀溶解平衡:BaSO 4 (s)1年前查看全部
- 锌钡白是BaSO 4 和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要
锌钡白是BaSO 4 和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO 2 、CO及少量SO 2 和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:

请根据上述流程回答下列问题:
(1)重晶石的化学式为_________,锌钡白可用于调制_______色和浅色油漆。
(2)处理过程( a )的步骤为:①_____________;②洗涤;③______________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是 。
(4)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为 。写出设备2中发生反应的离子方程式: _____________________、_____________。
(5)可用 法分离溶液中的钠盐,进行分离前,需要查得的是
。(数据)
(6)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为 (至少写一种)。 剑非寒1年前1
剑非寒1年前1 -
 cloudcoco 共回答了16个问题
cloudcoco 共回答了16个问题 |采纳率87.5%1年前查看全部
- 1.下列物质名称与化学式不符的是 A重晶石(BaSO4) B石膏(2CaSO4·12H2O) C胆矾(CuSO4· 5H
1.下列物质名称与化学式不符的是 A重晶石(BaSO4) B石膏(2CaSO4·12H2O) C胆矾(CuSO4· 5H2O)D明矾
1.下列物质名称与化学式不符的是
A重晶石(BaSO4) B石膏(2CaSO4·12H2O) C胆矾(CuSO4· 5H2O)D明矾(KAl(SO4)2·12H2O) 无礼地1年前2
无礼地1年前2 -
 游遍海南 共回答了26个问题
游遍海南 共回答了26个问题 |采纳率84.6%选B
CaSO4·2H2O 生石膏
CaSO4·1/2H2O 熟石膏1年前查看全部
- 工业上制备BaCl2的工艺流程图如下,某研究小组在实验室用重晶石(主要成分为BaSO4)对上述工业过程进行了模拟实验.
工业上制备BaCl2的工艺流程图如下,某研究小组在实验室用重晶石(主要成分为BaSO4)对上述工业过程进行了模拟实验.

(1)步骤①中BaSO4与碳在高温下反应,每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为______.
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
=______.c(Br−) c(Cl−)
【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
(3)在实验室中BaCl2的重要用途之一是检验SO42-,要检验某无色溶液中含有SO42- 的操作方法是:取少量样品,先加入足量的______(填试剂名称),无明显现象,再滴加少量______(填试剂名称),若有白色沉淀产生,说明含有SO42-.
(4)将SO2通入BaCl2溶液至饱和,未见有沉淀,继续通入另一种气体有沉淀生成,则后通入的气体不可能是______.
A.NH3B.NO2 C.CO2 D.H2S
(5)若NaOH溶液吸收H2S气体生成等物质的量的Na2S和NaHS,则溶液中阴离子浓度由大到小的顺序为______.
(6)将pH=1的稀硫酸慢慢加入一定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时混合溶液的体积为100mL,且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度为______mol/L.(保留小数点后三位) nbflyyang1年前1
nbflyyang1年前1 -
 一介过客 共回答了14个问题
一介过客 共回答了14个问题 |采纳率71.4%解题思路:(1)先写出方程式,再根据物质的量之比等于热量比求出反应热;
(2)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中
=C(Br −) C(Cl −)
,依此计算;Ksp(AgBr) Ksp(AgCl)
(3)检验SO42- 的操作方法是:取少量样品,先加入足量的稀盐酸,无明显现象,再滴加少量氯化钡,若有白色沉淀产生,说明含有SO42-.
(4)SO2气体通入BaCl2溶液中,未见白色沉淀,不发生反应,继续通入另一种气体立即产生沉淀,沉淀可能为硫酸钡或亚硫酸钡,也可能为S,则气体具有氧化性或碱性等,以此来解答.
(5)Na2S和NaHS的混合溶液显碱性,NaHS以水解为主,据此判断;
(6)反应的整个过程中,H+没参加反应,所以前后的H+物质的量没变,导致pH变化的原因是体积的变化,根据PH的定义,结合体积的变化情况来计算.(1)BaSO4与碳在高温下反应的方程式为:BaSO4(s)+4C(s)═4CO(g)+BaS(s),每1mol碳生成CO需要吸收142.8kJ的热量,所以△H=+571.2kJ/mol,此反应的热化学方程为:BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol,
故答案为:BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol;
(2)当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=
Ksp(AgBr)
c(Ag +),c(Cl-)=
Ksp(AgCl)
c(Ag +),
则
C(Br −)
C(Cl −)=
Ksp(AgBr)
Ksp(AgCl)=
5.4×10 −13
2.0×10 −10=2.7×10-3,
故答案为:2.7×10-3;
(3)检验SO42- 的操作方法是:取少量样品,先加入足量的稀盐酸,无明显现象,再滴加少量氯化钡,若有白色沉淀产生,说明含有SO42-.
故答案为:稀盐酸;氯化钡;
(4)A.氨气与二氧化硫发生反应生成亚硫酸铵,亚硫酸铵与钡离子结合生成亚硫酸钡沉淀,故A不选;
B.二氧化氮通入溶液中生成硝酸,硝酸氧化二氧化硫反应生成硫酸根离子,与钡离子结合生成硫酸钡沉淀,故B不选;
C.二氧化碳、二氧化硫与氯化钡均不反应,不能生成沉淀,故C选;
D.二氧化硫与硫化氢发生氧化还原反应生成S沉淀,故D不选;
故选C.
(5)Na2S和NaHS的混合溶液显碱性即c(OH-)>c(H+),NaHS以水解为主,则c(HS-)>c(S2-),所以溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+),所以阴离子的浓度由大到小的顺序为c(HS-)>c(S2-)>c(OH-),故答案为:c(HS-)>c(S2-)>c(OH-);
(6)将pH=1的稀硫酸慢慢加入一定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,发生的是硫酸根和钡离子之间的反应,反应的整个过程中,H+没参加反应,所以前后的H+物质的量没变,导致pH变化的原因是体积的变化,则反应后H+的浓度是0.01mol/L,稀硫酸pH=1,故反应的稀硫酸为10ml,而SO42-的浓度是0.005 mol/L,
故Ba2+的物质的量等于SO42-的物质的量,为0.0005mol,所以Cl-的物质的量是0.001mol,BaCl2溶液为100mL-10mL=90mL,原BaCl2溶液中Cl-的浓度=[0.001mol/0.09L]=0.011mol/L,故答案为:0.011.点评:
本题考点: 金属的回收与环境、资源保护;热化学方程式;难溶电解质的溶解平衡及沉淀转化的本质;酸碱混合时的定性判断及有关ph的计算;物质的分离、提纯和除杂.
考点点评: 本题为涉及热化学方程式的书写、溶度积的有关计算、元素化合物知识、离子浓度的比较等知识点,题量大,计算量较大,是对学生心理素质的考验,题目难度较高.1年前查看全部
- 重晶石中硫酸钡的检测方法,有没有简单的,快速的.
 高不了1年前1
高不了1年前1 -
 生活的一天 共回答了22个问题
生活的一天 共回答了22个问题 |采纳率95.5%没有,因为硫酸钡难溶于水,一般只有重量法了.1年前查看全部
- 重晶石(BaSO 4 )是重要的化工原料,制备氢氧化钡晶体[Ba(OH) 2 ·8H 2 O]的流程如下:
重晶石(baso 4 )是重要的化工原料,制备氢氧化钡晶体[ba(oh) 2 ·8h 2 o]的流程如下:

(1)写出煅烧时发生反应的热化学方程式:____________________________。
(2)写出氢氧化钡晶体与氯化铵晶体混合反应的化学方程式:_____________________。
(3)为检测煅烧时产生的co,可将煅烧产生的气体通入pbcl 2 溶液中,出现黑色沉淀和产生一种***能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:_____。
(4)向baso 4 沉淀中加入饱和na 2 co 3 溶液,充分搅拌,弃去上层清液,如此处理多次,可使baso 4 全部转化为baco 3 。发生的反应可表示为:
baso 4 (s)+co 3 2 - (aq) baco 3 (s)+so 4 2 - (aq)
baco 3 (s)+so 4 2 - (aq)
现有0.20 mol baso 4 ,加入1.0l 2.0mol•l -1 饱和na 2 co 3 溶液处理,假设c(so 4 2 - ) 起始 ≈0
平衡时,k=4.0x10 -2 ,求反应达到平衡时发生转化的baso 4 的物质的量。(写出计算过程结果保留2位有效数字)
(5)试从平衡的角度解释baso 4 可转化为baco 3 的原因:________________________。 依米001年前1
依米001年前1 -
 小尼牟素我 共回答了9个问题
小尼牟素我 共回答了9个问题 |采纳率88.9%(17分)
(1)BaSO 4 (s) + 4C(s)="BaS(s)" + 4CO(g) △H="+571.2" kJ•mol -1
(4分,其中:方程式2分,ΔH 2分,错漏单位扣1分,状态错漏0分。其他计量数,合理即给分)
(2)Ba(OH) 2 ·8H 2 O +2NH 4 Cl=BaCl 2 +2NH 3 ↑+10 H 2 O (2分,写Ba(OH) 2 反应给0分)
(3)CO +PbCl 2 +H 2 O=Pb↓+CO 2 ↑+2HCl (2分)
(4)设发生转化的BaSO 4 的物质的量为xmol,则平衡时c(SO 4 2 - )为x mol•L -1 (1分)
BaSO 4 (s)+CO 3 2 - BaCO 3 (s)+SO 4 2 -
BaCO 3 (s)+SO 4 2 -
起始浓度(mol•L -1 ): 2.0 0
转化浓度(mol•L -1 ): x x
平衡浓度(mol•L -1 ): (2.0—x) x (1分)
K= =
= =4.0×10 -2 (2分,其中列式、代入数值各1分)
=4.0×10 -2 (2分,其中列式、代入数值各1分)
x = 7.7×10 -2 (2分,单位、有效数字错漏合扣1分)
答:发生转化的BaSO 4 的物质的量为7.7×10 -2 mol
(5)BaSO 4 沉淀中存在沉淀溶解平衡:BaSO 4 (s) Ba 2+ (aq) + SO 4 2 - (aq) (1分),加入饱和碳酸钠溶液,CO 3 2 - 浓度增大,使Q c (BaCO 3 )=c(Ba 2+ )×c(CO 3 2 - )>K sp (BaCO 3 ) ,形成碳酸钡的过饱和溶液,因此析出BaCO 3 沉淀(1分),c(Ba 2+ )减小,使BaSO 4 沉淀向溶解方向移动,BaSO 4 转化为BaCO 3 (1分)。(合理即给分)
Ba 2+ (aq) + SO 4 2 - (aq) (1分),加入饱和碳酸钠溶液,CO 3 2 - 浓度增大,使Q c (BaCO 3 )=c(Ba 2+ )×c(CO 3 2 - )>K sp (BaCO 3 ) ,形成碳酸钡的过饱和溶液,因此析出BaCO 3 沉淀(1分),c(Ba 2+ )减小,使BaSO 4 沉淀向溶解方向移动,BaSO 4 转化为BaCO 3 (1分)。(合理即给分)
<>1年前查看全部
- 工业上制备BaCl 2 的工艺流程图如下 某研究小组在实验室用重晶石(主要成分BaSO 4 )对工业过程进行模拟实验。查
工业上制备BaCl 2 的工艺流程图如下 
某研究小组在实验室用重晶石(主要成分BaSO 4 )对工业过程进行模拟实验。查表得
BaSO 4 (s)+4C(s) 4CO(g)+BaS(s) ΔH1=571.2 kJ/mol ①
4CO(g)+BaS(s) ΔH1=571.2 kJ/mol ①
BaSO 4 (s)+2C(s) 2CO 2 (g)+BaS(s) ΔH2=226.2 kJ/mol ②
2CO 2 (g)+BaS(s) ΔH2=226.2 kJ/mol ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na 2 S水解的离子方程式为__________________________________________。
(2)向BaCl 2 溶液中加入AgNO 3 和KBr,当两种沉淀共存时, =________。
=________。
[Ksp(AgBr)=5.4×10 -13 ,Ksp(AgCl)=2.0×10 -10 ]
(3)反应C(s)+CO 2 (g) 2CO(g)的ΔH3=____kJ/mol。
2CO(g)的ΔH3=____kJ/mol。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是__________________________________________________。 sdgsdhdfhdfhg1年前1
sdgsdhdfhdfhg1年前1 -
 佛说心语 共回答了18个问题
佛说心语 共回答了18个问题 |采纳率83.3%1年前查看全部
- 天然硫酸钡叫做重晶石,医疗上常用多做X-射线透视肠胃的内服药剂,俗称“钡餐”.1面是对硫酸钡采用不同分类法的分类,不正确
天然硫酸钡叫做重晶石,医疗上常用多做X-射线透视肠胃的内服药剂,俗称“钡餐”.1面是对硫酸钡采用不同分类法的分类,不正确的是( )
A.BaSO4是酸
B.BaSO4是难溶性盐
C.BaSO4是钡盐
D.BaSO4是硫酸盐 hushui11年前1
hushui11年前1 -
 nnnn622 共回答了14个问题
nnnn622 共回答了14个问题 |采纳率100%解题思路:电离生成金属阳离子(或铵根离子)和酸根离子的化合物属于盐,根据盐中电离出的阳离子又可以将盐分为钾盐、钠盐、钡盐等,根据电离出的酸根离子可以将盐分为碳酸盐、硫酸盐、硝酸盐;根据溶解性分为难溶性盐和易溶性盐;酸是电离出的阳离子全部是氢离子的化合物.A、酸是电离出的阳离子全部是氢离子的化合物,不能电离出氢离子,所以BaSOm不是酸,故A错误;
B、BaSOm溶解度很小,属于难溶性盐,故B正确;
C、因阳离子为钡离子离子,所以属于钡盐,故C正确;
D、因阴离子为硫酸根离子,则BaSOm是硫酸盐,故D正确;
故选A.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系.
考点点评: 本题考查学生盐的概念和分类知识,可以根据盐的概念进行回答,难度不大.1年前查看全部
- 用重晶石和焦炭为原料,制取纯净硫酸钡的改进版
用重晶石和焦炭为原料,制取纯净硫酸钡的改进版
BaSO4+2C=BaS+2CO2↑(高温)
BaS+2HCl=BaCl2+H2S↑
BaCl2+H2SO4=BaSO4↓+2HCl
有毒气体H2S,为使试验既不产生H2S又能获得纯净BaSO4,提出改进意见.
相关反映的化学方程式.
望各位大侠相助. 藴溪1年前1
藴溪1年前1 -
 hhnanan 共回答了15个问题
hhnanan 共回答了15个问题 |采纳率86.7%用氢氧化钠吸收CO2和H2S1年前查看全部
- 以重晶石(主要成分为BaSO 4 )为主要原料制备立德粉(ZnS和BaSO 4 的混合物)的工艺流程如下:
以重晶石(主要成分为BaSO 4 )为主要原料制备立德粉(ZnS和BaSO 4 的混合物)的工艺流程如下:

(1)焙烧时,焦炭需过量,其目的是:①____________________________;②____________________________。
(2)焙烧过程中发生的反应之一是4CO(g)+BaSO 4 (s) BaS(s)+4CO 2 (g),该反应的平衡常数的表达式为__________________________________________________。
BaS(s)+4CO 2 (g),该反应的平衡常数的表达式为__________________________________________________。
反应器中发生反应的化学方程式为____________________________________。
(4)用工业级氧化锌(含少量FeO和Fe 2 O 3 杂质)和硫酸制取硫酸锌溶液时,需先后加入H 2 O 2 溶液和碳酸锌精制,加入H 2 O 2 溶液时发生反应的离子方程式为
________________________________,加入碳酸锌的目的是将溶液中的Fe 3 + 转化为红褐色沉淀,写出该反应的化学方程式:__________________________________________。 vv兵1年前1
vv兵1年前1 -
 地球村帅哥 共回答了30个问题
地球村帅哥 共回答了30个问题 |采纳率83.3%(1)①焦炭燃烧放热,提供反应所需温度
②提高重晶石的利用率
(2)K=
(3)BaS+ZnSO 4 =BaSO 4 ↓+ZnS↓
(4)2Fe 2 + +H 2 O 2 +2H + =2Fe 3 + +2H 2 O
Fe 2 (SO 4 ) 3 +3ZnCO 3 +3H 2 O=3ZnSO 4 +2Fe(OH) 3 +3CO 2 ↑
(1)重晶石与焦炭反应需要高温,而焦炭燃烧可放出热量达到反应所需的高温,同时焦炭过量,必然使更多的重晶石参与反应,从而提高了重晶石的利用率。(3)由流程图可知,反应物为BaS与ZnSO 4 ,可知它们发生复分解反应。(4)工业氧化锌用硫酸溶解时,溶液中存在Fe 2 + ,而H 2 O 2 有强氧化性,可将其氧化为Fe 3 + ;Fe 3 + 在溶液中发生水Fe 3 + +3H 2 O Fe(OH) 3 +3H + ,加入ZnCO 3 与H + 反应,使水解平衡向右移动,得到Fe(OH) 3 沉淀。
1年前查看全部
Fe(OH) 3 +3H + ,加入ZnCO 3 与H + 反应,使水解平衡向右移动,得到Fe(OH) 3 沉淀。
1年前查看全部
- 石膏:重晶石:绿矾:明矾:硫铁矿:
 chenmq1年前2
chenmq1年前2 -
 猢猢 共回答了14个问题
猢猢 共回答了14个问题 |采纳率92.9%CaSO4.2H2O
BaSO4
FeSO4.7H2O
KAl(SO4)2.12H2O
FeS1年前查看全部
- 锌钡白是BaSO 4 和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要
锌钡白是BaSO 4 和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO 2 、CO及少量SO 2 和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程 
请根据上述流程回答下列问题:
(1)重晶石的化学式为_____,锌钡白可用于调制_____色和浅色油漆。
(2)处理过程的步骤为:①__________;②洗涤;③__________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是____________________。
(4)检验锌钡白中含有S 2- 的方法是__________。
(5)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为__________。写出设备2中发生反应的离子方程式:_______________、_______________。
(6)可用_____法分离设备2溶液中的钠盐,进行分离前,需要查得的是__________。
(7)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为__________(至少写一种)。 挂一钩1年前1
挂一钩1年前1 -
 wybad 共回答了23个问题
wybad 共回答了23个问题 |采纳率87%(1)BaSO 4 ;白
(2)①过滤; ③干燥
(3)硫蒸气冷却变成了固体
(4)取样品加入盐酸,若产生的气体能使湿的醋酸铅试纸变黑,说明有硫离子
(5)CO;SO 2 +2OH - →SO 3 2- +H 2 O;CO 2 +2OH - →CO 3 2- +H 2 O
(6)结晶;各物质的溶解度随温度的变化情况
(7)橡胶、火药、农药、治皮肤病等1年前查看全部
- 重晶石矿石主要含有BaSO 4 ,还含有少量有SiO 2 、Al 2 O 3 、Fe 2 O 3 、MnO 2 、FeS
重晶石矿石主要含有BaSO 4 ,还含有少量有SiO 2 、Al 2 O 3 、Fe 2 O 3 、MnO 2 、FeS 2 、Na 2 O、K 2 O等杂质。以下是某工业制备硫酸钡以及分离某些金属的流程图。 
(1)煅烧过程中产生的污染性气体主要是_______________。
(2)确定第一次水洗液中有K + 存在的实验现象是_____________。
(3)写出碱洗时的氧化还原反应方程式:_________________。
(4)①反应生成沉淀的化学式__________,②反应的离子方程式为___________________。
(5)操作I为______,操作Ⅱ为_______。 245841211年前1
245841211年前1 -
 0白云飞0 共回答了28个问题
0白云飞0 共回答了28个问题 |采纳率85.7%(1)SO 2
(2)焰色反应中通过蓝色钴玻璃观察火焰呈紫色
(3)4MnO 2 +3O 2 +4KOH - =4KMnO 4 +2H 2 O
(4)①Fe(OH) 3 ;②AlO 2 - +CO 2 +2H 2 O=Al(OH) 3 +HCO 3 -
(5)加热;电解1年前查看全部
- (2009•徐州三模)工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等.高温煅烧还
(2009•徐州三模)工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等.高温煅烧还原法的工艺流程可简单的表示如下:

已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ•mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s)△H=-1473.2kJ•mol-1
Ba(s)+S(s)=BaS(g)△H=-460kJ•mol-1
请回答:
(1)C(s)和O2(g)反应生成CO(g)的热化学方程式为C(s)+[1/2](s)O2(g)=CO(g)△H=-110.5KJ/molC(s)+[1/2](s)O2(g)=CO(g)△H=-110.5KJ/mol.
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温,应采取的措施是______.
(3)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq)
则:①在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为______.
②与高温煅烧还原法相比,(用饱和Na2CO3溶液的)沉淀转化法的优点主要有______.
③已知:Ksp(BaCO3)=2.8×10-9,Ksp(BaSO4)=1.07×10-10.现欲用沉淀转化法将0.39mol BaSO4全部转化为BaCO3,如每次用1.00L 2.0mol•L-1Na2CO3溶液处理,至少需要处理______次才能达到目的. lili1165001年前1
lili1165001年前1 -
 因14 共回答了15个问题
因14 共回答了15个问题 |采纳率100%解题思路:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)依据平衡移动游戏因素分析;
(3)①依据碳酸钡溶度积,需要增加碳酸根离子使碳酸根离子浓度和钡离子浓度乘积大于溶度积形成碳酸钡沉淀;
②与高温煅烧还原法相比,(用饱和Na2CO3溶液的)沉淀转化法的优点是节能环保;
③依据沉淀转化结合溶度积常数计算处理将0.39mol BaSO4全部转化为BaCO3,所需操作次数;(1)①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ•mol-1
②Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ•mol-1
③Ba(s)+S(s)=BaS(g)△H=-460kJ•mol-1
依据盖斯定律②-③+①得到:4C(s)+2O2(g)=4CO(g)△H=-442kJ/mol;
得到热化学方程式为:C(s)+[1/2]O2(g)=CO(g)△H=-110.5kJ/mol;
故答案为:C(s)+[1/2]O2(g)=CO(g)△H=-110.5kJ/mol;
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温,平衡正向进行,应采取的措施是加入过量的炭,同时通入空气;
故答案为:加入过量的炭,同时通入空气;
(3)①在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法是将适量饱和Na2CO3溶液加入BaSO4沉淀中,充分搅拌,静置、弃去上层清液,如此操作,反复多次直到BaSO4全部转化为BaCO3;
故答案为:将适量饱和Na2CO3溶液加入BaSO4沉淀中,充分搅拌,静置、弃去上层清液,如此操作,反复多次(直到BaSO4全部转化为BaCO3);
②与高温煅烧还原法相比,(用饱和Na2CO3溶液的)沉淀转化法的优点主要有节约能源,无污染物生成,节能环保;
故答案为:节能,环保等;
③设每次能处理BaSO4的物质的量为x
BaSO4+CO32-═BaCO3+SO42-;
2-x x
K=
c(SO42−)
c(CO32−)=[x/2.0−x]=
1.07×10−10
2.58×10−9=0.041,
x=0.079
外理次数[0.39mol/0.079mol]=4.9;则至少处理5次;
故答案为:5;点评:
本题考点: 热化学方程式;化学平衡的调控作用;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查热化学反应及盖斯定律,沉淀溶解平衡的分析计算判断,明确热化学反应的关系及物质的状态、反应热的数值与物质的量的关系,理解沉淀溶解的实质是解题关键,题目难度不大.1年前查看全部
- 工业上用重晶石(BaSO 4 )制备BaCO 3 的常用方法主要有高温锻烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程
工业上用重晶石(baso 4 )制备baco 3 的常用方法主要有高温锻烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:

(1)若“煅烧”时产生一种***还原性气体,则反应的化学方程式为______。
(2)工业上煅烧重晶石矿粉时,为使baso 4 得到充分的还原和维持及应所需的高温,应采取的措施是______。
a.加人过量的炭,同时通入空气b.设法将生成的bas及时移出
(3)在第一次过滤后洗涤,检验是否洗涤干净的试剂最好是______。
(4)沉淀转化法制备baco 3 可用饱和na 2 co 3 溶液将baso 4 转化为baco 3 :
baso 4 (s)+co 3 2 - (aq) baco 3 (s)+so 4 2 - (aq)
baco 3 (s)+so 4 2 - (aq)
则:①在实验室将少量baso 4 固体全部转化为baco 3 的实验操作方法与步骤为______。
②与高温煅烧还原法相比,沉淀转化法的优点主要有______。
③已知:k sp (baco 3 )=2.40×10 - 9 ,k sp (baso 4 )=1.20×10 - 10 。现欲用沉淀转化法将baso 4 转化为baco 3 ,该反应的平衡常数为______。如用1.00 l 0. 210 mol • l - 1 na 2 co 3 溶液处理,试计算baso 4 被转化的质量______(要有计算过程,结果保留3位有效数字)。 kevin7121年前1
kevin7121年前1 -
 tadetaotao 共回答了25个问题
tadetaotao 共回答了25个问题 |采纳率88%(18分)
(1)BaSO 4 +4C BaS+4CO↑(3分)
BaS+4CO↑(3分)
(2)a(2分)
(3)H 2 SO 4 (2分,其它合理答案也给分)
(4)①将适量饱和Na 2 CO 3 溶液加入BaSO 4 固体中,充分搅拌,静置、弃去上层清液;如此操作,反复多次(直到BaSO 4 全部转化为BaCO 3 )(3分)
②节能、环保等(2分)
③5×10 -2 (2分)
设BaSO 4 被转化的物质的量为xmol,则碳酸根离子的变化浓度为xmol/L,即:
BaSO 4 (s)+CO 3 2 - (aq) BaCO 3 (s)+SO 4 2 - (aq)
BaCO 3 (s)+SO 4 2 - (aq)
起始浓度/mol•L -1 0.210 0
变化浓度/mol•L -1 x x
起始浓度/mol•L -1 0.210—x x (1分)
由于K= =
= ,则
,则 =
= (1分)
(1分)
解得:x=0.0100(1分)
由于m=n•M,则BaSO 4 被转化的质量为0.0100mol×233g/mol=2.33g(1分)
答:BaSO 4 被转化的质量为2.33g。
1年前查看全部
- (2009•锦州模拟)重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐.工业上一般采用高温煅烧还原法;实验
(2009•锦州模拟)重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐.工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法.
●高温煅烧还原法
(1)煅烧还原的热化学方程式为______.
有关的数据:Ba(s)+S(s)+202(g)=BaSO4(s)△H=-1.47321kJ•mol-1
C(s)+[1/2]02(g)=CO(g)△H=-110.51kJ•mol-1
Ba(s)+S(s)=BaS(s)△H=-460kJ•mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)______.
●沉淀转化法
BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO
(aq)⇋BaCO3(s)+SO42-(aq)(平衡常数K=O.042)2−3
(3)现有0.20mol BaSO4,每次用1.0L 2.0mol•L-1饱和Na2CO3溶液处理,BaSO4能全部转化,至少需要处理多少次?(写出计算过程)______
(4)从“绿色化学”角度分析,射饱和Na2CO3溶液沉淀转化法的优点是______.
(5)火力发电厂燃煤排烟,释放出大量的氮氧化物、二氧化碳等气体.某热电厂同时具有烟气脱硝、脱硫、二氧化碳捕集(脱碳)设施,成为高效、节能、绿色环保燃煤电厂.其中脱硝采用催化还原法,C0(NH2)2 (尿素)作还原剂,在加热条件下催化还原氮氧化物,1mol CO(NH2)2反应时失去6mol电子,请写出尿素与二氧化氮反应的化学方程式6NO2+4CO(NH2)2
7N2+4CO2+8H2O催化剂 .6NO2+4CO(NH2)2.
7N2+4CO2+8H2O催化剂 . sadasdas11年前1
sadasdas11年前1 -
 jvictor 共回答了16个问题
jvictor 共回答了16个问题 |采纳率93.8%解题思路:(1)根据盖斯定律结合题目中已知的热化学方程式来计算;
(2)在溶液中,硫离子水解导致溶液显示碱性;
(3)根据化学方程式和化学平衡常数进行计算;
(4)根据所发生的化学反应来判断分析方法的优点;
(5)根据已知反应物和生成物利用元素守恒,结合得失电子守恒书写方程式.(1)a、Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ•mol-1
b、C(s)+[1/2]O2(g)=CO(g);△H=-110.5kJ•mol-1
c、Ba(s)+S(s)=BaS(s);△H=-460kJ•mol-1,
根据盖斯定律:反应BaSO4(s)+4C(s)=BaS(s)+4CO(g)和a、b、c之间的关系是4b-a+c,
所以BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1;
(2)在硫化钡中,硫离子水解而使得硫化钡显碱性,即S2-+H2O⇌HS-+OH-,故答案为:S2-+H2O⇌HS-+OH-;
(3)设每次用1.00L 2.0 mol•L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42
(2.0-x)mol•L-1 x mol•L-1
根据K=
c(SO42−)
c(CO32−)=[x/2.0−x]=0.042
解得:x=0.081,处理次数=[0.2mol/0.081mol]=2.5,所以至少处理3次;
故答案为:3次;
(4)用饱和Na2CO3溶液沉淀转化法的优点是节能、环保,故答案为:节能,环保;
(5)C0(NH2)2 (尿素)作还原剂,在加热条件下催化还原氮氧化物,根据元素守恒则反应产物为N2、CO2和H2O,1mol CO(NH2)2反应时失去6mol电子,根据得失电子守恒配平方程式为:6NO2+4CO(NH2)2
催化剂
.
7N2+4CO2+8H2O,
故答案为:6NO2+4CO(NH2)2
催化剂
.
7N2+4CO2+8H2O.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;用盖斯定律进行有关反应热的计算;盐类水解的应用.
考点点评: 本题考查了学生用盖斯定律计算反应热、盐类水解的离子方程式的书写、化学方程式的书写以及沉淀转化的有关知识,侧重于对学生计算能力的考查,难度中等.1年前查看全部
- 工业上制备BaCl 2 的工艺流程图如下 某研究小组在实验室用重晶石(主要成分BaSO 4 )对工业过程进行模拟实验。查
工业上制备BaCl 2 的工艺流程图如下 
某研究小组在实验室用重晶石(主要成分BaSO 4 )对工业过程进行模拟实验。查表得 
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na 2 S水解的离子方程式为______________________
(2)向BaCl 2 溶液中加入AgNO 3 和KBr,当两种沉淀共存时 __________________
__________________
(3)
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是______________、______________。 燕山山月似钩1年前1
燕山山月似钩1年前1 -
 sasa2005 共回答了17个问题
sasa2005 共回答了17个问题 |采纳率82.4%1年前查看全部
- 请问比重4.2、硫酸钡含量98%的重晶石目前市场价格是多少?
 沉默的主人1年前1
沉默的主人1年前1 -
 比青蛙丑的yy 共回答了13个问题
比青蛙丑的yy 共回答了13个问题 |采纳率100%重晶石原矿石价格130-170元(最低价)不含运费
比重小于4.1每吨120元
比重4.1-4.2每吨140元
比重4.2以上每吨市场价150元以上1年前查看全部
- 用重晶石制取纯净硫酸钡的改进版BaSO4+2C=BaS+2CO2↑(高温) BaS+2HCl=BaCl2+H2S↑ Ba
用重晶石制取纯净硫酸钡的改进版
BaSO4+2C=BaS+2CO2↑(高温)
BaS+2HCl=BaCl2+H2S↑
BaCl2+H2SO4=BaSO4↓+2HCl
有毒气体H2S,为使试验既不产生H2S又能获得纯净BaSO4,提出改进意见.
不加入盐酸而加入Na2CO3,不会产生H2S气体 BaS+ Na2CO3=BaCO3↓+Na2S
BaCO3+2HCl=BaCl2+H2O+CO2↑ BaCl2+ Na2SO4== BaSO4↓+ 2NaCl
但为什么不直接BAS+NA2SO4==BASO4↓+NA2S 愚平1年前2
愚平1年前2 -
 千年的uu 共回答了26个问题
千年的uu 共回答了26个问题 |采纳率80.8%用此法中间有一步中Ba已易溶的BaCl2形式存在,可以通过重结晶、过滤等方法提纯,直接用Na2SO4不能通过这些常用方法提纯.1年前查看全部
- 重晶石矿粉与煤粉煅烧还原的热化学方程式 请教一下.重晶石矿粉与煤粉煅烧还原的热化学方程式,
重晶石矿粉与煤粉煅烧还原的热化学方程式 请教一下.重晶石矿粉与煤粉煅烧还原的热化学方程式,
谢谢~ 姹紫嫣红1081年前1
姹紫嫣红1081年前1 -
 wayi1978 共回答了19个问题
wayi1978 共回答了19个问题 |采纳率89.5%错了,产物是硫化钡:
BaSO4 + 3C + O2 = BaS + 3CO21年前查看全部
- 怎样用重晶石提炼硫酸钡?如题.
 tuntun10311年前1
tuntun10311年前1 -
 manwu989 共回答了15个问题
manwu989 共回答了15个问题 |采纳率86.7%重晶石 就是硫酸钡啊~
要是提纯的话 含有水分就电热蒸发,
含其他杂质要根据具体杂质成分提取
要是课后作业的话,好象王水能溶解 硫酸钡 然后就好办了吧1年前查看全部
- 用重晶石和焦炭为原料,制取纯净硫酸钡的改进版
用重晶石和焦炭为原料,制取纯净硫酸钡的改进版
BaSO4+2C=BaS+2CO2↑(高温)
BaS+2HCl=BaCl2+H2S↑
BaCl2+H2SO4=BaSO4↓+2HCl
有毒气体H2S,为使试验既不产生H2S又能获得纯净BaSO4,提出改进意见.
相关反映的化学方程式.
望各位大侠相助.
是不产生H2S haojia6271年前1
haojia6271年前1 -
 舟亦 共回答了9个问题
舟亦 共回答了9个问题 |采纳率88.9%BaSO4+2C=BaS+2CO2↑(高温)
2BaS+3O2=2BaO+2SO2(高温)
BaO+H2SO4=BaSO4↓+H2O
可以了么?不用我解释了吧?生成的SO2循环进H2SO4的生产.1年前查看全部
- (8分)重晶石(主要成分是BaSO 4 )是制备钡化合物的重要原料,但BaSO 4 不溶于水也不溶于酸,这给转化为其他钡
(8分)重晶石(主要成分是BaSO 4 )是制备钡化合物的重要原料,但BaSO 4 不溶于水也不溶于酸,这给转化为其他钡盐带来了困难,工业上用饱和Na 2 CO 3 溶液处理BaSO 4 沉淀,待达到平衡后,移走上层清夜,重复多次操作,将其转化为易溶于酸的BaCO 3 ,再由BaCO 3 制备其它钡盐。
Ksp(BaSO 4 )=1.0×10 -10 Ksp(BaCO 3 )=5.0×10 -10
(1)写出沉淀转化的方程式: ,此反应平衡常数 K 的值为 。
(2)要实现该转化C(CO 3 2- )不低于 mol/L
(3)必须更换Na 2 CO 3 溶液的原因是什么? 阳洋1年前0
阳洋1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 重晶石与焦炭高温下反应
 叠寒1年前1
叠寒1年前1 -
 思念你 共回答了20个问题
思念你 共回答了20个问题 |采纳率90%可能发生的反应有3个:
BaSO4+C==高温==BaSO3+CO↑
BaSO4+2C==高温==BaS+2CO2↑
CO2+C==高温==2CO1年前查看全部
- 制纯净硫酸钡的化学式用重晶石和焦炭为原料,制取纯净硫酸钡的化学式.望各位大侠相助.
 walkinginthe1年前2
walkinginthe1年前2 -
 cb84 共回答了20个问题
cb84 共回答了20个问题 |采纳率95%焦炭燃烧提供热使重晶石分解的.
BaSO4=(高温)BaO+SO3↑
BaO+H2O=Ba(OH)2
SO3+H2O=H2SO4
Ba(OH)2+H2SO4=BaSO4↓+2H2O
仅作参考.1年前查看全部
- 重晶石中的“重”怎么念?重晶石是以硫酸钡(BaSO 4 )为主要成分的非金属矿产品但重晶石中的“重”是念ZHONG啊还是
重晶石中的“重”怎么念?
重晶石是以硫酸钡(BaSO 4 )为主要成分的非金属矿产品
但重晶石中的“重”是念ZHONG啊还是念CHONG?
YTM YTM B . smithy1年前1
smithy1年前1 -
 warpath 共回答了24个问题
warpath 共回答了24个问题 |采纳率87.5%应该读 ZHONG 重晶石1年前查看全部
- 利用重晶石(BaSO4)制备其他钡盐,需要先将其转化成BaCO3.工业上一般采用高温煅烧还原法,实验室可以采用沉淀转化法
利用重晶石(BaSO4)制备其他钡盐,需要先将其转化成BaCO3.工业上一般采用高温煅烧还原法,实验室可以采用沉淀转化法实现这种转化.
Ⅰ.高温煅烧还原法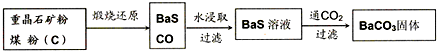
(1)煅烧还原的热化学方程式为:______.
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H1=-1473.2kJ•mol-1
C(s)+[1/2]O2(g)=CO(g);△H2=-110.5kJ•mol-1
Ba(s)+S(s)=BaS(s);△H3=-460kJ•mol-1
(2)实验测得水浸取液呈强碱性,为什么?(用离子方程式表示)______.
Ⅱ.沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液时,会有如下转化:
BaSO4(s)+CO
(aq)⇌BaCO3(s)+SO2−3
(aq)(平衡常数K=0.042).2−4
BaSO4沉淀转化为BaCO3沉淀的一般过程,是把BaSO4置于一定量的饱和Na2CO3溶液中浸泡,再充分搅拌,静止后弃去上层清液;如此处理多次,可使BaSO4全部转化为BaCO3.
(3)向足量BaSO4沉淀中加入一定量 c mol/L Na2CO3溶液充分搅拌后,溶液中SO
的浓度是多少?(写出计算过程,结果用含c的代数式表示)2−4
(4)现有0.40mol BaSO4,欲使之全部转化为BaCO3.若每次用1.00L 2.0mol•L-1饱和Na2CO3溶液处理,至少需要处理______次.
(5)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法,相对于高温煅烧还原法的优点是:______(至少写2点). 222qw881年前1
222qw881年前1 -
 tnntt 共回答了29个问题
tnntt 共回答了29个问题 |采纳率86.2%解题思路:(1)根据盖斯定律结合题目中已知的热化学方程式来计算;
(2)在溶液中,硫离子水解导致溶液显示碱性;
(3)根据化学方程式和化学平衡常数进行计算;
(4)根据化学方程式和化学平衡常数进行计算;
(5)根据所发生的化学反应来判断分析方法的优点;(1)a、Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ•mol-1
b、C(s)+[1/2]O2(g)=CO(g);△H=-110.5kJ•mol-1
c、Ba(s)+S(s)=BaS(s);△H=-460kJ•mol-1,
根据盖斯定律:反应BaSO4(s)+4C(s)=BaS(s)+4CO(g)和a、b、c之间的关系是4b-a+c,
所以BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1;
(2)在硫化钡中,硫离子水解而使得硫化钡显碱性,即S2-+H2O⇌HS-+OH-,故答案为:S2-+H2O⇌HS-+OH-;
(3)设每次用1.00L c mol•L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42
(c-x)mol•L-1 x mol•L-1
根据K=
c(SO42−)
c(CO32−)=[x/c−x]=0.042
解得:x=[0.042c/1.042]mol
溶液中硫酸根离子浓度为:[0.042c/1.042]mol/L;
答;溶液中硫酸根离子浓度为:[0.042c/1.042]mol/L;
(4)设每次用1.00L 2.0 mol•L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42
(2.0-x)mol•L-1 x mol•L-1
根据K=
c(SO42−)
c(CO32−)=[x/2.0−x]=0.042
解得:x=0.081,处理次数=[0.4mol/0.081]=4.9,所以至少处理5次;
故答案为:5次;
(5)用饱和Na2CO3溶液沉淀转化法的优点是节能、环保,故答案为:节能,环保;点评:
本题考点: 热化学方程式;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了学生用盖斯定律计算反应热、盐类水解的离子方程式的书写、化学方程式的书写以及沉淀转化的有关知识,侧重于对学生计算能力的考查,难度中等.1年前查看全部
- 重晶石制高纯硫酸钡时为什么要加入过量的炭,同时还要通入空气?
 hekeyang19801年前3
hekeyang19801年前3 -
 沸腾的冰山 共回答了11个问题
沸腾的冰山 共回答了11个问题 |采纳率81.8%重晶石与焦炭反应,生成硫化钡,一氧化碳及二氧化碳.由于是过量的炭,难免会有剩余,所以通入空气使得多余的炭继续氧化变成一氧化碳二氧化碳气体带走1年前查看全部
大家在问
- 1英语:by around eight o'clock是否等于at about eight o'clock?
- 21.三块完全相同的木块从同一高度由静止开始下落,A木块顺利下落,B木块在开始下落的瞬间被一水平飞来的子弹击中(未穿出),
- 3(2014•普宁市)黄瓜果肉细胞和人的口腔上皮细胞都有的结构是( )
- 4草缸用什么过滤
- 5英语画线提问?1:my mother oftr does homework in the morning 2:the g
- 6动物有血型吗?它们的血可以输给人类或者输给其他动物吗?
- 7计算下列各题,能简算的要简算.①14分之5*49*35分之2②36*(6分之1-9分之1)③18分之11*14分之3*5
- 8因为我自己的事情,用英语怎么说?
- 9如图,在三角形ABC中,DB是角B的平分线,DE平行于AB交BC于E,角BDE=35°,角C=46°,问角CDE是多少度
- 10美国签证,面签,是要求英语吗?
- 11请帮我找《折杨柳》的原文,
- 12质点M的位移s随时间t的变化关系为s(t)=at^2+1(位移单位:m,时间单位:s),若质点M在t=2s时的瞬时速度为
- 13英语作文,我的妈妈 急!好了加50分!
- 14Are you ten 做肯定回答
- 15电学,我家的楼梯灯在我家里的楼梯里,比如从二楼通向三楼的那段楼梯里有一盏楼梯灯,在二楼和三楼都有控制这盏灯的开关,在二楼







