钒电池的充放电的反应方程式,不要电极的反应式,要总的方程式
 卓美2022-10-04 11:39:541条回答
卓美2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 laoqu001 共回答了9个问题
laoqu001 共回答了9个问题 |采纳率100%- 钒电池总反应为 (VO2)+ + V2++2H+→(VO)2+ + V3++ H2O
- 1年前
相关推荐
- 在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,
在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的[1/25]和[1/10].全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:

下列有关该钒电池的说法不正确的是( )
A.该电池为可逆电池,当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高
B.放电过程中,右槽溶液中溶液颜色由紫色变为绿色
C.充电过程中,H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应
D.充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)增加了0.5mol 雌月季1年前1
雌月季1年前1 -
 坏掉的苹果 共回答了18个问题
坏掉的苹果 共回答了18个问题 |采纳率100%解题思路:A.当左槽溶液逐渐由黄变蓝,V元素的化合价由+5价变为+4价,该电极上得电子发生还原反应;
B.放电过程中,右槽为原电池负极,失电子发生氧化反应;
C.充电过程中,氢离子向阴极移动;
D.充电时,若转移的电子数为3.01×1023个即物质的量为0.5mol,根据转移电子和氢离子的物质的量之间的关系式判断.A.当左槽溶液逐渐由黄变蓝,V元素的化合价由+5价变为+4价,该电极上得电子发生还原反应,电极反应式为VO2++2H++e-=VO2++H2O,氢离子参加反应而使溶液中氢离子浓度减小,导致溶液pH增大,该过程为放电过程,故A错误;
B.放电过程中,右槽为原电池负极,失电子发生氧化反应,溶液由紫色变为绿色,故B正确;
C.充电过程中,右槽为阴极,H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应,故C正确;
D.充电时,左槽发生的反应为VO2++H2O═VO2++2H++e-,当转移电子为3.01×1023个即为0.5mol电子时,生成氢离子为1mol,此时氢离子参与正极反应,通过交换膜定向移动使电流通过溶液,溶液中离子的定向移动可形成电流,通过0.5mol电子,则左槽溶液中n(H+)的变化量为1mol-0.5mol=0.5mol,故D正确;
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,根据外接电源正负极确定该装置正负极或阴阳极,再结合电极反应式来分析解答即可,难点是电极反应式的书写,难度中等.1年前查看全部
- 在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向。如果电动汽车上使用新型钒电池,一次性充电3—5分钟后,
在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向。如果电动汽车上使用新型钒电池,一次性充电3—5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的1/25和1/10。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:
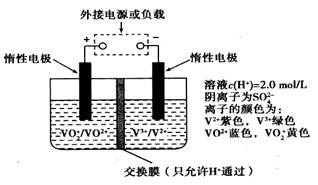
下列有关该钒电池的说法不正确的是:A.该电池为可逆电池, 当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高 B.放电过程中,右槽溶液中溶液颜色由紫色变为绿色 C.充电过程中, H + 可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应 D.充电时若转移的电子数为3.01  10 23 个,左槽溶液中n(H + )增加了0.5mol
10 23 个,左槽溶液中n(H + )增加了0.5mol handsen011年前1
handsen011年前1 -
 傲气轩辕 共回答了18个问题
傲气轩辕 共回答了18个问题 |采纳率88.9%A
1年前查看全部
大家在问
- 1重量为20千克的一箱苹果共有48只,问平均一千克苹果中有几只苹果?
- 2一箱苹果每只平均重85.6克,若再加一个94克重的苹果,则平均每只增重1.4克,这箱苹果共有多少只?
- 3一道普通的小学数学应用题甲和乙从东西两地同时出发,相对而行,两地相距10千米.甲每小时走3千米,乙每小时走2千米,几小时
- 4英文翻译 特此发布
- 5找不到施力物体的力是不存在的对吗?
- 6语文中什么是副词,简单解释并举例子
- 7“找不到施力物体的里是不存在的”这句话对么,为什么?
- 8入迷知晓振奋的近义词
- 9人类能从化学品中提取有机物质吗?能从有机物物质培养微生物吗?能总微生物制造出生命吗 .比喻新型物种
- 10成语同义词素 ()时()势
- 11流星体的物质内容是些什么
- 12五年级下册乘法口算题和答案
- 13目前发现的天体中,最小的是流星体,月球,冥王星还是星际物质
- 14某小学的同学参加比赛,每8人、每9人、每10人一组都多出3人.参加比赛的最少有多少人?
- 15化简3(2a^2-3ab)-2(a^2-ab)+2(-a^2+ab-b^2)要有过程
