NH3H2O是什么它是一个化学式我想知道它的学名是什么难道不是氢氧化铵吗它肯定是一个纯净物而且没中间那个点我知道但这不是
 sileduyaoai2022-10-04 11:39:546条回答
sileduyaoai2022-10-04 11:39:546条回答它是一个化学式
我想知道它的学名是什么
难道不是氢氧化铵吗
它肯定是一个纯净物
而且没中间那个点
我知道
但这不是学名
就像双氧水的学名是过氧化氢

已提交,审核后显示!提交回复
共6条回复
 冬阳之 共回答了21个问题
冬阳之 共回答了21个问题 |采纳率81%- 是氨水,NH4OH --氢氧化铵
- 1年前
 kiaoja 共回答了30个问题
kiaoja 共回答了30个问题 |采纳率- 氨水
- 1年前
 yaozai886 共回答了172个问题
yaozai886 共回答了172个问题 |采纳率- 一水和氨
- 1年前
 师洋吻思远 共回答了6个问题
师洋吻思远 共回答了6个问题 |采纳率- NH3·H2O是共价化合物 是氨分子与水分子以复杂的氢键连接起来的三维结构
- 1年前
 美人关我投降 共回答了2个问题
美人关我投降 共回答了2个问题 |采纳率- 二水合氨或者氨水
- 1年前
 xyx19 共回答了10个问题
xyx19 共回答了10个问题 |采纳率- 是氨水
- 1年前
相关推荐
- 某厂排放的废水中含有硫酸,若用氨水(NH3•H2O)中和,就能得到氮肥--硫酸铵[(NH4)2SO4],该反应所属的反应
某厂排放的废水中含有硫酸,若用氨水(NH3•H2O)中和,就能得到氮肥--硫酸铵[(NH4)2SO4],该反应所属的反应类型是( )
A. 复分解反应
B. 化合反应
C. 置换反应
D. 分解反应 SLH55671年前1
SLH55671年前1 -
 人行行人 共回答了27个问题
人行行人 共回答了27个问题 |采纳率88.9%解题思路:利用根据反应物、生成物写出反应的化学方程式(2NH3•H2O+H2SO4═(NH4)2SO4+2H20)然后根据化学反应的类型的特点进行判断,化合反应的特征是多变一;分解反应的特征是一变多;置换反应的特征是单质与化合物反应生成新的单质与化合物;复分解反应的特征是两种化合物相互交换成分生成两种新的化合物;A、属复分解反应,因为是两种化合物反应生成了两种化合物.
B、不属化合反应,因为不是两种或两种以上物质反应生成了另一种物质;
C、不属置换反应,因为不是单质与化合物反应生成单质与化合物;
D、不属分解反应,因为不是一种物质反应生成了两种或两种以上物质;
故选A点评:
本题考点: 反应类型的判定.
考点点评: 要求学生能能够熟练判断四种基本化学反应类型:化合反应(多变一)、分解反应(一变多)、置换反应(单质换单质)、复分解反应(头尾结合、双交换价不变)是这类题目的考查重点.1年前查看全部
- Ba(OH)2,NaOH,NH3•H2O比较(分别用a,b,c表示) (1)同c三种溶液Ph (2)同PH三
Ba(OH)2,NaOH,NH3•H2O比较(分别用a,b,c表示) (1)同c三种溶液Ph (2)同PH三种溶液C
(3))同PH三种溶液稀释相同倍数,则C
(4) 同PH三种溶液稀释不同倍数后PH仍相等,则三种溶液稀释倍数
(5)同C同V三种溶液消耗盐酸
(6)同PH同V三种溶液消耗同C盐酸体积 正宗李布衣1年前1
正宗李布衣1年前1 -
 d1_o 共回答了25个问题
d1_o 共回答了25个问题 |采纳率92%1,同PH三种溶液,Ba(OH)2,NaOH,NH3•H2O,的浓度是,2a=1年前查看全部
- 有A、B、C、D、E、F 6瓶不同物质的溶液,它们各是NH3•H2O、Na2CO3、MgSO4、NaHCO3
有A、B、C、D、E、F 6瓶不同物质的溶液,它们各是NH3•H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液
A+C沉,A+D沉,A+E气体 B+D沉 C+D沉 C+F无现象 xiepei1年前2
xiepei1年前2 -
 woodx 共回答了32个问题
woodx 共回答了32个问题 |采纳率90.6%A+E气体说明有A.E一种一定是HNO3.另一种可能是Na2CO3.NaHCO3中的一种..A+C沉,A+D沉说明A不是HNO3所以E为HNO3.A为Na2CO3.C.D就可能是MgSO4.BaCl2中的一种.因为B+D沉 C+D沉 C+F无现象说明D是MgSO4.C为BaCl2.B为NaHCO3,最后F为NH3•H2O
A:Na2CO3 B:NaHCO3 C:BaCl2 D:MgSO4 E:HNO3 F:NH3•H2O1年前查看全部
- 水解方程式HCO3- +H2O----H3O+ + CO32-NH4+ +2H2O---NH3H2O + H3O+这两个
水解方程式
HCO3- +H2O----H3O+ + CO32-
NH4+ +2H2O---NH3H2O + H3O+
这两个哪一个对?还是都对?……
 傻13青年1年前1
傻13青年1年前1 -
 一晚豌豆 共回答了13个问题
一晚豌豆 共回答了13个问题 |采纳率76.9%上一个是电离方程式
下一个对1年前查看全部
- (1)下列电解质中,①NaCl、②NaOH,③NH3•H2O、④CH3COOH,⑤BaSO4、⑥HCl
(1)下列电解质中,①NaCl、②NaOH,③NH3•H2O、④CH3COOH,⑤BaSO4、⑥HCl⑦H2O是强电解质的是______,是弱电解质的是______
(2)火箭推进器中有燃料肼(N2H4)和液态双氧水,它们反应产生氮气和水蒸气并放出热.已知:0.4mol液态肼与足量的液态双氧水反应生成氮气和水蒸气,放出256.652kJ的热量.该反应的热化学方程式______
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的大小关系为______.
(4)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ/mol
②C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
③2H2(g)+O2(g)=2H2O(l)△H3=-571.6KJ/mol则2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=______. 岁月清风1年前1
岁月清风1年前1 -
 灰涩涩 共回答了20个问题
灰涩涩 共回答了20个问题 |采纳率80%解题思路:(1)完全电离的电解质为强电解质,强酸、强碱和大多数盐是强电解质,部分电离的电解质是弱电解质,弱酸和弱碱属于弱电解质;
(2)反应方程式为:N2H4+2H2O2=N2+4H2O,根据0.4mol液态肼放出的热量,计算1mol液态肼放出的热量,进而写出热化学方程式;
(3)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热;
(4)根据盖斯定律进行计算.(1)①NaCl、②NaOH、⑤BaSO4、⑥HCl在水溶液里或熔融状态下完全电离,为强电解质;
③NH3•H2O、④CH3COOH、⑦H2O在水溶液里只有部分电离,为弱电解质,
故答案为:①②⑤⑥;③④⑦;
(2)反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出256.652KJ的热量,则1mol液态肼放出的热量为[265.652kJ/0.4]=641.63kJ,
所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ/mol;
(3)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热,因反应热为负值,放出的热量越多,则△H越小,则△H3>△H2>△H1,
故答案为:△H3>△H2>△H1;
(4)①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ/mol
②C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
③2H2(g)+O2(g)=2H2O(l)△H3=-571.6KJ/mol
将方程式2②+③-①得:2C(s)+2H2(g)+O2(g)=CH3COOH(l),则△H=2△H2+△H3-△H1=2(-393.5kJ/mol)+(-571.6KJ/mol)-(-870.3KJ/mol)=-488.3kJ/mol,
故答案为:-488.3kJ/mol.点评:
本题考点: 用盖斯定律进行有关反应热的计算;热化学方程式;反应热的大小比较;强电解质和弱电解质的概念.
考点点评: 本题考查了热化学反应方程式的书写、盖斯定律、强弱电解质的判断,根据强弱电解质概念、盖斯定律等来分析解答即可,只有(3)中浓硫酸、醋酸稀释过程中热量的变化,为易错点.1年前查看全部
- 将下列物质分类,并用序号填空:①NH3•H2O ②空气 ③Mg&
将下列物质分类,并用序号填空:
①NH3•H2O②空气③Mg④CuO⑤HNO3⑥碘酒⑦NaOH⑧纯碱⑨金刚石
其中,属于混合物的是______;属于氧化物的是______;属于酸的是______;属于盐的是______;属于单质的是______;属于电解质的是______. ycwyczy1年前1
ycwyczy1年前1 -
 lijwy 共回答了25个问题
lijwy 共回答了25个问题 |采纳率76%解题思路:根据混合物、氧化物、酸、盐、单质、电解质的定义判断.
混合物:由两种或多种物质混合而成的,这些物质相互间没有发生反应,混合物里各物质都保持原来的性质.
氧化物:由两种元素组成且其中一种是氧元素的化合物,
酸:在水溶液中电离出的阳离子全是氢离子的化合物,
盐:电离时生成金属离子或铵根离子(NH4+)与酸根离子或非金属离子的化合物.
单质:由同种元素组成的纯净物,
电解质:电解质是在水溶液中或在熔融状态下能够导电的化合物.根据定义分析:
①NH3•H2O是电解质;
②空气是混合物;
③Mg是单质;
④CuO是氧化物;
⑤HNO3是酸,属于电解质;
⑥碘酒是混合物;
⑦NaOH是强碱,属于电解质;
⑧纯碱是盐,属于电解质;
⑨金刚石是单质;
故答案为:②⑥; ④; ⑤;⑧;③⑨;①⑤⑦⑧.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系;电解质与非电解质.
考点点评: 本题考查了混合物、氧化物、碱、盐、单质、电解质的概念,侧重考查学生对这几个概念的辨别能力,通过本题要知道纯碱是盐不是碱,碘酒是混合物不是化合物.1年前查看全部
- 根据下列化合物:①NaCl ②NaOH ③HCl ④NH4Cl ⑤CH3COONa ⑥CH3COOH ⑦NH3•H2O
根据下列化合物:①NaCl ②NaOH ③HCl ④NH4Cl ⑤CH3COONa ⑥CH3COOH ⑦NH3•H2O ⑧H2O,回答下列问题.
(1)NH4Cl溶液显______性,用离子方程式表示原因______,其溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)c(Cl-)>c(NH4+)>c(H+)>c(OH-).
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=______,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=______.
(3)已知纯水中存在如下平衡:H2O+H2O═H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是______(填字母序号).
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]
D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m______(填“<”、“>”或“=”)n.
(5)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为:______. zhaoh1年前1
zhaoh1年前1 -
 飘飘zn 共回答了15个问题
飘飘zn 共回答了15个问题 |采纳率73.3%解题思路:(1)NH4Cl为强酸弱碱盐,水解呈酸性;
(2)CH3COONa为强碱弱酸盐,水解促进水的电离,醋酸抑制水的电离;
(3)欲使平衡向右移动,且所得溶液显酸性,可加入水解呈酸性的盐;
(4)一水合氨为弱电解质,不能完全电离,加水促进电离;
(5)溶液中氢离子浓度越大,则其pH越小,按照溶液中氢离子浓度由小到大顺序进行排列.(1)氯化铵为强酸弱碱盐,水解呈酸性,铵根离子水解的离子方程式为NH4++H2O⇌H++NH3•H2O,铵根离子水解,则(Cl-)>c(NH4+),所以溶液中离子浓度关系为:(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:酸;NH4++H2O⇌H++NH3•H2O;(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)CH3COONa为强碱弱酸盐,pH=11的CH3COONa溶液中,c(OH-)=10-3mol/L,c(H+)=10-11mol/L,CH3COONa 中氢离子和氢氧根离子都是水电离的,则水电离出来的c(OH-)为10-3mol/L;在pH=3的CH3COOH溶液中,c(OH-)=10-11mol/L,酸中的氢氧根离子由水电离,则水电离出来的c(OH-)=c(H+)为10-11mol/L,
故答案为:10-3mol/L;10-11mol/L;
(3)A.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故A错误;
B.向水中加Na2CO3固体,水解呈碱性,故B错误;
C.加热至100℃,促进水的电离,溶液呈中性,故C错误;
D.向水中加入(NH4)2SO4固体,水解呈酸性,故D正确;
故答案为:D;
(4)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,
故答案为:<;
(5)①NaCl ②NaOH ③HCl ④NH4Cl ⑤CH3COONa ⑥CH3COOH ⑦NH3•H2O,
显示碱性的为:②NaOH、⑤CH3COONa,⑦NH3•H2O,氢氧化钠为强碱,NH3•H2O为弱碱,CH3COONa为盐,所以pH②>⑦>⑤;
显示中性的为①NaCl,pH=7;
显示酸性的为:③HCl ④NH4Cl⑥CH3COOH,浓度相同时,盐酸为强酸,氢离子浓度最大,醋酸为一元弱酸,氢离子浓度小于盐酸,而氯化铵为强酸弱碱盐,氢离子浓度较小,所以三种酸性溶液的pH大小关系为:④>⑥>③,故物质的量浓度相同时,按pH由大到小的顺序为:②>⑦>⑤>①>④>⑥>③,
故答案为:②>⑦>⑤>①>④>⑥>③.点评:
本题考点: 盐类水解的应用;弱电解质在水溶液中的电离平衡;水的电离;影响盐类水解程度的主要因素.
考点点评: 本题考查了离子浓度大小比较、水的电离及其影响因素、弱电解质的电离平衡等知识,题目难度中等,试题涉及的题量较大,充分考查了学生对所学知识的掌握情况,明确溶液中水电离的氢离子浓度大小的计算方法.1年前查看全部
- 等浓度NH4CL NH3H2O混合溶液电离大于水解的原因是什么
 不吸烟只hh1年前2
不吸烟只hh1年前2 -
 jxt158201 共回答了18个问题
jxt158201 共回答了18个问题 |采纳率88.9%①首先要明确一点,氨水呈碱性
②盐溶液,无论是否有离子要水解都对含有酸或碱溶液的影响很微弱,溶液仍称酸/碱性,除非它们之间会发生反应
③分析具体题目:NH4Cl与NH3H20混合溶液呈碱性,NH4+会水解但及其微弱,可以忽略.但氨水电离出的OH-不可忽略,电离大于水解.
总的来说,你只要记住第②点,这类题目都没问题了1年前查看全部
- A,B,C,D,E五种溶液分别是NaOH溶液,NH3•H2O溶液,CH3COOH溶液,HCl溶液,NH4HSO4溶液中的
A,B,C,D,E五种溶液分别是NaOH溶液,NH3•H2O溶液,CH3COOH溶液,HCl溶液,NH4HSO4溶液中的一种,常温下进行下列实验.
①将1LpH=3的A溶液分别与0.001mol•L-1xLB溶液、0.001mol•L-1yLD溶液充分反应后溶液呈中性,x、y大小关系为:y<x;
②浓度均为0.1mol•L-1A和E溶液,pH(A)<PH(E);
③浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题
(1)D是______
(2)c(OH-)和体积均相等的两份溶液A和E,分别与锌粒反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是______
①反应所需要的时间:E>A
②开始反应时的速率:A>E
③参加反应的锌粉的物质的量:A=E
④反应过程的平均速率:E>A
⑤A溶液中有锌粉剩余
⑥E溶液中有锌粉剩余
(3)室温下,向0.01mol•L-1的C溶液中滴加0.01mol•L-1的D溶液至中性,得到的溶液中所有粒子的物质的量浓度由大到小的顺序为______
(4)常温下,将0.1mol•L-1的E溶液加水稀释的过程中,下列表达式的数据一定变小的是______
A.c(H+) B.
C.c(H+)•c(OH-) D.c(H+) c(E) c(OH−) c(H+)
(5)25℃时,已知某些物质的电子平衡常数如下表
则:物质的量浓度均为0.1mol.L-1的下列四种溶液:a.Na2CO3溶液,b.NaClO溶液 c.CH3COONa溶液,d.NaHCO3溶液的pH由大到小的顺序是______(用字母表示)化学式 CH3COOH H2CO3 HClO 电离平衡常数 1.8×10-5 K1=4.3×10-7
K2=5.6×10-113.0×10-8  八小戒1年前1
八小戒1年前1 -
 xudhui 共回答了21个问题
xudhui 共回答了21个问题 |采纳率100%解题思路:A溶液是酸性溶液,能和碱反应,所以B、D是NaOH和NH3•H2O,将1LpH=3的A溶液分别和相同浓度的B、D反应使溶液呈中性时,x、y大小关系为:y<x,强碱体积小于弱碱,所以D是NaOH、B是NH3•H2O;
浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性,如果C是醋酸或盐酸,其混合溶液呈碱性或中性,要使混合溶液呈酸性,则C是NH4HSO4;
浓度均为0.1mol•L-1A和E溶液,pH(A)<PH(E),说明A的电离程度大于E,所以A是盐酸、E是醋酸;
(1)根据以上分析确定D;
(2)c(OH-)和体积均相等的两份溶液A和E,A的浓度小于E,反应速率与氢离子浓度成正比,反应速率越大,反应时间越短,根据转移电子守恒计算消耗锌的质量,如果金属有剩余,应该是强酸中锌有剩余;
(3)室温下,向0.01mol•L-1的C溶液中滴加0.01mol•L-1的D溶液至中性,混合溶液中的溶质是等物质的量浓度的硫酸钠、硫酸铵,铵根离子水解但程度较小,根据物料守恒判断;
(4)E是醋酸,加水稀释促进醋酸电离,但溶液中c(H+)、c(CH3COO-)、c(CH3COOH)都减小,但c(OH-)增大;
(5)酸的电离平衡常数越大,酸根离子水解程度越小,则相同浓度的钠盐pH越小.A溶液是酸性溶液,能和碱反应,所以B、D是NaOH和NH3•H2O,将1LpH=3的A溶液分别和相同浓度的B、D反应使溶液呈中性时,x、y大小关系为:y<x,强碱体积小于弱碱,所以D是NaOH、B是NH3•H2O;
浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性,如果C是醋酸或盐酸,其混合溶液呈碱性或中性,要使混合溶液呈酸性,则C是NH4HSO4;
浓度均为0.1mol•L-1A和E溶液,pH(A)<PH(E),说明A的电离程度大于E,所以A是盐酸、E是醋酸;
(1)根据以上分析知,D是NaOH,故答案为:NaOH;
(2)A是HCl、E是醋酸,c(OH-)和体积均相等的两份溶液A和E,盐酸的浓度小于醋酸,
①反应过程中醋酸继续电离出氢离子,导致反应过程中醋酸中氢离子浓度大于盐酸,则醋酸反应速率大于盐酸,所以反应所需要的时间:E<A,故错误;
②开始反应时两种溶液中氢离子浓度相等,所以其反应速率:A=E,故错误;
③根据转移电子相等知,生成相同量的氢气时消耗相同量的锌,所以参加反应的锌粉的物质的量:A=E,故正确;
④应过程中醋酸继续电离出氢离子,导致反应过程中醋酸中氢离子浓度大于盐酸,所以反应过程的平均速率:E>A,故正确;
⑤盐酸浓度小于醋酸,要使生成氢气的量相等,则消耗酸的量相等,则A溶液中有锌粉剩余,故正确;
⑥如果E溶液中有锌粉剩余,则两种溶液中都应该有锌剩余,与题给信息不符合,故错误;
故选③④⑤;
(3)室温下,向0.01mol•L-1的C溶液中滴加0.01mol•L-1的D溶液至中性,混合溶液中的溶质是等物质的量浓度的硫酸钠、硫酸铵,铵根离子水解但程度较小,根据物料守恒得离子浓度大小顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)>c(H+),故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)>c(H+);
(4)A.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以c(H+)减小,故A正确;
B.加水稀释促进醋酸电离,所以氢离子的物质的量增大、醋酸分子的物质的量减小,则
c(H+)
c(E)增大,故错误;
C.c(H+)•c(OH-)为离子积常数,温度不变,水的离子积常数不变,故错误;
D.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,所以
c(OH−)
c(H+)增大,故错误;
故选A;
(5)根据电离平衡常数知,酸根离子水解程度大小顺序是CO32->ClO->HCO3->CH3COO-,相同浓度的钠盐溶液,酸根离子水解程度越大,其钠盐溶液的pH越大,所以这几种溶液pH大小顺序是a>b>d>c,
故答案为:a>b>d>c.点评:
本题考点: 无机物的推断;弱电解质在水溶液中的电离平衡;酸碱混合时的定性判断及有关ph的计算;几组未知物的检验.
考点点评: 本题以无机推断为载体考查弱电解质的电离及盐类水解,正确推断物质是解本题关键,再结合物质的性质、盐类水解特点等知识点分析解答,同时考查学生综合应用能力,注意:离子反应中反应速率与离子浓度成正比,与电解质强弱无关,水的离子积常数只与温度有关,这些都是易错点.1年前查看全部
- 高二电解质溶液中离子浓度大小向20mL0.1mol/L NH3H2O中逐滴滴加0.1mol/L HCl溶液.当滴加的盐酸
高二电解质溶液中离子浓度大小
向20mL0.1mol/L NH3H2O中逐滴滴加0.1mol/L HCl溶液.当滴加的盐酸溶液体积为10mL,混合溶液中存在的微粒有 ,各微粒浓度大小 ,电荷守恒式 .物料守恒式
当滴加的盐酸溶液体积为20mL时,混合溶液中存在的微粒有 ,各微粒浓度大小 ,电荷守恒式 .物料守恒式 DavKebe1年前2
DavKebe1年前2 -
 jd_zjj 共回答了14个问题
jd_zjj 共回答了14个问题 |采纳率85.7%当滴加盐酸10mL时,溶液中NH3H2O和NH4CI各占一半.浓度大小:c(NH4+)>c(Cl-)>c(OH-)>c(H+)电荷守恒式为:c(H+)+c(NH4+)=c(CL-)+c(OH-);物料守恒式为:n(NH3H2O)+n(NH4+)=0.1*0.02mol=0.002mol.滴加盐酸20mL时,溶液为NH4CI.浓度大小:c(Cl-)>c(NH4+)>c(H+)>C(OH-).电荷守恒式.物料守恒式不变.1年前查看全部
- 我是今年高三的学生 电离平衡常数中c(OH-)是指NH3H2O电离的,所以啊c(OH-)应该=c(NH4) 谢
 失落的琴键1年前1
失落的琴键1年前1 -
 eagle_zhjp 共回答了24个问题
eagle_zhjp 共回答了24个问题 |采纳率91.7%在25℃下,将a mol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_______中______性(填“酸”“碱”或“中”);用含a的代数式表示NH3•H2O的电离常数Kb=_________
这道题目中的c(OH-)
电离平衡你要掌握两条规律
1.就是正负电荷守恒:即c(NH4+) + c(H+) = c(Cl-) + c(OH-)
2.物料守恒
本题中,由于c(NH4+)=c(Cl-),则根据正负电荷守恒,
有c(H+) = c(OH-),即溶液中性.
c(OH-)不仅仅是NH3*H2O电离的,还有水电离的,NH4+水解的.1年前查看全部
- 为什么Al3+与NH3•H2O反应生成的Al(OH)3不溶于过量的氨水
 人生难道就是如此1年前1
人生难道就是如此1年前1 -
 神之胡子 共回答了8个问题
神之胡子 共回答了8个问题 |采纳率87.5%只溶于强碱1年前查看全部
- 在氨水中有效成分是NH3H2O还是NH3?
 wangwei3721年前5
wangwei3721年前5 -
 婕文茜 共回答了19个问题
婕文茜 共回答了19个问题 |采纳率89.5%在做质量分数或物质的量浓度时,一般认为是其中的溶质NH3,但在发生离子反应时,由于NH3.H2O=(OH-)+(NH4+),所以氨水是一种弱碱,与酸发生中和反应,此时有效成分为NH3.H2O1年前查看全部
- c(NH4+)相同的下列溶液:NH4Cl,(NH4)2SO4,NH4HSO4,NH3H2O
 lsh_82081年前1
lsh_82081年前1 -
 你写我看 共回答了18个问题
你写我看 共回答了18个问题 |采纳率100%那首先看,盐类,因为盐类是电解程度最高的NH4CL和NH4HSO4可单元酸盐,即1 MOL盐包含1 MOLNH4+离子但是NH4+离子存在水解现象(水解后为碱性),由于NH4HSO4同时还能产生H+离子抑制水解所以NH4+的电离要比NH4CL完全,产生...1年前查看全部
- 0.10mol.L-1的NH3•H2O溶液20ml中加入0.10 mol.L-1的HCl溶液20ml,溶液C
0.10mol.L-1的NH3•H2O溶液20ml中加入0.10 mol.L-1的HCl溶液20ml,溶液C(H+)值为
A.0 B.√0.05×Ka(NH4+) C.0.05 D.0.20 liwentan11年前2
liwentan11年前2 -
 陆上来风 共回答了22个问题
陆上来风 共回答了22个问题 |采纳率90.9%等体积混合,混合后体积扩大两倍,浓度都缩小2倍,反应后恰好得到
NH4Cl 0.05mol/L 40ml
-----NH4+ + H20 === NH3.H2O + H+
总量 0.05
水解 x x x (水是纯液体,不考虑它的浓度)
平衡0.05-x x x
Ka(NH4+)=x*x/(0.05-x)
C(H+)=x=【(0.05-x)×Ka(NH4+)】开根号
近似等于【0.05×Ka(NH4+)】开根号1年前查看全部
- 求解释一道化学题某温度下,pH=11的NH3•H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化
求解释一道化学题
某温度下,pH=11的NH3•H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为0.05mol•Lˉ1
某温度下,pH=11的NH3•H2O氢氧根离子浓度为10-3mol/L,和pH=1的盐酸溶液中氢离子浓度为0.1mol/L;等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应生成氯化铵浓度为0.05mol/L;依据氮元素守恒,反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为0.05mol•Lˉ1,故B正确;
为什么平衡浓度是0.05mol/l 没电离的nh3 h20在溶液中 怎么不算进去
求详细的解释明白 不会就别乱说....你们都没说明白啊 求大神啊 建_立1年前3
建_立1年前3 -
 yoyo_821 共回答了24个问题
yoyo_821 共回答了24个问题 |采纳率91.7%因为是恰好反应,所以产物恰好生成NH4Cl,即cNH4++cNH3•H2O+cNH3=cCl-=0.1/2=0.05mol/l,你也可以理解为N=Cl1年前查看全部
- 0.1MOL 的NH4CL和NH3H2O等体积混合离子浓度比较
0.1MOL 的NH4CL和NH3H2O等体积混合离子浓度比较
怎么分析啊,尤其是NH3H2O和氢氧根的浓度比较
是0.1MOL每升 bennysi1年前2
bennysi1年前2 -
 ANLEN2005 共回答了18个问题
ANLEN2005 共回答了18个问题 |采纳率100%用大于号小于号咯!
浓度比较结果是:c【NH4(+)】 > c【CL(-)】 >c【 NH3H2O】 >c【(OH)(-)】
等体积混合嘛,那假如用的是1L好算点咯!
0.2mol>n【NH4(+)】 >0.1mol ( NH4CL那里就有0.1mol了,NH3H2O还有一些电离出来的!)
n【CL(-)】=0.1mol
n【(OH)(-)】1年前查看全部
- 在相同条件下,同物质的量的NAOH NH3H2O BA(OH)2溶液,导电能力由强到弱的顺序是
在相同条件下,同物质的量的NAOH NH3H2O BA(OH)2溶液,导电能力由强到弱的顺序是
并给出原因 michal1231年前4
michal1231年前4 -
 tony_lj 共回答了16个问题
tony_lj 共回答了16个问题 |采纳率93.8%BA(OH)2>NAOH >NH3H2O
说实在的现在也没办法解释清楚,这好像是高中电解质的内容,忘记了!去看看书吧,或者等其他更好的答案1年前查看全部
- 在物质的分类中,下列属于同一范畴的物质是①NaCl ②(NH4)2SO4 ③ NH3•H2O ④KOH ⑤F
在物质的分类中,下列属于同一范畴的物质是①NaCl ②(NH4)2SO4 ③ NH3•H2O ④KOH ⑤Fe(OH)3 ⑥HNO3
A.③④⑤x05 B.①③⑥x05 C.②③⑤x05 D.②③⑥
答案知道了是A 但请会的人告知为什么 鹤野泽馨1年前2
鹤野泽馨1年前2 -
 slambyx 共回答了24个问题
slambyx 共回答了24个问题 |采纳率87.5%NH3.H2O是氨水,可写成NH4.OH,所以3.4.5都属于碱1年前查看全部
- 下列有关说法正确的是( )A.金属氧化物一定是碱性氧化物B.BaSO4、CH3COOH、K2O、NH3•H2O都是电解
下列有关说法正确的是( )
A.金属氧化物一定是碱性氧化物
B.BaSO4、CH3COOH、K2O、NH3•H2O都是电解质
C.工业上常用铝热反应来炼铁
D.二氧化硅不与任何酸反应,可用石英制造耐酸容器 jy01239141年前1
jy01239141年前1 -
 MixloseAng 共回答了15个问题
MixloseAng 共回答了15个问题 |采纳率93.3%解题思路:A、氧化铝属于金属氧化物,属于两性氧化物;B、电解质是在水溶液和熔融状态下能导电的化合物;C、工业上常用还原法来获得金属铁;D、二氧化硅可以和唯一的酸HF酸反应.A、金属氧化物不一定是碱性氧化物,如氧化铝属于两性氧化物,七氧化二锰属于酸性氧化物,故A错误;
B、BaSO4、CH3COOH、NH3•H2O是在水溶液中能导电的化合物,K2O是在熔融状态能导电的化合物,均属于电解质,故B正确;
C、工业上常用焦炭或是一氧化碳还原氧化铁来获得金属铁,故C错误;
D、二氧化硅可以和唯一的酸HF酸反应,可以用石英制造耐酸容器,但是不能盛氢氟酸,故D错误.
故选B.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系;电解质与非电解质;硅和二氧化硅.
考点点评: 本题涉及物质的分类、电解质的概念、金属的冶炼以及二氧化硅的性质知识,综合性较强,难度不大.1年前查看全部
- 常温下,两种溶液①0.1mol/L NH3•H2O ②0.1mol/L NH4
常温下,两种溶液①0.1mol/L NH3•H2O②0.1mol/L NH4Cl中:
(1)溶液①的pH______ 7(填“>”、“<”或“=”),其原因是______(用电离方程式表示).
(2)溶液②水解反应的离子方程式为______升温可以______(填“促进”或“抑制”)NH4Cl 的水解.
(3)两种溶液中c(NH4+) 的大小为______(填字母).
a.两种溶液中c(NH4+) 都等于0.1mol/L
b.两种溶液中c(NH4+) 都小于0.1mol/L
c.NH4Cl溶液中c(NH4+) 小于NH3•H2O溶液中c(NH4+) baomamcg1年前1
baomamcg1年前1 -
 szpowerliu 共回答了16个问题
szpowerliu 共回答了16个问题 |采纳率100%解题思路:(1)氨水是弱碱,在水溶液能电离出氢氧根离子,导致氢氧根离子浓度大于氢离子浓度;
(2)氯化铵是强酸弱碱盐,能水解导致溶液中氢离子浓度大于氢氧根离子浓度;盐类水解反应是吸热反应,升高温度能促进水解;
(3)氨水是弱电解质,在水中电离程度很小;氯化铵是强酸弱碱盐,能水解但水解程度很小,主要以电离为主,据此分析铵根离子浓度大小.(1)氨水是弱碱,在水溶液能电离出氢氧根离子,导致氢氧根离子浓度大于氢离子浓度,溶液呈碱性,溶液的pH>7,电离方程式为:NH3•H2O⇌NH4++OH-,
故答案为:>;NH3•H2O⇌NH4++OH-;
(2)氯化铵是强酸弱碱盐,能水解导致溶液中氢离子浓度大于氢氧根离子浓度,水解离子方程式为NH4++H2O⇌NH3•H2O+H+,溶液呈酸性;盐类水解反应是吸热反应,升高温度平衡向正反应方向移动,所以能促进水解,
故答案为:NH4++H2O⇌NH3•H2O+H+;促进;
(3)氨水是弱电解质,在水中电离程度很小;氯化铵是强酸弱碱盐,能水解但水解程度很小,主要以电离为主,所以相同浓度的氨水和氯化铵溶液,氯化铵溶液中铵根离子浓度较大,但都小于0.1mol/L,故选b.点评:
本题考点: 弱电解质在水溶液中的电离平衡;盐类水解的原理.
考点点评: 本题考查了弱电解质的电离,明确“盐类的水解是微弱的(弱酸弱碱盐除外),主要以电离为主”是解本题的关键,难度不大.1年前查看全部
- 盐酸和氨水为什么不是电解质?那HCL和NH3H2O呢?
 逋猎者的弹弓1年前4
逋猎者的弹弓1年前4 -
 节行路 共回答了15个问题
节行路 共回答了15个问题 |采纳率93.3%电解质是指在水溶液中或熔融状态下能导电的化合物,而盐酸和氨水指的是HCl和NH3H2O的水溶液,为混合物,所以既不是电解质,也不是非电解质.氯化氢和一水合氨是电解质.
一般判断:
1.能与水反应的气体,不是电解质.如二氧化碳、二氧化硫、三氧化硫、氨气等.
单质既不是电解质也不是非电解质.
2.大多数的酸、碱、盐、活泼金属的氧化物是电解质.
理解请及时采纳!祝你学习进步!1年前查看全部
- (2012•浦东新区模拟)甲、乙、丙、丁、戊五种溶液的溶质分别是HCl、CH3COOH、NaOH、NH3•H2O、Na2
(2012•浦东新区模拟)甲、乙、丙、丁、戊五种溶液的溶质分别是HCl、CH3COOH、NaOH、NH3•H2O、Na2CO3中的一种.常温下进行如下实验:①将0.1L pH=10的甲溶液分别与a L 0.001mol/L的乙溶液、b L 0.001mol/L的丁溶液充分反应后溶液呈中性时,a>b;②浓度均为0.1mol/L的丙和丁溶液等体积混合反应后,溶液呈酸性;③0.1mol/L的甲溶液pH小于0.1mol/L的戊溶液pH.下列判断正确的是( )
A.甲的溶质是Na2CO3
B.乙的溶质是CH3COOH
C.丙的溶质是NaOH
D.戊的溶质是HCl 爆爱771年前1
爆爱771年前1 -
 呼唤的野性 共回答了19个问题
呼唤的野性 共回答了19个问题 |采纳率94.7%解题思路:根据①确定乙、丁为HCl和CH3COOH两种酸,根据同浓度时乙的用量大说明乙是弱酸即为CH3COOH,则丁为HCl;
根据②确定丙是弱碱即为NH3•H2O,浓度均为0.1 mol/L的丙和丁溶液等体积混合后,溶液呈酸性,因氯化铵水解呈酸性;
根据③确定戊分别是NaOH或Na2CO3.0.1 mol/L的甲溶液pH小于0.1 mol/L的戊溶液pH说明戊是强碱NaOH;
甲是Na2CO3;以此解答该题.由①得出以下结论:甲溶液pH=9说明甲为碱性物质,则乙、丁为HCl和CH3COOH;
中和同样的碱性物质,同浓度时乙的用量大说明乙是弱酸即为CH3COOH;则丁为HCl;由②得出以下结论:由上已知丁为HCl,浓度均为0.1 mol/L的丙和丁溶液等体积混合后,溶液呈酸性.
说明丙是弱碱即为NH3•H2O;由③得出以下结论:由上已知甲,戊分别是NaOH或Na2CO3.0.1 mol/L的甲溶液pH小于0.1 mol/L的戊溶液pH说明戊是强碱NaOH;甲是Na2CO3;
所以:甲是Na2CO3;乙是CH3COOH;丙是NH3•H2O;丁为HCl;戊是NaOH,
故选AB.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡;盐类水解的应用.
考点点评: 本题考查物质的推断,题目难度较大,本题注意从酸、碱强弱的角度作为推断题的突破口.1年前查看全部
- A、B、C、D、E五种溶液分别是NaOH、 NH3•H2O、CH3COOH、HCl、NH4HSO 4中一种.
A、B、C、D、E五种溶液分别是NaOH、 NH3•H2O、CH3COOH、HCl、NH4HSO 4中一种.常温下进行下列实验: ①将1L pH=3的A溶液分别与0.001mol•L-1x LB溶液、0.001mol•L-1y L D溶液充分 反应后溶液呈中性,x、y大小关系为:y <x; ②浓度均为0.1mol•L-1A和E溶液,pH:A <E; ③浓度均为0.1mol•L-1C与D溶液等体积 混合,溶液呈酸性. A,B,C,D分别是什么
 想吹吹风吧1年前1
想吹吹风吧1年前1 -
 sarahpan97 共回答了20个问题
sarahpan97 共回答了20个问题 |采纳率95%A:CH3COOH
B;NH3•H2O
CNH4HSO4
D:NaOH,
E:HCl1年前查看全部
- 用过量的H2SO4、NaOH、NH3•H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①、②、③、④是( )
 用过量的H2SO4、NaOH、NH3•H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①、②、③、④是( )
用过量的H2SO4、NaOH、NH3•H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①、②、③、④是( )
A.①NaCl②NaOH③NH3•H2O④H2SO4
B.①H2SO4②NaOH③NH3•H2O④NaCl
C.①H2SO4②NH3•H2O③NaOH④NaCl
D.①NaCl②NH3•H2O③NaOH④H2SO4 dolpin1年前1
dolpin1年前1 -
 明镜亦非苔 共回答了13个问题
明镜亦非苔 共回答了13个问题 |采纳率76.9%解题思路:加入①时,只产生一种沉淀,故①一定是NaCl,沉淀为AgCl;在滤液中加入②后,生成两种沉淀,故②是NH3•H2O或NaOH而生成的沉淀,有一种在③中溶解,故②为NH3•H2O,③为NaOH,则④为H2SO4.从题目所给的图示步骤综合分析,可以看出第①步分离五种离子中的一种离子,只能是Ag+与Cl-结合生成AgCl沉淀.第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3•H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离.第④步用SO42-将Ba2+和K+分离,
故选D.点评:
本题考点: 物质分离、提纯的实验方案设计.
考点点评: 本题考查金属阳离子的定性分析,涉及物质的分离和提纯实验方案的设计,题目难度不大,注意根据物质的性质进行实验设计.1年前查看全部
- 为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.01mol•L-1氨水、0.1
为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.01mol•L-1氨水、0.1mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水.
(1)甲用pH试纸测出0.01mol•L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?______(填“是”或“否”),并说明理由:______.
(2)乙取出10ml0.01mol•L-1氨水,用pH试纸测出其pH=a,然后用蒸馏水稀释至1000ml,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b值应满足什么关系?(用等式或不等式表示):______
(3)丙取出10ml0.01mol•L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变______(填“深”或“浅”). jonsson1年前1
jonsson1年前1 -
 zhb_badboy 共回答了25个问题
zhb_badboy 共回答了25个问题 |采纳率92%解题思路:(1)根据一定物质的量浓度的溶液的pH大小,确定电解质的电离程度,进而确定强弱电解质;
(2)利用假设法分析,假设是强碱,稀释100倍后,溶液的pH减小2个单位,如果是弱碱,稀释100倍后,溶液的pH减小的小于2个单位;
(3)如果氨水是弱碱,则存在电离平衡,加入含有相同离子的盐能改变平衡的移动,则溶液的颜色发生变化,如果不变化,则证明是强碱.(1)如果氨水是强碱,0.01mol•L-1氨水的pH为10,说明c(OH-)=10-4mol/L,NH3•H2O没有完全电离,所以氨水是弱碱;
故答案为:是;0.01mol•L-1氨水的pH为10,说明c(OH-)=10-4mol/L,NH3•H2O没有完全电离;
(2)若是强碱,稀释100倍,pH减小2个单位,由于是弱碱,稀释的过程中,会部分电离,即c(OH-)变化的幅度变小,pH减小幅度小于2个单位,则有a-2<b,且b<a;
故答案为:a-2<b<a;
(3)向氨水中加入氯化铵后,如果氨水是弱电解质,则抑制氨水的电离,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅,则说明氨水存在电离平衡;
故答案为:浅.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查弱电解质的实验探究,为高频考点,侧重于学生的分析能力和实验能力的考查,注意利用假设法来分析解答即可,难度不大.1年前查看全部
- 下列物质中,属于配合物的是A.CuSO4 B.NH3•H2O C.K4[Fe(CN)6] D.KAl(SO4
下列物质中,属于配合物的是A.CuSO4 B.NH3•H2O C.K4[Fe(CN)6] D.KAl(SO4)2
 ilspilsp1年前1
ilspilsp1年前1 -
 凤凰懿 共回答了12个问题
凤凰懿 共回答了12个问题 |采纳率100%C,了解配位化合物的定义的话很明显1年前查看全部
- 2道大学化学计算题,高手进来在c(Mgcl2)=0.01mol/L和c(NH3H2O)=0.1mol/L的混合溶液中,N
2道大学化学计算题,高手进来
在c(Mgcl2)=0.01mol/L和c(NH3H2O)=0.1mol/L的混合溶液中,NH+4的浓度至少要多大时才能防止生成Mg(OH2)沉淀?Kb(氨水)=1.77×10-5 Ksp(Mg(OH)2)=5.6×10-12
正常人的尿液,PH=6.30.其中磷酸各种型体的总浓度为0.2mol/L已知Ka1 = 7.5 × 10-3. Ka2 = 6.2×10-8. Ka3 = 2.2×10-13,求c(PO43-)
第一题我算的也是0.075.第二题楼下算的方法好像不对。是磷酸各种型体的总浓度为0.2.而不是H3PO4浓度为0.2 我是明矾1年前3
我是明矾1年前3 -
 annnnyyy 共回答了19个问题
annnnyyy 共回答了19个问题 |采纳率94.7%1)根据题意列出方程式
NH3.H2O--NH4+ +OH-
MgCl2--Mg2+ +2Cl
Mg2+ + 2OH----Mg(OH)2
所以根据第一个方程c【NH4+】=Kb(氨水)/c(OH-)
而根据第三个方程,那么c(OH-)=根号[CKsp Mg(OH)2/Ksp Mg(OH)2]]
所以由上面的两个方程式可得
c【NH4+】=Kb(氨水)/根号[Ksp Mg(OH)2/C(Mg2+)]=Kb(氨水)*根号c(Mg2+)/根号Ksp Mg(OH)2,镁离子浓度已知所以有
计算得出即可稍微有点麻烦,得到0.075mol/l
2)磷酸电离过程吧,就是
H3PO4==H2PO4- +H+
H2PO4- ==HPO4(2-)+H+
HPO4(2-)==PO4(3-)+H+
根据基本公式那么c(H2PO4-)=ka1*c【H3PO4】/c[H+]
而第二个方程就是
c【HPO4(2-)+】=ka2*c(H2PO4-)/c[H+]
代入上式,那么
c【HPO4(2-)+】=ka2*ka1*c【H3PO4】/c[H+]平方,
同理第三个方程也如此
最后c【PO4(3-)】=ka2*ka1*ka3*c【H3PO4】/c[H+]立方,
氢离子浓度为10-6.3,所以带入解出
c【PO4(3-)】=1.02×10-3.1
好多年没做了,都快忘了错了指教啊1年前查看全部
- 5滴CoCl2溶液,滴加5滴NH4Cl和过量的NH3H2O震荡,观察溶液颜色,滴加H2O2震荡,观察颜色,并写出以上所涉
5滴CoCl2溶液,滴加5滴NH4Cl和过量的NH3H2O震荡,观察溶液颜色,滴加H2O2震荡,观察颜色,并写出以上所涉及方程式
 baocunyuan19801年前1
baocunyuan19801年前1 -
 blueApril 共回答了21个问题
blueApril 共回答了21个问题 |采纳率90.5%Co2+与过量氨水作用,生成[Co(NH3)6]2+配离子:
方程式:Co2+ +6 NH3·H2O === [Co(NH3)6]2+ + H2O
现象:溶液变为红棕色
[Co(NH3)6]2+配离子不稳定,被H2O2氧化成[Co(NH3)6]3+
方程式:2 [Co(NH3)6]2+ + H2O2 === 2 [Co(NH3)6]3+ + H2O + 2 OH-
现象:溶液变为紫红色1年前查看全部
- NH3•H2O 和 AlCL3是否为电解质 为什么
 zupz1年前1
zupz1年前1 -
 yrr26617 共回答了24个问题
yrr26617 共回答了24个问题 |采纳率91.7%都是电解质
NH3•H2O是弱电解质,AlCl3 是强电解质
都能电离出离子 NH3•H2O →NH4+ +OH- AlCl3 ==Al3+ +3Cl-1年前查看全部
- NH4CL-NH3.H2O比较浓度大小中NH3H2O和OH-和H+那个浓度大
NH4CL-NH3.H2O比较浓度大小中NH3H2O和OH-和H+那个浓度大
NH3H2O和OH-和H+浓度比较顺序 chengchengyanyan1年前2
chengchengyanyan1年前2 -
 gunlily 共回答了20个问题
gunlily 共回答了20个问题 |采纳率90%浓度从大到小为:NH3H2O,OH-,H+
氨水中存在以下化学平衡:
NH3+H2O=(可逆)=NH3·H2O
NH3·H2O=(可逆)=NH4+ +OH-
因此仅有一小部分氨分子与水反应而成铵离子NH4+和氢氧根离子OH-,故呈弱碱性.所以NH3H2O浓度大于OH-.
溶液呈碱性,所以OH-大于H+.1年前查看全部
- NH3H2O与少量和过量CO2反应的方程式分别是什么?
 我家的小熊1年前1
我家的小熊1年前1 -
 本名岐 共回答了11个问题
本名岐 共回答了11个问题 |采纳率100%NH3H2O+CO2=NH4HCO31年前查看全部
- 常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.
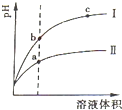 常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.
常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.
(1)已知CH3COOH溶液的pH=3,其电离度为______,由水电离的c(H+)=______.
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是______曲线,a、b两点中,导电能力更强的是______.
(3)NH3•H2O溶液和HCl溶液等体积混合后,溶液呈酸性的原因是(离子方程式表示)______.此时,该混合溶液中的微粒浓度关系正确的是______.
A.c(Cl-)>c(H+)>c(NH4+)>c(OH-)B.c(Cl-)=c(NH4+)>c(OH-)=c(H+)
C.c(NH4+)+c(NH3•H2O)=0.1mol•L-1 D.c(H+)=c(NH3•H2O)+c(OH-)
(4)已知NH3•H2O和NH4Cl等浓度混合时溶液呈碱性,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中各离子浓度的大小关系是______. 过客5231年前1
过客5231年前1 -
 walter001 共回答了25个问题
walter001 共回答了25个问题 |采纳率100%解题思路:(1)电离度=
×100%;由水电离的c(H+)等于溶液中氢氧根离子浓度;c(H+) c(CH3COOH)
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,所以pH变化大的为强酸;
溶液的导电能力与离子浓度成正比;
(3)等物质的量的氨水和盐酸混合时,二者恰好反应生成氯化铵,铵根离子水解;
根据溶液的酸碱性再结合电荷守恒判断离子浓度大小;
(4)NH3•H2O和NH4Cl等浓度混合时溶液呈碱性,说明一水合氨电离程度大于铵根离子水解程度,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中的溶质为硫酸铵、一水合氨和硫酸钠,再结合离子水解、电荷守恒判断.(1)电离度=
c(H+)
c(CH3COOH)×100%=
10−3
0.1×100%=1%;由水电离的c(H+)等于溶液中氢氧根离子浓度=
10−14
10−3mol/L=1×10-11mol.L-1,
故答案为:1%;1×10-11mol.L-1;
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,所以pH变化大的为强酸,根据图象知,I为盐酸;
溶液的导电能力与离子浓度成正比,氢离子浓度越大溶液的pH越小,所以溶液导电能力较大的是a;
故答案为:І;a;
(3)等物质的量的氨水和盐酸混合时,二者恰好反应生成氯化铵,铵根离子水解而使溶液中氢离子浓度大于氢氧根离子浓度,则溶液呈酸性,水解离子方程式为NH4++H2O⇌NH3•H2O+H+,
A.氯化铵能水解但水解程度较小,所以c(H+)<c(NH4+),故错误;
B.铵根离子水解而使溶液呈酸性,所以c(OH-)<c(H+),故错误;
C.溶液中存在物料守恒,根据物料守恒得c(NH4+)+c(NH3•H2O)=0.05mol•L-1,故错误;
D.根据质子守恒得c(H+)=c(NH3•H2O)+c(OH-),故正确;
故答案为:NH4++H2O⇌NH3•H2O+H+;D;
(4)NH3•H2O和NH4Cl等浓度混合时溶液呈碱性,说明一水合氨电离程度大于铵根离子水解程度,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中的溶质为硫酸铵、一水合氨和硫酸钠,钠离子不水解、铵根离子水解,溶液中存在电荷守恒c(Na+)+c(NH4+)=2c(SO42-),所以离子浓度大小顺序是c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-).点评:
本题考点: 弱电解质在水溶液中的电离平衡;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了弱电解质的电离,根据弱电解质电离特点结合电荷守恒、物料守恒来分析解答,难点是(4)题,明确溶液中的溶质及其性质,题目难度不大.1年前查看全部
- 19.常温下,pH=9的CH3COONa 溶液由水电离出来的c(H+)为a,pH=9的 NH3•H2O溶液由
19.常温下,pH=9的CH3COONa 溶液由水电离出来的c(H+)为a,pH=9的 NH3•H2O溶液由水电离出来的c(H+)为b,下列a和b的关系正确的是
A.a=b B.a=104b C.b=10-4a D.a=10-4b
10.X、Y、Z 3种元素.已知:X+ 和Y-两种离子具有相同的电子层结构;Z元素原子核内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成42个电子的负一价阴离子.下列有关说法正确的是
A.离子半径:X+>Y- B.原子序数X>Y>Z
C.X、Y、Z均属于短周期元素 D.X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 winds77121年前1
winds77121年前1 -
 八一ll 共回答了16个问题
八一ll 共回答了16个问题 |采纳率87.5%"CH3COONa 溶液pH=9是因为水解,所以水解的H+是10^-5
pH=9的 NH3•H2O溶液pH=9是因为电离,电离出10^-5 OH-所以水解的H+是10^-9
选B
根据题目推断,最可能的情况是X为K,Y为Cl,Z为O
所以选B、D"说的好啊,恩,不错1年前查看全部
- 有下列五种物质:①NaHSO4②NH4Cl ③NaAlO2 ④NH3•H2O ⑤Al(OH
有下列五种物质:①NaHSO4②NH4Cl ③NaAlO2 ④NH3•H2O ⑤Al(OH)3,请按要求回答:
(1)溶于水,并能抑制水电离的是(用编号回答)______;
(2)溶于水,并能促进水电离的是(用编号回答)______;
(3)NH4Cl的水解离子方程式是:______;
(4)Al(OH)3的电离方程式是:______. amanda_tin1年前1
amanda_tin1年前1 -
 zhangchao79101 共回答了12个问题
zhangchao79101 共回答了12个问题 |采纳率83.3%解题思路:(1)根据影响水的电离的因素分析,如酸溶液和碱溶液抑制了水的电离;
(2)含有弱酸根离子或者弱碱根离子的盐溶液促进了水的电离;
(3)氯化铵溶液中铵离子发生水解生成一水合氨和氢离子;
(4)氢氧化铝为两性氢氧化物,能够电离出氢离子和氢氧根离子.(1)酸溶液和碱溶液抑制了是电离,①NaHSO4中电离出大量的氢离子.抑制了水的电离;④NH3•H2O 电离出大量的氢氧根离子,抑制了水的电离,
故答案为:①④;
(2)②NH4Cl中的铵离子、③NaAlO2 中的偏铝酸根离子能够发生水解,促进了水的电离,
故答案为:②③;
(3)氯化铵溶液中铵离子发生水解,溶液显示酸性,其水解的离子方程式为:NH4++H2O⇌NH3•H2O+H+;
故答案为:NH4++H2O⇌NH3•H2O+H+;
(4)氢氧化铝为两性氢氧化物,在溶液中电离平衡为:AlO2-+H2O+H+⇌Al(OH)3⇌Al3++3OH-,
故答案为:AlO2-+H2O+H+⇌Al(OH)3⇌Al3++3OH-.点评:
本题考点: 水的电离;弱电解质在水溶液中的电离平衡;盐类水解的应用.
考点点评: 本题考查了水的电离及其影响、盐的水解原理,题目难度中等,注意明确水的电离的影响因素,明确酸溶液和碱溶液抑制了水的电离,能够水解的盐溶液能够促进水的电离.1年前查看全部
- 古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:NaClO+NH3•H2O→N2H4+NaCl+H2O
古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:NaClO+NH3•H2O→N2H4+NaCl+H2O
(1)请配平上述化学方程式.并用单线桥法标出电子转移的方向和数目.
(2)NH3•H2O在上述反应中显示出来的性质是______.
A.氧化性B.还原性C.酸性D.碱性
(3)该反应的氧化产物是______,NaClO发生______反应.
(4)若生成 0.2mol N2H4,则转移的电子为______ mol. 100321年前1
100321年前1 -
 丝路骆驼 共回答了13个问题
丝路骆驼 共回答了13个问题 |采纳率92.3%解题思路:(1)根据氧化还原反应中得失电子守恒的思想来配平方程式;
(2)化合价升高元素在反应中作还原剂,具有还原性;
(3)还原剂对应的产物叫氧化产物,氧化剂在反应中被还原,发生还原反应;
(4)根据氧化还原反应中得失电子的数目和各种物质的量的关系来回答.(1)一水合氨中的氮元素化合价由-3价升高到了-2价,失1mole-电子,次氯酸钠中氯元素化合价由+1价降低到了-1价,得2mole-电子,氧化还原反应中得失电子守恒,则配平情况电子转移的方向和数目为:
 ,故答案为:
,故答案为: ;
;
(2)一水合氨中氮元素的化合价升高了,表现了还原性,故答案为:B;
(3)还原剂是一水合氨,对应的原产物是N2H4,次氯酸钠中氯元素化合价由+1价降低到了-1价,为氧化剂,发生了还原反应,故答案为:N2H4;还原;
(4)2mol一水合氨中的氮元素化合价由-3价升高到了-2价,失2mole-电子,次氯酸钠中氯元素化合价由+1价降低到了-1价,得2mole-电子,反应共转移2mol电子,生成1mol N2H4,若生成 0.2mol N2H4,转移0.4mol,电子,故答案为:0.4.点评:
本题考点: 氧化还原反应方程式的配平;氧化还原反应的电子转移数目计算.
考点点评: 本题考查学生氧化还原反应中的有关概念以及转移电子的知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- (1)在下列物质:烧碱,NH3•H2O,SO3,铁片,石墨,甲烷,醋酸,碳酸钙中,属于电解质的是______,其中属于强
(1)在下列物质:烧碱,nh3•h2o,so3,铁片,石墨,甲烷,醋酸,碳酸钙中,属于电解质的是______,其中属于强电解质的是______,既不属于电解质又不属于非电解质的是______.
(2)下列说法正确的是(填序号,错选倒扣分)______
①我国许多城市已经推广使用清洁燃料,如压缩天然气(cng)类和液化石油气(lpg)类.这两类燃料的主要成分都是烃.
②大气污染物就是化石燃料燃烧的废气.
③绿色化学的核心就是化学反应原子利用率为100%
④由金属矿物转变成金属,一般要经过探矿、开采、选矿、冶炼等阶段.
⑤乙烯、乙炔、苯都是不饱和烃,都能使酸性高锰酸钾溶液褪色.
⑥能量有热能、化学能、太阳能、生物能、电能等,它们必须要经过化学反应才能转化.
⑦形成化合物种类最多的元素在周期表中 ia和 iva,周期表中含元素种类最多的族在 iiib. hhh20021年前1
hhh20021年前1 -
 哑哑都督 共回答了20个问题
哑哑都督 共回答了20个问题 |采纳率80%解题思路:(1)根据熔融或溶于水能导电的化合物来判断电解质,根据在水中或熔化时能完全电离来判断强电解质,电解质与非电解质都是化合物;
(2)①天然气的主要成分是甲烷,液化石油气中主要含丙烷和丁烷;
②大气污染物包括气体、固体颗粒等多种;
③绿色化学的核心利用化学原理从源头上减少和消除工业生产对环境的污染;
④根据金属的冶炼来分析;
⑤苯不能使酸性高锰酸钾溶液褪色;
⑥很多能量不需要利用化学变化来实现,如热能、电能、太阳能等;
⑦形成化合物种类最多的元素为碳、氢,周期表中IIIB包括镧系和锕系.(1)因烧碱、NH3•H2O、醋酸、碳酸钙在溶于水或熔化状态下能导电,且都是化合物,则烧碱、NH3•H2O、醋酸、碳酸钙属于电解质,又烧碱、碳酸钙在水中或熔化时能完全电离,
则烧碱、碳酸钙属于强电解质,铁片、石墨都是单质,则铁片、石墨既不属于电解质又不属于非电解质,
故答案为:烧碱、NH3•H2O、醋酸、碳酸钙;烧碱、碳酸钙;铁片、石墨;
(1))①天然气的主要成分是甲烷,液化石油气中主要含丙烷和丁烷,它们都是由碳、氢元素组成,则两类燃料的主要成分都是烃,故①正确;
②大气污染物包括气体、固体颗粒等多种,化石燃料燃烧的废气主要含碳、硫的化合物,则大气污染物包含化石燃料燃烧的废气,故②错误;
③绿色化学的核心利用化学原理从源头上减少和消除工业生产对环境的污染,故③错误;
④根据金属的冶炼可知,要经过探矿、开采、选矿、冶炼等阶段将化合态的金属转变为游离态,故④正确;
⑤苯不能使酸性高锰酸钾溶液褪色,故⑤错误;
⑥化学能需要利用化学变化来实现,而热能、电能、太阳能等不需要利用化学反应就可实现,故⑥错误;
⑦因形成化合物种类最多的元素为碳、氢,周期表中IIIB包括镧系和锕系,则形成化合物种类最多的元素在周期表中IA和IVA,周期表中含元素种类最多的族在IIIB,故⑦正确;
故答案为:①④⑦.点评:
本题考点: 电解质与非电解质;绿色化学;元素周期律和元素周期表的综合应用;常见的能量转化形式;使用化石燃料的利弊及新能源的开发;强电解质和弱电解质的概念;乙烯的化学性质;苯的性质.
考点点评: 本题考查电解质、与环境有关的问题,考查知识点较多,学生应注意积累细小知识点来解答此类习题,难度不大,(2)中学生容易多选或少选而出错.1年前查看全部
- NH3H2O是不是纯净物?是不是电解质?NH3是不是电解质?
 阳总1年前4
阳总1年前4 -
 天蓝百合 共回答了7个问题
天蓝百合 共回答了7个问题 |采纳率100%既然能写出化学式,当然是纯净物,不是电解质,NH3不是电解质1年前查看全部
- 下列离子在水溶液中能大量共存吗?通二氧化碳后还能大量共存么?K+ Ag+ NH3H2O NO3-
 yuchr1年前1
yuchr1年前1 -
 wyzbob2005 共回答了19个问题
wyzbob2005 共回答了19个问题 |采纳率94.7%不能大量共存
向硝酸银溶液中加入过量氨水
NH3.H2O+AgNO3=AgOH+NH4NO3
生成的AgOH又马上和HN.H2O继续反应
AgOH+2NH3.H2O=Ag(NH3)2OH+2H2O银氨溶液
通入二氧化碳后 也不能,Ag 和CO32-不能共存1年前查看全部
- 比如说两种溶液NH3H2O NH4CL同时存在时,是水解大于电离还是电离大于水解?
比如说两种溶液NH3H2O NH4CL同时存在时,是水解大于电离还是电离大于水解?
另外这种混合溶液哪些是水解大,哪些有又是电离大? zhoulaw1年前2
zhoulaw1年前2 -
 gmls 共回答了23个问题
gmls 共回答了23个问题 |采纳率82.6%NH4CL是盐完全水解,产生大量NH4+离子抑制NH3H2O的电离,混合溶液呈碱性故电离大于水解,即溶液中电离大于水解1年前查看全部
- 电离大于水解溶液都显酸性吗为什么CH3COOH.CH3COONa,NH3H2O,NH4Cl等物质量混合时,电离大于水解啊
电离大于水解溶液都显酸性吗
为什么CH3COOH.CH3COONa,NH3H2O,NH4Cl等物质量混合时,电离大于水解啊? seu_0102031年前2
seu_0102031年前2 -
 小寒寒175 共回答了26个问题
小寒寒175 共回答了26个问题 |采纳率92.3%不一定
首先,电离大于水解,是指电离出的弱酸根、弱碱离子,而这些离子又会再水
解,但是水解的程度远远小于电离的程度.
再者,要看电离出的是弱酸跟还是弱碱离子,才能判断溶液酸碱性.
比如:
①NaAC (醋酸钠简写)
NaAC =电离= Na+ + AC-
因为AC-是弱碱离子,所以要水解,则AC- + H2O = HAC + OH-
②NH4cl 氯化铵
NH4cl =电离= (NH4)+ + cl-
因为NH4是弱酸根,所以要水解,则(NH4)+ + H2O = NH3·H2O + H+1年前查看全部
- 25摄氏度时ph为12的氨水,C(NH4+)+C(NH3H2O)=1×10^-12mol/L为何错
 wjun8201年前0
wjun8201年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 等浓度等体积的nh4cl与nh3h2o混合,溶液成什么性啊,为何
 hibernate_ksl1年前2
hibernate_ksl1年前2 -
 huaerl 共回答了20个问题
huaerl 共回答了20个问题 |采纳率90%碱性 一般情况下 弱碱和等浓度的对应的强酸弱碱盐,弱碱电离程度大于盐的水解程度.比如1mol/L氨水电离程度大于1mol/L氯化铵水解程度.
同理,弱酸和等浓度其对应的强碱弱酸盐,弱酸电离程度大于对应盐的水解程度.比如1mol/L醋酸电离程度大于1mol/L醋酸钠的水解程度.1年前查看全部
- 有A、B、C、D、E、F六瓶不同物质的溶液,它们分别是:NH3•H2O,Na2CO3,MgSO4NAHCO3,HNO3和
有A、B、C、D、E、F六瓶不同物质的溶液,它们分别是:NH3•H2O,Na2CO3,MgSO4NAHCO3,HNO3和BaCl2,为了鉴别它们进行如下实验:
①D与A、B、C分别反应,均有沉淀生成②C与A反应有沉淀生成
③E与A反应有气体生成④F与C反应无明显现象
下列推断正确的是( )
A.B是MgSO4溶液
B.A是BaCl2溶液
C.D是NH3•H2O
D.F是NaHCO3溶液 健康与幸福1年前1
健康与幸福1年前1 -
 sg23456 共回答了11个问题
sg23456 共回答了11个问题 |采纳率100%解题思路:根据反应现象和物质的性质进行推断,本题中由题干中A和D与其他物质混合产生的沉淀或气体现象推出D为MgSO4,A为Na2CO3,进而推出B为NH3•H2O,C为BaCl2,E为HNO3,F为NaHCO3溶液.A+E气体说明有A、E一种一定是HNO3,另一种可能是Na2CO3、NaHCO3中的一种,A+C生成沉淀,A+D生成沉淀,说明A不是HNO3,所以E为HNO3.A为Na2CO3,C、D就可能是MgSO4,BaCl2中的一种,因为B+D生成沉淀,C+D生成沉淀,C+F无现象说明D是MgSO4,C为BaCl2,B为NH3•H2O,最后F为NaHCO3,
则A为Na2CO3,B为NaHCO3,C为BaCl2,D为MgSO4,E为HNO3,F为NaHCO3;
故选D.点评:
本题考点: 几组未知物的检验.
考点点评: 本题属于物质相互反应的性质推断题,把两两反应的现象归纳,并和题中信息的现象对照可得出结论.1年前查看全部
- 则此时NH3•H2O的电离常数Kb=……
则此时NH3•H2O的电离常数Kb=……
0.005怎么来的?数据是怎么回事? liangapril1年前1
liangapril1年前1 -
 2008X 共回答了13个问题
2008X 共回答了13个问题 |采纳率46.2%等体积混合后,体积增大一倍,则溶液减小一倍,所以c(Cl-)=0.01/2=0.005mol/L
而c(NH4+)=c(Cl-)=0.005mol/L1年前查看全部
- 分类是学习和研究化学物质及其变化的一种常用的基本方法.氨水(NH3•H2O)应与下列哪组属于同一类物质( )
分类是学习和研究化学物质及其变化的一种常用的基本方法.氨水(NH3•H2O)应与下列哪组属于同一类物质( )
A.硫酸铜、氯化钡
B.盐酸、硫酸
C.氢氧化钠、氢氧化钙
D.五氧化二磷、二氧化碳 jian0gnan8081年前1
jian0gnan8081年前1 -
 jztxl 共回答了15个问题
jztxl 共回答了15个问题 |采纳率86.7%解题思路:根据氨水电离得到的阴离子是氢氧化根离子,所以氨水属于碱解答.氨水电离得到的阴离子是氢氧化根离子,所以氨水属于碱;
A、硫酸铜和氯化钡属盐;
B、盐酸、硫酸属于酸;
C、氢氧化钠和氢氧化钙属于碱;
D、五氧化二磷、二氧化碳属氧化物.
故答案选:C.点评:
本题考点: 常见的氧化物、酸、碱和盐的判别.
考点点评: 要准确熟练掌握酸、碱、盐和氧化物的概念才能准确快速的解答这类题目,难度不大.1年前查看全部
- 250mL 2moL/L氨水中NH3H2O的分子数
250mL 2moL/L氨水中NH3H2O的分子数
250ML 2MOL/L的氨水中含有NH3-H2O的分子数为0.5NA
为什么不对呢?
补充一个问题 要是求 物质的量的浓度时,是要用NH3的物质的量还是用NH3H2O的物质的量来算呢? 晒得发黑1年前3
晒得发黑1年前3 -
 加应子 共回答了11个问题
加应子 共回答了11个问题 |采纳率81.8%第一个问题:n=V*C=0.25*2=0.5mol,即氨水中NH3、NH3·H2O、NH4+的总物质的量为0.5mol.
因为NH3在溶于水时,就以NH3、NH3·H2O、NH4+形式存在.
第二个问题:应该用NH3来算.250ML 2MOL/L的氨水,就表示0.5molNH3溶于水,配成的250ML溶液.
而0.5mol NH3溶于水时,不全以NH3形式存在,反应如下NH3+H2O=可逆=NH3·H2O=可逆=NH4+ + OH-,所以氨水中NH3、NH3·H2O、NH4+的总物质的量为0.5mol.1年前查看全部
- 弱电解质电离后离子浓度怎么判断比如一水合氨溶液中 为什么 NH3H2O 要比 NH4+ 弱电解质中是分子大还是离子大?
 sujiawan1年前1
sujiawan1年前1 -
 黄点点有点傻 共回答了26个问题
黄点点有点傻 共回答了26个问题 |采纳率92.3%若是学过化学反应原理的话,就应该知道碱性溶液水解程度大于电离程度,酸性条件下电离程度大于水解程度,氨水显碱性,所以nh3.h2o的浓度大一些,弱电解质的电离程度是不同的,弱电解质中是分子大还是离子大不能一概而论1年前查看全部
- 为什么铝离子中有铵根 加入OH- 写NH4+OH-=NH3H2O 不用可逆号啊
 steven_wbl1年前2
steven_wbl1年前2 -
 披着洋皮的成都仔 共回答了9个问题
披着洋皮的成都仔 共回答了9个问题 |采纳率77.8%楼上的回答有一定的局限性,没有把主要原因说明.
一个反应判断是否要用可逆符号,根据这个反应是否进行完全彻底.比如氢气和氧气在点燃的条件下生产水,反应很彻底,不加可逆符号.但是氢气氮气生产氨气的反应,不彻底,极有可能氨气会转化成氢气氮气,所以要可逆.
这个反应,是一个双水解反应,而且生成水和氨气两种弱电解质,反应是较为彻底的,因此不用加可逆符号.【若还不明白可去查阅水解反应,重点看看双水解反应为何进行彻底,就会明白了】1年前查看全部
大家在问
- 1怎样才能成为一个具有科学素养的小学教师
- 2幼时记趣 把庞然大物和拔山倒树而来的具体情景写出来
- 3原价怎么算?比如说,一个商品含利润价是56,加了百分之30的利润,怎么算原价啊
- 4逆矩阵公式在线性代数中,求逆矩阵:A^(-1)=|A|^(-1)*A^(*),如果A是通过划分的行列式,那|A|应该怎么
- 5若圆C1:x2+y2=1与圆C2:x2+y2-6x-8y+m=0外切,则m=______.
- 6Since his father died three years ago,he ______(not,pay) any
- 7数学的科学计数法:比如0.000000789用科学计数法表示,但要保留两位有效数字.
- 8母亲的纽扣 阅读答案我十二岁生日的那天早上,母亲把我从被窝里拉出来,惊喜地送给我一样礼物.我很吃惊,长那么大,母亲还是第
- 9解不等式 (根下k)减kx大于等于0 k属于(0,1)
- 10求函数导数,共两题.T(x) = A (x-y) - (A/3)乘以y ,A为大于零的常数,x,y 都是未知正整数.F(
- 11下图都是正方体的表面展开图,还原成正方体后,其中两个完全一样的( )。
- 12修路队修一条路已修的是全长的五分之二多28千米,未修的比全长的九分之四
- 134700克=______千克 516厘米=___
- 14过硫化钠是属于哪一类的火灾危险性分类?
- 15质量均为1kg的10个相同的砖块,平行紧靠成一直线放在光滑的地面上,如图..F=10N,问第7个砖对第8个砖的压力是..
