泡铜练粗铜的化学方程式
 天然大氧吧2022-10-04 11:39:543条回答
天然大氧吧2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 曾经的静思 共回答了18个问题
曾经的静思 共回答了18个问题 |采纳率83.3%- 阳极接粗铜Cu-2e=Cu²+ 还有zn fe等会先反应 到溶液中 Ag等会形成阳极泥 阴极接精铜Cu²+2e=Cu 电解质溶液是CuSo4
- 1年前
 uujianlong 共回答了2个问题
uujianlong 共回答了2个问题 |采纳率- 你是说电解精炼铜吗?正极接粗铜Cu+2e=Cu²+ 负极接精铜Cu²+2e=Cu 电解质溶液是CuSo4
- 1年前
 rogerlam557 共回答了2个问题
rogerlam557 共回答了2个问题 |采纳率- .......已经有人讲了
- 1年前
相关推荐
- 电解铜中粗铜为什么作阳极,精铜作阴极
 南纬风_北纬雨1年前3
南纬风_北纬雨1年前3 -
 7466 共回答了18个问题
7466 共回答了18个问题 |采纳率94.4%电解是阳极被氧化,金属做阳极将被溶解.所以将粗铜置于阳极,比铜活泼的杂质金属与铜将一起溶解为离子,而金、铂、银等不如铜活泼的金属将直接沉淀为阳极泥.而在阴极形成的金属阳离子将得到电子变成金属析出,此时,由于铜离子氧化能力强将先析出而杂质离子留在溶液中,这样就精炼了1年前查看全部
- (2013•河南模拟)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备
(2013•河南模拟)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2•2H2O).

(1)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体1(加热仪器和夹持装置已略去).
①仪器A的名称是______.
②装置B中发生反应的离子方程式是MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O△ .MnO2+4H++2Cl-.
Mn2++Cl2↑+2H2O△ .
③如果浓盐酸不能顺利滴下,可能的原因是______
④装置Ⅳ中盛装的试剂是______,其作用是______.
(2)在CuCl2溶液转化为CuCl2•2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)⇌CuCl42-(aq)+4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K=c(CuCl 42− ) c[Cu(H2O) 42+ ]•c4(Cl−) .c(CuCl 42− ) c[Cu(H2O) 42+ ]•c4(Cl−)
②现欲使溶液由黄色变成蓝色,请写出两种可采用的方法
a.______ b.______.
(3)由CuCl2溶液得到CuCl2•2H2O的过程中要加入盐酸的目的是______. 6543211001年前1
6543211001年前1 -
 heaven_yfs 共回答了17个问题
heaven_yfs 共回答了17个问题 |采纳率94.1%解题思路:(1)①仪器A是分液漏斗;
②装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水;
③根据没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐即不与外界连通会使分液漏斗中的液体难以滴下;
④实验中的反应物之一为氯气,能污染大气,所以需要处理尾气;
(2)①生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值为平衡常数,注意水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去;平衡常数只受温度影响,与离子浓度无关;
②根据平衡移动原理分析;
(3)加盐酸防止Cu2+水解.(1)①仪器A是分液漏斗,故答案为:分液漏斗;
②装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O;
③因没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐即不与外界连通会使分液漏斗中的液体难以滴下,
故答案为:没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐;
④实验中的反应物之一为氯气,能污染大气,所以需要处理尾气,一般用NaOH溶液吸收,故答案为:NaOH溶液;吸收多余的氯气;
(2)①Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)+4H2O(l)的平衡常数为k=
CuCl42-(aq)+4H2O(l)的平衡常数为k=
c(CuCl 42− )
c[Cu(H2O) 42+]•c4(Cl−),故答案为:
c(CuCl 42− )
c[Cu(H2O) 42+]•c4(Cl−);
②现欲使溶液由黄色变成蓝色,平衡逆移,可以加水稀释或者加硝酸银溶液来减小减少Cl-的浓度,故答案为:加水稀释;加硝酸银溶液;
(3)由CuCl2溶液得到CuCl2•2H2O的过程中Cu2+水解,所以要加盐酸防止Cu2+水解,故答案为:防止Cu2+水解.点评:
本题考点: 铜金属及其重要化合物的主要性质;化学平衡常数的含义;化学平衡的影响因素;氯气的实验室制法.
考点点评: 本题考查学生对工艺流程理解、实验装置的理解、平衡移动、平衡常数,物质分离提纯等,难度中等.1年前查看全部
- 下列说法中正确的是( )A.电解精炼铜时,用粗铜(含少量锌、铁等杂质)作阳极,纯铜作阴极,用CuSO4溶液作电解液.电
下列说法中正确的是( )
A.电解精炼铜时,用粗铜(含少量锌、铁等杂质)作阳极,纯铜作阴极,用CuSO4溶液作电解液.电解前后,溶液中铜离子浓度不变
B.20℃稀NaOH溶液的Kw大于80℃稀H2SO4溶液的Kw
C.100℃pH=2的H2SO4溶液与100℃pH=12的NaOH溶液等体积混合,溶液显碱性
D.往NH4HCO3溶液中加过量NaOH溶液的离子方程式为:NH4++OH-=NH3+H2O 网络gg1年前1
网络gg1年前1 -
 alex_wo 共回答了27个问题
alex_wo 共回答了27个问题 |采纳率85.2%解题思路:A、粗铜中铜是电子发生氧化反应,含有的锌、铁也会失电子发生氧化反应,依据电子守恒分析判断;
B、水的电离是吸热过程,升温促进水的电离,水的离子积常数增大;
C、100°C离子积常数增大中性溶液PH小于7;
D、过量的氢氧化钠溶液和碳酸氢根离子、铵根离子反应.A、粗铜中铜是电子发生氧化反应,含有的锌、铁也会失电子发生氧化反应,依据电子守恒分析判断,溶液中铜离子浓度减小,故A错误;
B、水的电离是吸热过程,升温促进水的电离,水的离子积常数增大,20℃稀NaOH溶液的Kw小于80℃稀H2SO4溶液的Kw,故B错误;
C、100°C离子积常数增大中性溶液PH小于7,100℃pH=2的H2SO4溶液与100℃pH=12的NaOH溶液等体积混合,碱过量溶液显碱性,故C正确;
D、往NH4HCO3溶液中加过量NaOH溶液的离子方程式为:NH4++HCO3-+2OH-=NH3•H2O+H2O+CO32-,故D错误;
故选C.点评:
本题考点: 电解原理;离子方程式的书写;水的电离;pH的简单计算.
考点点评: 本题考查了电解原理分析应用,水的电离平衡影响因素分析,离子积常数的分析应用,离子方程式书写量不同产物不同,题目难度中等.1年前查看全部
- (2013•北京模拟)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不不反应).某化学兴趣小组在实验室条件
(2013•北京模拟)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不不反应).某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定.
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的______极相连.阴极上的电极反应式为______.电解过程中,硫酸铜的浓度会______(选填:变大、不变、变小).
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:______.
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1:3的混合物),请你简要解释金能够溶于王水的原因:______.序号 反应 平衡常数 1 Au+6HNO3(浓)═Au(NO3)3+3NO2↑+3H2O <<1 2 Au3++4Cl-═AuCl4- >>1
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+ 的浓度为______mol•L-1,Fe2+的浓度为______mol•L-1. tianpeng20011年前1
tianpeng20011年前1 -
 zhuleiqiusuo 共回答了22个问题
zhuleiqiusuo 共回答了22个问题 |采纳率100%解题思路:步骤一:电解精炼铜时,精铜做阴极,粗铜作阳极,阴极上是铜离子得电子;根据锌、铁与硫酸铜发生置换反应分析;
步骤二:(1)金属银可以和硝酸反应得到硝酸银以及水和一氧化氮;金离子可以和氯离子之间发生反应,形成稳定的AuCl4-离子,可以根据化学平衡移动原理来解释;
(2)根据化学反应原理结合原子守恒的思想来计算回答.步骤一:在电解精炼铜时,阳极反应是金属锌、铁、镍等先失电子,阴极上是铜离子得电子产生铜,电解反应为:Cu2++2e═Cu,精铜做阴极,粗铜作阳极;硫酸铜的浓度会变小,原因是锌、铁与硫酸铜发生置换反应;
故答案为:正;Cu2++2e═Cu;变小;
步骤二:(1)金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水,反应的离子方程式为:3Ag+4H++NO3-═3Ag++NO↑+2H2O;根据表中的信息,Au+6HNO3(浓)═Au(NO3)3+3NO2↑+3H2O,并且Au3++4Cl-═AuCl4-,在王水中,含有浓硝酸和浓盐酸,浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中,
故答案为:3Ag+4H++NO3-═3Ag++NO↑+2H2O;浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应1平衡向右移动,则金溶于王水中;
(2)100mL的滤液中含有亚铁离子、铜离子、锌离子,当加入足量的金属Fe以后,会将金属铜全部置换出来,所以生成的3.2g金属是Cu,所以铜离子的浓度c=[n/V]=
3.2
64
0.1mol/L=0.5 mol/L,
亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是:[4.8g/160g/mol]×2=0.06mol,所以加入铁粉后的滤液中亚铁离子的浓度c=[n/V]=[0.06mol/0.1L]=0.6mol/L,由于加入了铁粉,铁与溶液中的铁离子反应生成了亚铁离子,所以100mL滤液中亚铁离子的浓度为:0.6mol/L-0.5 mol/L=0.1mol/L,
故答案为:0.5;0.1.点评:
本题考点: 电解原理;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了电解原理,涉及了电解精炼铜、化学平衡移动原理以及物质的含量的测定的综合知识,考查角度广,难度较大.1年前查看全部
- 某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl 2 ·2H 2 O)。 (1)实验室采用如下图所示的装
某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl 2 ·2H 2 O)。 
(1)实验室采用如下图所示的装置,可将反应①粗铜与Cl 2 反应转化为固体1(部分仪器和夹持装置已略去)。 
① 仪器A的名称是_________________。
② 连接好装置后,加入药品前,应该进行的实验操作是_______________。
③ 装置B中发生反应的离子方程式是______________。
④ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)________________。
⑤ 虚线内缺少实验装置,请你画出装置图,标明药品名称。
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。
a.NaOHb.NH 3 ·H 2 Oc.CuOd.Cu 2 (OH) 2 CO 3 e.CuSO 4
操作①的名称是______________。
(3)在溶液2转化为CuCl 2 ·2H 2 O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H 2 O) 4 2+ (aq) +4Cl - (aq) CuCl 4 2- (aq) +4H 2 O(l)
CuCl 4 2- (aq) +4H 2 O(l)
蓝色黄色
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl 2 溶液中有上述转化关系的是(填序号)_____________。
a.将Y稀释,发现溶液呈蓝色 b.在Y中加入CuCl 2 晶体,溶液变为绿色 c.在Y中加入NaCl固体,溶液变为绿色 d.取Y进行电解,溶液颜色最终消失
(4)操作②需在氯化氢气流中经过加热浓缩、__________、过滤、洗涤、干燥。 wangzhiqing001年前1
wangzhiqing001年前1 -
 dxg1860 共回答了19个问题
dxg1860 共回答了19个问题 |采纳率84.2%1年前查看全部
- 氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl 2 ·xH 2 O)。

(1)实验室采用如图所示装置,可使粗铜与Cl 2 反应转化为固体1(部分加热仪器和夹持装置已略去)。该装置中仪器a的名称是 。装置b中发生反应的离子方程式是 。该装置存在一定的安全隐患,消除该安全隐患的措施是 。
(2)操作Ⅱ中应控制的pH范围为 ,其目的是 。
已知:
(3)操作Ⅲ的程序依次为 、 、过滤、自然干燥.得到CuCl 2 ·xH 2 O晶体。
(4)若制备的氯化铜晶体经检验含有FcCl 2 ,其原因可能是 ,试提出两种不同的改进方案:① ;② 。 lwmlwm0071年前1
lwmlwm0071年前1 -
 gdhylong 共回答了20个问题
gdhylong 共回答了20个问题 |采纳率90%(15分)(1)分液漏斗(2分);MnO 2 +4H + +2Cl - Mn 2+ +Cl 2 ↑+2H 2 O(2分);在C和D之间连接一个防倒吸装置(2分);
(2)3.2≤pH<4.7(2分);使FeCl 3 转化为Fe(OH) 3 沉淀而与CuCl 2 溶液分离(或除去CuCl 2 溶液中FeCl 3 ) (2分) (3)蒸发浓缩、冷却结晶(2分)
(4)与粗铜反应的氯气不足量(1分);①通足量的氯气(1分) ②在操作Ⅱ中加入CuO前先加入足量的H 2 O 2 或通入Cl 2 (1分)
1年前查看全部
- 如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问
如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题:

(1)甲烷燃料电池负极电极反应式是:______;
(2)石墨电极(C)的电极反应式为______;
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体体积为______L;丙装置中阴极析出铜的质量为______g;
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图2所示).
若用于制漂白液时a为电池______极,电解质溶液最好用______.
若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阳极选用______作电极. toughbanker1年前1
toughbanker1年前1 -
 海角哥 共回答了19个问题
海角哥 共回答了19个问题 |采纳率94.7%解题思路:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极.
(1)燃料电池中,负极上投放燃料,负极上失电子发生氧化反应.
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨是阳极,阳极上氯离子失电子发生氧化反应.
(3)根据串联电池中转移电子数相等计算铁电极上生成氢气的体积、丙装置中析出铜的质量.
(4)电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是漂白液的有效成分;若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阴极上氢离子放电生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁.燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极.
(1)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:
CH4+10OH--8e-=CO32-+7H2O.
故答案为:CH4+10OH--8e-=CO32-+7H2O.
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑.
故答案为:2Cl--2e-=Cl2↑.
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=
2.24L
22.4L/mol×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;丙装置中阴极上析出铜,设析出铜的质量为yg.
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
x=4.48
2Cu 2++2e-=Cu
2mol 64g
0.4mol yg
y=12.8
故答案为:4.48;12.8.
(4)电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是漂白液的有效成分,B电极上生成氯气,氯气的密度小于溶液的密度,所以生成的氯气上升,能和氢氧化钠溶液充分的接反应生成次氯酸钠,所以A极上析出氢气,即A极是阴极,所以a为电池负极;若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阴极上氢离子放电生成氢气,如果阳极是惰性电极,阳极上氢氧根离子放电生成氧气得不到氢氧化亚铁,所以阳极上应该是铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁.
故答案为:负极;饱和食盐水;铁.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理及物质的量的有关计算,难点是(4)题中电解质溶液的选取及电极材料的选取,根据实验目的进行正确选取即可.1年前查看全部
- (12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回
(12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲烷燃料电池负极反应式是 ;
(2)石墨(C)极的电极反应式为 ;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成 的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH) 2 的实验装置(如图所示)。
若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH) 2 ,使用硫酸钠作电解质溶液,阳极选用________作电极。 jiguihua1年前1
jiguihua1年前1 -
 背锦离乡 共回答了15个问题
背锦离乡 共回答了15个问题 |采纳率93.3%(12分) (1) CH 4 +10OH - -8e - =CO 3 2- +7H 2 O ;(3分)
(2)2Cl - -2e - =Cl 2 ↑;(2分) (3)4.48L,(2分) 12.8g;(2分)
(4) 负(1分) 饱和氯化钠溶液或食盐水(1分) 铁 (1分)
1年前查看全部
- 铜的电解精炼原理中的一点疑问阴离子在阳极失去电子的时候为什么粗铜会发生Cu→Cu2++2e-这个反应?阴离子不是已经失去
铜的电解精炼原理中的一点疑问
阴离子在阳极失去电子的时候为什么粗铜会发生Cu→Cu2++2e-这个反应?阴离子不是已经失去电子了吗?为什么铜还要失去电子?为什么发生反应的是电极而不是电解液?
还有,为什么电解精炼铜的时候阳极的铜会溶解,电解精炼镍的时候阳极的铜杂质会变成阳极泥? xiaonuochen1年前2
xiaonuochen1年前2 -
 语图度 共回答了19个问题
语图度 共回答了19个问题 |采纳率100%1、在阳极上,铜以的形态是原子,化合价为0.你说的阴离子在阳极失去电子,我不晓得你说的是那种阴离子,因为在阳极上,杂质金属一般以氧化物的形式存在,金属显正价.
2、阳极发生反应从电化学的角度来说:Cu的标准电位为+0.34,H2O的标准电位是+1.23,硫酸根的标准电位是+2.42,一般来说电解精炼时槽电压维持在0.32-0.34V,所以阳极只能发生标准电位在这个范围之下得反应如:Cu,Fe,Zn等金属都在阳极上失去电子成为离子进入溶液.
3、电解精炼过程中发生的反应,建议你看下电解池和原电池的区别.在电解池中,溶液只承担一个搬运离子的作用,其自身成分一般不发生改变.故而在精炼铜时:理想化的反应式:
阳极:Cu-2e=Cu2+ 阴极:Cu2+ +2e=Cu.至于在实际产生中,电解液中铜离子的浓度在上升等等···就涉及电流效率和副反应的问题了.
4、第二点说了,电化学反应主要是看标准电位和电解时两端的电压.在精炼Ni时,Ni的标准电位是+0.25v,这个电位还不能使铜(+0.34v)溶解,因此铜是不会溶解的.1年前查看全部
- (2013•黄冈模拟)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备
(2013•黄冈模拟)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2•2H2O).

(1)为了完成步骤Ⅰ,可采用如下图所示的装置将粗铜转化为固体a.
在该实验中,加热A、C装置中的酒精灯时,应该先点燃______装置的酒精灯,D装置的作用是______,C装置中生成的产物是______.
(2)步骤Ⅱ中的操作是:将步骤Ⅰ中的固体加入到容器中,然后加入______,固体完全溶解.
(3)步骤Ⅲ中加入的试剂是H2O2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式:______.
(4)步骤Ⅳ中应先加入某试剂,然后过滤得到滤液.为了调节溶液的pH只使Fe3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是______.
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl2•2H2O晶体.现欲得到无水CuCl2,在实验室也可以采用上述装置完成CuCl2•2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是______. congtou4375330531年前1
congtou4375330531年前1 -
 九米 共回答了17个问题
九米 共回答了17个问题 |采纳率82.4%解题思路:(1)为了防止金属和氧气之间的反应,在金属参与反应之前先将装置中的空气排净,氯气可以和金属之间反应,氯气有毒,要进行尾气处理;
(2)根据金属铜和金属铁化学性质的区别进行回答;
(3)双氧水是绿色氧化剂,可以将亚铁离子氧化为三价铁离子,自身被还原为水;
(4)氨水或是氢氧化钠溶液和氢离子之间反应产物是铵盐、钠盐以及水;
(5)在氯化铜溶液中,铜离子水解导致溶液显示酸性,盐酸环境可以抑制其水解的发生.(1)为了防止金属Fe、Cu和氧气之间的反应,在金属和氯气的反应之前要先产生氯气,先将装置中的空气排净,氯气和金属之间反应,得到的是高价金属氯化物,氯气有毒,可以用碱石灰进行尾处理,故答案为:A;吸收尾气,防止污染空气;CuCl2、FeCl3;
(2)金属铜不可以和盐酸之间反应但是金属铁可以,向金属混合物中加入盐酸、过滤可以将金属铜、铁分离,故答案为:稀盐酸;
(3)双氧水是绿色氧化剂,可以将亚铁离子氧化为三价铁离子,自身被还原为水,即H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)氨水或是氢氧化钠溶液和氢离子之间反应产物是铵盐、钠盐以及水,加入试剂CuO粉末调节溶液的pH使Fe3+完全沉淀,若用氨水或NaOH溶液,会防止引进杂质,且试剂的量不易控制,故答案为:加入氨水或是氢氧化钠溶液会引进杂质,且试剂的量不易控制;
(5)CuCl2•2H2O脱水得到无水CuCl2,应该是在氯化氢气流中进行的,目的是抑制铜离子水解,所以A装置是氯化氢的发生装置,装置内装的是氯化钠晶体和浓硫酸,故答案为:氯化钠晶体和浓硫酸.点评:
本题考点: 制备实验方案的设计;铜金属及其重要化合物的主要性质.
考点点评: 本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大.1年前查看全部
- (2011•奉贤区二模)工业制硫酸铜不是直接用铜和浓硫酸反应,而是将粗铜(含少量银)浸入稀硫酸中,并不断从容器下部吹入细
(2011•奉贤区二模)工业制硫酸铜不是直接用铜和浓硫酸反应,而是将粗铜(含少量银)浸入稀硫酸中,并不断从容器下部吹入细小的空气泡.有关该制备方法的叙述中,不正确的是( )
A.该方法应用了原电池工作原理
B.该方法不产生污染大气的二氧化硫
C.该方法提高了硫酸的利用率
D.该方法提高了铜的利用率 都市里孤独的狼1年前1
都市里孤独的狼1年前1 -
 iiii 共回答了12个问题
iiii 共回答了12个问题 |采纳率91.7%解题思路:反应方程式为:2Cu+O2+2H2SO4═2CuSO4+2H2O,铜、银浸入稀硫酸中分别作为负极与正极形成原电池,所以粗铜中所含的银可以加快反应的速度,与Cu与浓H2SO4加热进行的反应相比较,前者节省能源,不会放出SO2气体,硫酸的利用率高.A、工业上以粗铜、稀硫酸和空气制取硫酸铜的反应方程式如下:2Cu+2H2SO4+O2=2CuSO4+2H2O,铜、银浸入稀硫酸中分别作为负极与正极形成原电池,所以粗铜中所含的银可以加快反应的速度.电极反应式如下:负极(铜):2Cu-4e-=2Cu2+ 正极(银):4H++O2+4e-=2H2O,故A正确;
B、稀硫酸的弱氧化性体现在H+上,而不体现在SO42-离子的+6价S上,所以反应不会产生SO2,故B正确;
C、实验室用铜与浓硫酸共热的方法制取硫酸铜时,只有一半物质的量的浓硫酸与铜结合生成硫酸铜,另一半浓硫酸被还原生成二氧化硫而损失掉,所以相对于实验室制法,工业上以粗铜为原料制取硫酸铜的方法更节约硫酸,因此提高了硫酸的利用率,故C正确;
D、根据质量守恒,生成相同物质的量的硫酸铜,消耗的铜的量是相等的,故D错误.
故选D.点评:
本题考点: 浓硫酸的性质;制备实验方案的设计.
考点点评: 本题考查工业生产硫酸铜的原理,考查学生的评价能力,注意从原料的利用率和环保问题等角度进行评价和分析,本题难度不大.1年前查看全部
- 以CuSO 4 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 A.电能全
以CuSO 4 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
A.电能全部转化为化学能 B.粗铜接电源正极,发生还原反应 C.溶液中Cu 2 + 向阳极移动 D.利用阳极泥可回收Ag、Pt、Au等金属  好了嘛1年前1
好了嘛1年前1 -
 桃花传奇sb 共回答了22个问题
桃花传奇sb 共回答了22个问题 |采纳率77.3%D
1年前查看全部
- (2012•上饶二模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究性学习小组用粗铜(含杂质Fe)按图1所
(2012•上饶二模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究性学习小组用粗铜(含杂质Fe)按图1所示流程制备氯化铜晶体(CuCl2•H2O).

请回答下列问题:
(1)实验室采用如图2所示的装置制取固体l(加热仪器和夹持装置已略去).
①仪器a的名称是______;装置B中的试剂为______.
②装置A中反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O△ .MnO2+4H++2Cl-.
Mn2++Cl2↑+2H2O△ .
③装置D中的试剂为______,其作用是______.
(2)在除去溶液1中的Fe3+时,加入试剂X用于调节pH以除去杂质.
①X可选用下列试剂中的______(填字母代号).
A.Na2CO3 B.NH3•H2O C.CuO D.CuSO4
②为使CuCl2溶液中的Fe3+完全除去,根据如表数据,溶液pH范围应保持在______.
当溶液的pH=4时,c(Fe3+)=______mol/L.[Fe(OH)3的Ksp=4.0×10-38]
(3)在溶液2转化为CuCl2•2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.已知如下转化关系:离子 Fe3+ Cu2+ 氢氧化物开始沉淀时的pH 1.9 4.7 氢氧化物完全沉淀时的pH 3.2 6.7
Cu(H2O)
(aq)+4Cl-(aq)⇌CuCl2+4
(aq)+4H2O(l)2−4
请设计合理的实验方案证明CuCl2溶液中存在上述转化关系:______. 流连月光1年前1
流连月光1年前1 -
 yemin 共回答了12个问题
yemin 共回答了12个问题 |采纳率83.3%解题思路:(1)粗铜为Fe、Cu的混合物,与氯气反应生成固体1的主要成分为CuCl2和FeCl3,实验室采用如图2所示的装置制取固体l,制备原理为二氧化锰和浓盐酸在加热条件下反应生成氯气,应浓硫酸干燥后与粗铜在加热条件下反应生成CuCl2和FeCl3,多于的氯气用氢氧化钠溶液吸收,以防污染空气;
(2)除去CuCl2和FeCl3混合溶液中的Fe3+,应调节溶液pH3.2~4.7之间,可加入CuO、Cu(OH)2、CuCO3等物质,注意不能引入新的杂质;
(3)Cu(H2O)42+为蓝色,CuCl42-为黄色,溶液颜色由蓝色变为绿色,可改变Cu(H2O)42+或CuCl42-的浓度.(1)①由装置图可知a为分液漏斗,b中的试剂为浓硫酸,故答案为:分液漏斗;浓硫酸;
②二氧化锰和浓盐酸在加热条件下反应生成氯气,反应的离子方程式为MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O;
③装置D中的试剂为氢氧化钠溶液,可用于吸收多余的氯气,生成氯化钠和此次氯酸钠,防止污染环境,
故答案为:NaOH溶液; 吸收多余的氯气,防止污染空气;
(2)①可加入CuO、Cu(OH)2、CuCO3等物质,注意不能引入新的杂质,题中只有C符合,故答案为:C;
②为使CuCl2溶液中的Fe3+完全除去,应调节溶液pH介于3.2~4.7之间,可保证Fe3+完全除去,而不影响Cu2+,
当溶液的pH=4时,c(OH-)=1×10-10 mol•L-1,则c(Fe3+)=
4.0×10−38
(1.0×10−10)3mol•L-1=4.0×10-8 mol•L-1,
故答案为:3.2~4.7;4.0×10-8;
(3)Cu(H2O)42+为蓝色,CuCl42-为黄色,溶液颜色由蓝色变为绿色,如取氯化铜晶体配制成蓝绿色溶液,然后向溶液中加水稀释,溶液变为蓝色或向溶液中加入CuCl2晶体,溶液变为绿色,可证明溶液中存在Cu(H2O)42+(aq)+4Cl-(aq)⇌CuCl42-(aq)+4H2O(l)的平衡,
故答案为:取氯化铜晶体配制成蓝绿色溶液,然后向溶液中加水稀释,溶液变为蓝色;或向溶液中加入CuCl2晶体,溶液变为绿色等.点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;铜金属及其重要化合物的主要性质.
考点点评: 本题考查学生对工艺流程理解、实验装置的理解、平衡移动、平衡常数,物质分离提纯等,难度中等,需要学生具有基本扎实的基础与综合运用能力,(2)中②可以根据借助溶度积常数进行计算.1年前查看全部
- (2013•青岛一模)(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体
(2013•青岛一模)(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是______;
(2)检验溶液B中是否存在Fe3+的方法是______;
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+△ .2Cu2++SO32-+2Cl-+H2O;
2CuCl↓+SO42-+2H+△ .
(Ⅱ)(1)常温下,某同学将稀盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
请回答:从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=______mol•L-1;从第②组情况表明,C______0.2mol•L-1(选填“>”、“<”或“=”);实验编号 氨水物质的量浓度
(mol•L-1)盐酸物质的量浓度
(mol•L-1)混合溶液pH ① 0.1 0.1 pH=5 ② C 0.2 pH=7 ③ 0.2 0.1 pH>7
从第③组情况分析可知,混合溶液中c(NH4+)______c(NH3•H2O)(选填“>”、“<”或“=”).
(2)写出以下四组溶液NH4+离子浓度由大到小的顺序______>______>______>______(填选项编号).
A.0.1mol•L-1 NH4ClB.0.1mol•L-1 NH4Cl和0.1mol•L-1 NH3•H2O
C.0.1mol•L-1 NH3•H2OD.0.1mol•L-1NH4Cl和0.1mol•L-1 HCl. ahpk7991年前1
ahpk7991年前1 -
 sonana 共回答了23个问题
sonana 共回答了23个问题 |采纳率87%解题思路:(Ⅰ)(1)铜离子和铁离子都能在水溶液中发生水解反应,避免水解,用稀盐酸溶解;
(2)三价铁离子的检验方法,使用硫氰化钾溶液检验;
(3)铜离子变成了亚铜离子,被还原,亚硫酸根被氧化成硫酸根,写成反应,根据化合价升降相等配平方程式;
(Ⅱ)(1)①溶液是氯化铵溶液,铵离子水解显示酸性,溶液中的氢离子就是水电离的;
②中溶液PH=7,溶液显示中性,c=0.2时,溶液显示酸性,要显示中性,氨水必须多些;
③中反应完后,溶质是氯化铵和氨水,且PH>7,氨水的电离程度大于铵离子的水解,溶液中铵离子浓度大于氨水浓度;
(2)A、NH4Cl 部分水解,铵离子浓度略小于0.1mol•L-1;
B、氨水的电离大于电解程度,溶液中铵离子浓度大于0.1mol•L-1;
C、氨水部分电离,氨水中铵离子小于A的铵离子浓度;
D、盐酸中的氢离子抑制了铵离子的电解,使得铵离子 浓度变大,大于A中的铵离子浓度.(Ⅰ)(1)为了防止铜离子、铁离子水解,一般用稀盐酸溶解氯化铁和氯化铜;
故答案为:防止铁盐、铜盐发生水解反应;
(2)Fe3+的检验方法是:取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无Fe3+,若溶液变红色,则存在Fe3+;
故答案为:取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无Fe3+,若溶液变红色,则存在Fe3+;
(3)生成了CuCl,亚硫酸根检验还原性,被氧化成硫酸根,根据化合价变化配平方程式可得:2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+;
故答案为:2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+;
(Ⅱ)(1)从第①组情况分析,生成了氯化铵溶液,铵离子水解,溶液显示酸性,溶液中的氢离子是水电离的,故中由水电离出的c(H+)=1×10-5mol•L-1;
从第②组情况表明,pH=7,溶液显示中性,若C=2,生成氯化铵溶液,显示酸性,故氨水的浓度稍大些,即C>2;
从第③组情况分析可知,pH>7,氨水的电离程度大于水解程度,故铵离子浓度大于氨水浓度;
故答案为:1×10-5 mol•L-1;>;>;
(2)A、0.1mol•L-1 NH4Cl 中,铵离子部分水解,溶液中铵离子浓度稍小于0.1mol•L-1;
B、0.1mol•L-1 NH4Cl和0.1mol•L-1 NH3•H2O溶液中,氨水电离出的铵离子大于溶液中铵离子的水解,铵离子浓度大于0.1mol•L-1;
C、0.1mol•L-1 NH3•H2O中,氨水部分电离,溶液中铵离子浓度较小,小于A中的铵离子浓度;
D、0.1mol•L-1NH4Cl和0.1mol•L-1 HCl溶液中,由于盐酸溶液中氢离子的影响,抑制了铵离子的水解,导致溶液中铵离子浓度接近0.1mol•L-1,大于A中铵离子浓度;
故答案为:B>D>A>C.点评:
本题考点: 铜金属及其重要化合物的主要性质;离子浓度大小的比较;酸碱混合时的定性判断及有关ph的计算;铁的化学性质;二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查铜金属及其化合物的性质,涉及了较多的离子浓度大小比较题目,可以根据所学知识完成,本题难度中等.1年前查看全部
- (18分)如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
(18分)如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式___________________
 _____________________________________。
_____________________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或 “石墨极”)区
“石墨极”)区
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成 的气体的分子数为________;丙装置中阴极析出铜的质量为_______
的气体的分子数为________;丙装置中阴极析出铜的质量为_______ _。
_。 guwen12231年前1
guwen12231年前1 -
 nishialibaba 共回答了21个问题
nishialibaba 共回答了21个问题 |采纳率76.2%1年前查看全部
- 混合物分离或提纯除去固体碘中的NA2SO4除去粗铜中的金属杂质除去蛋白质中的杂质除去固体nacl中混有的nh4clnac
混合物分离或提纯
除去固体碘中的NA2SO4
除去粗铜中的金属杂质
除去蛋白质中的杂质
除去固体nacl中混有的nh4cl
nacl溶液中混有碘水 zhjvip1年前3
zhjvip1年前3 -
 不可思议tt 共回答了13个问题
不可思议tt 共回答了13个问题 |采纳率100%1,加水溶解后过滤
2. 将粗铜放入稀盐酸中,直到没有气泡产生,然后过滤.
3. 蛋白质分子属于大分子,可以采取渗透法.
4. 加入足量氢氧化钠溶液,加热至不再产生气体后,加入足量稀盐酸,加热蒸发.
5. 加热使碘升华1年前查看全部
- (1)粗铜中含有少量锌、铁、银、金等金属,采用电解法提纯粗铜时,应以______为阳极,______为阴极,______
(1)粗铜中含有少量锌、铁、银、金等金属,采用电解法提纯粗铜时,应以______为阳极,______为阴极,______为电解质溶液,电解时,在阴极上还原出来的金属是______,留在溶液中的离子是______.
(2)欲在铜片上镀银,请设计实验,画出装置图,注明电极和电解质溶液的名称,写出电极方程式______. 九月的木瓜1年前0
九月的木瓜1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 【急】为什么粗铜中的金和银以阳极泥的形式出现
【急】为什么粗铜中的金和银以阳极泥的形式出现
①在电解精炼铜时 粗铜中的金和银是以单质的形式作为阳极泥沉淀在电解池的池底 我知道这个结论 为什么不是通电使金和银氧化失电子形成金属阳离子再被镀到精铜上
②粗铜中有铁 电解时铁以例子的形式存在 可否理解为当电解质溶液中的铜离子全部被镀到阴极后 就可以再把铁离子镀到阴极上?麻烦作答 芥子微尘1年前2
芥子微尘1年前2 -
 yy的痛 共回答了22个问题
yy的痛 共回答了22个问题 |采纳率95.5%1)因为金、银比铜更难失电子,因此总是铜先失电子,以离子形式脱落,进入溶液.阳极上的铜在溶解的时候,杂于其中的金和银就脱落下来.如果阳极是纯银的话,电压足够的情况下,银也会以离子形式进入溶液,但此时铜溶下来了,银根本就不能在阳极上了,掉下来了.
2)可以这么理解.铜比铁更易得电子,所以铜先镀到阴极,当铜镀完后,继续通电,铁会镀上去.1年前查看全部
- 粗铜的电解精炼如图所示.在粗铜的电解过程中,图中c电极的材料是______(填“粗铜板”或“纯铜板”);在d电极上发生的
 粗铜的电解精炼如图所示.在粗铜的电解过程中,图中c电极的材料是______(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为______;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是______.电解一段时间后,电解液中的金属离子有______.
粗铜的电解精炼如图所示.在粗铜的电解过程中,图中c电极的材料是______(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为______;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是______.电解一段时间后,电解液中的金属离子有______.  伊叶孤帆1年前1
伊叶孤帆1年前1 -
 11水果味 共回答了19个问题
11水果味 共回答了19个问题 |采纳率100%解题思路:用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极;阳极与电池的正极相连发生氧化反应,阴极与电池的负极相连发生还原反应;金属的活动性顺序为Zn>Fe>Cu>Ag>Pt,因此在电解过程中Ag、Au不会失去电子,而是形成阳极泥,根据电解原理来解答.用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极;
该装置中a为原电池的正极,b为原电池的负极,所以c为电解池的阳极,d为电解池的阴极,电解时,以硫酸铜溶液为电解液,溶液中的Cu2+得到电子沉积在阴极上,发生还原反应,即Cu2++2e-=Cu;
作阳极的粗铜中的铜以及比铜活泼的金属失去电子进入溶液,所以Fe发生Fe-2e-═Fe2+反应,以Fe2+的形式进入溶液中;比铜不活泼的金属Au、Ag不会失去电子,以单质的形成沉入电解槽形成“阳极泥”,则沉积在电解槽底部(阳极泥)的杂质是Au、Ag,电解一段时间后,电解液中的金属离子有Cu2+、Fe2+,
故答案为:粗铜板;Cu2++2e-=Cu;Au、Ag;Cu2+、Fe2+.点评:
本题考点: 铜的电解精炼.
考点点评: 本题考查铜的电解精炼、氧化还原等知识,根据电解原理和氧化还原的规律解题是解答的关键,题目难度中等.1年前查看全部
- (2014•东城区一模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制
(2014•东城区一模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2•2H2O).

(1)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
①仪器A的名称是______.
②装置B中发生反应的离子方程式是MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O△ .MnO2+4H++2Cl-.
Mn2++Cl2↑+2H2O△ .
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)______.
(2)试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)______.
a.NaOHb.NH3•H2Oc.CuOd.Cu2(OH)2CO3e.CuSO4
(3)在溶液2转化为CuCl2•2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K=c(Cu
)Cl 2−4c[Cu
]•c4(Cl−)(H2O) 2+4.若增大氯离子浓度,K值(填“增大”、“减小”或“不变”)______.c(Cu
)Cl 2−4c[Cu
]•c4(Cl−)(H2O) 2+4
②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)______.
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失. 雨中香樟1年前1
雨中香樟1年前1 -
 东健1 共回答了21个问题
东健1 共回答了21个问题 |采纳率95.2%解题思路:(1)①仪器A是分液漏斗.
②装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水.
③HCl对反应没有影响.
(2)由工艺流程可知,加入试剂X用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,不能引入新杂质.
(3)①生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值为平衡常数,注意水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去;平衡常数只受温度影响,与离子浓度无关.
②根据平衡移动原理分析.(1)①仪器A是分液漏斗.
故答案为:分液漏斗.
②装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O.
故答案为:MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O.
③HCl对反应没有影响,不需要在浓硫酸洗气瓶前增加吸收HCl的装置.
故答案为:否.
(2)由工艺流程可知,加入试剂X用于调节pH以除去杂质,且不能引入新杂质.
a.NaOH引入杂质钠离子,故a错误;
b.NH3•H2O 引入铵根离子,故b错误;
c.CuO可以调节pH值,除去杂质,过量的CuO过滤除去,不引入杂质,故c正确;
d.Cu2(OH)2CO3 可以调节PH值,除去杂质,过量的Cu2(OH)2CO3过滤除去,不引入杂质,故d正确;
e.CuSO4不能调节pH值,引入硫酸根离子,故e错误;
故选:cd.
(3)①Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)+4H2O(l)的平衡常数为K=
CuCl42-(aq)+4H2O(l)的平衡常数为K=
c(Cu
Cl2−4)
c[Cu
(H2O)2+4]•c4(Cl−).
平衡常数只受温度影响,与离子浓度无关,增大氯离子浓度,K值不变.
故答案为:
c(Cu
Cl2−4)
c[Cu
(H2O)2+4]•c4(Cl−);不变.
②a.将Y稀释,平衡向作反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故a正确;
b.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故b正确;
c.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故c正确;
d.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故d错误.
故选:abc.点评:
本题考点: 制备实验方案的设计;化学平衡的影响因素;难溶电解质的溶解平衡及沉淀转化的本质;铜金属及其重要化合物的主要性质.
考点点评: 本题考查学生对工艺流程理解、实验装置的理解、平衡移动、平衡常数,物质分离提纯等,难度中等,小于学生基本扎实的基础与综合运用能力,(3)中②a可以根据借助平衡常数进行判断.1年前查看全部
- (6分)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(C
(6分)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl 2 ·2H 2 O)。
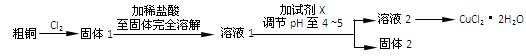
(1)实验室采用如下图所示的装置,可将粗铜与Cl 2 反应转化为固 体1(部分仪器和夹持装置已略去)。
体1(部分仪器和夹持装置已略去)。
①仪器A的名称是 。
②装置B中发生反应的离子方程式是 。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”) 。
④ NaOH溶液的作用
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号) 。
a.NaOH b.NH 3 ·H 2 O c.CuO d.Cu 2 (OH) 2 CO 3 e.CuSO 4 bfal1年前1
bfal1年前1 -
 盖房子缺料 共回答了24个问题
盖房子缺料 共回答了24个问题 |采纳率87.5%(6分)
(1)①分液漏斗②MnO 2 +4H + +2Cl - = △ Mn 2+ + Cl 2 ↑+2H 2 O③否④除去Cl 2 和HCl
(2)c d(各1分)
略1年前查看全部
- (2013•常德模拟)某研究小组用粗铜(含杂质铁)与一定体积浓硫酸反应进行实验研究(如图装置),并按下述流程除杂制备硫酸
(2013•常德模拟)某研究小组用粗铜(含杂质铁)与一定体积浓硫酸反应进行实验研究(如图装置),并按下述流程除杂制备硫酸铜晶体(CuSO4•5H20)

请回答下列问题:
(1)试管A中开始反应时的主要化学方程式Cu+2H2SO4
CuSO4+SO2↑+2H2O△ .Cu+2H2SO4;
CuSO4+SO2↑+2H2O△ .
(2)若反应后A处有少量固体剩余,使其溶解的最好方法是______;
(3)试管B中的实验现象是______,使用浸润某种溶液的棉花的作用是______;
(4)步骤Ⅱ中加入的试剂是双氧水,写出有关反应的离子方程式______;
(5)步骤Ⅳ中,将溶液蒸发浓缩、冷却结晶后再进行______(填操作名称)可制得CuSO4•5H2O晶体,该操作所需的玻璃仪器有烧杯、漏斗和______(填仪器名称). hahanew211年前1
hahanew211年前1 -
 忆梦缘 共回答了16个问题
忆梦缘 共回答了16个问题 |采纳率81.3%解题思路:(1)加热条件下,Cu和浓硫酸发生氧化还原反应生成CuSO4、SO2和H2O;
(2)Cu和稀硫酸不反应,所以会有部分金属剩余,要使剩余金属溶解,可以加入少量双氧水;
(3)二氧化硫具有漂白性,能使品红溶液褪色;二氧化硫有毒,排入空气会污染大气;
(4)酸性条件下,双氧水和Cu、稀硫酸反应生成硫酸铜和水;
(5)将溶液蒸发浓缩、冷却结晶后再进行过滤即可得到CuSO4•5H2O晶体,根据仪器的作用选取仪器.(1)加热条件下,Cu和浓硫酸发生氧化还原反应生成CuSO4、SO2和H2O,反应方程式为Cu+2H2SO4
△
.
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4
△
.
CuSO4+SO2↑+2H2O;
(2)Cu和稀硫酸不反应,所以会有部分金属剩余,要使剩余金属溶解,可以加入少量双氧水,双氧水具有氧化性,酸性条件下能将Cu氧化为铜离子,自身被还原为水,没有杂质产生,故答案为:加适量双氧水;
(3)二氧化硫具有漂白性,能使品红溶液褪色,所以B中的现象是品红溶液褪色;二氧化硫有毒,排入空气会污染大气,棉花的作用是吸收二氧化硫,防止污染大气,故答案为:溶液褪色;吸收二氧化硫;
(4)酸性条件下,双氧水和Cu、稀硫酸反应生成硫酸铜和水,离子方程式为Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(5)将溶液蒸发浓缩、冷却结晶后再进行过滤即可得到CuSO4•5H2O晶体,过滤时需要烧杯、玻璃棒、漏斗,故答案为:过滤;玻璃棒.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查探究铜和浓硫酸的反应,侧重考查学生实验操作能力、分析问题能力,涉及混合物的分离和提纯、氧化还原反应、离子方程式的书写等知识点,知道常见元素化合物性质,题目难度不大.1年前查看全部
- 下列有关说法正确的是(N A 为阿伏加德罗常数) ( ) A.工业上粗铜
下列有关说法正确的是(N A 为阿伏加德罗常数) ( )
A.工业上粗铜的电解精炼时,每转移1mol电子时阳极上溶解的铜小于0.5N A B.1.12L Cl 2 含有1.7N A 个质子 C.1mol NaHSO 4 固体中含阴阳离子数为3N A D.将1mol NO 2 气体在降温后颜色变浅,但其所含的分子数仍然为N A  kgb66yy1年前1
kgb66yy1年前1 -
 jinzu1982 共回答了23个问题
jinzu1982 共回答了23个问题 |采纳率87%A
1年前查看全部
- 某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2•2H2O).
某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2•2H2O).

(1)步骤①中采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
①仪器A的名称是______;
②连接好装置,然后进行的实验操作是______;
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)______,理由是______;
④虚线内缺少实验装置,请你画出装置图,标明药品名称.
(2)步骤②的具体操作是______.
(3)步骤③中试剂X用于调节pH以除去杂质,可选用下列试剂中的______(填序号).
a.NaOHb.NH3H2Oc.Cu2(OH)2CO3d.CuSO4
X发生反应的离子方程式是______;得到固体2的操作名称是______.
(4)步骤④的操作过程中,发现溶液颜色由蓝色变为绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)⇌CuCl42-(aq)+4H2O(l)
蓝色黄色
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)______.
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失. 塞上鸿飞1年前1
塞上鸿飞1年前1 -
 ZHU07483 共回答了15个问题
ZHU07483 共回答了15个问题 |采纳率93.3%解题思路:粗铜中含有Fe,与氯气反应生成CuCl2和FeCl3,步骤③目的是调节溶液pH,使FeCl3发生水解生成Fe(OH)3沉淀而除去,则加入的物质应不能引入新杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,得到的溶液2为溶液CuCl2,经蒸发浓缩,冷却结晶可得到CuCl2晶体;实验室用二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,含有HCl、H2O等杂质,必须经过除杂,以此解答该题.△ .(1)①仪器A是分液漏斗,故答案为:分液漏斗;
②制备气体,应首先检验装置的气密性,故答案为:检验装置气密性;
③HCl对反应没有影响,不需要在浓硫酸洗气瓶前增加吸收HCl的装置,故答案为:否;HCl不影响氯气和粗铜的反应的产物;
④反应后尾气含有氯气,不能直接排放到空气中,应用NaOH溶液进行尾气的吸收,如图 ,故答案为:
,故答案为: ;
;
(2)步骤②为固体溶解的操作,操作方法为取固体1于烧杯中,加入适量稀盐酸,用玻璃棒搅拌至固体全部溶解,
故答案为:取固体1于烧杯中,加入适量稀盐酸,用玻璃棒搅拌至固体全部溶解;
(3)步骤③目的是调节溶液pH,使FeCl3发生水解生成Fe(OH)3沉淀而除去,则加入的物质应不能引入新杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,发生反应的离子方程式为Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,从溶液中分离出固体,应用过滤的方法,
故答案为:c;Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;过滤;
(4)a.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故a正确;
b.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故b正确;
c.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故c正确;
d.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故d错误.
故答案为:abc.点评:
本题考点: 制备实验方案的设计;铜金属及其重要化合物的主要性质.
考点点评: 本题考查考查较为综合,涉及物质的制备、检验和性质实验设计等问题,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.1年前查看全部
- 氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工原料。某研究小组用粗铜(含杂质Fe) 按下述流程制备氯化铜晶体(CuCl
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工原料。某研究小组用粗铜(含杂质Fe) 按下述流程制备氯化铜晶体(CuCl 2 ·2H 2 O)。

⑴实验室采用如右图所示的装置,可将粗铜与Cl 2 反应转化为固体
1(部分仪器和夹持装置已略去)。
①仪器A的名称是_________________。
②装置B中发生的反应的离子方程式是
__________________________________。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要______(填“是”或“否”)。
⑵试剂X用于调节pH以除去杂质,X可选用下列试剂中的_________(填序号)。
a.NaOH b.NH 3 ·H 2 O c.CuO d.Cu 2 (OH) 2 CO 3 e.CuSO 4
⑶在溶液2转化为CuCl 2 ·2H 2 O的操作过程中,发现溶液颜色由蓝色变为绿色,小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H 2 O) 4 2 + (aq)+4Cl - (aq) CuCl 4 2 - (aq)+4H 2 O(l)
CuCl 4 2 - (aq)+4H 2 O(l)
蓝色黄色
①上述反应的化学平衡常数表达式是 K =________________________,若增大氯离子浓度, K 值_________(填“增大”、 “减小”或“不变”)。
②取氯化铜晶体配制蓝绿色溶液Y,进行如下实验,其中能够证明CuCl 2 溶液中有上述转化关系的是___________(填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl 2 晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失 ANAY_ZIZI1年前1
ANAY_ZIZI1年前1 -
 henin129 共回答了17个问题
henin129 共回答了17个问题 |采纳率70.6%⑴①分液漏斗
②MnO 2 +4H + +2Cl - Mn 2 + +Cl 2 ↑+2H 2 O
Mn 2 + +Cl 2 ↑+2H 2 O
③否
⑵cd
⑶① 不变
不变
②abc (每空2分,共14分)
(1)①仪器A的名称是分液漏斗;
②装置B中发生的反应的离子方程式是:MnO 2 +4H + +2Cl - Mn 2 + +Cl 2 ↑+2H 2 O;
Mn 2 + +Cl 2 ↑+2H 2 O;
③因浓硫酸与HCL不反应,所以没有必要在浓硫酸洗气瓶前增加吸收HCl的装置;
(2)试剂X用于调节pH以除去杂质,X可选用CuO、Cu 2 (OH) 2 CO 3 ;
(3)①上述反应的化学平衡常数表达式是 K = ;增大氯离子浓度, K 值不变,因K值只受温度影响与其他因素无关;
;增大氯离子浓度, K 值不变,因K值只受温度影响与其他因素无关;
②取氯化铜晶体配制蓝绿色溶液Y,进行如下实验,其中能够证明CuCl 2 溶液中有上述转化关系的是:abc1年前查看全部
- 下列说法正确的是 A.电解精炼铜时,同一时间内阳极溶解的粗铜的质量比阴极析出的铜的质量大 B.在镀件上电镀锌,可以用锌做
下列说法正确的是
A.电解精炼铜时,同一时间内阳极溶解的粗铜的质量比阴极析出的铜的质量大 B.在镀件上电镀锌,可以用锌做阳极,也可以用惰性材料做阳极 C.二次电池充电过程是化学能转化为电能的过程 D.二次电池充电时,电池上标有“+”的电极应与外接电源的负极相连  hitleijunmin1年前1
hitleijunmin1年前1 -
 ff文云 共回答了14个问题
ff文云 共回答了14个问题 |采纳率100%1年前查看全部
- 以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是( )
以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是( )
A.电能全部转化为化学能
B.粗铜接电源负极,发生氧化反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Pt、Au等金属 猫咪森林19831年前1
猫咪森林19831年前1 -
 零失败 共回答了13个问题
零失败 共回答了13个问题 |采纳率100%解题思路:电解精炼铜时,粗铜作阳极,该电极上Zn、Fe、Ni、Cu失电子,精铜作阴极,该极上是铜离子得电子,阳极上铜以及比铜活泼的金属会溶解,而没有铜活泼的金属会从阳极掉落下,形成阳极泥.A、电解池中,电能不会全部转化为化学能,还会伴随热能等形式的能的产生,故A错误;
B、电解精炼铜时,粗铜作阳极,接电源正极,发生氧化反应,故B错误;
C、溶液中Cu2+向阴极移动,在阴极上发生还原反应,故C错误;
D、在阳极上,没有铜活泼的金属Ag、Pt、Au等金属会从阳极掉落下,形成阳极泥,利用阳极泥可回收Ag、Pt、Au等金属,故D正确.
故选D.点评:
本题考点: 铜的电解精炼.
考点点评: 本题以电解精炼铜为例考查学生电解池的工作原理,注意知识的归纳和整理以及应用是关键,难度不大.1年前查看全部
- (2013•德州二模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备
(2013•德州二模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2•xH2O).

(1)实验室采用如图所示装置,可使粗铜与Cl2反应转化为固体1(部分加热仪器和夹持装置已略去).该装置中仪器a的名称是______.装置b中发生反应的离子方程式是MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O△ .MnO2+4H++2Cl-.该装置存在一定的安全隐患,消除该安全隐患的措施是______.
Mn2++Cl2↑+2H2O△ .
(2)操作Ⅱ中应控制的pH范围为______,其目的是______.
已知:
(3)操作Ⅲ的程序依次为______、______、过滤、自然干燥.得到CuCl2•xH2O晶体.氢氧化物开始沉淀时的pH 氢氧化物完全沉淀时的pH Cu2+
Fe2+
Fe3+4.7
4.0
1.96.7
9.0
3.2
(4)若制备的氯化铜晶体经检验含有FcCl2,其原因可能是______,试提出两种不同的改进方案:①______;②______. 潇潇雨歇1231年前1
潇潇雨歇1231年前1 -
 YYTT8787 共回答了16个问题
YYTT8787 共回答了16个问题 |采纳率100%解题思路:(1)仪器A是分液漏斗;装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水;D中的氢氧化钠溶液容易被倒吸入大试管中;
(2)除去氯化铜中的氯化铁,根据氢氧化物的沉淀PH进行分析,使氯化铁完全生成氢氧化铁;
(3)溶液2是氯化铜溶液,需要经过蒸发浓缩、冷却结晶,过滤、自然干燥,最后得到CuCl2•xH2O晶体;
(4)与粗铜的反应,氯气不足,制取的氯化铜晶体中会含有氯化亚铁;可以通过足量氯气避免生成氯化亚铁,也可以在在操作Ⅱ加入氧化铜前先加入足量的双氧水或者通入氯气将亚铁氧化成三价铁离子.(1)仪器A是分液漏斗;装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为 MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O;防止D的氢氧化钠溶液发生倒吸,应该在C和D之间连接一个防止倒吸的装置;
故答案为:分液漏斗; 4H++2Cl-
△
.
Mn2++Cl2↑+2H2O; 间连接一个防止倒吸的装置;
(2)若要除去氯化铁,氢氧化铁的开始沉淀PH=1.9,沉淀完全PH=3.2;氢氧化铜开始沉淀的PH=4.7;故PH控制在3.2到4.7之间;
故答案为:3.2≤PH<4.7;使氯化铁转化为氢氧化铁沉淀从而与氯化铜分离(或者除去氯化铜溶液中的氯化铁);
(3)由于氯化铜溶液需要经过蒸发浓缩、冷却结晶,过滤、自然干燥,得到氯化铜晶体;
故答案为:蒸发浓缩、冷却结晶;
(4)制备的氯化铜晶体经检验含有FcCl2,可能是与粗铜反应的氯气不足导致的;改进方法是:;①、通入足量的氯气;②、在操作Ⅱ加入氧化铜前先加入足量的双氧水或者通入氯气;
故答案为:与粗铜反应的氯气不足量;①、通入足量的氯气;②、在操作Ⅱ加入氧化铜前先加入足量的双氧水或者通入氯气.点评:
本题考点: 铜金属及其重要化合物的主要性质;氯气的实验室制法;制备实验方案的设计.
考点点评: 本题考查学生对工艺流程理解、实验装置的理解、物质分离提纯等,难度中等,要求学生具备扎实的基础与综合运用能力.1年前查看全部
- 进行粗铜的电解精炼为什么要将粗铜置于阳极
进行粗铜的电解精炼为什么要将粗铜置于阳极
还有,原电池的负极是不是等同于电解池的阴极? 我是小林林1年前3
我是小林林1年前3 -
 月半月半 共回答了20个问题
月半月半 共回答了20个问题 |采纳率95%一般用电解法精炼铜,粗铜作阳极,硫酸铜等铜盐做电解液.
在阳极上,粗铜和溶液中的SO42-和OH-离子都能放电,但是硫酸根和氢氧根失去电子的能力很弱,而金属铜失去电子的能力比他们强,所以阳极反应为Cu-2e=Cu2+;
在阴极上,溶液中的H+和Cu2+都能得到电子,但是铜离子得到电子的能力比氢离子强,而起浓度也比他大得多,所以阴极反应为Cu2++2e=Cu.
总反应为:Cu(阳极)=Cu(阴极)
如果电解质溶液或者换成水,反应就不会发生;
如果没有溶液,用一根导线把阴极和阳极连接起来,电子流动不是化学反应了.1年前查看全部
- 电解精炼铜①粗铜的溶解与纯铜的生成:阳极(粗铜):Cu -2e- = Cu2+阴极(纯铜):Cu2+ + 2e- = C
电解精炼铜
①粗铜的溶解与纯铜的生成:阳极(粗铜):Cu -2e- = Cu2+
阴极(纯铜):Cu2+ + 2e- = Cu
②比铜活泼的金属:Zn、Fe、Ni只溶解,不析出;
Zn - 2e- = Zn 2+ Ni-2e- = Ni 2+
③比铜不活泼的金属:Au、Pt不溶解,而以单质的形式沉积在电解槽底,形成阳极泥;
我想问的是,②Zn、Fe、Ni是不放电的啊,为什么为失去电子,再者,变成离子后应该会得电子变成单质啊,为什么为什么?③为什么Au、Pt会跑出来,什么原因? 刘bao1年前2
刘bao1年前2 -
 蠢过只猪 共回答了21个问题
蠢过只猪 共回答了21个问题 |采纳率90.5%问题1:Zn、Fe、Ni肯定是放电的啊,越活泼的越先析出的;离子得电子变单质不是初中化学学的吗?
问题2:因为Au、Pt是粗铜中的杂质,因为铜析出,而Au、Pt不发生电极反应,因而出来了啊1年前查看全部
- Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后
Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 __。
(2)检验溶液B中是否存在Fe 3 + 的方法是 __。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO 4 溶液中加入一定量的Na 2 SO 3 和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:实验编号 氨水物质的量浓度/(mol·L -1 ) 盐酸物质的量浓度/(mol·L -1 ) 混合溶液pH ① 0.1 0.1 pH=5 ② c 0.2 pH=7 ③ 0.2 0.1 pH>7
请回答:
(4)从第①组情况分析,该组所得混合溶液中由水电离出的c(H + )= __mol·L -1 ;从第②组情况表明,c __(填“>”“<”或“=”)0.2 mol·L -1 ;从第③组情况分析可知,混合溶液中c(NH 4 + ) __(填“>”“<”或“=”)c(NH 3 ·H 2 O)。
(5)写出以下四组溶液NH 4 + 浓度由大到小的顺序 __> __> __> __(填选项编号)。
A.0.1 mol·L -1 NH 4 Cl
B.0.1 mol·L -1 NH 4 Cl和0.1 mol·L -1 NH 3 ·H 2 O
C.0.1 mol·L -1 NH 3 ·H 2 O
D.0.1 mol·L -1 NH 4 Cl和0.1 mol·L -1 HCl mjt34991年前0
mjt34991年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问
如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲烷燃料电池负极电极反应式是:
(2)石墨电极(C)的电极反应式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_ L;丙装置中阴极析出铜的质量为 g
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH) 2 的实验装置(如图所示)。若用于制漂白液时a为电池_ 极,电解质溶液最好用_ 。若用于制 Fe(OH) 2 ,使用硫酸钠做电解质溶液,阳极选用 作电极。
 过眼vs云烟1年前1
过眼vs云烟1年前1 -
 ttqqTT 共回答了16个问题
ttqqTT 共回答了16个问题 |采纳率93.8%(1)CH 4 -8e - +10OH - =CO 3 2 - +7H 2 O
(2)2Cl - -2e - =Cl 2 ↑
(3)4.48 12.8
(4)负 饱和氯化钠溶液或食盐水 铁
1年前查看全部
大家在问
- 1How do I Love Thee, English? 作文
- 2向明中学英语教的是新世纪还是牛津?
- 3为了比较水和煤油的吸热能力,小王做了如下图所示的实验,在2个相同的烧杯中分别装有质量、初温都相同的水和煤油,用两个相同的
- 4如何实现下列的文献检索内容,1、利用美国《工程索引》(Ei)数据库检索“北京XX大学的作者发表的题名中有“laser”文
- 5How about playing tennis this afternoon?(改为同义句)
- 6大家帮忙出几道有关声音的产生与传播的物理应用题.(要副带算式与答案哦!)要那种有考点的...
- 7有什么含"困"的成语?
- 8You must wash yourself ______ you have meals填什么
- 9用比例解,写关系式
- 10f(x)是一次函数,且f(1)=1,f(f(2))=f(4),求f(x)
- 11听诊器是什么样子的
- 12十三分之三化成百分数是多少
- 13tuo这个拼音里有单韵母吗
- 14长方体棱长之和是48厘米,从一个顶点出发的三条棱长度之和是多少厘米?
- 15树木能阻止水土流失,英语翻译句子