若某非金属元素的最高正化合价为+m,它的最高正价氧化物对应的水化物形成的酸中有b个氧原子
 眼泪哗哗的流2022-10-04 11:39:542条回答
眼泪哗哗的流2022-10-04 11:39:542条回答这种酸的化学式为

已提交,审核后显示!提交回复
共2条回复
 et1910 共回答了16个问题
et1910 共回答了16个问题 |采纳率93.8%- 设非金属元素为R
R的最高正化合价为+m-------- 通常R原子的个数为1,带 m 个正电荷
它的最高正价氧化物对应的水化物形成的酸中有b个氧原子-------b个氧原子共带 -2b 个电荷----------------根据正负化合价之和为 0 ,则有 (2b - m) 个氢原子.
所以,化学式为 H(2b - m)RO - 1年前
 jmh1127 共回答了10个问题
jmh1127 共回答了10个问题 |采纳率- 请把题补充完整
- 1年前
相关推荐
- 关于硝酸的说法正确的是( ) A.Cu可以溶解在稀硝酸中并生成H 2 B.浓HNO 3 不能与非金属单质反应 C.硝酸
关于硝酸的说法正确的是( ) A.Cu可以溶解在稀硝酸中并生成H 2 B.浓HNO 3 不能与非金属单质反应 C.硝酸与金属反应时,主要是+5价的氮元素得电子 D.常温下,向浓HNO 3 中投入Fe片,会产生大量的红棕色气体  mn4011年前1
mn4011年前1 -
 无印血 共回答了21个问题
无印血 共回答了21个问题 |采纳率95.2%解;A、铜和稀硝酸反应生成了硝酸铜和一氧化氮,故A错误;
B、浓硝酸能够和非金属碳反应生成二氧化碳,故B错误;
C、硝酸与金属反应时,主要是+5价的氮元素得电子变成一氧化氮或者二氧化氮,故C正确;
D、常温下,金属铁、铝能够与浓硝酸发生钝化,不会产生大量的红棕色气体,故D错误;
故选C.1年前查看全部
- 非金属氢化物的沸点如何判断
 w-jc1年前1
w-jc1年前1 -
 荔枝迷 共回答了19个问题
荔枝迷 共回答了19个问题 |采纳率84.2%1.同一主族中,表现为从上倒下气态氢化物的稳定性递减x0d2.同一周期中,表现为从左至右气态氢化物的稳定性递增x0d注意这里是没有例外的!x0d是通用性质,x0d所谓HF中含有特殊的氢键,x0d这种只作用于分子间,不作用于原子之间的键能x0d而原子之间的键能越大,气态氢化物的稳定性也就越强.这种分子间作用的氢键,只能影响物质的溶沸点1年前查看全部
- 关于氨气的化学性质请问氨气是单质吗?我觉得氨气应该是单质啊,但是做的练习上选择题要选 非金属单质 我觉得氧气是单质为什么
关于氨气的化学性质
请问氨气是单质吗?
我觉得氨气应该是单质啊,但是做的练习上选择题要选 非金属单质
我觉得氧气是单质为什么氨气不是单质了呢?
注:我这几天才开始学化学这门学科,若出现低级错误请见谅
那这么说氨气是化合物了? 刘小庆1年前4
刘小庆1年前4 -
 hfgx0601 共回答了14个问题
hfgx0601 共回答了14个问题 |采纳率100%单质必须是由同种元素组成的纯净物,混合物不可能是单质.
O2 只有O元素构成.氨气NH3由N和H元素构成.所以不是单质
2,氨气是化合物.1年前查看全部
- 下列说法正确的是( )A.Li是最活泼金属,F是最活泼非金属B.Mg(OH)2碱性比Ca(OH)2强C.X2+的核外电
下列说法正确的是( )
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.X2+的核外电子数目为18,则X在第四周期第ⅡA族
D.H2S的稳定性比HCl强 飘漂在ss1年前1
飘漂在ss1年前1 -
 aaavv 共回答了17个问题
aaavv 共回答了17个问题 |采纳率94.1%解题思路:A.最活泼的金属在元素周期表的左下角,最活泼的非金属元素在周期表的右上角;
B.根据同主族元素的金属性的递变规律分析;
C.X2+的核外电子数目为18,则原子核外应有4个电子层,最外层电子数为2;
D.根据同周期元素的非金属性的递变规律解答.A.元素周期表中,同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素的金属性逐渐增强,非金属性逐渐减弱,则最活泼的金属在元素周期表的左下角,最活泼的非金属元素在周期表的右上角,故A错误;
B.同主族元素从上到下元素的金属性逐渐增强,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则Mg(OH)2碱性比Ca(OH)2弱,故B错误;
C.X2+的核外电子数目为18,则原子核外应有4个电子层,最外层电子数为2,应位于周期表第四周期第ⅡA族,故C正确;
D.同周期元素从左到右元素的非金属性逐渐增强,非金属性越强,对应氢化物的稳定性越强,则H2S的稳定性比HCl弱,故D错误.
故选C.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期律的递变规律,题目难度不大,注意元素的金属性、非金属性与对应单质、化合物的性质之间关系的判断.1年前查看全部
- (2009•宝鸡三模)已知X、Y、Z、W都是短周期的非金属元素,其原子序数依次增大.W原子的质子数是Y原子质子数的两倍,
(2009•宝鸡三模)已知x、y、z、w都是短周期的非金属元素,其原子序数依次增大.w原子的质子数是y原子质子数的两倍,x原子与w原子的最外层电子数之和是y和z原子的质子数之和的[1/3].y的氢化物分子中有三个共价键.
(1)x、z的元素名称分别是______、______,w元素原子结构示意图为______.
(2)y的氢化物分子的空间构型为______,属于______分子(填“极性”或“非极性”)
(3)由以上任意三种元素组成的化合物中,其水溶液显酸性的有(填写化学式)______、______.(任写两种)
(4)写出一个离子反应方程式,要求反应物与生成物的离子或分子均是由以上元素中的两种元素组成且各微粒所含的电子数相同.nh4++oh-
nh3↑+h2o[或nh3+h3o+═nh4++h2o或oh-+h3o+═2h2o]△ .nh4++oh-.
nh3↑+h2o[或nh3+h3o+═nh4++h2o或oh-+h3o+═2h2o]△ .
(5)***材料学家已成功制备了w元素与y元素组成的耐高温的新型材料w3y4.工业上可用w的氢化物与y的氢化物反应制得耐高温化合物和氢气,此反应的化学方程式为3sih4+4nh3
si3n4+12h2高温 .3sih4+4nh3.
si3n4+12h2高温 . 其实我最想开源1年前0
其实我最想开源1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 非金属活动顺序表
 山中翠翠1年前1
山中翠翠1年前1 -
 汪汪414 共回答了12个问题
汪汪414 共回答了12个问题 |采纳率100%非金属活动顺序 非金属是这样:因为非金属一般都是若干原子构成的分子,而分子是非金属常见形态,所以我这里排的是分子顺序表,比较实用:
氟〉氯〉氧〉溴〉氮、硫〉氢〉红磷〉碘、碳、砷、硒、硼、硅
稀有气体 :Xe>Kr>Ar>Ne>He
总之元素周期表里越是左下方,越是右上方越强.惰性气体不算.
金属活动性顺序表的应用
金属活动性顺序是历年来中考命题的热点,题目的难易不同,题型各异.因此对金属活动性顺序表的正确理解和灵活运用十分重要.我们主要从以下几个方面对其进行理解.
1.金属与酸发生反应
(1)金属应是在金属活动性顺序中排在(H)前面的金属.
(2)单质铁与酸发生置换反应时生成亚铁盐.
(3)K、Ca、Na除与酸反应外,还能与水在常温下发生置换反应,其余金属则不能.
2.金属与盐发生置换反应
(1)在金属活动性顺序中只有排在前面的金属才能把排在后面的金属从其盐溶液中置换出来,而与H的位置无关.但K、Ca、Na等金属例外,由于它们过于活泼,与盐溶液不发生置换反应,而是先与溶液中的水发生反应.
(2)铁与盐溶液发生置换反应时,只生成二价亚铁盐.
(3)用同种金属置换不同的盐溶液,盐中金属排在金属活动性顺序中较后的金属首先被置换出来.用不同的金属置换同种盐溶液,盐中金属排在金属活动性顺序中较前的金属先被置换出来.
还有要知道:金属制与溶液发生置换反应,而且(溶液中,前置后,隔越远,置越先)1年前查看全部
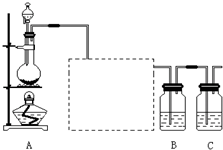
- 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中加入的试剂是______.
(2)画出虚线框内的实验装置图,并注明所加试剂,______说明装置的作用______.
(3)装置B中盛放的试剂是______(选填下列所给试剂的代码),实验现象为______,化学反应方程式是______,该反应属于四种基本反应类型中的______反应.
A.Na 2 S溶液B.Na 2 SO 3 溶液C.Na 2 SO 4 溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因.
______
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例).
______
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气.在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由.
______
______.
 jiangcheng7171年前1
jiangcheng7171年前1 -
 eent123 共回答了21个问题
eent123 共回答了21个问题 |采纳率90.5%(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO 2 .故答案为:浓盐酸;MnO 2 ;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度.所用装置为:
.故答案为:
;除去Cl 2 中的HCl气体;
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na 2 S溶液,发生的是置换反应,化学方程式为:Na 2 S+Cl 2 =2NaCl+S↓.
故答案为:A;有淡黄色沉淀生成;Na 2 S+Cl 2 =2NaCl+S↓;置换;
(4)从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
故答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强;
(5)我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HCl的稳定性比H 2 S的稳定性强或者HClO 4 的酸性比H 2 SO 4 的酸性强.
故答案为:HCl的稳定性比H 2 S的稳定性强或者HClO 4 的酸性比H 2 SO 4 的酸性强.(其他合理答案均可);
(6)判断元素金属性强弱的依据有:最高价氧化物对应水化物的碱性强弱、单质与水或酸反应置换出氢气的剧烈程度、金属之间的置换反应等,而判断元素具有金属的依据与之不同,如(5)所述.因此,Cl元素的化合价既有升高又有降低,不能说明氯元素既具有金属性又具有非金属性.本题答案为:金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.
故答案为:不能;金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.(其他合理答案均可)1年前查看全部
- 分子原子离子的区别如FeO为什么是分子构成的,而NaCl却是由离子构成的,以上两个不都是非金属与金属之间的反应吗
 翼幻神羽1年前2
翼幻神羽1年前2 -
 鹤栖西池 共回答了19个问题
鹤栖西池 共回答了19个问题 |采纳率84.2%FeO和NaCl都是离子化合物,都是由离子构成的,只是FeO不溶于水,不能的水中电离为Fe2+和O2-离子;而氯化钠是溶于水的,可电离出钠离子和氯离子.1年前查看全部
- 下列有关氧化还原反应的叙述正确的是( ) A.金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂 B.化合物
下列有关氧化还原反应的叙述正确的是( ) A.金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂 B.化合物中某元素处于最高价只能被还原 C.失电子越多的还原剂,其还原性越强 D.某元素在反应中由化合物转化为单质,该元素一定被氧化  qinke20051年前1
qinke20051年前1 -
 xyh95002 共回答了10个问题
xyh95002 共回答了10个问题 |采纳率100%A、金属单质在氧化还原反应中只能作还原剂,非金属单质可能作还原剂也可能作氧化剂也可能既作氧化剂又作还原剂,如:Cl 2 +H 2 O=HCl+HClO,氯气既氧化剂又作还原剂,故A错误;
B、处于最高价态的元素只能得电子不能失电子,所以只有氧化性,故B正确;
C、还原剂的还原性与失电子的难易程度有关,与失电子的多少无关,故C错误;
D、某元素在反应中由化合物转化为单质,该元素可能被氧化也可能被还原,如:2Na 2 O 2 +2H 2 O=4NaOH+O 2 ↑中,氧元素的化合价既有升高的也有降低的,所以氧元素既被氧化又被还原,故D错误;
故选B.1年前查看全部
- 下列叙述中,正确的是( )A. 含金属元素的离子不一定都是阳离子B. 在氧化还原反应中,非金属单质一定是氧化剂C. 化
下列叙述中,正确的是( )
A. 含金属元素的离子不一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 化合物变为单质时,化合价变化的元素一定被还原
D. 金属离子被还原一定得到金属单质 tiramisu11241年前5
tiramisu11241年前5 -
 supersever 共回答了24个问题
supersever 共回答了24个问题 |采纳率79.2%解题思路:A.含金属元素的离子也可能为阴离子,如AlO2-等;
B.非金属性单质可作还原剂,如C、H2等;
C.化合物变为单质时,化合价变化的元素可被氧化,也可被还原;
D.金属离子被还原不一定得到单质.A.含金属元素的离子可为简单阳离子或酸根离子,如为酸根离子,则为阴离子,如AlO2-等,故A正确;
B.当非金属单质的元素的化合价为最低价态时,可为还原剂,故B错误;
C.化合物变为单质时,化合价变化的元素可被氧化,也可被还原,如Cu2+→Cu,S2-→S,故C错误;
D.金属离子被还原不一定得到单质,如Fe3+→Fe2+,故D错误.
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应知识,侧重于常见物质的性质的考查,题目难度不大,注意相关基础知识的积累.1年前查看全部
- 三个不同短周期非金属元素的单质X、Y、Z,在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气).请针对以下两种不同
三个不同短周期非金属元素的单质X、Y、Z,在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气).请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是______;
②生成固体C的化学方程式是______;
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是______;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是______;
③将Y与(1)中某单质的水溶液充分反应可生两种强酸,该反应方程式是______. lliiaannggnn1年前5
lliiaannggnn1年前5 -
 ryufeng 共回答了22个问题
ryufeng 共回答了22个问题 |采纳率95.5%解题思路:(1)若常温下X、Y、Z均为气体,A和B化合生成固体C时有白烟产生,应是氯化氢与氨气反应生成氯化铵,则C为NH4Cl,A、B分别为HCl、NH3中的一种,结合转化关系可知Y为H2;
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,结合转化关系可推知,Y为S、X为H2、A为H2S、B为SO2.(1)若常温下X、Y、Z均为气体,A和B化合生成固体C时有白烟产生,应是氯化氢与氨气反应生成氯化铵,则C为NH4Cl,A、B分别为HCl、NH3中的一种,结合转化关系可知Y为H2,则:
①由上述分析可知,Y的化学式是H2,故答案为:H2;
②生成固体C的化学方程式是:NH3+HCl=NH4Cl,故答案为:NH3+HCl=NH4Cl;
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,结合转化关系可推知,Y为S、X为H2、A为H2S、B为SO2,则:
①由上述分析可知,B的化学式是SO2,故答案为:SO2;
②向苛性钠溶液中通入过量的H2S,所发生反应的离子方程式是:H2S+OH-=HS-+H2O,故答案为:H2S+OH-=HS-+H2O;
③将S与(1)中某单质的水溶液充分反应可生两种强酸,应是硫与氯水反应生成硫酸与HCl,该反应方程式是:S+3Cl2+4H2O=H2SO4+6HCl,故答案为:S+3Cl2+4H2O=H2SO4+6HCl.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物推断,属于猜测验证型题目,需要学生熟练掌握元素化合物知识,难度中等.1年前查看全部
- (2014•青岛二模)碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用.
(2014•青岛二模)碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用.
(1)用于发射“天宫一号”的长征二号F火箭的燃料是液态偏二甲肼(CH3-NH-NH-CH3),氧化剂是液态四氧化二氮.二者在反应过程中放出大量能量,同时生成无毒、无污染的气体.已知室温下,1g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式______.
(2)298K时,在2L的密闭容器中,发生可逆反应:2NO2(g)⇌N2O4(g)△H=-a kJ•mol-1(a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题.
①298k时,该反应的平衡常数为______ L•mol-1.
②下列事实能判断该反应处于平衡状态的是______.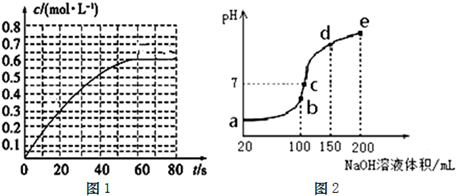
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c.V(N2O4)正=2V(NO2)逆
③若反应在398K进行,某时刻测得n(NO2)=0.6mol,n(N2O4)=1.2mol,则此时V(正)______V(逆)(填“>”“<”或“=”).
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2.试分析图2中a、b、c、d、e五个点,
①水的电离程度最大的是______;
②其溶液中c(OH-)的数值最接近NH3•H2O的电离常数K数值的是______;
③在c点,溶液中各离子浓度由大到小的排列顺序是______. nuoqi1年前1
nuoqi1年前1 -
 我是河南人2006 共回答了12个问题
我是河南人2006 共回答了12个问题 |采纳率100%解题思路:(1)先求出偏二甲肼的物质的量,再根据物质的量之比等于热量比求出反应热,然后写出热化学方程式;
(2)①有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,带入平衡常数表达式计算;
②a、气体的质量不变,容积恒定,因此气体的密度为一定值;
b、混合气体的颜色不变说明NO2的浓度保持恒定;
c、当2V(N2O4)正=V(NO2)逆时,正、逆反应速率相等;
③反应为放热反应,升高温度,K值减小,计算可知此时的浓度商Q=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
(3)①a、b、c、d、e五个点,根据反应量的关系,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;c、d、e三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.
②溶液中铵根离子浓度与一水合氨浓度最接近时,溶液中c(OH-)的数值最接近NH3•H2O的电离常数K数值;
③c点溶液呈中性,则溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分.(1)1g燃料完全燃烧释放出的能量为42.5kJ,则1mol偏二甲肼完全燃烧释放出的能量为42.5kJ×60=2550kJ,其热化学方程式为:C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ/mol;
故答案为:C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ/mol;
(2)①有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,
则K=
c(N2O4)
c2(NO2)=[0.6mol/L
(0.3mol/L)2=6.67L/mol,
故答案为:6.67;
②a、反应物和生成物全是气态物质,气体的质量不变,容积为2L保持恒定,由ρ=
m/V]可知气体的密度为一定值,因此气体的密度保持不变不一定处于平衡状态,故a错误;
b、混合气体的颜色不变说明NO2的浓度不变,说明反应处于化学平衡状态,故b正确;
c、当2V(N2O4)正=V(NO2)逆时,正、逆反应速率相等,说明反应处于化学平衡状态,故c错误;
故答案为:b;
③反应为放热反应,升高温度,K值减小,密闭容器的体积为2L,因此的N2O4的浓度为0.6mol/L,N2O4的浓度为0.3mol/L,浓度商Q=
c(N2O4)
c2(NO2)=
0.6mol/L
(0.3mol/L)2=6.67L/mol=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
故答案为:<;
(3)①a、b、c、d、e五个点,根据反应量的关系,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;c、d、e三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离,因此水的电离程度最大的是b点,溶液中c(OH-)的数值最接近NH3•H2O的电离常数K数值,
故答案为:b;
②氨水为弱碱,溶液呈碱性,c点溶液呈中性,铵根离子浓度过大,e点溶液碱性过强,一水合氨浓度过大,相对而言d点溶液中铵根离子浓度与一水合氨浓度最接近,溶液中c(OH-)的数值最接近NH3•H2O的电离常数K数值,
故答案为:d;
③c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,b点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).点评:
本题考点: 热化学方程式;用化学平衡常数进行计算;化学平衡状态的判断;物质的量或浓度随时间的变化曲线;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查知识点全面,涉及热化学方程式的书写、平衡常数的计算、平衡的移动、离子浓度大小比较、盐类水解等知识点,离子浓度大小比较常与盐类水解、弱电解质的电离联合考查,确定离子浓度大小时要结合电荷守恒、物料守恒来分析解答.1年前查看全部
- 为何氟是与水反应最剧烈的非金属单质?
为何氟是与水反应最剧烈的非金属单质?
刚开始学元素周期律,有些不太明白:
1.同主族元素从上到下单质与水或酸反应越来越剧烈(如铯与水反应比铷剧烈),但为何氟与水反应比同主族的氯和溴等都要剧烈?
2.请问单质与水反应的剧烈与否取决于什么?氧化性or还原性? 爬树的鱼1年前5
爬树的鱼1年前5 -
 我气愤 共回答了16个问题
我气愤 共回答了16个问题 |采纳率93.8%第一:
同主族元素从上到下单质与水或酸反应越来越剧烈,这个金属元素主族适用.
而氟与水反应剧烈是因为氟的氧化性比氧的强(F在O后面),可以直接把O置换出来.还有氟的结构,它是只有2层电子层的,因为要达到8电子的稳定结构就必须要获得一个电子(或者共用一对电子对),因为它不可能失去7个电子达到2电子的稳定结构~,且氟的原子序数大于氧,吸引电子的能力比氧的强,就置换出氧了~
而氯和溴都是在第三、第四周期的.在氧的后面,所以不剧烈.
第二:金属单质与水反应的剧烈程度主要看还原性,还原行越强,跟水反应的时候就越剧烈.
而非金属单质与水反应一般都不剧烈.当然氟除外(这个太特殊了,当年我特地问老师,才告诉我原因的~)1年前查看全部
- 金属与非金属元素物理性质的比较包括 :状态 密度 光泽 导电性导热性 延展性
 k_lonely1年前1
k_lonely1年前1 -
 帅哥qww 共回答了24个问题
帅哥qww 共回答了24个问题 |采纳率91.7%一般说来金属单质具有金属光泽,大多数金属为银白色;非金属单质一般不具有金属光泽,颜色也是多种多样.
金属除汞在常温时为液态外,其他金属单质常温时都呈固态;非金属单质在常温时多为气态,也有的呈液态或固态.
一般说来,金属的密度较大,熔点较高;而非金属的密度较小,熔点较低.
金属大都具有延展性,能够传热、导电;而非金属没有延展性,不能够传热、导电1年前查看全部
- 铁与氧化性不同的非金属反应可生成不同价态的铁的化合物,如铁与氯气反应生成______(填化学式),铁与硫反应生成____
铁与氧化性不同的非金属反应可生成不同价态的铁的化合物,如铁与氯气反应生成______(填化学式),铁与硫反应生成______(填化学式).  ms00p1年前1
ms00p1年前1 -
 胖妞妞的姐妹淘 共回答了25个问题
胖妞妞的姐妹淘 共回答了25个问题 |采纳率96%因氯气具有强氧化性,生成高价态金属氯化物,而S具有弱氧化性,生成低价态金属硫化物,
则Fe与氯气反应生成FeCl 3 ,Fe与S反应生成FeS,
故答案为:FeCl 3 ;FeS.1年前查看全部
- 为什么非金属原子结合相同数量的电子行成稳定结构,放出能量多的,元素非金属性强
 红绳绿幽灵1年前1
红绳绿幽灵1年前1 -
 langren7hao 共回答了21个问题
langren7hao 共回答了21个问题 |采纳率66.7%因为非金属外层电子书较多(一般都多余最外层电子可能数量的一半).因此核力比较强,容易吸引多余的电子,达到最外层电子饱和的相对稳定状态.宇宙中所有的物质都有能量最低原理,当非金属捕获外层电子时,放出能量,导致自身能量状态降低,达到相对跟稳定的状态.放出能量多的元素,其捕获电子的能力也强,因此其非金属性也强1年前查看全部
- 金属、非金属、碱性氧化物、酸性氧化物、酸、碱和盐分别可能与哪些类别的物质发生反应?
 yoyo-wei1年前1
yoyo-wei1年前1 -
 蔡雄 共回答了12个问题
蔡雄 共回答了12个问题 |采纳率100%金属:酸、盐、非金属
非金属:金属、非金属、盐等
碱性氧化物:酸性氧化物、酸、水
酸性氧化物:碱、碱性氧化物、水
酸:碱、盐、碱性氧化物
碱:酸、盐、酸性氧化物盐:金属(非金属)、盐、酸、碱1年前查看全部
- 金属与非金属组成的具有金属特性的物质是合金吗?请举例。
 单翼天使-1年前2
单翼天使-1年前2 -
 新hh 共回答了77个问题
新hh 共回答了77个问题 |采纳率15.6%是1年前查看全部
- 下列关于合金的叙述,正确的是() A.非金属和金属之间也可以形成合金 B.合金的硬度可以比原金属更高,化
下列关于合金的叙述,正确的是() A.非金属和金属之间也可以形成合金 B.合金的硬度可以比原金属更高,化
下列关于合金的叙述,正确的是()
A.非金属和金属之间也可以形成合金
B.合金的硬度可以比原金属更高,化学性质也可能和原成分
C.合金的熔沸点一般比组成他们的各成分金属要高
D.合金的用途比纯金属的用途更广
下列关于合金的叙述,正确的是()
A.非金属和金属之间也可以形成合金
B.合金的硬度可以比原金属更高,化学性质也可能和原成分金属不同
C.合金的熔沸点一般比组成他们的各成分金属要高
D.合金的用途比纯金属的用途更广
本题为多选题 xx江1年前4
xx江1年前4 -
 aiyefh899 共回答了21个问题
aiyefh899 共回答了21个问题 |采纳率95.2%A对,比如说钢
D也对,因为合金在工业上的用途 比纯金属更广、更重要
B应该对,这个没找到解释1年前查看全部
- 下列物质,在一定条件下能与某些酸、碱、金属、非金属反应的是( )
下列物质,在一定条件下能与某些酸、碱、金属、非金属反应的是( )
A. Al2O3
B. H2SO3
C. Na2S
D. NaHCO3 唐蹈海1年前1
唐蹈海1年前1 -
 静静790904 共回答了17个问题
静静790904 共回答了17个问题 |采纳率82.4%解题思路:根据物质的性质判断,Al2O3是两性氧化物,NaHCO3属于酸式盐,H2SO3和Na2S是具有还原性的物质可以被强氧化剂氧化,联系高中阶段所学知识用排除法解答.A.Al2O3能够与强酸、强碱反应,由于Al2O3的熔点较高,与非金属难以反应,故A不选;
B.H2SO3可被强氧化性的酸氧化(如硝酸)、可与碱发生中和反应、与活泼金属反应放出氢气、可被氯气或氧气等非金属氧化,故B选;
C.Na2S可被强氧化性的酸氧化(如硝酸)、与酸反应生成H2S,可被氯气或氧气等非金属氧化,但不与碱反应、金属反应,故C不选;
D.NaHCO3可与强酸反应放出CO2、与碱发生中和反应,与金属、非金属不反应,故D不选.
故选B.点评:
本题考点: 含硫物质的性质及综合应用;镁、铝的重要化合物.
考点点评: 本题题主要考查某些化合物的性质,题目难度不大,学习中需要熟练掌握典型化合物的性质.1年前查看全部
- 钛(Ti)因为具有神奇的性能越来越引起人们的关注,常温下钛不和非金属、强酸反应,红热时却能与常见的非金属单质反应.钛是航
钛(Ti)因为具有神奇的性能越来越引起人们的关注,常温下钛不和非金属、强酸反应,红热时却能与常见的非金属单质反应.钛是航空、军工、电力等方面的必需原料.目前大规模生产钛的方法是:
第一步,金红石(主要成分TiO2)、炭粉混合在高温条件下通入氯气制得TiCl4和一种可燃性气体.该反应的化学方程式______.该反应的还原剂是______.
第二步,在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛.该反应的化学方程式为______. timyao1年前1
timyao1年前1 -
 ddnangelwings 共回答了20个问题
ddnangelwings 共回答了20个问题 |采纳率90%解题思路:第一步:金红石(主要成分TiO2)、炭粉混合在高温条件下通入氯气制得TiCl4和一种可燃性气体,写出反应的化学方程式即可.
第一步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛,写出反应的化学方程式即可.第一步:在高温时,将金红石(TiO2)、炭粉混合并通入氯气制得TiCl4和一种可燃气体(由质量守恒定律,反应前后元素种类不变,该气体是一氧化碳),反应的化学方程式为:TiO2+2C+2Cl2
高温
.
TiCl4+2CO;C夺取了二氧化钛中的氧,该反应的还原剂是C.
第二步:在氩气的环境中,用过量的镁在加热条件下与TiCl4反应制得金属钛,反应的化学方程式为:2Mg+TiCl4
高温
.
2MgCl2+Ti.
故答案为:TiO2+2C+2Cl2
高温
.
TiCl4+2CO;C;2Mg+TiCl4
高温
.
2MgCl2+Ti.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 常见氧化剂和还原剂1常见氧化剂:(1)活泼的非金属单质(2)含高价元素的含氧酸(3)含高价元素的盐(4)含高价元素的氧化
常见氧化剂和还原剂
1常见氧化剂:(1)活泼的非金属单质(2)含高价元素的含氧酸(3)含高价元素的盐(4)含高价元素的氧化物(5)过氧化物;2常见的还原剂(1)活泼的金属单质(2)某些非金属单质(3)元素处于低价态物质…各举三例哈,谢谢大家~
 黑玫瑰01年前1
黑玫瑰01年前1 -
 dy787mbf 共回答了18个问题
dy787mbf 共回答了18个问题 |采纳率72.2%1.)Br2、F2、Cl2; 2.)HClO、HCLO、浓硝酸 3.)KMnO4、NH4NO3、KNO3
4.)MnO2、SO3
5)H2O2、金属过氧化物
1)K、Na、Li
2)c、Si、H2
3)so2、co、No
我是学化学的,应该都对吧,嘻1年前查看全部
- (1)某元素的原子结构示意图如图,则该元素原子核内有______质子,它属于______(填“金属或非金属”),原子核外
 (1)某元素的原子结构示意图如图,则该元素原子核内有______质子,它属于______(填“金属或非金属”),原子核外有______个电子层,在化学反应中易______(填“得”、“失”电子,形成______
(1)某元素的原子结构示意图如图,则该元素原子核内有______质子,它属于______(填“金属或非金属”),原子核外有______个电子层,在化学反应中易______(填“得”、“失”电子,形成______
(2)用化学用语填空:
①两个氧分子______ ②一个铝离子______ ③3个碳酸根离子______
④水中氧元素显-2价H2−2 O H2⑤三氧化二铁______.−2 O  xiaoxiao75751年前1
xiaoxiao75751年前1 -
 liweiguang111 共回答了23个问题
liweiguang111 共回答了23个问题 |采纳率87%解题思路:原子结构示意图的表示法:小圆圈和圈内的数字表示原子核和核内质子数;弧线表示电子层,弧线上的数字该电子层上的电子数;离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;化合物化学式的书写步骤:归类→定序→标价→交叉→约简,据此进行解答.(1)由元素的原子结构示意图可知,则该元素原子核内有11质子,属于钠元素,元素的名称中带有金字旁,它属于金属,原子核外有3个电子层,最外层有1个电子,小于4,在化学反应中易失电子,形成钠离子,符号为:Na+.
(2)①两个氧分子,在氧气的化学式的前边加计量数2,符号为:2O2;
②由离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.可知,一个铝离子符号为:Al3+;
③3个碳酸根离子的符号为:3CO32-;
④水中氧元素显-2价,在水的化学式中氧的元素符号的正上放标出“-2”,符号为:H2
−2
O;
⑤三氧化二铁中.氧-2价,铁为+3价,化学式是:Fe2O3.
故答为:(1)11,金属,3,失,Na+;(2)(5分)①2O2,②Al3+,③3CO32-;④H2
−2
O;⑤Fe2O3;点评:
本题考点: 原子结构示意图与离子结构示意图;化学符号及其周围数字的意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础.1年前查看全部
- 只有非金属原子才能构成共价键吗举个例子 什么叫极性非极性共价键和配位键
 idmeid1年前1
idmeid1年前1 -
 zhkun1 共回答了23个问题
zhkun1 共回答了23个问题 |采纳率87%氯化铝是特例,金属化合物形成的共价.极性非极性是按分子结构是否对称来划分,对称是非极性,不对称是极性.要想在这点上高分或全分,就要熟悉基本的化合物的分子结构是否对称.1年前查看全部
- 某非金属元素R与氧可形成RO和RO2两种氧化物.实验测定,在RO中R的质量分数为42.9%,通过计算确定RO2的化学方程
某非金属元素R与氧可形成RO和RO2两种氧化物.实验测定,在RO中R的质量分数为42.9%,通过计算确定RO2的化学方程式!1
急用! 答案等于选择1年前1
答案等于选择1年前1 -
 斜插梅花醉洛阳 共回答了15个问题
斜插梅花醉洛阳 共回答了15个问题 |采纳率100%R是碳元素
RO中R是42.9%,那么O是57.1%
所以R的式量除以O的式量=42.9:57.1
而O的式量是16,所以R的式量是14,就是碳啦~
所以是二氧化碳~1年前查看全部
- 元素周期表中,非金属元素间的反应规律
 Tripod-1年前1
Tripod-1年前1 -
 topline 共回答了13个问题
topline 共回答了13个问题 |采纳率69.2%主要根据氧化还原性来反应的
同族之间,从上到下,氧化性减弱,还原性增强1年前查看全部
- 下列说法正确的是 A.Li是最活泼金属,F是最活泼非金属 B.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族
下列说法正确的是
A.Li是最活泼金属,F是最活泼非金属 B.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 C.X 2+ 的核外电子数目为18,则X在第四周期第ⅡA族 D.Mg(OH) 2 碱性比Ca(OH) 2 强  曹小月1年前1
曹小月1年前1 -
 wallimn 共回答了23个问题
wallimn 共回答了23个问题 |采纳率91.3%C
1年前查看全部
- 地壳中含量最多的非金属元素与碳元素组成的化合物是
 依然08281年前2
依然08281年前2 -
 汪仔的女友 共回答了14个问题
汪仔的女友 共回答了14个问题 |采纳率78.6%CO,CO21年前查看全部
- 若非金属元素R的原子最外层电子数为N.则R的最高正化合价为______.最低负化合价为_____
 a188811年前1
a188811年前1 -
 常在雨中想着晴 共回答了16个问题
常在雨中想着晴 共回答了16个问题 |采纳率87.5%最高正化合价为+N;最低负化合价为-(8-N).O、F及稀有气体除外1年前查看全部
- 一种非金属单质x能把另一种非金属单质y从什么种置换出来,说明非金属性越强
 0o莫莫o01年前2
0o莫莫o01年前2 -
 81711651 共回答了14个问题
81711651 共回答了14个问题 |采纳率100%2F2+2H2O=4HF+O2 氟强于氧
Cl2+2KBr=2KCl+Br2 氯强于溴
Cl2+H2S=S+2HCl 氯强于硫
从盐溶液或酸都可以.1年前查看全部
- 金属元素与非金属元素能形成共价化合物?
 lhl小丽1年前1
lhl小丽1年前1 -
 800业务 共回答了13个问题
800业务 共回答了13个问题 |采纳率76.9%AlCl3,AlBr3,AlI3,FeCl3,FeBr3,CuCl2,HgCl2,Hg2Cl2,醋酸铅等都是1年前查看全部
- 物质A~F都是初中化学中的常见物质,它们有如图所示的转化关系。回答下列问题: (1)若A为固体非金属单质,E为红色固体单
物质A~F都是初中化学中的常见物质,它们有如图所示的转化关系。回答下列问题: 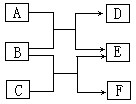
(1)若A为固体非金属单质,E为红色固体单质,则B、D的化学式为:B___________、D____________,写出下列反应化学方程式:A+B:____________________。
(2)若E为一种盐,则A、C的化学式可能是__________、_________;写出下列反应化学方程式:B+C:_______________________。 queyouciren1年前1
queyouciren1年前1 -
 ddw911 共回答了16个问题
ddw911 共回答了16个问题 |采纳率81.3%1年前查看全部
- 金属和非金属及其化合物方程式
 bearken01年前4
bearken01年前4 -
 supapa 共回答了18个问题
supapa 共回答了18个问题 |采纳率94.4%4P+5O2点燃===2P2O5
S+O2点燃===SO2
C+O2点燃===CO2
3Fe+2O2点燃===Fe2O3
2Mg+O2点燃===2MgO
4Al+3O2点燃===2Al2O3
2H2+O2点燃===2H2O
CaO+H2O===Ca(OH)2
CO2+H2O===H2CO3
2C+O2点燃===2CO2
2CO+O2点燃===2CO21年前查看全部
- 非金属单质是液体是什么物质
 bc071年前4
bc071年前4 -
 Lycias 共回答了22个问题
Lycias 共回答了22个问题 |采纳率90.9%溴吧1年前查看全部
- 常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为
常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为198 g·mol -1 ,且其中各元素的质量比为:钾:金属B:氧=39:28:32。
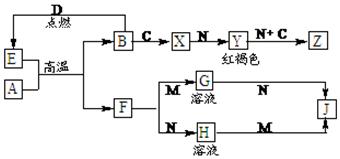
请回答下列问题:
(1)C的化学式为 ,Z的化学式为 。
(2)写出检验X中阳离子的方法 。
(3)写出E和A在高温下反应的化学方程式为 。
(4)写出A和N反应的离子方程式 。 yinxiangsc1年前1
yinxiangsc1年前1 -
 gjl6866 共回答了15个问题
gjl6866 共回答了15个问题 |采纳率100%1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(3)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10% H 2 O 2 和3.0mol•L -1 H 2 SO 4 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率(×10 -3 mol•L -1 •min -1 ) 7.34 8.01 9.25 7.98 7.24 6.73 5.76
(5)在提纯后的CuSO 4 溶液中加入一定量的Na 2 SO 3 和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______. 天行罪星1年前1
天行罪星1年前1 -
 妫子 共回答了21个问题
妫子 共回答了21个问题 |采纳率90.5%(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应,其离子方程式为:Cu+2Fe 3+ =Cu 2+ +2Fe 2+ ,故答案为:Cu+2Fe 3+ =Cu 2+ +2Fe 2+ ;
(2)露天焚烧会产生污染环境的气体,直接填埋时会引起水体和土壤的污染,故选:BD;
(3)金属铜在酸性环境下和双氧水的反应为:Cu+H 2 O 2 +2H + =Cu 2+ +2H 2 O,故答案为:Cu+H 2 O 2 +2H + =Cu 2+ +2H 2 O;
(4)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,故答案为:H 2 O 2 分解速率加快;
(5)根据题干信息,可知发生的反应为2Cu 2+ +SO 3 2- +2Cl - H 2 O
△
.
2CuCl↓+SO 4 2- +2H + ,故答案为:2Cu 2+ +SO 3 2- +2Cl - +H 2 O
△
.
2CuCl↓+SO 4 2- +2H + .1年前查看全部
- 简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性?
简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性?
什么是简单非金属阴离子?S2-是吗那他不既有还原型又有氧化性吗但答案这个选项又是对的 hazaline1年前2
hazaline1年前2 -
 男炎之隐 共回答了23个问题
男炎之隐 共回答了23个问题 |采纳率91.3%S2-化合价为-2已经最低了,所以没有氧化性,只有还原性1年前查看全部
- 下列有关化学键与晶体结构说法正确的是( ) A.非金属元素组成的化合物一定是共价化合物 B.对于组成结构相似的分子晶体
下列有关化学键与晶体结构说法正确的是( ) A.非金属元素组成的化合物一定是共价化合物 B.对于组成结构相似的分子晶体,相对分子质量越大,熔沸点一定越高 C.两种元素组成的分子一定只有极性键 D.含阴离子的化合物一定有阳离子  望之水玉1年前1
望之水玉1年前1 -
 zhaohappy2008 共回答了18个问题
zhaohappy2008 共回答了18个问题 |采纳率88.9%A、NH 4 Cl全部是由非金属元素组成的,但氯化铵是离子化合物,故A错误;
B、如卤族元素的氢化物中,氯、溴、碘的氢化物随着相对分子质量的增其熔沸点逐渐增大,但氟化氢中含有氢键导致其熔沸点较大,故B错误;
C、烃是由两种元素组成的化合物,不仅含有极性键还含有非极性键,故C错误;
D、离子化合物中阴阳离子所带电荷相等,所以含有阳离子的化合物一定含有阴离子,故D正确;
故选D.1年前查看全部
- 液氧是什么颜色?什么类别?是氧化物,酸,碱,盐,金属,还是非金属?两个问题都要回答
 missroad20041年前1
missroad20041年前1 -
 musk2005 共回答了14个问题
musk2005 共回答了14个问题 |采纳率100%淡蓝色,是非金属单质1年前查看全部
- 由金属元素和非金属元素组成的化合物一定是离子化合物吗
 云中鹤81061年前1
云中鹤81061年前1 -
 清and清 共回答了14个问题
清and清 共回答了14个问题 |采纳率100%周期表中金属与非金属交界处的金属常可与氯等非金属形成共价化合物,如:AlCl3、SnCl4、SbCl5、SnH4、SbH3、BiH3等.格氏试剂(RMgX,X为卤素)中的Mg—C键主要也是共价键.二烃基镁等全烃基有机金属化合物(IA族有机金属化合物除外)是共价化合物.1年前查看全部
- XY两种元素是同周期的非金属元素
XY两种元素是同周期的非金属元素

答案选了C 为什么不把D也选了呢
在周期表中应该是 X在Y的左边呀 非金属性Y比X强的话为什么D不选呢 u5hv31年前3
u5hv31年前3 -
 lijunqiao 共回答了17个问题
lijunqiao 共回答了17个问题 |采纳率88.2%非金属性也就是氧化性Y比X强,是指的单质,但是D选项说的是阴离子,所以离子只有还原性,跟氧化性正好相对,所以阴离子的还原性X比Y强1年前查看全部
- 金属 + 非金属(除氧外)---- 盐 化学式 越多越好
 2437891年前2
2437891年前2 -
 洛阳小伙 共回答了24个问题
洛阳小伙 共回答了24个问题 |采纳率79.2%2Na + F2
2Na + Cl2
2Na + Br2
2Na + I2
2Na + S
换一种金属还可以写1年前查看全部
- 用下面的提示写化学方程式1 金属+非金属→________2 酸+碱→___+___3 金属+____→金属氧化物4 金
用下面的提示写化学方程式
1 金属+非金属→________
2 酸+碱→___+___
3 金属+____→金属氧化物
4 金属氧化物+___→碱
5 非金属+____→非金属氧化物
6 非金属氧化物+___→酸
7 酸+金属氧化物→___+___
8 碱+非金属氧化物→___+____
9 碱+盐→____+____ 偶然_妖精1年前1
偶然_妖精1年前1 -
 zhuanghong536 共回答了20个问题
zhuanghong536 共回答了20个问题 |采纳率100%1.盐:2Na + Cl2 ===2NaCl
2.盐,水:HCl + NaOH === NaCl + H2)
3.氧气:2Ca + O2 === 2CaO
4.水:CaO + H2O === Ca(OH)2
5.氧气:C + O2 == CO2
6.水:SO3 + H2O === H2SO4
7.盐,水:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
8.盐,水:CO2 + 2NaOH === Na2CO3 + H2O
9.碱,盐:Ba(OH)2 + Na2SO4 === BaSO4(s) + 2NaOH1年前查看全部
- 臭氧的化学价和物质类别?物质类别的选项:金属,非金属,稀有气体,金属氧化物,非金属氧化物,酸,碱,盐
 宜宾夏阳1年前6
宜宾夏阳1年前6 -
 夜微凉 共回答了19个问题
夜微凉 共回答了19个问题 |采纳率89.5%臭氧 O3 化学价为0,非金属,
这位同学要加强化学学习啊,别老是上网了额1年前查看全部
- 现有化合物A和三种单质B、C、D,通常状况下,A、D是无色气体,B是红色非金属,C是黑色粉末,现在进行下列实验:1 在D
现有化合物A和三种单质B、C、D,通常状况下,A、D是无色气体,B是红色非金属,C是黑色粉末,现在进行下列实验:1 在D中点燃B,生成一中白色的固体物质;2 在高温下炙热的C与A反应,生成一中无色气体;3 C在D中燃烧时在一定条件下可得到一种和2 的生成物相同的无色气体.
根据以上实验,推断这四种物质(用化学式回答):
A__________B____________C___________D___________. 金陵童话1年前1
金陵童话1年前1 -
 aa一世 共回答了8个问题
aa一世 共回答了8个问题 |采纳率62.5%A______CO2____B______P______C______C_____D_______O2____.1年前查看全部
- 对于非金属单质比如:磷单质.5P可以说是五个磷分子吗?
对于非金属单质比如:磷单质.5P可以说是五个磷分子吗?
为什么非金属单质也可以用原子描述? 京华小西1年前1
京华小西1年前1 -
 木子美和 共回答了21个问题
木子美和 共回答了21个问题 |采纳率90.5%不可以.
很多非金属在单质时有多种结构的物质.如氧元素的单质,有氧气O2、臭氧O3,它们的分子有固定的原子构成.对常温下为固体的单质,有类似的情况,如P元素的单质,有红磷,结构比较复杂,白磷:分子结构为P4,如S元素的单质:有S2、S4、S8等,在初高中学习阶段,一般对常温常压下常见元素的气体单质介绍较多,但对固体单质,一般不过多研究其结构,因为内容超出了我们学习的内容.所以通常仅用元素符号表示这种物质.据此,你说的5P,可以表示5个磷原子,但 绝对不是磷元素形成的分子.1年前查看全部
- 历社连线题1.黑色金属矿 2.有色金属矿3.非金属矿 A.煤,石油 B.铁,锰 D.金银 C.铜,铝 E.磷灰石 F.铅
历社连线题
1.黑色金属矿
2.有色金属矿
3.非金属矿
A.煤,石油
B.铁,锰 D.金银
C.铜,铝
E.磷灰石
F.铅,锌 louleying1年前1
louleying1年前1 -
 ouyan0516 共回答了18个问题
ouyan0516 共回答了18个问题 |采纳率88.9%1.黑色金属矿 ——B
2.有色金属矿 ——C、D、F
3.非金属矿 ——A、E
刚学的.
还有什么不明白的地方再问我.1年前查看全部
- 怎么区分化学元素 金属 非金属 稀有气体 能不能从核外电子数目上区分
 八戒和玉兔1年前1
八戒和玉兔1年前1 -
 dreamanniu 共回答了21个问题
dreamanniu 共回答了21个问题 |采纳率95.2%初中
看最外层电子数
金属元素的原子 一般少于4个
非金属元素的原子 一般等于或多余4个
稀有气体的原子 8个(氦为2个)1年前查看全部
- 物理问题第三周期的非金属原子最高配位数能达到7个,而硅只有4个(键角比其他非金属的大),能不能用压力使硅原子间的键角减小
物理问题
第三周期的非金属原子最高配位数能达到7个,而硅只有4个(键角比其他非金属的大),
能不能用压力使硅原子间的键角减小?如果能,需要的压力大吗?
谢谢 虫子飞吧1年前1
虫子飞吧1年前1 -
 灰灰猫儿 共回答了12个问题
灰灰猫儿 共回答了12个问题 |采纳率75%这种事情从理论上来讲当然可以了,如果你有能耐控制一个分子的话,我想压力不大.1年前查看全部
大家在问
- 1复数到底该写作z=a+bi还是z=a+ib
- 2《青藏公路上的等待》
- 3初一苏教版语文第八课《行道树》原文
- 4跪求一篇关于友谊的英语小短文!用来演讲,差不多2分钟,
- 5根据所提供的词语写一段话.(不少于30个字)献出、行动、改变.
- 6氢气还原氧化铜实验步骤1.停止用酒精灯加热 2.将CuO粉末平铺在试管底 3.把试管固定在铁架台上 4.用酒精灯加热 5
- 7汉译英.坐在沙发里
- 8我的理想 作文
- 9蔫的近义词(形容一种心情)
- 101 Mbps等于多少k/s?
- 11求英语高手 翻译给高分,着急.No fight can end, and no friendship can move
- 12《明日歌》阅读诗歌完成练习.⒈下列诗句中加点的词意思分析有错的一项是( )
- 13自然界中许多生物彼此之间都存在着或多或少的亲缘关系.在下列分类单位中,物种间亲缘关系最近的是( ) A.门 B.科 C
- 14请学霸解答••••小的有礼了!!!
- 15简单数学题,有点想不通.4/a>-1/2 -1/a


