1.1mol共轭二烯烃与1mol氢气加成,能发生1,
 邱小熊2022-10-04 11:39:545条回答
邱小熊2022-10-04 11:39:545条回答
1.1mol共轭二烯烃与1mol氢气加成,能发生1,
2.一氯三甲基硅烷(SiClMe3)有什么性质和作用?它与邻苯二乙醚怎么反应?
2.一氯三甲基硅烷(SiClMe3)有什么性质和作用?它与邻苯二乙醚怎么反应?

已提交,审核后显示!提交回复
共5条回复
 dai0809 共回答了18个问题
dai0809 共回答了18个问题 |采纳率83.3%- 1、不能.共轭二烯烃是发生1,4亲电加成.
2、一氯三甲基硅烷与叔丁基氯类似,只不过把中间的碳原子换成Si.
因此 一氯三甲基硅烷 较容易发生水解,C-Si ,Cl-Si 键容易断裂.
邻苯二乙醚其实就是双酚的衍生物,活性比一般的醚高.
可能生成邻位的Me3SiOphOSiMe3 - 1年前
 Google测试员161 共回答了2个问题
Google测试员161 共回答了2个问题 |采纳率- 1.能。发生反应后得到C-C=C-C结构
2.不知道 - 1年前
 和lp 共回答了34个问题
和lp 共回答了34个问题 |采纳率- 共轭加成与温度有关,能发生1,4加成
- 1年前
 断桥残雪Athena 共回答了19个问题
断桥残雪Athena 共回答了19个问题 |采纳率73.7%- 1,可以
- 1年前
 只有坚强 共回答了13个问题
只有坚强 共回答了13个问题 |采纳率- 1、可以,低温下以1,2加成为主,较高温度1,4加成为主,但所得到的都是两种加成都有的混合产物。
2、一般做保护基用。通常叫做“三甲基氯硅烷”。与醚类一般不反应吧 - 1年前
相关推荐
- 两道化学关于物质的量的习题~1.1mol的甲烷CH4在1.8mol的氧气中燃烧,恰好完全反应.燃烧后的产物中既有CO2也
两道化学关于物质的量的习题~
1.1mol的甲烷CH4在1.8mol的氧气中燃烧,恰好完全反应.燃烧后的产物中既有CO2也有CO,则CO2和CO总的物质的量是?
知道答案是1mol就是不知道怎么来的…貌似不用到方程式也可以做出来……?求教
2.在不同质量的SO2和Al2O3中氧元素的质量相等,求这时SO2和Al2O3的物质的量之比?
QAQ其实就是上课溜号没听到不太懂的地方…求指教 qianzy1年前2
qianzy1年前2 -
 applecock 共回答了24个问题
applecock 共回答了24个问题 |采纳率83.3%如果求CO2和CO总的物质的量不用算都可以知道是1mol,C原子守恒
如果要求分别有多少的话,可设燃烧后的产物中CO2 有X摩尔,CO有Y摩尔
CH4+2O2=CO2+2H2O
X 2X X
2CH4 +3O2 =2CO+4H2O
Y (3/2)Y Y
X+Y=1,2X+1.5Y=1.8,X=0.6,Y=0.4
2、假设SO2和Al2O3的物质的量分别为X,Y,因为不同质量的SO2和Al2O3中氧元素的质量相等,那么2X*16=3*16Y,X:Y=3:2
SO2和Al2O3的质量的比才是16:17 (3*64:(2*102))1年前查看全部
- 写几个热化学方程式1.1mol辛烷在氧气中燃烧,生成二氧化碳和和水,放出5518kj热量.2.1克甲醇燃烧生成二氧化碳和
写几个热化学方程式
1.1mol辛烷在氧气中燃烧,生成二氧化碳和和水,放出5518kj热量.
2.1克甲醇燃烧生成二氧化碳和液态水时放热22.68kj.
3.若适量的氮气和氧气完全反应,每生成23克二氧化氮需要吸收16.95kj热量. lzy19871年前1
lzy19871年前1 -
 ds3g321sg 共回答了17个问题
ds3g321sg 共回答了17个问题 |采纳率88.2%111111111111111111111111年前查看全部
- 1.1molNa中含有()mol电子,含有()质子,发生化学反应时,会失去()mol电子.
1.1molNa中含有()mol电子,含有()质子,发生化学反应时,会失去()mol电子.
2.含有0.5mol硫酸钠的溶液中所含溶质微粒的总物质的量为()mol.
3.如果1g水中含有m个氧原子,则阿伏伽德罗常数可表示为().
4.()g硝酸与4.9g硫酸含有相同的氧原子数.
5.20g氢氧化钠混在()g水中才能使10个水分子中混有1个Na离子?
(十万急呀!最好有过程,) lily61861年前2
lily61861年前2 -
 三灌帮不要填写 共回答了17个问题
三灌帮不要填写 共回答了17个问题 |采纳率88.2%1.1molNa中含有(11)mol电子,含有(11mol)质子,发生化学反应时,会失去(1)mol电子.
2.含有0.5mol硫酸钠的溶液中所含溶质微粒的总物质的量为(1.5)mol.
3.如果1g水中含有m个氧原子,则阿伏伽德罗常数可表示为(18m).
4.(4.2)g硝酸与4.9g硫酸含有相同的氧原子数.
5.20g氢氧化钠混在(90)g水中才能使10个水分子中混有1个Na离子?
1.Na 11号元素,质子数=电子数=原子序数=11,最外层电子数是1,容易失去
2.Na2SO4溶液含有2Na+和1个SO42-,总共3个离子,所以0.5mol有1.5mol
3.4.9÷98=0.05mol的硫酸,O原子有0.05×4=0.2mol,所以硝酸的物质的量是0.2÷3=1/15mol.质量=1/15×63=4.2g
4.Na有20÷40=0.5mol
水有10×0.5=5mol
则5×18=90g1年前查看全部
- 有机化学练习题,谁来帮我解答1.1mol乙烯与氯气完全加成后,再与氯气发生取代,整个过程最多需要反应掉的氯气的物质的量为
有机化学练习题,谁来帮我解答
1.
1mol乙烯与氯气完全加成后,再与氯气发生取代,整个过程最多需要反应掉的氯气的物质的量为_______mol.
2.
溴苯 可以发生消去反应嘛?并说明理由
1题答案是5 mol为什么啊?
取代为什么是4mol? rrrrr11111年前6
rrrrr11111年前6 -
 秦晟 共回答了21个问题
秦晟 共回答了21个问题 |采纳率90.5%1.应该是5摩尔.刚才弄错了,抱歉.
首先在加成的过程中会消耗1摩尔氯气变为C2H4Cl2.
之后在取代的过程中,因为氯原子只能取代H原子,则可知消耗氯气的量最多的时候,需要把H原子取代完全.
而因为在取代的过程中,每摩尔氯气反应中取代1个H原子,生成新的有机物和HCl,则因为还有4个H原子,所以取代反应需要4摩尔氯气.可知取代反应消耗的氯气的物质的量最多为4摩尔.
则反应掉的氯气的物质的量最多为1+4=5摩尔.
2.溴苯不能发生单纯的消去反应,但消去反应可以作为一些其他反应的步骤
因为溴苯消去的产物是活泼的中间体苯炔C6H4,其不能稳定单独存在,会立即发生其他的反应.
大学中确实有这样以苯炔中间体为机理的反应,有兴趣可以看大学有机1年前查看全部
- 1.1mol某烃完全燃烧可得到2molCO2:在一定条件下,1mol该烃能与2molH2发生加成反应,这种烃是( )
1.1mol某烃完全燃烧可得到2molCO2:在一定条件下,1mol该烃能与2molH2发生加成反应,这种烃是( )
A;CH4 B;C2H4 C;C2H2 D;C3H4
2.下列各组物质中,能用高锰酸钾酸性溶液鉴别的是
A;乙烯,乙炔 B;1-己烯,苯 C;苯,正己烷 D;苯,1-己炔
3.组成为C3H6Cl2的卤代烃,可能存在的同分异构体有
A;3种 B;4种 C;5种 D;6种
4.下列化合物中,既能发生消去反应,又能发生水解反应的是
A;氯仿 B;氯甲烷 C;乙醇 D;氯乙烷
5.汽油燃烧产生的汽车尾气中,所含的大气污染物主要是 ( )
A;碳的氧化物 B;硫的氧化物 C;氮的氧化物 D;磷的氧化物
6.家庭使用的天然气(主要成分CH4),液化石油气(主要成分C3H8)燃烧反应的主要化学方程式分别为:
CH4+2O2→CO2+2H2O:C3H8+5O2→3CO2+4H2O
A;减小空气进量,增大天然气进量 B;减小空气进量,减小天然气进量
C;增大空气进量,增大天然气进量 D;增大空气进量,减小天然气进量
第六题 :现有一套以液化石油气为原料的杜具,欲改为烧天然气,应采取的措施是( ) ws7671年前9
ws7671年前9 -
 桀骜小宝 共回答了21个问题
桀骜小宝 共回答了21个问题 |采纳率81%1、C 由1mol某烃完全燃烧可得到2molCO2,知该烃C原子数为2,又由1mol该烃能与2molH2发生加成反应,可知该烃含三键,所以为C2H2,乙炔.
2、BD 高锰酸钾能氧化烯烃炔烃,但不能氧化苯和环己烷
3、C 同一个C上带有两个Cl,有两种;两个C分别带有一个Cl有三种,其中1号C和2号C分别带有一个Cl有两种,因为2号C为手性碳,有旋光异构.
4、D 氯乙烷强碱条件下能发生消除反应生成乙烯,弱碱条件能水解生成乙醇.
5、AC
6、A 根据CH4+2O2→CO2+2H2O:C3H8+5O2→3CO2+4H2O可知,CH4的耗氧量不如C3H8,所以要减小空气进量,增大天然气进量1年前查看全部
- 2.3g钠中含有1.1mol电子,在跟足量水反应中失去多少摩电子? 为什么答案是1摩尔呢?
 zlysy1年前3
zlysy1年前3 -
 心情故事和你 共回答了19个问题
心情故事和你 共回答了19个问题 |采纳率78.9%Na反应时 失去的是最外层的那个电子 ,虽然1个Na有11个电子,1个Na转换为Na+ 离子时只失去1个电子,
2.3g Na为2.3/23=0.1mol 跟足量水反应失去0.1 mol电子 ,不是1mol
2Na+2H2O==2NaOH+H21年前查看全部
- 1.1mol甲烷与3mol氯气反应 得到的产物有哪些?
1.1mol甲烷与3mol氯气反应 得到的产物有哪些?
2下列物质可以鉴别乙醇 乙酸 乙酸乙酯的是
A稀硫酸 B氢氧化钠溶液 C碳酸钠溶液D紫色石蕊溶液
3.中用水不能鉴别的一组
A乙醇和乙酸 B苯和四氯化碳 C溴水和苯溴
请大侠每题简述理由 luxuyan1年前4
luxuyan1年前4 -
 丢失的岁月 共回答了30个问题
丢失的岁月 共回答了30个问题 |采纳率96.7%1、甲烷与氯气的反应属于连续反应,即只要有一卤代物,就会连续反应生成二卤、三卤、四卤,那么1mol甲烷与3mol氯气,产物有:三氯甲烷、四氯甲烷、氯化氢
2、CD
A中加入乙酸和乙醇都是互溶
B中加入乙醇互溶,加入乙酸中和互溶,加入乙酸乙酯水解互溶,看不出来的
C中加入乙酸气泡,加入乙醇互溶,加入乙酸乙酯分层
D中加入乙酸呈红色,乙醇互溶,乙酸乙酯分层
3、A
A都是互溶的
B都是分层的,但苯在上层,后者在下层
C的话加入溴水无变化,加入苯和溴,是分层,
如果是溴苯,也是分层,在下层1年前查看全部
- 有关烃的计算1.1mol某烃在足量氧气中完全燃烧,生成22.4LCO2(标况)和36gH2O,求该烃中含炭原子,氢原子的
有关烃的计算
1.1mol某烃在足量氧气中完全燃烧,生成22.4LCO2(标况)和36gH2O,求该烃中含炭原子,氢原子的物质的量,确定该烃的化学式
2.某气态烃标准状况下的密度为0.7143g/L,该烃中炭与氢元素的质量比为3:1,求该烃分子式 猿渡翼1年前1
猿渡翼1年前1 -
 今天是080101 共回答了14个问题
今天是080101 共回答了14个问题 |采纳率92.9%22.4LCO中有1mol碳,36gH2O中氢4mol,
由于原子守衡,1mol某烃有1mol碳、氢4mol
该烃的化学式:CH4
2、摩尔质量:0.7143g/L*22.4=16g/mol
炭:16/4*3=12,1mol,氢元素16/4=4mol
烃分子式=CH41年前查看全部
- 在容积恒定的密闭容器中,一定量的SO2与1.1mol O2发生反应:2SO2(g)+O2(g)催化剂△2SO3
在容积恒定的密闭容器中,一定量的SO2与1.1mol O2发生反应:2SO2(g)+O2(g)
2SO3(g)△H<0.当气体的物质的量减少0.315mol时,反应达到平衡,SO2的平衡转化率是90%.下列说法正确的是( )催化剂 △
A. 相同条件下,平衡时若充入稀有气体,SO2的转化率增大
B. 反应开始时,向容器中通入的SO2的物质的量是0.7 mol
C. 保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大
D. 保持其他条件不变,仅缩小容器体积,反应达到平衡时容器中有1.485 mol气体 火日烈1年前1
火日烈1年前1 -
 Earthl 共回答了18个问题
Earthl 共回答了18个问题 |采纳率94.4%解题思路:A.容器的容积恒定,通入稀有气体,反应混合物各组分的浓度不变,平衡不移动;
B.利用差量法计算参加反应的二氧化硫的物质的量,再利用二氧化硫的转化率计算开始通入的二氧化硫的物质的量;
C.降低温度,正、逆反应速率都减慢,正反应速率降低较小,平衡向正反应进行;
D.根据B中的解答计算原平衡时混合气体总的物质的量,仅缩小容器体积,压强增大,平衡向正反应方向移动,混合气体总的物质的量减小,据此判断.A.容器的容积恒定,通入稀有气体,反应混合物各组分的浓度不变,平衡不移动,SO2的转化率不变,故A错误;
B.设二氧化硫的物质的量是xmol,则:,
2SO2(g)+O2(g)⇌2SO3(g) 气体物质的量减少△n
2mol 1mol
xmol 0.315mol
故x=0.315×2=0.63,
故向容器中通入的SO2的物质的量=[0.63mol/90%]=0.7mol,故B正确;
C.降低温度,正、逆反应速率都减慢,正反应速率降低较小,平衡向正反应进行,故C错误;
D.原平衡时,混合气体的总的物质的量=0.7mol+1.1mol-0.315mol=1.485mol,保持其他条件不变,仅缩小容器体积,压强增大,平衡向正反应方向移动,混合气体总的物质的量减小,达新平衡时,应小于1.485mol,故D错误;
故选B.点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查化学平衡有关计算、影响化学平衡的因素等,难度中等,注意利用差量法进行的计算,注意基础知识的理解掌握.1年前查看全部
- 某化学兴趣小组的同学通过实验比较等体积(200mL)0.55mol/L硫酸、1.1mol/L盐酸、1.1mol/L醋酸分
某化学兴趣小组的同学通过实验比较等体积(200mL)0.55mol/L硫酸、1.1mol/L盐酸、1.1mol/L醋酸分别与过量金属反应生成氢气的速率请你协助完成如下实验,并回答相关问题.
(1)实验用品:仪器(略)、药品(除给定的三种酸溶液外,在Na、Mg、Fe三种金属中选择最合适的一种,并说明理由).选择的金属是MgMg,不选其它两种金属的理由是由于Na太活泼,能和水反应产生氢气,影响实验结论;Fe与酸反应的速率较慢,实验时间较长由于Na太活泼,能和水反应产生氢气,影响实验结论;Fe与酸反应的速率较慢,实验时间较长.
(2)实验原理:(用离子方程式表示)2H++Mg=H2↑+Mg2+、2CH3COOH+Mg=H2↑+Mg2++2CH3COO-2H++Mg=H2↑+Mg2+、2CH3COOH+Mg=H2↑+Mg2++2CH3COO-.
(3)甲同学设计的实验装置,乙同学认为该装置不能控制三个反应在同一时间发生,并作了相应的改进.你认为乙同学改进的措施是:同时用分液漏斗分别向烧瓶中加入酸液同时用分液漏斗分别向烧瓶中加入酸液.
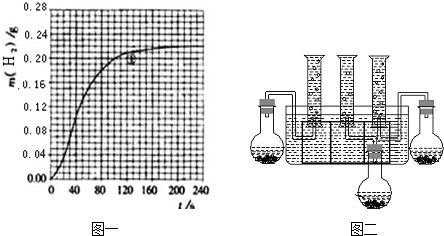
(4)按改进后的装置进行实验,实验中HCl与金属反应产生H2质量随时间变化的关系见图一,计算实验在80-120s范围内HCl的平均反应速率0.00375mol/(L.min)0.00375mol/(L.min)(忽略溶液体积变化,写出计算过程).
(5)请在答题卡的框图中,画出HAc、H2SO4与金属反应产生H2质量随时间变化关系的预期结果示意图.
(6)量筒的规格由酸溶液的体积酸溶液的体积决定.
(7)对盐酸和醋酸反应图象的异同,你的解释是醋酸中存在电离平衡,反应开始时c(H+)小于盐酸,故反应速率也小于盐酸.由于醋酸、盐酸最终提供的H+的物质的量相等,故最后的得到H2体积相等.醋酸中存在电离平衡,反应开始时c(H+)小于盐酸,故反应速率也小于盐酸.由于醋酸、盐酸最终提供的H+的物质的量相等,故最后的得到H2体积相等.. 龙傲炎黄1年前1
龙傲炎黄1年前1 -
 typfasz 共回答了24个问题
typfasz 共回答了24个问题 |采纳率87.5%(1)Na太活泼,能和水反应产生氢气,影响实验结论;Fe与酸反应的速率较慢,实验时间较长.故镁较合适,
故答案为:Mg;由于Na太活泼,能和水反应产生氢气,影响实验结论;Fe与酸反应的速率较慢,实验时间较长;
(2)镁与硫酸、盐酸反应实质为,镁与氢离子反应,置换出氢气,反应离子方程式为2H++Mg=H2↑+Mg2+,
醋酸是弱电解质,应写化学式,离子方程式为 2CH3COOH+Mg=H2↑+Mg2++2CH3COO-,
故答案为:2H++Mg=H2↑+Mg2+、2CH3COOH+Mg=H2↑+Mg2++2CH3COO-;
(3)保证同时向三烧瓶内加入酸,可同时用分液漏斗分别向烧瓶中加入酸液,故答案为:同时用分液漏斗分别向烧瓶中加入酸液;
(4)由图可知,80-120s范围内生成氢气的质量为0.21g-0.18g=0.03g,
2HCl~H2 ↑
2mol 2g
nmol 0.03g
所以n=0.03mol
所以△c(HCl )=
0.03mol
0.2L=0.15mol/L,
所以v(HCl )=
0.15mol/L
40s=0.00375mol/(L.min),
故答案为:0.00375mol/(L.min);
(5)硫酸中氢离子浓度大于醋酸中氢离子浓度,反应速率硫酸比醋酸快,两种提供的氢离子的物质的量相等,最后生成的氢气一样多.HAc、H2SO4与金属反应产生H2质量随时间变化关系的示意图为: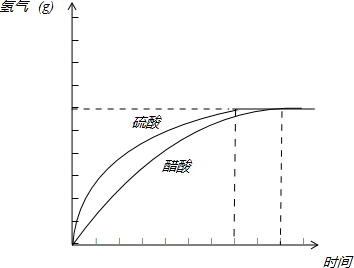 ,故答案为:
,故答案为: ;
;
(6)量筒用于测量生成氢气的体积,氢气的体积取决于酸溶液的体积,故答案为:酸溶液的体积;
(7)醋酸中存在电离平衡,反应开始时c(H+)小于盐酸,故反应速率也小于盐酸.由于醋酸、盐酸最终提供的H+的物质的量相等,故最后的得到H2体积相等,
故答案为:醋酸中存在电离平衡,反应开始时c(H+)小于盐酸,故反应速率也小于盐酸.由于醋酸、盐酸最终提供的H+的物质的量相等,故最后的得到H2体积相等.1年前查看全部
- 某化学兴趣小组的同学通过实验比较等体积(200mL)0.55mol/L硫酸、1.1mol/L盐酸、1.1mol/L醋酸分
某化学兴趣小组的同学通过实验比较等体积(200mL)0.55mol/L硫酸、1.1mol/L盐酸、1.1mol/L醋酸分别与过量金属反应生成氢气的速率请你协助完成如下实验,并回答相关问题. 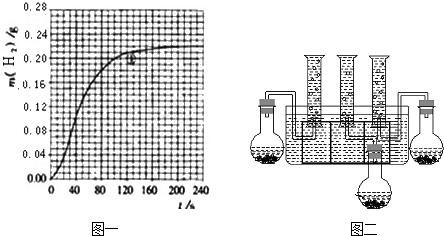
(1)实验用品:仪器(略)、药品(除给定的三种酸溶液外,在Na、Mg、Fe三种金属中选择最合适的一种,并说明理由).选择的金属是______,不选其它两种金属的理由是______.
(2)实验原理:(用离子方程式表示)______.
(3)甲同学设计的实验装置,乙同学认为该装置不能控制三个反应在同一时间发生,并作了相应的改进.你认为乙同学改进的措施是:______.
(4)按改进后的装置进行实验,实验中HCl与金属反应产生H 2 质量随时间变化的关系见图一,计算实验在80-120s范围内HCl的平均反应速率______(忽略溶液体积变化,写出计算过程).
(5)请在答题卡的框图中,画出HAc、H 2 SO 4 与金属反应产生H 2 质量随时间变化关系的预期结果示意图.
(6)量筒的规格由______决定.
(7)对盐酸和醋酸反应图象的异同,你的解释是______. figo77771年前1
figo77771年前1 -
 yamasaqi 共回答了20个问题
yamasaqi 共回答了20个问题 |采纳率90%(1)Na太活泼,能和水反应产生氢气,影响实验结论;Fe与酸反应的速率较慢,实验时间较长.故镁较合适,故答案为:Mg;由于Na太活泼,能和水反应产生氢气,影响实验结论;Fe与酸反应的速率较慢,实验时间较长;...1年前查看全部
- 1.1mol氯气跟白磷完全反应生成三氯化磷和五氯化磷,其物质的量比为2:1,则生成物中五氯化磷的物质的量为( )
1.1mol氯气跟白磷完全反应生成三氯化磷和五氯化磷,其物质的量比为2:1,则生成物中五氯化磷的物质的量为( )
A.0.4mol
B.0.1mol
C.0.2mol
D.0.05mol lalaking1591年前1
lalaking1591年前1 -
 小奇0129 共回答了18个问题
小奇0129 共回答了18个问题 |采纳率94.4%解题思路:1.1mol氯气跟白磷完全反应生成三氯化磷和五氯化磷,其物质的量比为2:1,设五氯化磷的物质的量为xmol,根据三氯化磷和五氯化磷的物质的量之比知三氯化磷的物质的量为2xmol,根据氯原子守恒计算五氯化磷的物质的量.1.1mol氯气跟白磷完全反应生成PCl3、PCl5,其物质的量比为2:1,设五氯化磷的物质的量为xmol,根据三氯化磷和五氯化磷的物质的量之比知三氯化磷的物质的量为2xmol,根据氯原子守恒得2xmol×3+xmol×5=1.1mol,x=0.1,所以五氯化磷的物质的量为0.1mol,
故选B.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查了物质的量的计算,根据氯原子守恒进行计算即可,题目难度不大.1年前查看全部
大家在问
- 1奖引后进,如恐不及,赏识之下,率为闻人
- 2在1,2,3,…2008中最多可选出多少个数,使选出的数中任意两个数的和都不能被3整除?
- 3什么是著名的“风筝之都”
- 4下列说法中,能反映液体蒸发快慢与液体温度有关的是( )
- 5解二元一次方程时用配方法,配的这项怎么确定?
- 6拼音ng怎么发音如题,不要告诉我是“嗯”的拼音,这个我知道,问题怎么发音我不清楚.感觉这个拼音比较特殊,是两个声母组成,
- 7简单叙述生物与环境的关系: 你如何认识生物种类的多样性,谈谈你的看法:
- 8关于英语的被动语态情景:你把坏掉的表送到钟表店. You:And how long will it take?will
- 9英语做不来!急用补单词:1.Work hard,or you'll lose the o______ to win th
- 10“新的一天又开始了”的英语翻译啊,求你了,翻译,最好今天给我
- 11(2008•花都区模拟)给出下列三个函数:①f(x)=x+1,②f(x)=1x,③f(x)=x2,其中在区间(0,+∞)
- 12证明:延长DC交BE于点M,∵BE∥AC,AB∥DC,∴四边形ABMC是平行四边形,∴CM=AB=DC,C为DM的中点,
- 13列一下特殊温度,比如水结冰0度,绝对零度是-273度
- 14《阅微草堂笔记》是以什么形式写成的志怪小说?
- 15水电图纸上RL-2-4-G和RL-2-4-H是什么意思
