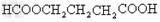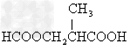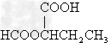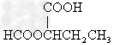把含氯的自来水放到太阳底下暴晒,会怎样?
 qushengjie1986542022-10-04 11:39:543条回答
qushengjie1986542022-10-04 11:39:543条回答自来水中的氯是不是就没掉了?
氯离子跑到哪里去了?

已提交,审核后显示!提交回复
共3条回复
 rryynn 共回答了16个问题
rryynn 共回答了16个问题 |采纳率93.8%- 酸性增强
Cl-没少,反而变多
ClO-少了
2HClO=2HCl+O2 - 1年前
 遵eeee药 共回答了637个问题
遵eeee药 共回答了637个问题 |采纳率- 不会,只是氯气及次氯酸没有了而已
- 1年前
 轻触 共回答了1494个问题
轻触 共回答了1494个问题 |采纳率- 次氯酸会分解产生氧气和氯化氢,氯化氢挥发,可能得到的水中无氯离子了,或很少的 氯离子与氢结合氯化氢挥发出去了
- 1年前
相关推荐
- 1、某混合物含有KCl、NaCl和Na2CO3,经分析知含钠为31.5%,含氯为27.08%(以上均为质量分数)则混合物
1、某混合物含有KCl、NaCl和Na2CO3,经分析知含钠为31.5%,含氯为27.08%(以上均为质量分数)则混合物中Na2CO3的质量分数为多少?
2、由组成的混合物中,钠元素的质量分数为46%,则混合物中氧元素的质量分数为多少?
以上两题望写出解答过程
2、由Na2S、Na2SO3、Na2SO4组成的混合物中,钠元素的质量分数为46%,则混合物中氧元素的质量分数为多少? 小孩me1年前1
小孩me1年前1 -
 xy4125 共回答了27个问题
xy4125 共回答了27个问题 |采纳率85.2%1.2K+ -- CO3 2- -- 2Na+
78 60 46
78x/60 x 46x/60
78x/60 + x = 1-31.5%-27.08%
解得x=18% 46x/60=13.8%
所以 Na2CO3质量分数是18%+13.8%=31.8%
2.2Na+ - S-
46 32
46% x
x=32%
故氧元素质量分数为1-32%-46%=22%
解析:第一题的思考思路应从电荷守恒的角度分析.因为此题所及元素有K Na Cl CO3 2- 四项,而除去了Na Cl就只剩下K CO3 2- ,假设这些混合物容于溶液,那么此溶液定会守恒,而有一个CO3 2- 就得有2个K,因而可以得到CO3 2-的质量分数,进得求得Na的质量分数.
第二题的思考思想应该看一下三种物质原子数上的特殊之处.他们的共同点是有两个Na和一个S,因而除去这两种元素外就得到了氧气元素.1年前查看全部
- 生活中氯化合物生活中常用的含氯化合物的名称,用途等~追加分····尽量详细一点··谢谢哈···
 一起kk1年前5
一起kk1年前5 -
 36051845 共回答了12个问题
36051845 共回答了12个问题 |采纳率100%1、氯化铵 (NH4Cl) 用途:用于金属焊接、电镀、鞣革,以及制干电池等.
2、氯化钡 (BaCl2) 用途:作分析试剂、脱水剂,制钡盐,以及用于电子、仪表、冶金等工业.
3、氯化钾 (KCl) 用途:农业上用作钾肥(以氧化钾计含量为50—60%),肥效快,可用作基肥和追肥.
4、氯化铝 (AlCl3) 用途:用作有机合成和石油工业的催化剂,并用于处理润滑油和制造蒽醌等.
5、氯化镁 (MgCl2) 用途:用于制金属镁、消毒剂、冷冻盐水、陶瓷,并用于填充织物、造纸等方面.
6、氯化钠 (NaCl) 用途:可用于食品调味和腌鱼肉蔬菜;制造氯气、氢气、盐酸、氢氧化钠、氯酸盐、次氯酸盐、漂白粉、金属钠,以及供盐析肥皂和鞣制皮革等.经高度精制的NaCl可用来制造生理盐水等.
7、氯化铁 (FeCl3 或Fe2Cl6) 用途:在有机合成上可用作氧化剂或催化剂.医药上用作止血剂,也用于制铁盐等.
8、氯化铜 (CuCl2) 用途:用作试剂、氧化剂、媒染剂、木材防腐剂等.也用于石油馏分的脱臭和脱硫.
9、氯化锌 (ZnCl2) 用途:用作焊接熔剂、媒染剂及木材防腐剂;在有机合成中用作脱水和缩聚反应的催化剂.
10、氯乙烯 (CH2=CHCl) 用途:用作聚氯乙烯的单体.
11、次氯酸(HClO)及其盐
(1) 制备
①通氯气于冰水中:Cl2 + H2O = HClO + H+ + Cl-
②通氯于碱液中可得次氯酸盐:Cl2+ 2NaOH → NaClO + NaCl + H2O
③工业上用电解冷浓食盐水并剧烈搅拌来制备NaClO
(2)性质
①是弱酸,但为很强的氧化剂,且具有漂白性
②受热易发生氧化还原反应
3ClO-→ ClO3- + 2Cl-
(3) 用途:制造漂白粉Ca(ClO)2
漂白粉:Cl2与Ca(OH)2反应 2Cl2 + 2Ca(OH)2 → Ca(ClO)2+ +CaCl2 +2H2O
12、亚氯酸(HClO2)及其盐
亚氯酸是目前所知唯一的亚卤酸,非常不稳定.
(1) 制备
①ClO2在水中分2ClO2 + H2O → HClO2 + HClO3
②通ClO2于Na2O2或NaOH与H2O2可得亚氯酸盐
2ClO2 + Na2O2 → 2NaClO2 + O2;2ClO2 + H2O2 + OH-→ 2ClO2- +O2 + H2O
(2) 性质与用途
①非常不稳定的化合物,但亚氯酸盐较稳定.
②具有漂白性
13、氯酸(HClO3)及其盐:浓度高于40%则不稳定
(1) 制备
①次氯酸根水溶液加热,产生自身氧化还原反应(歧化反应):3ClO-→ ClO3- + 2Cl-
②电解热氯化钠水溶液并加以搅拌:3Cl2 + 6OH- → ClO3- + 5Cl- + 3H2O
(2) 性质及用途
①氯酸和氯酸盐皆为强氧化剂
③KClO3受热反应
A.无催化剂,不可加强热:4KClO3 → 3KClO4 + KCl (约100℃)
B.催化剂(MnO2):2KClO3 → 2KCl + 3O2↑ (约300℃)
14、高氯酸(HClO4)及其盐
(1) 制备
①低压蒸馏KClO4与H2SO4的混合液:KClO4 + H2SO4 → HClO4 + KHSO4
②电解食盐水时,阳极产生的氯气被氧化:1/2Cl2 + 4H2O → ClO4-+ 8H+ + 7e-
③氯酸盐受热分4KClO3 → 3KClO4 + KCl
(2) 性质与用途
①最稳定的含氧酸,不易分解
②非常强的酸
15、聚氯乙烯 -[-CH2-CHCl-]n- 塑料袋1年前查看全部
- 下列关于氯气及含氯化合物的说法中,不正确的是( )
下列关于氯气及含氯化合物的说法中,不正确的是( )
A.氯气是纯净物,液氯是混合物,化学性质不同
B.氯气和NaOH溶液反应可制备“84”消毒液
C.氢气在氯气中燃烧时发出苍白色的火焰
D.氯气是黄绿色的,氯离子是无色的 chen48561年前1
chen48561年前1 -
 寒江栖枫 共回答了12个问题
寒江栖枫 共回答了12个问题 |采纳率75%解题思路:A.液氯为氯气的液态,为单质;
B.氯气与NaOH反应生成NaClO;
C.氢气在氯气中燃烧生成HCl,有苍白色的火焰;
D.氯气为黄绿色气体,而氯离子为无色离子.A.液氯为氯气的液态,氯气、液氯为同种单质,化学性质相同,故A错误;
B.氯气与NaOH反应生成NaClO,则氯气和NaOH溶液反应可制备“84”消毒液,故B正确;
C.氢气在氯气中燃烧生成HCl,燃烧时发出苍白色的火焰,故C正确;
D.氯气为黄绿色气体,而氯离子为无色离子,颜色均正确,故D正确;
故选A.点评:
本题考点: 氯气的化学性质.
考点点评: 本题考查氯气的化学性质,为高频考点,把握氯气的颜色、状态及氯气的化学性质为解答的关键,注重基础知识的考查,题目难度不大.1年前查看全部
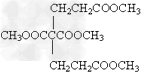
- 某有机物为含氯的酯(C6H8O4Cl2),在稀硫酸存在下水解产生A和B,A和B的物质的量之比为2:1,有机物A(C2H3
某有机物为含氯的酯(C6H8O4Cl2),在稀硫酸存在下水解产生A和B,A和B的物质的量之比为2:1,有机物A(C2H3O2Cl)可由有机物D(C2H3OCl)氧化而得,则( )
O
||
A.A的结构简式为H—C—O—CH2Cl,B为乙醇
Cl O
| ||
B.A的结构简式为CH2—C—OH,B为乙二醇
O
||
C.D的结构简式CH3—C—O—Cl
D.B为乙二酸 眼泪泡泡1年前5
眼泪泡泡1年前5 -
 天堂的交集 共回答了12个问题
天堂的交集 共回答了12个问题 |采纳率91.7%选B啊,你用那个酯加两个水再减去两个A就得出B的分子式了,是C2H6O21年前查看全部
- 某有机化合物的分子式C3H7ON,加入NaOH溶液煮沸,则水解生成羧酸盐,并放出某气体,将此气体通入盐酸溶液后,得含氯量
某有机化合物的分子式C3H7ON,加入NaOH溶液煮沸,则水解生成羧酸盐,并放出某气体,将此气体通入盐酸溶液后,得含氯量为52.6%的盐,写出这个化合物的构造式、名称以及水解反应式.
顺便把反应的生成的气体也写出来 家养野花1年前2
家养野花1年前2 -
 啊不CO 共回答了15个问题
啊不CO 共回答了15个问题 |采纳率100%CH3-NH-CO-CH3 碳与氧双键连接 气体为CH3-NH2
我不知道如何命名
CH3-NH-CO-CH3+NaOH=CH3-NH2+NaO-CO-CH2-CH3
盐为[CH3-NH3]+[CL]- CH3NH3Cl
水解CH3-NH-CO-CH3+H2O=CH3-NH2+CH3COOH1年前查看全部
- 1mol甲烷和1mol氯气混合,在紫外线作用下可以发生反应,则生成的含氯有机物是( )
1mol甲烷和1mol氯气混合,在紫外线作用下可以发生反应,则生成的含氯有机物是( )
A. 只有CH3Cl
B. 只有CH2Cl2
C. 只有CHCl3
D. 多种氯代烃 crzgl1年前3
crzgl1年前3 -
 miao413 共回答了20个问题
miao413 共回答了20个问题 |采纳率90%解题思路:甲烷和氯气在光照条件下发生反应,生成有机物有CH3Cl、CH2Cl2、CHCl3、CCl4,还有无机物氯化氢,据此完成即可.由于甲烷和氯气在光照条件下发生反应,生成有机物有CH3Cl、CH2Cl2、CHCl3、CCl4,还有无机物:氯化氢,总计5种产物,
故选D.点评:
本题考点: 甲烷的化学性质;取代反应与加成反应.
考点点评: 本题考查甲烷的性质,题目难度不大,本题注意甲烷与氯气发生取代反应的特点.1年前查看全部
- 有机物A的分子式是C3H6O2;D为六元环状有机化合物;F为高分子有机化合物;G为含氯有机化合物.它们在一定条件下存在如
有机物A的分子式是C3H6O2;D为六元环状有机化合物;F为高分子有机化合物;G为含氯有机化合物.它们在一定条件下存在如下转化关系.
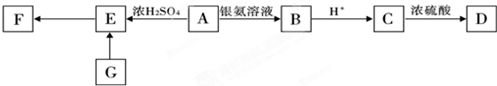
请根据以上条件,回答下列问题:
(1)E中官能团的名称是______;A→E的反应类型为______;F的结构简式为______.
(2)G可能的结构简式为______.
(3)写出下列化学方程式:
①A与银氨溶液反应______.
②C→D______. 爱猪小天使1年前1
爱猪小天使1年前1 -
 cokico 共回答了20个问题
cokico 共回答了20个问题 |采纳率90%解题思路:有机物A的分子式是C3H6O2,能被银氨溶液氧化生成B,B酸化得到C,C中含有羧基,C在浓硫酸作用下生成D为六元环状有机化合物,应是发生酯化反应,C中还含有羟基,则A含有醛基与羟基,结构D为六元环状有机化合物,则C中羧基与羟基连接在同一碳原子上,则A为CH3CH(OH)CHO、B为CH3CH(OH)COONH4、C为CH3CH(OH)COOH、D为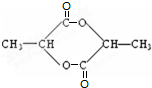 .A在浓硫酸作用下发生消去反应生成E为CH2=CHCHO,E发生加聚反应生成F为
.A在浓硫酸作用下发生消去反应生成E为CH2=CHCHO,E发生加聚反应生成F为 .G为含氯有机化合物,发生消去反应生成E,则G为ClCH2CH2CHO或CH3CH(Cl)CHO,据此解答.
.G为含氯有机化合物,发生消去反应生成E,则G为ClCH2CH2CHO或CH3CH(Cl)CHO,据此解答.
有机物A的分子式是C3H6O2,能被银氨溶液氧化生成B,B酸化得到C,C中含有羧基,C在浓硫酸作用下生成D为六元环状有机化合物,应是发生酯化反应,C中还含有羟基,则A含有醛基与羟基,结构D为六元环状有机化合物,则C中羧基与羟基连接在同一碳原子上,则A为CH3CH(OH)CHO、B为CH3CH(OH)COONH4、C为CH3CH(OH)COOH、D为
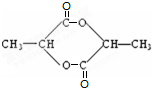 .A在浓硫酸作用下发生消去反应生成E为CH2=CHCHO,E发生加聚反应生成F为
.A在浓硫酸作用下发生消去反应生成E为CH2=CHCHO,E发生加聚反应生成F为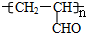 .G为含氯有机化合物,发生消去反应生成E,则G为ClCH2CH2CHO或CH3CH(Cl)CHO,
.G为含氯有机化合物,发生消去反应生成E,则G为ClCH2CH2CHO或CH3CH(Cl)CHO,
(1)由上述分析可知,E为CH2=CHCHO,含有碳碳双键、醛基;A→E的反应类型为消去反应;F的结构简式为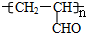 ,
,
故答案为:碳碳双键、羟基;消去反应;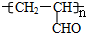 ;
;
(2)由上述分析可知,G的可能结构为:ClCH2CH2CHO或CH3CH(Cl)CHO,
故答案为:ClCH2CH2CHO或CH3CH(Cl)CHO;
(3)①A与银氨溶液反应的方程式为: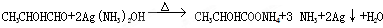 ,
,
②C→D的反应方程式为: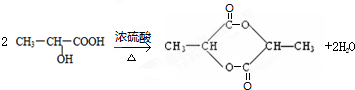 ,
,
故答案为: ;
; .
.点评:
本题考点: 有机物的推断.
考点点评: 本题考查有机物的推断,难度中等,注意根据反应条件及生成的结构确定A的结构是关键,再根据官能团的转化关系顺推判断,注意掌握官能团的性质与转化.1年前查看全部
- 常温常压下、2.24L四氯化碳中所含氯原子数大于0.4NA 、 对不?
 solomonmeteor1年前2
solomonmeteor1年前2 -
 shui255 共回答了15个问题
shui255 共回答了15个问题 |采纳率93.3%是正确的
在 常温常压下 四氯化碳 是液体 因此 由于其密度更高
摩尔数 大于 0.1mol 所以 氯原子数大于0.4NA1年前查看全部
- 有一种氯化物实验测得它含氯的质量分数为47.65%这种质量是
 紫小貓qq1年前1
紫小貓qq1年前1 -
 tracny 共回答了16个问题
tracny 共回答了16个问题 |采纳率81.3%KCl1年前查看全部
- 1mol甲烷和1mol氯气混合,在紫外线作用下可以发生反应,则生成的含氯有机物是( )
1mol甲烷和1mol氯气混合,在紫外线作用下可以发生反应,则生成的含氯有机物是( )
A.只有CH3Cl
B.只有CH2Cl2
C.只有CHCl3
D.多种氯代烃 嫁人就嫁郭晓冬1年前1
嫁人就嫁郭晓冬1年前1 -
 butpchen 共回答了19个问题
butpchen 共回答了19个问题 |采纳率78.9%解题思路:甲烷和氯气在光照条件下发生反应,生成有机物有CH3Cl、CH2Cl2、CHCl3、CCl4,还有无机物氯化氢,据此完成即可.由于甲烷和氯气在光照条件下发生反应,生成有机物有CH3Cl、CH2Cl2、CHCl3、CCl4,还有无机物:氯化氢,总计5种产物,
故选D.点评:
本题考点: 甲烷的化学性质;取代反应与加成反应.
考点点评: 本题考查甲烷的性质,题目难度不大,本题注意甲烷与氯气发生取代反应的特点.1年前查看全部
- 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2 CuO/CuCl
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2 CuO/CuCl2
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反
应A:4HCl+O2
2Cl2+2H2OCuO/CuCl2 .400℃
已知:ⅰ.反应A中,1mol HCl被氧化,放出28.9kJ的热量.
ⅱ.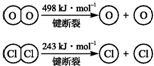
(1)反应A的热化学方程式是______.
(2)断开1mol H-O键与断开1mol H-Cl键所需能量相差约为______ kJ,H2O中H-O键比HCl
中H-Cl键(填“强”或“弱”)______.
(3)大气中的部分碘源于O3对海水中I-的氧化.O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)═IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HIO(aq)△H2
③HIO(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
总反应的化学方程式为______,其反应热△H=______.
 小树的秘密1年前1
小树的秘密1年前1 -
 春发1 共回答了26个问题
春发1 共回答了26个问题 |采纳率88.5%(1)依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
(2)焓变=反应物断键吸收热量-生成物形成化学键放出热量,4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
4×E(H-Cl)+498-[243×2+4×E(H-O)]=-115.6,得到4×E(H-O)-4×E(H-Cl)=498-486+115.6=127.6
E(H-O)-E(H-Cl)=31.9≈32,H2O中H-O键比HCl中H-Cl键强,
故答案为:32;强;
(3)将所给的三个反应:①+②+③可得总反应:2I-(aq)+O3(g)+2H+(aq)?I2(aq)+O2(g)+H2O(l),△H=△H1+△H2+△H3,
故答案为:2I-+O3+2H+?I2+O2+H2O;△H1+△H2+△H3.1年前查看全部
- 下列与含氯化合物有关的说法正确的是( )
下列与含氯化合物有关的说法正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.用加热的方法可以将NH4Cl与碘的混合物分离
D.ClO-与Fe2+、H+均能大量共存 dyn_hh1年前1
dyn_hh1年前1 -
 机密32 共回答了22个问题
机密32 共回答了22个问题 |采纳率90.9%解题思路:A.NaClO是强电解质;
B.向沸水中逐滴加入少量饱和FeCl3溶液,氯化铁可水解生成氢氧化铁胶体;
C.加入时氯化铵分解,碘升华;
D.ClO-与Fe2+、H+发生氧化还原反应,且生成HClO.A.NaClO属于盐,是强电解质,故A错误;
B.向沸水中逐滴加入少量饱和FeCl3溶液,氯化铁可水解生成氢氧化铁胶体,为实验室制备氢氧化铁胶体的常用方法,故B正确;
C.加入时氯化铵分解,碘升华,温度稍低时又生成氯化铵,碘可重新生成固体,不能分离,故C错误;
D.ClO-与Fe2+发生氧化还原反应,与H+生成HClO,故D错误.
故选B.点评:
本题考点: 氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查较为综合,涉及电解质、胶体的制备、物质的分离以及离子共存等问题,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.1年前查看全部
- 用Cl 2 生产某些含氯有机物时会产生副产物HCl。 利用反应A:4HCl+O 2 2Cl 2 +
用Cl 2 生产某些含氯有机物时会产生副产物HCl。利用反应A:4HCl+O 2
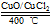 2Cl 2 +2H 2 O,
2Cl 2 +2H 2 O,
可实现氯的循环利用。
已知:Ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.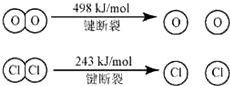
Ⅱ.则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为A.16kJ B.24kJ C.32kJ D.48kJ  bob_gao1年前1
bob_gao1年前1 -
 虎魄重光 共回答了13个问题
虎魄重光 共回答了13个问题 |采纳率92.3%C
1年前查看全部
- 某+2价金属的氯化物,经测定知道含氯 52.59%,该金属元素是
 有缘相识无缘相守1年前4
有缘相识无缘相守1年前4 -
 漠鱼鱼 共回答了13个问题
漠鱼鱼 共回答了13个问题 |采纳率76.9%设金属的元素符号为M,因为是+2价金属,所以氯化物为MCl2,经测定知道含氯 52.59%,所以设金属的相对分子质量为m,则有m/71 = 47.41/52.59
解得m=64
所以相对分子质量为64的只有铜元素,所以该金属元素为铜Cu
有问题欢迎追问1年前查看全部
- 某有机物甲经氧化得到乙(分子式为C2H3O2Cl);而甲经水解可得丙,1mol丙和2mol乙反应得一种含氯的酯(C6H8
某有机物甲经氧化得到乙(分子式为C2H3O2Cl);而甲经水解可得丙,1mol丙和2mol乙反应得一种含氯的酯(C6H8O4Cl2);由此推断甲的结构简式为( )
A.ClCH2CH2OH
B.OHC-O-CH2Cl
C.ClCH2CHO
D.HOCH2CH2OH sunlei1181年前1
sunlei1181年前1 -
 蛋糕冰淇淋 共回答了16个问题
蛋糕冰淇淋 共回答了16个问题 |采纳率87.5%解题思路:甲经氧化得到乙(分子式为C2H3O2Cl),甲经水解可得丙,1mol丙和2mol乙反应得一种含氯的酯(C6H8O4Cl2),则甲中含有2个C原子,还含有-Cl和-OH,丙中含有2个-OH,以此来解答.甲经氧化得到乙(分子式为C2H3O2Cl),甲经水解可得丙,1mol丙和2mol乙反应得一种含氯的酯(C6H8O4Cl2),则甲中含有2个C原子,还含有-Cl和-OH,甲中-Cl水解得到-OH,所以丙中含有2个-OH,即甲为ClCH2CH2OH,故选A.
点评:
本题考点: 有机物的推断.
考点点评: 本题考查有机物的推断,明确常见有机物醇、卤代烃的性质及酯化反应即可解答,注意碳链骨架的变化是解答本题的关键,题目难度不大.1年前查看全部
- (2013•宝鸡三模)NA表示阿伏加德罗常数,下列与含氯化合物有关的说法正确的是( )
(2013•宝鸡三模)NA表示阿伏加德罗常数,下列与含氯化合物有关的说法正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子 zyu55001年前1
zyu55001年前1 -
 绿帽子真好看 共回答了15个问题
绿帽子真好看 共回答了15个问题 |采纳率93.3%解题思路:A、次氯酸是弱酸,次氯酸钠是盐属于强电解质;
B、依据氢氧化铁胶体的实验室制备方法分析判断;
C、离子化合物是离子构成的化合物,氯化氢是共价化合物水溶液中电离成离子;
D、依据电解氯化钠反应的化学方程式计算电子转移;A、次氯酸是弱酸,次氯酸钠是盐属于强电解质,故A错误;
B、向沸水中逐滴加入少量饱和FeCl3溶液,加热可制得Fe(OH)3胶体,故B正确;
C、离子化合物是离子构成的化合物,氯化氢是共价化合物水溶液中电离成离子,氯化钠是离子化合物,故C错误;
D、电解NaCl溶液得到22.4LH2(标准状况)物质的量为1mol,反应为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑,理论上需要转移2NA个电子,故D错误;
故选B.点评:
本题考点: 阿伏加德罗常数;氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查了强弱电解质的概念应用,氢氧化铁胶体的实验室制备方法,离子化合物的分析判断,电解反应的电子转移数目计算.1年前查看全部
- 某化工厂排放的废水中含氯总量以Cl2计为0.01mol/L.该厂欲配制固体试剂(Na2SO3与NaOH的混合物)一次性除
某化工厂排放的废水中含氯总量以Cl2计为0.01mol/L.该厂欲配制固体试剂(Na2SO3与NaOH的混合物)一次性除去Cl2并使溶液呈中性.试计算:
(1)所配固体试剂中NaOH的质量分数;
(2)若该厂每天排放废水100m3,每天处理废水需该固体的质量(kg). roya1121年前1
roya1121年前1 -
 felix521 共回答了15个问题
felix521 共回答了15个问题 |采纳率93.3%解题思路:(1)除去Cl2并使溶液呈中性,先发生反应Na2SO3+Cl2+H2O═Na2SO4+2HCl,再用NaOH中和盐酸,发生反应NaOH+HCl=NaCl+H2O,由方程式可知固体试剂中n(Na2SO3):n(NaOH)=1:2,据此计算解答;
(2)计算氯气的物质的量,根据方程式计算n(Na2SO3),进而计算n(NaOH),再根据m=nM计算.(1)除去Cl2并使溶液呈中性,先发生反应Na2SO3+Cl2+H2O═Na2SO4+2HCl,再用NaOH中和盐酸,发生反应NaOH+HCl=NaCl+H2O,由方程式可知固体试剂中n(Na2SO3):n(NaOH)=1:2,故所配固体试剂中NaOH的质量分数=[2mol×40g/mol/2mol×40g/mol+1mol×126g/mol]×100%=38.8%,
答:所配固体试剂中NaOH的质量分数为38.8%.
(2)100m3废水中n(Cl2)=105L×0.01mol/L=1000mol,根据Na2SO3+Cl2+H2O═Na2SO4+2HCl,可知n(Na2SO3)=n(Cl2)=1000mol,而(NaOH)=2n(Na2SO3)=2000mol,
故需要试剂的质量=1000mol×126g/mol+2000mol×40g/mol=206×103g=206kg,
答:处理废水100m3需该固体的质量为206kg.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查根据方程式进行的计算,难度不大,明确废水处理发生的反应是关键,注意根据反应确定亚硫酸钠与氢氧化钠的关系.1年前查看全部
- 从一种珊瑚中分离出的活性含氯化合物punaglandin具有很强的抗癌活性,它的结构简式如图,有关该化合物的说法正确的是
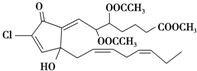 从一种珊瑚中分离出的活性含氯化合物punaglandin具有很强的抗癌活性,它的结构简式如图,有关该化合物的说法正确的是( )
从一种珊瑚中分离出的活性含氯化合物punaglandin具有很强的抗癌活性,它的结构简式如图,有关该化合物的说法正确的是( )
A.分子有3种含氧官能团
B.分子中所有碳原子可以处于同一平面
C.1mol该物质最多消耗4mol NaOH或3mol Br2
D.该物质中只有一种官能团能使酸性高锰酸钾溶液褪色 ff茶韵1年前1
ff茶韵1年前1 -
 15053500 共回答了17个问题
15053500 共回答了17个问题 |采纳率88.2%解题思路:有机物含有酯基,可发生水解反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有氯原子,可发生水解反应,含有羟基,可发生取代、消去和氧化反应,含有羰基,可发生加成反应,以此解答该题.A.分子中的含氧官能团有羰基、羟基和酯基,故A正确;
B.分子中含有饱和烃基,具有甲烷的结构特点,则不可能在同一个平面,故B错误;
C.分子中含有4个碳碳双键,可与4mol溴加成,故C错误;
D.能与高锰酸钾发生氧化还原反应的官能团有羟基和碳碳双键,故D错误.
故选A.点评:
本题考点: 有机物的结构和性质.
考点点评: 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、酯性质的考查,注意选项C中均与溴发生加成反应的官能团,题目难度不大.1年前查看全部
- 1,某碱金属的氯化物中含氯47.65%,这种碱金属的名称是( )A.锂 B钠 C钾 D铷
 ogdasd6q1年前2
ogdasd6q1年前2 -
 eincubus 共回答了20个问题
eincubus 共回答了20个问题 |采纳率90%C钾1年前查看全部
- 金属元素氯化物含氯的质量分数是74.78%,且R原子量是47.9,则氯化物中,R元素的化合价是——
金属元素氯化物含氯的质量分数是74.78%,且R原子量是47.9,则氯化物中,R元素的化合价是——
急 priscilla_jing1年前1
priscilla_jing1年前1 -
 tdown 共回答了11个问题
tdown 共回答了11个问题 |采纳率90.9%设化合价为x ,化学式为RClx.
35.5x/(47.9+35.5x)=74.78% x=4
R元素的化合价是+41年前查看全部
- 下列与含氯化合物有关的说法正确的是 A.HClO是弱酸,所以NaClO是弱电解质 B.向沸水中逐滴加入少量饱和FeCl
下列与含氯化合物有关的说法正确的是
A.HClO是弱酸,所以NaClO是弱电解质 B.向沸水中逐滴加入少量饱和FeCl 3 溶液,可制得Fe(OH) 3 胶体 C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 D.电解NaCl溶液得到22.4 L H 2 (标准状况),理论上需要转移N A 个电子  jasonwjk1年前1
jasonwjk1年前1 -
 姚安 共回答了13个问题
姚安 共回答了13个问题 |采纳率92.3%B
1年前查看全部
- 下列含氯化合物中,氯元素为+7价的物质是 ( )
下列含氯化合物中,氯元素为+7价的物质是 ( )
下列含氯化合物中,氯元素为+7价的物质是 ( )
A、KClO3 B、KClO C、KClO4 D、HCl 凡帆浮萍1年前3
凡帆浮萍1年前3 -
 jiaxin5680799 共回答了12个问题
jiaxin5680799 共回答了12个问题 |采纳率91.7%选C,根据电荷守恒,K为+1价,O为-2价,故Cl为+7价1年前查看全部
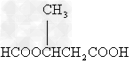
- 某有机物甲经氧化得乙(C2H3O2Cl),而甲在NaOH水溶液中加热反应可得丙.1mol丙和2mol乙反应得一种含氯的酯
某有机物甲经氧化得乙(C2H3O2Cl),而甲在NaOH水溶液中加热反应可得丙.1mol丙和2mol乙反应得一种含氯的酯(C6H8O4Cl2).由此可推断甲的结构简式为( )
A.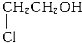
B.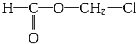
C.CH2ClCHO
D.HOCH2CH2OH 遥冬1年前1
遥冬1年前1 -
 ninnny 共回答了20个问题
ninnny 共回答了20个问题 |采纳率95%解题思路:甲经氧化后得乙(分子式为C2H3O2Cl),乙应为CH2ClCOOH,说明甲中含有能被氧化的官能团,可能为-OH或-CHO,甲经水解可得丙,1mol丙和2mol乙反应的一种含氯的酯(C6H8O4Cl2),说明丙中含有两个-OH,应为CH2OHCH2OH,则甲为CH2ClCH2OH.乙应为CH2ClCOOH,甲经水解可得丙,1mol丙和2mol乙反应的一种含氯的酯(C6H8O4Cl2),说明甲水解后生成CH2OHCH2OH,则甲为CH2ClCH2OH,故选A.
点评:
本题考点: 有机物分子中的官能团及其结构.
考点点评: 本题考查了有机物官能团及其结构的判断,根据乙的分子式及乙发生的反应确定乙的结构简式,再结合丙、乙的结构确定甲的结构,题目难度中等.1年前查看全部
- 氯元素的相对原子质量为35.5,由氯35和氯37构成的10克氯化钠中含氯37的质量是多少克?
 镯子爱1年前3
镯子爱1年前3 -
 twobluefish 共回答了21个问题
twobluefish 共回答了21个问题 |采纳率81%由十字交叉法得
35 1.5 3
35.5
37 0.5 1
即CL35与CL37的物质的量之比为3:1
10g氯化钠得物质的量为20/117 mol
则10g氯化钠中氯元素的物质的量为20/117 mol
氯37得物质的量为20/117 * 1/4 =5/117 mol
质量为5/117 * 37=1.58 g1年前查看全部
- 某化工厂排放的废水中含氯总量以Cl2计为0.01mol/L.该厂欲配制固体试剂(Na2SO3与NaOH的混合物)一次性除
某化工厂排放的废水中含氯总量以Cl2计为0.01mol/L.该厂欲配制固体试剂(Na2SO3与NaOH的混合物)一次性除去Cl2并使溶液呈中性.试计算:
(1)所配固体试剂中NaOH的质量分数;
(2)若该厂每天排放废水100m3,每天处理废水需该固体的质量(kg). 快乐一生XTXK1年前1
快乐一生XTXK1年前1 -
 adjective 共回答了15个问题
adjective 共回答了15个问题 |采纳率93.3%解题思路:(1)除去Cl2并使溶液呈中性,先发生反应Na2SO3+Cl2+H2O═Na2SO4+2HCl,再用NaOH中和盐酸,发生反应NaOH+HCl=NaCl+H2O,由方程式可知固体试剂中n(Na2SO3):n(NaOH)=1:2,据此计算解答;
(2)计算氯气的物质的量,根据方程式计算n(Na2SO3),进而计算n(NaOH),再根据m=nM计算.(1)除去Cl2并使溶液呈中性,先发生反应Na2SO3+Cl2+H2O═Na2SO4+2HCl,再用NaOH中和盐酸,发生反应NaOH+HCl=NaCl+H2O,由方程式可知固体试剂中n(Na2SO3):n(NaOH)=1:2,故所配固体试剂中NaOH的质量分数=[2mol×40g/mol/2mol×40g/mol+1mol×126g/mol]×100%=38.8%,
答:所配固体试剂中NaOH的质量分数为38.8%.
(2)100m3废水中n(Cl2)=105L×0.01mol/L=1000mol,根据Na2SO3+Cl2+H2O═Na2SO4+2HCl,可知n(Na2SO3)=n(Cl2)=1000mol,而(NaOH)=2n(Na2SO3)=2000mol,
故需要试剂的质量=1000mol×126g/mol+2000mol×40g/mol=206×103g=206kg,
答:处理废水100m3需该固体的质量为206kg.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查根据方程式进行的计算,难度不大,明确废水处理发生的反应是关键,注意根据反应确定亚硫酸钠与氢氧化钠的关系.1年前查看全部
- 某化工厂排放的废水中含氯总量以Cl2计为0.01mol/L.该厂欲配制固体试剂(Na2SO3与NaOH的混合物)一次性除
某化工厂排放的废水中含氯总量以Cl2计为0.01mol/L.该厂欲配制固体试剂(Na2SO3与NaOH的混合物)一次性除去Cl2并使溶液呈中性.试计算:
(1)所配固体试剂中NaOH的质量分数;
(2)若该厂每天排放废水100m3,每天处理废水需该固体的质量(kg). ganlizhen1年前1
ganlizhen1年前1 -
 小糊糊 共回答了19个问题
小糊糊 共回答了19个问题 |采纳率89.5%解题思路:(1)除去Cl2并使溶液呈中性,先发生反应Na2SO3+Cl2+H2O═Na2SO4+2HCl,再用NaOH中和盐酸,发生反应NaOH+HCl=NaCl+H2O,由方程式可知固体试剂中n(Na2SO3):n(NaOH)=1:2,据此计算解答;
(2)计算氯气的物质的量,根据方程式计算n(Na2SO3),进而计算n(NaOH),再根据m=nM计算.(1)除去Cl2并使溶液呈中性,先发生反应Na2SO3+Cl2+H2O═Na2SO4+2HCl,再用NaOH中和盐酸,发生反应NaOH+HCl=NaCl+H2O,由方程式可知固体试剂中n(Na2SO3):n(NaOH)=1:2,故所配固体试剂中NaOH的质量分数=2mol×...
点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查根据方程式进行的计算,难度不大,明确废水处理发生的反应是关键,注意根据反应确定亚硫酸钠与氢氧化钠的关系.1年前查看全部
- 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:
4HCl+O2
2Cl2+2H2OCuO/CuCl2 .400℃
已知:ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.
ⅱ.
(1)反应A的热化学方程式是______.
(2)断开1mol H-O键与断开1mol H-Cl键所需能量相差约为______ kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)______. MTL的鲁西西1年前1
MTL的鲁西西1年前1 -
 辛家ff铺清水 共回答了17个问题
辛家ff铺清水 共回答了17个问题 |采纳率94.1%解题思路:(1)反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出;
(2)依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,焓变=反应物断键吸收热量-生成物形成化学键放出热量计算.(1)依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
故答案为:4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
(2)焓变=反应物断键吸收热量-生成物形成化学键放出热量,4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
4×E(H-Cl)+498-[243×2+4×E(H-O)]=-115.6,得到4×E(H-O)-4×E(H-Cl)=498-486+115.6=127.6
E(H-O)-E(H-Cl)=31.9≈32,H2O中H-O键比HCl中H-Cl键强,
故答案为:32;强.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了热化学方程式书写,化学键键能和焓变关系计算,图象分析判断,题目难度中等.1年前查看全部
- 1,下列有关氟利昂的说法,正确的是 A 氟利昂是一类含氯的卤代烃
1,下列有关氟利昂的说法,正确的是 A 氟利昂是一类含氯的卤代烃
B 氟利昂化学性质稳定,有毒
C 氟利昂大多数沸点高,难汽化
D 在平流层中,氟利昂在紫外线照射下发生分解产生的氯原子,可引发损耗臭氧的反应,使臭氧层破坏,危害地球上的生物
请帮忙分析此4个选项, 宝宝贝贝er1年前2
宝宝贝贝er1年前2 -
 uu在春季 共回答了14个问题
uu在春季 共回答了14个问题 |采纳率78.6%个人感觉这道题目出得并不严密,有些选项模棱两可,不算是规范考试题目.因此在此我将题目涉及的知识点写明,不深究个别选项的正确与否.
A.氟利昂是几种氟氯代甲烷和氟氯代乙烷的总称,是含氯和氟的卤代烃.所以A选项错误.
B.氟利昂化学性质稳定,但是是无毒的气体,否则也不会曾经被广泛用作制冷剂.B错误.
C.沸点高与难汽化的含义相同;因为沸点高,所以更难形成气体,也就是难汽化.这条性质可以由卤代烷烃的沸点普遍较高得出.(示例:氯代甲烷的沸点要高于甲烷,且沸点随-Cl取代-H的数量的增加而增加).
个人感觉C选项只好这么来理解,C选项的表述“沸点高、难汽化”需要一个和它进行比较的对象才可进行比较.如果说作为制冷剂,相对于室温来说易液化、易汽化也并不无道理,但是那样的话,就缺乏了一个判定高或低的标准.因此我个人感觉氟利昂(卤代烷烃)比较的对象应该是烷烃.C选项是正确的.
D.氟利昂的分解发生于平流层,产生氯原子(自由基)与臭氧反应,生成的产物不稳定,迅速分解为O2和氯原子(自由基).因此,氟利昂起到了臭氧分解过程中的催化剂的作用.D选项正确.
希望能够帮助到你~
如有疑惑,欢迎追问1年前查看全部
- 下列含氯的化合物:①HClO;②Cl2;③NaCl;④KClO3;⑤HClO4,按氯元素的化合价由高到低的顺序排列为(填
下列含氯的化合物:①HClO;②Cl2;③NaCl;④KClO3;⑤HClO4,按氯元素的化合价由高到低的顺序排列为(填序号)______.
 也丫头1年前1
也丫头1年前1 -
 jhhh1969 共回答了19个问题
jhhh1969 共回答了19个问题 |采纳率89.5%解题思路:根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合各选项中的化学式进行解答本题.氢元素显+1价,氧元素显-2价,设HClO中氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)=0,则x=+1价.根据单质中元素的化合价为0,Cl2属于单质,故氯元素的化合价为0.钠元素显+1价...
点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答.1年前查看全部
- 用Cl 2 生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
用Cl 2 生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O 2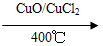 2Cl 2 +2H 2 O
2Cl 2 +2H 2 O
(1)已知:ⅰ.反应A中,4 molHCl被氧化,放出115.6 kJ的热量。
ⅱ.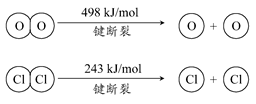
①H 2 O的电子式是________。
②反应A的热化学方程式是______________________________________。
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ,H 2 O中H—O键比HCl中H—Cl键(填“强”或“弱”)________。
(2)对于反应A,下图是在4种投料比[n(HCl):n(O 2 ),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。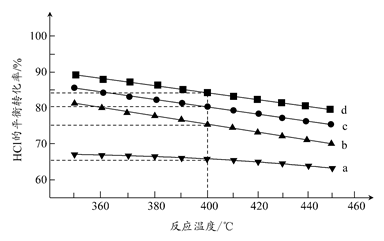
①曲线b对应的投料比是________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是______________________________。
③投料比为2:1、温度为400℃时,平衡混合气中Cl 2 的物质的量分数是________。 zxhuse1年前1
zxhuse1年前1 -
 VV20998s 共回答了22个问题
VV20998s 共回答了22个问题 |采纳率86.4%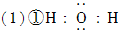
②4HCl(g)+O 2 (g)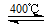 2Cl 2 (g)+2H 2 O(g)
2Cl 2 (g)+2H 2 O(g)
ΔH=-115.6 kJ/ mol
③32 强
(2)①4:1
②投料比越高,对应的反应温度越低
③30.8%
(1)③设H—O键的键能为x,H—Cl键的键能为y,则有-115.6=-2×243-4x+4y+498,化简得x-y=31.9,即断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为32 kJ,H 2 O中H—O键比HCl中H—Cl键强。
(2)①同一温度下,O 2 的浓度越大,HCl的平衡转化率越高,故曲线a、d分别对应n(HCl):n(O 2 )为6:1、1:1的情况,曲线b对应的投料比是4:1。
②在图上作一平行于温度轴的直线与曲线b、c、d相交,可以看出,当不同投料比下HCl的平衡转化率相同时,曲线b对应的温度最低,曲线d对应的温度最高。则可得出结论:投料比越高,对应的反应温度越低。
③此时HCl的平衡转化率为80%。设反应开始时n(HCl)=2a mol,n(O 2 )=a mol。
4HCl(g)+O 2 (g)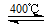 2Cl 2 (g)+2H 2 O(g)
2Cl 2 (g)+2H 2 O(g)
起始 2a mol a mol 0 0
转化 1.6a mol 0.4a mol 0.8a mol 0.8a mol
平衡 0.4a mol 0.6a mol 0.8a mol 0.8a mol
则平衡混合气体中Cl 2 的物质的量分数是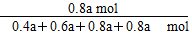 ×100%≈30.8%。
1年前查看全部
×100%≈30.8%。
1年前查看全部
- G、W、X、Y、Z、均为含氯的含氧化合物,我们不了解他们的化学式,但知道他们在一定条件下具有如下转化关系
G、W、X、Y、Z、均为含氯的含氧化合物,我们不了解他们的化学式,但知道他们在一定条件下具有如下转化关系
①G-->W+NaCl ②W+H2O-->(电解)X+H2 ③Y+NaOH-->G+W=H2O
④Z+NaOH-->W+X+H2O 这五种化合物中的氯的化合价由低到高的顺序是: 学烧菜的H1年前3
学烧菜的H1年前3 -
 huxiaohui521 共回答了12个问题
huxiaohui521 共回答了12个问题 |采纳率83.3%①G-->W+NaCl 氯化钠中氯为最低价,故w>G,
②W+H2O-->(电解)X+H2 水变氢气,氢化合价降低,故X>W,
③Y+NaOH-->G+W=H2O Y介于W、G之间
④Z+NaOH-->W+X+H2O Z介于W、X之间
的氯的化合价由低到高的顺序是
G、Y、W、Z、X1年前查看全部
- 氯气的化合价有多种怎么判断呢?比如氯气有多种化合价,但是在各种含氯的物质中,怎么判断这些有多种化合价的物质的化合价呢?如
氯气的化合价有多种怎么判断呢?
比如氯气有多种化合价,但是在各种含氯的物质中,怎么判断这些有多种化合价的物质的化合价呢?如氧化钴CoCl2中cl(氯)的化合价是多少?
可是答案说是-2价 hnasd1年前4
hnasd1年前4 -
 db_dts 共回答了13个问题
db_dts 共回答了13个问题 |采纳率84.6%氯气一般化合价只有-1价;特别明显钴是金属.顶多是氯气时是0价1年前查看全部
- 1.进行物质分类;福尔马林,凡士林,石墨,液氯(含氯99.6%,含水分0.05%)
1.进行物质分类;福尔马林,凡士林,石墨,液氯(含氯99.6%,含水分0.05%)
2.风化为什么是化学变化?
3.氯化钠的颜色 紫枫叶Ж1年前1
紫枫叶Ж1年前1 -
 jeff1122 共回答了22个问题
jeff1122 共回答了22个问题 |采纳率90.9%醛类溶液福尔马林,混合物
凡士林主要是甘油等多羟基醇与脂类,混合物
石墨主要是C,看成是单质了
液氯,Cl单质液态死扣有水分,应该也是混合物
2
风化是一个化学变化过程.例如,日常生活中碱块(Na2CO3·10H2O)变成碱面(Na2CO3),其结构式发生了变化,就是风化现象.加热结晶水合物使它们失去结晶水的现象不叫风化,而叫失水.
3
无色立方结晶或白色立方结晶,因为颗粒过小导致折射反射等显示为白色粉末
溶液 无色透明1年前查看全部
- 氯化物和什么物质反应生成氯化钠我现有的物质就是氯化物,我要让它转化为氯化钠!是在水中将含氯的化合物通过化学反应生成氯化钠
氯化物和什么物质反应生成氯化钠
我现有的物质就是氯化物,我要让它转化为氯化钠!是在水中将含氯的化合物通过化学反应生成氯化钠! chenlong3441年前8
chenlong3441年前8 -
 82308 共回答了21个问题
82308 共回答了21个问题 |采纳率90.5%一般和NaOH反应生成氯化钠.
如:MgCl2 + 2NaOH = 2NaCl + Mg(OH)2(沉淀)1年前查看全部
- 液氯含氯99.6%,含水不超过0.05%,它是( )A.纯净物 B.混合物 C.化合物.D单质
液氯含氯99.6%,含水不超过0.05%,它是( )A.纯净物 B.混合物 C.化合物.D单质
为什么是混合物啊?我老师说物质没有绝对纯的,只要含99%以上就是纯净物了,我也说是混合物.但是老师这样说.到底怎么才能更明了地分清是纯净物还是混合物呢.为什么说它是纯净物?我看过书,它好像说是纯净物啊! 回看天际Q1年前2
回看天际Q1年前2 -
 zlaizhysinacom 共回答了14个问题
zlaizhysinacom 共回答了14个问题 |采纳率85.7%B.混合物1年前查看全部
- 焚烧含氯塑料产生有刺激性气味的氯化氢气体会对空气造成污染?
 也许呀1年前2
也许呀1年前2 -
 chenlili222 共回答了18个问题
chenlili222 共回答了18个问题 |采纳率94.4%氯化氢气体溶于水是酸性,氯离子扩散到高层对臭氧层影响大1年前查看全部
- 如何证明氯酸钾中含氯.酸.钾三种元素
 窗外的树1年前2
窗外的树1年前2 -
 woaizdyan 共回答了11个问题
woaizdyan 共回答了11个问题 |采纳率100%是氯,氧,钾.加热有氧气,证明氧,加热后剩余固体加硝酸银有不溶酸的沉淀,证明氯,钾元素用焰色反应1年前查看全部
- 求烃的分子式.某烃与氯气加成的产物中,含碳31.9%,含氢5.3%,含氯62.8%.由质谱研究知其卤代烃的相对分子质量为
求烃的分子式.
某烃与氯气加成的产物中,含碳31.9%,含氢5.3%,含氯62.8%.由质谱研究知其卤代烃的相对分子质量为113.则该烃的分子式是什么? oo灰不复燃1年前2
oo灰不复燃1年前2 -
 20025143 共回答了20个问题
20025143 共回答了20个问题 |采纳率85%卤代烃,相对分子质量为113,
含碳31.9%,则含碳的个数=113X31.9%/12=3
含氢5.3%,则含氢的个数=113X5.3%/1=6
含氯62.8%,则含氯的个数=113X62.8%/35.5=2
该烃的分子式:C3H61年前查看全部
- 烷烃的二氯取代物若有氯取代支链甲基上的氢该选含氯的还是最长碳链为主链?
 枕戈书生1年前1
枕戈书生1年前1 -
 峰之舞 共回答了21个问题
峰之舞 共回答了21个问题 |采纳率95.2%依然选最长碳链为主连1年前查看全部
- 2道初二化学问题1、某硝酸铵(NH4NO3)样品中含氯的质量分数为28%,则样品的纯度为A、35% B、80% C、28
2道初二化学问题
1、某硝酸铵(NH4NO3)样品中含氯的质量分数为28%,则样品的纯度为
A、35% B、80% C、28% D、无法计算
2、A、B相对原子质量比为1:32,形成化合物中A、B质量比为1:16,则A、B原子个数比为( )
A、1:4 B、2:1 C、1:2 D、4:1
要过程 fa2511年前1
fa2511年前1 -
 fengyunlsz 共回答了29个问题
fengyunlsz 共回答了29个问题 |采纳率93.1%1.14×2÷(28+4+48)=0.35 0.28÷0.35=0.8 B
2.(带比例设)设A为X个,B为Y个
1X:32Y=1:16
X=2 Y=1
B1年前查看全部
- (2007•广州)下列各组含氯物质中,氯元素化合价相同的一组是( )
(2007•广州)下列各组含氯物质中,氯元素化合价相同的一组是( )
A.Cl2、HCl
B.NaCl、HClO
C.ClO2、NaClO2
D.KClO3、Ca(ClO3)2 bingmaan1年前1
bingmaan1年前1 -
 雨薇1015 共回答了18个问题
雨薇1015 共回答了18个问题 |采纳率77.8%解题思路:根据单质中元素的化合价为0,化合物中元素的正负化合价的代数和为0来计算氯元素化合价.A、Cl2中氯元素的化合价为0,HCl中氯元素的化合价为-1价,故A错误;
B、NaCl中氯元素的化合价为-1价,HClO中氯元素的化合价为+1价,故B错误;
C、ClO2中氯元素的化合价为+4价,NaClO2中氯元素的化合价为+3价,故C错误;
D、KClO3、Ca(ClO3)2中氯元素的化合价都为+5价,故D正确;
故选D.点评:
本题考点: 有关元素化合价的计算;常见元素与常见原子团的化合价;化合价规律和原则.
考点点评: 本题考查化合价的计算,需要对每种物质中的化合价分别计算后判断是否相同而较麻烦,学生应熟悉常见元素在化合物中的化合价.1年前查看全部
- (三选一)【有机化学基础】某研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明)
(三选一)【有机化学基础】
某研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明)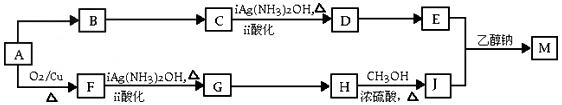
已知:①的分子式为C 5 H 8 O 4 ,能发生水解反应,核磁共振氢谱显示E分子内有2种不同环境的氢原子,其个数比为3:1。
②ROOCCH 2 COO +CH 2 =CHCOO
+CH 2 =CHCOO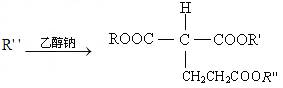
(R、  代表相同或不相同的烃基)
代表相同或不相同的烃基)
(1)A分子中的含氧官能团的名称是______________________。
(2)D→E反应的化学方程式是____________________。
(3)A→B反应所需的试剂是_______________。
(4)G→H反应的化学方程式是____________。
(5)已知1mol E与2 mol J反应生成1 mol M,则M的结构简式是___________。
(6)E的同分异构体有下列性质:
①能与NaHCO 3 反应生成CO 2 ;
②能发生水解反应,且水解产物之一能发生银镜反应,
则该同分异构体共有_____种,其中任意1种的结构简式是___________。
(7)J可合成高分子化合物,该高分子化合物结构简式是___________。 failurer1年前1
failurer1年前1 -
 hhong0516 共回答了25个问题
hhong0516 共回答了25个问题 |采纳率92%1年前查看全部
- 某+2价金属的氯化物,经测定知道含氯 52.59%,该金属元素是
 是终点还是起点1年前3
是终点还是起点1年前3 -
 kelvindollars8 共回答了25个问题
kelvindollars8 共回答了25个问题 |采纳率88%设金属M的相对原子质量为a
MCl2的相对分子质量为a+35.5×2=a+71
71÷(a+71)=52.59%
a=64
该金属元素是铜1年前查看全部
- 有含氯量为34.36%的标准样,某分析人员测得值为34.18%,计算绝对误差和相对误差.
有含氯量为34.36%的标准样,某分析人员测得值为34.18%,计算绝对误差和相对误差.
如题 4966528921年前1
4966528921年前1 -
 傅红雪杀鸡仔 共回答了15个问题
傅红雪杀鸡仔 共回答了15个问题 |采纳率80%绝对误差=|34.18%-34.36%|=0.18%
相对误差=|34.18-34.36|/34.36=0.52%1年前查看全部
- (1999•南通)下列含氯化合物中,氯元素的化合价最低的是( )
(1999•南通)下列含氯化合物中,氯元素的化合价最低的是( )
A.HClO4
B.KCl
C.NaClO
D.KClO3 SpiritBy1年前1
SpiritBy1年前1 -
 sane0108 共回答了20个问题
sane0108 共回答了20个问题 |采纳率85%解题思路:根据单质中元素的化合价为零;化合物中正负化合价的代数和为零,结合各选项中的化学式进行解答本题.A、HClO4,氢元素显+1,氧元素显-2,设HClO4中氯元素的化合价为x,(+1)+x+(-2)×4=0,解得x=+7.
B、KCl,钾元素显+1,设KCl中氯元素的化合价为x,则有(+1)+x=0,解得x=-1;
C、NaClO,钠元素显+1,氧元素显-2,设NaClO中氯元素的化合价为x,(+1)+x+(-2)=0,解得x=+1;
D、KClO3,钾元素显+1,氧元素显-2,设KClO3中氯元素的化合价为x,(+1)+x+(-2)×3=0,解得x=+5.
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力.1年前查看全部
- 钠23分别于氯35和氯37(氯元素的相对原子质量为35.5)构成的10g氯化钠中含氯37质量为多少,
钠23分别于氯35和氯37(氯元素的相对原子质量为35.5)构成的10g氯化钠中含氯37质量为多少,
感激毕竟 131488680301年前1
131488680301年前1 -
 猫猫宝贝爱吃鱼 共回答了21个问题
猫猫宝贝爱吃鱼 共回答了21个问题 |采纳率100%1.58119661年前查看全部
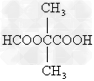
- 某有机物甲经氧化后得乙(分子式为C 2 H 3 O 2 Cl);而甲经水解可得丙,1mol丙和2mol乙反应得一种含氯的
某有机物甲经氧化后得乙(分子式为C 2 H 3 O 2 Cl);而甲经水解可得丙,1mol丙和2mol乙反应得一种含氯的酯(C 6 H 8 O 4 Cl 2 );由此推断甲的结构简式为 [ ]
A. ClCH 2 CH 2 OH
B. OHC-O-CH 2 -Cl
C. ClCH 2 CHO
D. HOCH 2 CH 2 OH hzxsj1691年前1
hzxsj1691年前1 -
 关平 共回答了22个问题
关平 共回答了22个问题 |采纳率86.4%C1年前查看全部
- GQXYZ均为含氯的化合物,在一定条件下具有如下转化关系
GQXYZ均为含氯的化合物,在一定条件下具有如下转化关系
1.G→Q+NaCl
2.Q+H20→X+H2↑
3.Y+NaOH→G+Q+HO
4.Z+NaOH→Q+X+H2O
判断氯的化合价由高到低的排列顺序
A .X Y Z G Q B .Y X Z G Q C .G Y Q Z X D.X Z Q Y G
【提示:氯的含氧的化合物一般氯的化合价为正价】
老师说是选D 可否解释下为什么 (还有其它选项) 163rwp1年前1
163rwp1年前1 -
 8825682 共回答了25个问题
8825682 共回答了25个问题 |采纳率88%由2可得X>Q 由4可得Z在Q与X之间,所以:X>Z>Q.
由1可得,Q>G,由3可得Y在G和Q之间,所以:Q>Y>G.
所以:X>Z>Q>Y>G.选D1年前查看全部
- 某+2价金属元素的氯化物汇中含氯64%,又知其原子核内质子数等于中子数,求该金属元素的相对原子质量及其氯化物的化学式
 羊咩咩20031年前1
羊咩咩20031年前1 -
 消失的鼠子 共回答了18个问题
消失的鼠子 共回答了18个问题 |采纳率83.3%M/71=36/64 解M=40 20号元素-CaCl21年前查看全部
大家在问
- 1△ABC三边长为a,b,c,满足条件a+b=c+4,ab=4c+8,试判断△ABC的形状.
- 2“我偶一抬头,望见了娘那带笑的黄油布似的脸,心里一酸,眼里涌出了眼泪……”表达了“我”怎样的感情?
- 3请选出下列句子中表达得体的一句[ ]A.某校学生会的科普小报征稿启事中说:“由于我们的思想水平有限,本报难免有缺点和错误
- 4简单英语questionsThe door is (1.open2.opens3.opened)选哪个the door
- 5初三英语12单元用所给词的适当形式填空1.It's very comfortable ______ (sleep) in
- 6规定的会议时间是十点半 用英语怎么翻译
- 7修一面长10米的墙,12天完成,平均每天修这面墙的几分之几?平均每天修几分之几米?
- 8第一题:小青蛙一次跳3厘米,它往前跳4次,一共跳了多少厘米?
- 9we'll have more free time to ____ around. we are going to __
- 10给出下列算式:3平方-1平方=8=8×1,5平方-3平方=16=8×2,7平方-5平方=24=8×3,9平方-7平方=3
- 11求函数y=tan(2x-[π/3]),x≠[5π/12+kπ2(k∈Z)
- 12读澳大利亚气候类型分布示意图,回答问题。 (1)图中沿120°E经线自南向北,气候类型依次是________、_____
- 13围绕“ways to communicate with each other”这一话题,写一篇80字左右的短文!
- 14(3y-2x)/4=(x+y)/3=(3x-y+1)/5的解题过程?
- 15甲容器中有百分之8的食盐水300千克,乙容器中有百分之12.5的食盐水120千克,往甲、乙两个容器中倒入等量的