以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是1.505×1023,则此时在阴极上析出铜的质量是( )
 44409162022-10-04 11:39:540条回答
44409162022-10-04 11:39:540条回答A.8g
B.16g
C.32g
D.64g

已提交,审核后显示!提交回复
共0条回复
相关推荐
- 如右图所示,a、b是两根石墨棒,下列叙述正确的是( )
如右图所示,a、b是两根石墨棒,下列叙述正确的是( )

A.a是正极,发生还原反应,b是阴极,发生还原反应 B.装置工作时,稀硫酸溶液中C(H + )变小、C(Cu 2+ )变大 C.往滤纸上滴加酚酞试液,a极附近颜色变红 D.稀硫酸中硫酸根离子的物质的量不变  今晨无风1年前1
今晨无风1年前1 -
 温顺小灰狼 共回答了10个问题
温顺小灰狼 共回答了10个问题 |采纳率90%D
铜、锌、稀硫酸形成原电池,锌做负极,铜做正极,b 和负极相连,b 是阴极,a 和正极相连,a 是阳极。故A 错误;
B.错误,装置工作时,氢离子在正极得电子,所以,稀硫酸溶液中C(H + )变小、没有Cu 2+ 。
C 错误,氯离子在a电极放电,往滤纸上滴加酚酞试液,a极附近颜色不变
D 正确,硫酸根离子不放电,所以,硫酸根离子的物质的量不变。1年前查看全部
- 如图甲、乙是电化学实验装置。 (1)若甲、乙两烧杯中均盛有饱和NaCl溶液。①甲中石墨棒上的电极反应式为 &
如图甲、乙是电化学实验装置。

(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl 2 氧化了生成的I 2 。若反应中Cl 2 和I 2 的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为: ;
(2)若甲、乙两烧杯中均盛有CuSO 4 溶液。
①甲中铁棒上的电极反应式为: ;
②如果起始时乙中盛有200 mL pH = 5的CuSO 4 溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。 wing6441年前1
wing6441年前1 -
 大熊猫儿 共回答了17个问题
大熊猫儿 共回答了17个问题 |采纳率76.5%(1)①O 2 +2H 2 O+4e - =4OH -
②2Cl - +2H 2 O 2OH - +H 2 ↑+Cl 2 ↑
2OH - +H 2 ↑+Cl 2 ↑
③5Cl 2 +I 2 +6H 2 O=10HCl+2HIO 3
(2)①Fe-2e - =Fe 2+
②CuO(或CuCO 3 ) 0.8(或1.24)
(1)若两烧杯中均盛有饱和NaCl溶液,则:
①甲装置为原电池,石墨棒作正极,O 2 放电,电极反应为:O 2 +2H 2 O+4e - =4OH - 。
②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为:2Cl - +2H 2 O Cl 2 ↑+H 2 ↑+2OH - 。③Cl 2 和I 2 的物质的量之比为5∶1,生成HCl和HIO 3 。
Cl 2 ↑+H 2 ↑+2OH - 。③Cl 2 和I 2 的物质的量之比为5∶1,生成HCl和HIO 3 。
(2)若两烧杯中均盛有CuSO 4 溶液,则:①甲装置为原电池,铁作负极,电极反应式为:Fe-2e - =Fe 2+ 。②乙装置为电解池,电解反应为:2CuSO 4 +2H 2 O 2Cu+2H 2 SO 4 +O 2 ↑,根据电解方程式,从电解质溶液中析出Cu,放出O 2 ,因此只需加入CuO(或CuCO 3 )即可恢复到电解前的状态。由电解反应式可知,2H + ~CuO~CuCO 3 ,电解后n(H + )=" 0.1×0.2" = 0.02(mol),故m(CuO)=0.02×
2Cu+2H 2 SO 4 +O 2 ↑,根据电解方程式,从电解质溶液中析出Cu,放出O 2 ,因此只需加入CuO(或CuCO 3 )即可恢复到电解前的状态。由电解反应式可知,2H + ~CuO~CuCO 3 ,电解后n(H + )=" 0.1×0.2" = 0.02(mol),故m(CuO)=0.02× ×80 = 0.8(g),m(CuCO 3 )=0.02×
×80 = 0.8(g),m(CuCO 3 )=0.02× ×124=1.24(g)
1年前查看全部
×124=1.24(g)
1年前查看全部
- 按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)
按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)

A.C 1 上发生还原反应 B.M 装置中SO 4 2 - 移向Cu电极 C.工作一段时间后装置M 中溶液pH变大,装置N中溶液pH变小 D.Cu电极与C 2 电极上的电极反应相同  阿东网络1年前1
阿东网络1年前1 -
 西北的冬夜 共回答了16个问题
西北的冬夜 共回答了16个问题 |采纳率75%CD
1年前查看全部
- 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )
 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )
如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )
A.锌片是负极
B.两个铜片上都发生氧化反应
C.石墨是阳极
D.两个蕃茄都形成原电池 lcn_wf1年前1
lcn_wf1年前1 -
 e0990 共回答了20个问题
e0990 共回答了20个问题 |采纳率85%解题思路:依据图装置分析可知铜和锌电极发生的是原电池反应,锌做负极,铜做正极;右装置是电解池,铜做电解池的阴极,碳做电解池的阳极;A、装置中依据活泼性差别判断,锌为原电池负极,故A正确;
B、原电池中铜电极上氢离子得电子发生还原反应,右装置是电解池,铜电极为阴极,阴极上阳离子得电子发生还原反应,故B错误;
C、石墨和原电池正极相连做电解池的阳极,故C正确;
D、左装置是原电池,右装置是电解池,故D错误;
故选AC.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池、电解池原理的分析应用,电极名称、电极判断、电极反应是解题关键,题目较简单.1年前查看全部
- 急求两根石墨棒与 CuCl2溶液组成原电池的正负极反应方程式
急求两根石墨棒与 CuCl2溶液组成原电池的正负极反应方程式
我也不清楚 就给了张图
叫你写一根碳棒上的电极反应 师大文氓1年前3
师大文氓1年前3 -
 赛诸葛1号 共回答了22个问题
赛诸葛1号 共回答了22个问题 |采纳率86.4%上面说的不错 石墨间没有电位差
电解的话就是:
- Cu2+ + 2e=Cu
+ 2Cl- - 2e=Cl21年前查看全部
- 图13-8中X是直流电源.两槽中c、d、e为石墨棒,f是铜棒,e、f两电极的质量相等.接通电路后,发现d附近显红色、③连

图13-8中X是直流电源.两槽中c、d、e为石墨棒,f是铜棒,e、f两电极的质量相等.接通电路后,发现d附近显红色、
③连接Y、Z槽线路中,电流的方向是d__________e(用“→”和“←”填空).
②若Y槽中溶液体积为500mL(电解后可视为不变),槽中电解反应的速率v(OH-)=____.
怎么判断阴,阳,正,负级. 违章man1年前1
违章man1年前1 -
 一点糖 共回答了18个问题
一点糖 共回答了18个问题 |采纳率88.9%③→
D显红色,D生成碱,氢离子变成氢气得到氢氧根,得到电子,所以是d是阴极,c是阳极,e是阳极,f是阴极
第二问条件不全,但是可以根据电子守恒来做:算出电子转移数,根据电极反应方程式计算即可1年前查看全部
- 如图甲、乙是电化学实验装置。 (1)若甲、乙两烧杯中均盛有NaCl溶液。①甲中石墨棒上的电极反应式为
如图甲、乙是电化学实验装置。

(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl 2 氧化了生成的I 2 。若反应中Cl 2 和I 2 的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为 。
(2)若甲、乙两烧杯中均盛有CuSO 4 溶液。
①甲中铁棒上的电极反应式为 ;
②乙中Fe电极是 (填阳极或阴极),总反应式是 ,
电解一段时间后溶液PH将 (填增大、减小或不变) 705天1年前1
705天1年前1 -
 Cervantes 共回答了19个问题
Cervantes 共回答了19个问题 |采纳率94.7%(1)①O 2 +4e - +2H 2 O=4OH - ② 2Cl - +2H 2 O=Cl 2 ↑+H 2 ↑+2OH - ③5 Cl 2 +I 2 +6H 2 O=10HCl+2HIO 3
(2)① Fe-2e-=Fe 2+ ②阴极,2CuSO 4 +2H 2 O=2Cu+O 2 ↑+2H 2 SO 4 ;减小
(1)甲为铁的吸氧腐蚀:正极:O 2 +4e - +2H 2 O=4OH - 负极:Fe-2e-=Fe 2+
乙是电解食盐水:2Cl - +2H 2 O=Cl 2 ↑+H 2 ↑+2OH -
(2)甲为原电池,铁为负极: Fe-2e-=Fe 2+ ;
乙为电解硫酸铜的电解池;铁为阴极,总反应为:2CuSO 4 +2H 2 O=2Cu+O 2 ↑+2H 2 SO 41年前
41年前查看全部
- 物质的性质决定物质的用途.下列物质的用途主要利用其化学性质的是 ( ) A.石墨棒作干电池电
物质的性质决定物质的用途.下列物质的用途主要利用其化学性质的是 ( ) A.石墨棒作干电池电
为什么是b 篓篓篱种荔枝1年前3
篓篓篱种荔枝1年前3 -
 steven929 共回答了22个问题
steven929 共回答了22个问题 |采纳率95.5%A 石墨棒作干电池是由于其原子之间存在着金属键 不是化学性质
石墨是混合型晶体 同时存在着共价键 金属键 分子间作用力1年前查看全部
- 按如图装置进行实验(N装置中两个电极均为石墨棒),下列描述正确的是( )
按如图装置进行实验(N装置中两个电极均为石墨棒),下列描述正确的是( )

A.a、b未连接时,装置N中C1电极上有气体析出
B.不论a、b是否连接,装置M中观察到的实验现象相同
C.a、b连接,工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小
D.a、b连接,装置M中若有0.1molSO42-移到Cu电极,装置N中C2极放出H22.24L(标准状况) haixuantan1年前1
haixuantan1年前1 -
 信我吧 共回答了15个问题
信我吧 共回答了15个问题 |采纳率86.7%解题思路:如果a、b连接时,左边装置是原电池,Zn易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,C1是阳极,电极反应式为OH--4e-=2H2O+O2↑,C2是阴极,电极反应式为2H++2e-=H2↑,
如果a、b不连接时,左边装置不能构成原电池,只有锌和稀硫酸发生置换反应,据此分析解答.A.a、b未连接时,装置N中不发生反应,故A错误;
B.a、b连接时,装置M中发生原电池反应,Cu作正极,有气体生成,a、b不连接时,锌和氢离子直接反应,接触面上析出气体,故B错误;
C.a、b连接,M是原电池,铜电极上氢离子放电生成氢气,导致溶液酸性减弱,N中电解水,导致硫酸浓度增大,所以工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小,故C正确;
D.a、b连接,M是原电池,所以装置M中若有0.1molSO42-移到Zn电极,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池原理,明确各个电极上发生的反应是解本题关键,知道电解质溶液中阴阳离子移动方向,题目难度不大.1年前查看全部
- 考试化学题,1 利用石墨棒和铁作电极溶液为NaCl写出电极总反应式 2 X与负极连接 Y与正极连接 都用石墨作电极电解5
考试化学题,
1 利用石墨棒和铁作电极溶液为NaCl写出电极总反应式 2 X与负极连接 Y与正极连接 都用石墨作电极电解500mL含CuSO4的1molLNaCL溶液,两极都得到11.2L气体,问X Y分别为什么极气体?电路通过电子多少mol? 超潜1年前1
超潜1年前1 -
 往事12345 共回答了19个问题
往事12345 共回答了19个问题 |采纳率94.7%1,2Cl(-)-2e=Cl2,2H(+)+2e=H2
2,X是H2,Y是Cl2
(11.2/22.4)*2=1mol电子1年前查看全部
- 以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极上析出铜的质量是( )
以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极上析出铜的质量是( )
A.8g
B.16g
C.32g
D.64g lueovun1年前1
lueovun1年前1 -
 le46499 共回答了17个问题
le46499 共回答了17个问题 |采纳率100%解题思路:电解氯化铜溶液时,阳极上氯离子失电子发生氧化反应生成氯气,阴极上铜离子得电子发生还原反应生成铜单质,根据转移电子与析出铜之间的关系式计算.电解氯化铜溶液时,阳极上氯离子失电子发生氧化反应生成氯气,阴极上铜离子得电子发生还原反应生成铜单质,所以阴极上的电极反应式为Cu2++2e-=Cu,设当有3.01×1023个电子转移时,在阴极上析出物质的质量为x.
Cu2++2e-=Cu
2×6.02×1023 64g
3.01×1023 x
所以x=16g,即析出铜的质量为16g,
故选B.点评:
本题考点: 电解原理.
考点点评: 本题以电解原理为载体考查了阿伏伽德罗常数的有关计算,难度不大,明确溶液中离子的放电顺序是解本题的关键,然后根据转移电子与析出金属质量之间的关系计算即可.1年前查看全部
- 化学,高二题目,石墨棒和铁做电极电解……
化学,高二题目,石墨棒和铁做电极电解……
利用石墨棒和铁作电极设计成如图的装置(图是从网上找了个类似的,我自己改了一下)
里面是NaCl溶液,溶液表面滴有几滴苯,实验开始时,同时在两边各滴入几滴酚酞溶液
一段时间后左边的电极附近可看到______________________________
电池总反应式________________________________________________
我觉得第一个空应该就是变红吧
苯是什么作用?
阴阳电极的反应有哪些?
Fe会反应么??
给过程哦
谢谢啦最后到底是氢氧化亚铁还是氯化亚铁呢……

 ymtlc1年前3
ymtlc1年前3 -
 小冰哥哥 共回答了22个问题
小冰哥哥 共回答了22个问题 |采纳率81.8%你的铁是连在电池正极吧,如果是的话,左边应该会产生无色气泡(氢气),并且溶液会变红。
总反应式:Fe+2H2O=Fe(OH)2↓+H2↑(注意表明反应条件为电解) 其实这是一个很简单反应,只不过平常条件下不会发生,这里通过电解的方法使它进行,氯化钠只是起电解质的作用,来增强导电能力。铁做阳极失去两个电子变成亚铁离子(电解时铁不会被氧化成正三价),水电离出的氢离子在阴极得电子生成氢气,溶液中氢氧根浓度逐渐增大,和亚铁离子产生沉淀。本质上就是水和铁的置换反应。
这里苯隔绝了空气,从而是氢氧化亚铁不会被氧化。如果没有苯的话,你会发现,产生的白色沉淀迅速变成灰绿色,最终变成红褐色。
高中化学问题可以在百度Hi问我1年前查看全部
- 原电池的化学式疑问例如:锌,石墨棒为两极,硫酸铜溶液为电解液组成的原电池.正极反应式是Cu2+ +2e- ==Cu 负极
原电池的化学式疑问
例如:锌,石墨棒为两极,硫酸铜溶液为电解液组成的原电池.正极反应式是Cu2+ +2e- ==Cu 负极反应式是Zn2+ - 2e-===Zn2+
为什么正极的反应式不是石墨棒+离子而是铜+离子呢?我就是搞不明白有时候为什么正极反应时的反应物是电解质溶液中的物质参与而不是正极的反应参与?
为什么正极的反应式不是石墨棒+离子而是铜+离子呢?我就是搞不明白有时候为什么正极反应时的反应物是电解质溶液中的物质参与而不是正极的反应物参与? sunfai1年前3
sunfai1年前3 -
 78nba 共回答了16个问题
78nba 共回答了16个问题 |采纳率75%原电池放电反应,负极是要失电子的,你应该知道电池的话,电流是由正到负,所以电子就是由负极到正极了.
所以负极所用的导体要比正极的化学性质活泼,这样才能是负极失电子.
还有不明白的,可以问我.
这个,我表达能力不是很好 - -、1年前查看全部
- 如右图所示,a、b是两根石墨棒.下列叙述正确的是
 爱上玫瑰普洱茶1年前3
爱上玫瑰普洱茶1年前3 -
 chenga2004 共回答了16个问题
chenga2004 共回答了16个问题 |采纳率87.5%铜锌和稀硫酸构成原电池,由于锌的金属性强于铜
则锌做负极,锌失去电子变成锌离子;
铜做正极,硫酸的氢离子得到电子变成氢气.
负极连接阴极;正极连接阳极.
则a为阴极;b为阳极.故A、B均错误.
铜锌原电池,实质反应为锌和硫酸的氢离子反应,得到硫酸锌和氢气
硫酸根离子的浓度几乎不发生变化,故C错误.
右端为电解池,实质为点解氯化钠溶液
a为阴极,阳离子放电,为水的氢离子放电变成氢气
由于水的氢离子大量放电,氢氧根离子浓度大大增加,则加入酚酞变红.
故D正确
b为阳极,阴离子放电,为氯化钠的氯离子放电变成氯气
答案:D1年前查看全部
- 以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×10 23 ,则此时在阴极上析出铜的质量是( ) A.
以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×10 23 ,则此时在阴极上析出铜的质量是( ) A.8g B.16g C.32g D.64g  可疑的kk1年前1
可疑的kk1年前1 -
 起跑地平线 共回答了17个问题
起跑地平线 共回答了17个问题 |采纳率76.5%电解氯化铜溶液时,阳极上氯离子失电子发生氧化反应生成氯气,阴极上铜离子得电子发生还原反应生成铜单质,所以阴极上的电极反应式为Cu 2+ +2e - =Cu,设当有3.01×10 23 个电子转移时,在阴极上析出物质的质量为x.
Cu 2+ +2e - =Cu
2×6.02×10 23 64g
3.01×10 23 x
所以x=16g,即析出铜的质量为16g,
故选B.1年前查看全部
- 利用石墨棒 锌片 和200mL的稀硫酸组成原电池 将化学能转化成机器能 当石墨棒上产生3.36L(标况
利用石墨棒 锌片 和200mL的稀硫酸组成原电池 将化学能转化成机器能 当石墨棒上产生3.36L(标况 气体时 硫酸恰好完全耗尽
1.有多少个电子通过了导线
2.求原稀硫酸的物质的量 丹丹爱宁洋1年前4
丹丹爱宁洋1年前4 -
 李四通八达 共回答了13个问题
李四通八达 共回答了13个问题 |采纳率92.3%1.氢气是0.15摩尔,所以应该是有0.3摩尔氢离子得到了0.3摩尔电子,电子数为6.02×10^23×0.3个.
2.硫酸的物质的量应该与产生的氢气的物质的量相等.1年前查看全部
- 下列各组的电极材料和电解液,不能组成原电池的是( ) A.铜片、石墨棒,蔗糖溶液 B.锌片、石墨棒,硫酸铜溶液 C.锌
下列各组的电极材料和电解液,不能组成原电池的是( ) A.铜片、石墨棒,蔗糖溶液 B.锌片、石墨棒,硫酸铜溶液 C.锌片、铜片,稀盐酸 D.铜片、银片,硝酸银溶液  loongloongaway1年前1
loongloongaway1年前1 -
 bianaoke 共回答了14个问题
bianaoke 共回答了14个问题 |采纳率78.6%A、蔗糖溶液不是电解质溶液,故A错误.
B、符合原电池的构成条件,故B正确.
C、符合原电池的构成条件,故C正确.
D、符合原电池的构成条件,故D正确.
故选A1年前查看全部
- 下列物质导电性最差的是?一、熔融的氢氧化钠 二、石墨棒 三
下列物质导电性最差的是?一、熔融的氢氧化钠 二、石墨棒 三
下列物质导电性最差的是?
一、熔融的氢氧化钠
二、石墨棒
三、盐酸溶液
四、固态氢氧化钠 丹心一片照酒精1年前5
丹心一片照酒精1年前5 -
 流星_贤 共回答了17个问题
流星_贤 共回答了17个问题 |采纳率88.2%熔融的氢氧化钠、石墨棒、盐酸溶液均能导电,而固态氢氧化钠中的离子不能自由移动,所以不导电.盐的晶体中离子被静电作用束缚不能自由移动而不导电是易忽视的知识点
故选四1年前查看全部
- 原电池正极怎么会发生吸氧腐蚀?将铁棒和石墨棒用导线连接放到氯化钠水溶液中,不应该是构成原电池吗?负极 铁棒 Fe-2e`
原电池正极怎么会发生吸氧腐蚀?
将铁棒和石墨棒用导线连接放到氯化钠水溶液中,不应该是构成原电池吗?
负极 铁棒 Fe-2e`=Fe 2+
正极 石墨 2H+ + 2e`=H2
不对吗?为什么答案上给的是石墨发生吸氧腐蚀? 盈盈m_m笑语1年前2
盈盈m_m笑语1年前2 -
 韵星 共回答了26个问题
韵星 共回答了26个问题 |采纳率92.3%氯化钠溶液是中性溶液,H+极少(约10^-7mol/L,十的负七次方 摩尔每升),不足以发生析氢腐蚀.1年前查看全部
- 如图所示,在研究电源电动势与内、外电压关系的实验装置中,玻璃容器盛有稀硫酸,稀硫酸中插入石墨棒M、锌棒N作为电源的两极。
如图所示,在研究电源电动势与内、外电压关系的实验装置中,玻璃容器盛有稀硫酸,稀硫酸中插入石墨棒M、锌棒N作为电源的两极。A、B是位于两电极内侧的探针,理想电压表V 1 、V 2 分别接在电源的两极和探针上,下列说法正确的是 ()

A.M极为电源正极,电压表V 2 的正接线柱应与探针B相连
B.当滑动变阻器触头向左移动时,电压表V 1 、V 2 的示数均减小
C.当滑动变阻器触头向左移动时,电源提供的总功率不变,滑动变阻器电功率一定减小
D.无论滑动变阻器触头向右还是向左移动,滑动变阻器上通过相同的电量时,电源消耗的化学能相等 紫梦之兵1年前1
紫梦之兵1年前1 -
 钰·蝴蝶 共回答了15个问题
钰·蝴蝶 共回答了15个问题 |采纳率80%1年前查看全部
- 铁棒与石墨棒用导线连接后浸入0.01mol•L -1 的食盐溶液中,可能出现的现象是( ) A.铁棒附近产生OH -
铁棒与石墨棒用导线连接后浸入0.01mol•L -1 的食盐溶液中,可能出现的现象是( ) A.铁棒附近产生OH - B.铁棒逐渐被腐蚀 C.石墨棒上放出Cl 2 D.石墨棒上放出O 2  夏夜之荧1年前1
夏夜之荧1年前1 -
 爱上柠檬 共回答了14个问题
爱上柠檬 共回答了14个问题 |采纳率100%铁棒与石墨棒用导线连接后浸入0.01mol•L -1 的食盐溶液中,构成原电池,Fe为负极,石墨为正极,发生吸氧腐蚀,
A.正极上产生OH - ,故A错误;
B.Fe为负极,失去电子而逐渐被腐蚀,故B正确;
C.氯离子不放电,不会产生氯气,故C错误;
D.石墨棒上氧气得电子生成OH - ,故D错误;
故选B.1年前查看全部
- 以石墨棒作正电极,电解氯化铜溶液,若电解是转移的电子数是6.02*10^23,则此时在阴极析出的铜的质量是?
以石墨棒作正电极,电解氯化铜溶液,若电解是转移的电子数是6.02*10^23,则此时在阴极析出的铜的质量是?
如何从电子的数量计算到物质的量?要具体步骤,不要只一个答案给我. 学习借鉴1年前3
学习借鉴1年前3 -
 shinyyou 共回答了23个问题
shinyyou 共回答了23个问题 |采纳率91.3%转移的电子数是6.02*10^23,也就是1mol
因为析出的铜的反应式为Cu2++2e-=Cu
所以生成的Cu和电子的关系是1:2
所以析出铜0.5mol 既32g
根据N=Na*n(N是电子的数量,Na是1mol粒子的数量,n是摩尔数)1年前查看全部
- 下列用品中,通常情况下属于绝缘体的是( ) A.铁棒 B.石墨棒 C.玻璃杯 D.盐水
 ff76811年前1
ff76811年前1 -
 传说中的帆帆 共回答了18个问题
传说中的帆帆 共回答了18个问题 |采纳率100%铁棒、石墨棒、盐水是导体.
玻璃杯是绝缘体.
故选C.1年前查看全部
- 石墨棒与铜棒用导线连接后插入浓硝酸溶液中,并加热溶液,能否形成原电池?
 ee牙舌屈1年前3
ee牙舌屈1年前3 -
 义箐 共回答了17个问题
义箐 共回答了17个问题 |采纳率88.2%能.符合原电池结构的基本要求:
1、不同的两个电极
2、电解质溶液
3、能自发进行的氧化还原反应
4、闭合回路,导线连接
总反应是:Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Cu是负极,电极反应是:Cu - 2e- = Cu2+
石墨是正极,电极反应是:4H+ + 2NO3^- + 2e- = 2NO2 + 2H2O1年前查看全部
- 如图所示,将铁棒和石墨棒擦入1 L 1 mol•L-1食盐水中.下列说法正确的是( )
如图所示,将铁棒和石墨棒擦入1 l 1 mol•l-1食盐水中.下列说法正确的是( )
 a. 若电键k与n连接,铁被保护不会腐蚀
a. 若电键k与n连接,铁被保护不会腐蚀
b. 若电键k与n连接,正极反应式是4oh--4e-=2h2o+o2↑
c. 若电键k与m连接,将石墨棒换成铜棒,可实现铁棒上镀铜
d. 若电键k与m连接,当两极***生28 l(标准状况)体时,生成了1 mol naoh wskyygtuu1年前1
wskyygtuu1年前1 -
 c34532ee55133136 共回答了18个问题
c34532ee55133136 共回答了18个问题 |采纳率88.9%解题思路:若电键K与N连接,该装置构成了原电池,较活泼的金属铁作负极,负极上铁失电子发生氧化反应,石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应;
若电键K与M连接,该装置是电解池,碳作阳极,铁作阴极,阳极上氯离子放电,阴极上氢离子放电.A、若电键K与N连接,该装置构成了原电池,较活泼的金属铁作负极而加速被腐蚀,故A错误.B、若电键K与N连接,该装置构成了原电池,不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2...
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池原理,明确电极上发生的反应是解本题关键,注意电解池中阳极如果是活泼电极发生的电极反应,为易错点.1年前查看全部
- 下列物质的用途与其化学性质相关的是 A.干冰用于人工降雨 B.石墨棒作干电池电极 C.用二氧化碳作温室气体肥料
下列物质的用途与其化学性质相关的是
A.干冰用于人工降雨 B.石墨棒作干电池电极 C.用二氧化碳作温室气体肥料 D.铜用于制造导线  bbbt1年前1
bbbt1年前1 -
 周佳逸 共回答了19个问题
周佳逸 共回答了19个问题 |采纳率84.2%C
A、干冰用于人工降雨,是利用干冰升华降温,使水蒸气冷凝成雨水,没有新物质生成,所以干冰升华属于物理性质,与化学性质无关;
B、石墨可用作干电池的电极,利用石墨的导电性,为物理性质,与化学性质无关;
C、用二氧化碳作温室气体肥料是利用了二氧化碳的化学性质--能和水反应生成有机物.
D、用铜做导线是利用铜的导电性,属于物理性质,与化学性质无关.
故选C.1年前查看全部
- 如图为原电池装置示意图:(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A电极名称为______,写出正极的电极反应
 如图为原电池装置示意图:
如图为原电池装置示意图:
(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A电极名称为______,写出正极的电极反应式______.
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为______极(填正或负),写出电极反应式:正极______,负极______.
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的______极(填正或负),该电池的总反应为:______. huang29289171年前1
huang29289171年前1 -
 空谷兰545 共回答了17个问题
空谷兰545 共回答了17个问题 |采纳率88.2%解题思路:(1)根据得失电子判断正负极并写出电极反应式;
(2)根据得失电子判断正负极并写出电极反应式;
(3)根据得失电子判断正负极并写出电极反应式,电极反应式相加得电池反应式.(1)该原电池中,锌失电子变成离子进入溶液,所以锌极即A极为负极,石墨为正极,正极上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑.
故答案为:负极;2H++2e-=H2↑;
(2)该原电池中,铁片失电子变成二价铁离子进入溶液,电极反应式为 Fe-2e-=Fe2+;所以铁片作负极,铜片作正极,正极上三价铁离子得电子生成二价铁离子,
电极反应式为2Fe3++2 e-=2Fe2+,故答案为:正;2Fe3++2 e-=2Fe2+;Fe-2e-=Fe2+;
(3)在原电池中失电子的一极为负极,得电子的一极为正极,在氢氧燃料电池中,氧气得电子,所以通入氧气的一极为该电池的正极;氢气和氧气反应生成水,
所以电池反应式为2H2+O2=2H2O,故答案为:正;2H2+O2=2H2O.点评:
本题考点: 原电池和电解池的工作原理;电极反应和电池反应方程式.
考点点评: 本题考查了原电池的正负极的判断及电极反应式的书写等知识点,写电极反应式时要注意电解质溶液的成分,电解质溶液不同,电极反应式可能不同,如氢氧燃料电池中电解质为酸或碱时,电极反应式就不同.1年前查看全部
- (14分)按下图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象。
(14分)按下图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象。

(1)接电源负极的石墨棒上现象 电极反应为
(2)接电源正极的石墨棒上现象, 电极反应为
电解反应的化学方程式
(3)在上述电解反应中,被氧化的物质是 离子
(4)如何验证阳极产生的气体: q3691年前1
q3691年前1 -
 天狼星使 共回答了16个问题
天狼星使 共回答了16个问题 |采纳率93.8%1年前查看全部
- 为什么铁棒是阴极?石墨棒是阳极?阴极产生的是什么气体额?
为什么铁棒是阴极?石墨棒是阳极?阴极产生的是什么气体额?
为什么阴极产生氢气额?

 yrrr1年前3
yrrr1年前3 -
 tyxinjiang 共回答了18个问题
tyxinjiang 共回答了18个问题 |采纳率83.3%1.为什么铁棒是阴极?石墨棒是阳极
其实因为电源正极连着石墨 石墨就是阳极
(也可以反过来接 不过金属Fe作阳极会溶解 Fe发生氧化反应)
2.阴极产生的是什么气体额
产生的是H2(阴极区还有NaOH aq)
因为阴极是释放出电子的 H+要得电子
(也可以理解为阴极带-电 H+带+电 正负吸引)1年前查看全部
- 将两个石墨棒与直流电源的两极相连并插入氯化铜溶液中,现象?原因?
将两个石墨棒与直流电源的两极相连并插入氯化铜溶液中,现象?原因?
请问其中的电子从哪里来 yimei8111年前3
yimei8111年前3 -
 皮拉鲁 共回答了17个问题
皮拉鲁 共回答了17个问题 |采纳率82.4%这是个电解池
1.在惰性电极中 阳极:阴离子的移动方向Cl— -2e—=Cl2
阴极:阳离子移动的方向Cu2+ +2e—=Cu1年前查看全部
- 按图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )
按图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )

A.C1上发生还原反应
B.M装置中SO42-移向Cu电极
C.工作一段时间后装置M、N中溶液PH均变大
D.Cu电极与C2电极上的电极反应相同 我不用联通1年前1
我不用联通1年前1 -
 carmen8383 共回答了15个问题
carmen8383 共回答了15个问题 |采纳率100%解题思路:由图可知,M构成原电池,Zn为负极,Cu为正极;N为电解池,C1为阳极,C2为阴极,结合电极反应及原电池反应、电解反应来解答.A.N为电解池,C1为阳极,发生氧化反应,故A错误;
B.M构成原电池,Zn为负极,则SO42-移向Zn电极,故B错误;
C.M中发生Zn+2H+═Zn2++H2↑,N装置中两个电极均为石墨棒,N中发生2H2O
电解
.
2H2↑+O2↑,则一段时间后装置M中溶液pH变大,装置N中溶液pH变小,故C错误;
D.Cu电极与C2电极上的电极反应均为氢离子发生的还原反应,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池及电解原理,明确装置是解答本题的关键,并熟悉工作原理及电极反应来解答,题目难度不大.1年前查看全部
- 铁和石墨棒做电极,电解质溶液是氯化钠所构成的原电池,电极反应式怎么写?
 幽谷睡莲1年前1
幽谷睡莲1年前1 -
 zflfly 共回答了17个问题
zflfly 共回答了17个问题 |采纳率94.1%正极材料:石墨
负极材料:铁
负极反应式:Fe-2e-=Fe2+
正极反应式:O2+2H2O+4e-=4OH-1年前查看全部
- (2011•焦作一模)如图所示,将铁棒和石墨棒插入1 L 1 mol•L-1食盐水中.下列
 (2011•焦作一模)如图所示,将铁棒和石墨棒插入1 l 1 mol•l-1食盐水中.下列说法正确的是( )
(2011•焦作一模)如图所示,将铁棒和石墨棒插入1 l 1 mol•l-1食盐水中.下列说法正确的是( )
a.若电键k与n连接,铁被保护不会腐蚀
b.若电键k与n连接,正极反应式是4oh--4e-=2h2o+o2↑
c.若电键k与m连接,若在溶液中滴入酚酞试液,则在石墨棒附近先出现红色
d.若电键k与m连接,当两极***生28 l(标准状况)气体时,生成了1 mol naoh wj228wj1年前1
wj228wj1年前1 -
 狗不理饺子 共回答了23个问题
狗不理饺子 共回答了23个问题 |采纳率82.6%解题思路:若电键K与N连接,该装置没有外接电源,所以构成了原电池;组成原电池时,较活泼的金属铁作负极,负极上铁失电子发生氧化反应;石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应.若电键K与N连接,该装置没有外接电源,所以构成了原电池.
A、若电键K与N连接,该装置没有外接电源,所以构成了原电池;较活泼的金属铁作负极,负极上铁失电子生成二价铁离子进入溶液,所以铁不被保护,故A错误.
B、若电键K与N连接,该装置没有外接电源,所以构成了原电池;不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,故B错误.
C、若电键K与M连接,该装置是电解池,碳棒作阳极,铁棒作阴极,碳棒上氯离子放电生成氯气,铁棒上氢离子放电生成氢气,铁棒附近生成氢氧化钠,所以铁棒附近先出现红色,故C错误.
D、若电键K与M连接,该装置构成电解池,碳棒作阳极,铁棒作阴极,根据钠原子守恒得生成的n(NaOH)=n(NaCl)=1mol,根据2NaCl+2H2O
电解
.
H2↑+Cl2↑+2NaOH知,生成1mol氯化钠时生成氯气和氢气的体积之和为22.4L<28L,所以生成的气体中还有一部分氧气,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,难度不大,能正确分析吸氧腐蚀的电极反应是解本题的关键.1年前查看全部
- 两个化学问题(焓变与原电池)反应热就是焓变,不对请说明两者关系.将铁片与石墨棒插入食盐水中,并用盐桥连接,是否能形成原电
两个化学问题(焓变与原电池)
反应热就是焓变,不对请说明两者关系.
将铁片与石墨棒插入食盐水中,并用盐桥连接,是否能形成原电池?如果不能,其系统符合原电池形成条件,且产生了微弱电流,为什么不行? jordeng20001年前3
jordeng20001年前3 -
 yyyy326303 共回答了15个问题
yyyy326303 共回答了15个问题 |采纳率80%等压条件下的 反应热等于焓变.
等容条件,高中不学,也不用管.
高中就认为,焓变等同于热效应就行了.
放热:焓变 = 反应热 < 0
吸热:焓变 = 反应热 > 0
可以形成原电池
负极:Fe-2e-=Fe2+
正极:O2+2H2O+4e-=4OH-1年前查看全部
- 电解池 铁棒和石墨棒用导线连接后,浸入滴有几滴酚酞的试液的食盐溶液中,则可能出现的现象是( )A.铁棒附近溶液变红B.铁
电解池
铁棒和石墨棒用导线连接后,浸入滴有几滴酚酞的试液的食盐溶液中,则可能出现的现象是( )
A.铁棒附近溶液变红
B.铁棒逐渐被腐蚀
C.石墨棒上放出黄绿色气体
D.始末棒上放出无色气体 luohaijun91年前3
luohaijun91年前3 -
 火爆不息 共回答了15个问题
火爆不息 共回答了15个问题 |采纳率80%解
这道题涉及到的问题是电解池的问题
做这种题的时候要先判断哪个材料做阳极哪个材料做阴极,因为如果是活泼金属做阳极的时候,活泼金属反映.但是如果是惰性材料做阳极,金属做阴极的时候,金属就不能参加反映了.所以在这到题中,不知道是否是铁做阳极,这到题是不是还有个图.
但是根据你所选的答案B来看,这里的铁是做阳极的,即在阳极上Fe-2e-=Fe2+ ,在阴极上2H+ +2e-=H2,所以阴极上氢氧根多,所以显碱性,所以A错,因该是石墨棒附近溶液变红,因为阳极上Fe-2e-=Fe2+,所以铁棒逐渐被腐蚀B正确.在阴极上2H+ +2e-=H2,氢气是无色的,所以C错.但是不会始末棒上放出无色气体,因为开始和结束会随着反映物的增加或减少而改变
我想你可能还会有疑问,如果是铁做阴极会发生怎么样的反映呢?那么阳极是2Cl--2e-=Cl2,阴极即2H+ +2e-=H2,那么如果是这种情况的话因选AC1年前查看全部
- (1)以锌、石墨棒为两极,硫酸铜溶液为电解液组成的原电池。
(1)以锌、石墨棒为两极,硫酸铜溶液为电解液组成的原电池。
负极反应式是:______________;正极反应式是:______________
(2)某反应是吸热反应,且所吸收的热能由外部热源(如酒精灯)提供,提供的热能主要起到______________的作用。
(3)利用下列反应:Fe + 2Fe 3+ = 3Fe 2+ 制一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,写出电极反应式。①
②_______是负极,负极反应式:_____________________
③_______是正极,正极反应式:_____________________ wintel_wangsir1年前1
wintel_wangsir1年前1 -
 风语者1120 共回答了14个问题
风语者1120 共回答了14个问题 |采纳率92.9%1年前查看全部
- 铁棒与石墨棒用导线连接后浸入0.01mol•L-1的食盐溶液中,可能出现的现象是( )
铁棒与石墨棒用导线连接后浸入0.01mol•L-1的食盐溶液中,可能出现的现象是( )
A. 铁棒附近产生OH-
B. 铁棒逐渐被腐蚀
C. 石墨棒上放出Cl2
D. 石墨棒上放出O2 天天月81年前3
天天月81年前3 -
 科利昂 共回答了13个问题
科利昂 共回答了13个问题 |采纳率100%解题思路:铁棒与石墨棒用导线连接后浸入0.01mol•L-1的食盐溶液中,构成原电池,Fe为负极,石墨为正极,发生吸氧腐蚀,以此来解答.铁棒与石墨棒用导线连接后浸入0.01mol•L-1的食盐溶液中,构成原电池,Fe为负极,石墨为正极,发生吸氧腐蚀,
A.正极上产生OH-,故A错误;
B.Fe为负极,失去电子而逐渐被腐蚀,故B正确;
C.氯离子不放电,不会产生氯气,故C错误;
D.石墨棒上氧气得电子生成OH-,故D错误;
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和吸氧腐蚀,明确电极的判断及发生的电极反应即可解答,题目难度不大.1年前查看全部
- 下列各组的电极材料和电解液,不能组成原电池的是( ) A.铜片、石墨棒,蔗糖溶液 B.锌片、石墨棒,硫酸铜溶液 C.锌
下列各组的电极材料和电解液,不能组成原电池的是( ) A.铜片、石墨棒,蔗糖溶液 B.锌片、石墨棒,硫酸铜溶液 C.锌片、铜片,稀盐酸 D.铜片、银片,硝酸银溶液  从来不响的铃1年前1
从来不响的铃1年前1 -
 对不起我很爱你 共回答了26个问题
对不起我很爱你 共回答了26个问题 |采纳率92.3%A、蔗糖溶液不是电解质溶液,故A错误.
B、符合原电池的构成条件,故B正确.
C、符合原电池的构成条件,故C正确.
D、符合原电池的构成条件,故D正确.
故选A1年前查看全部
- 铁和氯化铁溶液和石墨棒可以组成原电池吗?
 红枣莲子1年前1
红枣莲子1年前1 -
 zhengkidd 共回答了20个问题
zhengkidd 共回答了20个问题 |采纳率90%可以,铁能和氯化铁发生氧化还原反应.
Fe+2FeCl3=3FeCl2
拆成正负极反应
Fe-2e-=Fe2-
Fe3++e-=Fe2+1年前查看全部
- 下列物质中导电性最差的是( ) A.石墨棒 B.固态氯化钾 C.熔融氢
下列物质中导电性最差的是( ) A.石墨棒 B.固态氯化钾 C.熔融氢
下列物质中导电性最差的是( ) A.石墨棒 B.固态氯化钾 C.熔融氢氧化钠 D.盐酸 ,选择哪一项?为什么? 2aatb1年前3
2aatb1年前3 -
 骑着猪跑 共回答了19个问题
骑着猪跑 共回答了19个问题 |采纳率84.2%我觉得选b吧,因为氯化钾是离子化合物,离子化合物固体时不导电,融化时导电,水溶液导电1年前查看全部
- 下列物质导电性最差的是?一、熔融的氢氧化钠 二、石墨棒 三、盐酸
下列物质导电性最差的是?一、熔融的氢氧化钠 二、石墨棒 三、盐酸
下列物质导电性最差的是?
一、熔融的氢氧化钠
二、石墨棒
三、盐酸溶液
四、固态氢氧化钠 nalizi1年前2
nalizi1年前2 -
 fanyl00 共回答了20个问题
fanyl00 共回答了20个问题 |采纳率90%应该是固体氢氧化钠,因为固体氢氧化钠中虽有阴阳离子,但离子不能自由移动,不能导电.1年前查看全部
- 知道 > 已解决 锌锰干电池中炭黑什么作用?锌锰干电池在石墨棒周围填充NH4Cl和淀粉糊,...
知道 > 已解决 锌锰干电池中炭黑什么作用?锌锰干电池在石墨棒周围填充NH4Cl和淀粉糊,...
知道 >
已解决
锌锰干电池中炭黑什么作用?
锌锰干电池在石墨棒周围填充NH4Cl和淀粉糊,还填有MnO2糊和炭黑,NH4Cl是正极,淀粉糊提供离子通道,MnO2糊吸收NH3,那炭黑什么作用?
MnO2糊吸收H2
湘茫幽梦2011-4-10
相当于原电池的正极
干电池是以碳棒为正极,锌为负极
干电池内有点解液,
负极中金属失去电子,流到碳棒,由于碳棒有负电子,因此会吸引电解液中的正电子,故会聚集正电子.负极中金属失电子,形成金属阳离子,与电解液中的负离子结合.
与电解液中的负离子结合还是与电解液中的阴离子结合. xcfdfdfdfdf1年前1
xcfdfdfdfdf1年前1 -
 pfr1988 共回答了17个问题
pfr1988 共回答了17个问题 |采纳率64.7%我靠!干电池里有正电子?
炭黑,有很大的表面积和催化活性,在干电池里,用于把电子塞到铵根离子里面,维持外界的电流通路.1年前查看全部
- 比较硬度的大小取日常生活中的一些物品:玻璃、刀片、钢锯条、大理石、瓷砖、砖块、硫酸铜晶体、石墨棒、钥匙、砂轮、有机玻璃等
比较硬度的大小
取日常生活中的一些物品:玻璃、刀片、钢锯条、大理石、瓷砖、砖块、硫酸铜晶体、石墨棒、钥匙、砂轮、有机玻璃等相互刻划,比较它们硬度的大小. 岳洁1年前2
岳洁1年前2 -
 贴心设计的 共回答了20个问题
贴心设计的 共回答了20个问题 |采纳率95%两两互相刻划,划痕深的硬度就大.这是比较简单方便的方法.1年前查看全部
- 铁棒与石墨棒用导线连接后浸入0.01mol•L-1的食盐溶液中,可能出现的现象是( )
铁棒与石墨棒用导线连接后浸入0.01mol•L-1的食盐溶液中,可能出现的现象是( )
A. 铁棒附近产生OH-
B. 铁棒逐渐被腐蚀
C. 石墨棒上放出Cl2
D. 石墨棒上放出O2 seven的hyfy1年前1
seven的hyfy1年前1 -
 朝琴穆楚 共回答了17个问题
朝琴穆楚 共回答了17个问题 |采纳率100%解题思路:铁棒与石墨棒用导线连接后浸入0.01mol•L-1的食盐溶液中,构成原电池,Fe为负极,石墨为正极,发生吸氧腐蚀,以此来解答.铁棒与石墨棒用导线连接后浸入0.01mol•L-1的食盐溶液中,构成原电池,Fe为负极,石墨为正极,发生吸氧腐蚀,
A.正极上产生OH-,故A错误;
B.Fe为负极,失去电子而逐渐被腐蚀,故B正确;
C.氯离子不放电,不会产生氯气,故C错误;
D.石墨棒上氧气得电子生成OH-,故D错误;
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和吸氧腐蚀,明确电极的判断及发生的电极反应即可解答,题目难度不大.1年前查看全部
- 铁和石墨棒做电极,电解质溶液是氯化钠所构成的原电池,电极反应式怎么写?
 lzchengneng1年前2
lzchengneng1年前2 -
 广东青少 共回答了15个问题
广东青少 共回答了15个问题 |采纳率100%这个不一定,请你告诉我铁是阳极还是阴极 .在线等你1年前查看全部
- 把金属A与石墨连线后 插入含金属离子B+和C+的混合溶液中 若在石墨棒上只析出单质B 而不析出单质C 则ABC的金属活泼
把金属A与石墨连线后 插入含金属离子B+和C+的混合溶液中 若在石墨棒上只析出单质B 而不析出单质C 则ABC的金属活泼性是C大于A大于B
为毛? 苦咖啡891568861年前1
苦咖啡891568861年前1 -
 醴陵64 共回答了17个问题
醴陵64 共回答了17个问题 |采纳率88.2%因为金属A与石墨构成原电池,所以A可以使比自己稳定的金属析出在石墨上.
因为石墨棒上只析出单质B 而不析出单质C ,所以活性是C大于A大于B.
又因为金属A是固体,因此不存在不足的情况.1年前查看全部
- 如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题:
(1)若两池中均为CuSO 4 溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒,乙池中的______棒.
②乙池中阳极的电极反应式是______.
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______.
②甲池中石墨电极上的电极反应属于______(填“氧化反应”或“还原反应”).
③将湿润的KI淀粉试纸放在乙池石墨电极附近,发现试纸变蓝,反应的化学方程式为______.
④若乙池转移0.02mole - 后停止实验,池中溶液体积是200mL,则溶液混合匀后的pH=______.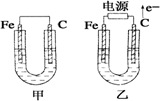
 月-明1年前1
月-明1年前1 -
 laoha 共回答了18个问题
laoha 共回答了18个问题 |采纳率83.3%(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,外电路电子流向电源正极,所以碳棒为阳极,放出氯气,阴极铁电极上发生还原反应有Cu析出,
故答案为:碳;铁;
②乙池中,惰性电极为阳极,电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH - -4e - =2H 2 O+O 2 ↑,故答案为:4OH - -4e - =2H 2 O+O 2 ↑;
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,方程式为:2Cl - +2H 2 O
电解
.
Cl 2 ↑+H 2 ↑+2OH - ,
故答案为:2Cl - +2H 2 O
电解
.
Cl 2 ↑+H 2 ↑+2OH - ;
②甲池中碳棒为正极,正极上氧气得电子发生还原反应,故答案为:还原反应;
③将湿润的KI淀粉试纸放在乙池石墨电极附近,发现试纸变蓝,则石墨电极上氯离子失电子生成氯气,氯气和碘离子反应生成碘单质,碘遇淀粉试液变蓝色,反应方程式为:KI+Cl 2 =I 2 +2KCl,
故答案 为:KI+Cl 2 =I 2 +2KCl;
④电解氯化钠溶液的方程式为:2NaCl+2H 2 O
电解
.
Cl 2 ↑+H 2 ↑+2NaOH,乙池转移0.02mole - 后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=
n
V =
0.02mol
0.2L =0.1mol/L,所以溶液中氢离子浓度=
1 0 -14
0.1 mol/L=1 0 -13 mol/L ,所以溶液的pH=13,
故答案为:13.1年前查看全部
- 铜片,石墨棒,稀硫酸,导线,烧杯为什么不能形成简单原电池?
 yanling2211年前1
yanling2211年前1 -
 2047991 共回答了19个问题
2047991 共回答了19个问题 |采纳率94.7%因为形成原电池的前提条件是:能自发地进行氧化还原反应,这儿的铜片,石墨棒,稀硫酸之间均不能发生氧化还原反应.1年前查看全部
- 电解氯化镁是否生成沉淀?以石墨棒作为电极
 fkloveqf1年前4
fkloveqf1年前4 -
 又被你雷倒了 共回答了24个问题
又被你雷倒了 共回答了24个问题 |采纳率87.5%看用什么电解棒了
溶液为 MgCl2 + 2H2O === Cl2 + Mg(OH)2 + H21年前查看全部
大家在问
- 1飞流的瀑布!你天生的金嗓子,雄浑的男高音多么有气势.是拟人句吗
- 22007年11月5日,“嫦娥一号”探月卫星沿地月转移轨道直奔月球,在距月球表面200km的P点进行第一次“刹车制动”后被
- 3(2013•济宁)(1)实验室中,我们通常使用下面三种方法来制取氧气:
- 4一个数减去它的五分之二等于2.88,这个数是多少?
- 5等物质的量的硫酸和磷酸具有相同的 A体积 B质量 C质子数 D原子数
- 6英语翻译很高兴能来到这里应聘,我叫XXX,我今年XX岁,毕业于广东中信学院.朋友们都说我一个热情开朗而又不失细心稳重的女
- 7袋中装着标有数字1,2,3,4的卡片各1张,甲从袋中任取2张卡片(每张卡片被取出的可能性都相等),并记下卡面数字和为X,
- 8某有机物在氧气中完全燃烧生成二氧化碳和水的质量比为22:9,
- 9小明从平面镜里看到镜子对钟表示数的图象如图,这时的实际时刻是( )
- 10求值[sin(α+30°)-sin(α-30°)]/cosα
- 11买书 作文
- 12某水果店运来苹果和梨共450kg,其中苹果的质量是李的2倍.苹果和梨各有多少千克?这这题的设该怎么写?
- 13英语作文:做一个纸飞机(不得少于45个单词)怎么写?
- 14请问“不差什么”这里“差”是读一声还是四声?
- 15Don’t cut in line, or other people may _______. A.get nervou



