叠氮化钠分解反应的化学式有助于回答者给出准确的答案
 gsrtw2022-10-04 11:39:541条回答
gsrtw2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 qno5847s_f_373c 共回答了15个问题
qno5847s_f_373c 共回答了15个问题 |采纳率93.3%- 2NaN3=2Na+3N2
- 1年前
相关推荐
- 叠氮化钠的充气原理?汽车安全气囊和一种可自动充气气球的原理是利用叠氮化钠受撞击会分解,产生大量的气体氮气.我想知道当利用
叠氮化钠的充气原理?
汽车安全气囊和一种可自动充气气球的原理是利用叠氮化钠受撞击会分解,产生大量的气体氮气.
我想知道当利用材质比较薄的材料,比如普通气球,可以利用叠氮化钠根据上面的原理进行充气吗?
如果根据材质的厚薄和空间的大小放入合适的叠氮化钠,是不是可行? 身与白云间1年前3
身与白云间1年前3 -
 lkdsjflkjsadlfjl 共回答了16个问题
lkdsjflkjsadlfjl 共回答了16个问题 |采纳率81.3%可以充气1年前查看全部
- 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列部分研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列部分研究.
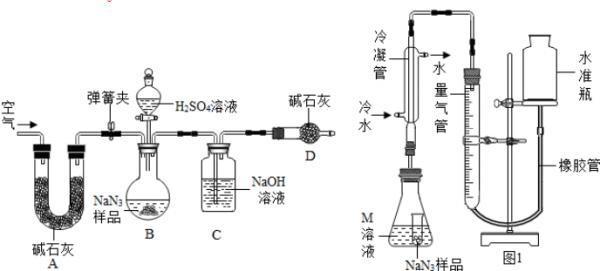
【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为2NaN3
2Na+3N2↑撞击 .2NaN3.
2Na+3N2↑撞击 .
【制备研究】
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O═NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图装置(已知H2SO4溶液与NaN3,反应不生成气体).
(3)装置A的作用是______.
设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据;根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因______. Rafel1年前1
Rafel1年前1 -
 风中的女孩 共回答了12个问题
风中的女孩 共回答了12个问题 |采纳率91.7%解题思路:(1)根据信息判断反应物、生成物、反应条件,然后写出方程式;
(2)根据质量守恒定律的实质来判断X的化学式,再根据气体的酸碱性考虑;
(3)根据碱石灰的成分和用途来完成第一空的解答即可,而④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;根据氢氧化钠溶液可以和二氧化碳反应的性质来完成解答.(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3
撞击
.
2Na+3N2↑;
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X的化学式为:NH3,氨气溶于水形成的氨水显碱性,能使湿润的红色石蕊试纸变蓝,使无色酚酞试液变红色,所以可以用无色酚酞试纸或红色石蕊试纸检测;
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN3时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na2CO3;
故答案为:(1)2NaN3
撞击
.
2Na+3N2↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的.点评:
本题考点: 物质的相互转化和制备;实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;质量守恒定律及其应用.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.1年前查看全部
- NaN3(叠氮化钠)化合价是多少?有人说氮的化合价是负三分之一 我也是这么想的 但是化合价有分数价吗?
 蜂拥1年前1
蜂拥1年前1 -
 orange625 共回答了18个问题
orange625 共回答了18个问题 |采纳率83.3%答:NaN3(叠氮化钠)属于化合物,其化合价为零,其中钠元素的化合价为+1价,根据“化合物中各元素正负化合价代数和等于零”可计算出氮元素的化合价=[0-(+1)]÷3=-1/3.因此化合价也是有分数,只不过初中为降低难度,几乎都使用整数化合价.1年前查看全部
- 有些汽车安装了安全气囊,气囊中装有“叠氮化钠”(NaN3)等固体粉末.一旦汽车发生强烈的意外碰撞,传感器将激活特定的电路
有些汽车安装了安全气囊,气囊中装有“叠氮化钠”(NaN3)等固体粉末.一旦汽车发生强烈的意外碰撞,传感器将激活特定的电路放电,叠氮化钠迅速分解生成钠并放出氮气(N2),使安全气囊打开,起到保护作用.此后气体通过气囊上的小孔迅速消散,气囊收缩.
(1)写出叠氮化钠在放电条件下分解的化学方程式:2NaN3
2Na+3N2↑放电 .2NaN3.
2Na+3N2↑放电 .
(2)写出安全气囊中选用叠氮化钠的理由:______. catroom_first1年前1
catroom_first1年前1 -
 傻冒gg 共回答了23个问题
傻冒gg 共回答了23个问题 |采纳率91.3%解题思路:(1)根据题中的叙述找出反应物、生成物以及反应条件,然后依据方程式的书写规则进行分析;
(2)根据氮气的化学性质进行分析.(1)叠氮化钠在放电的条件下生成钠和氮气,故答案为:2NaN3
放电
.
2Na+3N2↑;
(2)氮气的化学性质稳定,不易和其他物质反应,故答案为:氮气稳定无毒.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类方程式的书写题时,首先确定反应原理,然后再依据原理找出反应物、生成物和反应条件,根据方程式的书写规则书写方程式.1年前查看全部
- (2012•丰泽区质检)汽车的安全气囊中装有叠氮化钠(NaN3),受到强烈撞击时发生分解:2NaN3═2Na+3N2↑,
(2012•丰泽区质检)汽车的安全气囊中装有叠氮化钠(NaN3),受到强烈撞击时发生分解:2NaN3═2Na+3N2↑,气囊的体积迅速膨胀,达到保护驾乘人员的目的.请计算,要产生42g氮气,理论上需要多少g叠氮化钠分解?
 eugene54181年前1
eugene54181年前1 -
 qiaoli-x 共回答了15个问题
qiaoli-x 共回答了15个问题 |采纳率93.3%解题思路:写出化学方程式并代入氮气的质量计算出氮化钠的质量.设叠氮化钠的质量为X
2NaN3═2Na+3N2↑
130 84
X 42g
[130/84]=[x/42g]
得:X=65g
答:理论上需要65g叠氮化钠分解.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 掌握化学方程式的计算格式和规范性,记得最后要有“答”.1年前查看全部
- 写出下列化学方程式:汽车中安全气囊中装有叠氮化钠(NaN3)固体粉末、受撞击后分解生成钠并放出氧气
写出下列化学方程式:汽车中安全气囊中装有叠氮化钠(NaN3)固体粉末、受撞击后分解生成钠并放出氧气
是放出氮气 julianalisa1年前2
julianalisa1年前2 -
 马马克中 共回答了10个问题
马马克中 共回答了10个问题 |采纳率100%2NaN3=撞击=2Na+3N2↑1年前查看全部
- 安全气袋能提高汽车的安全性。该安全气袋中,装有一种能在瞬间分解放出气体的混合物,其成分主要是:叠氮化钠(NaN 3 )、
安全气袋能提高汽车的安全性。该安全气袋中,装有一种能在瞬间分解放出气体的混合物,其成分主要是:叠氮化钠(NaN 3 )、Fe 2 O 3 粉、少量NaNO 3 和具有较大表面积的陶土、SiO 2 粉、石墨纤维。
(1)万一发生意外撞击时,首先是叠氮化钠在0.01秒内引发、0.03秒内全部分解,生成金属钠,并放出_____________气体 ,该分解反应的化学方程式为____________。
(2)在气体消失同时,由叠氮化钠分解生成的金属钠与Fe 2 O 3 发生反应,生成氧化钠和铁。该反应的化学方程式为_______________。 伊人何在啊1年前1
伊人何在啊1年前1 -
 长空残剑飞雪 共回答了21个问题
长空残剑飞雪 共回答了21个问题 |采纳率76.2%1年前查看全部
- 叠氮化钠分解反应的化学方程式?
 yan0011年前1
yan0011年前1 -
 月亮树19230 共回答了25个问题
月亮树19230 共回答了25个问题 |采纳率92%2NaN3=(撞击)2Na+3N21年前查看全部
- 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
[查阅资料]
①NaN3受撞击会生成Na、N2.
②NaN3遇盐酸、H2SO4溶液无气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和氨气(NH3).
[问题探究]
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式:2NaN3
2Na+3N2↑撞击 .2NaN3.
2Na+3N2↑撞击 .
(2)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示):______.
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,化学小组同学设计了如下实验装置.
①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是______.
②小刚同学在大家讨论的基础上,设计了装置II.请分析:装置II中A的作用______;若无装置C,对测定结果造成的影响是______(填“偏大”、“偏小”或“无影响”);
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D.
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
其正确顺序为______(填字母序号,可重复).
(4)该小组对某一工业级NaN3样品进行检测.取100克该样品于烧杯中,加水将其溶解,然后逐滴加入一定溶质质量分数的稀硫酸并不断振荡.
首先发生的反应是:2Na2CO3+H2SO4=2NaHCO3+Na2SO4;
然后发生的反应是:2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑;
在上述过程中生成二氧化碳的质量与加入稀硫酸质量的关系如图甲所示.
①请你根据以上信息,在图乙的坐标系中画出检测过程中烧杯中溶液的质量随滴加硫酸溶液质量的变化曲线.
②计算该样品中纯碱的质量分数. dj33331年前1
dj33331年前1 -
 fishshow 共回答了16个问题
fishshow 共回答了16个问题 |采纳率81.3%解题思路:(1)根据信息“NaN3受撞击会生成Na、N2”判断反应物、生成物、反应条件,然后写出方程式;
(2)氢氧化钠和空气中的二氧化碳反应反应生成碳酸钠,据此回答;
(3)①浓盐酸易挥发,产生的氯化氢气体,进入B装置;二氧化碳气体逸出时带出的水蒸气在装置B中冷凝而被吸收;装置A内空气中的二氧化碳被装置B吸收;A中生成的二氧化碳不能全部进入B装置,使实验产生误差等.据此分析;
②根据碱石灰、浓硫酸、澄清石灰水的成分和用途回答;
③根据反应原理设计试验步骤;
(4)①从题目中给出的反应原理和图象进行分析解答;
②此反应的总的化学方程式是Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,根据图中生成的二氧化碳的质量和化学方程式Na2CO3+H2SO4=Na2SO4+H2O+CO2↑计算出样品中碳酸钠的质量,然后根据质量分数公式便可计算出样品中纯碱的质量分数.解(1)根据题目中信息“NaN3受撞击会生成Na、N2”可得此反应的反应物是叠氮化钠,生成物是钠和氮气,反应条件是撞击,故答案为:2NaN3
撞击
.
2Na+3N2↑;
(2)工业级NaN3中常含有少量的Na2CO3,其原因是氢氧化钠和空气中的二氧化碳反应反应生成碳酸钠,故答案为:2NaOH+CO2═Na2CO3+H2O
(3)①装置I用浓盐酸与样品反应,浓盐酸具有挥发性,产生的氯化氢气体被装置B吸收,二氧化碳气体逸出时带出的水蒸气在装置B中冷凝而被吸收;装置A内空气中的二氧化碳被装置B吸收;A中生成的二氧化碳不能全部进入B装置,使实验产生误差等.故答案为:浓盐酸有挥发性,挥发出的氯化氢气体会带来实验误差;
②装置II中A中药品是碱石灰,碱石灰可作干燥剂,能吸收空气中的水分和二氧化碳,防止空气中水蒸汽和二氧化碳干扰试验;C装置的浓硫酸干燥CO2气体,若无C装置会使实验结果偏大;CO2通入澄清石灰水,使澄清石灰水变浑浊,装置E的作用是检验二氧化碳是否被D装置完全吸收,防止空气中的二氧化碳和水蒸气进入D装置.故答案为:吸收空气中的二氧化碳和水;偏大;
③根据装置II,小组同学设计的实验步骤为:称量样品,检查装置气密性;打开弹簧夹,鼓入空气;称量装置D;打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞;打开弹簧夹,鼓入空气;称量装置D;其正确顺序为 bcadca;
(4)①本实验中首先发生的反应是:2Na2CO3+H2SO4=2NaHCO3+Na2SO4,然后发生的反应是:2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑.从图甲可看出当加入稀硫酸的质量是50g时开始生成二氧化碳,从而导致溶液质量增加变慢;当加入稀硫酸100g的时候,二氧化碳不再产生,溶液质量增加速率恢复到以前.故答案为:
②从图甲看,最多生成的二氧化碳的质量是4.4g.设样品中碳酸钠的质量是x.
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 4.4g
[106/x]=[44/4.4g]
解得:x=10.6g
根据质量分数公式可得该样品中纯碱的质量分数为:[10.6g/100g]×100%=10.6%
答:该样品中纯碱的质量分数为10.6%.点评:
本题考点: 有关溶质质量分数的简单计算;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,对这类题目要重点训练.1年前查看全部
- 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.

【查阅资料】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2.
(2)将生成的金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X.则为______,实验室检验该气体使用的试纸是湿润______.根据制备反应,工业级NaN3中会含有Na2CO3.试分析工业级NaN3中含有Na2CO3的可能原因______.
【Na2CO3质量分数测定】
为进一步测定NaN3样品中Na2CO3的质量分数设计如下图装置(已知H2SO4溶液与NaN3,反应不生成气体).
实验步骤如下:
①按图连接装置,______;
②准确称得盛有碱石灰(固体氢氧化钠和氧化钙的混合物)的干燥管D的质量为a g;
③准确称得叠氮化钠(NaN3)样品的质量W g放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后再称得干燥管D的总质量为b g.根据实验中测得的有关数据,可以算出样品中碳酸钠的质量分数.
试回答:(1)第⑤步缓缓鼓入空气的目的是______,装置A中试剂X最适宜选用______.写出B中生成气体的反应方程式______.
(2)若没有C装置,则会导致测定结果______(填:“偏大”或“偏小”).
(3)E装置的作用是______. yifenghaha1231年前1
yifenghaha1231年前1 -
 waigeshi 共回答了11个问题
waigeshi 共回答了11个问题 |采纳率90.9%解题思路:【查阅资料】
(2)根据质量守恒定律分析X;根据氨气的性质分析检验的方法,根据生成的产物中含有氢氧化钠及其性质分析;
【Na2CO3质量分数测定】
有气体生成的反应应检查装置的气密性;
(1)根据装置中充满二氧化碳气体分析缓缓鼓入空气的目的,根据空气中含有少量的二氧化碳分析装置A中试剂X,根据B中发生的反应写出反应的方程式;
(2)根据生成的气体中含有水蒸气分析;
(3)根据空气中含有二氧化碳和水蒸气分析.【查阅资料】(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X的化学式为:NH3.氨气的水溶液显碱性,检验该气体使用的试纸是湿润红色石蕊试纸,工业级NaN3中含有Na2CO3的可能原因是:生成NaN2的同时有NaOH生成,NaOH吸收空气中的CO2生成Na2CO3;
【Na2CO3质量分数测定】
①按图连接装置,应检查装置的气密性;
(1)由于装置中充满二氧化碳气体,缓缓鼓入空气的目的是:将B中生成的二氧化碳赶往D中.由于空气中含有少量的二氧化碳,为了防止干扰,应除去.所以,装置A中试剂X最适宜选用氢氧化钠溶液.在B中碳酸钠与硫酸反应生成了硫酸钠、二氧化碳和水,反应的方程式是:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(2)由于生成的气体中含有水蒸气,若没有C装置,则会导致测定结果偏大;
(3)为了防止空气中的二氧化碳和水蒸气对实验的结果造成影响,所以E装置的作用是吸收空气中的水和二氧化碳.
故答为:【查阅资料】(2)NH3,红色石蕊试纸,生成NaN2的同时有NaOH生成,NaOH吸收空气中的CO2生成Na2CO3;
【Na2CO3质量分数测定】检查装置的气密性(1)将B中生成的二氧化碳赶往D中,氢氧化钠溶液,Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;(2)偏大;(3)吸收空气中的水和二氧化碳.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;质量守恒定律及其应用.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.1年前查看全部
- 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为______.
制备研究:
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体).
(3)装置A的作用是______.设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据.根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因______.
NaN3纯度测定:
精确称量0.140g NaN3样品,设计如图装置,测定其纯度.已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______(填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN3样品与M溶液接触的操作是______.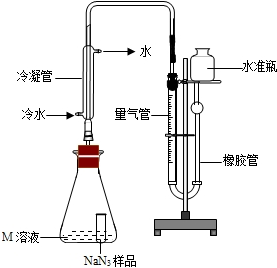
(6)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是______.
(7)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是______(填字母序号).
A.100mLB.1LC.2L
(8)计算NaN3样品的纯度(写出计算过程). 608991年前1
608991年前1 -
 cnzaq 共回答了14个问题
cnzaq 共回答了14个问题 |采纳率100%解题思路:(1)根据信息判断反应物、生成物、反应条件,然后写出方程式.
(2)根据质量守恒定律和氨水呈碱性回答.
(3)根据碱石灰的成分和用途回答前一空;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置.
(4)根据出现液面差后,如装置严密,装置内的气压不变的情况回答.
(5)使锥形瓶倾斜,让小试管倾斜其中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝可除去生成的气体中的水蒸气;生成的气体进入量气管后,右管中液面上升,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出.
(8)先根据体积和密谋计算氮气的体积,再利用关系式2NaN3→3N2计算NaN3样品的纯度.(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3
撞击
.
2Na+3N2↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X为氨气,氨水呈碱性,检验时用无色酚酞试纸或红色石蕊试纸.
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN3时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na2CO3.
(4)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变.
(5)使小试管中的NaN3样品与M溶液接触的操作是使锥形瓶倾斜,让小试管中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气;为了排除两侧液面不水平,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%.
故答案为:(1)2NaN3
撞击
.
2Na+3N2↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的;
(4)不变;
(5)使锥形瓶倾斜;
(6)除去生成的气体中的水蒸气;调节量气管使,两侧的液面保持水平;
(7)A;
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%..点评:
本题考点: 实验探究物质的组成成分以及含量;化学实验方案设计与评价.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.1年前查看全部
- 水溶液中叠氮化钠经过光照,光解产生什么?
 yuanmingfei85701年前1
yuanmingfei85701年前1 -
 xdtyft 共回答了18个问题
xdtyft 共回答了18个问题 |采纳率83.3%2Na3N+2H2O =2NaOH+3N2 ↑ +2H2↑所以生成氢气和氮气1年前查看全部
- 汽车的安全气囊内有叠氮化钠(NaN 3 )或硝酸铵(NH 4 NO 3 )等物质.当汽车在高速行驶中受到猛烈撞击时,这些
汽车的安全气囊内有叠氮化钠(NaN 3 )或硝酸铵(NH 4 NO 3 )等物质.当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊.
(1)其中,叠氮化钠分解产生氮气和固态钠.请写出叠氮化钠分解的化学方程式______.
(2)硝酸铵是常用氮肥,从安全角度考虑,存放和使用化学硝酸铵时应注意的问题有______. 54611年前1
54611年前1 -
 wwzte 共回答了17个问题
wwzte 共回答了17个问题 |采纳率94.1%(1)叠氮化钠分解生成钠和氮气,反应的化学方程式为:2NaN 3
撞击
.
2Na+3N 2 ↑;
故答案为:2NaN 3
撞击
.
2Na+3N 2 ↑;
(2)由于硝酸铵受撞击时易爆炸,易分解产生气体,在有限空间内,气体急速膨胀,易爆炸,因此硝酸铵不能与易燃物混放;同时要避免受到撞击,故不能用铁锤等物将结块的硝酸铵砸碎;故答案为:
不能与易燃物质混在一起;避免受到撞击(或结块时,不能用铁锤砸碎).1年前查看全部
- 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为______.
制备研究:
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体).
(3)装置A的作用是______.设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据.根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因______.
NaN3纯度测定:
精确称量0.140g NaN3样品,设计如图装置,测定其纯度.已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______(填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN3样品与M溶液接触的操作是______.
(6)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是______.
(7)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是______(填字母序号).
A.100mLB.1LC.2L
(8)计算NaN3样品的纯度(写出计算过程). y19909161年前1
y19909161年前1 -
 frison 共回答了18个问题
frison 共回答了18个问题 |采纳率88.9%解题思路:(1)根据信息判断反应物、生成物、反应条件,然后写出方程式.
(2)根据质量守恒定律和氨水呈碱性回答.
(3)根据碱石灰的成分和用途回答前一空;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置.
(4)根据出现液面差后,如装置严密,装置内的气压不变的情况回答.
(5)使锥形瓶倾斜,让小试管倾斜其中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝可除去生成的气体中的水蒸气;生成的气体进入量气管后,右管中液面上升,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出.
(8)先根据体积和密谋计算氮气的体积,再利用关系式2NaN3→3N2计算NaN3样品的纯度.(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3
撞击
.
2Na+3N2↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X为氨气,氨水呈碱性,检验时用无色酚酞试纸或红色石蕊试纸.
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN3时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na2CO3.
(4)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变.
(5)使小试管中的NaN3样品与M溶液接触的操作是使锥形瓶倾斜,让小试管中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气;为了排除两侧液面不水平,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%.
故答案为:(1)2NaN3
撞击
.
2Na+3N2↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的;
(4)不变;
(5)使锥形瓶倾斜;
(6)除去生成的气体中的水蒸气;调节量气管使,两侧的液面保持水平;
(7)A;
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%..点评:
本题考点: 实验探究物质的组成成分以及含量;化学实验方案设计与评价.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.1年前查看全部
- 叠氮化钠废水怎么处理?我看到说,叠氮化钠与20%-25%的硝酸反应,可以破坏叠氮根,这样可不可以达到建议预处理的目的?产
叠氮化钠废水怎么处理?
我看到说,叠氮化钠与20%-25%的硝酸反应,可以破坏叠氮根,这样可不可以达到建议预处理的目的?产物有哪些? thirevelaw1年前1
thirevelaw1年前1 -
 13565348 共回答了20个问题
13565348 共回答了20个问题 |采纳率95%可能性不大!不过建议你试试臭氧处理!最后会让臭氧分解!
效果不错1年前查看全部
- 某些高级轿车配置的安全气囊内有叠氮化钠(NaN3).当汽车在高速行驶中受到猛
某些高级轿车配置的安全气囊内有叠氮化钠(NaN3).当汽车在高速行驶中受到猛
烈撞击时.叠氮化钠(NaN3)分解产生两种单质,气囊鼓起填补在乘员与挡风玻璃、方向盘之间.达到保护驾乘人员的目的.叠氮化钠的外观很像食盐.易溶于水和液氨.剧毒物品.主要用途:汽车安全气囊的气化剂,污水含氮量测定.合成农药等.根据上述信息,请根据以上信息回答:
(1)叠氮化钠的性质有______
(2)写出叠氮化钠分解的化学方程式______. adad07961年前1
adad07961年前1 -
 功课不管 共回答了15个问题
功课不管 共回答了15个问题 |采纳率100%解题思路:化学性质是指通过化学变化表现出来的性质,物理性质是不需要发生化学变化表现出来的性质;本题还考查到了质量守恒定律推断化学方程式.(1)由题意知,叠氮化钠的外观很像食盐,易溶于水和液氨,剧毒物品,食盐是白色固体,因此叠氮化钠
也是白色固体;
(2)叠氮化钠(NaN3)分解产生两种单质,根据质量守恒定律,可知反应前后元素不变,由它的化学式NaN3可推知其化学方程式为:2NaN3═2Na+3N2↑;
故答案为:
(1)白色固体,易溶于水和液氨,毒性,撞击易分解;(2)2NaN3═2Na+3N2↑.点评:
本题考点: 化学性质与物理性质的差别及应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是考查物理性质和化学性质的题,正确区分化学性质和物理性质,关键是看是否发生了化学变化.1年前查看全部
- (2012•上海)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下
(2012•上海)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下)氮气,至少需要叠氮化钠______g.
 高愚1年前1
高愚1年前1 -
 00涧水蓝 共回答了36个问题
00涧水蓝 共回答了36个问题 |采纳率91.7%解题思路:叠氮化钠分解反应方程式为2NaN3=3N2↑+2Na,根据氮气和叠氮化钠之间的关系式计算叠氮化钠的质量.叠氮化钠分解反应方程式为2NaN3=3N2↑+2Na,设需要叠氮化钠的质量为x,
2NaN3=3N2↑+2Na
130g 67.2L
x 40.32L
130g:67.2L=x:40.32L
x=[130g×40.32L/67.2L]=78g,
故答案为:78.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查了根据方程式进行计算,正确书写方程式是解本题关键,再结合方程式中各物理量的关系进行解答即可,题目难度不大.1年前查看全部
- (3分)有些汽车安装了安全气囊,气囊中装有“叠氮化钠”(NaN 3 )等固体粉末。一旦汽车发生强烈的意外碰撞,传感器将激
(3分)有些汽车安装了安全气囊,气囊中装有“叠氮化钠”(NaN 3 )等固体粉末。一旦汽车发生强烈的意外碰撞,传感器将激活特定的电路放电,叠氮化钠迅速分解生成钠并放出氮气(N 2 ),使安全气囊打开,起到保护作用。此后气体通过气囊上的小孔迅速消散,气囊收缩。
(1)写出叠氮化钠在放电条件下分解的化学方程式: 。
(2)写出安全气囊中选用叠氮化钠的理由: 。 69牧马人1年前1
69牧马人1年前1 -
 ys1988169 共回答了27个问题
ys1988169 共回答了27个问题 |采纳率96.3%(1)2NaN 3 放电 2 Na+3N 2 ↑(2)氮气化学性质稳定
1年前查看全部
- 叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
 叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
2NaNH2+N2O═NaN3+NaOH+NH3↑
3NaNH2+NaNO3═NaN3+3NaOH+NH3↑
(1)①氮原子的L层电子排布图______.
②氮所在的周期中,第一电离能最大的元素为______(填元素符号).
③与N3互为等电子体的粒子为______(写出一种).
④氨气的电子式______.
(2)NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,其主要原因是______
(3)依据价层电子对互斥理论,NO-3间构型呈______形.
(4)汽车安全气囊的设计是基于反应6NaN3+Fe2O3═3Na2O+2Fe+9N2↑,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如图所示,下列有关铁及晶体的说法中正确的是______.
A.金属铁的导电性是由于通电时产生的自由电子作定向移动
B.α-Fe、γ-Fe的堆积方式分别与钾和铜相同
C.空间利用率α-Fe大于γ-Fe
D.金属铁内部存在金属键
(5)铁的上述两种晶体(α-Fe:γ-Fe)的密度比值为______.(写成小数,保留2位有效数字) inina111年前0
inina111年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生
叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生
40.32 L(标准状况下)氮气,至少需要叠氮化钠______g.
答案是78,我知道用比例的办法能做出来,但是为什么用化学方程式列出式子就怎么也算不对呢?设叠氮化钠的质量是ng
2NaN3 = 2Na+ 3N2
2*(23+14*3) 3*(14*2)
n 1.8
m=nM=2*(23+14*3)*1.8*(23+14*3)/3*14*2=181.0714g
和正确答案差了那么远啊,我都快疯了, yzyhf1年前3
yzyhf1年前3 -
 小李子qiqi 共回答了19个问题
小李子qiqi 共回答了19个问题 |采纳率89.5%计算如下
2NaN3 = 2Na+ 3N2
2 3
n 1.8mol
n=2*1.8/3=1.2 mol
m=n*M=1.2*(23+14*3) =78 g
你的错误分析:
2NaN3 = 2Na+ 3N2
2*(23+14*3) 3*(14*2)
与数值2*(23+14*3) 3*(14*2)相对的是质量,不是物质的量!物质的量与化学计量数对应(即与2 3对应)!1年前查看全部
- 哪种化学反应对气球充气效果好第一种:汽车安全气囊和一种可自动充气气球的原理是利用叠氮化钠受撞击会分解,产生大量的气体氮气
哪种化学反应对气球充气效果好
第一种:汽车安全气囊和一种可自动充气气球的原理是利用叠氮化钠受撞击会分解,产生大量的气体氮气.
第二种:自动充气气球能自己充气是因为利用了稀盐酸(即食用柠檬酸)和碳酸氢钠(即食用小苏打粉)混合产生二氧化碳的化学原理.(此种气球大多是比较厚的材质)
请问:
1、这两种充气原理哪种更适合应用在比较小且薄的气球上.
2、哪种原理产生的温度更高(气球本体空间小且薄,如果贴近皮肤,会不会伤及皮肤). 等你在三西路1年前6
等你在三西路1年前6 -
 小鼻涕虫 共回答了19个问题
小鼻涕虫 共回答了19个问题 |采纳率89.5%第二种,第一种需要撞击,容易损坏气球,且反应太快.而第二种可以控制反应速率.第一种温度更高,但两种温度都不会伤及皮肤,就是盐酸要小心.1年前查看全部
- 怎么配制0.05%叠氮化钠溶液?
怎么配制0.05%叠氮化钠溶液?
真心求个靠谱的答案... 楼主是鼠黑1年前1
楼主是鼠黑1年前1 -
 glennrobinson 共回答了17个问题
glennrobinson 共回答了17个问题 |采纳率94.1%精确称取50mg叠氮钠,用50ml蒸馏水溶解到100ml烧杯中,玻璃棒引流,移入100ml容量瓶,分别再用20ml蒸馏水洗涤烧杯两次,玻璃棒引流移入容量瓶,最后用滴管吸取蒸馏水滴至容量瓶刻度,盖好容量瓶瓶盖,颠倒混匀几次.1年前查看全部
- 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为______.
制备研究:
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体).
(3)装置A的作用是______.设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据.根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因______.
NaN3纯度测定:
精确称量0.140g NaN3样品,设计如图装置,测定其纯度.已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______(填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN3样品与M溶液接触的操作是______.
(6)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是______.
(7)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是______(填字母序号).
A.100mLB.1LC.2L
(8)计算NaN3样品的纯度(写出计算过程). magichmw1年前1
magichmw1年前1 -
 叮当喵 共回答了21个问题
叮当喵 共回答了21个问题 |采纳率95.2%解题思路:(1)根据信息判断反应物、生成物、反应条件,然后写出方程式.
(2)根据质量守恒定律和氨水呈碱性回答.
(3)根据碱石灰的成分和用途回答前一空;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置.
(4)根据出现液面差后,如装置严密,装置内的气压不变的情况回答.
(5)使锥形瓶倾斜,让小试管倾斜其中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝可除去生成的气体中的水蒸气;生成的气体进入量气管后,右管中液面上升,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出.
(8)先根据体积和密谋计算氮气的体积,再利用关系式2NaN3→3N2计算NaN3样品的纯度.(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3
撞击
.
2Na+3N2↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X为氨气,氨水呈碱性,检验时用无色酚酞试纸或红色石蕊试纸.
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN3时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na2CO3.
(4)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变.
(5)使小试管中的NaN3样品与M溶液接触的操作是使锥形瓶倾斜,让小试管中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气;为了排除两侧液面不水平,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%.
故答案为:(1)2NaN3
撞击
.
2Na+3N2↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的;
(4)不变;
(5)使锥形瓶倾斜;
(6)除去生成的气体中的水蒸气;调节量气管使,两侧的液面保持水平;
(7)A;
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%..点评:
本题考点: 实验探究物质的组成成分以及含量;化学实验方案设计与评价.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.1年前查看全部
- 叠氮化钠废液(少量)如何处理,如何确保处理完全,臭氧的方法太麻烦了.另外硝酸银处理的反应式谢谢
 青柠乐vivian1年前1
青柠乐vivian1年前1 -
 ll玲 共回答了22个问题
ll玲 共回答了22个问题 |采纳率86.4%可以使用次氯酸钠溶液对含有叠氮化物的溶液进行销毁:
NaClO+2NaN3+H2O==NaCl+2NaOH+3N2↑1年前查看全部
- 叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:2NaNH2+N2O
叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:2NaNH2+N2O
 叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
2NaNH2+N2O═NaN3+NaOH+NH3↑
3NaNH2+NaNO3═NaN3+3NaOH+NH3↑
(1)①氮原子的L层电子排布图______.
②氮所在的周期中,第一电离能最大的元素为______(填元素符号).
③与N3互为等电子体的粒子为______(写出一种).
④氨气的电子式______.
(2)NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,其主要原因是______
(3)依据价层电子对互斥理论,NO-3间构型呈______形.
(4)汽车安全气囊的设计是基于反应6NaN3+Fe2O3═3Na2O+2Fe+9N2↑,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如图所示,下列有关铁及晶体的说法中正确的是______.
A.金属铁的导电性是由于通电时产生的自由电子作定向移动
B.α-Fe、γ-Fe的堆积方式分别与钾和铜相同
C.空间利用率α-Fe大于γ-Fe
D.金属铁内部存在金属键
(5)铁的上述两种晶体(α-Fe:γ-Fe)的密度比值为______.(写成小数,保留2位有效数字)
 布诺美1年前1
布诺美1年前1 -
 Qlxs 共回答了14个问题
Qlxs 共回答了14个问题 |采纳率85.7%(1)①氮原子的L层上,2s能级上有2个电子、2p能级上有3个电子,根据能量最低原理、洪特规则、保里不相容原理知,其L层电子排布图为 ,故答案为:
,故答案为: ;
;
②同一周期中,元素第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素大于相邻元素,所以第二周期元素中第一电离能最大的是Ne,故答案为:Ne;
③价电子数相等、原子个数相等的微粒互斥等电子体,与N3互为等电子体的粒子有CO2等,故答案为:CO2等;
④氨气分子中氮原子和每个氢原子之间都存在一个共用电子对,氨气分子的电子式为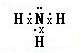 ,故答案为:
,故答案为: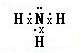 ;
;
(2)NH3中存在氢键,N2O中不存在氢键,氢键的存在导致NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,故答案为:氨气分子间存在氢键;
(3)NO-3中价层电子对个数=3+[1/2](5+1-3×2)=3且不含孤电子对,所以其空间构型为平面三角形,故答案为:平面三角;
(4)A.金属铁的导电性是由于通电时自由电子作定向移动,电子不是通电才产生的,故错误;
B.α-Fe、γ-Fe的堆积方式分别与钾和铜相同,α-Fe为体心立方堆积,γ-Fe为面心立方堆积,故正确;
C.空间利用率α-Fe小于γ-Fe,故错误;
D.金属晶体中存在金属键,所以金属铁内部存在金属键,故正确;
故选BD;
(5)α-Fe中Fe原子个数=1+8×[1/8]=2,γ-Fe中Fe原子个数=8×[1/8]+6×
1
2=4,设Fe原子半径为r,α-Fe中晶胞边长=
4r
3,γ-Fe中晶胞的边长=
4r
2,α-Fe密度ρ=
m
V=
56
NA×2
(
4r
3)3,γ-Fe密度=
56
NA×4
(1年前查看全部
- 叠氮化钠如何制钠的方程式
 834867941年前3
834867941年前3 -
 卢瑞林 共回答了18个问题
卢瑞林 共回答了18个问题 |采纳率100%隔绝空气加热
2NaN3=加热=2Na+3N21年前查看全部
- 叠氮化钠的结构
 jackchan1992121年前2
jackchan1992121年前2 -
 meteor78 共回答了20个问题
meteor78 共回答了20个问题 |采纳率100%叠氮酸钠化学式为:NaN3.
结构可以这样理
叠氮酸可以写成H-N=N≡N,中间的和右边的N原子是sp杂化,左边的与H原子结合的N原子是sp2杂化,分子中有三个N原子形成的三中心四电子大π键和右边两个N原子形成的π键.叠氮酸钠是叠氮酸的钠盐,可以写成Na+[N=N≡N]-.1年前查看全部
- 叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN 3 ,迅速分解为Na、N 2 ,反应方程式为______.
制备研究:
(2)将金属钠与液态氨反应得NaNH 2 ,再将NaNH 2 与N 2 O反应可生成NaN 3 、NaOH和气体X,该反应的化学方程式为2NaNH 2 +N 2 O=NaN 3 +NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na 2 CO 3 质量分数测定:工业级NaN 3 中常含有少量的Na 2 CO 3 ,为测定样品中Na 2 CO 3 的质量分数设计如图
装置(已知H 2 SO 4 溶液与NaN 3 ,反应不生成气体).
(3)装置A的作用是______.设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据.根据制备反应,分析工业级NaN 3 中含有Na 2 CO 3 的可能原因______.
NaN 3 纯度测定:
精确称量0.140gNaN 3 样品,设计如图装置,测定其纯度.已知2NaN 3 →3N 2
(NaN 3 中的N全部转化为N 2 ,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______(填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN 3 样品与M溶液接触的操作是______.
(6)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是______.
(7)常温下测得量气管读数为67.2mL(N 2 的密度为1.25g/L),则实验中选用的量气管规格合适的是______(填字母序号).
A.100mLB.1LC.2L
(8)计算NaN 3 样品的纯度(写出计算过程). 某迴1年前1
某迴1年前1 -
 bluewaterfall 共回答了21个问题
bluewaterfall 共回答了21个问题 |采纳率95.2%(1)汽车经撞击后,30毫秒内引发NaN 3 迅速分解为Na、N 2 ,即反应物是NaN 3 ,生成物是Na、N 2 ,条件是撞击,所以反应方程式为 2NaN 3
撞击
.
2Na+3N 2 ↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X为氨气,氨水呈碱性,检验时用无色酚酞试纸或红色石蕊试纸.
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN 3 时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na 2 CO 3 .
(4)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变.
(5)使小试管中的NaN 3 样品与M溶液接触的操作是使锥形瓶倾斜,让小试管中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气;为了排除两侧液面不水平,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN 3 样品的纯度X
2NaN 3 →3N 2
130 84
X×0.140g0.084g
X=92.86%
答:NaN 3 样品的纯度92.86%.
故答案为:(1)2NaN 3
撞击
.
2Na+3N 2 ↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的;
(4)不变;
(5)使锥形瓶倾斜;
(6)除去生成的气体中的水蒸气;调节量气管使,两侧的液面保持水平;
(7)A;
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN 3 样品的纯度X
2NaN 3 →3N 2
130 84
X×0.140g0.084g
X=92.86%
答:NaN 3 样品的纯度92.86%..1年前查看全部
- (2010•扬州)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
(2010•扬州)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为2NaN3
2Na+3N2↑撞击 .2NaN3.
2Na+3N2↑撞击 .
制备研究:
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体).
(3)装置A的作用是______.设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据.根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因______.
NaN3纯度测定:
精确称量0.140g NaN3样品,设计如图装置,测定其纯度.已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______(填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN3样品与M溶液接触的操作是______.
(6)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是______.
(7)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是______(填字母序号).
A.100mLB.1LC.2L
(8)计算NaN3样品的纯度(写出计算过程). qwert_6681年前1
qwert_6681年前1 -
 我就是爱八卦 共回答了21个问题
我就是爱八卦 共回答了21个问题 |采纳率81%解题思路:(1)根据信息判断反应物、生成物、反应条件,然后写出方程式.
(2)根据质量守恒定律和氨水呈碱性回答.
(3)根据碱石灰的成分和用途回答前一空;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置.
(4)根据出现液面差后,如装置严密,装置内的气压不变的情况回答.
(5)使锥形瓶倾斜,让小试管倾斜其中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝可除去生成的气体中的水蒸气;生成的气体进入量气管后,右管中液面上升,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出.
(8)先根据体积和密谋计算氮气的体积,再利用关系式2NaN3→3N2计算NaN3样品的纯度.(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3
撞击
.
2Na+3N2↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X为氨气,氨水呈碱性,检验时用无色酚酞试纸或红色石蕊试纸.
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN3时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na2CO3.
(4)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变.
(5)使小试管中的NaN3样品与M溶液接触的操作是使锥形瓶倾斜,让小试管中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气;为了排除两侧液面不水平,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%.
故答案为:(1)2NaN3
撞击
.
2Na+3N2↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的;
(4)不变;
(5)使锥形瓶倾斜;
(6)除去生成的气体中的水蒸气;调节量气管使,两侧的液面保持水平;
(7)A;
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%..点评:
本题考点: 实验探究物质的组成成分以及含量;化学实验方案设计与评价.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.1年前查看全部
- (10分)叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。
(10分)叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。

【查阅资料】
①NaN 3 受撞击会生成Na、N 2 .
②NaN 3 遇盐酸、H 2 SO 4 溶液无气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN 3 的制备方法是:将金属钠与液态氨反应制得NaNH 2 ,再将NaNH 2 与N 2 O反应可生成NaN 3 、NaOH和氨气(NH 3 ).
【问题探究】
⑴汽车经撞击后,30毫秒内引发NaN 3 迅速分解,写出该反应的化学方程式:
① 。
⑵工业级NaN 3 中常含有少量的Na 2 CO 3 ,其原因是(用化学方程式表示):
② 。
⑶为测定某工业级NaN 3 样品中含有Na 2 CO 3 的质量分数,化学小组同学设计了如下实验
装置。
①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na 2 CO 3 的纯度,小组内同学通过讨论认为不可以,其理由可能是 ③ 。
②小刚同学在大家讨论的基础上,设计了装置II.请分析:装置II中A的作用 ④ ;若无装置C,对测定结果造成的影响是 ⑤ (填“偏大”、“偏小”或“无影响”);
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D.
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
其正确顺序为 ⑥ (填字母序号,可重复).
⑷该小组对某一工业级NaN 3 样品进行检测。取100克该样品于烧杯中,加水将其溶解,然后逐滴加入一定溶质质量分数的稀硫酸并不断振荡。
首先发生的反应是:2Na 2 CO 3 +H 2 SO 4 =2NaHCO 3 +Na 2 SO 4 ;然后发生的反应是:2NaHCO 3 +H 2 SO 4 = Na 2 SO 4 +2H 2 O+2CO 2 ↑;在上述过程中生成二氧化碳的质量与加入稀硫酸质量的关系如图甲所示。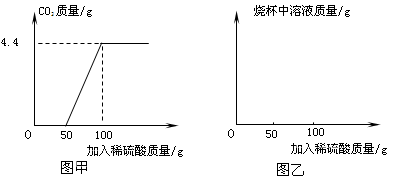
①请你根据以上信息,在图乙的坐标系中画出检测过程中烧杯中溶液的质量随滴加硫酸溶液质量的变化曲线。
②计算该样品中纯碱的质量分数。 hanml1年前1
hanml1年前1 -
 李小马哥哥 共回答了24个问题
李小马哥哥 共回答了24个问题 |采纳率87.5%①2NaN 3 2Na+3N 2 ↑② 2NaOH+CO 2 =Na 2 CO 3 +H 2 O③ 浓盐酸有挥发性,挥发出的氯化氢气体会带来实验误差 ④ 吸收空气中的二氧化碳...1年前查看全部
- (2009•松北区一模)某些高级轿车配置的安全气囊内有叠氮化钠(NaN3).当汽车在高速行驶中受到猛
(2009•松北区一模)某些高级轿车配置的安全气囊内有叠氮化钠(NaN3).当汽车在高速行驶中受到猛
烈撞击时.叠氮化钠(NaN3)分解产生两种单质,气囊鼓起填补在乘员与挡风玻璃、方向盘之间.达到保护驾乘人员的目的.叠氮化钠的外观很像食盐.易溶于水和液氨.剧毒物品.主要用了:汽车安全气囊的气化剂,污水含氮量测定.合成农药等.根据上述信息,请根据以上信息回答:
(1)叠氮化钠的性质有白色固体、易溶于水和液氨、剧毒物品、受撞击时容易分解白色固体、易溶于水和液氨、剧毒物品、受撞击时容易分解
(2)写出叠氮化钠分解的化学方程式2NaN3
2Na+3N2↑2NaN3撞击 . .
2Na+3N2↑撞击 . .
(3)叠氮化钠属于化合物化合物(填”物质分类”). sx862101年前1
sx862101年前1 -
 apollo_zjy 共回答了21个问题
apollo_zjy 共回答了21个问题 |采纳率76.2%(1)叠氮化钠的性质有:白色固体、易溶于水和液氨、剧毒物品、受撞击时容易分解.
(2)叠氮化钠分解生成钠和氮气,反应的化学方程式为:2NaN3
撞击
.
2Na+3N2↑.
(3)叠氮化钠是由氮元素和钠元素组成的纯净物,属于化合物.故填:化合物.1年前查看全部
- 汽车的安全气囊中装有叠氮化钠(NaN 3 ),受到强烈撞击时发生分解,其化学方程式为:2NaN 3
汽车的安全气囊中装有叠氮化钠(NaN 3 ),受到强烈撞击时发生分解,其化学方程式为:2NaN 3 == 2Na + 3N 2 ↑,气囊的体积迅速膨胀,达到保护驾乘人员的目的。请计算,要产生42 g氮气,理论上需要多少克叠氮化钠分解?
 31065011年前1
31065011年前1 -
 yhs7812 共回答了20个问题
yhs7812 共回答了20个问题 |采纳率90%设理论上需要叠氯化钠的质量为 x (0.5分)
2NaN 3 == 2Na + 3N 2 ↑
13084(1分)
x 42g(1分)
130∶84=x∶42g (1分)
x =65g (1分)
答: 理论上需要叠氯化钠的质量为65g。
写出化学方程式并代入氮气的质量计算出氮化钠的质量.1年前查看全部
- 为保证驾乘人员人身安全,许多汽车中增设了安全气囊,内置叠氮化钠(NaN 3 ),在汽车发生一定强度的碰撞时,叠氮化钠发生
为保证驾乘人员人身安全,许多汽车中增设了安全气囊,内置叠氮化钠(NaN 3 ),在汽车发生一定强度的碰撞时,叠氮化钠发生分解反应:2NaN 3 →2Na+3N 2 ↑,立即气体充满气囊,以达到保护驾乘人员的目的。
若填充一安全气囊需要0.9 mol氮气,则约含 个氮原子,需要有 mol的叠氮化钠发生上述的分解反应,这些叠氮化钠的质量是 g。 flowing_wind1年前1
flowing_wind1年前1 -
 香蜜湖大剧院 共回答了11个问题
香蜜湖大剧院 共回答了11个问题 |采纳率90.9%1.0836 ×10 24 0.6 39
1年前查看全部
- 汽车的安全气囊内有叠氮化钠(NaN 3 )或硝酸铵(NH 4 NO 3 )等物质.当汽车在高速行驶中受到猛烈撞击时,这些
汽车的安全气囊内有叠氮化钠(NaN 3 )或硝酸铵(NH 4 NO 3 )等物质.当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊.
(1)其中,叠氮化钠分解产生氮气和固态钠.请写出叠氮化钠分解的化学方程式_______________.
(2)硝酸铵是常用氮肥,从安全角度考虑,存放和使用化学硝酸铵时应注意的问题有___________________. 茫茫夜游人1年前0
茫茫夜游人1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- NaN3(叠氮化钠)中氮的化合价是多少?
 我是老土1年前2
我是老土1年前2 -
 _个性aa_ 共回答了17个问题
_个性aa_ 共回答了17个问题 |采纳率100%化合物中各元素的化合价的代数和为0.根据这条规律,由Na为+1价,可知3个N总化合价为-1价,那么每个N的化合价为-1/3 价(负三分之一价).1年前查看全部
- 求叠氮化钠NaNO3的各元素的化合价,
求叠氮化钠NaNO3的各元素的化合价,
打错了,是NaN3 VC果冻1年前1
VC果冻1年前1 -
 fal_pof 共回答了19个问题
fal_pof 共回答了19个问题 |采纳率94.7%Na +1,N 平均 -1/3
如果你要更精确一点,叠氮离子中,3个N成直线形,两头的N化合价 -2/3,中间的N +1/3
解释起来就比较复杂了,需要用到离域∏键的知识.如果你没还学过,就不要探求了,以后会明白的.1年前查看全部
- 叠氮化钠溶液如何灭菌?能不能在121℃ 15min条件下灭菌?使用的注意事项是什么?
 烟瘾ii龙1年前1
烟瘾ii龙1年前1 -
 yu6091345 共回答了21个问题
yu6091345 共回答了21个问题 |采纳率90.5%叠氮化钠有剧毒,要小心防止中毒1年前查看全部
- 叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN 3 ,迅速分解为Na、N 2 ,反应方程式为 。
【制备研究】
(2)将金属钠与液态氨反应得NaNH 2 ,再将NaNH 2 与N 2 O反应可生成NaN 3 、NaOH和气体X,该反应的化学方程式为2NaNH 2 +N 2 O===NaN 3 +NaOH+X,实验室检验X 气体使用的试纸是湿润________。
【Na 2 CO 3 质量分数测定】工业级NaN 3 中常含有少量的Na 2 CO 3 ,为测定样品中Na 2 CO 3 的质量分数设计如图装置(已知H 2 SO 4 溶液与NaN 3 ,反应不生成气体)。 (碱石灰是NaOH和CaO的混合物)
(3)装置A的作用是 。设计的实验步骤为:
①精确称量样品,检查装置气密性;
②打开弹簧夹,鼓入空气,称量装置C;
③关闭弹簧夹,打开分液漏斗活塞;
④再打开弹簧夹, ;
⑤再次称量装置C。计算碳酸钠含量至少需要测定 (填数字)个数据。根据制备反应,分析工业级NaN 3 中含有Na 2 CO 3 的可能原因 。
【NaN 3 纯度测定】精确称量0.140gNaN 3 样品,设计如图装置,测定其纯度。已知2NaN 3 3N 2 (NaN 3 中的N全部转化为N 2 ,其他产物略),反应中放出大量的热。
3N 2 (NaN 3 中的N全部转化为N 2 ,其他产物略),反应中放出大量的热。 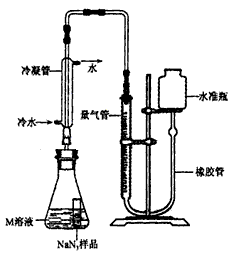
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差 (填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN 3 样品与M溶液接触的操作是 。
(6)使用冷水冷凝的目的是 。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是 。
(7)常温下测得量气管读数为67.2 mL(N 2 的密度为 1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN 3 样品的纯度(写出计算过程)。 线在涯天1年前1
线在涯天1年前1 -
 酸甜口香糖 共回答了19个问题
酸甜口香糖 共回答了19个问题 |采纳率84.2%1年前查看全部
- 叠氮化钠(NaN 3 )是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品
叠氮化钠(NaN 3 )是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品中NaN 3 的质量分数。实验步骤如下:
①称取约2.5000g叠氮化钠试样,配成250mL溶液。
②准确量取25.00mL溶液置于锥形瓶中,用滴定管加入50.00mL 0.1000mol·L -1
(NH 4 ) 2 Ce(NO 3 ) 6 (六硝酸铈铵),
[发生反应为:2(NH 4 ) 2 Ce(NO 3 ) 6 +2NaN 3 =4NH 4 NO 3 +2Ce(NO 3 ) 3 +2NaNO 3 +3N 2 ↑](杂质不参与反应)。
③反应后将溶液稍稀释,然后向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol·L -1 (NH 4 ) 2 Fe(SO 4 ) 2 (硫酸亚铁铵)标准滴定溶液滴定过量的Ce 4+ 至溶液由淡绿色变为黄红色(发生的反应为:Ce 4+ +Fe 2+ = Ce 3+ +Fe 3+ ),消耗硫酸亚铁铵标准溶液24.00mL。
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有 、 。
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为 。
(3)若其它读数正确,滴定到终点后,读取滴定管中 (NH 4 ) 2 Fe(SO 4 ) 2 标准溶液体积按图图示读取,将导致所测定样品中叠氮化钠质量分数 (选填:“偏大”、“偏小”或“不变”)。
(4)通过计算确定叠氮化钠试样中含NaN 3 的质量分数为多少(写出计算过程)。 1202YY1年前1
1202YY1年前1 -
 tuliplin2005 共回答了17个问题
tuliplin2005 共回答了17个问题 |采纳率100%(1)250mL容量瓶、胶头滴管(每空1分,共2分)
(2)2NaN 3 2Na + 3N 2 ↑(2分)
2Na + 3N 2 ↑(2分)
(3)偏小(2分)
(4)n[(NH 4 ) 2 Ce(NO 3 ) 6 ]= 0.1000mol·L -1 ×50.00×10 -3 L=5.000×10 -3 mol
n[(NH 4 ) 2 Fe(SO 4 ) 2 ]= 0.0500mol·L -1 ×24.00×10 -3L=1.200×10-3 mol
与NaN 3 反应的n[(NH 4 ) 2 Ce(NO 3 ) 6 ]= 5.000×10 -3 mol-1.200×10 -3 mol
=3.800×10 -3 mol
ω= =0.9880 (共6分)
=0.9880 (共6分)
<>1年前查看全部
- (2013•顺义区二模)叠氮化钠(NaN3)受撞击时能在瞬间完全分解为钠和氮气,故可应用于汽车安全气囊.若产生56克(标
(2013•顺义区二模)叠氮化钠(NaN3)受撞击时能在瞬间完全分解为钠和氮气,故可应用于汽车安全气囊.若产生56克(标准状况下体积为44.8升)的氮气,应在气囊内填充叠氮化钠(NaN3)的质量是多少?
 快乐虹猫蓝兔1年前1
快乐虹猫蓝兔1年前1 -
 酷玩数码 共回答了20个问题
酷玩数码 共回答了20个问题 |采纳率90%解题思路:根据叠氮化钠分解的化学方程式结合生成的氮气的质量可以计算出叠氮化钠的质量.设应填充叠氮化钠的质量为x
2NaN3
撞击
.
2Na+3N2↑
13084
X56g
[130/x]=[84/56g]
解得:x≈86.7g
答:应填充叠氮化钠的质量为86.7g点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据化学反应方程式的计算的审题是非常关键的,一般是抓住“三找”;即一找化学反应方程式,二找已知量和未知量,三找用到的相对质量关系.1年前查看全部
- 为保证驾乘人员人身安全,许多汽车中增设了安全气囊,内置叠氮化钠(NaN3),在汽车发生一定强度的碰撞时,叠氮化钠发生分解
为保证驾乘人员人身安全,许多汽车中增设了安全气囊,内置叠氮化钠(NaN3),在汽车发生一定强度的碰撞时,叠氮化钠发生分解反应:2NaN3→2Na+3N2↑,立即气体充满气囊,以达到保护驾乘人员的目的.
若填充一安全气囊需要0.9mol氮气,则约含______个氮原子,需要有______ mol的叠氮化钠发生上述的分解反应,这些叠氮化钠的质量是______g. 他们都叫我兔子1年前1
他们都叫我兔子1年前1 -
 想什么就什么 共回答了15个问题
想什么就什么 共回答了15个问题 |采纳率80%解题思路:先求出N2的物质量,再根据阿伏加德罗常数求出原子的总个数.
根据化学方程式,求叠氮化钠(NaN3)的物质的量,根据其摩尔质量,求其质量.已知氮化钠的摩尔质量M=65g/mol,阿伏加德罗常数NA=6.02×1023mol-1.汽车的安全气囊在汽车发生一定强度的碰撞时,利用叠氮化钠(NaN3)固体发生分解反应,迅速产生氮气和固态钠,反应的化学方程式为:2NaN3
撞击
.2Na+3N2↑.
故可求填充一安全气囊需要0.9mol氮气,则约含氮原子的个数为:0.9mol×6.02×1023mol-1×2=1.0836×1024;需要叠氮化钠的物质的量为:0.9mol×[2/3]=0.6mol,则其质量为0.6mol×65g/mol=39g.
故答案为:1.0836×1024;0.6;39点评:
本题考点: 有关化学式的计算和推断.
考点点评: 加强对基本概念的记忆,基本方法的学习利用,是学好3-3的基本方法.此处要求不高,不用做太难的题目.1年前查看全部
- 叠氮化钠分解生成氮气与钠的化学方程式中生成的氮气要加箭头吗
 laolang31年前1
laolang31年前1 -
 唐袖明香 共回答了9个问题
唐袖明香 共回答了9个问题 |采纳率88.9%要,因为反应物中并无气体,这反应与过氧化氢分解相似.1年前查看全部
- 叠氮化钠中氮元素的化合价
 anachun1年前3
anachun1年前3 -
 CUTE_CC82 共回答了16个问题
CUTE_CC82 共回答了16个问题 |采纳率87.5%表观化合价可以看做 负三分之一 价1年前查看全部
- 亚硝酸钠可以和厌氧氨反应制叠氮化钠 ,在它们反应的物质的量之比为多少时,生成叠氮化钠和水?
亚硝酸钠可以和厌氧氨反应制叠氮化钠 ,在它们反应的物质的量之比为多少时,生成叠氮化钠和水?
氨基和一氧化二氮反应制叠氮化钠,在它们反应的物质的量之比为多少时,生成叠氮化钠和水. gouby1年前1
gouby1年前1 -
 197964 共回答了16个问题
197964 共回答了16个问题 |采纳率93.8%NaNO2 + N2H4 ―→ NaN3 + 2H2O
NaNH2 + N2O ―→ NaN3 + H2O1年前查看全部
- 叠氮化钠(NaN3)是抗禽流感药物"达菲"合成过程
叠氮化钠(NaN3)是抗禽流感药物"达菲"合成过程
叠氮酸钠(NaN3)是抗禽流感药物“达菲“合成过程中的中间活性物质,3molNaN3受撞击会生成4mol 氮气和一种离子化合物(Na3N),还放出大量的热.下列有关叙述中错误的是().
NaN3跟水反应是由nh3生成
为什么是错的
怎么分析出来的呀 blue亚麻裙子1年前2
blue亚麻裙子1年前2 -
 通讯报道 共回答了20个问题
通讯报道 共回答了20个问题 |采纳率90%先纠正一点NaN3分解生成的是钠单质
是这样的
NaN3+H2O可逆号=NaOH+HN3
如果你让它生成NH3,是缺少H的1年前查看全部
大家在问
- 1请问有机物和无机物的本质区别在哪里?
- 2有机物和无机物的本质区别是什么?
- 3已知二次函数的图像经过点(1,0).(3.0)和(2.3)求这个二次函数的表达式
- 4占地4公顷的一块三角形苗圃,底是400米,与底对应的高是多少米?
- 51.汽油加上乙醇为什么能缓解汽油危机?2.酿酒发生了怎样的化学变化?3.
- 6化学常见元素的名称,符号怎么背比较容易?
- 7如果两个有机物的的最最简式相同,那它们完全燃烧后的什么会相同,为什么?
- 8把酒话桑麻,何日君再来?
- 9用过氧化氢制取氧气时,分液漏斗中的过氧化氢溶液必须缓缓地滴入锥形瓶中.这是为什么?
- 10过氧化氢和二氧化锰制取氧气的装置中,锥形瓶中应该放什么?长颈漏斗中应该放什么?
- 11人类还能在地球生存多少年?
- 12修路队修一段公路,已修的米数与未修的米数的比是4:5.如果再修60米,就正好修了一半,这条公路长多少米?
- 13两个圆柱高相等,大圆柱底面半径等于小圆柱底面直径,小圆柱体积是大圆柱的( )
- 14我一有消息就通知你,用英语怎么翻译
- 15如有消息,我会及时通知您.怎么翻译?


