锌与稀硫酸反应制H2有15克,锌可制得多少克氧气?多少体积的氧气?
 hylhyl2022-10-04 11:39:541条回答
hylhyl2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 before0 共回答了13个问题
before0 共回答了13个问题 |采纳率100%- Zn + H2SO4 === ZnSO4 + H2↑
65 2
15g x
65/2=15g/x
x=0.46g
0.46g/(0.0899g/L)=5.12L
可制得0.46克H2 体积合5.12L - 1年前
相关推荐
- 1.写出下列反应的文字表达式.(1)铁与稀硫酸反应制氢气.(2)铝与稀硫酸反应制氢气.(3)锌与稀硫酸反应制氢气.(4)
1.写出下列反应的文字表达式.
(1)铁与稀硫酸反应制氢气.
(2)铝与稀硫酸反应制氢气.
(3)锌与稀硫酸反应制氢气.
(4)氧化碳与稀硫酸反应.
(5)氧化镁与稀盐酸反应.
2.填空题.
(1)煤气的主要成分是___.煤气中毒实质上是___玉血液中的___结合,使人体缺氧而引起.
(2)煤在氧气充足的条件下燃烧产生___气体,而煤在氧气不充足的条件下燃烧产生的气体是___.反应的文字表达式分别是______和______. 沁如祉水1年前2
沁如祉水1年前2 -
 flyfwy 共回答了15个问题
flyfwy 共回答了15个问题 |采纳率100%2Fe+3H2so4=Fe2(so4)3+3H2
2Al+3H2so4=Al2(so4)3+3H2
Zn+H2so4=Znso4+H2
Mg+2Hcl=Mgcl2+H2
煤气的主要成分是_co__.煤气中毒实质上是co__和血液中红细胞_结合,使人体缺氧而引起.
(2)煤在氧气充足的条件下燃烧产生_co2__气体,而煤在氧气不充足的条件下燃烧产生的气体是_co__.反应的文字表达式分别是_c+o2=co2_和_2c+o2=2co_.1年前查看全部
- 下列物质中,能由金属与稀硫酸反应制得的是
下列物质中,能由金属与稀硫酸反应制得的是
A:CUSO4
B:FE2(SO4)3
C:CU(OH)2
D:BACL2
 jiejie3831年前1
jiejie3831年前1 -
 zhuoyuec 共回答了19个问题
zhuoyuec 共回答了19个问题 |采纳率94.7%B1年前查看全部
- 下列离子方程式正确的是( )A.硫化亚铁与稀硫酸反应制硫化氢气体:S2++2H+→H2S↑B.次氯酸钠溶液中通入过量的
下列离子方程式正确的是( )
A.硫化亚铁与稀硫酸反应制硫化氢气体:S2++2H+→H2S↑
B.次氯酸钠溶液中通入过量的SO2气体:ClO-+SO2+H2O→HClO+HSO −3
C.已知NaAlO2溶液中通少量的CO2生成Al(OH)3沉淀和Na2CO3,则NaAlO2溶液与NaHCO3溶液混合:
+AlO −2
+H2O→Al(OH)3↓+HCO −3CO 2−3
D.Ca(HCO3)2溶液与Ca(OH)2溶液混合:Ca2++
+OH-→CaCO3↓+H2OHCO −3 njshg1年前1
njshg1年前1 -
 annmi0808 共回答了24个问题
annmi0808 共回答了24个问题 |采纳率83.3%解题思路:A、硫化亚铁是难溶于水的物质不能拆成离子;
B、次氯酸根离子具有强氧化性,二氧化硫被氧化为硫酸;
C、碳酸的酸性强于氢氧化铝,偏铝酸根离子结合氢离子促进碳酸氢根离子的电离;
D、同种金属的酸式盐和碱反应生成盐和水;A、硫化亚铁难溶于水,与稀硫酸反应制硫化氢气体的离子方程式为:FeS+2H+=H2S↑+Fe2+;故A错误;
B、次氯酸钠溶液中通入过量的SO2气体,次氯酸根离子氧化二氧化硫为硫酸,离子方程式为:ClO-+SO2+H2O=SO42-+Cl-+2H+;故B错误;
C、NaAlO2溶液与NaHCO3溶液混合,偏铝酸根结合氢离子能力强于碳酸氢根,所以偏铝酸根离子会结合碳酸氢根离子电离出的氢离子,促进碳酸氢根离子电离,离子方程式为:
AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,故C正确;
D、Ca(HCO3)2溶液与Ca(OH)2溶液混合生成碳酸钙出的和水离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故D正确;
故选CD.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子方程式的书写原则和注意问题,涉及酸性的比较、物质溶解性和化学性质以及难溶电解质的转化等知识,题目难度中等,学习中注意把握相关知识.1年前查看全部
- (2013•启东市模拟)实验室用锌和稀硫酸反应制氢气,如果几次实验中锌的用量不同,但硫酸用量相同,锌用量和生成氢气体积(
 (2013•启东市模拟)实验室用锌和稀硫酸反应制氢气,如果几次实验中锌的用量不同,但硫酸用量相同,锌用量和生成氢气体积(同温、同压)关系如图所示.试推断:
(2013•启东市模拟)实验室用锌和稀硫酸反应制氢气,如果几次实验中锌的用量不同,但硫酸用量相同,锌用量和生成氢气体积(同温、同压)关系如图所示.试推断:
(1)锌和过量的硫酸反应,在图中______处;
(2)过量锌和硫酸反应,在图中______处;
(3)适量锌和硫酸反应,在图中______处. rrrrrr1年前1
rrrrrr1年前1 -
 You笨蛋 共回答了21个问题
You笨蛋 共回答了21个问题 |采纳率95.2%解题思路:根据锌与稀硫酸的反应结合图象进行分析,从图象可以看出OA段是生成的氢气量不断增加,到A点氢气量最大,可知在A点时稀硫酸正好用完,再继续加锌氢气量不再变大,所以A点是该反应的转折点,此点表示的是酸中的氢元素恰好全部转化为氢气两者恰好反应,据此分析解答即可.由锌与稀硫酸的反应,观察图象可知,
①锌和过量的H2SO4反应,在锌未反应完时,生成的氢气的质量不断增加,当锌全部参加反应时生成的氢气最多,在图中的O-A处;
②过量的锌和H2SO4反应时,不在产生氢气,氢气的质量达到最大,同时也是定值,在图中的 A-B处;
③当锌与适量的H2SO4恰好完全反应时,生成的氢气最多,在图中A处.
故答为:①O-A;②A-B;③A点评:
本题考点: 金属的化学性质.
考点点评: 此题是对金属与酸反应的考查,解题的关键是针对图象对相关过程的分析,并抓住转折点的含义.1年前查看全部
- (2009•奉贤区二模)用65g锌粒与含1mol溶质的稀盐酸反应制取H2为M克,用56g铁与含1mol溶质的稀硫酸反应制
(2009•奉贤区二模)用65g锌粒与含1mol溶质的稀盐酸反应制取H2为M克,用56g铁与含1mol溶质的稀硫酸反应制取H2为N克,问:M和N的大小关系正确的是( )
A.M=N
B.M>N
C.M<N
D.无法确定 wb6111年前1
wb6111年前1 -
 善良的狗 共回答了16个问题
善良的狗 共回答了16个问题 |采纳率87.5%解题思路:根据金属活动性,锌和铁都能和酸反应,根据反应的化学方程式进行计算,比较得出的结果即可.设锌和1mol盐酸反应生成氢气质量为M
Zn+2HCl=ZnCl2+H2↑
22
1mol Mg
[2/2=
1mol
Mg]
M=1g
设铁与1mol硫酸反应生成氢气质量为N,
Fe+H2SO4=FeSO4+H2↑
1 2
1molNg
[1/2=
1mol
Ng]
N=2g
所以N>M,
故选C点评:
本题考点: 根据化学反应方程式的计算;氢气的制取和检验;金属的化学性质.
考点点评: 此题考查了金属和酸反应的有关计算,要利用有用的数据进行计算,此题难度中等.1年前查看全部
- 实验室常用锌和稀硫酸反应制氢气.若制取0.2g氢气,需要锌的质量是多少?
 驿动的心LB1年前3
驿动的心LB1年前3 -
 越轘辕 共回答了13个问题
越轘辕 共回答了13个问题 |采纳率92.3%解题思路:首先正确写出锌和稀硫酸反应的化学方程式,然后根据方程式,利用氢气的质量求出需要金属锌的质量.设反应需要锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
[65/x=
2
0.2g]
解之得:x=6.5g
答:需要金属锌6.5克.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题是根据化学方程式的计算题,该题比较简单,就是用一种生成物的质量求一种反应物的质量,属于最基本类型的计算题.1年前查看全部
- 1:用氢气还原氧化铜制的单质铜.若要得到3.2克铜所需的氢气需要多少克锌与足量的稀硫酸反应制得?
 请你自觉1年前4
请你自觉1年前4 -
 yancong 共回答了19个问题
yancong 共回答了19个问题 |采纳率100%H2+CuO=加热=Cu+H2O
2 64
m(H2) 3.2g
2/m(H2)=64/3.2
解得m(H2)=0.1g
Zn+H2SO4==ZnSO4+H2↑
65 2
m(Zn) 0.1g
65/m(Zn)=2/0.1
解得m(Zn) = 3.25g
所以需要3.25gZn1年前查看全部
- 化学反应气体体积 计算25度、101kPa时,用化学反应气体体积测定1mol气体体积,若用Zn粉代替镁条与稀硫酸反应制H
化学反应气体体积 计算
25度、101kPa时,用化学反应气体体积测定1mol气体体积,若用Zn粉代替镁条与稀硫酸反应制H2,则应称取锌粉质量约为多少克? _三星_1年前1
_三星_1年前1 -
 表xx 共回答了26个问题
表xx 共回答了26个问题 |采纳率92.3%可用方程式求出答案.
则因为是生成1摩尔的氢气.
有:Zn+H2SO4=ZnSO4+H2
1 1
X 1
则由1/X=1/1可得X=1,则需要锌的物质的量为1摩尔.
因为锌的相对原子质量为65,
所以需要锌的质量为65克.1年前查看全部
- 初三化学铁锈跟稀硫酸反应制硫酸亚铁的化学方程式
 天空为何那么暗1年前9
天空为何那么暗1年前9 -
 愁天 共回答了20个问题
愁天 共回答了20个问题 |采纳率90%Fe+Fe2O3+3H2SO4=3FeSO4+3H2
Fe+H2SO4=FeSO4+H2
气体箭头自己标下1年前查看全部
- 实验室用锌和稀硫酸反应制氢气,若用32.5g锌和足量稀硫酸反应,试求
实验室用锌和稀硫酸反应制氢气,若用32.5g锌和足量稀硫酸反应,试求
①生成标准状况下的氢气的体积②消耗的硫酸的物质的量③生成硫酸锌的物质的量 wgy3867467711年前1
wgy3867467711年前1 -
 钱有多重 共回答了19个问题
钱有多重 共回答了19个问题 |采纳率94.7%设生成氢气的体积为X,消耗硫酸的物质的量为Y,生成硫酸锌的物质的量为Z
Zn + H2SO4 = ZnSO4 + H2↑
65 1 1 22.4
32.5g Y Z X
X=11.2L
Y=0.5mol
Z=0.5mol
答:①生成标准状况下的氢气的体积为11.2升
②消耗的硫酸的物质的量0.5mol
③生成硫酸锌的物质的量0.5mol1年前查看全部
- 32.用锌片与稀硫酸反应制H2 ,每次实验结果记录如下:
32.用锌片与稀硫酸反应制H2 ,每次实验结果记录如下:
次数 加入锌片的质量/g 稀硫酸质量/g 产生H2质量/g
1 1.95 100 0.06
2 3.9 100
3 5.85 100 0.18
4 7.8 100 0.2
5 9.75 100
6 11.7 100 0.2
(1)第二、五次产生的氢气质量是多少?
(2)稀硫酸的溶质质量分数为多少? (过程)
 2824398851年前1
2824398851年前1 -
 fishice_wb 共回答了18个问题
fishice_wb 共回答了18个问题 |采纳率83.3%1、第二次0.12 第五次0.2
2、100G稀硫酸产生0.2G的氢气
根据计算100G稀硫酸里有9.8G的硫酸
所以质量分数为9.8%1年前查看全部
- 某科学兴趣小组要在实验室制取一定量的MgSO 4 .同学们分别在实验室里找到了以下四种反应物,其中不能通过与稀硫酸反应制
某科学兴趣小组要在实验室制取一定量的MgSO 4 .同学们分别在实验室里找到了以下四种反应物,其中不能通过与稀硫酸反应制得MgSO 4 的是( ) A.Mg B.MgO C.Mg(OH) 2 D.MgCl 2  暗暗侠1年前1
暗暗侠1年前1 -
 木质素1983 共回答了22个问题
木质素1983 共回答了22个问题 |采纳率81.8%A、镁可与硫酸反应生成硫酸镁,方案可行;
B、氧化镁可与硫酸反应生成硫酸镁和氢气,方案可行;
C、氢氧化镁和硫酸反应生成硫酸镁和水,方案可行;
D、氯化镁与硫酸不反应,生成物中无气体、沉淀和水,故不能通过与稀硫酸反应制得MgSO 4 ,符合题意;
故选D.1年前查看全部
- 用过量的锌和500ml稀硫酸反应制氢气,当反应停止时,制得氢气6g,试求稀硫酸的物质的量浓度.
 加州物管是狗1年前1
加州物管是狗1年前1 -
 jjssahz 共回答了19个问题
jjssahz 共回答了19个问题 |采纳率84.2%H2SO4----------H2
1mol--------------2g
3mol--------------6g
此稀硫酸的物质的量浓度是
3/0.5=6mol/L1年前查看全部
- 用过量的锌和500MOL稀硫酸反应制氢气,当反应停止时,制得氢气6g,氢气中所含氢原子的数目是
 ronaldomhl11年前4
ronaldomhl11年前4 -
 deeper13 共回答了12个问题
deeper13 共回答了12个问题 |采纳率91.7%H2的物质的量 = 6 g ÷ 2 g/mol = 3 mol
氢分子数 = 3 mol × NA = 3NA
氢原子数 = 2×氢分子数 = 6NA = 3.612×10^24个
答案:3.612×10^24个1年前查看全部
- 用足量的铁片与一定量的稀硫酸反应制氢气,下列措施既能使氢气的生成速率加快,又不影响氢气的产量的是( )
用足量的铁片与一定量的稀硫酸反应制氢气,下列措施既能使氢气的生成速率加快,又不影响氢气的产量的是( )
A.滴入适量Na2SO4溶液
B.不用稀硫酸,改用98%的浓硫酸
C.加入少量碳酸钠固体
D.不用铁片,改用等质量的铁粉 s317051年前1
s317051年前1 -
 janvis 共回答了19个问题
janvis 共回答了19个问题 |采纳率94.7%解题思路:增大铁片与稀硫酸的反应速率,可从影响反应速率的外界因素思考,可增大浓度、升高温度、增大固体的表面积以及形成原电池反应等,注意浓硫酸与铁发生钝化反应.A.滴入适量Na2SO4溶液,氢离子浓度降低,反应速率减小,故A错误;
B.改用98%的浓硫酸,与铁发生钝化反应,不生成氢气,故B错误;
C.加入少量碳酸钠固体,消耗硫酸,生成二氧化碳气体,生成氢气的总量减小,故C错误;
D.改用等质量的铁粉,固体表面积增大,反应速率增大,生成氢气的总量不变,故D正确.
故选D.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意浓硫酸与铁发生钝化反应的性质,为易错点.1年前查看全部
- (上它它9•宿迁二模)实验化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含
(宿迁二模)实验化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(上n地O4•9H上O).某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质.
(1)制备皓矾的实验流程1图所示.
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)9:上.9一9.9
Fe(OH)上:9.6一9.6
上n(OH)上:5.9一5.它
试回答下列问题:①加入的试剂①,供选择使用的有:氨水、NaClO溶液、上它%的H上O上、浓硫酸、浓硝酸等,应选用______,其理由是______
②加入的试剂②,供选择使用的有:上n粉、上nO、上n(OH)上、上nCO9、上n地O4等,应选用______,其理由是______
③从晶体1→晶体上,该过程的名称是______.
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是______.
(上)探究上n地O4•9H上O的性质
⑤称取上5.9g上n地O4•9H上O研细后置于坩埚中小心加热,测得残留固体的质量与温度的对应数据见下表:
试写出上n地O4•9H上O加热到1它它它℃时的反应方程式温度(℃) 6它 上4它 99它 1它它它 残留固体质量(g) 19.9 16.1 5.1 5.1 上n地O4•9H上O
上nO+地O9+9H上O1它它它℃ .上n地O4•9H上O.
上nO+地O9+9H上O1它它它℃ .
⑥取少量上n地O4•9H上O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解;若改用氨水得到相同的现象.查资料知,氢氧化锌与氢氧化铝均有两性,且锌离子可与氨水形成络合离子[上n(NH9)4]上+.则上n(OH)上沉淀中加入NaOH溶液和加氨水均得到无色溶液的离子反应方程式为:______(任写一个). 13ge11年前1
13ge11年前1 -
 qhss2002 共回答了16个问题
qhss2002 共回答了16个问题 |采纳率75%解题思路:(1)①依据流程分析判断,试剂1是为了把亚铁离子氧化为铁离子,在PH=2.7-3.可以全部沉淀,其他离子不沉淀,同时加入的试剂不能引入新的杂质;
②试剂2是用来调节溶液PH到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;
③晶体重新结晶的过程是物质提纯的方法是重结晶;
④洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;
(2)⑤根据ZnSO4•7H2O加热到1000℃时所的固体的质量情况来确定成分;
(2)氢氧化锌具有两性,可以和强碱反应可溶于水的盐.(多)①化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,溶于酸后生成亚铁离子锌离子,依据开始生成氢氧化物沉淀到沉淀完全的四H范围分别为:Fe(OH)3:0.7-3.7Fe(OH)0:7.6-9.6 Zn(OH)0:他.7-8,分析判断,直接沉淀亚铁离子,锌离子也会全部全部沉淀,不能实现实验目的和要求,除去亚铁离子需要先把亚铁离子氧化为铁离子,调节溶液四H使三价铁离子全部沉淀,此时锌离子不沉淀,来实现分离,加入的氧化剂不能引入新的杂质,氨水、NaClO溶液、00%的H0O0、浓硫酸、浓硝酸中只有00%的H0O0 在氧化亚铁离子不引入杂质,故答案为:00%的H0O0;将制氢废液中的Fe0+氧化成Fe3+,同时避免引入新的杂质;
②试剂0是用来调节溶液四H到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;Zn粉会把氧化得到的铁离子还原,起不到除去的作用,ZnO、Zn(OH)0、ZnCO3可以反应调节溶液四H到3.7,使铁离子沉淀,同时不引入新的杂质,ZnSO4不能调节溶液四H,且引入杂质硫酸根离子,故答案为:ZnO、Zn(OH)0、ZnCO3;
③晶体溶解再结晶是提纯晶体的方法为重结晶;故答案为:重结晶;
④洗涤晶体表面的杂质离子,同时减了皓钒晶体的损失;在得到皓矾时,向晶体中加入了量酒精洗涤而不用水的原因是,晶体溶于水,不溶于酒精,所以目的是为n冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率;故答案为:为n冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率;
(0)⑤ZnSO4•7H0O加热到多000℃时所的固体的质量为8.多g,加热到60°会将所有的结晶水失去,到多000℃时硫酸锌已经分解为氧化锌、三氧化硫,故答案为:ZnSO4•7H0O
多000℃
.
ZnO+SO3+7H0O,故答案为:ZnSO4•7H0O
多000℃
.
ZnO+SO3+7H0O;
⑥向硫酸锌中逐滴加入NaOH溶液,发现先产生白色沉淀氢氧化锌,然后又逐渐溶解在氢氧化钠中,发生的化学反应为;Zn(OH)0+0OH-=ZnO00-+0H0O,故答案为:Zn(OH)0+0OH-=ZnO00-+0H0O.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题是一道关于物质的分离和提纯的综合实验设计题,考查学生分析和解决问题的能力,难度大.1年前查看全部
- 用过量的锌和500毫升稀硫酸反应制氢气,当反应停止时,制的氢气67.2升(标准状况下),稀硫酸物质的量浓度
 pjwwy1年前1
pjwwy1年前1 -
 yunfeng5219 共回答了23个问题
yunfeng5219 共回答了23个问题 |采纳率87%n(H2SO4) = n(H2)=67.2L / (22.4L/mol)= 3mol
c(H2SO4)= 3mol / 0.5L = 6mol/L1年前查看全部
- 下列离子方程式正确的是( ) A.硫化亚铁与稀硫酸反应制硫化氢气体:S 2+ +2H + →H 2 S↑ B.次氯酸钠
下列离子方程式正确的是( ) A.硫化亚铁与稀硫酸反应制硫化氢气体:S 2+ +2H + →H 2 S↑ B.次氯酸钠溶液中通入过量的SO 2 气体:ClO - +SO 2 +H 2 O→HClO+ HSO -3 C.已知NaAlO 2 溶液中通少量的CO 2 生成Al(OH) 3 沉淀和Na 2 CO 3 ,则NaAlO 2 溶液与NaHCO 3 溶液混合:
+AlO -2
+H 2 O→Al(OH) 3 ↓+HCO -3 CO 2-3 D.Ca(HCO 3 ) 2 溶液与Ca(OH) 2 溶液混合:Ca 2+ +
+OH - →CaCO 3 ↓+H 2 OHCO -3  pepelulu1年前1
pepelulu1年前1 -
 wcg829 共回答了24个问题
wcg829 共回答了24个问题 |采纳率83.3%A、硫化亚铁难溶于水,与稀硫酸反应制硫化氢气体的离子方程式为:FeS+2H + =H 2 S↑+Fe 2+ ;故A错误;
B、次氯酸钠溶液中通入过量的SO 2 气体,次氯酸根离子氧化二氧化硫为硫酸,离子方程式为:ClO - +SO 2 +H 2 O=SO 4 2- +Cl - +2H + ;故B错误;
C、NaAlO 2 溶液与NaHCO 3 溶液混合,偏铝酸根结合氢离子能力强于碳酸氢根,所以偏铝酸根离子会结合碳酸氢根离子电离出的氢离子,促进碳酸氢根离子电离,离子方程式为:
AlO 2 - +HCO 3 - +H 2 O=Al(OH) 3 ↓+CO 3 2- ,故C正确;
D、Ca(HCO 3 ) 2 溶液与Ca(OH) 2 溶液混合生成碳酸钙出的和水离子方程式为:Ca 2+ +HCO 3 - +OH - =CaCO 3 ↓+H 2 O,故D正确;
故选CD.1年前查看全部
- (7分)某化学课外小组的同学用Mg等与稀硫酸反应制H 2 ,根据反应进行的情况,同学们得出了反应时间与产生H 2 的体积
(7分)某化学课外小组的同学用Mg等与稀硫酸反应制H 2 ,根据反应进行的情况,同学们得出了反应时间与产生H 2 的体积关系,并做出了如下图象。请回答:

(1)分析判断,_____________段化学反应速度最快,原因可能是___________________;
FG段化学反应速率较慢的原因可能是____________________________________________。
(2)为了降低该反应的反应速率,你认为可以采取哪些措施_________________(至少说出两种)。 mcl19711年前1
mcl19711年前1 -
 lant47 共回答了19个问题
lant47 共回答了19个问题 |采纳率84.2%(1)EF 反应放热,温度升高 浓度下降较快 (2)向反应体系中加水,降低酸的浓度,或加入少量CH 3 COONa晶体
图象纵坐标为产生H 2 的体积,横坐标为反应的时间,所以曲线的斜率即为反应速率。增大反应速率的因素有:①增大反应物浓度,②增大反应体系压强,③升高温度,④加催化剂。但此反应过程浓度始终在下降,且为敞口体系,压强不变,也未加催化剂,所以在反应过程中浓度下降的同时速率反而提高,只能是温度的影响。1年前查看全部
- 实验室常用锌和稀硫酸反应制氢气.先要制取标准状况下的氢气2.24L,至少需要锌多少克?
 望舒草9941年前4
望舒草9941年前4 -
 龙颜舞 共回答了12个问题
龙颜舞 共回答了12个问题 |采纳率91.7%理论很容易算,实际挺不好算的,反应达到平衡就不反应了,所以锌不会完全反应,算也就比较麻烦1年前查看全部
- 用纯锌片和稀硫酸反应制H2时反应不快,可将锌片的一角在硫酸铜溶液中浸一下,再和硫酸反应,可加快产生H2的速率
 gggg4321年前5
gggg4321年前5 -
 chester25 共回答了15个问题
chester25 共回答了15个问题 |采纳率80%锌首先和硫酸铜反应生成铜构成了原电池,所以反应速率会加大.
关于原电池,可以看看链接1年前查看全部
- 实验室常用锌和稀硫酸反应制氢气.若制取0.2g氢气,需要锌的质量是多少?
 巴西非勒1年前1
巴西非勒1年前1 -
 wind_shu 共回答了16个问题
wind_shu 共回答了16个问题 |采纳率93.8%解题思路:首先正确写出锌和稀硫酸反应的化学方程式,然后根据方程式,利用氢气的质量求出需要金属锌的质量.设反应需要锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
[65/x=
2
0.2g]
解之得:x=6.5g
答:需要金属锌6.5克.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题是根据化学方程式的计算题,该题比较简单,就是用一种生成物的质量求一种反应物的质量,属于最基本类型的计算题.1年前查看全部
- 实验室用Zn和稀硫酸反应制氢气,若用32.5克Zn与足量的稀硫酸反应,试求
实验室用Zn和稀硫酸反应制氢气,若用32.5克Zn与足量的稀硫酸反应,试求
生成标准状况下的氢气的体积;反应消耗的硫酸的物质的量;生成硫酸锌的物质的量. XSFFRRRRR1年前2
XSFFRRRRR1年前2 -
 fengvsran 共回答了25个问题
fengvsran 共回答了25个问题 |采纳率84%Zn + H2SO4=========ZnSO4 + H2
65g 1mol 1mol 1mol
32.5g y=0.5mol z=0.5mol x=0.5mol
生成标准状况下的氢气的体积:v=0.5mol*22.4L/mol=11.2L
反应消耗的硫酸的物质的量0.5mol;生成硫酸锌的物质的量0.5mol1年前查看全部
- 高一化学必修一离子方程式1、锌与稀硫酸反应制氢气的离子方程式2、铜片插入硝酸银溶液中的离子方程式3、碳酸氢钠与稀盐酸混合
高一化学必修一离子方程式
1、锌与稀硫酸反应制氢气的离子方程式
2、铜片插入硝酸银溶液中的离子方程式
3、碳酸氢钠与稀盐酸混合的离子方程式 随我言1年前1
随我言1年前1 -
 神样_沙少 共回答了19个问题
神样_沙少 共回答了19个问题 |采纳率94.7%Zn + 2H+= Zn2+ + H2↑ Cu + 2Ag+ = 2Ag + Cu2+HCO3- + H+ = H2O + CO2↑元素符号后面的加号均为电荷数,为上角标.离子反应其实很简单,在刚学离子反应时可以先写出化学反应式,然后根据溶质在溶液中的状态将可以拆开的...1年前查看全部
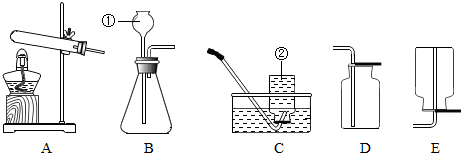
- 请根据下列装置,回答问题:(1)写出标号①②的仪器名称:①______,②______.(2)常温下,用锌和稀硫酸反应制
请根据下列装置,回答问题:

(1)写出标号①②的仪器名称:①______,②______.
(2)常温下,用锌和稀硫酸反应制取氢气,应选用的发生装置是______(填字母序号,下同),选用装置______能收集到较干燥的H2.
(3)实验室通常用稀盐酸和石灰石反应制取CO2,该反应的化学方程式为______.此外,CO2也可以用碳酸氢钠(NaHCO3)固体加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为:2NaHCO3
Na2CO3+H2O+CO2↑△ .2NaHCO3;若用此法来制取CO2,应选用的发生装置是______.实验室常用______(填试剂名称)检验二氧化碳,发生反应的化学方程式为______;判断CO2已收集满的方法是______.
Na2CO3+H2O+CO2↑△ .
(4)用高锰酸钾制取O2,装置A还缺少的一种用品是______;要收集一瓶较纯净的氧气,最好选用装置______(填装置序号).
(5)用装置F制取气体,在反应过程中,用弹簧夹夹住导气管上的橡皮管,过一会儿反应就会停止.其原因是______. 各自保平安1年前1
各自保平安1年前1 -
 帅帅鸽 共回答了11个问题
帅帅鸽 共回答了11个问题 |采纳率63.6%解题思路:(1)要熟悉各种仪器的名称、用途和使用方法;(2)根据反应物的状态、反应条件、生成气体的性质可以确定发生装置、收集装置;(3)石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳能使澄清石灰水变浑浊,二氧化碳的密度比空气大,不能燃烧,不支持燃烧;(4)实验室可以用加热高锰酸钾的方法制取氧气,高锰酸钾受热容易扩散,氧气不易溶于水,密度比空气大;(5)利用装置F制取气体的优点是,可以随时使反应进行,也可以随时使反应停止.(1)①是长颈漏斗,通过长颈漏斗可以向锥形瓶中注入液体;②是水槽,用排水法收集气体时要用到水槽.
故填:长颈漏斗;水槽.
(2)常温下,锌和稀硫酸反应生成硫酸锌和氢气,B和F装置都可以用作制取氢气的发生装置,氢气难溶于水,可以用排水法收集,但是收集的氢气不干燥,氢气的密度比空气小,可以用向下排空气法收集,即用E装置收集,收集的氢气比较干燥.
故填:B或F;E.
(3)碳酸钙和稀盐酸反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
碳酸氢钠受热分解的化学方程式为:2NaHCO3
△
.
Na2CO3+H2O+CO2↑;
利用碳酸氢钠分解制取二氧化碳需要加热,应该选择A装置作为发生装置;
实验室常用澄清石灰水检验二氧化碳,因为二氧化碳能和石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
判断二氧化碳已收集满的方法是:把燃烧的木条放在集气瓶口,如果燃烧的木条熄灭,说明已经收集满.
故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;2NaHCO3
△
.
Na2CO3+H2O+CO2↑;A;澄清石灰水;CO2+Ca(OH)2═CaCO3↓+H2O;把燃烧的木条放在集气瓶口,如果燃烧的木条熄灭,说明已经收集满.
(4)用高锰酸钾制取氧气时,因为高锰酸钾受热容易扩散,为了防止高锰酸钾进入导管,通常在试管口塞一团棉花;
因为氧气的密度比空气大,可以用向上排空气法收集,氧气不易溶于水,可以用排水法收集,用排水法收集的氧气比用向上排空气法收集的氧气较纯净一些.
故填:一团棉花;D.
(5)过一会儿反应就会停止的原因是:反应中产生的气体使右侧管内的压强增大,使固、液分离,反应停止.
故填:反应中产生的气体使右侧管内的压强增大,使固、液分离,反应停止.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;二氧化碳的实验室制法;二氧化碳的检验和验满;氢气的制取和检验;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查二氧化碳、氧气的性质、发生装置和收集装置的选择及其化学方程式的书写,书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.1年前查看全部
- 化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,使得溶液中混有
化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4•7H2O).某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾.制备皓矾的实验流程如图所示.

已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7Fe(OH)2:7.6-9.6Zn(OH)2:5.7-8.0试回答下列问题:
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用______,其理由是______;
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用______;
(3)从晶体1→晶体2,该过程的名称是______;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是______. 589844441年前1
589844441年前1 -
 jasonwuhan 共回答了18个问题
jasonwuhan 共回答了18个问题 |采纳率94.4%解题思路:(1)依据流程分析判断,试剂1是为了把亚铁离子氧化为铁离子,在PH=2.7-3.可以全部沉淀,其他离子不沉淀,同时加入的试剂不能引入新的杂质;
(2)试剂2是用来调节溶液PH到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;
(3)晶体重新结晶的过程是物质提纯的方法是重结晶;
(4)洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;(1)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,溶于酸后生成亚铁离子锌离子,依据开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8,分析判断,直接沉淀亚铁离子,锌离子也会全部全部沉淀,不能实现实验目的和要求,除去亚铁离子需要先把亚铁离子氧化为铁离子,调节溶液PH使三价铁离子全部沉淀,此时锌离子不沉淀,来实现分离,加入的氧化剂不能引入新的杂质,氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸中只有20%的H2O2 在氧化亚铁离子不引入杂质,故答案为:20%的H2O2;将制氢废液中的Fe2+氧化成Fe3+,同时避免引入新的杂质;
(2)试剂2是用来调节溶液PH到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;
a、Zn粉会把氧化得到的铁离子还原,起不到除去的作用,故a不符合;
b、ZnO可以反应调节溶液PH到3.7,使铁离子沉淀,同时不引入新的杂质,故b符合;
c、Zn(OH)2可以反应调节溶液PH到3.7,使铁离子沉淀,同时不引入新的杂质,故c符合;
d、ZnCO3可以反应调节溶液PH到3.7,使铁离子沉淀,同时不引入新的杂质,故d符合;
e、ZnSO4不能调节溶液PH,且引入杂质硫酸根离子,故e不符合;
故答案为:bcd;
(3)晶体溶解再结晶是提纯晶体的方法为重结晶;
故答案为:重结晶;
(4)洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是,晶体溶于水,不溶于酒精,所以目的是为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率;
故答案为:为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率;点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了物质提纯的实验方案设计和试剂选择,关键是除杂原则不能引入新的杂质,考查了铁、锌及其化合物性质的应用,题目难度中等.1年前查看全部
- (12分)某学生在课外活动中用铁粉(含杂质且杂质不参加反应)和稀硫酸反应制
(12分)某学生在课外活动中用铁粉(含杂质且杂质不参加反应)和稀硫酸反应制
取氢气。所做5次实验结果记录如下表(每次实验产生的氢气全部被收集,且体积在相同
条件下测定。该条件下氢气的密度是0.089∥L),
根据上述实验结果进行分析、计算,并回答下列问题:
(1)上述实验中,铁粉一定过量的实验编号是_________;
(2)铁粉的纯度是________;
(3)计算稀硫酸的质量分数(要求写出计算过程,计算结果精确到0.1)。 303550441年前1
303550441年前1 -
 溜溜的敏敏 共回答了21个问题
溜溜的敏敏 共回答了21个问题 |采纳率95.2%(1)5 (2分) (2)96.5%(3分)
(3)根据表中所给数据分析,确定3组实验恰好完全反应……………………(1分)
设生成2.24 L氢气需H 2 S0 4 的质量为m
Fe + H 2 S0 4 = FeS0 4 +H 2 ↑………………………………………………(2分)
98 2
m 2.24 L×0.089 g/L
98/m= 2/ (2.24 L×0.089 g/L)
m=9.8 g………………………………………………………………(2分)
稀硫酸的质量分数=9.8g/50g×l00%=19.6%………………………………………(1分)
答:稀硫酸的质量分数是19.6%。 (1分)
分析:(1)根据实验3和实验5可以看出同样是50g稀硫酸,与不同质量的铁粉反应放出氢气的体积相等,说明在第五次实验中加入的铁粉是过量的;
(2)比较实验3和实验5,不同质量的铁粉与等质量的硫酸反应生成氢气的质量相等,说明此时硫酸的已经被完全消耗,即50g硫酸只能产生2.24L氢气,比较实验3和实验4,同质量的铁粉和不同质量的硫酸反应生成氢气的质量相等,说明此时铁粉已被完全消耗,即5.8g铁只能产生2.24L氢气,综合两方面的分析可以知道5.8g铁粉和50g硫酸恰好完全反应,即实验3是恰好完全反应的,故可以根据实验3的数据完成(2)和(3)的计算.
(1)比较实验3和实验5可知:同样是50g稀硫酸,与不同质量的金属反应放出氢气的体积相等,所以可以判断实验5中的金属是过量的;
根据表中所给数据分析,确定3组实验恰好完全反应
(2)设生成2.24 L氢气需H 2 S0 4 的质量为x,5.8个铁粉中含有铁的质量为y,则:
Fe+H 2 S0 4 ═FeS0 4 +H 2 ↑
56 98 2
y x 2.24 L×0.089 g/L =
= =
=
解得:x=9.8 g y=5.6g
(2)铁的纯度为: ×100%=96.6%;
×100%=96.6%;
(3)稀硫酸的质量分数= ×l00%=19.6%;
×l00%=19.6%;
答:(3)稀硫酸的质量分数是19.6%.
故答案为:(1)5;
(2)96.6%;
(3)19.6%.
<>1年前查看全部
- 用锌与稀硫酸反应制得氢气22.4L(标准状况下),问需要锌粒多少克?(在标准状况下氢气的密度约为0.09g/L
 源源生1年前3
源源生1年前3 -
 hainandao888 共回答了20个问题
hainandao888 共回答了20个问题 |采纳率80%n(H2)=22.4/22.4=1mol
Zn+H2SO4==ZnSO4+H2↑
65 1
x 1mol
65/x = 1/1
解得x = 65g
所以需要锌粒65g1年前查看全部
- 实验室里用Zn与足量的稀硫酸反应制氢气,若需要4480毫升氢气,需要多少摩尔Zn和多少克20%的硫酸
 betawww1年前1
betawww1年前1 -
 aardvark2003 共回答了21个问题
aardvark2003 共回答了21个问题 |采纳率85.7%Zn + H2SO4 = ZnSO4 + H2↑
V(H2)=4.480/22.4=0.2mol
所以n(Zn)=0.2mol
n(H2SO4)=0.2mol
m(H2SO4)=19.6g
m(20%的硫酸)=19.6/20%=98g
∴需要0.2摩尔Zn和98克20%的硫酸1年前查看全部
- (2012•斗门区一模)(1)实验室中常用氯酸钾和二氧化锰加热制氧气、锌粒与稀硫酸反应制氢气、石灰石与稀盐酸制二氧化碳气
(2012•斗门区一模)(1)实验室中常用氯酸钾和二氧化锰加热制氧气、锌粒与稀硫酸反应制氢气、石灰石与稀盐酸制二氧化碳气体.
写出标号仪器的名称①______②______
请结合所给药品选择适当的气体发生和收集装置填入下表:(填字母)
(2)由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题.某化学研究小组的同学欲对某种塑料袋的组成进行分析探究(资料显示该塑料只含C、H两种元素),他们设计了如图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量.气体 发生装置 收集装置 O2 ______ ______ H2 ______ ______ CO2 ______ ______ 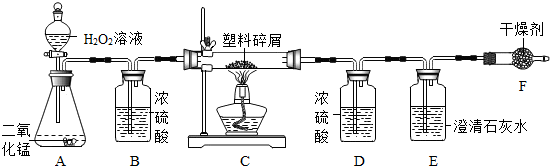
①仪器B的作用是______.
②仪器E中的现象是______.
③若仪器C的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,若仪器D增重a g,则Wg该塑料试样中含氢元素的质量为[1/9]a[1/9]ag(计算结果可为分数形式)
④若装置中没有连接仪器B,将使该塑料试样中氢元素的质量测算结果______(填“偏小”、“偏大”、“无影响”中之一). rusiwei1年前1
rusiwei1年前1 -
 我也爱弹吉它 共回答了26个问题
我也爱弹吉它 共回答了26个问题 |采纳率84.6%解题思路:(1)根据发生装置和收集装置的选择依据进行分析解答.
(2)对某种塑料袋的组成元素进行分析探究,用好题中信息,结合课本知识含氢元素的物质燃烧产生水,含碳元素的物质燃烧生成二氧化碳;以上知识再结合题中实验解答该题.另外还用到根据质量守恒定律和化学式计算某元素的质量分数.(1)①长颈漏斗;②集气瓶
(2)装置B中装的是浓硫酸,浓硫酸用于除水蒸气;
(3)装置E中装的是澄清的石灰水,是用来检验二氧化碳的,二氧化碳能使澄清的石灰水变浑浊;
(4)塑料试样充分燃烧后,浓硫酸具有吸水性,故D增重的质量就是W g该塑料试样燃烧生成的水的质量,装置D增重a g,据质量守恒定律,水中氢元素即塑料样品中的氢元素,所以W g该塑料试样中含氢元素的质量为 [1/9]ag;
(5)若整套装置中没有连接仪器B,会使氧气中的水蒸会进入装置D,从而使实验测得的水的质量大于塑料样品燃烧生成的水,故将使该塑料试样中氢元素的质量测算结果偏大.
故答案为:
(1)①长颈漏斗;②集气瓶
气体 发生装置 收集装置
O2 A C或D
H2 B C或E
CO2 B D(2)①除去气体中的水蒸气;②澄清石灰水变浑浊;③[1/9]a;④偏大点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;化学实验方案设计与评价;常见气体的检验与除杂方法;白色污染与防治.
考点点评: 本题是实验探究题,考查了装置的选择依据及化合物中碳元素和氢元素的验证过程和根据化学式的计算,综合性极强,只要看清反应的实质较易解答该题.1年前查看全部
- 锌和稀硫酸反应制硫酸锌晶体为什么要用杂锌
 若尘hene1年前1
若尘hene1年前1 -
 99dn142 共回答了21个问题
99dn142 共回答了21个问题 |采纳率81%纯锌反应很慢,杂锌中含有许多没有锌活泼的金属,构成无数微小的原电池,可以大大加快反应速率1年前查看全部
- 铁与稀硫酸反应制氢气为什么用18mol/L的硫酸代替稀硫酸不能使氢气生成速率加大
 zlyj12301年前4
zlyj12301年前4 -
 qqj526 共回答了16个问题
qqj526 共回答了16个问题 |采纳率100%因为18mol/L的硫酸会使铁钝化,铁表面会生成一层致密的氧化膜,防止硫酸氧化其内部.1年前查看全部
- 粗锌代替纯锌和稀硫酸反应制氢气符合绿色化学理念吗
 红发妖人1年前1
红发妖人1年前1 -
 裸露寄居蟹 共回答了15个问题
裸露寄居蟹 共回答了15个问题 |采纳率80%粗锌含有铜,铁等.铜不和硫酸反应,和锌组成原电池,能使反应加快.在锌反应完之后,铁也会和硫酸反应生成氢气.
但是,绿色化学是什么理念,我不是太清楚...我觉得应该符合的吧1年前查看全部
- (2008•肇庆二模)用粗锌(含少量Fe等杂质)与稀硫酸反应制氢气,其废液中含有大量的硫酸锌.同学们用制氢气的废液来制取
(2008•肇庆二模)用粗锌(含少量Fe等杂质)与稀硫酸反应制氢气,其废液中含有大量的硫酸锌.同学们用制氢气的废液来制取皓矾(ZnSO4•7H2O),并探究其性质.
(l)制备皓矾实验流程如下图所示:
已知:氢氧化物沉淀的pH范围见下表.
请回答下列问题:氢氧化物 Fe(OH)3 Fe(OH)2 Zn(OH)2 开始沉淀pH 2.7 7.6 5.7 完全沉淀pH 3.7 9.6 8.0
①加入的试剂a,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用______,其理由是______.
②加入的试剂b,供选择使用的有:Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用______,其理由是______.
③从晶体l→晶体2,该过程的名称是______.
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是______.
(2)探究皓矾的性质
⑤称取28.7g ZnSO4•7H2O研细后置于坩埚中小心加热,其固体质量与温度的对应数据见上表.则1000℃时皓矾的反应方程式为______.温度(℃) 60 240 930 1000 残留固体质量(g) 19.7 16.1 8.1 8.1
⑥取少量ZnSO4•7H2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解.查资料得知Zn(OH)2具有两性,则Zn(OH)2溶于NaOH溶液的离子方程式为:______. 苹果宝贝8281年前1
苹果宝贝8281年前1 -
 zxf4759 共回答了17个问题
zxf4759 共回答了17个问题 |采纳率94.1%解题思路:(1)①依据流程分析判断,试剂1是为了把亚铁离子氧化为铁离子,在PH=2.7-3.可以全部沉淀,其他离子不沉淀,同时加入的试剂不能引入新的杂质;
②试剂2是用来调节溶液PH到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;
③晶体重新结晶的过程是物质提纯的方法是重结晶;
④洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;
(2)⑤根据ZnSO4•7H2O加热到1000℃时所的固体的质量情况来确定成分;
⑥氢氧化锌具有两性,可以和强碱反应可溶于水的盐.(1)①化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,溶于酸后生成亚铁离子锌离子,依据开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8,分析判断,直接沉淀亚铁离子,锌离子也会全部全部沉淀,不能实现实验目的和要求,除去亚铁离子需要先把亚铁离子氧化为铁离子,调节溶液PH使三价铁离子全部沉淀,此时锌离子不沉淀,来实现分离,加入的氧化剂不能引入新的杂质,氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸中只有20%的H2O2 在氧化亚铁离子不引入杂质,
故答案为:20%的H2O2;将制氢废液中的Fe2+氧化成Fe3+,同时避免引入新的杂质;
②试剂2是用来调节溶液PH到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;Zn粉会把氧化得到的铁离子还原,起不到除去的作用,ZnO、Zn(OH)2、ZnCO3可以反应调节溶液PH到3.7,使铁离子沉淀,同时不引入新的杂质,ZnSO4不能调节溶液PH,且引入杂质硫酸根离子,
故答案为:ZnO、Zn(OH)2、ZnCO3;调节溶液的pH至3.7~5.7使Fe3+全部转化为Fe(OH)3沉淀,同时避免Zn2+损失和引入其它杂质;
③晶体溶解再结晶是提纯晶体的方法为重结晶,故答案为:重结晶;
④洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是,晶体溶于水,不溶于酒精,所以目的是为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率,
故答案为:为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率;
(2)⑤ZnSO4•7H2O加热到1000℃时所的固体的质量为8.1g,加热到60°会将所有的结晶水失去,到1000℃时硫酸锌已经分解为氧化锌、三氧化硫,故答案为:ZnSO4•7H2O
1000°C
.
ZnO+SO3↑+7H2O↑,故答案为:ZnSO4•7H2O
1000°C
.
ZnO+SO3↑+7H2O↑;
⑥向硫酸锌中逐滴加入NaOH溶液,发现先产生白色沉淀氢氧化锌,然后又逐渐溶解在氢氧化钠中,发生的化学反应为;Zn(OH)2+2OH-=ZnO22-+2H2O,
故答案为:Zn(OH)2+2OH-=ZnO22-+2H2O.点评:
本题考点: 氨的制取和性质.
考点点评: 本题是一道关于物质的分离和提纯的综合实验设计题,考查学生分析和解决问题的能力,难度大.1年前查看全部
- 离子反应方程式和一道化学题1.过量SO2通入少量氨气中2.SO2通入淀粉的碘溶液中,蓝色褪去3.用硫化亚铁和稀硫酸反应制
离子反应方程式和一道化学题
1.过量SO2通入少量氨气中
2.SO2通入淀粉的碘溶液中,蓝色褪去
3.用硫化亚铁和稀硫酸反应制取H2S气体
4.H2S气体通入FeCl3溶液中出现浑浊
5.蔗糖中滴加浓硫酸变成黑面包
可以的话顺便打一下化学方程式(有加分的哦)
某白色固体混合物,可能含有NaHSO4、BaCl2、MaCl2、NaHCO3 和NaAlO2中的一种或几种.对式样进行检验有如下实验现象:1.取少量该固体物质,加水溶解,最终得到澄清溶液,没有沉淀和气体生成;2.向所得澄清溶液中滴加氢氧化钠溶液,有白色沉淀生成,加至过量时沉淀消失 .
1.原混合物中一定含有的物质是:
2.原混合物中不一定含有的物质是:
3.写出实验中产生沉淀和沉淀消失的化学反应方程式 阅人多矣1年前4
阅人多矣1年前4 -
 没有杂乱的ll 共回答了15个问题
没有杂乱的ll 共回答了15个问题 |采纳率93.3%SO2+NH3+H2O=NH4++HSO3-
I2+SO2+2H2O=2I-+SO42-+4H+
FeS+2H+=H2S+Fe2+
H2S+2Fe3+=S+2Fe2++2H+
C12H22O11=(浓硫酸)=12C+11H2O C+2H2SO4(浓)=CO2+2SO2+2H2O
1.NaHSO4 NaAlO2
2.NaHCO3 BaCl2
3.Al3+ +3OH-=Al(OH)3 Al(OH)3+OH-=AlO2-+2H20(4H+ + AlO2-=Al3++2H2O)1年前查看全部
- 甲、乙、丙、丁四位同学用锌与稀硫酸反应制氢气,所得相关数据记录如下(误差忽略不计)
甲、乙、丙、丁四位同学用锌与稀硫酸反应制氢气,所得相关数据记录如下(误差忽略不计)
甲 乙 丙 丁
取用稀盐酸的质量/g 200 200 200 400
加入金属的质量/g x 1.25x 2x 2x
生成氢气的质量/g 0.8 1 1.2 1.6
(1)甲同学加入金属锌的质量x ;
(2)稀硫酸中溶质的质量分数 zizhuzhai1年前1
zizhuzhai1年前1 -
 bin1127 共回答了18个问题
bin1127 共回答了18个问题 |采纳率100%根据已知的数据可知甲、乙、丁的反应为锌完全反应,所以根据反应式有:Zn------H2.65.2.x.0.4所以x=13g.(1)答案(2)中要求酸的质量分数,所以使用丙组数据(因为酸完全反应了)根据反应式有:H2SO4--------H2.98.2.m....1年前查看全部
大家在问
- 1某溶液中含有1种铁的氧化物1g,与过量的硝酸银溶液反应,生成氧化银沉淀2.65g,则此溶液中铁的氧化物是什么?
- 2怎样使作文变得丰富多彩,富有内涵?
- 3石壕吏表现了作者怎样的情感?谢谢了,大神帮忙啊
- 43x+2y=11的正整数解是______.
- 5求下段文章描写颜色的词语,速快!
- 6容易理解错误的成语
- 7“to__ther"在空格里加哪两个字母能组成一个单词?
- 8thoughts 和advice的问题
- 9有哪些加上“日”偏旁的字?告诉下,超级狂需要!
- 10当a=?时a的平方小于2a
- 11你们走了,留下的是一座“为人师表”的巍巍丰碑.联系上下文写出下面句子的意思
- 12你们走了留下的是一座为人师表的巍巍丰碑的意思什么
- 13回答完再追加分:等比数列问题为什么当q不等于-1或q=-1且k为奇数时,数列Sk,S2k-1,S3k-2k时成等比数列?
- 140的n次方根为0,这句话是不对的吧?
- 15估算 根号13 (估算到0.1)和三次方根100(估算到个位)
