配位平衡
 梦行蓝天2022-10-04 11:39:540条回答
梦行蓝天2022-10-04 11:39:540条回答
配位平衡
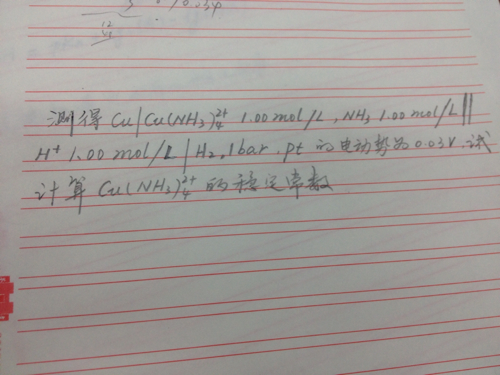
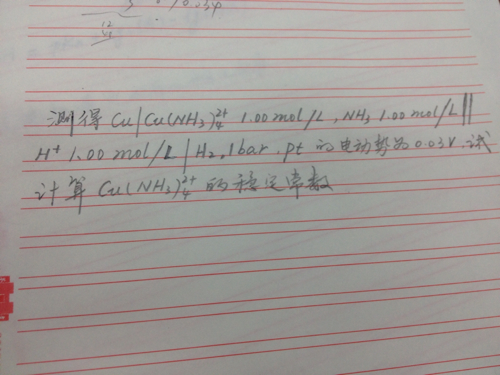

已提交,审核后显示!提交回复
共0条回复
相关推荐
- 配位平衡习题:定性地解释以下现象:[Fe(CN)6]3- 的颜色比[Fe(CN)6]4-的颜色深.
配位平衡习题:定性地解释以下现象:[Fe(CN)6]3- 的颜色比[Fe(CN)6]4-的颜色深.
[Fe(CN)6]3- 的颜色比[Fe(CN)6]4-的颜色深.为什么? 哈里路亚_mamaya1年前1
哈里路亚_mamaya1年前1 -
 夜羽 共回答了16个问题
夜羽 共回答了16个问题 |采纳率100%因为赤血盐中的铁是3价铁,黄血盐中的是2价.看核外电子的排布,3价铁是3d5,2价铁是3d6.也就是说Fe3+中有5个电子是处于相同自旋方向的(我忘了那个专业名词了……),而Fe2+中只有4个.
你理解电子跃迁对物质颜色的影响么?能够跃迁的电子数越多,就说明这种物质对光的吸收越强,所以说也就越深.1年前查看全部
- 化学平衡包括哪四大平衡?不是守恒,貌似是电解平衡,配位平衡,水解平衡等等.其中四个称为化学反应的四大平衡的
 北冰洋lhbzcxc1年前5
北冰洋lhbzcxc1年前5 -
 ada85 共回答了22个问题
ada85 共回答了22个问题 |采纳率95.5%通常说的四大化学平衡为氧化还原平衡、沉淀溶解平衡、配位平衡、酸碱平衡.1年前查看全部
- 配位平衡与氧化还原反应的关系是什么?配位平衡对氧化还原反应的影响有什么规律吗?
 yxs365821年前1
yxs365821年前1 -
 xinwuyu 共回答了17个问题
xinwuyu 共回答了17个问题 |采纳率94.1%配位平衡可能影响氧化还原反应的进行,因为配位的稳定系数有的非常大,被配位的中心离子的游离浓度就大幅度减少(可以由配位的稳定系数算出来),被配位中心离子是氧化/还原剂的话,其浓度大大减少当然有很大的影响.根据能斯特方程式,对于任一电池反应:
aA+bB=cC+dD
E=E(标准)-(RT)/(nF)ln(([C]∧c*[D]∧d)/([A]∧a*[B]∧b))
浓度对 氧化/还原对的电势电位有影响,改变大时因而可能造成反应的进行的方向.1年前查看全部
- 有关配位平衡电对,稳定常数的问题~
有关配位平衡电对,稳定常数的问题~
已知E(Ag+/Ag)=0.799V,Ksp(AgBr)=5.0*10的(-13)次方,E([Ag(S2O3)2]3-/Ag)=0.017.试计算(1)[Ag(S2O3)]3-的稳定常数K(2)若将0.10mol的AgBr固体完全溶解在1L的Na2S2O3溶液中,该Na2S2O3溶液的最小浓度应为多少? korla47h1年前1
korla47h1年前1 -
 angly21 共回答了18个问题
angly21 共回答了18个问题 |采纳率88.9%默认你所给出的条件全为标况下测得的数据.
(1)我们可以将[Ag(S2O3)2]3-溶液看成是非标况下的银离子溶液,并借此套用能斯特方程
φ([Ag(S2O3)2]3-/Ag)=φ(Ag+/Ag)+ RTln(αox)/nF(αred)
即0.017V = 0.799V + 0.0592log(αox/αred)
而αox=【Ag+】,αred=1
所以可以算出标况下二硫代硫酸根合银(I)酸根离子溶液中银离子浓度为6.173*10^-14mol/L
再将结果用三段法代入反应Ag+ + 2(S2O3)2- = [Ag(S2O3)2]3-
得[Ag(S2O3)]3-的稳定常数K=1/2*(6.173*10^-14)^2=1.312*10^26
(2)设参与反应的硫代硫酸根为x mol
AgBr + 2(S2O3)2- = [Ag(S2O3)2]3- + Br-
0.1 x - -
-0.1 -0.2 0.1 0.1
0 x-0.2 0.1 0.1
该反应的平衡常数K=【[Ag(S2O3)2]3-】【Br-】/【(S2O3)2-】^2
=【[Ag(S2O3)2]3-】【Br-】【Ag+】/【(S2O3)2-】^2【Ag+】 同乘银离子
=K稳*Ksp(AgBr) =6.56*10^13
=0.1*0.1/(x-0.2)^2
由此可以解出x=0.2
因此该溶液最小浓度应为x=0.2mol/L1年前查看全部
- 英语翻译:氧化还原平衡、沉淀溶解平衡、配位平衡、酸碱平衡.
 为雪封心11年前1
为雪封心11年前1 -
 永州不ww鸟 共回答了23个问题
永州不ww鸟 共回答了23个问题 |采纳率95.7%氧化还原平衡
Redox balance
沉淀溶解平衡
Precipitate dissolution equilibrium
配位平衡
Complex balance
酸碱平衡
Acid-base balance1年前查看全部
- 化学配位平衡题在 0.20 mol/L Ag(CN)2-的溶液中,加入等体积 0.20 mol/L 的KI 溶液,问可否
化学配位平衡题
在 0.20 mol/L Ag(CN)2-的溶液中,加入等体积 0.20 mol/L 的KI 溶液,问可否形成 AgI 沉淀?(K稳[Ag(CN)2-] =1.0×10^21 ,Ksp(AgI)=1.5×10^-16 ) jm6lll1年前1
jm6lll1年前1 -
 钱万广 共回答了16个问题
钱万广 共回答了16个问题 |采纳率87.5%可以的,由平衡常数可以算出Ag(CN)2-里面的Ag+的浓度是0.1的3次根号*10^-7
那么[Ag+]*[I-]越等于10^-9大于Ksp(AgI)
则有沉淀生成1年前查看全部
- 溶解平衡,酸碱平衡,配位平衡,氧化还原平衡
溶解平衡,酸碱平衡,配位平衡,氧化还原平衡
它们之间有什么样的联系?
它们的计算公式上有什么联系呢?
Ksp,Ka Kb ,Kf,电极电动势,它们之间的转化关系是什么 as14841年前2
as14841年前2 -
 微笑的小罗 共回答了21个问题
微笑的小罗 共回答了21个问题 |采纳率90.5%溶解平衡是分子之间的浓度平衡.
酸碱平衡是酸碱度(H+ ,OH-)的平衡,属次分子级,属于化学反应
配位平衡,是固体沉淀和电离离子之间的稳定状态,属于化学反应.
氧化还原平衡:水相中电子迁移过程,遵守得失平衡.
都属于物质(分子、离子或电子)在变化过程中趋向于平衡、稳定的一种必然选择.
是神奇的自然法则1年前查看全部
- 化学配位平衡的计算将c(AgNO3)=0.20mol/L的硝酸银溶液20ml与(1) c(NH3)=1.0mol/L的氨
化学配位平衡的计算
将c(AgNO3)=0.20mol/L的硝酸银溶液20ml与
(1) c(NH3)=1.0mol/L的氨水20ml混合;
(2) c(KCN)=1.0mol/L的氰化钾水溶液20ml混合.
求混合液中的c(Ag+).
要求具体的步骤和原因. 独角妖精阿咿拉1年前2
独角妖精阿咿拉1年前2 -
 czy2000 共回答了15个问题
czy2000 共回答了15个问题 |采纳率86.7%1、AgNO3+NH3.H2O=AgOH↓+NH4NO3
2、AgNO3+KCN=AgCN↓+KNO3
两个方程式都有沉淀,要计算的就是AgNO3过量还是不足的问题.
因为量都是20ml,可以都看成1L,方便计算
你确定后面的是1mol每升?0.2mol的AG+将完全被1mol的OH-或者CN-中和的
因为离子比例是1:1,那么AG都将完成沉淀下来,所以不含有银离子了.1年前查看全部
大家在问
- 1某校化学兴趣小组在老师的指导下,进行了“影响双氧水分解因素”的实验.请你帮助回答如下问题,并说明理由.
- 2过氧化氢在二氧化锰催化下分解是否生热
- 3过氧化氢分解热的测定中二氧化锰的作用是什么?
- 4用同样地一个杯子向空瓶里倒水,如果倒进了3杯水,连瓶共重440克,如果倒进5杯水,连瓶620克
- 5直角三角形斜边的平方等于两直角边乘积的2倍,求这个三角形3个角
- 65cm长的一条线段,其中的1cm是这条线段的五分之一,这条线段是单位“1” 对还是错?
- 7一条线段,是单位"1”被平均分成了9份,第二条线段比第一条短,刚好占了第一条线段的6/9,但书上显示是5/9
- 8如图,在梯形ABCD中,AD∥BC,E,F分别是对角线BD、AC的中点,AD=22cm,BC=38cm,则EF=____
- 9在梯形ABCD中,AD平行于BC,E,F分别是BD,AC的中点,且AD等于3,BC等于9,求EF的长
- 102008年的10月6日是小明的8岁生日,妈妈和小明的生日是同一天,妈妈的年龄是他的4倍,妈妈是哪年哪月出生的
- 11|log(sinα)cosα|>|log(cosα)sinα | 求 α∈?
- 12小明今年的年龄、生日的月份数和日期数相乘,结果是2376,并且他的年龄比他生日的月份数大一.小明今年几
- 13测量工作中用水平面代替水准面时,地球曲率对距离高差的影响如何
- 14从甲地到乙地快车用8小时,慢车用12小时两车同时开出1小时后快车和慢车一共行了这段路的几分之几,2小时呢
- 15㐚这个字怎么念,怎么感觉这不是个字
