某质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极,下列手法中不正确的是( )
 eleitium2022-10-04 11:39:541条回答
eleitium2022-10-04 11:39:541条回答 某质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极,下列手法中不正确的是( )
某质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极,下列手法中不正确的是( )A.a极为该电池的负极
B.该电池的正极反应式为O2+4e-+2H2O=4OH-
C.多孔活性铂电极有利于吸附气体,增大接触面积
D.H+(质子)由负极移向正极

已提交,审核后显示!提交回复
共1条回复
 hh常渴 共回答了14个问题
hh常渴 共回答了14个问题 |采纳率100%- 解题思路:该电池属于酸性氢氧燃料电池,电池工作时的正负极反应式分别为:正极:O2+4H++4e-═2H2O;负极:H2-2e-═2H+,在原电池中阳离子向电池的正极移动,阴离子向电池的负极移动,以此解答该题.
A.a极通入氢气,发生氧化反应,是原电池的负极,故A正确;
B.通入氧气的一极是原电池的正极,在酸性条件下,氧气得电子被还原,发生的电极反应为:O2+4H++4e-═2H2O,故B错误;
C.多孔活性铂电极具有较强的吸附性,有利于吸附气体,增大接触面积,故C正确;
D.阳离子向正极移动,故D正确.
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,为高频考点,明确燃料电池中得失电子的物质即可解答,注意该原电池是酸性电池,可能很多同学不能根据“质子交换膜”确定溶液的酸碱性,为易错点. - 1年前
相关推荐
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH 3 OH(g)+H 2 O(g) = CO 2 (g)+3H 2 (g);△H = + 49.0 kJ·mol -1
②CH 3 OH(g)+1/2O 2 (g) = CO 2 (g)+2H 2 (g);△H =-192.9 kJ·mol -1
下列说法正确的是 [ ]
[ ]A.CH 3 OH的燃烧热为192.9 kJ·mol -1
B.反应①中的能量变化如上图所示
C.CH 3 OH转变成H 2 的过程一定要吸收能量
D.根据②推知反应:CH 3 OH(l)+1/2O 2 (g) = CO 2 (g)+2H 2 (g)的△H>-192.9 kJ·mol -1 hanzhongkang1年前1
hanzhongkang1年前1 -
 yj1234888 共回答了20个问题
yj1234888 共回答了20个问题 |采纳率95%D1年前查看全部
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH 3 OH(g)+H 2 O(g) = CO 2 (g)+3H 2 (g);△H = + 49.0 kJ·mol -1
②CH 3 OH(g)+1/2O 2 (g) = CO 2 (g)+2H 2 (g);△H =-192.9 kJ·mol -1
下列说法正确的是
[ ]
A.反应①中的能量变化如上图所示
B.CH 3 OH转变成H 2 的过程一定要吸收能量
C.根据①推知反应:CH 3 OH(l)+H 2 O(g)=CO 2 (g)+3H 2 (g)的 △H> + 49.0kJ·mol -1
D.根据②推知反应:CH 3 OH(l)+1/2O 2 (g) = CO 2 (g)+2H 2 (g)的△H>-192.9 kJ·mol -1 ztycz1年前1
ztycz1年前1 -
 汪萍 共回答了17个问题
汪萍 共回答了17个问题 |采纳率76.5%D1年前查看全部
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH 3 OH(g)+H 2 O(g) = CO 2 (g)+3H 2 (g);△H = + 49.0 kJ/mol
②CH 3 OH(g)+1/2O 2 (g) = CO 2 (g)+2H 2 (g);△H =-192.9 kJ/mol
下列说法正确的是 [ ]
[ ]A.CH 3 OH(g)+3/2O 2 (g) = CO 2 (g)+2H 2 O(g);△H =-192.9 kJ/mol
B.反应①中的能量变化如图所示
C.CH 3 OH转变成H 2 的过程一定要吸收能量
D.根据②推知反应:CH 3 OH(l)+1/2O 2 (g) = CO 2 (g)+2H 2 (g)的△H>-192.9 kJ/mol 传教士z1年前1
传教士z1年前1 -
 小拜金 共回答了23个问题
小拜金 共回答了23个问题 |采纳率87%D1年前查看全部
- A、B、C、D分别为固体氧化物燃料电池、碱性燃料电池、质子交换膜燃料电池、熔融盐燃料电池,其中正极的反应产物为水的是
A、B、C、D分别为固体氧化物燃料电池、碱性燃料电池、质子交换膜燃料电池、熔融盐燃料电池,其中正极的反应产物为水的是
( )
A.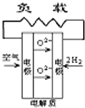
B.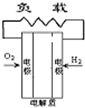
C.
D.
 xjdhappy11年前1
xjdhappy11年前1 -
 wananwa 共回答了23个问题
wananwa 共回答了23个问题 |采纳率91.3%解题思路:原电池中,阳离子向正极移动,正极上得到电子,结合正极的反应产物为水来解答.A.在固体氧化物燃料电池中,正极上O2+4e-=2O2-,故A不选;
B.碱性燃料电池中,正极上发生O2+2H20+4e-=4OH-,故B不选;
C.质子交换膜燃料电池,正极上发生4H++O2+4e-=2H20,故C选;
D.熔融盐燃料电池中,2CO2+O2+4e-=2CO32-,故D不选;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查燃料电池,明确原电池的工作原理是解答本题的关键,注意电解质及电极反应,题目难度不大.1年前查看全部
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ;△H=-192.9kJ·mol-1
下列说法正确的是
[ ]
A、根据反应①,64gCH3OH完全燃烧放出的热量为98kJ
B、反应①中的能量变化如上图所示
C、CH3OH转变成H2的过程一定要吸收能量
D、根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1

 chen0049931年前1
chen0049931年前1 -
 海棠一叶 共回答了15个问题
海棠一叶 共回答了15个问题 |采纳率93.3%化学能与热能的相互转化.
专题:化学反应中的能量变化.
分析:A、利用盖斯定律,②×3-①×2可得甲醇燃烧的热化学方程式,进而可知甲醇的燃烧热;
B、根据△H=生成物总能量-反应物总能量来判断;
C、根据已知的甲醇转化为氢气的两种反应原理来判断;
D、根据物质的能量大小与物质的状态关系来判断.
A、根据盖斯定律将,②×3-①×2可得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,所以甲醇的燃烧热为676.7kJ/mol,故A错误;
B、反应①的△H>0,而图示的△H=生成物总能量-反应物总能量<0,故B错误;
C、由已知可知,反应①为吸热反应,而反应②为放热反应,故C错误;
D、同物质的量的同种物质,气态能量最高,其次液态能量,固态能量最低,由②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1,故D正确;
故选D.
点评:本题考查化学反应的反应热的计算.注意在比较反应热大小时要带符号比较,并注意盖斯定律的应用来解答.1年前查看全部
- (2011•连云港模拟)直接甲醇燃料电池(DMFC),它属于质子交换膜燃料电池(PEMFC)中之一类,系直接使用水溶液以
 (2011•连云港模拟)直接甲醇燃料电池(DMFC),它属于质子交换膜燃料电池(PEMFC)中之一类,系直接使用水溶液以及蒸汽甲醇为燃料供给能源,而不需通过重组器高温重组甲醇、汽油及天然气等再取出氢以供发电.下列对于该电池的说法不正确的是( )
(2011•连云港模拟)直接甲醇燃料电池(DMFC),它属于质子交换膜燃料电池(PEMFC)中之一类,系直接使用水溶液以及蒸汽甲醇为燃料供给能源,而不需通过重组器高温重组甲醇、汽油及天然气等再取出氢以供发电.下列对于该电池的说法不正确的是( )
A.直接甲醇燃料电池低温生电、燃料成分危险性低与电池结构简单等特性
B.电池工作时,电解质溶液pH值保持不变
C.电池的负极反应式为3O2+12e-+12H+═6H2O
D.电池工作时,1molCH3OH被氧化时就有6NA个氢离子在正极消耗 凸-_-凸o觜1年前1
凸-_-凸o觜1年前1 -
 小云儿宝贝 共回答了21个问题
小云儿宝贝 共回答了21个问题 |采纳率95.2%解题思路:A.直接甲醇燃料电池低温生电、燃料成分危险性低、电池结构简单;
B.电池工作的原理是氢气与氧气反应生成水的过程,水增多,使硫酸溶液pH增大;
C.原电池负极失电子;
D.根据在闭合回路中正极和负极流过的电子数相等解题.A.直接甲醇燃料电池低温生电、燃料成分危险性低、电池结构简单等,故A正确;
B.该装置中由于水的生成而使硫酸溶液的浓度变小,因此pH值增大,故B错误;
C.原电池负极失电子,应为甲醇失电子,负极反应式为:2CH3OH+2H2O-12e-═12H++2CO2,故C错误;
D.正极发生的电极反应式是:3O2+12H++12e-═6H2O,负极发生的电极反应式是:2CH3OH+2H2O-12e-═12H++2CO2,当1molCH3OH被氧化时,负极失去6mol电子,在正极正极得到6mol电子,消耗的氢离子是6mol,即1molCH3OH被氧化时就有6NA个氢离子在正极消耗,故D正确;
故选:BC.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查学生燃料电池的工作原理知识,题干信息和图示转化关系是分析的关键,可以根据所学知识进行回答,难度适中.1年前查看全部
- 质子交换膜燃料电池工作时总反应式
质子交换膜燃料电池工作时总反应式
抱歉...氢气和氧气... 思诺宝贝1年前2
思诺宝贝1年前2 -
 zz8ss5ww6 共回答了12个问题
zz8ss5ww6 共回答了12个问题 |采纳率83.3%氢氧燃料电池吧
2H2+O2=2H2O
不过一般的氢氧燃料电池都有电解质溶液,或酸或碱1年前查看全部
- 14日化学,45,6.甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
14日化学,45,6.甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
· ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1= + 49.0 kJ·mol -1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H2=-192.9 kJ·mol -1
下列说法正确的是
A. CH3OH的燃烧热为192.9kj/mol
C.CH3OH转变成H2的过程一定要吸收热量
D.根据2.推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ/mol
我的问题是:为什么不可以选A? 夜会美1年前1
夜会美1年前1 -
 agai6006 共回答了19个问题
agai6006 共回答了19个问题 |采纳率94.7%A:燃烧热要求生成最稳定的化合物.CH3OH的燃烧热,应该是CH3OH燃烧后,生成CO2和H2O时所放出的热量,而非生成H2时的热量.1年前查看全部
- (2014•上海模拟)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
 (2014•上海模拟)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
(2014•上海模拟)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+[1/2]O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
A.上述图示的反应为吸热反应
B.图中的能量变化如图所示,则Q=E3-E1
C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量
D.根据①②推知:在25℃,101kPa时,1mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应676.7kJ jh6vgcny781年前1
jh6vgcny781年前1 -
 猫比是大哥 共回答了19个问题
猫比是大哥 共回答了19个问题 |采纳率94.7%解题思路:A、从图上可见,反应物能量高于生成物;
B、根据△H=生成物总能量-反应物总能量来判断;
C、根据已知的甲醇转化为氢气能量变化分析;
D、利用盖斯定律分析.A、从图上可知,反应物能量高,反应放热,故A错误;
B、在反应②中,由图示△H=生成物总能量-反应物总能量=E1-E2,故B错误;
C、由已知可知,反应②为放热反应,故C错误;
D、根据盖斯定律将,②×3-①×2可得:CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,所以甲醇的燃烧热为676.7kJ/mol,故D正确;
故选:D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查化学能与热能的相互转化以及反应热的计算.注意在比较反应热大小时要带符号比较.1年前查看全部
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
CH 3 OH(g) + H 2 O(g) → CO 2 (g) + 3H 2 (g) – 49.0 kJ
下列说法正确的是A.1 LCH 3 OH蒸汽与1 L水蒸汽反应生成1 L CO 2 气体与3 L氢气吸收热量49.0 kJ B.1个CH 3 OH分子与1个水分子反应生成1个CO 2 分子与3个H 2 分子吸收49.0 kJ热量 C.相同条件下1molCH 3 OH(g)与1mol H 2 O(g)的能量总和小于1molCO 2 (g)与3 mol H 2 (g)的能量总和 D.1 molCH 3 OH蒸汽与1 mol液态水反应生成1mol CO 2 气体与3 mol 氢气吸收的热量小于49.0 kJ  cysl1年前1
cysl1年前1 -
 swjsyht2 共回答了16个问题
swjsyht2 共回答了16个问题 |采纳率81.3%
1年前查看全部
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH 3 OH(g)+H 2 O(g)=CO 2 (g)+3H 2 (g) △H=+49.0 kJ·mol -1
②CH 3 OH(g)+1/2O 2 (g)=CO 2 (g)+2H 2 (g) △H=-192.9 kJ·mol -1
下列说法正确的是[ ]A.CH 3 OH的反应热不仅与各物质的状态有关,也与参加反应的反应物的量有关
B.CH 3 OH蒸气的燃烧热大于676.7kJ·mol -1
C.CH 3 OH转变成H 2 的过程只能是一个从高能量到低能量的过程
D.根据①推知反应:CO 2 (g)+3H 2 (g)=CH 3 OH(l)+H 2 O(g) 的△H<-49.0kJ·mol -1 guanxi12101年前1
guanxi12101年前1 -
 O潺潺O 共回答了24个问题
O潺潺O 共回答了24个问题 |采纳率95.8%BD1年前查看全部
- (2012•闵行区一模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
 (2012•闵行区一模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
(2012•闵行区一模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+1/2O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
A.1molCH3OH完全燃烧放出热量192.9 kJ
B.②中的能量变化如图所示,则Q=E3-E1
C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量
D.根据②推知:在25℃,101 kPa时,1 molCH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ songsong7891年前1
songsong7891年前1 -
 cll0720 共回答了17个问题
cll0720 共回答了17个问题 |采纳率88.2%解题思路:A、利用盖斯定律分析;
B、根据Q=反应物总能量-生成物总能量来判断;
C、依据反应①②可知甲醇转化为氢气可以吸热,也可以放热;
D、根据氢气燃烧放热来判断.A、根据盖斯定律将,②×3-①×2可得:CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,所以1molCH3OH完全燃烧放出热量为676.7kJ,故A错误;
B、在反应②中,由图示Q=反应物总能量-生成物总能量=E2-E1,故B错误;
C、由已知可知,反应②为放热反应,故C错误;
D、氢气燃烧放热,根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ,故D正确;
故选D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查化学能与热能的相互转化以及反应热的计算.注意在比较反应热大小时要带符号比较.1年前查看全部
- (2008•东莞模拟)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
 (2008•东莞模拟)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
(2008•东莞模拟)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol -1
②CH3OH(g)+[1/2]O2(g)=CO2(g)+2H2(g)△H2=-192.9kJ•mol -1
下列说法正确的是( )
A.反应②中的能量变化如图所示,则△H2=E1-E3
B.CH3OH的燃烧热△H=-192.9 kJ•mol -1
C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量
D.根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ 比格依斯特1年前1
比格依斯特1年前1 -
 liuguangfu 共回答了14个问题
liuguangfu 共回答了14个问题 |采纳率92.9%A、依据图象分析反应②中的能量变化分析可知反应焓变=E1-E2,故A错误;
B、依据甲醇燃烧热是1mol甲醇完全燃烧生成二氧化碳和液态水时放出的热量,数值大于192.9KJ,CH3OH的燃烧热△H<-192.9 kJ•mol -1 ,故B错误;
C、依据反应①②可知甲醇转化为氢气可以吸热,也可以放热,故C错误;
D、氢气燃烧放热,根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ,故D正确;
故选D.1年前查看全部
- (2010•卢湾区二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
 (2010•卢湾区二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
(2010•卢湾区二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+[1/2]O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法不正确的是( )
A.反应①中的能量变化如图所示
B.从①和②中看出:物质的量相同的H2O(g)所具有的能量低于O2(g)
C.1mol CH3OH与H2O(g)完全反应要吸收49.0kJ能量
D.根据②推知反应:CH3OH(l)+[1/2]O2(g)→CO2(g)+2H2(g)+Q,Q<192.9kJ 草人木1年前1
草人木1年前1 -
 Jun726 共回答了32个问题
Jun726 共回答了32个问题 |采纳率93.8%解题思路:A、反应①是吸热反应,反应物能量小于生成物;
B、反应①是吸热反应,反应②是放热反应,对比反应的热化学方程式可知等物质的量的气态水能量低于氧气的能量;
C、依据盖斯定律结合①②合并:②-①得到H2(g)+[1/2]O2(g)=H2O(g)△H=-241.9 kJ/mol;所以2H2(g)+O2(g)=2H2O(g)△H=-483.8 kJ/mol;
D、依据反应②甲醇反应生成二氧化碳和氢气的焓变是-192.9kJ/mol;而1 mol CH3OH气态变化为液态放热,充分燃烧生成二氧化碳和水放出的热量小于192.9 kJ.A、图中表示的是吸热反应,而反应①是吸热反应,图象符合,故A正确;
B、依据盖斯定律结合①②合并:②-①得到H2(g)+[1/2]O2(g)=H2O(g)△H=-241.9 kJ/mol;所以2H2(g)+O2(g)=2H2O(g)△H=-483.8 kJ/mol;物质的量相同的H2O(g)所具有的能量低于O2(g),故B正确;
C、1mol CH3OH(g)与H2O(g)完全反应要吸收49.0kJ能量,甲醇状态不知,反应焓变不能判断,故C错误;
D、反应②气态甲醇反应生成二氧化碳和氢气的焓变是-192.9kJ/mol;而1 mol液态 CH3OH充分燃烧生成二氧化碳和水放出的热量小于192.9 kJ,故D正确;
故选:C.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了热化学方程式的分析应用,可逆反应不能进行彻底,物质能量的变化判断是解题关键,题目难度中等.1年前查看全部
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH 3 OH(g)+H 2 O(g) CO 2 (g)+3H 2 (g) ΔH="+49.0" kJ·mol -1
CO 2 (g)+3H 2 (g) ΔH="+49.0" kJ·mol -1
②CH 3 OH(g)+O 2 (g) CO 2 (g)+2H 2 (g) ΔH="-192.9" kJ·mol -1
CO 2 (g)+2H 2 (g) ΔH="-192.9" kJ·mol -1
下列说法正确的是( )
A.CH 3 OH的燃烧热为192.9 kJ·mol -1 B.反应①中的能量变化如上图所示 C.CH 3 OH转变成H 2 的过程一定要吸收能量 D.根据②推知反应CH 3 OH(l)+O 2 (g)  CO 2 (g)+2H 2 (g)的ΔH>-192.9 kJ·mol -1
CO 2 (g)+2H 2 (g)的ΔH>-192.9 kJ·mol -1  爱妻骑士1年前1
爱妻骑士1年前1 -
 longsolong 共回答了19个问题
longsolong 共回答了19个问题 |采纳率94.7%D
反应②中H 2 (g)不是稳定的氧化物,A项不正确;反应①为吸热反应,而图示反应为放热反应,B项不正确;据题给反应①、②可知,CH 3 OH转变成H 2 的过程可以吸收能量,也可以放出能量,C项不正确;由于CH 3 OH在气态时比在液态时能量高,可知等量CH 3 OH(l)比CH 3 OH(g)反应时放出热量少,即D项正确。1年前查看全部
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH 3 OH(g)+H 2 O(g) = CO 2 (g)+3H 2 (g) D H =" +" 49.0 kJ·mol-1
②CH 3 OH(g)+1/2O 2 (g) = CO 2 (g)+2H 2 (g) D H =-192.9 kJ·mol-1
下列说法正确的是A.CH 3 OH的燃烧热为192.9 kJ·mol -1 B.反应①中的反应物总能量大于生成物的总能量 C.CH 3 OH转变成H 2 的过程一定要吸收能量 D.根据②推知反应:CH 3 OH(l)+1/2O 2 (g)=CO 2 (g)+2H 2 (g) 的D H >-192.9 kJ·mol-1  honh3031年前1
honh3031年前1 -
 icekingly 共回答了13个问题
icekingly 共回答了13个问题 |采纳率69.2%D
燃烧热是指1 mol可燃物完全燃烧生成稳定氧化物(液态水)时所放出的热量,故A错;反应①的焓变大于0,为吸热反应,故反应物总能量小于生成物的总能量;C项由题意可看出绝对错误;D项:由于液态甲醇的能量低,故它发生类似反应后的D H >-192.9 kJ·mol-1,正确。1年前查看全部
- (2011•奉贤区一模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
(2011•奉贤区一模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+[1/2]O2(g)═CO2(g)+2H2(g);△H=-192.9kJ•mol-1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9kJ•mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+[1/2]O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 zhuzp721年前1
zhuzp721年前1 -
 宋剑麾 共回答了10个问题
宋剑麾 共回答了10个问题 |采纳率100%解题思路:A、利用盖斯定律,②×3-①×2可得甲醇燃烧的热化学方程式,进而可知甲醇的燃烧热;
B、根据△H=生成物总能量-反应物总能量来判断;
C、根据已知的甲醇转化为氢气的两种反应原理来判断;
D、根据物质的能量大小与物质的状态关系来判断.A、根据盖斯定律将,②×3-①×2可得:CH3OH(g)+[3/2] O2(g)=CO2(g)+2H2O(l)△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,所以甲醇的燃烧热为676.7kJ/mol,故A错误;
B、反应①的△H>0,而图示的△H=生成物总能量-反应物总能量<0,故B错误;
C、由已知可知,反应①为吸热反应,而反应②为放热反应,故C错误;
D、同物质的量的同种物质,气态能量最高,其次液态能量,固态能量最低,由②推知反应:CH3OH(l)+[1/2]O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1,故D正确;
故选D.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查化学反应的反应热的计算.注意在比较反应热大小时要带符号比较,并注意盖斯定律的应用来解答.1年前查看全部
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH 3 OH(g)+H 2 O(g)=CO 2 (g)+3H 2 (g)
ΔH 1 =+49.0 kJ/mol;
②CH 3 OH(g)+ O 2 (g)=CO 2 (g)+2H 2 (g)
O 2 (g)=CO 2 (g)+2H 2 (g)
ΔH 2 =-192.9 kJ/mol。
根据上述反应,下列说法正确的是( )
A.反应①中的能量变化如上图所示 B.CH 3 OH转变成H 2 的过程一定要吸收能量 C.1 mol CH 3 OH充分燃烧放出的热量为192.9 kJ D.可推知2H 2 (g)+O 2 (g)=2H 2 O(g) ΔH=-483.8 kJ/mol  鳍豚与天使1年前1
鳍豚与天使1年前1 -
 cuiliu 共回答了21个问题
cuiliu 共回答了21个问题 |采纳率95.2%D
A项,反应①为吸热反应,即图示能量变化关系错误;B项,从题中反应①②来看,CH 3 OH转变成H 2 可能吸热,也可能放热;反应②中生成物H 2 可以继续燃烧,即1 mol CH 3 OH充分燃烧放出的热量要大于192.9 kJ;根据盖斯定律可判断D项正确。1年前查看全部
- 有四种燃料电池:A固体氧化物燃料电池;B碱性氢氧化物燃料电池;C质子交换膜燃料电池;D熔融盐燃料电池,下面是工作原理示意
有四种燃料电池:A固体氧化物燃料电池;B碱性氢氧化物燃料电池;C质子交换膜燃料电池;D熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( )
 我就不信收1年前1
我就不信收1年前1 -
 小猪莎拉 共回答了17个问题
小猪莎拉 共回答了17个问题 |采纳率94.1%C
A项,正极反应生成O 2- ;B项,正极反应生成OH - ;C项,正极反应生成H 2 O;D项,正极反应生成C。1年前查看全部
- 有关质子交换膜燃料电池的问题题上说导电粒子为质子,且在电池内部由正极定向移动至负极是错的 我想问下为什么为什么在电池内部
有关质子交换膜燃料电池的问题
题上说导电粒子为质子,且在电池内部由正极定向移动至负极是错的 我想问下为什么
为什么在电池内部是从负极移动到正极。 柯落珞1年前2
柯落珞1年前2 -
 xxx08q 共回答了17个问题
xxx08q 共回答了17个问题 |采纳率100%正负极是针对电势高低来说的,电势高的是正极,电势低的是负极,显然是
阴阳极是针对氧化还原反应来说的,发生氧化反应的一极是阳极(就是原电池的负极,失电子被氧化),发生还原反应的一极是阴极(就是原电池的正极,得电子被还原).
质子是从阳极向阴极移动的.1年前查看全部
- 随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。
随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。
(1)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH 3 OH(g)+H 2 O(g)=CO 2 (g)+3H 2 (g) ΔH=+49.0kJ/mol
B、CH 3 OH(g)+3/2O 2 (g)=CO 2 (g)+2H 2 O(g) ΔH=-192.9kJ/mol
又知H 2 O(l)=H 2 O(g) ΔH=+44 kJ/mol,请写出32g的CH 3 OH(g)完全燃烧生成液态水的热化学方程式 。
(2)下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH 3 OH+3O 2 =2CO 2 +4H 2 O。则c电极是 (填“正极”或“负极”),
c电极上发生的电极反应式是 。
 hndinosaur11年前1
hndinosaur11年前1 -
 一只小猪猪 共回答了16个问题
一只小猪猪 共回答了16个问题 |采纳率93.8%(1)CH 3 OH(g)+3/2O 2 (g)=CO 2 (g)+2H 2 O(l)ΔH=-280.9kJ/mol
(2)负极 CH 3 OH+ H 2 O -6e - = CO 2 +6H +
1年前查看全部
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH 3 OH(g)+H 2 O(g) = CO 2 (g)+3H 2 (g);△H = + 49.0 kJ·mol -1
②CH 3 OH(g)+1/2O 2 (g) = CO 2 (g)+2H 2 (g);△H =-192.9 kJ·mol -1
下列说法正确的是 [ ]
[ ]A.CH 3 OH的燃烧热为192.9 kJ·mol -1
B.反应①中的能量变化如上图所示
C.CH 3 OH转变成H 2 的过程一定要吸收能量
D.根据②推知反应:CH 3 OH(l)+1/2O 2 (g) = CO 2 (g)+2H 2 (g)的△H>-192.9 kJ·mol -1 归正1年前1
归正1年前1 -
 海baby 共回答了27个问题
海baby 共回答了27个问题 |采纳率96.3%D1年前查看全部
- (2009•红桥区一模)据媒体报道:以氢氧燃料电池为动力的公交车即将在北京试运行.质子交换膜燃料电池(PEMFC)常作为
(2009•红桥区一模)据媒体报道:以氢氧燃料电池为动力的公交车即将在北京试运行.质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源.该燃料电池以氢为燃料,空气为氧化剂,铂为催化剂,导电离子是氢离子.下列对该燃料电池的描述中正确的是( )
①正极反应为:O2+4H++4e-═2H2O②负极反应为:2H2-4e-═4H+
③总的化学反应为:2H2+O2═2H2O④H+通过电解质向正极移动.
A.①②③④
B.②③④
C.①②④
D.①②③ meizhen88991年前1
meizhen88991年前1 -
 NEIJIANGZY 共回答了16个问题
NEIJIANGZY 共回答了16个问题 |采纳率93.8%解题思路:该燃料电池中,通入燃料的电极是负极,负极上燃料失电子发生氧化反应,通入氧化剂的电极是正极,正极上氧气得电子发生还原反应,原电池放电时,阳离子向正极移动.该燃料电池属于原电池,①正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e-═2H2O,故正确;
②负极上氢气失电子生成氢离子,所以负极反应为:2H2-4e-═4H+,故正确;
③将正负极电极反应式相加得总的化学反应为:2H2+O2═2H2O,故正确;
④该电池放电时,阳离子向正极移动,所以H+通过电解质向正极移动,故正确;
故选A.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查燃料电池,根据原电池原理来分析解答,注意原电池放电时电解质溶液中阴阳离子的定向移动,为易错点.1年前查看全部
- (2012•吉林一模)甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理是:
 (2012•吉林一模)甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理是:
(2012•吉林一模)甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+0.5O2(g)=CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
A.CH3OH的燃烧热是192.9kJ/mol
B.CH3OH转变成H2的过程一定要吸收能量
C.反应①中的能量变化如图所示
D.根据反应①和②可推知:2H2(g)+O2(g)=2H2O(g)△H=-483.8kJ/mol qianchengguo1年前1
qianchengguo1年前1 -
 cycqjh 共回答了16个问题
cycqjh 共回答了16个问题 |采纳率100%解题思路:A.依据反应②甲醇反应生成二氧化碳和氢气的焓变是-192.9kJ/mol以及氢气燃烧要放出热量,结合盖斯定律分析;
B.根据已知的两个反应①②来判断CH3OH转变成H2的过程所伴随的能量变化;
C、根据吸热反应中反应物总能量小于于生成物的总能量来判断;
D.根据根据盖斯定律来计算化学反应的焓变.A.反应②甲醇反应生成二氧化碳和氢气的焓变是-192.9kJ/mol;而氢气燃烧生成液态水要放出热量,结合盖斯定律分析可知1molCH3OH充分燃烧生成二氧化碳和液态水的焓变是小于-192.9kJ/mol,CH3OH的燃烧热大于192.9 kJ•mol-1,故A错误;
B.CH3OH转变成H2的过程按照反应①是吸热反应,按照②反应是放热反应,所以不一定要吸收能量,故B错误;
C.反应①为吸热反应,所以反应物总能量小于生成物的总能量,故C错误;
D.根据已知两个反应:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol,
②CH3OH(g)+0.5O2(g)=CO2(g)+2H2(g)△H=-192.9kJ/mol,②×2-2×①可以得到反应2H2(g)+O2 (g)=2H2O (g),所以该反应的焓变△H=2×(-192.9kJ/mol)-2×49.0kJ/mol=-483.8kJ/mol,故D正确;
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查化学能与热能的相互转化以及反应热的计算,注意盖斯定律在计算焓变时的应用,难度不大.1年前查看全部
- 随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
(1)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热______(填“大于”、“等于”或“小于”)192.9kJ/mol.已知水的气化热为44kJ/mol,则氢气燃烧热的热化学方程式为H2(g)+[1/2]O2(g)=H2O(l)△H=-124.6kJ/molH2(g)+[1/2]O2(g)=H2O(l)△H=-124.6kJ/mol.
(2)下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图.甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.则c电极是______(填“正极”或“负极”),c电极上发生的电极反应是______.
 mabanphy1年前1
mabanphy1年前1 -
 cbqq5f 共回答了21个问题
cbqq5f 共回答了21个问题 |采纳率90.5%解题思路:(1)燃烧热是指可燃物完全燃烧生成稳定的氧化物所放出的热量,应生成液态水,而气态水变为液态水要放出热量,可利用盖斯定律计算反应热;
(2)原电池中电子从负极经外电路流向正极,负极反应氧化反应.(1)燃烧热是指可燃物完全燃烧生成稳定的氧化物所放出的热量,应生成液态水,而气态水变为液态水要放出热量,由以上热化学方程式可以看出,当生成气态水时放出的热量为192.9kJ,则生成液态水应放出更多的热量,
已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol
利用盖斯定律将②-①可得:
[3/2]O2(g)+3H2(g)=3H2O(g)△H=-241.9kJ/mol
即[1/2]O2(g)+H2(g)=H2O(g)△H=-80.6kJ/mol
又知:H2O(g)=H2O(l)△H=-44kJ/mol
则有:H2(g)+[1/2]O2(g)=H2O(l)△H=-(80.6+44)kJ/mol=-124.6kJ/mol,
故答案为:大于;H2(g)+[1/2]O2(g)=H2O(l)△H=-124.6kJ/mol;
(2)原电池中电子从负极经外电路流向正极,根据电子流向可知c电极为负极,
甲醇在负极上发生氧化反应,电极反应式为CH3OH-6e-+H2O=CO2+6H+,
故答案为:负极;CH3OH-6e-+H2O=CO2+6H+.点评:
本题考点: 燃烧热;热化学方程式;化学电源新型电池.
考点点评: 本题考查化学反应与能量,题目难度中等,注意利用盖斯定律计算反应热.1年前查看全部
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:CH 3 OH(g)+H 2 O(g)=CO 2 (g)
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:CH 3 OH(g)+H 2 O(g)=CO 2 (g)+3H 2 (g)ΔH=+49.0 kJ·mol -1
下列说法正确的是()A.1 L CH 3 OH蒸汽与1 L水蒸气反应生成1 L CO 2 气体与3 L氢气吸收热量49.0 kJ B.1个CH 3 OH分子与1个水分子反应生成1个CO 2 分子与3个H 2 分子吸收49.0 kJ热量 C.相同条件下1 mol CH 3 OH(g)与1 mol H 2 O(g)的能量总和小于1 mol CO 2 (g)与3 mol H 2 (g)的能量总和 D.1 mol CH 3 OH蒸汽与1 mol液态水反应生成1 mol CO 2 气体与3 mol氢气吸收的热量小于49.0 kJ  lwl_cqupt1年前1
lwl_cqupt1年前1 -
 灵薄狱 共回答了15个问题
灵薄狱 共回答了15个问题 |采纳率86.7%C
热化学方程式中,化学计量数代表物质的量,A、B错误;C项,该反应为吸热反应,生成物总能量高;D项,由于液态水变成气态水需要吸收热量,所以吸收的热量应大于49.0 kJ。1年前查看全部
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如下:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如下:
①CH 3 OH(g)+H 2 O(g)===CO 2 (g)+3H 2 (g) ΔH=+49.0 kJ/mol
②CH 3 OH(g)+12O 2 (g)===CO 2 (g)+2H 2 (g) ΔH=-192.9 kJ/mol
下列说法正确的是 [ ]
[ ]A.CH 3 OH的燃烧热为 192.9 kJ/mol
B.反应①中的能量变化如上图所示
C.CH 3 OH转变成H 2 的过程一定要吸收能量
D.根据②推知反应CH 3 OH(l)+12O 2 (g)===CO 2 (g)+2H 2 (g)的ΔH>-192.9 kJ/mol mitch011年前1
mitch011年前1 -
 dcehci 共回答了14个问题
dcehci 共回答了14个问题 |采纳率92.9%D1年前查看全部
- 近年来,山东省大力发展以太阳能、风能、燃料电池为代表的新能源.如图1是某种质子交换膜燃料电池原理示意图.
近年来,山东省大力发展以太阳能、风能、燃料电池为代表的新能源.如图1是某种质子交换膜燃料电池原理示意图. 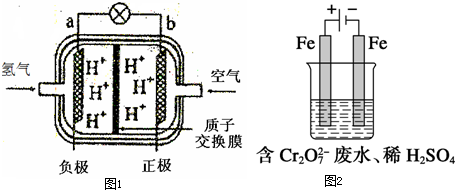
(1)该燃料电池工作过程中,质子(H + )透过质子交换膜移动到______极(填“a”或“b”).该电池的正极反应式为:______.
(2)若用此燃料电池作为电源向铁制品上镀上一层铜,则铁制品要连接在燃料电池的______极(填“a”或“b”)上.若用此燃料电池电解精炼银,应使粗银作电解池的______极,使用AgNO 3 和HNO 3 的混合溶液作电解液,若阴极有少量红棕色气体生成,则生成该气体的电极反应式为______.
(3)实验室利用此燃料电池为电源模拟处理含 C r 2 O 7 2- 的废水,装置如图2所示.已知阳极反应式是Fe-2e - ═Fe 2+ ,阴极上有气体产生,其电极反应式是:______.一段时间后,测得阴极产生的气体在标况下的体积为2.24L,则燃料电池至少要通入标况下空气的体积约为______L.(已知空气中氧气约占
)1 5  monttoneca1年前1
monttoneca1年前1 -
 爱在云端rita 共回答了17个问题
爱在云端rita 共回答了17个问题 |采纳率82.4%(1)该装置为氢氧燃料酸性电池,燃料电池中,通入燃料的电极为负极,通入氧化剂的电极为正极,原电池放电时,电解质溶液中氢离子向正极b移动,正极上氧气得电子和氢离子反应生成水,电极反应式为O 2 +4H + +4e - =2H 2 O,故答案为:b;O 2 +4H + +4e - =2H 2 O;
(2)电镀时,镀层作阳极,镀件作阴极,所以铁上镀铜时,铁作阴极,连接原电池的负极a;电解精炼时,粗银作阳极,纯银作阴极,所以粗银作阳极,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮,电极反应式为:2H + +NO 3 - +e - =NO 2 ↑+H 2 O,
故答案为:a;阳;2H + +NO 3 - +e - =NO 2 ↑+H 2 O;
(3)电解时,阳极是活泼金属,所以阳极上铁失电子发生氧化反应,阴极上氢离子得电子发生还原反应,电极反应式为,阴极生成2.24L氢气,转移电子的物质的量=
2.24L
22.4L/mol ×2 =0.2mol,串联电路中转移电子相等,则通入空气的体积=
0.2mol
4
1
5 ×22.4L/mol=5.6L,
故答案为:2H + +2e - ═H 2 ↑;5.6.1年前查看全部
- 质子交换膜燃料电池 反应方程式 和原理
 陌路单行1年前2
陌路单行1年前2 -
 蜻蜓025 共回答了10个问题
蜻蜓025 共回答了10个问题 |采纳率100%首先,质子就是氢离子,所以质子交换膜燃料电池就是在酸性条件下发生的电极反应而已.如氢氧燃料电池:负极:H2-2e=2H+,正极:O2+4e+4H+=2H2O.其他燃料电池电极反应式以此类推即可.1年前查看全部
- 2010年的上海世博会是第41届综合性世博会,其内运用多处科技创新.图1为PEMFC(质子交换膜燃料电池),以全氟磺酸型
2010年的上海世博会是第41届综合性世博会,其内运用多处科技创新.图1为PEMFC(质子交换膜燃料电池),以全氟磺酸型固体聚合物为电解质,铂/碳或铂一钌为电极,氢或净化重整气为燃料,空气或纯氧为氧化剂.图2为光伏并网发电装置,通过并网,上海市将使用半导体照明(LED).发出白光的LED是由GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成的.

下列有关说法中正确的是( )
A.从原理分析,图1为原电池装置,图2为电解池装置
B.图1中电子经装置从右向左移动
C.图2中N型半导体为正极,P型半导体为负极
D.LED中的Ga和Y都显+3价 4111618341年前1
4111618341年前1 -
 lemon_tea32 共回答了25个问题
lemon_tea32 共回答了25个问题 |采纳率92%解题思路:A、图2是将太阳能直接转化为电能的装置;
B、根据通入氢气的一极为电源的负极,通入氧气的一极为电源的正极,电子从负极经外电路流向正极;
C、根据离子的定向移动判断正负极;
D、根据元素的化合价代数和为0进行判断.A、图1是原电池装置,图2是将太阳能直接转化为电能的装置,故A错误;
B、通入氢气的一极为电源的负极,通入氧气的一极为电源的正极,图1电子经外电路从左向右移动,故B错误;
C、根据图2中离子的定向移动可知,阳离子向P型半导体移动,则P型半导体应为正极,故C错误;
D、GaN中Ga元素的化合价为+3价,N元素的化合价为-3价,Y3Al5O12中O元素的化合价为-2价,Al元素的化合价为+3价,则Y的化合价为+3价,故D正确.
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查燃料电池和新型电池的原理,注意燃料电池和新型电池的正、负极材料分析和电极反应方程式书写,并加强电化学问题探究设计,实物图分析及新型电池的分析的能力培养.抓住两极反应的本质,是解题思维的起点:电化学的本质是氧化还原反应,所以理解电极反应首先得理解电化学中的氧化还原关系.原电池中负极发生氧化反应,正极发生还原反应.1年前查看全部
- A,B,C,D分别为固体氧化物燃料电池,碱性燃料电池,质子交换膜燃料电池,熔融盐燃料电池,其中正极的反应产物为水的是
 顽皮少爷1年前1
顽皮少爷1年前1 -
 345059405 共回答了20个问题
345059405 共回答了20个问题 |采纳率70%选C
A中正极为O2+4e==2O2-
B中正极为O2+4e+2H2O==4OH-
C中为O2+4e+4H+==2H2O
D为O2+4e+2CO2==2CO3 2-
高二这一块内容其实并不难,你要把最简单的原电池和电解池原理掌握好,然后遇到提用这些知识来解决即可,一开始可能不太熟悉,多练一练就好了,对了,还要注意电解质,写完基本的以后若能与电解质反应把电解质也加进去,写出最后的产物就好了.不太熟的话可以一步一步写,然后叠加,也可以得到.试试吧1年前查看全部
- 试就一种燃料电池体系(如质子交换膜燃料电池,固体氧化物燃料电池)说明燃料电池的特点、优势及目前存在
 wer36691年前2
wer36691年前2 -
 依破天 共回答了24个问题
依破天 共回答了24个问题 |采纳率87.5%……你是要交论文么?随便找篇综述翻译一下就好了,比如固体氧化物燃料电池(sofc),找篇阳极支撑型的review,翻译前半段就好了.像sofc的特点就是生产以及使用过程当中无毒无污染,发电效率高,可以实现热电联供.1年前查看全部
- (2009•宿迁二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
 (2009•宿迁二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
(2009•宿迁二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=49.0kJ•mol-1
②CH3OH(g)+[1/2]O2(g)=CO2(g)+2H2(g)△H2=-192.9KJ•mol-1
下列说法正确的是( )
A.根据②推知:在25℃,101kPa时,1molCH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9kJ
B.反应②中的能量变化如图所示,则△H2=E1-E3
C.H2燃烧能放出大量的热,故CH30H转变成H2的过程必须吸收能量
D.CH30H的燃烧热△H=-192.9kJ•mol-1 梨花压倒菊花1年前1
梨花压倒菊花1年前1 -
 晓之林 共回答了11个问题
晓之林 共回答了11个问题 |采纳率100%解题思路:A、根据物质的能量大小与物质的状态关系来判断;
B、根据△H=生成物总能量-反应物总能量来判断;
C、根据已知的甲醇转化为氢气能量变化分析;
D、利用盖斯定律分析.A、同物质的量的同种物质,气态能量最高,其次液态能量,固态能量最低,由②推知反应:CH3OH(l)+[1/2]O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1,故A正确;
B、在反应②中,由图示△H=生成物总能量-反应物总能量=E1-E2,故B错误;
C、由已知可知,反应②为放热反应,故C错误;
D、根据盖斯定律将,②×3-①×2可得:CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,所以甲醇的燃烧热为676.7kJ/mol,故D错误;
故选A.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查化学能与热能的相互转化以及反应热的计算.注意在比较反应热大小时要带符号比较.1年前查看全部
大家在问
- 1写出下面句子中画线词的近义词。
- 22,1,2/3的最小公倍数是多少?
- 30.4公顷是多少平方米.0.073是多少公顷.1180平方千米是多少公顷按顺序
- 4壶口瀑布课文本文写的是壶口瀑布,第1段中却提到了人的各种情感,用意何在?
- 5220V?W的灯泡,接在220V的电源上,通过灯丝的电流为十
- 6(2012•湖南模拟)如图所示,物块A放在直角三角形斜面体B上面,B放在弹簧上面并紧挨着竖直墙壁,初始时A、B静止;现用
- 7[ka:sl] 看音标 写单词
- 8如图在直三棱柱ABC-A1B1C1中,∠ABC=90°,AB=BC=2,AA1=4,D是BC的中点E是CC1上一点,且C
- 9写出下列诗句的修辞手法(在线等)
- 10把一个数变成什么的幂的形式,叫做科学记数法
- 111头大象加5头牛等于10吨,2头大象加5头牛等于16吨,1头大象加1条鲸鱼等于20吨,问大象有多少吨,鲸鱼多少
- 12我想起了童年作文。
- 13下列化学现象描述正确的是( )
- 14王安石《千秋岁引》的原词是什么?
- 15(2012•包头)下列实验方案设计可行的是( )
