用热的烧碱溶液洗涤试管内壁的硫,生成哪些物质?
 来自群星2022-10-04 11:39:541条回答
来自群星2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 爱生活爱时尚 共回答了21个问题
爱生活爱时尚 共回答了21个问题 |采纳率95.2%- 6NaOH+3S=加热=2Na2S+Na2SO3+3H2O
硫的歧化反应,生成硫化钠和亚硫酸钠 - 1年前
相关推荐
- 要除去碳酸钙中的部分碳酸钠,应用什么试剂?1.烧碱溶液 2.硫酸钠溶液 3.盐酸 4.水
要除去碳酸钙中的部分碳酸钠,应用什么试剂?1.烧碱溶液 2.硫酸钠溶液 3.盐酸 4.水
说明原因
如果要除去氯化钾中的碳酸钾呢?(选项相同) 刘亮亮1年前1
刘亮亮1年前1 -
 笑天天地 共回答了13个问题
笑天天地 共回答了13个问题 |采纳率92.3%4.水
碳酸钙是不溶性的盐
3.盐酸1年前查看全部
- 有关:在一定温度下向饱和烧碱溶液中放入一定量的Na2O2过氧化钠,充分反应后恢复至原来温度
有关:在一定温度下向饱和烧碱溶液中放入一定量的Na2O2过氧化钠,充分反应后恢复至原来温度
虽然析出氢氧化钠但是水会与过氧化钠反应
所以为什么说氢氧根等总数减小
这有点不懂 缘圆一生1年前1
缘圆一生1年前1 -
 张桃溪 共回答了18个问题
张桃溪 共回答了18个问题 |采纳率88.9%请注意“饱和”二字,也就是说现在水中已经无法再溶解氢氧化钠.所以水与过氧化钠反应生成的氢氧化钠不会溶解.而氢氧化钠又会析出,因而氢氧根总数减少.1年前查看全部
- 既能跟铁发生置换反应,又能跟烧碱溶液发生复分解反应的是( )
既能跟铁发生置换反应,又能跟烧碱溶液发生复分解反应的是( )
A. 氧气
B. 二氧化碳
C. 硫酸铜溶液
D. 氯化铁溶液 封三csu1年前1
封三csu1年前1 -
 forgerlansir 共回答了20个问题
forgerlansir 共回答了20个问题 |采纳率85%解题思路:跟铁发生置换反应的是盐酸或稀硫酸以及活动性比铁弱的金属的盐溶液,能跟烧碱发生复分解反应要求反应后生成沉淀或水.A、氧气具有强氧化性,不能与铁发生置换反应,故A错误;
B、二氧化碳不与铁反应,故B错误;
C、铁的活动性比铜强,能把硫酸铜中的铜置换出来,氢氧化钠可与硫酸铜反应生成氢氧化铜沉淀,故C正确;
D、铁与氯化铁发生的是化合反应,故D错误.
答案:C点评:
本题考点: 金属的化学性质;复分解反应及其发生的条件.
考点点评: 本题考查的是常见物质间的置换反应以及复分解反应,完成此题,可以依据已有的知识完成.1年前查看全部
- 淀粉 烧碱溶液 会反应吗 ?淀粉 和 烧碱溶液 会反应吗 ?ThankYou
 某是主1年前1
某是主1年前1 -
 s13572595578 共回答了18个问题
s13572595578 共回答了18个问题 |采纳率83.3%会,淀粉会发生水解1年前查看全部
- 怎样区别稀硫酸,稀烧碱溶液和蒸馏水?方法是什么?
 kashtan1年前1
kashtan1年前1 -
 kwgkwg022 共回答了15个问题
kwgkwg022 共回答了15个问题 |采纳率93.3%用紫色石蕊试液,变红色的为硫酸,蓝色的为烧碱,不变色的为水,或者ph试纸也可以,跟标准比色卡比对,酸性的为硫酸,碱性的为烧碱,中性为水1年前查看全部
- 向稀硫酸中加入烧碱溶液至PH=7蒸干可得硫酸钠晶体?
向稀硫酸中加入烧碱溶液至PH=7蒸干可得硫酸钠晶体?
还有nh3和hno3反映生成nh4no3是固氮的一种方法, heromao1年前1
heromao1年前1 -
 forjiao 共回答了24个问题
forjiao 共回答了24个问题 |采纳率100%·1对吧硫酸和烧碱都是强酸:碱.2不对吧.固氮貌似是把N2转变为含氮化合物1年前查看全部
- 离子方程式(1)氯化铜与烧碱溶液混合(2)锌粉加入硫酸氢钠溶液中
 xiaoxiaofeifei1年前1
xiaoxiaofeifei1年前1 -
 zouyunfeng8 共回答了17个问题
zouyunfeng8 共回答了17个问题 |采纳率94.1%Cu2+ + 2OH- = Cu(OH)2 Zn + 2H+ = Zn2+ + H21年前查看全部
- 将氯气通入烧碱溶液中得到
 cyp471年前3
cyp471年前3 -
 可怜oo王 共回答了25个问题
可怜oo王 共回答了25个问题 |采纳率88%2NaOH+Cl2=NaCl+NaClO+H2O
6NaOH+3Cl2=加热=5NaCl+NaClO3+3H2O1年前查看全部
- 将一盛满氯气的试管倒立于盛有烧碱溶液的烧杯中,一段时间后出现的现象是
 wchangkai1年前2
wchangkai1年前2 -
 乾鹰 共回答了22个问题
乾鹰 共回答了22个问题 |采纳率90.9%由于Cl2+NaOH==NaCl+H20.
也就是说,试管内德气体逐渐变为水和NaCl,由于大气压力的作用,溶液会被压至试管内部,所以,我们能看到的现象是
试管内溶液液面上升,溶液最终占据整个试管1年前查看全部
- 有镁、铝和铁的混合物13.1克,与足量烧碱溶液共热后,在标况下产生3.36升氢气,将剩余溶液过滤后,残渣...
有镁、铝和铁的混合物13.1克,与足量烧碱溶液共热后,在标况下产生3.36升氢气,将剩余溶液过滤后,残渣...
有镁、铝和铁的混合物13.1克,与足量烧碱溶液共热后,在标况下产生3.36升氢气,将剩余溶液过滤后,残渣与足量稀硫酸反应,在标况下又产生6.72升氢气.求混合物中各物质的质量. smw5551年前1
smw5551年前1 -
 路过走过看过见过 共回答了22个问题
路过走过看过见过 共回答了22个问题 |采纳率100%2Al~3H2
n(H2)=3.36/22.4=0.15mol
n(Al)=0.15*2/3=0.1mol,m(Al)=27*0.1=2.7g
Mg~H2,Fe~H2
n(Mg)+n(Fe)=6.72/22.4=0.3mol
24n(Mg)+56n(Fe)=13.1-2.7=10.4g
n(Mg)=0.2mol,n(Fe)=0.1mol
m(Mg)=4.8g,m(Fe)=5.6g1年前查看全部
- 烧碱溶液中含有偏铝酸根,加入硫酸后,反应式是什么?
 每天的风1年前2
每天的风1年前2 -
 koo200 共回答了16个问题
koo200 共回答了16个问题 |采纳率93.8%首先 是 2NaOH +H2SO4==Na2SO4 +2H2O
然后 AlO2- +H+ +H2O===Al(OH)3 沉淀
最后 Al(OH)3 +3H+ ==Al3+ +3H2O1年前查看全部
- 高中化学:饱和的烧碱溶液中加钠如上.问,烧碱的浓度变化,质量分数变化,质量变化,及为什么这样变化?
 Lxj_01221年前1
Lxj_01221年前1 -
 siyuedefeng 共回答了17个问题
siyuedefeng 共回答了17个问题 |采纳率82.4%1,考虑温度
个人觉得 烧碱浓度变大,质量分数变大,总质量变大.
原因:2Na+2H2O= 2NaOH+H2
加入的是Na,假设有1mol反应则质量增加46g减少2g所以总质量应该变大
Na和水的反应是一个剧烈放热的反应,必然导致温度上升,溶解度上升.由于溶质烧碱增加溶液水的减少,烧碱可以继续溶解.所以溶液中的烧碱浓度和质量分数都应该变大.
2,不考虑温度
不考虑温度就不用考虑溶解度,那么浓度与质量分数不变,质量变大.1年前查看全部
- 浓烧碱溶液中加铝片的化学方程式
 我孤独吗1年前0
我孤独吗1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在干冰、碳酸氢铵、海水、空气、石灰水、盐酸、液氧、甲烷、白酒、烧碱溶液中,哪些是混合物,单质,氧化物
在干冰、碳酸氢铵、海水、空气、石灰水、盐酸、液氧、甲烷、白酒、烧碱溶液中,哪些是混合物,单质,氧化物
,酸溶液,碱溶液,盐,最简单的有机物? Oolong1年前4
Oolong1年前4 -
 zpj0068 共回答了23个问题
zpj0068 共回答了23个问题 |采纳率95.7%混合物:海水、空气、石灰水、盐酸、白酒、烧碱溶液
单质:液氧
氧化物:干冰
酸:盐酸
碱:石灰水、烧碱溶液
盐:碳酸氢铵
最简单的有机物:甲烷1年前查看全部
- 一钟黄色花汁,分别滴加在稀盐酸、食醋、蔗糖水、蒸馏水、肥皂水、烧碱溶液、石灰水里,依次呈现红、红、黄、黄、绿、绿、绿颜色
一钟黄色花汁,分别滴加在稀盐酸、食醋、蔗糖水、蒸馏水、肥皂水、烧碱溶液、石灰水里,依次呈现红、红、黄、黄、绿、绿、绿颜色,该花汁可不可以作为酸碱指示剂
 炎唐1年前1
炎唐1年前1 -
 这楼主是个大草包 共回答了22个问题
这楼主是个大草包 共回答了22个问题 |采纳率86.4%你好~
可以.由于稀盐酸、食醋显酸性;蔗糖水、蒸馏水呈中性;肥皂水、烧碱溶液以及石灰水呈碱性,而从表中的颜色变化可知:该花汁遇到酸、碱以及中性溶液均会呈现不同的颜色,故可以作指示剂使用.
有疑惑请追问~谢谢!望采纳~
——寒冰烈1年前查看全部
- 帮着写几个化学离子方程式不是化学方程式,是离子方程式!钠和水反应:烧碱溶液吸收氯气铁与硫酸铜溶液铁与盐酸反应澄清石灰水通
帮着写几个化学离子方程式
不是化学方程式,是离子方程式!
钠和水反应:
烧碱溶液吸收氯气
铁与硫酸铜溶液
铁与盐酸反应
澄清石灰水通入CO2反应 萧风残月1年前1
萧风残月1年前1 -
 lxyh001 共回答了18个问题
lxyh001 共回答了18个问题 |采纳率94.4%1.不是离子反应
2.Cl2+2OH-=Cl-+ClO-+H2O
3.Fe+Cu2+=Fe2++Cu
4.Fe+2H+=Fe2++H2
5.CO2+Ca2++2OH-=CaCO3+H2O1年前查看全部
- 烧碱溶液变质.要除杂提纯.应加入的试剂是.其主要实验操作是.
 哲奇1年前2
哲奇1年前2 -
 hanbingzhi 共回答了23个问题
hanbingzhi 共回答了23个问题 |采纳率91.3%因为空气中的二氧化碳和烧碱反应生成碳酸钠和水.
1.取样,加盐酸,有气泡生成.
2.加氢氧化钙溶液,生成碳酸钙沉淀和氢氧化钠.
3.除去沉淀用过滤.1年前查看全部
- 相同质量的si的单质与铝单质分别根足量的烧碱溶液反应,生成的气体在同温同压下的体积比是多少
 和平大使311年前1
和平大使311年前1 -
 王浪恋玮 共回答了17个问题
王浪恋玮 共回答了17个问题 |采纳率88.2%Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
可以得到是1 mol硅即24 g对应2体积的氢气;2 mol铝即52 g对应3体积的氢气
在相同质量下,可以得知两者的体积比为52 :361年前查看全部
- 在氧气中灼烧0.44g硫铁矿,生成的二氧化硫经过一系列变化最终转化为硫酸,用20ml 0.5mol/l的烧碱溶液恰好完全
在氧气中灼烧0.44g硫铁矿,生成的二氧化硫经过一系列变化最终转化为硫酸,用20ml 0.5mol/l的烧碱溶液恰好完全中和这些硫酸,则原混合物中的硫百分含量约为
A 36% B 46% C 53% D 22% 美丽大方的朋友1年前1
美丽大方的朋友1年前1 -
 trsmedia 共回答了29个问题
trsmedia 共回答了29个问题 |采纳率86.2%(0.02*0.5/2)*32/0.44
A1年前查看全部
- 在浓烧碱溶液中加入铝片的化学方程式 离子方程式!对了 它和在稀烧碱中加入铝片的方程式 离子方程
 eeЙ浪子1年前3
eeЙ浪子1年前3 -
 一月就是一天 共回答了11个问题
一月就是一天 共回答了11个问题 |采纳率100%二者一样
2NaOH+2Al+2H2O=2NaAlO2+3H2↑
2OH¯+2Al+2H2O=2AlO2¯+3H2↑1年前查看全部
- 在氧气,铁粉,石灰石,硫酸铜,水,盐酸,烧碱溶液中选择写化学方程式及现象 置换反应和两个复分解反应
 softsoul1年前1
softsoul1年前1 -
 hyand 共回答了18个问题
hyand 共回答了18个问题 |采纳率88.9%Fe + 2HCl === FeCl2 + H2↑
现象:有气泡产生,溶液由无色变成浅绿色
Fe+CuSO4==Cu+FeSO4
现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色.
NaOH+HCl==NaCl+H2O
现象:放热
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
现象:有蓝色沉淀生成,蓝色溶液变成无色1年前查看全部
- 美铝铜合金1.2g 加入过量盐酸,生成氢气1.12g,沉淀.09g,若将此合金放入烧碱溶液中,则大约产生多少氢气
美铝铜合金1.2g 加入过量盐酸,生成氢气1.12g,沉淀.09g,若将此合金放入烧碱溶液中,则大约产生多少氢气
在标准状况下 新llll1年前3
新llll1年前3 -
 still211 共回答了13个问题
still211 共回答了13个问题 |采纳率76.9%“镁铝铜合金1.2g 加入过量盐酸,生成氢气1.12g”那是不可能.1.12g应该是1.12升吧,如果是,那么
n(H2)=1.12/22.4=0.05mol
M(镁铝平均)=(1.2-0.09)/0.05=22.2g/mol
n(Mg)/n(2/3Al)=(22.2-18)/(24-22.2)=7/3
n(Mg)=0.05×7/10=0.035mol
n(2/3Al)=0.015mol
将此合金放入烧碱溶液中,则产生22.4×0.015=0.336升氢气.1年前查看全部
- 体积和物质的量浓度相同的1.醋酸,2.盐酸,3.硫酸三溶液,分别与同浓度的烧碱反应,要使反应后的溶液呈中性,所需烧碱溶液
体积和物质的量浓度相同的1.醋酸,2.盐酸,3.硫酸三溶液,分别与同浓度的烧碱反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为 (1
我觉得老师给的这个答案是错的
虽然说醋酸不能完全电离,但是和烧碱反应到最后电离出的离子和盐酸也是一样,是不是呢
硫酸的我明白了 zhtoto0071年前9
zhtoto0071年前9 -
 lvyucheng 共回答了15个问题
lvyucheng 共回答了15个问题 |采纳率93.3%因为醋酸是一元酸,而且是弱酸,如果有1:1的烧碱跟醋酸反应,之后的溶液的PH>7
估计你们还没学强碱弱酸盐的电离.这么说吧,把醋酸钠放在水里,理论上就会有1:1的醋酸根和Na+.但是由于醋酸根是弱酸的根,一部分会跟水反应,生成醋酸,留下OH-,所以溶液就是弱碱性的了.这就是为什么1:1的醋酸跟烧碱反应,会是弱碱性的.
而盐酸是一元酸,是强酸.与1:1 的烧碱反应,之后的溶液是PH=7
硫酸是二元酸,是强酸.与2:1 的烧碱反应,之后的溶液是PH=7.如果与1:1的烧碱反应,之后还剩下一半的H+.1年前查看全部
- 将A g的烧碱溶液与B g的硫酸铜溶液充分混合,将反应所得的混合物过滤,得蓝色沉淀物和无色滤液.下列
将A g的烧碱溶液与B g的硫酸铜溶液充分混合,将反应所得的混合物过滤,得蓝色沉淀物和无色滤液.下列有关说法中正确的是( )
A. 滤液中可能含有硫酸铜
B. 滤液的pH一定等于7
C. 滤液的质量一定小于(A+B)g
D. 滤液中含有的溶质只可能为一种 marllon1年前1
marllon1年前1 -
 sill8888 共回答了13个问题
sill8888 共回答了13个问题 |采纳率69.2%解题思路:A、根据硫酸铜溶液是蓝色的进行解答;
B、根据如果氢氧化钠溶液过量进行解答;
C、根据烧碱溶液与硫酸铜溶液充分混合生成氢氧化铜沉淀进行解答;
D、根据如果氢氧化钠溶液过量进行解答.A、硫酸铜溶液是蓝色的,而反应后得到无色滤液,所以滤液中一定没有硫酸铜,故A错误;
B、如果氢氧化钠溶液过量,滤液中含有氢氧化钠,溶液呈碱性,pH则大于7,故B错误;
C、烧碱溶液与硫酸铜溶液充分混合生成氢氧化铜沉淀,所以滤液的质量一定小于(A+B)g,故C正确;
D、如果氢氧化钠溶液过量,滤液中含有硫酸钠和氢氧化钠,所以溶质不只有一种,故D错误.
故选:C.点评:
本题考点: 碱的化学性质;溶液的酸碱性与pH值的关系.
考点点评: 主要考查了对碱和盐的反应,培养学生分析问题、解决问题的能力.1年前查看全部
- 下列物质中,既能和水反应,其水溶液又能分别和铁、氯化钡溶液、烧碱溶液反应的是()
下列物质中,既能和水反应,其水溶液又能分别和铁、氯化钡溶液、烧碱溶液反应的是()
A. 盐酸
B. 硫酸钾
C. 氧化钙
D. 无水硫酸铜 楚人留香1年前1
楚人留香1年前1 -
 linfeng520 共回答了23个问题
linfeng520 共回答了23个问题 |采纳率91.3%解题思路:A、根据盐酸不会与氯化钡反应进行分析;
B、根据硫酸钾和铁不会反应进行分析;
C、根据氧化钙和水生成的氢氧化钙不会与铁反应进行分析;
D、根据硫酸铜和铁、烧碱等会发生反应进行分析.A、盐酸不和水反应,盐酸和铁会反应,但是和氯化钡不会反应,不满足要求,故A错误;
B、硫酸钾不和水反应,硫酸钾会与氯化钡反应,但是不会与铁反应,不满足要求,故B错误;
C、氧化钙和水生成的氢氧化钙,但是其溶液和铁与氯化钡都不反应,不满足要求,故C错误;
D、无水硫酸铜可以结合水变成五水合硫酸铜晶体(CuSO4•5H2O),硫酸铜溶液可以和铁反应生成铜和硫酸亚铁溶液,与氯化钡反应生成硫酸钡和氯化铜,与烧碱反应生成氢氧化铜和硫酸钠钠,故D正确;
故选D.点评:
本题考点: 酸、碱、盐的鉴别.
考点点评: 在解此类题时,首先分析题中各物质的性质,然后将选项中的物质代入进行验证即可.1年前查看全部
- 一’写出下列反应的化学方程式:1‘用烧碱溶液吸收二氧化硫;2’纯碱与石灰水;3‘熟石灰与盐酸;4’硫酸雨苟性钠;5‘生石
一’写出下列反应的化学方程式:
1‘用烧碱溶液吸收二氧化硫;
2’纯碱与石灰水;
3‘熟石灰与盐酸;
4’硫酸雨苟性钠;
5‘生石灰与盐酸;
6’石灰石与稀盐酸;
7‘小苏打中和过多的胃酸;
8’盐酸除铁锈;
9‘高猛酸钾受热分解;
二’氧化钙放入水中所得到的溶液的pH——7,其溶液中的溶质是——,发生的反应是——,此溶液在空气中久置,表面已形成白膜,原因是【用方程式表示】——————————,洗出这白膜常用————,原因是【用方程式表示】————————————,工厂废气中的二氧化硫可用氢氧化钠来吸收除去,写出有关的化学方程式———————————. 不能爱1年前1
不能爱1年前1 -
 youngsyste3 共回答了19个问题
youngsyste3 共回答了19个问题 |采纳率89.5%1.2NaOH+SO2=Na2SO3+H2O
2.Na2CO3+Ca(OH)2=CaCO3(沉淀)+2NaOH
3.Ca(OH)2+2HCl=CaCl2+2H2O
4.H2SO4+2NaOH=Na2SO4+2H2O
5.CaO+2HCl=H2O=CaCl2
6.CaCO3+2HCl=H2O+CaCl2+CO2(气体)
7.NaHCO3+HCl=NaCl+H2O+CO2(气体)
8.Fe2O3+6HCl=2FeCl3+3H2O
9.2KMnO4=K2MnO4+MnO2+O2
二、大于 Ca(OH)2 CaO+H2O=Ca(OH)2 Ca(OH)2+CO2=CaCO3(沉淀)+H2O
盐酸 2HCl+CaCO3=H2O+CO2(气体)+CaCl2 最后一个空就是第一个方程式
谢谢~1年前查看全部
- 6.14-化学/P112(23).电解84.7ml 16% 的烧碱溶液(密度为 1.18g/ml),用石墨做电极,
6.14-化学/P112(23).电解84.7ml 16% 的烧碱溶液(密度为 1.18g/ml),用石墨做电极,
过一段时间后,电解质溶液浓度变为19.5%,求这一段时间内收集到的气体在标准状况下的体积升数.
33.5L
我做出来却是3.36L. 何必醉1年前2
何必醉1年前2 -
 coffeecindy 共回答了12个问题
coffeecindy 共回答了12个问题 |采纳率91.7%m(NaOH)=84.7mL*1.18g/mL*16%=16g.
电解过程中,被电解的是水,与氢氧化钠无关.
电解后的溶液质量:16g/19.5%=82g.
被电解的水的质量为:84.7mL*1.18g/mL-82g=18g.
n(H2O)=1mol
n(H2)=1mol
n(O2)=0.5mol
V(H2 O2)=1.5mol*22.4L/mol=33.6L1年前查看全部
- (2005•呼和浩特)化学兴趣小组同学在进行“碱的性质”探究实验过程中,甲乙两组同学分别向相同体积的石灰水和烧碱溶液中,
(2005•呼和浩特)化学兴趣小组同学在进行“碱的性质”探究实验过程中,甲乙两组同学分别向相同体积的石灰水和烧碱溶液中,同时通入CO2气体,前者变浑浊,后者未见明显现象.对此,甲组同学认为:CO2能与石灰水反应,不能与烧碱溶液反应.乙组同学认为:甲组同学的结论不完全正确.乙组同学如何用实验证明自己的观点呢?请你利用下面的实验用品帮助他们完成以下实验方案.
(1)提出假设:烧碱溶液也能与CO2发生反应.
(2)设计方案:
①制取CO2气体;
a.化学反应原理(用化学方程式表示):______.
b.请你从图中,选出正确的发生装置(填字母)______,选择该装置的理由是______.往装置中加药品前一定要______.
②组装实验装置:(除需要烧碱溶液外)还应选择下列装置中的______.(填字母)
③验证假设进行实验:
④反思与应用:实验步骤 实验现象 结论 向装有CO2 的瓶中注入少量NaOH溶液后,立即连接实验所选装置,振荡反应容器. ______ 提出的假设______.(填“成立”或“不成立”)
a.本实验从反应物的角度,利用______的改变验证了反应的发生.
b.在实验室中,久置的烧碱溶液会变质,其原因是(写化学方程式)______.因此,烧碱溶液应______保存. 刺猬仙人球1年前1
刺猬仙人球1年前1 -
 小聆听 共回答了16个问题
小聆听 共回答了16个问题 |采纳率81.3%解题思路:设计方案:①从实验室制取CO2气体的反应原理,装置特点,实验步骤等方面回答;
②组装实验装置时要考虑采用什么装置来验证氢氧化钠和二氧化碳反应,
③验证假设进行实验:主要从验证二氧化碳和氢氧化钠反应后气压变小入手,把气压变小转化成明显的实验现象.
④反思与应用:思考解决问题的方法和保存氢氧化钠的方法.①a.制取二氧化碳的反应原理就是碳酸钙和盐酸反应,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑
b. 制取二氧化碳的反应物为固体和液体,反应不需加热,所以应选择D装置.往装置中加药品前一定要 检查装置气密性.
②组装实验装置时,检验二氧化碳是否和氢氧化钠溶液反应,要通过直观的现象表示出来,可以选择气球膨大,或导管吸入水柱的方法.故选择的仪器为 EB或EAD.(填字母)
③验证假设进行实验:看到现象应是气球胀大或烧杯中的水被倒吸.证明二氧化碳与氢氧化钠溶液发生了反应.
④反思与应用:a.本实验从反应物的角度,利用 压强的改变验证了反应的发生.
b.在实验室中,久置的烧碱溶液会变质,其原因是 2NaOH+CO2=Na2CO3+H2O.因此,烧碱溶液应 密封保存.
故答案:①a;CaCO3+2HCl=CaCl2+H2O+CO2↑
b.D; 反应物为固体和液体,反应不需加热检查装置气密性
②EB或EAD
③
实验现象结论
气球胀大或D装置中的水倒吸成立④a;压强
b.2NaOH+CO2=Na2CO3+H2O; 密封点评:
本题考点: 二氧化碳的实验室制法;制取二氧化碳的操作步骤和注意点;二氧化碳的化学性质;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题全面考查了二氧化碳的实验室制法,还有如何检验二氧化碳能否和氢氧化钠溶液反应的相关知识.1年前查看全部
- 已知1在化工生产中,原料往往不能全部转化为产品2工业上常用电解纯净的饱和食盐水的方法得到烧碱溶液,再经过浓缩,蒸发等步骤
已知
1在化工生产中,原料往往不能全部转化为产品
2工业上常用电解纯净的饱和食盐水的方法得到烧碱溶液,再经过浓缩,蒸发等步骤制造烧碱.
现要分析一种仓库里的固体烧碱样品
(1)猜测样品中可能含有哪些杂质
(2)设计实验方案来验证猜测的正确性
1、根据已知1猜测杂质可能为氯化钠
2、取少量固体加水溶解,滴入硝酸银溶液,再滴入硝酸溶液,如果生成白色沉淀,则证明确有氯化钠杂质.
为什么要先加入
好吧...为什么要加入 AgNO3 和 HNO3 去鉴别? 快马加鞭81年前1
快马加鞭81年前1 -
 武药人 共回答了11个问题
武药人 共回答了11个问题 |采纳率81.8%如只加AgNO3样品中烧碱也会和AgNO3反应产生沉淀.这样就无法鉴别是否有氯化钠
了.加了HNO3仍然有沉淀则证明样品中有氯化钠,因为这里只有氯化银不溶于 HNO3 而氢氧化银是溶于HNO3溶液的.1年前查看全部
- 一道关于电离平衡的问题今有1、CH3COOH 2、HCL 3、H2SO4三种溶液(1)中和同一烧碱溶液,需同浓度的三种酸
一道关于电离平衡的问题
今有1、CH3COOH 2、HCL 3、H2SO4三种溶液
(1)中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系是 1=2>3
(2)体积和浓度相同的1、2、3三种溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液PH值为7,所需烧碱溶液的体积关系为3>2>1
第二问的答案为什么不是3>2=1 不到百万aa的猪1年前1
不到百万aa的猪1年前1 -
 tangchao00 共回答了15个问题
tangchao00 共回答了15个问题 |采纳率93.3%硫酸用得最多你知道 因为是二元酸
CH3COOH是弱酸 在溶液里电离不完全 所以还有以CH3COOH分子存在的醋酸 他们承酸性 想要完全中和酸 就必须用更多的烧碱NAOH才行 才能使PH为71年前查看全部
- 已知氧化铝与烧碱溶液反应时,会生成偏铝酸钠(NaALO2)和水,写出该化学反应方程式
 baobao20081年前1
baobao20081年前1 -
 无名hobsj6 共回答了17个问题
无名hobsj6 共回答了17个问题 |采纳率94.1%Al2O3+2NaOH====2NaAlO2+H2O
在化学书第一册99页有1年前查看全部
- 铝片溶于热的烧碱溶液氧化剂是什么想反应后的溶液中加稀硫酸最初的现象后来的现象
 kizww1年前1
kizww1年前1 -
 柳叶翩翩 共回答了24个问题
柳叶翩翩 共回答了24个问题 |采纳率83.3%2Al+ 2NaOH + 2H2O= 2NaAlO2+ 3H2↑
上面反应的氧化剂是氢氧化钠和水,或者说是一价氢.
NaAlO2中加稀硫酸,开始时NaAlO2过量,有白色Al(OH)3产生
AlO2- + H+ + H2O = Al(OH)3↓
继续加入稀硫酸,由于溶液酸性增强,Al(OH)3沉淀溶解
Al(OH)3 + 3H+ = Al3+ + 3H2O1年前查看全部
- 把10g市售硫氨样品溶于水,加入过量的烧碱溶液,加热到氨气全部逸出,并将生成的氨气用50ml2.5mol/L的硫酸完全吸
把10g市售硫氨样品溶于水,加入过量的烧碱溶液,加热到氨气全部逸出,并将生成的氨气用50ml2.5mol/L的硫酸完全吸收,此时溶液显酸性,然后用滴定管滴入40ml2.5mol/L的苛性钠溶液后,刚好将剩余硫酸中和,求该市售硫氨样品的纯度及含氮百分率.
 Gmute1年前1
Gmute1年前1 -
 sbjdj 共回答了20个问题
sbjdj 共回答了20个问题 |采纳率90%硫酸分两部分,硫酸中的氢离子与氨或氢氧根离子均按物质的量1;1反应.1mol硫铵[(NH4)2SO4]产生2mol NH3.
该市售硫铵样品的纯度=(0.050L×2.5mol/L×2-0.040L×2.5mol/L)÷2×132g/mol÷10g×100%=99%
含氮百分率=(0.050L×2.5mol/L×2-0.040L×2.5mol/L)×14÷10g×100%=21%1年前查看全部
- 为加快漂白粉的作用,最好办法是:A,加入烧碱溶液.B,用水湿润.C,加稀盐酸.D,加干燥剂
为加快漂白粉的作用,最好办法是:A,加入烧碱溶液.B,用水湿润.C,加稀盐酸.D,加干燥剂
我不太明白啊... superman_0081年前5
superman_0081年前5 -
 n_hao 共回答了26个问题
n_hao 共回答了26个问题 |采纳率96.2%C,加稀盐酸
Ca(ClO)2+2HCl=CaCl2+2HClO
生成HClO,发挥漂泊作用1年前查看全部
- 取20克烧碱放入180克水中,制成烧碱溶液.向200克食醋中滴加该溶液.至恰好完全反应.共用去烧碱溶液40克.
取20克烧碱放入180克水中,制成烧碱溶液.向200克食醋中滴加该溶液.至恰好完全反应.共用去烧碱溶液40克.
已知反应化学方程式为;CH3COOH+NaOH=CH3COONa+H2O
求烧碱溶液中溶质的质量分数和食醋中醋酸的质量分数 叫天1年前1
叫天1年前1 -
 foxxiaoya 共回答了25个问题
foxxiaoya 共回答了25个问题 |采纳率96%烧碱溶液中溶质的质量分数是20/(20+180)*100%=10%
设食醋中醋酸的质量为x.
CH3COOH+NaOH=CH3COONa+H2O
60 40
x 40*10%g
60/x=40/4
x=6g
食醋中醋酸的质量分数是6/200*100%=3%
答:烧碱溶液中溶质的质量分数是10%,食醋中醋酸的质量分数是3%1年前查看全部
- 向Cl与Al形成的化合物的水溶液中滴入烧碱溶液直至过量,现象 有关反应的离子方程式
 飞翔的小坏1年前1
飞翔的小坏1年前1 -
 性闻zz 共回答了14个问题
性闻zz 共回答了14个问题 |采纳率85.7%开始滴入时产生白色沉淀,并不断增加,最后沉淀逐渐溶解.
产生:Al3+ + 3OH- = Al(OH)3沉淀符号
溶Al(OH)3+OH- =AlO2 - +2H2O1年前查看全部
- 怎么鉴别氢氧化铷溶液,烧碱溶液和氨水
 nwey1年前2
nwey1年前2 -
 wuchao1123456 共回答了25个问题
wuchao1123456 共回答了25个问题 |采纳率88%闻气味,有刺激性气味的是氨水
进行焰色反应实验:
火焰颜色为紫红色的是氢氧化铷溶液,
火焰颜色为黄色的是烧碱溶液1年前查看全部
- 下列物质中,既能与稀硫酸反应,又能与烧碱溶液反应的是
下列物质中,既能与稀硫酸反应,又能与烧碱溶液反应的是
a NH4Cl
B NH4HS
C Na2CO3
D FeS
C是不可以和NaOH反应的.
A B D里怎么选呢?
A B D怎么选啊
为什么D不对?
A好象也没错饿..
B呢?
FeS为什么不能和碱反应? 红色-tt1年前3
红色-tt1年前3 -
 漫步的傻X 共回答了18个问题
漫步的傻X 共回答了18个问题 |采纳率100%啊,典型的酸式盐,都可以反应
比如和HCL生成氯化氨和H2S气体
和NaOH生成H2O和硫化氨加硫化钠1年前查看全部
- 将一定量的Cl2通入一定浓度的烧碱溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO
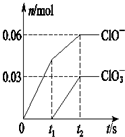 将一定量的Cl2通入一定浓度的烧碱溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的烧碱溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
A.烧碱溶液中NaOH的质量是3.6g
B.反应中转移电子的物质的量是0.09mol
C.氧化性ClO-<ClO3-
D.ClO3-的生成是由于温度升高引起的 q8131年前1
q8131年前1 -
 w0nw0klwlksng 共回答了15个问题
w0nw0klwlksng 共回答了15个问题 |采纳率100%解题思路:A.氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠和氯酸钠,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒计算n(Cl-),根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-),结合m=nM计算氢氧化钠质量;
B.由ClO-、ClO3-的物质的量,结合Cl元素化合价变化计算转移电子数目;
C.ClO-、ClO3-都是氧化产物,该反应不能确定次氯酸根离子和氯酸根离子氧化性强弱;
D.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾.A.氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠和氯酸钠,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(Na+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,则氢氧化钠的物质的量=0.3mol,则氢氧化钠质量=0.3mol×40g/mol=12g,故A错误;
B.由A中计算可知,反应中转移电子的物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故B错误;
C.ClO-、ClO3-都是氧化产物,该反应无法判断次氯酸根离子和氯酸根离子氧化性强弱,故C错误;
D.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故D正确;
故选D.点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题考查氧化还原反应的计算,根据原子守恒、转移电子守恒来分析解答,题目难度中等.1年前查看全部
- 硝酸和烧碱溶液的PH值与电导率的关系
 孑然不同1年前1
孑然不同1年前1 -
 无去不在 共回答了19个问题
无去不在 共回答了19个问题 |采纳率94.7%硝酸的ph值越低电导率越大
烧碱的ph值越高电导率越大
因为电导率和单位体积溶液中的离子数相关,离子数越多电导率越大1年前查看全部
- 实验室中能用磨口玻璃瓶存放的试剂是A.烧碱溶液B.浓硝酸C.氢氟酸D.硅酸钠溶液
实验室中能用磨口玻璃瓶存放的试剂是A.烧碱溶液B.浓硝酸C.氢氟酸D.硅酸钠溶液
急用!谢谢. 知乎则也1年前1
知乎则也1年前1 -
 guanaiflcr 共回答了17个问题
guanaiflcr 共回答了17个问题 |采纳率94.1%B
其余的能和玻璃反应,会粘连住磨口玻璃瓶塞1年前查看全部
- 下列各组中的物质充分反应后,所得溶液质量比反应前溶液质量减小的是( ) A.盐酸加入烧碱溶液中 B.锌片浸入硫酸铜溶液
下列各组中的物质充分反应后,所得溶液质量比反应前溶液质量减小的是( )
A.盐酸加入烧碱溶液中 B.锌片浸入硫酸铜溶液中 C.碳酸钠粉末加入稀盐酸中 D.二氧化碳通入足量石灰水中  赖妹1年前1
赖妹1年前1 -
 ngfbasobq 共回答了24个问题
ngfbasobq 共回答了24个问题 |采纳率95.8%D
1年前查看全部
- 下列离子方程式正确的是( )A.向烧碱溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2OB.硝酸铝溶液
下列离子方程式正确的是( )
A.向烧碱溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2O
B.硝酸铝溶液中加入过量氨水Al3++3NH3•H2O=Al(OH)3↓+3NH+4
C.氢氧化钡溶液和稀硫酸反应Ba2++SO42-=BaSO4↓
D.向酸性FeSO4溶液中滴入H2O2Fe2++H2O2+2H+=Fe3++2H2O 相约丹枫赴远冬1年前1
相约丹枫赴远冬1年前1 -
 剑客方无病 共回答了14个问题
剑客方无病 共回答了14个问题 |采纳率92.9%解题思路:A、烧碱过量,反应生成了偏铝酸根离子;
B、氨水碱性较弱,不能够溶解氢氧化铝,反应生成了氢氧化铝沉淀;
C、氢氧化钡与稀硫酸反应生成了硫酸钡沉淀和水,方程式中漏掉了水;
D、亚铁离子被双氧水氧化成了铁离子,离子方程式两边电荷不守恒.A、向烧碱溶液中滴加少量氯化铝溶液,氢氧根离子过量,反应生成了偏铝酸根离子,反应的离子方程式为:Az3++yO多-=AzO2-+2多2O,故A正确;
6、硝酸铝溶液中加入过量氨水,反应生成了氢氧化铝沉淀,反应的离子方程式为:Az3++3w多3•多2O=Az(O多)3↓+3w多y+,故6正确;
2、氢氧化钡溶液和稀硫酸反应,生成了硫酸钡沉淀和水,反应的离子方程式为:2多++SOy2-+6a2++2O多-=6aSOy↓+2多2O,故2错误;
上、向酸性六eSOy溶液中滴入多2O2,亚铁离子被氧化成铁离子,2六e2++多2O2+2多+=2六e3++2多2O,故上错误;
故选A6.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查了离子方程式的正误判断,题目难度中等,该题是高考中的高频题,侧重对学生能力的培养和训练,该题需要明确判断离子方程式常用方法(1)检查反应能否发生;(2)检查反应物、生成物是否正确;(3)检查各物质拆分是否正确;(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等);(5)检查是否符合原化学方程式.1年前查看全部
- 烧碱溶液吸收SO2化学式知道告诉下谢谢
 heding5201年前1
heding5201年前1 -
 不爱大坑 共回答了13个问题
不爱大坑 共回答了13个问题 |采纳率84.6%2NaOH+SO2=Na2SO3+H2O1年前查看全部
- (2007•番禺区一模)某化工厂常用电解纯净的饱和食盐水的方法来得到烧碱溶液,再经浓缩、蒸发等步骤制造固体烧碱.某化学兴
(2007•番禺区一模)某化工厂常用电解纯净的饱和食盐水的方法来得到烧碱溶液,再经浓缩、蒸发等步骤制造固体烧碱.某化学兴趣小组要分析该化工厂仓库里的固体烧碱样品.
(1)小组成员猜测该样品中含有碳酸钠,支持这种猜测的依据是(用化学方方程式表示)______.小组成员选用了三种不同类别的试剂,进行实验,验证猜想,并得出结论,碳酸钠确实存在.请你将实验过程中涉及的化学方程式填在下表中.
(2)现已知样品中含有氯化钠、氢氧化钠、碳酸钠,设计一个实验方案,来证实一定含有氯化钠存在.化学方程式 试剂1 试剂2 试剂3 
请写出试剂X的化学式______
请写出①反应的化学方程式______
请写出②反应的化学方程式______. 烟雨楼家族之烟灰1年前1
烟雨楼家族之烟灰1年前1 -
 钱之光 共回答了20个问题
钱之光 共回答了20个问题 |采纳率85%解题思路:(1)烧碱易潮解,潮解之后容易和空气中的二氧化碳反应,检验烧碱变质的方法就是根据碳酸钠的化学性质来选择合适的试剂来鉴别
(2)加入试剂A后生成了气体可知X为酸,但是考虑到后边的反应中加入了硝酸银,所以此时要排除氯离子和硫酸根离子的干扰,故应该选择稀硝酸,可以据此答题(1)烧碱露置于空气中时易于空气中的二氧化碳反应而变质,在验证烧碱是否变质实际上就是验证碳酸钠的存在,故可以据其性质来区分,要注意的是当用盐酸时要向把氢氧化钠反应掉,然后才会有气体产生,故本题的答案为:CO2+2NaOH=Na2CO3+H2O
化学方程式
试剂1 Na2CO3 +CaCl2═2NaCl+CaCO3↓
试剂2 Na2CO3+Ca(OH)2═2NaOH+CaCO3↓
试剂3
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O (2)加入X生成了气体可知X为酸,但是考虑到后边的反应中加入了硝酸银,所以此时要排除氯离子和硫酸根离子的干扰,故应该选择稀硝酸,当加入稀硝酸时除了和碳酸钠反应,还要和氢氧化钠发生中和反应,在混合物中能和硝酸银生成白色沉淀的是氯化钠,
故本题答案为:HNO3 NaOH+HNO3=NaNO3+H2O; Na2CO3+2HNO3=2NaNO3+CO2↑+H2ONaCl+AgNO3=AgCl↓+NaNO3点评:
本题考点: 酸、碱、盐的鉴别;电解水实验.
考点点评: 解答本题要求学生熟练掌握酸、碱、盐的化学性质,并能根据物质之间能否反应及其反应的实验现象来得出结论,熟记化学方程式:CO2+2NaOH=Na2CO3+H2O;Na2CO3+Ca(OH)2═2NaOH+CaCO3↓; NaOH+HCl=NaCl+H2O.1年前查看全部
- 取两毫升的硫酸铜溶液于试管中,滴加几滴烧碱溶液,观察到的现象是 反映的化学方程式为 再向试管中滴加稀盐酸,观察到的现象时
取两毫升的硫酸铜溶液于试管中,滴加几滴烧碱溶液,观察到的现象是 反映的化学方程式为 再向试管中滴加稀盐酸,观察到的现象时是 反映的化学方程式为
 xlcss1年前3
xlcss1年前3 -
 潇剑℃ 共回答了26个问题
潇剑℃ 共回答了26个问题 |采纳率92.3%取两毫升的硫酸铜溶液于试管中,滴加几滴烧碱溶液,观察到的现象是(产生蓝色沉淀)
反映的化学方程式为(CuSO4 + 2 NaOH = Cu(OH)2↙ + Na2SO4)
再向试管中滴加稀盐酸,观察到的现象时是(蓝色沉淀溶解,得到蓝色溶液)
反映的化学方程式为(Ca(OH)2 + 2 HCl = CuCl2 + 2 H2O)1年前查看全部
- 将二氧化碳通入一定量的烧碱溶液中,二者恰好完全反应后,得到88.8g溶液.
将二氧化碳通入一定量的烧碱溶液中,二者恰好完全反应后,得到88.8g溶液.
将所得溶液蒸干,可得到21.2g碳酸钠.求烧碱溶液中溶质质量分数 xiadelei1年前1
xiadelei1年前1 -
 夏日的娃娃 共回答了27个问题
夏日的娃娃 共回答了27个问题 |采纳率92.6%CO2+2NaOH=Na2CO3+H2O 44 80 106 18 Y X 21.2 解得X=16克.Y=8.8克.反应的质量等反应后的质量.设反应前烧碱溶液的质量为Z克.反应的前质量=8.8+Z=88.8gZ=80g则烧碱溶液中质量分...1年前查看全部
- 帮我写几个离子方程式,硫酸亚铁中加入经硫酸酸化的双氧水小苏打溶液与烧碱溶液反应氯气通入水中三氯化铁与氢碘酸反应氢氧化钡溶
帮我写几个离子方程式,
硫酸亚铁中加入经硫酸酸化的双氧水
小苏打溶液与烧碱溶液反应
氯气通入水中
三氯化铁与氢碘酸反应
氢氧化钡溶液与稀硫酸的反应
用氨水吸收过量二氧化碳
向漂白粉中通入二氧化碳气体
碳酸氢钠中加入少量氢氧化钡溶液
氨水与硝酸作用
硫化亚铁与稀硝酸作用
氯化铁制备氢氧化铁胶体 Jiang_linyan1年前1
Jiang_linyan1年前1 -
 zhanglia 共回答了23个问题
zhanglia 共回答了23个问题 |采纳率82.6%2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
HCO3- + OH- = CO32- + H2O
Cl2 + H2O = Cl- + HClO + H+
2Fe3+ + 2I- = 2Fe2+ +I2↓
OH- + H+ =H2O
CO2 + NH3·H2O = NH4+ + HCO3-
Ca2+ + 2ClO- +H2O + CO2 = CaCO3↓+2HClO
或ClO- + H2O + CO2 = HCO3- + HClO
HCO3- + Ba2+ + OH- = BaCO3↓+H2O
NH3·H2O +H+ =NH4+ + H2O
FeS + 6H+ + 3NO3-=Fe3+ + S + 3NO2↑ + 3H2O
Fe3+ + 3OH- = Fe(OH)31年前查看全部
- 能将烧碱溶液和澄清石灰水区别开来的物质是( )
能将烧碱溶液和澄清石灰水区别开来的物质是( )
A、盐酸 B、石蕊试液 C、二氧化碳 D、硝酸钠溶液
答案都说是C,
A为什么不行?
Na2CO3+HCl=H2O+CO2+NaCl 有气泡啊. luhaiou1年前1
luhaiou1年前1 -
 gabrielgao 共回答了14个问题
gabrielgao 共回答了14个问题 |采纳率92.9%烧碱是氢氧化钠,不是碳酸钠.
所以还是要C1年前查看全部
大家在问
- 1高中数学有没有什么重要的结论而课本却没有提到的?
- 2在水面上做简谐运动的弹簧振子,振幅A为2cm,周期T为2S,下列说法中正确的是()
- 3在一个周长为100厘米的正方形纸内,要剪一个最大的圆,这个远的半径是多少厘米?
- 4问一道英语的选择提: The children are ------ on the playground 选项有:pla
- 50.2mol有机物与0.4mol氧气在密闭容器中燃烧后的产物为二氧化碳,一氧化碳和水蒸气.产物经过浓硫酸后
- 6为甚么运动的电荷的相互作用是通过磁场发生的,而不是电场?
- 7生物体内不同的信息分子必须与相应的受体(化学本质多为糖蛋白)特异性结合才能发挥作用.图甲是植物体内生长素与相应受体结合后
- 8如图1是人体内某些信息分子作用的示意图,字母A~E表示信息分子,数字表示相关生理变化.请据图回答:
- 9庄子送葬这个故事的目的是什么
- 10图中温带地区A、B、C三地的气候类型由西向东分别是( )
- 11第一位把望远镜用于科学研究的是意大利物理学家( )
- 12当x趋近于0时(1+x)的1/x次方的二阶泰勒展开式
- 13英语翻译everytime when i thinking of you-i just don't know what
- 14(2012•漳州)小东喜欢用生活中的物品做物理小实验.有一次他用一条洗衣机的排水软管做实验:如图所示,把软管下端开口对准
- 15苯和水能用分液漏斗分离么..为什么
