歧化和钝化是个什么概念?
 anonymous12022-10-04 11:39:542条回答
anonymous12022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 cqwanghl 共回答了12个问题
cqwanghl 共回答了12个问题 |采纳率83.3%- 在反应中,若氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,使该元 超氧化物歧化酶(SOD)素的原子(或离子)一部分被氧化,另一部分被还原.这种自身的氧化还原反应称为歧化反应.这种反应又被称为康尼查罗反应.
例如Cl2+H2O=HClO+HCl
此反应中Cl2原本是0价
反应后一个升为+1价,一个降为-1价
歧化反应是[1]化学反应的一种,反应中某个元素的化合价既有上升又有下降.与归中反应相对.
铁、铝在稀HNO3或稀H2SO4中能很快溶解,但在浓HNO3或浓H2SO4中溶解现象几乎完全停止了,碳钢通常很容易生锈,若在钢中加入适量的Ni、Cr,就成为不锈钢了.金属或合金受一些因素影响,化学稳定性明显增强的现象,称为钝化.由某些钝化剂(化学药品)所引起的金属钝化现象,称为化学钝化.如浓HNO3、浓H2SO4、HClO3、K2Cr2O7、KMnO4等氧化剂都可使金属钝化. - 1年前
 bbs9099 共回答了17个问题
bbs9099 共回答了17个问题 |采纳率- 歧化是反应中同一元素的化合价原本相同,反应后相同元素的化合价有升高的,也有降低的,比方说双氧水的分解
钝化是指反应进行时反应物表面或形成致密氧化膜,或是由被固体覆盖,而阻止或减慢反应的进行
比如说铁在冷的浓硫酸中会发生钝化而阻止进一步的反应... - 1年前
相关推荐
- 有关化学平衡常数的题目实验测得氯气溶于水后约有三分之一的Cl2发生歧化转化为盐酸和次氯酸,求该反应的平衡常数.293K下
有关化学平衡常数的题目
实验测得氯气溶于水后约有三分之一的Cl2发生歧化转化为盐酸和次氯酸,求该反应的平衡常数.293K下氯气在水中的溶解度为0.09 mol•dm-3.
如图 可是最后分母中的c(标准状态浓度)去哪了?

 moshouzhengba1111年前1
moshouzhengba1111年前1 -
 zhlwyy 共回答了20个问题
zhlwyy 共回答了20个问题 |采纳率95%标准状态浓度=1.0mol/L
写或者不写只会影响单位,不会影响数据,计算过程中是可以忽略的.1年前查看全部
- 归中反应、部分氧化还原反应、歧化反应和自身氧化还原反应分别应该如何用化合价配平相应的化学方程式?
 51游戏人生1年前2
51游戏人生1年前2 -
 1977220 共回答了15个问题
1977220 共回答了15个问题 |采纳率93.3%你说的这些反应,都有电子的转移.比如一个从+5降到+2,一个从-1升到0,所以这两个物质的比例就应该是电子得失的比例,为1:3,多做做练习啥的,熟了就自己有自己的一套方法了,没多难1年前查看全部
- 归中,歧化反应的条件是什么?是不是有中间价就一定发生归中反应?歧化呢?浓硫酸有什么特殊的反应?
 anbeiyongquan1年前3
anbeiyongquan1年前3 -
 shycat719 共回答了23个问题
shycat719 共回答了23个问题 |采纳率91.3%归中反应就是指同种元素的不同化合物发生氧化还原反应,那种元素的化合价向中间靠拢.
歧化反应刚好与归中反应相反,一种元素的化合价向两边散开,
例如2Na2O2+2CO2====2Na2CO3+O2
此反应中,Na2O2中的O是-1价,他跟CO2反应后生成O为-2价的Na2CO3和O为0价的O2
不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而决不会出现高价态变低、低价态变高的交叉现象.——归中反应规律
价态归中是指,高价态的化合价降低,低价态的化合价升高,但不可能低的最后升的比原来高价态化合价还高.
归中现象:
1、氧化还原反应中的归中反应:
含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应.发生归中反应的条件是要符合中间价态理论:含有同一元素的不同价态的两种物质,只有当这种元素有中间价态时,才有可能发生归中反应.而且高低价态变化的结果是生成该元素的中间价态.归中反应的特点是氧化产物和还原产物是同一种物质.利用中间价态理论可以解释为什么二氧化硫可用浓硫酸干燥(因为不存在+5价的硫).
C+CO2=2CO
SO2+2H2S=3S↓+2H2O
H2SO3+2H2S=3S↓+3H2O
H2S+3H2SO4(浓)=4SO2+4H2O
2Fe3++Fe=3Fe2+
6HCl+KClO3=KCl+3Cl2↑+3H2O
5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
Ca(ClO)2+4HCl(浓)=2Cl2↑+CaCl2+2H2O
CuO+Cu=Cu2O
2Na+Na2O2 2Na2O
2.、复分解反应中的归中反应:
复分解反应的归中反应是指碱与多元酸反应,正盐与对应的酸式盐或酸反应,酸与对应的酸式盐反应,其中的氢原子数出现的归中现象,从而生成一种酸式盐的一类反应.其中反映的归中规律正是酸式盐的形成条件.
(1) 碱与多元酸反应:当多元酸过量时可形成酸式盐:
NaOH+H2S=NaHS+H2O;
H2SO4十NaOH=NaHSO4十H2O
(2) 多元酸与对应的正盐反应:
Na2S+H2S=2NaHS
CaCO3+H2O+CO2=Ca(HCO3)2
MgCO3+H2O+CO2=Mg(HCO3)2
Na2SO4+H2SO4=2NaHSO4
(NH4)2SO3+SO2+H2O=2NH4HSO3
Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2
(3) 多元酸与对应的酸式盐
Na2HPO4+H3PO4=2NaH2PO4
(4) 正盐与对应的酸式盐:
NaH2PO4+Na3PO4=2Na2HPO4
如果把正盐和碱中所含的可电离的氢离子看成是零,那么,生成酸式盐的归中条件是:两种反应物组成上要相差两个或两个以上可电离的氢离子.如果两种反应物的组成相差两个以上可电离的氢离子(即三元酸与对应正盐或与碱反应),则生成物与反应物用量有关,但符合“显强性”原理,即生成物的组成接近于过量物的组成.
如 (注:n表示物质的量)
≤1,其反应为:H3PO4+NaOH=NaH2PO4+H2O
在1—2之间,其反应为:2H3PO4+3NaOH=NaH2PO4+Na2HPO4+3H2O
=2,其反应为:H3PO4+2NaOH=Na2HPO2+2H2O
在2—3之间,其反应为:2H3PO4+5NaOH=Na2HPO4+Na3PO4+5H2O
≥3,其反应为:H3PO4+3NaOH=Na3PO4+3H2O
又如
≥2,其反应为:2H3PO4+Na3PO4=3NaH2PO4
=1,其反应为:H3PO4+Na3PO4=NaH2PO4+Na2HPO4
≤ ,其反应为:H3PO4+2Na3PO4=3Na2HPO4
3.、双水解反应中的归中反应:
这类归中反应是指能形成两性化合物的元素所形成的两类盐溶液反应形成氢氧化物的一类反应.这是金属阳离子和该金属所生成的阴离子生成中性的氢氧化物沉淀的归中现象.如:
Al3++3AlO2- +6H2O=4Al(OH)3↓
Zn2++ZnO2^2- +2H2O=2Zn(OH)2↓
“高价+低价→中间价”解释:
例:2H2S+SO2===3S+2H2O
此反应中,H2S中的S是-2价,SO2中的S是+4价,它们两者发生氧化还原反应后,生成0价的S和水
歧化反应
在反应中,若氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原.这种自身的氧化还原反应称为歧化反应.
例如2Na2O2+2CO2====2Na2CO3+O2
此反应中,Na2O2中的O是-1价,他跟CO2反应后生成O为-2价的Na2CO3和O为0价的O2
还有Cl2+H2O=HClO+HCl
此反应中Cl2原本是0价
反应后一个升为+1价,一个降为-1价
歧化反应是化学反应的一种,反应中某个元素的化合价既有上升又有下降.
例子
氯气与氢氧化钠溶液反应,生成氯化钠、氯酸钠和水.其离子方程式为:
3Cl2 + 6OH− = 5Cl− + ClO3− + 3H2O
氯气中氯的化合价为0.氯化钠中氯的化合价下降到-1;而氯酸钠中氯的化合价则上升到+5.所以,该反应是歧化反应.1年前查看全部
- 为什么会发生歧化反应 请从原子结构的角度解释不要从能斯特方程和电化学角度比如说发生氧化反应或还原反应是因为轨道结构的原因
为什么会发生歧化反应
请从原子结构的角度解释
不要从能斯特方程和电化学角度
比如说发生氧化反应或还原反应是因为轨道结构的原因
比如氯气在碱中的歧化 为什么同一物质在同一环境中会有不同的反应倾向?
好回答追分! 梅华20051年前2
梅华20051年前2 -
 蝎蝎链 共回答了15个问题
蝎蝎链 共回答了15个问题 |采纳率100%我的理解是氯分子极化后电子的分配不均造成的1年前查看全部
- 为什么亚铜离子在水溶液中易发生歧化反应,而在有机溶剂中不易发生歧化
 g_life_madein_sz1年前1
g_life_madein_sz1年前1 -
 xpez16183 共回答了20个问题
xpez16183 共回答了20个问题 |采纳率85%在无机溶液中铜以离子形式存在,它此时带电,与无机溶液中的其他离子容易发生反映,而且此时铜离子为中间价态也不稳定,就可以反生化合价升降的反应
在有机溶液中,除了铜离子本身以外,有机溶液不存在其它带电离子(因为有机溶液的成分是以基团形式存在,基团是不带电的),所以不易发生反映1年前查看全部
- 关于归中和歧化的反应疑问.过氧化钠和水反应。为什么过氧化钠既是还原剂又是氧化剂。而不是 过氧化钠是氧化剂。水是还原剂呢?
关于归中和歧化的反应疑问.
过氧化钠和水反应。
为什么过氧化钠既是还原剂又是氧化剂。
而不是 过氧化钠是氧化剂。水是还原剂呢?
在氧化还原反应如何判断一个反应物既是氧化剂又是还原剂呢?有些反应的其它反应物化合价也有变化。该如何去判断? jiye2003221年前3
jiye2003221年前3 -
 抛人远泛潇湘 共回答了12个问题
抛人远泛潇湘 共回答了12个问题 |采纳率100%关键还是分析元素化合价有无变化.过氧化钠与水反应,过氧化钠中氧元素是负一价,反应时负一价的氧有一半变到零价,一半变到负二价,所以它既是氧化剂又是还原剂.你还可以根据氧化还原反应的相关规律来理解1年前查看全部
- 酸化,水化,炭化,钝化,歧化,风化到底是怎样的一个过程?
 一世的宝贝1年前1
一世的宝贝1年前1 -
 俄u寡妇鱼 共回答了19个问题
俄u寡妇鱼 共回答了19个问题 |采纳率94.7%酸化即加酸使体系由碱性或中性变成酸性的过程.
水化即水分子的正、负电荷中心并不重合,是偶极子.它又有很强的的氢键作用,故水有特殊的结构.当盐类溶于水中生成电解质溶液时,离子的静电力破坏了原来的水结构,在其周围形成一定的水分子层,称为水化.
炭化 又称干馏,即将煤、木材、油页岩等在隔绝空气下加热分解为气体(煤气)、液体(焦油)和固体(焦炭)产物,焦油蒸气随煤气从焦炉逸出,可以回收利用,焦炭则由焦炉内推出.有机化合物在隔绝空气下热分解为碳和其他产物,以及用强吸水剂(浓硫酸)将含碳、氢、氧的化合物(如糖类)脱水而成炭的作用也称碳化.
钝化是在金属表面形成一层薄的氧化物层,使金属表面转化为不易被氧化的状态,而延缓金属的腐蚀速度的方法.
风化是指在室温和干燥空气里,结晶水合物.失去结晶水的现象等等.1年前查看全部
- 为什么硫代硫酸根在酸性条件下不稳定,自身歧化生成硫单质和二氧化硫 碱性环境稳定
为什么硫代硫酸根在酸性条件下不稳定,自身歧化生成硫单质和二氧化硫 碱性环境稳定
酸性增强氧化性 碱性不也增强还原性吗 幻沙杀患1年前2
幻沙杀患1年前2 -
 飞火流萤 共回答了24个问题
飞火流萤 共回答了24个问题 |采纳率75%因为硫代硫酸根是稳定的;然而硫代硫酸是一个弱酸,并且不稳定.
一旦酸化:S2O3 2- +2H+ ===H2S2O3
然后马上:H2S2O3===SO2↑+S↓+H2O
欢迎追问 在线回答1年前查看全部
- (2013•郑州三模)铜是一种与人类关系非常密切的有色金属.常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反
 (2013•郑州三模)铜是一种与人类关系非常密切的有色金属.常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH 等.
(2013•郑州三模)铜是一种与人类关系非常密切的有色金属.常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH 等.
(1)在CuCl2溶液中逐滴加入过量KI溶液,可能发生的反应有:2Cu2++4I=2CuI↓(白色)+I2;2Cu2++2I-+2Cl-=CuCl↓(白色)+I2.已知:常温下Ksp(CuCl)=1.20×10-6mol2•L-2;Kab(CuI)=5.06×10-12mol2•L-2. 由此推断上述反应生成主要沉淀物的化学式是______.
(2)向CuH中加入过量稀HCl,有气体生成,该反应的离子方程式为______.
(3)将冰铜(由Cu2S和FeS熔合成含Cu 18%-20%的一种物质)加入熔剂,在髙温下 吹入空气,冰铜中的Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应生成粗铜.上述两个 反应的化学方程式分别是2Cu2S+3O2
2Cu2O+2SO2、2Cu2O+Cu2S高温 .
6Cu+SO2↑高温 .2Cu2S+3O2.
2Cu2O+2SO2、2Cu2O+Cu2S高温 .
6Cu+SO2↑高温 .
(4)常温下,向0.20mol•L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜 沉淀,当溶液的pH=6时,c(Cu2+)=______mol•L‑1.[已知:Ksp[Cu(OH)2]=2.2×10-20mol•L-3]
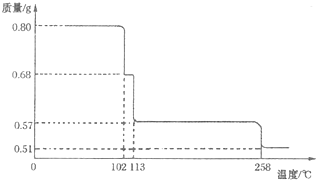
(5)将0.80gCuS04•5H20样品加热分解,其脱水过程中固体质量随温度的变化如图所示.请确定110℃时固体物质的化学式______.(要求写出推断过程) tianque1年前1
tianque1年前1 -
 baby1986 共回答了20个问题
baby1986 共回答了20个问题 |采纳率95%解题思路:(1)根据Ksp越小,溶解能力越小,越容易沉淀;(2)根据CuH中的-1价H和HCl中+1价的H反应生成氢气,Cu+在酸性条件下易发生歧化反应:2Cu=Cu2++Cu作答;(3)根据反应物和生成物配平得上述两个反应的化学方程式;(4)根据题给Cu(OH)2的溶度积计算;(5)从图象可知固体的质量为0.68克,依据题意根据CuSO4•5H2O△. CuSO4•xH2O+(5-x)H2O计算.(1)根据Ksp越小,溶解能力越小,越容易沉淀;因为Ksp(CuCl)=1.20×10-6mol2•L-2>Kab(CuI)=5.06×10-12mol2•L-2.故上述反应生成主要沉淀物的化学式是CuI,故答案为:CuI;
(2)向CuH中加入过量稀HCl有气体生成,原因是CuH中的-1价H和HCl中+1价的H反应生成氢气,又因为Cu+在酸性条件下易发生歧化反应:2Cu=Cu2++Cu;则该反应的离子方程式为 2CuH+2H+=Cu2++Cu+2H2↑,故答案为:2CuH+2H+=Cu2++Cu+2H2↑;
(3)在髙温下 吹入空气,冰铜中的Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应生成粗铜. 根据反应物和生成物配平得上述两个反应的化学方程式分别是 2Cu2S+3O2
高温
.
2Cu2O+2SO2、2Cu2O+Cu2S
高温
.
6Cu+SO2↑,故答案为:2Cu2S+3O
高温
.
2Cu2O+2SO2、2Cu2O+Cu2S
高温
.
6Cu+SO2↑;
(4)根据题给Cu(OH)2的溶度积即可确定pH=6时,c(OH-)=10-8mol/L,Ksp[Cu(OH)2]=2.2×10-20,则c(Cu2+)=2.2×10-4mol•L-1,
故答案为:2.2×10-4;
(5)设110℃时固体物质的化学式为CuSO4•xH2O,从图象可知固体的质量为0.68克,依据题意得
CuSO4•5H2O
△
.
CuSO4•xH2O+(5-x)H2O
250 160+18x
0.80g0.68 g
[250/160+18x]=[0.80g/0.68g],解得x=3,该固体物质的化学式为CuSO4•3H2O,
故答案为:CuSO4•3H2O.点评:
本题考点: 铜金属及其重要化合物的主要性质;化学方程式的有关计算;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题以铜的单质及化合物为载体,考查了化学方程式的书写和计算、Ksp的计算等,综合性较强.1年前查看全部
- 化学反应歧化和其他元素升降价可以同时么?
化学反应歧化和其他元素升降价可以同时么?
一个反应中 歧化反应的同时可能还有其他氧化还原么 yajane2bao1年前3
yajane2bao1年前3 -
 szz0414 共回答了26个问题
szz0414 共回答了26个问题 |采纳率88.5%15CuSO4 + 11P + 24H2O = 5Cu3P + 6H3PO4 + 15H2SO4
看看上面这条氧化还原反应方程式:P歧化,Cu化合价由+2变到+1.
自己可以得出结论了.1年前查看全部
- 从海水中提取溴,一开始浓缩的是粗溴,为什么要碱性条件下歧化、浓缩、酸性条件下逆歧化
从海水中提取溴,一开始浓缩的是粗溴,为什么要碱性条件下歧化、浓缩、酸性条件下逆歧化
在先和氢氧化钠反应,又和硫酸反应的过程中,溴的纯度高了吗?
 天蝎耀影1年前1
天蝎耀影1年前1 -
 likesomuch 共回答了13个问题
likesomuch 共回答了13个问题 |采纳率100%氢氧化钠和溴反应后生成两种盐,这样含溴的盐的沸点就要比纯溴要高了.之后蒸发浓缩就能够把大部分的溴以盐的形式保留下来,这就提高了溴的浓度.之后逆歧化就可以得到纯度比刚才要高的溴了.之后萃取分离就得到纯溴.1年前查看全部
- 单质硫在KOH的热溶液中发生歧化反应:3S+6KOH==2K2S+K2SO3+3H2O
单质硫在KOH的热溶液中发生歧化反应:3S+6KOH==2K2S+K2SO3+3H2O
若硫过量,进一步生成K2Sx(x 油茶妹儿1年前1
油茶妹儿1年前1 -
 xubin9933 共回答了24个问题
xubin9933 共回答了24个问题 |采纳率95.8%0.08mol S + 0.06mol KOH
首先按照题目给的方程式反应,得到 0.02mol K2S + 0.01mol K2SO3 + 0.05mol S
然后 S 继续反应.注意观察可以发现此时进行的反应是:
(x-1)S + K2S = K2Sx
S + K2SO3 = K2S2O3
根据题意,K2S 和 K2SO3 应全部反应完毕,因此 K2Sx 为 0.02mol,K2S2O3 为 0.01mol
根据 S 守恒可得 x=3
用 KClO-KOH 氧化其实可以看作 KClO 直接将 0.08mol S 从0氧化到+6,总传递电子数=0.08*6=0.48mol
考察各候选项 AC 正确.1年前查看全部
- 磷溶于碱中发生歧化反应反应方程式
 linjianff1年前1
linjianff1年前1 -
 jinying791209 共回答了20个问题
jinying791209 共回答了20个问题 |采纳率95%白磷可溶于热的浓碱溶液,生成磷化氢和次磷酸二氢盐
以NaOH为例,方程式:
P4 + 3NaOH + 3H2O== PH3↑ + 3NaH2PO21年前查看全部
- 歧化反应的化合价Cl2+H2O=HClO+HCl此反应中Cl2原本是0价反应后一个升为+1价,一个降为-1价歧化反应是[
歧化反应的化合价
Cl2+H2O=HClO+HCl
此反应中Cl2原本是0价
反应后一个升为+1价,一个降为-1价
歧化反应是[1]化学反应的一种,反应中某个元素的化合价既有上升又有下降.
歧化反应中一定要既有上升又有下降吗?或者只需要上升或下降就行 xx的鱼1年前1
xx的鱼1年前1 -
 kingder999 共回答了18个问题
kingder999 共回答了18个问题 |采纳率88.9%歧化反应中某个元素的化合价既有上升又有下降1年前查看全部
- 歧化反应氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,
歧化反应氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,
处于同一氧化态的元素上什么意思?
铁与氯化铁的反应是歧化反应吗?
如果不是是什么反应? shengjiong1年前5
shengjiong1年前5 -
 新新生 共回答了15个问题
新新生 共回答了15个问题 |采纳率80%歧化反应
在反应中,若氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原.这种自身的氧化还原反应称为歧化反应.
例如Cl2+H2O=HClO+HCl
此反应中Cl2原本是0价
反应后一个升为+1价,一个降为-1价
歧化反应是化学反应的一种,反应中某个元素的化合价既有上升又有下降.
例子
氯气与氢氧化钠溶液反应,生成氯化钠、氯酸钠和水.其离子方程式为:
3Cl2 + 6OH− = 5Cl− + ClO3− + 3H2O
氯气中氯的化合价为0.氯化钠中氯的化合价下降到-1;而氯酸钠中氯的化合价则上升到+5.所以,该反应是歧化反应.
你所说的 铁与三氯化铁是归中反应与歧化反应相反 (Fe + 2 FeCl3 = 3 FeCl2)
归中反应资料如下
归中反应就是指同种元素的不同化合物发生氧化还原反应,那种元素的化合价向中间靠拢.
歧化反应刚好与归中反应相反,一种元素的化合价向两边散开,
例如2Na2O2+2CO2====2Na2CO3+O2
此反应中,Na2O2中的O是-1价,他跟CO2反应后生成O为-2价的Na2CO3和O为0价的O2
不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而决不会出现高价态变低、低价态变高的交叉现象.——归中反应规律
价态归中是指,高价态的化合价降低,低价态的化合价升高,但不可能低的最后升的比原来高价态化合价还高.
归中现象:
1、氧化还原反应中的归中反应:
含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应.发生归中反应的条件是要符合中间价态理论:含有同一元素的不同价态的两种物质,只有当这种元素有中间价态时,才有可能发生归中反应.而且高低价态变化的结果是生成该元素的中间价态.归中反应的特点是氧化产物和还原产物是同一种物质.利用中间价态理论可以解释为什么二氧化硫可用浓硫酸干燥(因为不存在+5价的硫).
C+CO2=2CO
SO2+2H2S=3S↓+2H2O
H2SO3+2H2S=3S↓+3H2O
H2S+3H2SO4(浓)=4SO2+4H2O
2Fe3++Fe=3Fe2+
6HCl+KClO3=KCl+3Cl2↑+3H2O
5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
Ca(ClO)2+4HCl(浓)=2Cl2↑+CaCl2+2H2O
CuO+Cu=Cu2O
2Na+Na2O2 2Na2O
2.、复分解反应中的归中反应:
复分解反应的归中反应是指碱与多元酸反应,正盐与对应的酸式盐或酸反应,酸与对应的酸式盐反应,其中的氢原子数出现的归中现象,从而生成一种酸式盐的一类反应.其中反映的归中规律正是酸式盐的形成条件.
(1) 碱与多元酸反应:当多元酸过量时可形成酸式盐:
NaOH+H2S=NaHS+H2O;
H2SO4十NaOH=NaHSO4十H2O
(2) 多元酸与对应的正盐反应:
Na2S+H2S=2NaHS
CaCO3+H2O+CO2=Ca(HCO3)2
MgCO3+H2O+CO2=Mg(HCO3)2
Na2SO4+H2SO4=2NaHSO4
(NH4)2SO3+SO2+H2O=2NH4HSO3
Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2
(3) 多元酸与对应的酸式盐
Na2HPO4+H3PO4=2NaH2PO4
(4) 正盐与对应的酸式盐:
NaH2PO4+Na3PO4=2Na2HPO4
如果把正盐和碱中所含的可电离的氢离子看成是零,那么,生成酸式盐的归中条件是:两种反应物组成上要相差两个或两个以上可电离的氢离子.如果两种反应物的组成相差两个以上可电离的氢离子(即三元酸与对应正盐或与碱反应),则生成物与反应物用量有关,但符合“显强性”原理,即生成物的组成接近于过量物的组成.
如 (注:n表示物质的量)
≤1,其反应为:H3PO4+NaOH=NaH2PO4+H2O
在1—2之间,其反应为:2H3PO4+3NaOH=NaH2PO4+Na2HPO4+3H2O
=2,其反应为:H3PO4+2NaOH=Na2HPO2+2H2O
在2—3之间,其反应为:2H3PO4+5NaOH=Na2HPO4+Na3PO4+5H2O
≥3,其反应为:H3PO4+3NaOH=Na3PO4+3H2O
又如
≥2,其反应为:2H3PO4+Na3PO4=3NaH2PO4
=1,其反应为:H3PO4+Na3PO4=NaH2PO4+Na2HPO4
≤ ,其反应为:H3PO4+2Na3PO4=3Na2HPO4
3.、双水解反应中的归中反应:
这类归中反应是指能形成两性化合物的元素所形成的两类盐溶液反应形成氢氧化物的一类反应.这是金属阳离子和该金属所生成的阴离子生成中性的氢氧化物沉淀的归中现象.如:
Al3++3 +6H2O=4Al(OH)3↓
Zn2++ +2H2O=2Zn(OH)2↓
“高价+低价→中间价”解释:
例:2H2S+SO2===3S+2H2O
此反应中,H2S中的S是-2价,SO2中的S是+4价,它们两者发生氧化还原反应后,生成0价的S和水1年前查看全部
- 化学大神快来,在线等= ̄ω ̄= K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之
化学大神快来,在线等= ̄ω ̄= K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之
化学大神快来,在线等= ̄ω ̄=
K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为多少? 总之我就是不会电子得失守恒啊〒_〒赶脚好难,总把握不好,求大神讲解
 ma20051年前1
ma20051年前1 -
 纯洁滴花了眼 共回答了21个问题
纯洁滴花了眼 共回答了21个问题 |采纳率90.5%3K2MnO4 + 2H2SO4 = 2KMnO4 + MnO2 + 2K2SO4 + 2H2O
3MnO4^2- + 4H+ = 2MnO4^- + MnO2 + 2H2O
其实就是配平
=-=1年前查看全部
- 氧化还原反应中的歧化反应会分别得到比反应物氧化性更强及还原性更强的两种物质
氧化还原反应中的歧化反应会分别得到比反应物氧化性更强及还原性更强的两种物质
这是我自己想的说法,若没道理,举一个反例,
比如3NO2+H2O=2HNO3+NO
HNO3氧化性强于NO2,NO还原性强于NO2,可它不可逆啊 hhmybb1年前3
hhmybb1年前3 -
 最爱青椒 共回答了12个问题
最爱青椒 共回答了12个问题 |采纳率83.3%我个人觉得.你这样想是有道理的,
毕竟在高中阶段.同种元素价态高氧化性强,价态低还原性强,能发生歧化反映的必定是中间价态.所以既有氧化性,又有还原性.但是不要把归中反应和它看成是互逆的反应,因为发生氧化还原反应不只要有氧化剂和还原剂,还要有一定的条件.反应要结合物质本身的特性和化学反应规律,而氧化还原只是其中的一种.
所以你提到的问题绝大多数还是可以的,但是也有特例2Na2O2+2H20=4NaOH+O2这个也是歧化反应,价态是氧的升降,但是有钠的参与,就不能用你说的那样来判断了.
所以遇到还是具体问题具体分析比较好!
不过我对你的想法还是支持的!遇到问题能总结出规律来,也是一种能力的体现.1年前查看全部
- 氢化、氧化、水化、风化、碳化、钝化、催化、皂化、歧化、卤化、硝化、酯化、裂化、硬化
氢化、氧化、水化、风化、碳化、钝化、催化、皂化、歧化、卤化、硝化、酯化、裂化、硬化
哪位高手能把这14个“化”整合成一个容易记住的句子啊.
深表谢意. ggyuhuai1年前1
ggyuhuai1年前1 -
 edisonrei7 共回答了18个问题
edisonrei7 共回答了18个问题 |采纳率83.3%一句估计不行,我给你总结下吧.
氢化得氢.氧化得氧.水化得水,生成水合物或结晶水合物.风化失水,就跟干燥差不多,把水全部赶走.碳化后只剩下碳,比如浓硫酸碳化葡萄糖.钝化是指金属物质表面生成致密氧化膜,使其难以再和强酸或强碱反应.催化是指反应过程中,使得反应能够在更低能量下进行的过程.皂化是指脂肪酸生成脂肪酸盐的过程,生成表面活性剂,亲油亲水化合物,类似肥皂.歧化是指同一原子,同价态之间的氧化还原反应,比如两个亚铜离子,能生成一个铜离子和一个金属铜.卤化是指分子和卤族元素反应,使得分子带上F,Cl,Br,I.硝化是指和浓硝酸反应,使得分子带上硝基.酯化一般是指有机醇和有机酸反应,形成RCOOR酯类化合物的过程.裂化一般是指石油化工中,将长链烷烃高温裂化或裂解成不同的短链烷烃.硬化一般也是指失水过程.1年前查看全部
- 在碱性溶液中不能歧化的是 A ClO- B ClO2- C ClO3- D ClO4-
 audreylao1年前3
audreylao1年前3 -
 太空之吻 共回答了25个问题
太空之吻 共回答了25个问题 |采纳率84%D ClO4-
高氯酸根ClO4-中的氯是+7价的,是氯的最高化合价,不可能歧化了.1年前查看全部
- 只要求能说清归中反应 歧化反应方程式的配平如配平KClO3+HCl(浓)——KCl+Cl2+H2OS+KOH——K2S+
只要求能说清
归中反应 歧化反应方程式的配平
如配平KClO3+HCl(浓)——KCl+Cl2+H2O
S+KOH——K2S+K2SO3+H2O
MnO2+HCl——MnCl2+Cl2+H2O
一以上三个分别为例说一下 沉睡百年1年前6
沉睡百年1年前6 -
 小鱼要吃大鱼 共回答了21个问题
小鱼要吃大鱼 共回答了21个问题 |采纳率95.2%归中反应和歧化反应归根到底还是氧化还原反应,所以配平还是可以靠电子得失守恒,只是这两类反应元素化合价的变化相对较难判断,以下是我的配平一些心得,希望能帮到你.
1.归中反应:
以第一个反应为例
发生归中反应的反应物中化合价发生变化的元素必须存在两种及以上的化合价,如反应物中的Cl有+5(KClO3)和-1(HCl)两种化合价,而在生成物中该元素的化合价必须含有中间价,即既不高于反应物中的最高价,也不低于反应物中的最低价,如生成物中Cl含有0(Cl2)和-1(KCl)两种化合价,其中0价就是中间价.
氧化还原反应中化合价的变化是不能跳过中间价的,比如在此反应中+5价的Cl不能直接变成-1价,因为生成物中存在中间价0,所以在这个反应中,Cl2是由+5价的Cl被还原和-1价的Cl被氧化产生的,KCl中的氯离子则是由HCl提供的,化合价并无变化(-1).
明白了化合价如何变化配平就不难了,化合价变化分别为+5->0,-1->0,所以参加了氧化还原反应的KClO3:HCl=1:5,根据K守恒、电荷守恒,再根据H守恒,可配得方程式
KClO3+6HCl(浓)=KCl+3Cl2+3H2O
2.歧化反应
以第二个反应为例
与归中反应相反,歧化反应要求反应元素有中间价,比如此式中的0(S),而生成物则需要有高低价,如-2(K2S)和+4(K2SO3)
配平可以将方程式倒过来看,化合价变化分别为-2->0,+4->0,所以氧化还原反应生成的K2S:K2SO3=2:1,再根据K守恒和H守恒即可配出
3S+6KOH=2K2S+K2SO3+3H2O
以上可以看出,归中和歧化反应最大的特点就是氧化还原的元素有3个价
比如在第三个反应中
Mn在反应物和生成物中分别是+4和+2价,Cl则为-1和-1、0价,都只有2个价,所以第三个反应不是归中或歧化反应
反应中Mn:+4->+2,Cl:-1->0,所以MnO2:HCl=2:1,再根据Mn守恒、电荷守恒和H守恒可配出
MnO2+4Cl(浓)=MnCl2+Cl2+2H2O
总之注意先确定反应的元素,然后通过计算得失电子来确定氧化剂和还原剂的比例,最后再通过三大守恒配平.1年前查看全部
- 请问如何配平一个歧化反应方程式?
请问如何配平一个歧化反应方程式?
Ca(OH)2+Cl2----Ca(ClO)2+CaCl2
弱弱地问一句,多余的H+怎么配平啊?
 水榭楼台江南1年前1
水榭楼台江南1年前1 -
 水-方 共回答了20个问题
水-方 共回答了20个问题 |采纳率85%2Ca(OH)2+2Cl2----Ca(ClO)2+CaCl2+2H2O1年前查看全部
- (2014•虹口区一模)单质硫在KOH的热溶液中发生歧化反应:3S+6KOH△2K2S+K2SO3+3H2O;若硫过量,
(2014•虹口区一模)单质硫在KOH的热溶液中发生歧化反应:3S+6KOH
2K2S+K2SO3+3H2O;若硫过量,进一步生成K2Sx(x≤5)和K2S2O3.将0.08mol单质硫与含0.06mol KOH的热溶液充分反应恰好生成a mol K2Sx和b mol K2S2O3,再加入足量KClO、KOH的混合溶液,硫元素全部转化为K2SO4,转移电子n mol.则以下正确的是( )△
A.a=2b
B.x=2
C.n=0.48
D.b=0.02 佳喜1年前1
佳喜1年前1 -
 ee不锈 共回答了10个问题
ee不锈 共回答了10个问题 |采纳率90%解题思路:同一氧化还原反应中转移电子数相等,且反应前后各元素的原子个数相等,根据转移电子和原子守恒解答.A.将0.08mol单质硫与含0.06mol KOH的热溶液充分反应恰好生成a mol K2Sx和b mol K2S2O3,根据硫原子、钾原子守恒和转移电子守恒得
2a+2b=0.06
ax+2b=0.08
2a=2×b×(2−0),解得
x=3
a=0.02
b=0.01;
再加入足量KClO、KOH的混合溶液,硫元素全部转化为K2SO4,转移电子n mol,实际上转移电子总数为硫单质转化为硫酸根离子失去的电子数,
n=0.08mol×(6-0)=0.48mol,
故选AC.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查了氧化还原反应的计算,根据氧化还原反应中原子守恒、转移电子相等进行计算即可,注意硫代硫酸钠中其中一个硫原子的化合价为-2价,可以采用平均化合价的方法判断硫代硫酸钠中硫元素的化合价,硫元素的平均化合价为+2价,为易错点.1年前查看全部
- 有关归中反应和歧化反应我们老师说歧化反应被歧化的元素在反应后化合价一个升高,一个降低,我问他那么能不能一个升高(或降低)
有关归中反应和歧化反应
我们老师说歧化反应被歧化的元素在反应后化合价一个升高,一个降低,我问他那么能不能一个升高(或降低)而另一个不变呢?他说不能.他还说过归中反应和歧化反应是相反的,那么归中反应中某元素的化合价能不能一个归中而一个不变呢?
说个例子,MnO2+4HCl=====MnCl2+Cl2↑+2H2O中,氯元素发生歧化反应,一个降到0价,一个不变,按老师的话来说这不应该是歧化反应,但我看很多人都说过这是一个歧化反应,那么它到底是不是歧化反应呢? 隆高贯云霓1年前1
隆高贯云霓1年前1 -
 翠美 共回答了22个问题
翠美 共回答了22个问题 |采纳率81.8%气化是一部分化合价变高,一部分变低,不能不变的啊
像你这个,既不是岐化,也不是归中
归中可以说是岐化的逆过程,一个高的,一个低的,反应到中间价态1年前查看全部
- 二氧化氯 和碱反应的问题ClO2 和碱反应生成 ClO2- ClO3-,是一个歧化反应.若用过氧化钠或双氧水的碱溶液和它
二氧化氯 和碱反应的问题
ClO2 和碱反应生成 ClO2- ClO3-,是一个歧化反应.
若用过氧化钠或双氧水的碱溶液和它反应会得到较纯的ClO2-,这是因为ClO3-被还原了.
为什么ClO2-的氧化性更强,更不稳定,却不被进一步还原为一价氯呢? 在水的一方1年前1
在水的一方1年前1 -
 zizilo 共回答了18个问题
zizilo 共回答了18个问题 |采纳率88.9%温度条件不同,在高温下可以进一步还原1年前查看全部
- 钝化、歧化、油酯的硬化、卤化、硝化反应的定义分别是什么?
 tearsinthesky1年前1
tearsinthesky1年前1 -
 22259 共回答了24个问题
22259 共回答了24个问题 |采纳率95.8%1.钝化是在常温下,一些金属(Fe Al等)与浓硫酸或浓硝酸发生氧化还原反应,生成一层致密的氧化薄层阴碍了金属与浓酸的反应,此现象就是钝化.2.歧化歧化反应指在氧化还原反应中,反应物即充当还原剂也充当氧化剂.使右边...1年前查看全部
- 卤族元素为什么与碱发生歧化反应rt从0价有的变成正价有的变成负价,这些正价与负价的元素什么不会发生归中反应
 hd5631年前1
hd5631年前1 -
 chipi 共回答了19个问题
chipi 共回答了19个问题 |采纳率94.7%首先歧化反应是氧化还原反应,那么肯定存在化合价的升高和下降,很明显碱不会有化合价的升高和下降,卤族元素有多种价态,有正的负的和0,歧化就是一中物质化合价的升高和下降,卤族元素满足!
可以发生呀,但是你说的是卤族元素碱发生歧化反应,碱是金属阳离子或NH4-加OH形成,卤族元素在这是0价,发生氧化还原反应只有他化合价的升高和下降,金属阳离子或NH4-它们不会发生价态变化,卤族元素和碱发生歧化反应不可能金属阳离子化合价降低生成金属吧!1年前查看全部
- 同种元素价态变化 --类型?歧化,归中.什么东西?
同种元素价态变化 --类型?歧化,归中.什么东西?
题:下列变化中,同种素价态变化与反应.Cl2+2NaOH=NaCl+NaClO+H2O属于同一类型的是A ,3NO2+2H2O====2HNO3+NO
B,CaH2+2H2O2=Ca(OH)2+2H2↑
C,3S+6KOH=2K2S+K2SO3+3H2O,
D,.5NH4NO3==4N2↑+2HNO3+9H2O
详解--- chitty6131年前4
chitty6131年前4 -
 edimaya 共回答了20个问题
edimaya 共回答了20个问题 |采纳率95%C 解释:歧化 归中 反应都是 只一种元素 反应前后化合价即升高又降低
歧化反应比如反应前Cl是0价 歧化到 -1和+1价
归中 S和硫酸反应生成SO2 0价与+6价 归中到+4价1年前查看全部
- 为什么硫代硫酸根在酸性条件下不稳定 自身歧化
 lovebaobeitt1年前2
lovebaobeitt1年前2 -
 天然资源 共回答了18个问题
天然资源 共回答了18个问题 |采纳率88.9%因为硫代硫酸根是稳定的;然而硫代硫酸是一个弱酸,并且不稳定.
一旦酸化:S2O3 2- +2H+ ===H2S2O3
然后马上:H2S2O3===SO2↑+S↓+H2O
欢迎追问 在线回答1年前查看全部
- 硫和强碱反应是不是歧化反应,
 着说别是1年前1
着说别是1年前1 -
 shongjingh 共回答了28个问题
shongjingh 共回答了28个问题 |采纳率96.4%是的,3S+6KOH=2K2S+K2SO3+3H2O (加热)
S的化合价从0变为-2和+4 一升一降即为歧化.1年前查看全部
- Fe的歧化反应如何计算电动势?1L水,0.2mol Fe,0.2mol Fe3+,反应后Fe3+就没了,这种情况可以用能
Fe的歧化反应如何计算电动势?
1L水,0.2mol Fe,0.2mol Fe3+,反应后Fe3+就没了,这种情况可以用能斯特方程计算电动势吗?
E0(Fe2+/Fe)=-0.44V E0(Fe3+/Fe2+)=0.77V
请问具体如何计算呢?比如计算E(Fe3+/Fe2+)=0.77+0.06lg([Fe2+]/[Fe3+]) 可是[Fe2+]=0 lg(0)怎么算呢? CHAROW1年前2
CHAROW1年前2 -
 zdzzl77 共回答了18个问题
zdzzl77 共回答了18个问题 |采纳率88.9%Fe3+还有微量残余,
0.77+0.0591*lg([Fe3+]/[Fe2+])=-0.44+0.0591*lg[Fe2+]
[Fe2+]=0.3
可得E=-0.471V1年前查看全部
- 氧化还原反应方程式配平方法?如果是歧化反应,那又怎么配平?
 小夹豆子1年前1
小夹豆子1年前1 -
 滁州西涧 共回答了21个问题
滁州西涧 共回答了21个问题 |采纳率90.5%标电子转移1年前查看全部
- 求大神,氧化还原反应那一块,得失电子数,还有化合价什么的歧化归中怎么看啊
 小龙71年前3
小龙71年前3 -
 shuyingxian 共回答了18个问题
shuyingxian 共回答了18个问题 |采纳率88.9%先标出方程式中,各元素化合价.寻找方程式两边同一元素不同价态.你把它减一下,再乘上角标数就能算出得失电子数,注意电子是负的哦~1年前查看全部
- 化学反应中的歧化反应是究竟什么?
 football20081年前3
football20081年前3 -
 飞翔的RMB 共回答了21个问题
飞翔的RMB 共回答了21个问题 |采纳率95.2%自身的氧化还原反应称为歧化反应. 氯气与氢氧化钠溶液在常温下反应,生成氯化钠、次氯酸钠和水.其离子方程式为: Cl2 + 2OH? = Cl? + ClO? + H2O 氯气中氯元素的化合价为0.氯化钠中氯的化合价下降到-1价;而次氯酸钠中氯的化合价则上升到+1价. 而氯气和氢氧化钠溶液在高温下反应,生成氯酸钠、氯化钠和水. 这两个反应都是典型的歧化反应.1年前查看全部
- 说歧化反应只有在碱性条件下才能发生.请问原因是什么,为什么在酸性条件下反应就不能发生呢?
 lanyanfei1年前1
lanyanfei1年前1 -
 我行我素-孙 共回答了22个问题
我行我素-孙 共回答了22个问题 |采纳率86.4%酸性条件下会还原氢离子,所以不能进行1年前查看全部
- 除了有置换反应 化合反应 复分解反应 氧化还原反应 分解反应 归中反应 歧化反应 还有什么反应类型
除了有置换反应 化合反应 复分解反应 氧化还原反应 分解反应 归中反应 歧化反应 还有什么反应类型
可不可以给我解释一下:归中反应和歧化反应的区别,还有和氧化还原反应的区别. hahatu1年前3
hahatu1年前3 -
 蓝色风吟 共回答了23个问题
蓝色风吟 共回答了23个问题 |采纳率91.3%你说的那些反应并不是属于同一分类下的……
对于无机反应来说,其实就分为氧化还原反应和非氧化还原反应.
化合、分解、置换、复分解被称为“四大基本反应”,但是囊括的范围并不大,有许多的反应都不属于这四类.但是,置换一定是氧化还原反应,复分解一定是非氧化还原反应.化合和分解则有些是氧化还原反应,有些不是.举例:
SO3 + H2O = H2SO4(化合,非氧化还原)
4K + O2 = 2K2O(化合,氧化还原)
H2CO3 = H2O + CO2↑(分解,非氧化还原)
2H2O2 = 2H2O + O2↑(分解,氧化还原)
Fe + CuSO4 = FeSO4 + Cu(置换,氧化还原)
CH3COONa + HCl = CH3COOH + NaCl(复分解,非氧化还原)
注:一般情况下,除了同素异形体之间的转化(如O2和O3之间的转化),只要有单质参与反应(不管是作为反应物还是生成物),这个反应都是氧化还原反应!但是不是所有的氧化还原反应都必须有单质参与!
归中和歧化是两种特殊的氧化还原反应.归中和歧化有一个共同点,就是氧化剂、还原剂中,变价的元素是一样的.归中是指,氧化产物和还原产物中变价元素的化合价相同;歧化是指,氧化剂和还原剂中变价元素的化合价相同.
而且通常情况下,归中反应的氧化产物和还原产物是相同的,歧化反应的氧化剂和还原剂是相同的.
举例:
2K2S + K2SO3 + 3H2SO4 = 3S↓ + 3K2SO4(归中反应,氧化剂是K2SO3,还原剂是K2S,两者中变价元素都是S.氧化产物和还原产物都是S,价态相同)
3S + 6KOH = 2K2S + K2SO3 + 3H2O(歧化反应,氧化剂和还原剂都是S,变价元素相同,价态相同)1年前查看全部
- 归中和歧化 一定都是氧化还原反应么?
归中和歧化 一定都是氧化还原反应么?
有地方说 “复分解反应的归中反应是指碱与多元酸反应,正盐与对应的酸式盐或酸反应,酸与对应的酸式盐反应,其中的氢原子数出现的归中现象,从而生成一种酸式盐的一类反应.” 复分解不是氧化还原吧?…… 异样光彩1年前1
异样光彩1年前1 -
 bhlcmei 共回答了18个问题
bhlcmei 共回答了18个问题 |采纳率94.4%一定是的,因为归中和歧化都必发生化合价的升降所以一定是氧化还原反应1年前查看全部
- 碘单质在碱性条件下的歧化反应方程式
 angllove1年前1
angllove1年前1 -
 怀旧王子 共回答了7个问题
怀旧王子 共回答了7个问题 |采纳率100%生成碘酸钾和碘化钾,依据化合价变化进行配平,身边没有笔,不方便写出1年前查看全部
- 次氯酸根碱性条件下歧化是怎么反应的
 十一月的feng1年前3
十一月的feng1年前3 -
 hh贱客k20 共回答了18个问题
hh贱客k20 共回答了18个问题 |采纳率83.3%2ClO- (ClO2)- + H2O 阳极的氧化反应1年前查看全部
- 完全氧化还原、部分氧化还原、自身氧化还原、歧化这四种氧化还原反应有什么区别?
 hw8581年前1
hw8581年前1 -
 jsjzcyl 共回答了15个问题
jsjzcyl 共回答了15个问题 |采纳率93.3%完全氧化还原反应即参与反应的所有化学物质均有电子的得失,相对应的,部分氧化还原反应仅部分物质有电子的得失.简单的判定方法可为仅仅判断每个参与反应的物质是否都有化合价的变化,是即为完全氧化还原,反之即为部分氧化还原.
自身氧化还原反应指的就是某个化合物自己发生氧化还原反应.例如2KMnO4=加热=K2MnO4+MnO2+O2↑.
岐化反应,指的是某种相同化合价的元素在氧化还原反应中同时被氧化和还原.例如:2NaOH+Cl2=NaCl+NaClO+H2O.1年前查看全部
- 那些反应中那些元素会发生歧化,除了氮,氯,磷,还有什么,给点具体例子
 轩轩55号1年前3
轩轩55号1年前3 -
 huangk_fff 共回答了17个问题
huangk_fff 共回答了17个问题 |采纳率82.4%2Na2O2+2CO2====2Na2CO3+O2
此反应中,Na2O2中的O是-1价,他跟CO2反应后生成O为-2价的Na2CO3和O为0价的O2
还有Cl2+H2O=HClO+HCl
此反应中Cl2原本是0价
反应后一个升为+1价 一个降为-1价
3Cl2 + 6OH− → 5Cl− + ClO3− + 3H2O
氯气中氯的化合价为0.氯化钠中氯的化合价下降到-1;而氯酸钠中氯的化合价则上升到+5
要看能否发生岐化反应
就要看元素电视图
如果 右边的 E大于 左边的E
那么就可以岐化
如果你不懂的话~这么说吧
某元素中间氧化值的物种发生自身氧化还原反应,生成高氧化值物种和低氧化值物种,这样的反应叫做歧化反应.
相反,由同一元素的高氧化值物种和低氧化值物种生成中间氧化值物种的反应叫做反歧化反应.
这是定义 亚铜离子到铜离子的 E 小于 亚铜离子到单质铜的 所以
亚铜离子能够岐化为 铜离子和铜1年前查看全部
- 化学反应中的歧化反应是究竟什么?
 wjddm1年前3
wjddm1年前3 -
 7even1ne 共回答了13个问题
7even1ne 共回答了13个问题 |采纳率92.3%同一反应物的氧化还原反应、①同一反应物中、不同元素之间的氧化还原反应如kclo3分解②同一反应物中、同种元素不同价态之间的氧化还原反应、如硝酸氨分解③同一反应物中、同种元素同一价态之间的氧化还原反应、如氯气和氢氧化钠反应、 在这类反应中、某一元素的化合价一部分升高了、另一部分降低了这类氧化还原反应叫歧化反应1年前查看全部
- 可以帮忙归纳一下高中所有歧化、归中反应吗
可以帮忙归纳一下高中所有歧化、归中反应吗
感激不尽 穿心箭11111年前1
穿心箭11111年前1 -
 leeweizh 共回答了19个问题
leeweizh 共回答了19个问题 |采纳率89.5%归中反应就是指同种元素的不同化合物发生氧化还原反应,那种元素的化合价向中间靠拢.
歧化反应刚好与归中反应相反,一种元素的化合价向两边散开,
例如2Na2O2+2CO2====2Na2CO3+O2
此反应中,Na2O2中的O是-1价,他跟CO2反应后生成O为-2价的Na2CO3和O为0价的O2
不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而决不会出现高价态变低、低价态变高的交叉现象.——归中反应规律
价态归中是指,高价态的化合价降低,低价态的化合价升高,但不可能低的最后升的比原来高价态化合价还高.
归中现象:
1、氧化还原反应中的归中反应:
含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应.发生归中反应的条件是要符合中间价态理论:含有同一元素的不同价态的两种物质,只有当这种元素有中间价态时,才有可能发生归中反应.而且高低价态变化的结果是生成该元素的中间价态.归中反应的特点是氧化产物和还原产物是同一种物质.利用中间价态理论可以解释为什么二氧化硫可用浓硫酸干燥(因为不存在+5价的硫).
C+CO2=2CO
SO2+2H2S=3S↓+2H2O
H2SO3+2H2S=3S↓+3H2O
H2S+3H2SO4(浓)=4SO2+4H2O
2Fe3++Fe=3Fe2+
6HCl+KClO3=KCl+3Cl2↑+3H2O
5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
Ca(ClO)2+4HCl(浓)=2Cl2↑+CaCl2+2H2O
CuO+Cu=Cu2O
2Na+Na2O2 2Na2O
2.、复分解反应中的归中反应:
复分解反应的归中反应是指碱与多元酸反应,正盐与对应的酸式盐或酸反应,酸与对应的酸式盐反应,其中的氢原子数出现的归中现象,从而生成一种酸式盐的一类反应.其中反映的归中规律正是酸式盐的形成条件.
(1) 碱与多元酸反应:当多元酸过量时可形成酸式盐:
NaOH+H2S=NaHS+H2O;
H2SO4十NaOH=NaHSO4十H2O
(2) 多元酸与对应的正盐反应:
Na2S+H2S=2NaHS
CaCO3+H2O+CO2=Ca(HCO3)2
MgCO3+H2O+CO2=Mg(HCO3)2
Na2SO4+H2SO4=2NaHSO4
(NH4)2SO3+SO2+H2O=2NH4HSO3
Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2
(3) 多元酸与对应的酸式盐
Na2HPO4+H3PO4=2NaH2PO4
(4) 正盐与对应的酸式盐:
NaH2PO4+Na3PO4=2Na2HPO4
如果把正盐和碱中所含的可电离的氢离子看成是零,那么,生成酸式盐的归中条件是:两种反应物组成上要相差两个或两个以上可电离的氢离子.如果两种反应物的组成相差两个以上可电离的氢离子(即三元酸与对应正盐或与碱反应),则生成物与反应物用量有关,但符合“显强性”原理,即生成物的组成接近于过量物的组成.
如 (注:n表示物质的量)
≤1,其反应为:H3PO4+NaOH=NaH2PO4+H2O
在1—2之间,其反应为:2H3PO4+3NaOH=NaH2PO4+Na2HPO4+3H2O
=2,其反应为:H3PO4+2NaOH=Na2HPO2+2H2O
在2—3之间,其反应为:2H3PO4+5NaOH=Na2HPO4+Na3PO4+5H2O
≥3,其反应为:H3PO4+3NaOH=Na3PO4+3H2O
又如
≥2,其反应为:2H3PO4+Na3PO4=3NaH2PO4
=1,其反应为:H3PO4+Na3PO4=NaH2PO4+Na2HPO4
≤ ,其反应为:H3PO4+2Na3PO4=3Na2HPO4
3.、双水解反应中的归中反应:
这类归中反应是指能形成两性化合物的元素所形成的两类盐溶液反应形成氢氧化物的一类反应.这是金属阳离子和该金属所生成的阴离子生成中性的氢氧化物沉淀的归中现象.如:
Al3++3 +6H2O=4Al(OH)3↓
Zn2++ +2H2O=2Zn(OH)2↓
“高价+低价→中间价”解释:
例:2H2S+SO2===3S+2H2O
此反应中,H2S中的S是-2价,SO2中的S是+4价,它们两者发生氧化还原反应后,生成0价的S和水
编辑词条歧化反应
在反应中,若氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原.这种自身的氧化还原反应称为歧化反应.
例如2Na2O2+2CO2====2Na2CO3+O2
此反应中,Na2O2中的O是-1价,他跟CO2反应后生成O为-2价的Na2CO3和O为0价的O2
还有Cl2+H2O=HClO+HCl
此反应中Cl2原本是0价
反应后一个升为+1价,一个降为-1价
歧化反应是化学反应的一种,反应中某个元素的化合价既有上升又有下降.
例子
氯气与氢氧化钠溶液反应,生成氯化钠、氯酸钠和水.其离子方程式为:
3Cl2 + 6OH− = 5Cl− + ClO3− + 3H2O
氯气中氯的化合价为0.氯化钠中氯的化合价下降到-1;而氯酸钠中氯的化合价则上升到+5.所以,该反应是歧化反应.1年前查看全部
- 在酸性溶液中歧化为二价铜,说明在溶液中,二价铜离子的稳定性大于一价铜离子.怎么理解,什么是稳定性?
 白芸飘飘1年前2
白芸飘飘1年前2 -
 有爱的地方就是家 共回答了18个问题
有爱的地方就是家 共回答了18个问题 |采纳率88.9%2Cu+===Cu↓+Cu2+
在酸性环境中,一价铜离子会自动转化为二价铜离子,说明二价铜离子的稳定性大于一价铜离子
稳定性是在同一环境下对不同物质而言的,稳定性小的物质容易反应,稳定性大的物资不易反应
而且物资在同一环境下,反应总会向生成稳定性大的物质方向进行1年前查看全部
- 锰酸钾和浓盐酸及二氧化碳锰酸钾在PH≤13.5的时候自己身会发生歧化?所谓的通入二氧化碳是什么意思呢?如果我在锰酸钾中滴
锰酸钾和浓盐酸及二氧化碳
锰酸钾在PH≤13.5的时候自己身会发生歧化?所谓的通入二氧化碳是什么意思呢?
如果我在锰酸钾中滴价浓盐酸,锰会被还原至正二价,并生成氯气?
就是说如果我向高锰酸钾制氧气的剩余物中滴入浓盐酸,那么最终锰只剩+2价,电子全部从氯离子那得的 sscc1年前2
sscc1年前2 -
 心蔚蓝 共回答了24个问题
心蔚蓝 共回答了24个问题 |采纳率87.5%通入CO2,就是为了使溶液显酸性,而促进锰酸钾的自身歧化反应,
3MnO4^2- + 4H+ = 2MnO4^- + MnO2 + 2H2O
在锰酸钾中滴浓盐酸,锰会被还原至正二价,并生成氯气?
是的1年前查看全部
- 化学反应类型有那些我知道的分解,化合,复分解,置换,歧化
 selina8121年前7
selina8121年前7 -
 朝荷兰 共回答了19个问题
朝荷兰 共回答了19个问题 |采纳率84.2%络合,归中
有机里边还有,
取代反应,加成反应,酯化反应,皂化反应 ,磺化反应,消去反应 ,加聚反应,缩聚反应,成环反应等.常见的就这些.1年前查看全部
- 碱溶液有氧化性吗?譬如I2在水溶液中发生歧化,最高也就是+1价,为什么I2在冷碱溶液中却被氧化成了+5价?难道这不是氧化
碱溶液有氧化性吗?
譬如I2在水溶液中发生歧化,最高也就是+1价,为什么I2在冷碱溶液中却被氧化成了+5价?难道这不是氧化性吗?请详细作答.谢谢 CarlesPuyol1年前1
CarlesPuyol1年前1 -
 stellaYY 共回答了25个问题
stellaYY 共回答了25个问题 |采纳率96%可以将碱溶液看作是催化剂,促使生成+5价碘酸盐.注意,O和H都没有化合价的变化.
3I2+6NaOH=5NaI+NaIO3+3H2O1年前查看全部
- OH-跟CUCL作用生成的黄色沉淀变为橙色并迅速变为红色的CU2O,后者在酸性溶液中立即歧化为CU2+和CU
OH-跟CUCL作用生成的黄色沉淀变为橙色并迅速变为红色的CU2O,后者在酸性溶液中立即歧化为CU2+和CU
求过程中涉及的所有反应方程式和颜色变化的原因,即说明对应物质的颜色! fa85611年前1
fa85611年前1 -
 啊木1 共回答了20个问题
啊木1 共回答了20个问题 |采纳率85%很高兴为你解答这个问题:
铜的正一价离子与氢氧根结合生成橙色的氢氧化亚铜
但氢氧化亚铜因不稳定性导致其脱水产生红色氧化铜沉淀
具体方程式:
CUCL+OH-====CUOH+CL-
2CUOH====CU2O+H2O(脱水)
希望本回答能帮助到您1年前查看全部
- “酸中碱歧”,为何氧化亚铜与稀硫酸反应歧化?
 cc_hh1年前1
cc_hh1年前1 -
 迷途的饿狼 共回答了18个问题
迷途的饿狼 共回答了18个问题 |采纳率94.4%歧化反应和归中反应都是同种元素间的氧化还原反应,归中的大前提是体系里至少有某一元素的两种价态存在,歧化的大前提是体系中某一元素处于中间价态.这里的铜只有+1价,因为不稳定被酸溶解后发生歧化···
话说高中化学有各种奇怪口诀,都是有适用范围的,而且不能作为绝对判断依据,以字面意义去当作标准是错误的.(嘛,实际上那东西也没什么用处···)1年前查看全部
- 过氧化钠与二氧化碳用双线桥表示时,我觉得归中和歧化都可以,为什么大家都说是歧化
 fq专用小mj1年前1
fq专用小mj1年前1 -
 枫影2007 共回答了17个问题
枫影2007 共回答了17个问题 |采纳率94.1%2Na2O2+2CO2==2Na2CO3+O2,过氧化钠中的氧是负二价,而碳酸钠中的碳酸跟中的氧离子是负二价,氧气分子中的氧是零价,一个升高,一个降低当然是歧化反应了.归中反应是一高一低变成了中间的,而且遵守方程式从左向右的这个方向反应的.1年前查看全部
大家在问
- 1如图,边长为4的正方形纸片ABCD,E是边CD上的点,射线AE交BC的延长线于点G,在BC上取点F,以AF为折痕折叠,使
- 2用500粒种子做发芽试验,有10粒没有发芽,发芽率是______.
- 3P(x)与Q(x)分别是啥?高数
- 4人不总是幸运的英语怎么说no one can always be fortunately?我对英语已经绝望了 TUT
- 5aer the keys in the lost and found
- 6山不在高,有仙则名.水不在深,有龙则灵.斯是陋室,惟吾德馨………
- 7辩论题:民族技艺是否应该保密,反方二辩策略
- 8(2012•黄岩区)下面各个图形中,面积最大的是图( )
- 9Are they have anyhobbies?
- 10已知从1开始连续n个自然数相乘,1×2×3×……×n,乘积尾部恰有10个连续的0,n的最小值是多少?
- 11古代诗歌阅读(8分)雨过山村唐 · 王建雨里鸡鸣一两家,竹溪村路板桥斜。妇姑相唤浴蚕去,闲着庭中栀子花。小题1:这首诗中
- 12Where does he think he is?
- 13Beijing now offers some of the cheapest ski training classes
- 14求手写过程发照片
- 15请各位英语大神帮忙修改一下以下的英文文章,本人英文不好,有很多语病,先谢谢了。
