滴定反应时锥形瓶滴定管哪个用润洗,用什么溶液?
 Isly_yu2022-10-04 11:39:541条回答
Isly_yu2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 xiuwei03112 共回答了22个问题
xiuwei03112 共回答了22个问题 |采纳率81.8%- 滴定管要洗的.
你准备装什么溶液就用那种溶液先洗一遍.
锥形瓶不用润洗.但最好是应该用水冲一下.以防里面原有的残液把后加进去的溶液提前反应掉. - 1年前
相关推荐
- 滴定反应必须具备的条件是什么?滴定反应类型有哪几种?
 zzxueyao111年前2
zzxueyao111年前2 -
 Grand07 共回答了20个问题
Grand07 共回答了20个问题 |采纳率85%滴定反应具备条件:
定量进行,也就是第顶级和被滴定物质反应必须有明确的计量关系;
足够快的反应速率;
较好的选择性;
明显的终点显示.
类型:
酸碱滴定;氧化还原滴定;配位滴定;沉淀滴定.1年前查看全部
- 硝酸银与硫氰酸钾化学反应方程GB4639测盐分中滴定反应是什么,硝酸银与硫氰酸钾的反应式,
 chuchen1年前2
chuchen1年前2 -
 markdu 共回答了20个问题
markdu 共回答了20个问题 |采纳率80%AgNO3+KSCNAgSCN+KNO31年前查看全部
- 为什么滴定反应对化学反应程度要求比重量分析高?
 青春无语_hh1年前3
青春无语_hh1年前3 -
 jhkrdfewfn 共回答了20个问题
jhkrdfewfn 共回答了20个问题 |采纳率90%滴定反应一般都是完全反应,也就是有一种沉淀物的生成.或者有一种气体的生成.然后才能根据滴定的量来算出被反应的物是多少.是很精确的.重量分析主要是根据物质不灭.重量一定的道理.比如一种物体原重100克.干燥之后剩80克.那水份就是20克.不考虑化学反应.1年前查看全部
- 用NH4CNS标准滴定溶液回滴过量的测定样品中的含量时,应使用什么作指示剂;滴定反应
 亦水幽兰1年前1
亦水幽兰1年前1 -
 hdmtom 共回答了14个问题
hdmtom 共回答了14个问题 |采纳率85.7%楼主好!
楼主打错字了哦!是NH4SCN吧?
SCN-有一个非常重要的配合物:Fe(SCN)2+ ——有时候也写成Fe(SCN)3,这玩意是血红色的,所以在滴定时是经常用的!还有,楼主是想说测Ag+含量吧?是这样,Ag+会发生以下反应:Ag+ + SCN- == AgSCN↓,所以在滴Ag+时,先加入几滴铁铵矾,就是NH4Fe(SO4)2,作为指示剂,在滴定至终点时,就显出血红色.
PS:以上为佛尔哈德法,楼主所说的“回滴”想必是要用来测卤素离子吧?不过注意哦——在滴定Cl-时要加入硝基苯.
不晓得所说的对楼主有没有用——但愿有吧!1年前查看全部
- 酸碱中和滴定实验的问题比如要探究某碱的PH值 为什么不能是称取多少mL的碱然后用算跟它滴定反应看算消耗了多少mL 而是先
酸碱中和滴定实验的问题
比如要探究某碱的PH值 为什么不能是称取多少mL的碱然后用算跟它滴定反应看算消耗了多少mL 而是先测酸再用碱滴定呢 虽然不知道碱的浓度 但那样做也可以得到三个数据:v碱 v酸 c酸啊 代入等式不也可以计算出c碱吗? 武龙1年前1
武龙1年前1 -
 蓝色山脊 共回答了24个问题
蓝色山脊 共回答了24个问题 |采纳率100%检测碱的试剂是酚酞,碱使酚酞变红色,pH范围是8-10,而如果用酸则需要用紫色石蕊作指示剂,石蕊溶液遇碱变蓝,遇酸变红,变色范围是pH=5.0-8.0,且它的颜色变化不明显(红-蓝),所以选用酸滴定碱.1年前查看全部
- 滴定分析法对滴定反应有什么要求?
 怪姬1年前1
怪姬1年前1 -
 tianxing415 共回答了19个问题
tianxing415 共回答了19个问题 |采纳率89.5%1、反应要完全.被测物与标准液之间的反应须按一定的化学方程式进行,反应必须接近完全(一般为99.9%以上).定量计算的基础.
2、反应速度要快.反应须在瞬间完成,对于速度较慢的反应,有时可通过加热或加入催化剂的方式加快.
3、有简单可靠的方法能确定滴定终点.1年前查看全部
- 广东2008化学题,电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定 滴定反应的终点.右图是用KO
广东2008化学题,
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定 滴定反应的终点.右图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.下列示意图中,能正确表示用NH3•H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是:
为什么向醋酸继续加KOH,电导率会增加,而加NH3•H2O最后时会不变呢?

 crazyirene1年前2
crazyirene1年前2 -
 躲得过云 共回答了17个问题
躲得过云 共回答了17个问题 |采纳率94.1%题目的基本是,HCl强电解质,CH3COOH弱电解质,分别滴加KOH时,
HCl中生成KCl和水,离子数没有变化,但是溶液体积增大,所以离子总浓度减小,导电性先减小.然后KOH过量,离子数也会增加,所以离子总浓度会逐渐增大,导电性也增大.
CH3COOH原来离子很少,滴入KOH,即生成CH3COOK,强电解质,产生离子,即离子数增多,导电性增大.当KOH中和后过量,随着KOH加入,离子数还会增加,导电性增大.
问题中,是HCl与CH3COOH的混合溶液,滴入NH3.H2O,所以先与HCl反应,再与CH3COOH反应,会有三段变化.
1、HCl完全电离,加入NH3.H2O,生成NH4Cl,也是完全电离,所以离子数不变,但是溶液体积增大,所以离子总浓度会减小,导电性减小,所以BC错.
然后与CH3COOH反应,生成强电解质CH3COONH4,离子数增多,导电性增大.
最后,NH3.H2O过量,但是NH3.H2O是弱电解质,离子不多,所以离子数不再增大,当然导电性不可能再有明显增大,应该是几乎不变.
所以,是D1年前查看全部
- (2008•广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率的变化可以确定滴定反应的终点.如图所示是KO
 (2008•广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率的变化可以确定滴定反应的终点.如图所示是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线.下列示意图中,能正确表示用NH3•H2O滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
(2008•广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率的变化可以确定滴定反应的终点.如图所示是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线.下列示意图中,能正确表示用NH3•H2O滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
A.
B.
C.
D.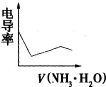
 人在行云里1年前1
人在行云里1年前1 -
 钟小洁 共回答了12个问题
钟小洁 共回答了12个问题 |采纳率83.3%解题思路:醋酸和一水合氨是弱电解质,在溶液里部分电离,氯化氢是强电解质,完全电离,向混合溶液中滴加氨水,氨水先和氯化氢反应生成强电解质氯化铵,氯化氢完全反应后,氨水再和醋酸反应生成强电解质醋酸铵,根据溶液中离子浓度变化与电导率的关系分析解答.氯化氢是强电解质,醋酸是弱电解质,滴加的弱电解质先和氯化氢反应生成强电解质氯化铵,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氯化氢完全被中和后,一水合氨继续电离与弱电解质醋酸反应生成强电解质醋酸铵,所以电导率增大;醋酸也完全反应后,继续滴加氨水,因为溶液被稀释,电导率有下降趋势,故选D.
点评:
本题考点: 电解质溶液的导电性;中和滴定.
考点点评: 本题考查了酸碱中和溶液电导率的变化,明确电导率与离子浓度的关系是解本题关键,根据电解质的强弱、离子浓度的变化来分析解答即可,难度中等.1年前查看全部
大家在问
- 1为什么20尺比40尺的集装箱限重更大
- 21物理填空..谢小船匀速前进时,水平方向上的一对平衡力是——在水平方向上存在的一对互相作用力是——
- 3古诗文中“游”名胜。下列诗句写的是哪处名胜呢?它属于哪个省?请分别填在横线上和括号内。
- 4已知4x^2+y^2-4x+4y+5=0,求x,y
- 5直棱柱,圆柱沿母线的侧面展开图是
- 6jenny lives in australia,but she
- 7一个图形画出后,再按1:2的比例图放大,应该是缩小,为什么是扩大?
- 8在算式中加上适当的运算符号和括号,使等式成立.用5个0.5等于2
- 9氯气与磷反应产生什么烟雾?
- 10钢琴的声音多么美妙啊!改成双重否定句
- 11英语作文七十词!
- 12《格列佛游记》他游历过的地名有车迟国吗,,?
- 13你喜欢什么动物呢?请运用事例写一段话,
- 14英译汉(高中)Studies serve for delight,for ornament,and for abilit
- 15数学单项式指出下列单项式的系数和次数: ①1/2πr²②-3x²y/5③5x³y④-3×1
