氯化亚铜是沉淀吗?
 zgg_1932022-10-04 11:39:541条回答
zgg_1932022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 水袖痕 共回答了18个问题
水袖痕 共回答了18个问题 |采纳率94.4%- 氯化亚铜是沉淀.
氯化亚铜是白色立方结晶或白色粉末.相对密度4.14.熔点430℃.沸点1490℃.微溶于水,水溶性:0.06 g/L (25℃),溶于浓盐酸和氨水生成络合物,不溶于乙醇. - 1年前
相关推荐
- 硫酸铜、亚硫酸钠、氯化钠制氯化亚铜的化学方程式
硫酸铜、亚硫酸钠、氯化钠制氯化亚铜的化学方程式
在水中进行,最好同时也写出离子方程式 zcn887f1年前2
zcn887f1年前2 -
 阳光柔弱 共回答了23个问题
阳光柔弱 共回答了23个问题 |采纳率78.3%2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4
2Cu(2+)+SO3(2-)+2Cl(-)+H2O=2CuCl↓+2H(+)+SO4(2-)1年前查看全部
- (2010•南京三模)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成
(2010•南京三模)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂.以粗盐水(含Ca2+、Mg2+、SO2-4等杂质).Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下:

(1)反应Ⅰ中加Na2CO3溶液的作用是______.
(2)反应Ⅱ在电解条件下进行,电解时阳极发生的电极反应可表示为______.
(3)写出反应Ⅵ的化学方程式______.
(4)反应Ⅳ加入的Cu必须过量,其目的是______.
(5)反应Ⅵ后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品.于70℃真空干燥的目的是______. cucucute1年前1
cucucute1年前1 -
 abc666888abc 共回答了20个问题
abc666888abc 共回答了20个问题 |采纳率85%解题思路:(1)碳酸根离子可以和钡离子以及钙离子之间发生反应生成碳酸钙以及碳酸钡沉淀;
(2)电解池的阳极发生失去电子的氧化反应;
(3)二氧化硫和硫酸铜之间可以发生氧化还原反应生成氯化亚铜沉淀;
(4)金属铜可以和铜离子在溶液中生成亚铜离子;
(5)乙醇和水易挥发,CuCl具有还原性,可以被空气氧化.(1)反应Ⅰ中加Na2CO3溶液可以粗盐溶液中的除去Ca2+和除去硫酸根离子所加的过量的Ba2+,故答案为:除去Ca2+和过量的Ba2+;
(2)对氯化钠溶液进行电解,在电解池的阳极上是氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(3)二氧化硫和硫酸铜之间可以发生氧化还原反应生成氯化亚铜沉淀,即2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+2NaHSO4+H2SO4或2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+Na2SO4+2H2SO4,故答案为:2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+2NaHSO4+H2SO4或2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+Na2SO4+2H2SO4;
(4)反应Ⅳ加入的Cu必须过量,金属铜可以和铜离子在溶液中生成亚铜离子,这样可以防止生成CuCl2,故答案为:防止生成CuCl2;
(5)CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,这样可以加快乙醇和水的蒸发,防止CuCl被空气氧化,故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;电解原理.
考点点评: 本题涉及物质的分离和提纯的方法以及操作、电解池的工作原理等方面的知识,注意知识的迁移和应用是解题的关键,难度不大.1年前查看全部
- 氯化亚铜与稀硫酸反应的化学方程式.
 qiuyby1年前5
qiuyby1年前5 -
 kong1208 共回答了9个问题
kong1208 共回答了9个问题 |采纳率88.9%稀硫酸发生歧化反应:
2 CuCl + H2SO4 = 2 HCl + CuSO4 + Cu(或2 CuCl = CuCl2 + Cu)
浓硫酸发生氧化还原反应:
2 CuCl + 2H2SO4 = CuCl2 + CuSO4 + SO2↑ + 2 H2O1年前查看全部
- 氯化亚铜(CuCl)是重要的化工原料.国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%.工
氯化亚铜(CuCl)是重要的化工原料.国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%.工业上常通过下列反应制备CuCl:2CuSO 4 +Na 2 SO 3 +2NaCl+Na 2 CO 3 ═2CuCl↓+3Na 2 SO 4 +CO 2 ↑
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO 4 溶液,试计算配制该溶液所需的CuSO 4 •5H 2 O与H 2 O的质量之比.
(2)准确称取所制备的0.2500gCuCl样品置于一定量的0.5mol•L -1 FeCl 3 溶液中,待样品完全溶解后,加水20mL,用0.1000mol•L -1 Ce(SO 4 ) 2 溶液滴定到终点,消耗24.60mLCe(SO 4 ) 2 溶液.有关反应的离子方程式为:Fe 3+ +CuCl═Fe 2+ +Cu 2+ +Cl - ,Ce 4+ +Fe 2+ ═Fe 3+ +Ce 3+ 通过计算说明上述样品中CuCl的质量分数是否符合标准. beibeixms1年前1
beibeixms1年前1 -
 潜水kk 共回答了13个问题
潜水kk 共回答了13个问题 |采纳率92.3%(1)设需要CuSO 4 •5H 2 O的质量为x,H 2 O的质量为y,则:
160
250 x
x+y =20.0%
即16x=5(x+y),所以 x:y=5:11
答:所需CuSO 4 •5H 2 O与H 2 O的质量之比为5:11.
(2)设样品中CuCl的质量为x,则:
由化学反应方程式可知:CuCl~~~Fe 2+ ~~~Ce 4+
11
n(CuCl)24.60×10 -3 L×0.1000mol/L
所以n(CuCl)=24.60×10 -3 L×0.1000mol/L=2.46×10 -3 mol.
所以该样品CuCl的质量为2.46×10 -3 mol×99.5g/mol=0.2448g.
0.2500g合格的CuCl中含有CuCl的质量0.2500g×96.5%=0.2413g,小于0.2448g,故该样品中CuCl的质量分数符合标准.
答:样品中CuCl的质量分数符合标准.1年前查看全部
- (2013•九江二模)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气
(2013•九江二模)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化.从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如图1所示

请回答下列问题:
(1)电镀污泥的主要成分是______(写化学式);
(2)酸浸时发生反应的离子方程式是______;
(3)析出CuCl晶体时的最佳pH在______左右;
(4)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:______;
(5)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装的目的是______. 泪蓝凝1年前1
泪蓝凝1年前1 -
 轻鸟 共回答了17个问题
轻鸟 共回答了17个问题 |采纳率76.5%解题思路:电镀废液中加入碱可生成Cu(OH)2、Fe(OH)3沉淀,在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,最后所得滤液为硫酸亚铁,结合CuCl的性质和题目要求解答该题.(1)电镀废液主要含Cu2+、Fe3+,加入碱可生成Cu(OH)2、Fe(OH)3沉淀,故答案为:Cu(OH)2、Fe(OH)3;
(2)在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,说明氢氧化铜被酸溶解,反应的离子方程式为Cu(OH)2+2H+=Cu2++2H2O,
故答案为:Cu(OH)2+2H+=Cu2++2H2O;
(3)由图2可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右,故答案为:3;
(4)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(5)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化.点评:
本题考点: 制备实验方案的设计;电解原理.
考点点评: 本题考查制备方案的设计,侧重于学生的分析能力和实验能力的考查,注意把握题给信息,答题时注意审题,把握自学能力的培养,难度中等.1年前查看全部
- (2014•永安市模拟)氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂.已知:
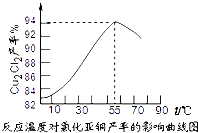 (2014•永安市模拟)氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂.已知:
(2014•永安市模拟)氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂.已知:
a.Cu2Cl2不溶于乙醇,在空气中会被迅速氧化;
b.在pH≥4时,Cu2+开始以碱式盐形式沉淀;
c.Cu2Cl2能溶于浓盐酸生成配合物,该配合物加水稀释后会重新析出Cu2Cl2沉淀.
(1)Cu2Cl2的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜[Cu2Cl2(CO)2•2H2O].该反应的化学方程式为______.
(2)工业上处理、回收含铜电缆废料制备氯化亚铜的方案如下:
①反应①符合绿色化学思想,则稀酸A为______,单质B为______.
②反应②的离子方程式是______.
为提高Cu2Cl2的产率,工业上常在反应②的溶液中加入适量稀碱溶液,控制pH为3.5左右,其目的是______.
③保持各反应物的最佳配比,改变温度,测得Cu2Cl2产率的变化如图所示,则反应最佳温度为______.
④析出的氯化亚铜晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装的目的是______. 侃天侃地1年前1
侃天侃地1年前1 -
 明明是你 共回答了13个问题
明明是你 共回答了13个问题 |采纳率100%解题思路:(1)根据题目信息书写化学方程式;
(2)①金属铜和稀硫酸不反应,但是在鼓入氧气的条件下会发生反应生成硫酸铜;
②根据化学平衡移动原理:减少生成物的浓度,化学平衡正向移动来分析;
③根据此温度下CuCl产率最大;
④根据立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装说明氯化亚铜在空气中会被氧化而变质;(1)由Cu2Cl2的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜[Cu2Cl2(CO)2•2H2O]可知,反应物有:Cu2Cl2、CO、H2O,生成物为[Cu2Cl2(CO)2•2H2O],则反应的化学方程式为:Cu2Cl2+2CO+2H2O═[Cu2Cl2(CO)2•2H2O]...
点评:
本题考点: 制备实验方案的设计;化学平衡建立的过程;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题主要考查了CuCl的制备,对制备过程中的有关知识进行了考查,氧化还原反应实质和规律的应用,培养了学生分析问题的能力和运用知识的能力.1年前查看全部
- 化合价表示氯化亚铜 氢氧化铜 硫化钠 氯化铵 硫化钾 氢氧化亚铁 锰酸钾 硫酸铁 硫酸钡紧急
 hengheng6251年前3
hengheng6251年前3 -
 fish-摆摆 共回答了21个问题
fish-摆摆 共回答了21个问题 |采纳率85.7%cucl2
cucl3
na2so4
nh4cl
k2s
fe(oh)2
k2mno4
fe2(so4)3
baso41年前查看全部
- 用氯化亚铜和氯化铜做CASS实验有区别吗?
用氯化亚铜和氯化铜做CASS实验有区别吗?
我是用来做铜加速醋酸盐雾实验,之前我们用氯化亚铜,但是国标要求是氯化铜,他们两个溶解到50G/L的NaCl溶液中有什么区别! happy_csu1年前1
happy_csu1年前1 -
 globular 共回答了19个问题
globular 共回答了19个问题 |采纳率73.7%氯化铜外层有空轨道 可以和Cl离子络和 氯化亚铜没法络和
这是区别
我对醋酸盐雾实验没什么了解 不知道这么答对你又没有帮助1年前查看全部
- 氯化亚铜和硼砂的反应观察到生成黄色沉淀是为什么?和你给出的方程式不符啊?
 y5y31年前1
y5y31年前1 -
 爱摸你的光头 共回答了24个问题
爱摸你的光头 共回答了24个问题 |采纳率87.5%12CuCl+ Na2B4O7+ 11H2O== 6Cu2O+ 4H3BO3+ 2NaCl+ 10HCl
氧化亚铜吧1年前查看全部
- 氯化亚铜(CuCl)是重要的化工原料.国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%.工
氯化亚铜(CuCl)是重要的化工原料.国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%.工业上常通过下列反应制备CuCl:2CuSO4+Na2SO3+2NaCl+Na2CO3═2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4•5H2O与H2O的质量之比.
(2)准确称取所制备的0.250 0g CuCl样品置于一定量的0.5 mol•L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol•L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液.有关反应的离子方程式为:Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+通过计算说明上述样品中CuCl的质量分数是否符合标准. abc257681年前1
abc257681年前1 -
 zainishenpang 共回答了6个问题
zainishenpang 共回答了6个问题 |采纳率100%解题思路:(1)设需要CuSO4•5H2O的质量为x,H2O的质量为y,根据化学式计算出硫酸铜的质量m(CuSO4),溶液质量为x+y
,利用质量分数列方程,计算x、y的比例关系.
(2)根据关系式计算n(CuCl),进而计算样品中m(CuCl),计算0.2500g合格的CuCl中含有CuCl的质量,进行比较判断.(1)设需要CuSO4•5H2O的质量为x,H2O的质量为y,则:
160
250x
x+y=20.0%
即16x=5(x+y),所以 x:y=5:11
答:所需CuSO4•5H2O与H2O的质量之比为5:11.
(2)设样品中CuCl的质量为x,则:
由化学反应方程式可知:CuCl~~~Fe2+~~~Ce4+
1 1
n(CuCl)24.60×10-3L×0.1000 mol/L
所以 n(CuCl)=24.60×10-3L×0.1000 mol/L=2.46×10-3mol.
所以该样品CuCl的质量为2.46×10-3mol×99.5g/mol=0.2448g.
0.2500g合格的CuCl中含有CuCl的质量0.2500g×96.5%=0.2413g,小于0.2448g,故该样品中CuCl的质量分数符合标准.
答:样品中CuCl的质量分数符合标准.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 考查物质的量浓度计算、滴定计算等,难度中等,注意在滴定计算中,由于涉及反应较多,通常利用关系式计算.1年前查看全部
- 能与氯化亚铜的氨溶液作用生成砖红色沉淀的是
能与氯化亚铜的氨溶液作用生成砖红色沉淀的是
A.1-丁炔 B.2-丁炔 C.1-丁烯 D.2-丁烯 tycs12261年前1
tycs12261年前1 -
 yingying_tsy 共回答了11个问题
yingying_tsy 共回答了11个问题 |采纳率81.8%A 只有端炔才有这条性质1年前查看全部
- 有哪位朋友做过桑德迈尔反应.能不能给我讲讲此反应的条件,也就是盐酸和氯化亚铜的用量.我现在想要用氯置换重氮基,那么我重氮
有哪位朋友做过桑德迈尔反应.能不能给我讲讲此反应的条件,也就是盐酸和氯化亚铜的用量.我现在想要用氯置换重氮基,那么我重氮盐做好以后加到酸和氯化亚铜的混合物中,肯定会使盐酸浓度降底,那么这对它有影响吗?
 kdablo1年前1
kdablo1年前1 -
 wiseking66 共回答了21个问题
wiseking66 共回答了21个问题 |采纳率81%没事儿.
盐酸过量,CuCl稍过量(10%)1年前查看全部
- 氯化亚铜的化学式应写为CuCl还是Cu2Cl2?
氯化亚铜的化学式应写为CuCl还是Cu2Cl2?
如果您知道原因,
好的话一定加分! jmilyjay1年前4
jmilyjay1年前4 -
 wzs8108 共回答了17个问题
wzs8108 共回答了17个问题 |采纳率94.1%无机里一定是CuCl,而在有机里,有时在一些权威文献中也会见到Cu2Cl2,这是习惯问题.
比如无机里是HAc,而在有机里是HOAc1年前查看全部
- (2011•如皋市模拟)氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂.以下是从含Cu2+、Fe
(2011•如皋市模拟)氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂.以下是从含Cu2+、Fe3+的电镀废液中制备氯化亚铜的工艺流程图.

如图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系.
试填空.
(1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:______.
(2)由反应①制备CuCl时的最佳pH在______左右.
(3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有______的特性.
(4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为:______.如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则化学方程式为:______. iambingyu1年前1
iambingyu1年前1 -
 Meng_Haiping 共回答了14个问题
Meng_Haiping 共回答了14个问题 |采纳率100%解题思路:(1)曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系,当pH=5时,三价铁离子已经全部沉淀,在电镀废液中再加入氢氧化钠溶液,三价铁离子和铜离子全部沉淀;
(2)根据平衡移动原理,减少生成物的浓度,化学平衡正向移动;结合图象中氯化亚铜的产率最大时的PH分析;
(3)在隔绝空气条件下进行反应①时CuCl产率较高,说明氯化亚铜易被空气中的氧气氧化;
(4)反应①中1mol铁粉完全反应转移2mol电子生成亚铁离子被铜离子氧化,生成氯化亚铜沉淀结合离子方程式书写方法写出;如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,说明亚硫酸钠被铜离子氧化为硫酸钠,本身被还原为氯化亚铜,结合化学方程式书写方法写出;(1)当pH=5时,三价铁离子已经全部沉淀,在电镀废液中再加入氢氧化钠溶液,铜离子全部沉淀;反应离子方程式为:Cu2++2OH-=Cu(OH)2↓,故答案为:Fe3++3OH-=Fe(OH)3↓;Cu2++2OH-=Cu(OH)2↓;
(2)因减少生成物的浓度,化学平衡正向移动,OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率.但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜沉淀(Cu2+能与OH-结合,生成氢氧化铜沉淀),从而降低了CuCl的产率,图象中分析由反应①制备CuCl时的最佳pH=3.5时CuCl的产率最大,故答案为:3.5;
(3)在隔绝空气条件下进行反应①时CuCl产率较高,说明氯化亚铜能被空气中的氧气氧化,故答案为:能被空气中的氧气氧化;
(4)反应①中1mol铁粉完全反应转移2mol电子生成亚铁离子被铜离子氧化,生成氯化亚铜沉淀结合离子方程式书写方法写出的离子方程式为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,说明亚硫酸钠被铜离子氧化为硫酸钠,本身被还原为氯化亚铜,结合化学方程式书写方法写出的化学方程式为:2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4;
故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4 ;点评:
本题考点: 铜金属及其重要化合物的主要性质;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题主要考查了CuCl的制备,对制备过程中的有关知识进行了考查,氧化还原反应实质和规律的应用,培养了学生分析问题的能力和运用知识的能力.1年前查看全部
- 氯化铜和亚硫酸钠反应?我觉得应该是生成硫酸钠和氯化亚铜~应该是
 心泉qxq1年前1
心泉qxq1年前1 -
 路上的貓 共回答了11个问题
路上的貓 共回答了11个问题 |采纳率90.9%你的想法很正确,这正是工业上大量生产CuCl的方法
2CuCl2 + Na2SO3 + H2O = CuCl↓ + Na2SO4 + 2HCl1年前查看全部
- 氯化亚铜(CuCl),白色结晶,微溶于水,不溶于硫酸、稀硝酸和醇,溶于氨水、浓盐酸,并生成配合物,它露置于空气中易被氧化
氯化亚铜(CuCl),白色结晶,微溶于水,不溶于硫酸、稀硝酸和醇,溶于氨水、浓盐酸,并生成配合物,它露置于空气中易被氧化为绿色的高价铜盐.氯化亚铜广泛应用于有机合成、染料、颜料、催化剂等工业.

实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为______,用95%乙醇代替蒸馏水洗涤的主要目的是______.
(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择______方案(填字母序号).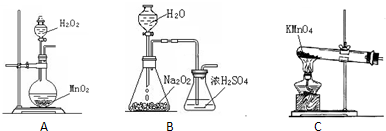
(3)实验开始时,温度计显示反应液温度低于室温,主要原因是______;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色;当______时停止通入氧气,打开瓶塞,沿______(填字母)口倾出棕色反应液于1 000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出.
(4)工业化生产时,95%乙醇可通过______方法循环利用,而______、______可直接循环利用. hanmeng8881年前1
hanmeng8881年前1 -
 一朵朵雲 共回答了25个问题
一朵朵雲 共回答了25个问题 |采纳率100%解题思路:(1)根据工艺流程可知,反应①过滤后,滤饼用酒精洗涤的CuCl,说明反应生成CuCl,还生成氯化铵;
CuCl微溶于水,用酒精洗去晶体表面的杂质离子及水分,避免CuCl溶于水而造成损耗;
(2)B装置可以根据锥形瓶内气泡的快慢判断产生O2的速率进行控制;
(3)氯化铵溶于水吸收大量热量,造成反应液温度降低;
烧瓶上方红棕色气体逐渐变为无色时停止通入氧气,打开瓶塞沿a或c倾出棕色反应液;
(4)洗涤后溶液含有乙醇,酒精沸点降低,可以采取蒸馏方法分离进行循环利用;反应生成氯化铵与硝酸可以直接利用.(1)根据工艺流程可知,反应①过滤后,滤饼用酒精洗涤的CuCl,说明反应生成CuCl,还生成氯化铵,反应方程式为:NH4[CuCl2]=CuCl↓+NH4Cl,
CuCl微溶于水,用酒精洗去晶体表面的杂质离子及水分,避免CuCl溶于水而造成损耗,
故答案为:NH4[CuCl2]=CuCl↓+NH4Cl;避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分;
(2)B装置可以根据锥形瓶内气泡的快慢判断产生O2的速率进行控制,A、C装置无法判断通入氧气的速率,故选选择B装置,
故答案为:B;
(3)氯化铵溶于水吸收大量热量,造成反应液温度降低;烧瓶上方红棕色气体逐渐变为无色时停止通入氧气,打开瓶塞沿a或c倾出棕色反应液,
故答案为:氯化铵溶于水吸收大量热量;烧瓶上方红棕色气体逐渐变为无色;a或c;
(4)洗涤后溶液含有乙醇,酒精沸点降低,可以采取蒸馏方法分离进行循环利用;反应生成氯化铵与硝酸可以直接利用,
故答案为:蒸馏;NH4Cl、HNO3.点评:
本题考点: 制备实验方案的设计;铜金属及其重要化合物的主要性质;常见气体制备原理及装置选择.
考点点评: 本题考查化学工艺流程、物质的分离提纯、对操作的理解、对装置的评价等,理解工艺流程原理是关键,有利于基础知识的巩固,侧重对学生综合能力的考查,难度中等.1年前查看全部
- 氧化亚铜与盐酸反应的么氧化亚铜和盐酸反应是生成氯化亚铜和水么?那么生成的是氯化亚铜溶液么?是的溶液是什么颜色的.生成的是
氧化亚铜与盐酸反应的么
氧化亚铜和盐酸反应是生成氯化亚铜和水么?那么生成的是氯化亚铜溶液么?是的溶液是什么颜色的.生成的是氯化亚铜沉淀的话,沉淀又是什么颜色的?
……无语了,既然反应,就应该是复分解反应啊,亚铜化合价+1,反应后不应该也是+1么。2楼的,我服了……反应物就氧,铜,氯氢元素竟然生成有硫元素 少TM清高1年前6
少TM清高1年前6 -
 不惜成本 共回答了20个问题
不惜成本 共回答了20个问题 |采纳率90%亚铜离子在酸性环境中极为不稳定,一旦生成立即歧化为铜离子和单质铜
因此氧化亚铜与盐酸反应,产物是氯化铜,铜,水.
失误了...是氯化铜1年前查看全部
- 氯化亚铜 在水溶液中 与二氧化锰反应
氯化亚铜 在水溶液中 与二氧化锰反应
a.二氧化锰作催化剂 氯化亚铜发生歧化反应,生成氯化铜和铜单质.
b.Cucl 和 MnO2反应 生成 Mncl2 和Cu(2+) 反应我配不平.
哪个反应正确 ,还是有其他的解释,
P.S.如果二氧化锰作催化剂,请给出二氧化锰的作用过程既与Cu(1+)的全部反应过程 你觉得覅1年前2
你觉得覅1年前2 -
 女儿瓷2008 共回答了14个问题
女儿瓷2008 共回答了14个问题 |采纳率85.7%a、二氧化锰不能作为氯化亚铜歧化的催化剂,只能做氧化剂;歧化反应不成立,因为氯化亚铜稳定得多.
b、酸性条件下才会发生氧化反应:2CuCl + MnO2 + 4H(+) = 2Cu(2+) + Mn(2+) + 2Cl(-) + 2H2O1年前查看全部
- (2010•南宁二模)氯化亚铜在氯的衍生物产品中占有较突出的位置,在有机合成工业中可作催化剂.以下是从含Cu2+、Fe3
(2010•南宁二模)氯化亚铜在氯的衍生物产品中占有较突出的位置,在有机合成工业中可作催化剂.以下是从含Cu2+、Fe3+的电镀废水中制备氯化亚铜的工艺流程图如图1所示.
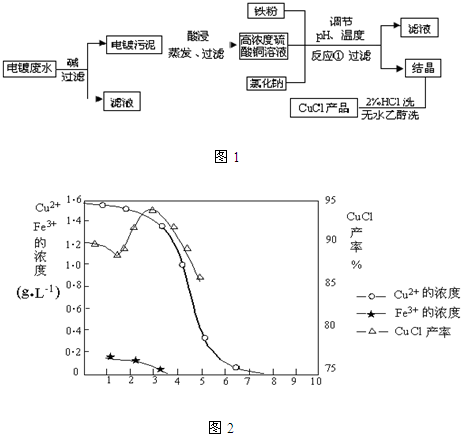
用滤液中Cu2+、Fe3+的含量对pH作图,可直观地反映出滤液中金属离子含量与pH之间的关系以及反应①系统pH与CuCl产率的关系(如图2).
请回答以下问题:
(1)含Cu2+、Fe3+的电镀废水加碱沉淀时,会有Fe(OH)3生成.当pH=5时,在电镀废水中再加入氢氧化钠溶液生成电镀污泥的主要成分为______.
(2)由反应①制备CuCl时的最佳pH在______左右.
(3)对CuCl产率探究时发现反应①在隔绝空气条件下进行时CuCl产率较高,由此推测CuCl具有______性.
(4)反应①中1mol铁粉完全反应转移2mol电子,写出其离子反应方程式为______.如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,请完成这一反应的化学方程式______. 江南美人1年前1
江南美人1年前1 -
 sndwg 共回答了16个问题
sndwg 共回答了16个问题 |采纳率87.5%解题思路:(1)曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系,当pH=5时,三价铁离子已经全部沉淀,在电镀废液中再加入氢氧化钠溶液,铜离子与氢氧根离子生成氢氧化铜沉淀;
(2)根据平衡移动原理,减少生成物的浓度,化学平衡正向移动;结合图象中氯化亚铜的产率最大时的PH分析;
(3)在隔绝空气条件下进行反应①时CuCl产率较高,说明氯化亚铜易被空气中的氧气氧化;
(4)反应①中1mol铁粉完全反应转移2mol电子生成亚铁离子被铜离子氧化,生成氯化亚铜沉淀结合离子方程式书写方法写出;如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,说明亚硫酸钠被铜离子氧化为硫酸钠,本身被还原为氯化亚铜,结合化学方程式书写方法写出;(1)当pH=5时,三价铁离子已经全部沉淀,在电镀废液中再加入氢氧化钠溶液,铜离子与氢氧化钠反应生成氢氧化铜沉淀,所以电镀污泥的主要成分为:Cu(OH)2,故答案为:Cu(OH)2;
(2)因减少生成物的浓度,化学平衡正向移动,OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率.但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜沉淀(Cu2+能与OH-结合,生成氢氧化铜沉淀),从而降低了CuCl的产率,图象中分析由反应①最佳pH=3.5时CuCl的产率最大,
故答案为:3.5;
(3)在隔绝空气条件下进行反应①时CuCl产率较高,说明氯化亚铜能被空气中的氧气氧化,
故答案为:能被空气中的氧气氧化;
(4)反应①中1mol铁粉完全反应转移2mol电子生成亚铁离子被铜离子氧化,生成氯化亚铜沉淀结合离子方程式书写方法写出的离子方程式为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,说明亚硫酸钠被铜离子氧化为硫酸钠,本身被还原为氯化亚铜,反应的化学方程式为:2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4;
故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4 ;点评:
本题考点: 金属的回收与环境、资源保护;铜金属及其重要化合物的主要性质.
考点点评: 本题主要考查了CuCl的制备,对制备过程中的有关知识进行了考查,氧化还原反应实质和规律的应用,培养了学生分析、理解问题的能力和灵活应用所学知识的能力.1年前查看全部
- (10分)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96
(10分)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上常通过下列反应制备CuCl :
2CuSO 4 + Na 2 SO 3 + 2 NaCl + Na 2 CO 3 =" 2" CuCl ↓+ 3 Na 2 SO 4 + CO 2 ↑
⑴ CuCl制备过程中需要配制质量分数为20.0% 的CuSO 4 溶液,试计算配制该溶液所需的CuSO 4 ·5H 2 O与H 2 O的质量之比。
O的质量之比。
⑵准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L -1 FeCl 3 溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L -1 Ce(SO 4 ) 2 溶液滴定到终点,消耗24.60mL Ce(SO 4 ) 2 溶液。有关反应的离子方程式为:
Fe 3+ +CuCl=Fe 2+ +Cu 2+ +Cl - ,Ce 4+ + Fe 2+ = Fe 3+ + Ce 3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。 vnbfcf1年前1
vnbfcf1年前1 -
 xia_guo 共回答了22个问题
xia_guo 共回答了22个问题 |采纳率86.4%(10分)(1)5:11(2)97.9%
略1年前查看全部
- 有机化学不饱和烃分子式C6H10的A和B,均能使溴的四氯化碳溶液褪色,并且经催化氢化得到相同的产物正己烷.A可与氯化亚铜
有机化学不饱和烃
分子式C6H10的A和B,均能使溴的四氯化碳溶液褪色,并且经催化氢化得到相同的产物正己烷.A可与氯化亚铜溶液作用产生红棕色沉淀,而B不发生这种反应.B经臭氧化后再还原水解,得到CH3CHO及乙二醛.推断A及B的可能结构,并用反应式加简要说明表示推断过程. 早恋早婚1年前1
早恋早婚1年前1 -
 chenshao2388 共回答了16个问题
chenshao2388 共回答了16个问题 |采纳率100%根据分子式可以看出A,B的不饱和度均为二,又因为 并且经催化氢化得到相同的产物正己烷 ,所以可以肯定都是直链烃,应该有两个双键,或者一个三键,“A可与氯化亚铜溶液作用产生红棕色沉淀”可以确定A是一端为三键的炔烃,所以A就是正己炔了CH3CH2CH2CH2CCH,“B经臭氧化后再还原水解,得到CH3CHO及乙二醛”,所以B肯定是CH3CH=CHCH=CHCH3,氧化使得双键断裂才可能会生成两种二个碳的CH3CHO及乙二醛1年前查看全部
- 氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质是微溶于水的白色固体,露置于空气中易
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质是微溶于水的白色固体,露置于空气中易被氧化为绿色的碱式氯化铜(Cu 2 (0H) 3 Cl),在热水中易水解生成氧化铜水合物而呈红色.以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程如图1. 
已知Ksp:CuCl:1.2×10 -4 CuOH:1.4×10 -15 Cu (OH) 2 :1.6×10 -10
请回答以下问题:
(1)写出反应①制备氯化亚铜的离子反应方程式:______.
(2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5.这样做的目的是______.
(3)图2是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图2可知,溶液温度控制在______时,CuCl产率能达到94%,随后随温度升高CuCl产率会下降,其原因是______.
(4)若要提高Cucl的产率你认为还可采取的措施有______.
(5)写出氯化亚铜在空气中被氧化的化学方程式______.
(6)反应①也可用铁代替亚硫酸钠,写出该反应的化学方程式______. 还是qcc4241年前1
还是qcc4241年前1 -
 seyhrdkjt 共回答了23个问题
seyhrdkjt 共回答了23个问题 |采纳率87%(1)由图示可知,反应物有:Cu 2+ 、SO 3 2- 、Cl - ,生成物有CuCl 2 、SO 4 - ,由于是氧化还原反应,化合价发生了变化,根据电子得失和质量守恒进行配平:2Cu 2+ +SO 3 2- +2Cl - +H 2 O=CuCl 2 ↓+SO 4 - +2H + ,故答案为:2Cu 2+ +SO 3 2- +2Cl - +H 2 O=CuCl 2 ↓+SO 4 - +2H + ;
(2)因减少生成物的浓度,化学平衡正向移动,OH - 中和了反应中的H + ,有利于平衡向右移动,提高CuCl的产率.但当OH - 浓度过大时,Cu + 能与OH - 结合,生成氢氧化亚铜沉淀(Cu 2+ 能与OH - 结合,生成氢氧化铜沉淀),从而降低了CuCl的产率,
故答案为:OH - 中和了反应中的H + ,有利于平衡向右移动,提高CuCl的产率.但当OH - 浓度过大时,Cu + 能与OH - 结合,生成氢氧化亚铜沉淀,从而降低了CuCl的产率;
(3)根据图象可知,因在60℃时CuCl产率最大,根据信息可知,随温度升高,促进了CuCl的水解,CuCl被氧化的速度加快,
故答案为:60℃温度过高,一是促进了CuCl的水解,二是促进了CuCl与空气中氧气发生反应;
(4)因温度升高,促进了CuCl与空气中氧气发生反应,所以反应①在隔绝空气条件下(还原气氛)进行可以提高CuCl的产率,故答案为:反应①在隔绝空气条件下进行;
(5)根据氧化产物结合氧化还原反应的电子守恒和原子守恒写出化学方程式并配平:4CuCl+O 2 +4H 2 O=2Cu 2 (OH) 3 Cl+2HCl,故答案为:4CuCl+O 2 +4H 2 O=2Cu 2 (OH) 3 Cl+2HCl;
(6)应①也可用铁代替亚硫酸钠,铁起的作用是做还原剂,把二价铜离子还原为氯化亚铜,本身被氧化为二价铁盐,书写化学方程式为2CuSO 4 +2NaCl+Fe=2CuCl↓+FeSO 4 +Na 2 SO 4 ,
故答案为:2CuSO 4 +2NaCl+Fe=2CuCl↓+FeSO 4 +Na 2 SO 4 .1年前查看全部
- (2009•江门一模)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质是微溶于水的白
(2009•江门一模)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质是微溶于水的白色固体,露置于空气中易被氧化为绿色的碱式氯化铜(Cu2(0H)3Cl),在热水中易水解生成氧化铜水合物而呈红色.以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程如图1.

已知Ksp:CuCl:1.2×10-4 CuOH:1.4×10-15 Cu (OH) 2:1.6×10-10
请回答以下问题:
(1)写出反应①制备氯化亚铜的离子反应方程式:______.
(2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5.这样做的目的是______.
(3)图2是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图2可知,溶液温度控制在______时,CuCl产率能达到94%,随后随温度升高CuCl产率会下降,其原因是______.
(4)若要提高Cucl的产率你认为还可采取的措施有______.
(5)写出氯化亚铜在空气中被氧化的化学方程式______.
(6)反应①也可用铁代替亚硫酸钠,写出该反应的化学方程式______. 酷狐1年前1
酷狐1年前1 -
 linxi76 共回答了26个问题
linxi76 共回答了26个问题 |采纳率92.3%解题思路:(1)根据题目信息及氧化还原反应的有关知识,书写配平离子方程式;
(2)根据平衡移动原理,减少生成物的浓度,化学平衡正向移动;
(3)根据此温度下CuCl产率最大;根据信息可知,考虑温度过高,促进了CuCl的水解,同时加快反应速率,CuCl易被氧化为绿色的高价铜盐;
(4)考虑隔绝空气条件下进行;
(5)根据氧化还原反应的化合价升降规律,结合给出的氧化产物,写出化学方程式;
(6)加入铁替代亚硫酸钠,所起的作用相同,做还原剂,把俄二价铜还原为一价铜,由于铜离子氧化性较弱,溶液中反应的铁被氧化为二价,根据原子守恒、电子守恒书写化学方程式.(1)由图示可知,反应物有:Cu2+、SO32-、Cl-,生成物有CuCl2、SO4-,由于是氧化还原反应,化合价发生了变化,根据电子得失和质量守恒进行配平:2Cu2++SO32-+2Cl-+H2O=CuCl2↓+SO4-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O=CuCl2↓+SO4-+2H+;
(2)因减少生成物的浓度,化学平衡正向移动,OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率.但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜沉淀(Cu2+能与OH-结合,生成氢氧化铜沉淀),从而降低了CuCl的产率,
故答案为:OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率.但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜沉淀,从而降低了CuCl的产率;
(3)根据图象可知,因在60℃时CuCl产率最大,根据信息可知,随温度升高,促进了CuCl的水解,CuCl被氧化的速度加快,
故答案为:60℃温度过高,一是促进了CuCl的水解,二是促进了CuCl与空气中氧气发生反应;
(4)因温度升高,促进了CuCl与空气中氧气发生反应,所以反应①在隔绝空气条件下(还原气氛)进行可以提高CuCl的产率,故答案为:反应①在隔绝空气条件下进行;
(5)根据氧化产物结合氧化还原反应的电子守恒和原子守恒写出化学方程式并配平:4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl,故答案为:4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl;
(6)应①也可用铁代替亚硫酸钠,铁起的作用是做还原剂,把二价铜离子还原为氯化亚铜,本身被氧化为二价铁盐,书写化学方程式为2CuSO4+2NaCl+Fe=2CuCl↓+FeSO4+Na2SO4,
故答案为:2CuSO4+2NaCl+Fe=2CuCl↓+FeSO4+Na2SO4.点评:
本题考点: 铜金属及其重要化合物的主要性质;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题主要考查了CuCl的制备,对制备过程中的有关知识进行了考查,氧化还原反应实质和规律的应用,培养了学生分析问题的能力和运用知识的能力.1年前查看全部
- 氯化亚铜(CuCl)是一种重要的化工产品,常用作催化剂,还可用于颜料、防腐等工业.其中铜元素的化合价是( )
氯化亚铜(CuCl)是一种重要的化工产品,常用作催化剂,还可用于颜料、防腐等工业.其中铜元素的化合价是( )
A.+1
B.+2
C.+3
D.+4 田尾竹1年前1
田尾竹1年前1 -
 xqm990221 共回答了17个问题
xqm990221 共回答了17个问题 |采纳率94.1%解题思路:根据氯化亚铜(CuCl)中,氯元素的化合价为-l,利用化学式及化合物中正负化合价的代数和为0来计算铜元素的化合价.因氯化亚铜(CuCl)中氯元素的化合价为-l价,设氯化亚铜(CuCl)中铜元素的化合价为x,根据化合物中正负化合价的代数和为0,则
x+(-1)=0
解得x=+1
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查利用已知元素的化合价和化学式来计算某元素的化合价,学生应学会利用信息中的关键信息,结合化合物中正负化合价的代数和为0,进行信息抽取使用.1年前查看全部
- 怎么化验水煤气中一氧化碳的含量现有一种方法是:氯化铜+氯化铵+氨水+纯铜丝=氯化亚铜.用氯化亚铜检测水煤气中的一氧化碳含
怎么化验水煤气中一氧化碳的含量
现有一种方法是:氯化铜+氯化铵+氨水+纯铜丝=氯化亚铜.用氯化亚铜检测水煤气中的一氧化碳含量,上面那个化学反应中纯铜丝需要一周才能用,太慢!是否有新的药水来代替纯铜丝.好的话可以再+100分!专家们!快来回答啊!急用! liubo198112151年前1
liubo198112151年前1 -
 鱿鱼86 共回答了22个问题
鱿鱼86 共回答了22个问题 |采纳率77.3%CuCl的制备通常是在浓盐酸环境下CuCl2与Cu的反应得到〔CuCl2〕-,然后加水使体系中Cl-浓度变小,〔CuCl2〕-被破坏从而获得CuCl.在以前的研究中发现乙醇可直接将AgNO3还原成Ag纳米带,进一步研究表明乙醇在适当环境下能够还原二价铜盐,或者PdCl2溶液,不过比较贵.1年前查看全部
- (2014•揭阳三模)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气
(2014•揭阳三模)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化.从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:

请回答下列问题:
(1)电镀污泥的主要成分是______(写化学式).
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:______.
(3)析出CuCl晶体时的最佳pH在______左右.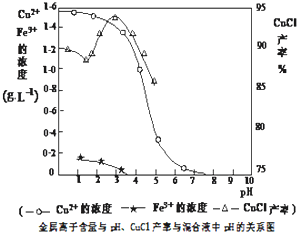
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装的目的是______.
(5)从滤液A中可回收的主要物质是______(写化学式).
(6)以碳棒为电极电解CuCl2溶液可得到CuCl.写出电解CuCl2溶液后的阴极上发生的反应为______. 雪与水的纠缠1年前1
雪与水的纠缠1年前1 -
 shenhao00412 共回答了18个问题
shenhao00412 共回答了18个问题 |采纳率94.4%解题思路:电镀废液中加入碱可生成Cu(OH)2、Fe(OH)3沉淀,在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,最后所得滤液为硫酸亚铁,结合CuCl的性质和题目要求解答该题.(1)电镀废液主要含Cu2+、Fe3+,加入碱可生成Cu(OH)2、Fe(OH)3沉淀,
故答案为:Cu(OH)2、Fe(OH)3;
(2)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,
故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(3)由图2可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右,
故答案为:3;
(4)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化.
(5)由框图分析可知:滤液A中主要物质是Na2SO4和FeSO4,
故答案为:Na2SO4和FeSO4;
(6)电解CuCl2溶液时,阴极上发生的反应为Cu2+得到电子生成+1价铜,
故答案为:Cu2++Cl-+e-═CuCl↓点评:
本题考点: 金属的回收与环境、资源保护;电解原理;铜金属及其重要化合物的主要性质.
考点点评: 本题考查制备方案的设计,侧重于学生的分析能力和实验能力的考查,注意把握题给信息,答题时注意审题,把握自学能力的培养,难度中等.1年前查看全部
- 氯化亚铜可由铜离子和碘离子反应制得,反应方程式答案为什么是2Cu2+5I-=2CuI(沉淀)+I3-,不是2Cu2+ +
氯化亚铜可由铜离子和碘离子反应制得,反应方程式答案为什么是2Cu2+5I-=2CuI(沉淀)+I3-,不是2Cu2+ + 4I- == 2CuI↓ + I2,I3-是什么东西
相同质量的金属与足量酸反应产生氢气的量之比等于其金属失去1摩尔电子时质量的倒数比中的金属失去1mol电子时的质量是什么意思?是失去的金属的质量还是剩下的金属的质量?
一定量的铝分别和一定量的盐酸和氢氧化钠反应,若酸产生氢气的体积比碱产生氢气的体积比介于1/3~1,则必是酸不足碱过量,为什么?
为什么铁离子的还原性强于铜离子?
铜绿的生成是铜先和氧气反应还是先和水,或者二氧化碳?
碳酸氢钠能和什么气体反应,除了二氧化硫,氯化氢之外的?
浓硝酸中二氧化氮为什么不和水反应?浓硝酸显黄色是因为溶有二氧化氮,HNO3==NO2+H2O+O2 那么二氧化氮为什么不和水反应呢,不是有那个反应方程式吗?NO2+H2O==HNO3+NO
注意了,我说的是三价的铁离子的还原性为什么强于铜离子?不是亚铁离子,希望大家可以帮我,最好能让我加你们,因为我的问题实在是太多了,可我都快高考了... nicelwh1年前4
nicelwh1年前4 -
 little-s 共回答了21个问题
little-s 共回答了21个问题 |采纳率100%题目很多,现在我时间不够,如果不急,等晚上回答1年前查看全部
- 氯化亚铜和硝酸银反应方程式
 寒冰之枫1年前5
寒冰之枫1年前5 -
 lizyly 共回答了19个问题
lizyly 共回答了19个问题 |采纳率84.2%CuCl+AgNo3=AgCl↓+CuNo31年前查看全部
- 氯化亚铜加硫代硫酸钠溶解,放置后溶液出现乳白色浑浊,为什么?
 wdv20031年前3
wdv20031年前3 -
 zjhlsy 共回答了16个问题
zjhlsy 共回答了16个问题 |采纳率93.8%CuCl + 2S2O3 2- = [Cu(S2O3)2]3- + Cl-;
[Cu(S2O3)2]3-离子长时间放置会缓慢分解,沉淀成份可能包括Cu2S2O3、Cu2S、S等.以下是一些可能发生的反应:
2[Cu(S2O3)2]3- = Cu2S2O3↓ + 3(S2O3)2-
Cu2S2O3 + H2O = Cu2S + H2SO4
(S2O3)2- = S↓ + (SO3)2-
(S2O3)2- + H2O = H2S↑ + (SO4)2-;1年前查看全部
- 氯化亚铜和浓氨水反应的化学方程式
 靴格拉斯1年前2
靴格拉斯1年前2 -
 fanlijing913 共回答了17个问题
fanlijing913 共回答了17个问题 |采纳率70.6%氯化亚铜能与氨形成络合物,因此能溶解在浓氨水中,得到无色溶液.
CuCl + 2NH3•H2O = 2H2O + [Cu(NH3)2]Cl1年前查看全部
- 氯化亚铜用大量水稀释后生成什么沉淀
 sadfkuhawkgeg1年前1
sadfkuhawkgeg1年前1 -
 inter200411 共回答了22个问题
inter200411 共回答了22个问题 |采纳率95.5%氢氧化铜沉淀.1年前查看全部
- 氯化亚铜与浓氨水反应的化学方程式
 乐与路1年前2
乐与路1年前2 -
 earthlingling 共回答了21个问题
earthlingling 共回答了21个问题 |采纳率90.5%生成4氨合铜络合物离子和氯离子1年前查看全部
- 氯化铁、氯气、次氯酸、氯化亚铜氧化性由强至弱
 不会游泳的鱼深圳1年前4
不会游泳的鱼深圳1年前4 -
 sunhongru1983 共回答了16个问题
sunhongru1983 共回答了16个问题 |采纳率81.3%氯气、次氯酸、氯化铁、氯化亚铜
氯气能跟水反应生成次氯酸
证明氯气的氧化性比次氯酸强
铁离子>铜离子>亚铁离子1年前查看全部
- 为什么氯化亚铜不溶于水?希望 说的详细点,而不只是 说氯化亚铜是沉淀...
 又爱zz整一天1年前2
又爱zz整一天1年前2 -
 changgedu 共回答了23个问题
changgedu 共回答了23个问题 |采纳率82.6%氯化亚铜中氯离子与铜离子相互极化,化学键接近于共价键,在水中溶解度很小.1年前查看全部
- 氯化亚铜溶于什么
 在刀尖上飞舞1年前3
在刀尖上飞舞1年前3 -
 nbabbqkk 共回答了18个问题
nbabbqkk 共回答了18个问题 |采纳率94.4%微溶于水,溶于浓盐酸和氨水生成络合物.在热水中迅速水解,生成氧化铜水合物而呈红色,与强酸缓慢反应.1年前查看全部
- 氯化亚铜加氨水生成什么络合物?
 yshj30271年前1
yshj30271年前1 -
 啊迁 共回答了12个问题
啊迁 共回答了12个问题 |采纳率100%[Cu(NH3)2]Cl 不稳定 空气中易被O2氧化为[Cu(NH3)4]2+1年前查看全部
- 邻氨基苯甲酸用亚硝酸钠,盐酸如何进行重氮化?然后接着再用氯化亚铜,盐酸置换而制得邻氯苯甲酸
 dongye50221年前1
dongye50221年前1 -
 shoe_gal 共回答了19个问题
shoe_gal 共回答了19个问题 |采纳率94.7%结构式不会打.我写中文
(苯甲酸——NH2)+2HCl+NaNO2======(苯甲酸——N2Cl)+NaCl+2H2O1年前查看全部
- 氯化亚铜与浓盐酸生成配合物H2CUCI3方程式
 简JIAN单DAN1年前1
简JIAN单DAN1年前1 -
 余颖婕 共回答了16个问题
余颖婕 共回答了16个问题 |采纳率93.8%CuCl+2HCl(浓)=H2CuCl31年前查看全部
- 氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂.以下是从含Cu 2+ 、Fe 3+ 的电镀废液中
氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂.以下是从含Cu 2+ 、Fe 3+ 的电镀废液中制备氯化亚铜的工艺流程图. 
如图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系.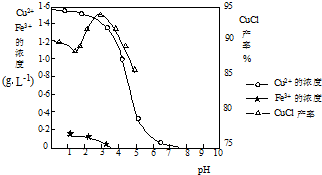
试填空.
(1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:______.
(2)由反应①制备CuCl时的最佳pH在______左右.
(3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有______的特性.
(4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为:______.如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则化学方程式为:______. mybmwx51年前1
mybmwx51年前1 -
 blackpeter 共回答了26个问题
blackpeter 共回答了26个问题 |采纳率96.2%(1)当pH=5时,三价铁离子已经全部沉淀,在电镀废液中再加入氢氧化钠溶液,铜离子全部沉淀;反应离子方程式为:Cu 2+ +2OH - =Cu(OH) 2 ↓,故答案为:Fe 3+ +3OH - =Fe(OH) 3 ↓;Cu 2+ +2OH - =Cu(OH) 2 ↓;
(2)因减少生成物的浓度,化学平衡正向移动,OH - 中和了反应中的H + ,有利于平衡向右移动,提高CuCl的产率.但当OH - 浓度过大时,Cu + 能与OH - 结合,生成氢氧化亚铜沉淀(Cu 2+ 能与OH - 结合,生成氢氧化铜沉淀),从而降低了CuCl的产率,图象中分析由反应①制备CuCl时的最佳pH=3.5时CuCl的产率最大,故答案为:3.5;
(3)在隔绝空气条件下进行反应①时CuCl产率较高,说明氯化亚铜能被空气中的氧气氧化,故答案为:能被空气中的氧气氧化;
(4)反应①中1mol铁粉完全反应转移2mol电子生成亚铁离子被铜离子氧化,生成氯化亚铜沉淀结合离子方程式书写方法写出的离子方程式为:2Cu 2+ +2Cl - +Fe=2CuCl↓+Fe 2+ ;如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,说明亚硫酸钠被铜离子氧化为硫酸钠,本身被还原为氯化亚铜,结合化学方程式书写方法写出的化学方程式为:2CuSO 4 +Na 2 SO 3 +2NaCl+H 2 O=2CuCl↓+2Na 2 SO 4 +H 2 SO 4 ;
故答案为:2Cu 2+ +2Cl - +Fe=2CuCl↓+Fe 2+ ;2CuSO 4 +Na 2 SO 3 +2NaCl+H 2 O=2CuCl↓+2Na 2 SO 4 +H 2 SO 4 ;1年前查看全部
- 分子式为c6h10的A及B,均能合溴的四氯化碳溶液褪色,并且经过催化氢化得到相同的产物正己烷.A可与氯化亚铜的氨溶液作用
分子式为c6h10的A及B,均能合溴的四氯化碳溶液褪色,并且经过催化氢化得到相同的产物正己烷.A可与氯化亚铜的氨溶液作用产生红棕色沉淀,而B不发生这种反应.B经臭氧化后再还原水解,得到ch3cho及乙二醛.推断A及B的结构.
 江湖愚人1年前2
江湖愚人1年前2 -
 oolfy 共回答了18个问题
oolfy 共回答了18个问题 |采纳率88.9%首先,分子式C6H10满足CnH2n-2的通式,且能使Br2的CCl4溶液褪色,故该物质可能是二烯烃、单炔烃或环烯;又,由于A、B与H2加成后都得到正己烷,因此排除环状结构,只可能是二烯烃或单炔烃,且为直链结构;
再看,A能与氯化亚铜的氨溶液反应生成炔化亚铜红棕色沉淀,则A中必含有炔氢,即含有-C≡CH结构;再结合前面的推论,因此A只能是1-己炔,即CH3-CH2-CH2-CH2-C≡CH
又,B经臭氧化和还原水解后生成醛基,因此B中一定含有碳碳双键,是二烯烃;又,反应机理为C=C变为2个C=O,因为产物中有乙醛,乙醛只有一端有醛基,因此原双键一定是CH3-CH=的结构;又因为还有乙二醛,因此含有=CH-CH=的结构.综合一下,B就是2,4-己二烯,即CH3-CH=CH-CH=CH-CH31年前查看全部
- 在制备氯化亚铜时,能否用氯化铜和铜屑在用盐酸酸化呈微弱的酸性条件下反应?
 -单行线-1年前2
-单行线-1年前2 -
 04随风飘摇 共回答了17个问题
04随风飘摇 共回答了17个问题 |采纳率82.4%不知道你的弱酸性弱到什么程度.这个反应其实对酸度并不敏感,酸性强一些弱一些都没什么影响,关键是要高浓度的氯离子.我们做无机化学实验都是用氯化铜+氯化钠+铜屑反应制备的,没有问题,其中氯化钠就是提供氯离子用的.
当然酸性不能太弱,弱到一定程度铜离子会水解,反应就很难进行了.铜离子的水解pH值在4左右,所以体系pH应该在3以下.1年前查看全部
- 氯化铜和氨气的反应方程式?不是氯化亚铜.我觉得不对头啊,元素都不守恒!
 kui1231年前1
kui1231年前1 -
 小雨飘过 共回答了18个问题
小雨飘过 共回答了18个问题 |采纳率83.3%氯化铜与氨气反应?
应该是在溶液中反应吧.溶液中反应有两种情况:
一种是少量氨水:CuCl2+2NH3.H2O=2NH4Cl+Cu(OH)2↓,则有蓝色沉淀生成
一种是氨水过量,则生成的沉淀会与氨水进一步生成络合物[Cu(NH3)4]Cl2,沉淀又会消失,方程式为:CuCl2+ + 4NH3.H2O == [Cu(NH3)4]Cl2+ 4H2O 分反应为:第一步:CuCl2+2NH3.H2O=2NH4Cl+Cu(OH)2↓ 第二步:Cu(OH)2 + 4NH3==[Cu(NH3)4]2+ + 2OH-1年前查看全部
- 请问氯化亚铜的化学式是什么,百度百科上说是CuCl,但在教辅书上写的却是Cu2Cl2,这两个中到底哪个是对的吖
 100chuwen1年前4
100chuwen1年前4 -
 linjack1024 共回答了9个问题
linjack1024 共回答了9个问题 |采纳率100%无机里一定是CuCl,而在有机里,有时在一些权威文献中也会见到Cu2Cl2,这是习惯问题.
比如无机里是HAc,而在有机里是HOAc .其实都一样的.1年前查看全部
- 氯化钙氯化锌氯化钡氯化铝氯化钾氯化银氯化铁氯化亚铁氯化铜氯化亚铜硫酸钠硫酸铜硫酸锌硫酸镁硫酸钡硫酸钙硫酸铝硫酸铁硫酸亚铁
氯化钙
氯化锌
氯化钡
氯化铝
氯化钾
氯化银
氯化铁
氯化亚铁
氯化铜
氯化亚铜
硫酸钠
硫酸铜
硫酸锌
硫酸镁
硫酸钡
硫酸钙
硫酸铝
硫酸铁
硫酸亚铁
硫酸铵
硫酸钾
碳酸钙
碳酸钾
碳酸钠
碳酸银
碳酸钡
碳酸镁
碳酸锌
碳酸铵
硝酸钾
硝酸钠
硝酸银
硝酸钙
硝酸镁
硝酸钡
硝酸锌
硝酸铜
硝酸铁
硝酸亚铁
硝酸铵
硝酸汞 海岸之珠1年前2
海岸之珠1年前2 -
 charmcao 共回答了20个问题
charmcao 共回答了20个问题 |采纳率100%氯化钙CaCl2
氯化锌ZnCl2
氯化钡BaCL2
氯化铝AlCl3
氯化钾KCl
氯化银AgCl
氯化铁FeCl3
氯化亚铁FeCl2
氯化铜CuCl2
氯化亚铜CuCl
硫酸钠Na2SO4
硫酸铜CuSO4
硫酸锌ZnSO4
硫酸镁MgSO4
硫酸钡BaSO4
硫酸钙CaSO4
硫酸铝Al2(SO4)3
硫酸铁Fe2(SO4)3
硫酸亚铁FeSO4
硫酸铵(NH4)2SO4
硫酸钾K2SO4
碳酸钙CaCO3
碳酸钾K2CO3
碳酸钠Na2CO3
碳酸银Ag2CO3
碳酸钡BaCO3
碳酸镁MgCO3
碳酸锌ZnCO3
碳酸铵(NH4)2CO3
硝酸钾KNO3
硝酸钠NaNO3
硝酸银AgNO3
硝酸钙Ca(NO3)2
硝酸镁Mg(NO3)2
硝酸钡Ba(NO3)2
硝酸锌Zn(NO3)2
硝酸铜Cu(NO3)2
硝酸铁Fe(NO3)3
硝酸亚铁Fe(NO3)2
硝酸铵NH4NO3
硝酸汞Hg(NO3)21年前查看全部
- 为什么把铝(Al)放进氯化亚铜(Cu2Cl),氯化亚铜变了颜色?
为什么把铝(Al)放进氯化亚铜(Cu2Cl),氯化亚铜变了颜色?
本来Cu2Cl溶解是蓝色的,可是把铝放进去变了颜色,不是蓝色了,这是为什么? lw1541年前4
lw1541年前4 -
 wazzh 共回答了18个问题
wazzh 共回答了18个问题 |采纳率100%如果是氯化亚铜,分子式应该是(CuCl),Cu是+1价.铝(Al)放进氯化亚铜(CuCl),发生了氧化还原反应,3CuCl+Al=3Cu+AlCl31年前查看全部
- 能与氯化亚铜碱性氨溶液作用生成棕红色沉淀的有哪些?
 221053951年前1
221053951年前1 -
 爱吃猪肉的老鼠 共回答了12个问题
爱吃猪肉的老鼠 共回答了12个问题 |采纳率91.7%是炔键位于一段的有机物,也就是R-C三CH,可以和亚铜氨反应生成棕红色的炔化亚铜沉淀(R-C三C-Cu↓).1年前查看全部
- 某不饱和烃A,分子式为C9H8;A能和氯化亚铜氨溶液反应产生红色沉淀.化合物A催化加
某不饱和烃A,分子式为C9H8;A能和氯化亚铜氨溶液反应产生红色沉淀.化合物A催化加
某不饱和烃A,分子式为C9H8;A能和氯化亚铜氨溶液反应产生红色沉淀.化合物A催化加氢后得到B(C9H12),将化合物B用酸性重铬酸钾氧化得到酸性化合物C(C8H6O4);若将化合物A与1,3-丁二烯作用则得到另一个不饱和化合物D;将化合物D催化脱氢得到2-甲基联苯.据以上写出化合物A,B,C,D的结构式,并写出相关反应. 小傻瓜dq1年前1
小傻瓜dq1年前1 -
 反面 共回答了21个问题
反面 共回答了21个问题 |采纳率85.7%先计算A的不饱和度:9+1-8/2=6.所以分子中肯能含有苯环(不饱和度为4),其他可能含有2个烯键或一个炔键.A能和氯化亚铜氨溶液反应产生红色沉淀,说明是端基炔.化合物A催化加氢后得到B(C9H12),说明A中确实很有苯环.将化合物B用酸性重铬酸钾氧化得到酸性化合物C(C8H6O4),说明A是甲基苯乙炔;再根据D催化脱氢得到2-甲基联苯,可以确定A是2-甲基苯乙炔.B是1-乙基-2-甲基苯.C是2-甲基苯甲酸.1年前查看全部
- 如何制取氯化亚铜方法尽可能多些!
 阴郁之心1年前1
阴郁之心1年前1 -
 孤帆750 共回答了21个问题
孤帆750 共回答了21个问题 |采纳率90.5%1)用铜,氯化铜溶液加热即可.
Cu+CuCl2=2CuCl(加热)
2)氯化铜993℃分解成氯化亚铜(CuCl).
3)由铜和氯化合
4)由碳酸铜和盐酸作用而制得1年前查看全部
大家在问
- 1Martin can answer all the questions.对Martin提问
- 2食用油在什么液体里面溶解
- 3高中学的全部忘掉了!题目的大概意思是,曲线y=sin(x)+3和y=4在第一象限所围城的范围绕着y=4旋转的体积是多少,
- 4Why do you like Mary?Because she is ___ honest girl.A.a B.an
- 5在发生超重和失重现象时,物体受力不平衡么
- 6Like you're nothing,you're perfect to me.
- 7Which ___of Nanjing did you live in last year?
- 8在568后面补上三个数字,组成一个六位数,使它能分别被3、4、5整除,并且要求这个数值尽可能小.这个六位数是______
- 9函数f(x)=ax^2-2ax+b+2(a不等于0)在【2,3】上有最大值5和最小值2,求a,b的值
- 10简述伽利略,牛顿,爱因斯坦对自然科学的贡献
- 11两个连续偶数的和除以他们的差,商是9,两个偶数是多少.
- 1278×9.9+7.8简算,急.
- 13be called与be named意思是否相同
- 14童年时光 作文
- 15Ping Pong is popular among China ,____ both young and old ca
