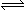化工产品中甲醛含量的测试四羟甲基硫酸磷样品中的甲醛含量怎么测试?
 dickcoboy2022-10-04 11:39:541条回答
dickcoboy2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 pkfmtv43 共回答了14个问题
pkfmtv43 共回答了14个问题 |采纳率85.7%- 甲醛含量高吗?可以称取6克样品于250ml锥形瓶中加3滴百里香酚酞,用1mol/l的氢氧化钠调蓝,1mol/l硫酸调无色,再加6.3克无水亚硫酸钠,50ml水,用1mol/l硫酸滴定至蓝色消失.X=C*V*3.003/m 结果是百分含量.
- 1年前
相关推荐
- 海洋是个巨大的资源宝库,利用海水可制取许多化工产品.
海洋是个巨大的资源宝库,利用海水可制取许多化工产品.
(1)用海水提取氯化钠,常先通过蒸发除水得到粗盐,再除去泥沙可得到精盐,精盐中仍含有少量的CaCl 2 、Na 2 SO 4 杂质.除去精盐中的上述杂质,可先加入过量______溶液,再加入过量的______溶液,然后再经过滤,滤掉的沉淀中含有______、滴加适量的______、蒸发,即可得到纯净的氯化钠.
(2)从海水中提取溴常用吹出法,即用氯气(C1 2 )将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br 2 ).流程示意图如下:
①写出氯气从NaBr中置换出溴单质的化学方程式:______;该反应在pH=3的酸性条件下进行,可用______测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br 2 +SO 2 +2H 2 O=H 2 SO 4 +2HBr).根据流程图分析,通入SO 2 和水的目的是______. 天堂向左dd向右1年前1
天堂向左dd向右1年前1 -
 xiaodiaoyuhou 共回答了12个问题
xiaodiaoyuhou 共回答了12个问题 |采纳率83.3%(1)海水晒盐的原理是通过蒸发海水制得粗盐,由于BaCl 2 可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,以及碳酸钠可以和CaCl 2 反应生成氯化钠和碳酸钙,碳酸钠还与过量的氯化钡反应生成碳酸钡和氯化钠;过滤除去不溶于水的杂质,再滴加稀盐酸除掉过量的碳酸钠再进行蒸发结晶即可,最后得到氯化钠;
(2)依据题干叙述可知氯气和溴化钠可以置换出溴单质,反应物是氯气和溴化钠,生成物是氯化钠和溴,根据观察法配平即可,其化学方程式为:Cl 2 +2NaBr=2NaCl+Br 2 ,常见的测定溶液酸碱度的方法是使用pH试纸测定溶液的酸碱度,由于吸收塔中发生的反应是Br 2 +S0 2 +2H 2 0═H 2 S0 4 +2HBr所以加入二氧化硫的目的是使溴与空气相互分离;
故答案为:(1)BaCl 2 ; Na 2 CO 3 ; BaSO 4 、BaCO 3 和CaCO 3 ;盐酸;(2)①Cl 2 +2NaBr=2NaCl+Br 2 ;pH试纸;②使Br 2 转化为HBr使溴与空气相互分离.1年前查看全部
- (2013•广东)银铜合金广泛用于航空工业.从切割废料中回收银并制备铜化工产品的工艺如下:
(2013•广东)银铜合金广泛用于航空工业.从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为______;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为______.
(2)固体混合物B的组成为______;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为______.
(3)完成煅烧过程中一个反应的化学方程式:______CuO+______Al2O3
______CuAlO2+______↑高温 .
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为______mol CuAlO2,至少需要1.0mol•L-1的Al2(SO4)3溶液______L.
(5)CuSO4溶液也可用于制备胆矾,其基本操作是______、过滤、洗涤和干燥. 相宜本草sh1年前1
相宜本草sh1年前1 -
 主演你 共回答了22个问题
主演你 共回答了22个问题 |采纳率90.9%解题思路:(1)根据电解原理分析判断;无色的NO在常温下与空气中的O2迅速化合生成红棕色N02;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,根据Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃判断产物;根据氢氧化铝显两性能与碱反应;
(3)根据化合价升降总数相等以及原子守恒来配平;
(4)根据铜元素守恒建立关系式:Cu~CuAlO2来计算;根据铝元素守恒建立关系式:Al2(SO4)3~2CuAlO2来计算;
(5)根据可溶性溶质从溶液中析出晶体的方法;(1)电镀法精炼银时,粗银为阳极,精银为阴极,阳极上失电子变成离子进入溶液了:Ag-e-=Ag+,阴极银离子得到电子形成单质银:Ag++e-=Ag;无色的NO在常温下与空气中的O2迅速化合生成红棕色N02:2NO+O2=2NO2;
故答案为:Ag++e-=Ag;2NO+O2=2NO2;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃,煮沸后Cu(OH)2分解产生氧化铜,可知B为Al(OH)3和CuO;氢氧化铝显两性能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3和CuO;Al(OH)3+OH-=AlO2-+2H2O;
(3)反应前Cu为+2价,反应后为+1,化合价降低1,Al化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,故答案为:4;2;4;O2;
(4)由关系式:Cu~CuAlO2得n(CuAlO2)=[5000g×63.5%/64g/mol]=50.0mol,则CuAlO2为50.0mol,
由关系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×[1/2]=25.0mol,所以需要体积为
25.0mol
1.0mol•L −1=25.0L,
故答案为:50.0;25.0;
(5)由CuSO4溶液获得CuSO4•5H2O晶体,需要经过蒸发浓缩,冷却结晶(或结晶),过滤等操作,故答案为:蒸发浓缩、冷却结晶.点评:
本题考点: 金属的回收与环境、资源保护;铜金属及其重要化合物的主要性质.
考点点评: 本题以从废料中回收银并制备铜化工产品为背景,考查了电解原理、沉淀的判断、氧化还原反应的配平以及化学计算,难度不大.1年前查看全部
- 淀粉属于化工产品吗
 jacgsey1年前4
jacgsey1年前4 -
 emil_005 共回答了20个问题
emil_005 共回答了20个问题 |采纳率90%化工产品分为以下几类
化学矿
无机化工原料
有机化工原料
化学肥料
农药
高分子聚合物
涂料及无机颜料
染料及有机颜料
信息用化学品
化学试剂
食品和饲料添加剂
合成药品
日用化学品
胶粘剂
橡胶制品
淀粉是有机化工原料1年前查看全部
- 本人做化工产品,有二氯甲烷和一些盐类物质,用离心机甩虑,聚丙烯滤袋总是甩会就变小,请问是什么原因?
本人做化工产品,有二氯甲烷和一些盐类物质,用离心机甩虑,聚丙烯滤袋总是甩会就变小,请问是什么原因?
应该如何避免? hzfay1年前3
hzfay1年前3 -
 biedaiti 共回答了16个问题
biedaiti 共回答了16个问题 |采纳率93.8%二氯甲烷溶缩!换用尼龙、棉纤维制作的.1年前查看全部
- 某化工厂二月份比一月份生产化工产品1.2吨,三月份比二月份增产25分之4,第一季度生
某化工厂二月份比一月份生产化工产品1.2吨,三月份比二月份增产25分之4,第一季度生
产的化工产品恰好占全年计划产量的35%,已知一月份生产化工产品是12又5分之1吨,全年计划的生产量是多少吨?(得数保留整数)(列式计算) p208632631年前1
p208632631年前1 -
 liran007 共回答了18个问题
liran007 共回答了18个问题 |采纳率88.9%一月份:12.2吨
二月份:12.2+1.2=13.4吨
三月份:13.4*(1+4/25)=15.544吨
第一季度:12.2+13.4+15.544=41.144吨
全年:41.144/0.35=117吨1年前查看全部
- 甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
①CH 3 OH(g) CH 2 O(g)+H 2 (g) ΔH 1 ="+84.2" kJ·mol -1
CH 2 O(g)+H 2 (g) ΔH 1 ="+84.2" kJ·mol -1
向反应体系中通入氧气,通过反应②2H 2 (g)+O 2 (g) 2H 2 O(g) ΔH 2 ="-483.6" kJ·mol -1 提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
2H 2 O(g) ΔH 2 ="-483.6" kJ·mol -1 提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )A.5.74∶1 B.11.48∶1 C.1∶1 D.2∶1  zhan__1年前1
zhan__1年前1 -
 sunnyjesse2001 共回答了17个问题
sunnyjesse2001 共回答了17个问题 |采纳率100%1年前查看全部
- “绿色化学”是指 [ ] A.颜色为绿色的化工产品
“绿色化学”是指 [ ]A.颜色为绿色的化工产品
B.绝对不含任何化学物质的无害产品
C.只能使用,不能再生产的化学产品
D.采用无毒无害的原料、生产出有利环保的产品 知道1231年前1
知道1231年前1 -
 七然星浪 共回答了23个问题
七然星浪 共回答了23个问题 |采纳率91.3%D1年前查看全部
- (2012•淄博一模)化工产品纯碱中含有NaCl,某研究性学习小组为了测定纯碱的纯度(即纯碱中Na2CO3的质量分数),
(2012•淄博一模)化工产品纯碱中含有NaCl,某研究性学习小组为了测定纯碱的纯度(即纯碱中Na2CO3的质量分数),称取含NaCl的纯碱固体11.4g,将其配成溶液,再向其中逐滴加入适量的7.3%的稀盐酸,恰好完全反应,使气体全部放出,共收集到4.4g CO2气体.计算纯碱的纯度?(结果保留一位小数)
 ss眼1年前1
ss眼1年前1 -
 jxz168 共回答了18个问题
jxz168 共回答了18个问题 |采纳率77.8%解题思路:根据碳酸钠与盐酸反应的方程式,由生成的二氧化碳的质量,可求出碳酸钠的质量,再计算出纯碱的纯度.设纯碱样品中碳酸钠的质量为X
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 4.4g
[106/44=
X
4.4g] 解得:X=10.6g
纯碱的纯度是:
10.6g
11.4g×100%=93.0%
答:纯碱的纯度是93.0%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据化学方程式可以表示反应中各物质的质量比,由反应中任意物质的质量可计算出反应中其它物质的质量.1年前查看全部
- 氨是一种重要的化工产品,其化学式为______,具有______气味,密度比空气的______(填“大”或“小”),__
氨是一种重要的化工产品,其化学式为______,具有______气味,密度比空气的______(填“大”或“小”),______(填“易”或“难”)溶于水,因此,收集氨气应采用______法.  32112231年前1
32112231年前1 -
 天堂书房 共回答了15个问题
天堂书房 共回答了15个问题 |采纳率93.3%氨气化学式为;NH 3 ,有刺激性气味,密度比空气的小,极易溶于水,收集氨气应用向下排空气法,故答案为:NH 3 ;刺激性;小;易;向下排空气.1年前查看全部
- (13分)、近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚氯乙烯(PVC
(13分)、近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成路线。

请回答下列问题:
(1)A的结构中含有三键,写出A的结构式 ,
写出B和PVC的结构简式
(2)写出反应类型 反应① 反应② 。
(3)反应③中C、D两种单体按…CDCDCD…方式加聚,D的结构为CH 2 =CHOOCCH 3 ,写出C的结构简式 。
(4)写出D与氢氧化钠溶液共热时发生的化学反应方程式 。 ngvgv1年前1
ngvgv1年前1 -
 誓去的诺言 共回答了13个问题
誓去的诺言 共回答了13个问题 |采纳率76.9%1年前查看全部
- 化工产品物质名词急需翻译啊 翻译成汉语或者是英语
化工产品物质名词急需翻译啊 翻译成汉语或者是英语
甲氧基环丙烷
2,3-二甲基丁烷
四甲基戊烷
戊烷
甲基环戊烷
3-甲基己烷
己烷
苯
甲苯
氯辛烷
辛烷
乙苯
二甲苯
壬烯
壬烷
1,2,4-三甲基苯
1-羟基-4,4-二甲基环己胺
癸烷
二甲基十一烷 走走倒抽了1年前3
走走倒抽了1年前3 -
 潮飞 共回答了30个问题
潮飞 共回答了30个问题 |采纳率86.7%甲氧基环丙烷 methylcyclopropane
2,3-二甲基丁烷 2,3 dime methyl butane
四甲基戊烷 tetramethylpentane
戊烷 pentane
甲基环戊烷 methylcyclopentane
3-甲基己烷 3 - methyl hexane
己烷 hexane
苯 benzene
甲苯 toluene
氯辛烷 chlorooctane
辛烷 octane
乙苯 ethylbenzene
二甲苯 dimethylbenzene
壬烯 nonylene
壬烷 nonane
1,2,4-三甲基苯 1,2,4-trimethylbenzene
癸烷 decane
二甲基十一烷 dimethylundecane1年前查看全部
- 海洋是个巨大的资源宝库,利用海水可制取许多化工产品。
海洋是个巨大的资源宝库,利用海水可制取许多化工产品。
(1)氯碱工业是以电解食盐水为基础化学工业,写出电解食盐水的化学方程式___________________________________________________________________.
(2)从海水中提取溴常用吹出法,即用氯气(Cl 2 )将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br 2 )。流程示意图如下:
①写出氯气从NaBr中置换出溴单质的化学方程式:____________________;该反应在pH=3的酸性条件下进行,可用________测定反应液的酸碱度。
②吹出的溴和大量空气混合在—起进入吸收塔,根据流程图分析,通入SO 2 和水的目的是。_____________________________________________________.(用化学方程式表示) yezhiye1年前1
yezhiye1年前1 -
 精灵琥珀 共回答了16个问题
精灵琥珀 共回答了16个问题 |采纳率93.8%1年前查看全部
- (2小12•江宁区二模)硫化钠是重要的化工产品.工业上采用无水芒硝(N42SO4)-炭粉还原法生产硫化钠(N42S),其
(2小12•江宁区二模)硫化钠是重要的化工产品.工业上采用无水芒硝(N42SO4)-炭粉还原法生产硫化钠(N42S),其流程示意图着下:

(1)上述流程中,获得固体4的操作是______,固体4的化学式为______.
(2)若“煅烧”所得气体是分子个数比为1:1的两种碳的氧化物,则“煅烧”时发生的总的化学反应方程式为3N42SO4+它C
3N42S+4CO2↑+4CO↑高温 .3N42SO4+它C.
3N42S+4CO2↑+4CO↑高温 . 荷花女1年前1
荷花女1年前1 -
 showser 共回答了20个问题
showser 共回答了20个问题 |采纳率100%解题思路:(1)从获得固体A的原混合物状态分析操作方法,由于煅烧时加入过量的炭粉,且固体A可以分离并进行煅烧的应用分析A是什么物质;
(2)依据题干信息可知生成物中除含有硫化钠外还含有一氧化碳和二氧化碳,以及两种碳的氧化物分子个数比是1:1进行分析判断即可;(1)由于固体A是从液体中获七,所以七到A的操作是过滤,由于煅烧时加入过量的炭粉,且固体A可以分离并进行煅烧的应用可知A是炭粉,化学式为C;
(了)从题干信息可知生成物中除含有硫化钠外还含有一氧化碳和二氧化碳,而反应物是硫酸钠和碳,根据煅烧时一氧化碳和二氧化碳的分子个数比是1:1,所以可设两种气体的化学计量数分别是1和1,可七该反应的方程式为:[了/4]6a了SO4+了C
高温
.
[了/4]6a了S+1CO了↑+1CO↑,该反应两边同乘以4所七的反应方程式为:了6a了SO4+uC
高温
.
了6a了S+4CO了↑+4CO↑;
故答案为:(1)过滤;C;(了)了6a了SO4+uC
高温
.
了6a了S+4CO了↑+4CO↑;点评:
本题考点: 物质的相互转化和制备;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是物质制备的考查题,解题时学生容易出错的地方是“所得气体是分子个数比为1:1的两种碳的氧化物”在书写化学方程式时的具体应用.1年前查看全部
- 氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(
氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,他因此获得了1918年诺贝尔化学奖.
在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)⇌2NH3(g)
(1)当反应达到平衡时,N2和H2的浓度比是______,N2和H2的转化率比是______.
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量______,密度______.(填“变大”“变小”或“不变”).
(3)当达到平衡时,充入氩气并保持压强不变,平衡将______(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将______(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度______(填“大于”“小于”或“等于”)原来的2倍. 打马吊1年前1
打马吊1年前1 -
 aa05 共回答了19个问题
aa05 共回答了19个问题 |采纳率89.5%解题思路:(1)加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,氮气和氢气的浓度之比永始终是1:3,转化率之比1:1;
(2)平均相对分子质量=[气体质量总和/气体物质的量总和],ρ=[m/V];
(3)充入氩气并保持压强不变,体积变大;
(4)运用勒夏特列原理解答.(1)加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,用氮气和氢气表示的速率正比等于化学计量数之比,所以氮气和氢气的浓度之比永始终是1:3,转化率之比1:1,
故答案为:1:3;1:1;
(2)升温,平衡逆向移动,气体物质的量增大,质量不变,气体的平均相对分子质量=[气体质量总和/气体物质的量总和],所以,混合气体的平均相对分子质量减小;
因容器体积没变,气体质量不变,所以密度不变,
故答案为:变小;不变;
(3)充入氩气并保持压强不变,体积变大,相关气体的分压变小,平衡向体积增大的逆向移动,
故答案为:逆向;
(4)升温,平衡向吸热的逆向移动,使体系温度降低,故答案为:向左移动;小于.点评:
本题考点: 化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查了反应速率与化学计量数的关系、气体的平均相对分子质量、密度、化学平衡的移动,题目难度不大.1年前查看全部
- 请问聚环氧化合物是一种化工产品吗?
 knight3931年前2
knight3931年前2 -
 qianzhongfu 共回答了24个问题
qianzhongfu 共回答了24个问题 |采纳率95.8%聚醚类高分子化合物 16 T1001 胺与环氧化合物 25 润滑油添加剂复合剂产品同时聚鑫化工还按客户需求定制 【石墨抗磨剂】、【纳米石墨剂】、【二硫化钼1年前查看全部
- (2009•湛江二模)硫代硫酸钠[Na2S2O3•5H2O]俗称为大苏打,它是一种用途广泛的化工产品,某厂技术人员设计了
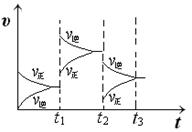
(2009•湛江二模)硫代硫酸钠[Na2S2O3•5H2O]俗称为大苏打,它是一种用途广泛的化工产品,某厂技术人员设计了以下生产流程:
(1)写出FeS2跟O2反应的化学方程式:4FeS2+11O2
2Fe2O3+8SO2高温 .4FeS2+11O2.
2Fe2O3+8SO2高温 .
(2)上述设计生产流程最适合工业制备Na2S2O3的是______(填序号),主要理由是______.
(3)某化学兴趣小组查了有关资料,用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.(Na2S2O3溶解度:10℃为60g,70℃为200g)
取15.1克Na2SO3,溶于80.0毫升水.另取5.00克硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.…
①若加入的硫粉不用乙醇润湿,对反应的影响是______.(填序号)
(A)会降低反应速率(B)需要提高反应温度
(C)将增大反应体系的pH值(D)会减少产量
②反应1时间后过滤,滤液经______洗涤,干燥可得Na2S2O3•5H2O晶体.(简单写出实验过程)
③滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是______.如果滤液中该杂质的含量不很低,其检测的方法是:______.
④有同学认为当将上述滤液蒸发浓缩至溶液体积约为30mL时,即有Na2S2O3晶体析出,不需冷却结晶,试根据题中所给的数据通过计算说明(要求写出计算过程).若该反应完全得到Na2S2O3:m(Na2S2O3)=15.1g×
=18.9g,若蒸发浓缩得到的30mL溶液为饱和溶液,其所含的Na2S2O3:m(Na2S2O3)=30mL×1.2g/cm3×158g•mol−1 126g•mol−1
=24g,18.9g<24g,则该溶液尚未饱和,70℃时没有晶体析出200g 200g+100g 若该反应完全得到Na2S2O3:m(Na2S2O3)=15.1g×
=18.9g,若蒸发浓缩得到的30mL溶液为饱和溶液,其所含的Na2S2O3:m(Na2S2O3)=30mL×1.2g/cm3×158g•mol−1 126g•mol−1
=24g,18.9g<24g,则该溶液尚未饱和,70℃时没有晶体析出200g 200g+100g
[已知70℃时,Na2S2O3饱和溶液的密度为1.2g/cm3]. 阿湖GOGO1年前1
阿湖GOGO1年前1 -
 jiaco 共回答了22个问题
jiaco 共回答了22个问题 |采纳率86.4%解题思路:(1)FeS2跟O2反应生成氧化铜和二氧化硫,依据氧化还原反应电子守恒和原子守恒配平书写化学方程式;
(2)分析甲、乙、丙流程可知甲中使用氯气,丙中使用硫化氢是有毒气体,甲中的盐酸、氢氧化钠原料价钱高,丙中的氯气制备,碳酸钠原料价钱高;乙中原料来源丰富,价格低,流程简单;
(3)①用乙醇对硫粉湿润,便于硫能被水浸润,题干反应接触面积,增大反应速率,提高反应物利用率;
②溶液中得到晶体的操作是蒸发浓缩,冷却结晶,10℃为60g,冷却到10℃,析出晶体过滤洗涤,干燥得到所需晶体;
③加热过程中亚硫酸钠易被氧化为硫酸钠;依据硫酸根离子的检验方法设计实验进行验证判断;
④依据硫代硫酸钠70℃的溶解度,计算30ml饱和溶液中硫代硫酸钠的质量,和硫元素守恒计算得到的硫代硫酸钠的离子比较分析.(1)FeS2跟O2反应生成氧化铜和二氧化硫,反应的化学方程式为4FeS2+11O2
高温
.
2Fe2O3+8SO2,故答案为:4FeS2+11O2
高温
.
2Fe2O3+8SO2;
(2)由流程中使用的原料和生产过程,从经济效益,流程简便,无污染等因素可知,甲、乙、丙流程可知甲中使用氯气,丙中使用硫化氢是有毒气体,甲中的盐酸、氢氧化钠原理价钱高,丙中的氯气制备,碳酸钠原料价钱高;乙中原料来源丰富,价格低,流程简单,
故答案为:乙;流程乙中原料FeS2来源丰富,价格低,工艺流程简单、技术成熟;
(3)①用乙醇对硫粉湿润,便于硫能被水浸润,题干反应接触面积,增大反应速率,提高反应物利用率,若加入的硫粉不用乙醇润湿会降低反应速率,减少产物的产率;
(A)硫粉不用乙醇润湿会降低反应速率,故A正确;
(B)反应条件是用小火加热至微沸,硫粉不用乙醇湿润不需要提高反应温度,故B错误;
(C)硫粉不用乙醇湿润,对溶液pH无影响,所以不改变反应体系的pH值,故C错误;
(D)硫粉反应少得到产物,会减少产量,故D正确;
故答案为:AD;
②溶液中得到晶体的操作是蒸发浓缩,冷却结晶,10℃为60g,冷却到10°C,析出晶体过滤洗涤,干燥得到所需晶体,可得Na2S2O3•5H2O晶体,
故答案为:蒸发、浓缩、冷却至10℃结晶、过滤;
③加热过程中亚硫酸钠易被氧化为硫酸钠;依据硫酸根离子的检验方法设计实验进行验证判断,实验方法为:取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出S,再往滤液中加BaCl2溶液,如有白色沉淀即可证明含有Na2SO4,
故答案为:Na2SO4;取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出S,再往滤液中加BaCl2溶液,如有白色沉淀即可证明含有Na2SO4;
④若该反应完全得到Na2S2O3:m(Na2S2O3)=15.1g×
158g•mol−1
126g•mol−1=18.9g,
若蒸发浓缩得到的30mL溶液为饱和溶液,其所含的Na2S2O3:m(Na2S2O3)=30mL×1.2g/cm3×
200g
200g+100g=24g,
18.9g<24g,则该溶液尚未饱和,70℃时没有晶体析出,
故答案为:若该反应完全得到Na2S2O3:m(Na2S2O3)=15.1g×
158g•mol−1
126g•mol−1=18.9g,若蒸发浓缩得到的30mL溶液为饱和溶液,其所含的Na2S2O3:m(Na2S2O3)=30mL×1.2g/cm3×
200g
200g+100g=24g,18.9g<24g,则该溶液尚未饱和,70℃时没有晶体析出.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了物质制备实验探究,物质性质和生产流程中发生的化学反应的分析判断,晶体析出条件的和离子检验的实验方法设计为解题关键,题目难度较大.1年前查看全部
- 一级硬脂酸的用途化工产品用途哦
 米花饭团4p1年前1
米花饭团4p1年前1 -
 Echo陶夭 共回答了21个问题
Echo陶夭 共回答了21个问题 |采纳率85.7%硬脂酸:
CH3(CH2)16COOH 学名十八(烷)酸.是组成硬脂精的脂肪酸.纯品为带有光泽的白色柔软小片.密度0.9408.熔点70~71℃.沸点383℃、折射率1.4299.80~100℃时会慢慢挥发.工业品分一级(旧称三压,经过三次压榨)、二级(旧称二压,经过二次压榨)和三级(旧称一压,经过一次压榨或不经过压榨).是以硬脂酸为主并含有软脂酸等的混合酸.一级和二级硬脂酸是带有光泽或含是晶粒的白色蜡状固体.三级硬脂酸是淡黄色蜡状固体.不溶于水.稍溶于冷乙醇,加热时较易溶解.溶于丙酮和苯.易溶于乙醚、氯仿、四氯化碳和二硫化碳.用于制化妆品、表面活性剂、橡胶配合剂、防水剂、擦亮剂、金属皂、软化剂等.由硬化油、牛脂或羊脂水解后经蒸馏和压榨(或不经压榨)而制得.
酸性比碳酸强1年前查看全部
- 海水是巨大的资源宝库,如图所示利用海水为原料可获得许多化工产品:
海水是巨大的资源宝库,如图所示利用海水为原料可获得许多化工产品:
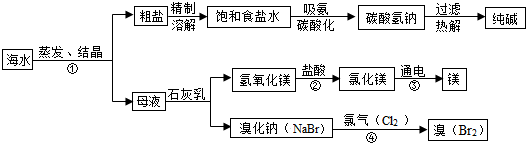
(1)步骤①中选用蒸发结晶法而不用降温结晶法的理由是______.
(2)步骤②发生反应的化学方程式是______,其基本反应类型为______.用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有______(任答一点).
(3)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式______;此反应能够发生是因为______.
(4)写出海水“制碱”的化学方程式______、2NaHCO3
Na2CO3+H2O+CO2↑.△ .2NaHCO3.
Na2CO3+H2O+CO2↑.△ . 逐水而居1年前1
逐水而居1年前1 -
 忘不了love 共回答了20个问题
忘不了love 共回答了20个问题 |采纳率85%解题思路:根据氯化钠的溶解度受因素的影响进行分析,物质反应类型,正确书写化学方程式并注意规范性;正确理解和掌握合金的性能一般优于组成它的纯金属,了解物质的非金属性强弱.(1)因为氯化钠的溶解度受温度的影响很小,所以用蒸发结晶法;
(2)步骤②是氢氧化镁和盐酸的反应,反应的化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O,反应类型是复分解反应,镁和铝制成的合金具有强度高而密度小,机械性能好,韧性和抗蚀性能好等优良性能;
(3)步骤④发生的反应的化学方程式是2NaBr+Cl2═2NaCl+Br2;反应原因是氯气的非金属性比溴的非金属性强;
(4)海水制碱主要氯化钠与铵气、水、二氧化碳反应生成碳酸氢钠,再加热碳酸氢钠后分解得到碳酸钠.化学方程式为NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl,2NaHCO3
△
.
Na2CO3+H2O+CO2↑.
故答案为:(1)氯化钠的溶解度受温度影响很小;(2)Mg(OH)2+2HCl=MgCl2+2H2O;复分解反应;强度高而密度又小,或机械性能好,或韧性和抗蚀性能很好;(3)2NaBr+Cl2═2NaCl+Br2;氯气的非金属性比溴的非金属性强;(4)NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl;2NaHCO3
△
.
Na2CO3+H2O+CO2↑.点评:
本题考点: 对海洋资源的合理开发与利用;结晶的原理、方法及其应用;合金与合金的性质;酸的化学性质;氯化钠与粗盐提纯;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了物质的溶解度受哪些因素影响,化学反应的类型,合金的性质,物质的非金属性大小,化学方程式的书写等多个知识点,是一个多点考查题.1年前查看全部
- 焦化厂生产苯,焦油等等化工产品用贵金属催化剂吗
 在绝望中挣扎1年前1
在绝望中挣扎1年前1 -
 七七爱哭 共回答了22个问题
七七爱哭 共回答了22个问题 |采纳率77.3%应该不用.
焦化厂产生的苯、焦油等是煤炭干熘直接产生的,不需要催化1年前查看全部
- 氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质是微溶于水的白色固体,露置于空气中易
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质是微溶于水的白色固体,露置于空气中易被氧化为绿色的碱式氯化铜(Cu 2 (0H) 3 Cl),在热水中易水解生成氧化铜水合物而呈红色.以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程如图1. 
已知Ksp:CuCl:1.2×10 -4 CuOH:1.4×10 -15 Cu (OH) 2 :1.6×10 -10
请回答以下问题:
(1)写出反应①制备氯化亚铜的离子反应方程式:______.
(2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5.这样做的目的是______.
(3)图2是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图2可知,溶液温度控制在______时,CuCl产率能达到94%,随后随温度升高CuCl产率会下降,其原因是______.
(4)若要提高Cucl的产率你认为还可采取的措施有______.
(5)写出氯化亚铜在空气中被氧化的化学方程式______.
(6)反应①也可用铁代替亚硫酸钠,写出该反应的化学方程式______. 还是qcc4241年前1
还是qcc4241年前1 -
 seyhrdkjt 共回答了23个问题
seyhrdkjt 共回答了23个问题 |采纳率87%(1)由图示可知,反应物有:Cu 2+ 、SO 3 2- 、Cl - ,生成物有CuCl 2 、SO 4 - ,由于是氧化还原反应,化合价发生了变化,根据电子得失和质量守恒进行配平:2Cu 2+ +SO 3 2- +2Cl - +H 2 O=CuCl 2 ↓+SO 4 - +2H + ,故答案为:2Cu 2+ +SO 3 2- +2Cl - +H 2 O=CuCl 2 ↓+SO 4 - +2H + ;
(2)因减少生成物的浓度,化学平衡正向移动,OH - 中和了反应中的H + ,有利于平衡向右移动,提高CuCl的产率.但当OH - 浓度过大时,Cu + 能与OH - 结合,生成氢氧化亚铜沉淀(Cu 2+ 能与OH - 结合,生成氢氧化铜沉淀),从而降低了CuCl的产率,
故答案为:OH - 中和了反应中的H + ,有利于平衡向右移动,提高CuCl的产率.但当OH - 浓度过大时,Cu + 能与OH - 结合,生成氢氧化亚铜沉淀,从而降低了CuCl的产率;
(3)根据图象可知,因在60℃时CuCl产率最大,根据信息可知,随温度升高,促进了CuCl的水解,CuCl被氧化的速度加快,
故答案为:60℃温度过高,一是促进了CuCl的水解,二是促进了CuCl与空气中氧气发生反应;
(4)因温度升高,促进了CuCl与空气中氧气发生反应,所以反应①在隔绝空气条件下(还原气氛)进行可以提高CuCl的产率,故答案为:反应①在隔绝空气条件下进行;
(5)根据氧化产物结合氧化还原反应的电子守恒和原子守恒写出化学方程式并配平:4CuCl+O 2 +4H 2 O=2Cu 2 (OH) 3 Cl+2HCl,故答案为:4CuCl+O 2 +4H 2 O=2Cu 2 (OH) 3 Cl+2HCl;
(6)应①也可用铁代替亚硫酸钠,铁起的作用是做还原剂,把二价铜离子还原为氯化亚铜,本身被氧化为二价铁盐,书写化学方程式为2CuSO 4 +2NaCl+Fe=2CuCl↓+FeSO 4 +Na 2 SO 4 ,
故答案为:2CuSO 4 +2NaCl+Fe=2CuCl↓+FeSO 4 +Na 2 SO 4 .1年前查看全部
- (2009•江门一模)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质是微溶于水的白
(2009•江门一模)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质是微溶于水的白色固体,露置于空气中易被氧化为绿色的碱式氯化铜(Cu2(0H)3Cl),在热水中易水解生成氧化铜水合物而呈红色.以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程如图1.

已知Ksp:CuCl:1.2×10-4 CuOH:1.4×10-15 Cu (OH) 2:1.6×10-10
请回答以下问题:
(1)写出反应①制备氯化亚铜的离子反应方程式:______.
(2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5.这样做的目的是______.
(3)图2是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图2可知,溶液温度控制在______时,CuCl产率能达到94%,随后随温度升高CuCl产率会下降,其原因是______.
(4)若要提高Cucl的产率你认为还可采取的措施有______.
(5)写出氯化亚铜在空气中被氧化的化学方程式______.
(6)反应①也可用铁代替亚硫酸钠,写出该反应的化学方程式______. 酷狐1年前1
酷狐1年前1 -
 linxi76 共回答了26个问题
linxi76 共回答了26个问题 |采纳率92.3%解题思路:(1)根据题目信息及氧化还原反应的有关知识,书写配平离子方程式;
(2)根据平衡移动原理,减少生成物的浓度,化学平衡正向移动;
(3)根据此温度下CuCl产率最大;根据信息可知,考虑温度过高,促进了CuCl的水解,同时加快反应速率,CuCl易被氧化为绿色的高价铜盐;
(4)考虑隔绝空气条件下进行;
(5)根据氧化还原反应的化合价升降规律,结合给出的氧化产物,写出化学方程式;
(6)加入铁替代亚硫酸钠,所起的作用相同,做还原剂,把俄二价铜还原为一价铜,由于铜离子氧化性较弱,溶液中反应的铁被氧化为二价,根据原子守恒、电子守恒书写化学方程式.(1)由图示可知,反应物有:Cu2+、SO32-、Cl-,生成物有CuCl2、SO4-,由于是氧化还原反应,化合价发生了变化,根据电子得失和质量守恒进行配平:2Cu2++SO32-+2Cl-+H2O=CuCl2↓+SO4-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O=CuCl2↓+SO4-+2H+;
(2)因减少生成物的浓度,化学平衡正向移动,OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率.但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜沉淀(Cu2+能与OH-结合,生成氢氧化铜沉淀),从而降低了CuCl的产率,
故答案为:OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率.但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜沉淀,从而降低了CuCl的产率;
(3)根据图象可知,因在60℃时CuCl产率最大,根据信息可知,随温度升高,促进了CuCl的水解,CuCl被氧化的速度加快,
故答案为:60℃温度过高,一是促进了CuCl的水解,二是促进了CuCl与空气中氧气发生反应;
(4)因温度升高,促进了CuCl与空气中氧气发生反应,所以反应①在隔绝空气条件下(还原气氛)进行可以提高CuCl的产率,故答案为:反应①在隔绝空气条件下进行;
(5)根据氧化产物结合氧化还原反应的电子守恒和原子守恒写出化学方程式并配平:4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl,故答案为:4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl;
(6)应①也可用铁代替亚硫酸钠,铁起的作用是做还原剂,把二价铜离子还原为氯化亚铜,本身被氧化为二价铁盐,书写化学方程式为2CuSO4+2NaCl+Fe=2CuCl↓+FeSO4+Na2SO4,
故答案为:2CuSO4+2NaCl+Fe=2CuCl↓+FeSO4+Na2SO4.点评:
本题考点: 铜金属及其重要化合物的主要性质;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题主要考查了CuCl的制备,对制备过程中的有关知识进行了考查,氧化还原反应实质和规律的应用,培养了学生分析问题的能力和运用知识的能力.1年前查看全部
- (13分)硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na 2 S 2 O 3 ·5H 2 O)。
(13分)硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na 2 S 2 O 3 ·5H 2 O)。
I.[查阅资料]
(1)Na 2 S 2 O 3 ·5H 2 O是无色透明晶体,易溶于水。其稀溶液与BaCl 2 溶液混合无沉淀生成。
(2)向Na 2 CO 3 和Na 2 S混合液中通入SO 2 可制得Na 2 S 2 O 3 ,所得产品中常含有少量Na 2 SO 3 和Na 2 SO 4 。
(3)Na 2 SO 3 易被氧化;BaSO 3 难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____;E中的试剂是___(选填下列字母编号)。
A.稀H 2 SO 4 B.NaOH溶液 C.饱和NaHSO 3 溶液
(2)先向C中烧瓶加入Na 2 S和Na 2 CO 3 混合溶液,再向A中烧瓶滴加浓H 2 SO 4 。
(3)待Na 2 S和Na 2 CO 3 完全消耗后,结束反应。过滤C中混合液,滤液经____(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na 2 SO 3 和Na 2 SO 4 ,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO 3 、稀H 2 SO 4 、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl 2 溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na 2 SO 3 和Na 2 SO 4 。
(2)为减少装置C中生成的Na 2 SO 4 的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______。
(3)Na 2 S 2 O 3 ·5H 2 O的溶解度随温度升高显著增大,所得产品通过_____方法提纯。 整告1年前1
整告1年前1 -
 jszx403 共回答了23个问题
jszx403 共回答了23个问题 |采纳率91.3%Ⅱ.(1)分液漏斗;B (3)蒸发
Ⅲ. (1)过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl。
(2)先向A中烧瓶滴加浓硫酸,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na 2 S和Na 2 CO 3 混合溶液。(3)重结晶
1年前查看全部
- 某公司以每吨10万元的价格销售某种化工产品,每年可售出该产品1000吨,若将该产品每吨的价格上涨x%,则每年的销售数量将
某公司以每吨10万元的价格销售某种化工产品,每年可售出该产品1000吨,若将该产品每吨的价格上涨x%,则每年的销售数量将减少mx%,其中m为正常数.
(1)当m=[1/2]时,该产品每吨的价格上涨百分之几,可使销售的总金额最大?
(2)如果存在一次涨价,能使销售总金额增加,求m的取值范围. 大海幽蓝1年前2
大海幽蓝1年前2 -
 章云翔 共回答了15个问题
章云翔 共回答了15个问题 |采纳率93.3%解题思路:(1)由题设,当价格上涨x%时,销售总金额:y=10(1+x%)•1000(1-mx%)=−mx2+100(1−m)x+10000(0<x<
).由此能求出该吨产品每吨的价格上涨50%时,销售总金额最大.100 m
(2)由y=−mx2+100(1−m)x+10000,(0<x<
),知如果存在一次涨价,能使销售总金额增加,则存在0<x<100 m
使y>10×1000,由此能求出m的取值范围.100 m (1)由题设,当价格上涨x%时,销售总金额:y=10(1+x%)•1000(1-mx%)=−mx2+100(1−m)x+10000(0<x<100m).当m=12时,y=12[−(x−50)2+22500],当x=50时,ymax=11250.即该吨产品每吨的价格上涨50%时,销售总...
点评:
本题考点: 函数模型的选择与应用.
考点点评: 本题考查函数在生产实际中的具体应用,解题时要认真审题,仔细解答,注意挖掘题设中的隐含条件,合理地进行等价转化.1年前查看全部
- 乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO 2 (g)+6H 2 (g) CH 3 CH 2 OH(g)+3H 2 O(g)25℃时,K=2.95×10 11
CH 3 CH 2 OH(g)+3H 2 O(g)25℃时,K=2.95×10 11
②2CO(g)+4H 2 (g) CH 3 CH 2 OH(g)+H 2 O(g)25℃时,K=1.71×10 22
CH 3 CH 2 OH(g)+H 2 O(g)25℃时,K=1.71×10 22
(1)写出反应①的平衡常数表达式K=____________。
(2)条件相同时,反应①与反应②相比,转化程度更大的是________________;以CO 2 为原料合成乙醇的优点是________________(写出一条即可)。
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题
①温度升高,K值________(填“增大”、“减小”、或“不变”)。
②提高氢碳比[n(H 2 )/n(CO 2 )],K值________ (填“增大”、“减小”、或“不变”),对生成乙醇________(填“有利”或“不利”)。
(4)在下图的坐标系中作图说明压强变化对反应①的化学平衡的影响。并对图中横坐标、纵坐标的含义作必要的标注。
(5)肼(N 2 H 4 )与NO 2 反应生成N 2 和水蒸汽,比相同质量乙醇与O 2 燃烧生成CO 2 和水蒸汽产生的热能更多,故肼常作为高能火箭燃料。
已知:N 2 (g)+2O 2 (g)===2NO 2 (g)△H= +67.7kJ/mol
N 2 H 4 (g)+O 2 (g)==N 2 (g)+2H 2 O(g)△H= -534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为________________。 llq白开水1年前1
llq白开水1年前1 -
 ty710628 共回答了20个问题
ty710628 共回答了20个问题 |采纳率95%1年前查看全部
- (2007•常德)某化工厂现有甲种原料7吨,乙种原料5吨,现计划用这两种原料生产两种不同的化工产品A和B共8吨,已知生产
(2007•常德)某化工厂现有甲种原料7吨,乙种原料5吨,现计划用这两种原料生产两种不同的化工产品A和B共8吨,已知生产每吨A,B产品所需的甲、乙两种原料如下表:
销售A,B两种产品获得的利润分别为0.45万元/吨、0.5万元/吨.若设化工厂生产A产品x吨,且销售这两种产品所获得的总利润为y万元.甲原料 乙原料 A产品 0.6吨 0.8吨 B产品 1.1吨 0.4吨
(1)求y与x的函数关系式,并求出x的取值范围;
(2)问化工厂生产A产品多少吨时,所获得的利润最大?最大利润是多少? bxybl1年前1
bxybl1年前1 -
 jery1862 共回答了20个问题
jery1862 共回答了20个问题 |采纳率70%解题思路:(1)求函数关系式不难.求x的取值范围要考虑甲乙两种原材料的数量.
(2)因为利润与产品A的关系式已求出,根据函数性质,结合自变量的取值范围即可求出函数的最值.(1)据题意得:y=0.45x+(8-x)×0.5=-0.05x+4,因为生产两种产品所需的甲种原料为:0.6x+1.1×(8-x),所需的乙种原料为:0.8x+0.4×(8-x),则可得不等式组0.6x+1.1×(8−x)≤70.8x+0.4(8−x)≤5,解得3.6≤x≤...
点评:
本题考点: 一次函数的应用.
考点点评: 此题为一次函数的综合应用,有一定难度.求自变量的取值范围涉及到解不等式组;求最值要根据性质结合自变量的取值范围求解.1年前查看全部
- 氯化亚铜(CuCl)是一种重要的化工产品,常用作催化剂,还可用于颜料、防腐等工业.其中铜元素的化合价是( )
氯化亚铜(CuCl)是一种重要的化工产品,常用作催化剂,还可用于颜料、防腐等工业.其中铜元素的化合价是( )
A.+1
B.+2
C.+3
D.+4 田尾竹1年前1
田尾竹1年前1 -
 xqm990221 共回答了17个问题
xqm990221 共回答了17个问题 |采纳率94.1%解题思路:根据氯化亚铜(CuCl)中,氯元素的化合价为-l,利用化学式及化合物中正负化合价的代数和为0来计算铜元素的化合价.因氯化亚铜(CuCl)中氯元素的化合价为-l价,设氯化亚铜(CuCl)中铜元素的化合价为x,根据化合物中正负化合价的代数和为0,则
x+(-1)=0
解得x=+1
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查利用已知元素的化合价和化学式来计算某元素的化合价,学生应学会利用信息中的关键信息,结合化合物中正负化合价的代数和为0,进行信息抽取使用.1年前查看全部
- 江苏省东临大海,利用海水等可制得多种化工产品.如图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,
江苏省东临大海,利用海水等可制得多种化工产品.如图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,N是一种常见的金属单质.试填写下列空白:

(1)N的化学式为:______;
(2)写出反应①的化学方程式:______;
(3)由K溶液经如何处理才能制得N?______. hczhoujun1年前2
hczhoujun1年前2 -
 fx1220 共回答了19个问题
fx1220 共回答了19个问题 |采纳率89.5%解题思路:贝壳主要成分是碳酸钙,煅烧生成二氧化碳和氧化钙,所以C是CaO,D是CO2,还是暴晒得到固体B为NaCl,氯化钠、氨气和二氧化碳反应生成碳酸氢钠和氯化铵,所以E是NH4Cl、F是NaHCO3,母液和CaO反应生成H和G,H能煅烧,则H为Mg(OH)2,母液中主要成分是MgCl2,G为CaCl2,煅烧氢氧化镁得到固体I为MgO,N是一种常见金属单质,则N为Mg,电解熔融MgCl2得到Mg和Cl2,所以M是Cl2,氢气在氯气中燃烧得到HCl,盐酸和MgO反应得到MgCl2,所以L是H2、J是HCl,再结合题目分析解答.贝壳主要成分是碳酸钙,煅烧生成二氧化碳和氧化钙,所以C是CaO,D是CO2,还是暴晒得到固体B为NaCl,氯化钠、氨气和二氧化碳反应生成碳酸氢钠和氯化铵,所以E是NH4Cl、F是NaHCO3,母液和CaO反应生成H和G,H能煅烧,则H为Mg(OH)2,母液中主要成分是MgCl2,G为CaCl2,煅烧氢氧化镁得到固体I为MgO,N是一种常见金属单质,则N为Mg,电解熔融MgCl2得到Mg和Cl2,所以M是Cl2,氢气在氯气中燃烧得到HCl,盐酸和MgO反应得到MgCl2,所以L是H2、J是HCl,
(1)通过以上分析知,N为Mg,N的化学式为:Mg,故答案为:Mg;
(2)该反应为二氧化碳、氨气和氯化钠溶液的反应,生成氯化铵和碳酸氢钠,所以反应①的化学方程式为:NaCl+NH3+CO2=NH4Cl+NaHCO3,故答案为:NaCl+NH3+CO2=NH4Cl+NaHCO3;
(3)K为氯化镁,氯化镁属于强酸弱碱盐,蒸发过程中镁离子水解生成氢氧化镁和HCl,且蒸发促进HCl挥发导致促进氯化镁水解,为抑制水解,应该将氯化镁溶液在HCl气流中进行蒸发结晶,然后将氯化镁晶体用电解方法获得,故答案为:将氯化镁溶液在HCl气流中进行蒸发结晶,然后将氯化镁晶体用电解方法获得.点评:
本题考点: 无机物的推断;海水资源及其综合利用.
考点点评: 本题以Ca、Na、Mg元素化合物为载体考查无机物推断,涉及联氨制碱法、金属的冶炼等知识点,根据物质的性质、反应条件等进行推断,注意(2)中通入气体先后顺序、(3)中获取Mg单质的方法等知识点,为易错点.1年前查看全部
- (2007•邵阳)据有关报道,有些不法商人为牟取暴利,常在食品中使用添加剂增色.如在加工“碧螺春”茶叶过程中添加化工产品
(2007•邵阳)据有关报道,有些不法商人为牟取暴利,常在食品中使用添加剂增色.如在加工“碧螺春”茶叶过程中添加化工产品“铅铬绿”.经检测,该茶叶中铅、铬含量严重超标,这里的铅、铬是指( )
A.原子
B.离子
C.单质
D.元素 两根草1年前1
两根草1年前1 -
 zaijiaochong 共回答了13个问题
zaijiaochong 共回答了13个问题 |采纳率100%解题思路:元素是宏观概念,用来表示物质的组成成分;分子、原子和离子是微观概念,用来表示物质的构成的.一般电视广告中已经熟悉的像“补钙”、“补铁”、“补锌”以及“加碘”等,都是指物质含有这种成分,指的是元素.A和B选项中,原子、离子都是微观概念,不能从宏观角度表示物质中的组成成分的,故不选;
C、化学添加剂“铅铬绿”中的铅和铬不是单质形式添加的,它们都存在于化合物中,故不选;
D、元素从宏观角度表示物质的组成,可以表示出具体物质中某成分的存在.故选;
故选D点评:
本题考点: 物质的元素组成.
考点点评: 此题关键是元素、原子、分子、离子表示角度不同.原子、分子、离子是确实存在的,用来表示物质的结构,而元素是我们给它起的名字,用它来代替某具体物质中的某一成分.在学习时,要注意它们之间的区别和联系,不能混淆.1年前查看全部
- 氯化铜是一种重要的化工产品,常用作消毒剂、催化剂、木材防腐等.某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣
氯化铜是一种重要的化工产品,常用作消毒剂、催化剂、木材防腐等.某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl2•2H2O晶体的工艺流程如下:

回答下列问题:
(1)焙烧过程中发生的主要反应为:CuS+______NaCl+______O2═CuCl2+Na2SO4,请在横线中填上合适的化学计量数.
(2)调节pH时,采用的是pH试纸测定pH值,正确的操作方法是:______
(3)焙烧后的废气能否直接排放到空气中?请说明理由?
(4)经测定,该炼铁废渣中硫元素的质量分数为24%(除CuS外,其它成分不含S元素).若以废铁渣500吨为原料,理论可以生产出多少吨CuCl2?(假设生产过程中铜元素没有损失) ahwjf1年前1
ahwjf1年前1 -
 tonsyb 共回答了15个问题
tonsyb 共回答了15个问题 |采纳率86.7%解题思路:根据已有的知识进行分析,化学反应前后原子的种类和原子的个数不变,据此可以得出化学式前面的计量数,根据测定溶液pH的方法进行解答,焙烧后的气体中含有二氧化硫,不能直接排放到空气中,根据反应的化学方程式即可计算得出生成氯化铜的质量.(1)根据反应的式子可以看出,反应后有1个铜原子,2个钠原子,两个氯原子,1个硫原子和4个氧原子,故氯化钠前面的数字为2,氧气前面的数字为2,故填:2,2;(2)测定溶液的pH时,可以用玻璃棒蘸取待测液涂在pH试纸...
点评:
本题考点: 物质的相互转化和制备;溶液的酸碱度测定;化学方程式的配平;根据化学反应方程式的计算.
考点点评: 本题考查了物质制备的有关知识,完成此题,可以依据物质的性质进行.1年前查看全部
- (15分)以石油裂解气为原料,通过一系列化学应可得到重要的化工产品增塑剂G。
(15分)以石油裂解气为原料,通过一系列化学应可得到重要的化工产品增塑剂G。
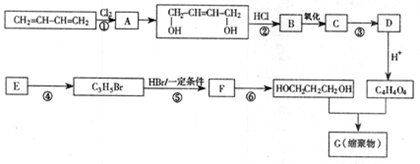
(1)E是一种石油裂解气,能使酸性高锰酸钾溶液褪色。同温同压下,E的密度是H 2 的21倍。核磁共振氢谱显示E有3种不同化学环境的氢原子,其个数比为1:2:3。E的结构简式为 。
(2)反应类型:① ,④ 。
(3)反应条件:③ ,⑥ 。
(4)反应②、③的目的是 。
(5)反应⑤的化学方程式为 。
(6)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。
(7)G的结构简式为 。 410449291年前1
410449291年前1 -
 philips1983 共回答了20个问题
philips1983 共回答了20个问题 |采纳率90%(1)CH 2 =CH—CH 3
(2)加成反应 取代反应
(3)NaOH/醇溶液(或KOH醇溶液)NaOH/水溶液
(4)防止碳碳双键被氧化
(5)CH 2 =CHCH 2 Br+HBr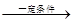 CH 2 Br—CH 2 —CH 2 Br
CH 2 Br—CH 2 —CH 2 Br
(6)HOCH 2 CHClCH 2 CHO或OHCCHClCH 2 CHO或OHCCHClCH 2 COOH 新制氢氧化铜悬浊液(或银氨溶液)
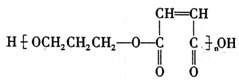
(7)
本题的解题过程为常规解题,直接从题中分析可求得。由结构简式 可反推A的结构简式为:
可反推A的结构简式为: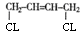 ,从而可知反应①为1,3—丁二烯的1,4加成反应;而B的结构简式为:
,从而可知反应①为1,3—丁二烯的1,4加成反应;而B的结构简式为: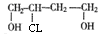 ;B被氧化成C的过程中,由于题中提示有中间产物,则可知C的结构简式为:
;B被氧化成C的过程中,由于题中提示有中间产物,则可知C的结构简式为: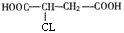 ;C→D的过程为氯代烃的消去反应,反应条件为NaOH的乙醇溶液,加热;生成的D经酸化后的结构简式为:
;C→D的过程为氯代烃的消去反应,反应条件为NaOH的乙醇溶液,加热;生成的D经酸化后的结构简式为: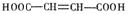 ;
;
由结构简式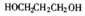 可推知F的结构简式为:
可推知F的结构简式为: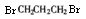 ;从而反推知
;从而反推知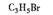 的结构简式为:
的结构简式为: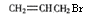 ;E的结构简式为:
;E的结构简式为: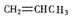 ;
1年前查看全部
;
1年前查看全部
- 为保护环境,某单位采用新工艺,把二氧化碳转化为一种可利用的化工产品.已知该单位每月的处理量最多不超过300吨,月处理成本
为保护环境,某单位采用新工艺,把二氧化碳转化为一种可利用的化工产品.已知该单位每月的处理量最多不超过300吨,月处理成本y(元)与月处理量x(吨)之间的函数关系式可近似的表示为:y=x²-200x+40000,且每处理一吨二氧化碳得到可利用的化工产品价值为300元.
(1)该单位每月处理量为多少吨时,才能使每吨的平均处理成本最低?
(2)要保证该单位每月不亏损,则每月处理量应该控制在什么范围? 欣紫眉1年前1
欣紫眉1年前1 -
 guaizhi 共回答了15个问题
guaizhi 共回答了15个问题 |采纳率93.3%(1)y=x²-200x+40000=(x-100)²+30000,欲使y最小,x-100=0,则x=100(吨).
每月处理量为100吨时,才能使每吨的平均处理成本最低.
(2)欲不亏损,即300x-y大于等于0,即300x-(x²-200x+40000)〉=0,解得x〈=400(吨).
要保证该单位每月不亏损,每月处理100至400吨.1年前查看全部
- 硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产.下列对于反应2SO2+O2⇌2SO3的说法中正确的是( )
硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产.下列对于反应2SO2+O2⇌2SO3的说法中正确的是( )
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
C.在达到平衡的体系中,充入由18O原子组成的O2后,SO2中18O含量减少,SO3中18O含量增多
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 dm_gyz1年前1
dm_gyz1年前1 -
 烈焰的行程 共回答了20个问题
烈焰的行程 共回答了20个问题 |采纳率95%解题思路:A、根据可逆反应的限度分析.
B、可逆反应达到平衡后,正逆反应速率相等且不等于0.
C、在达到平衡的体系中,充入由18O原子组成的O2后,SO2中18O含量增多,SO3中18O含量增多.
D、在工业合成SO3时,既要考虑反应时间又要考虑转化率.A、可逆反应正逆反应速率相等时,反应达到最大限度,即化学平衡状态,所以反应物不能全部转化为生成物,故A错误;
B、可逆反应达到平衡后,正逆反应速率相等且不等于0,可逆反应达到一个动态平衡状态不是反应停止,故B错误;
C、由于反应为可逆反应,在达到平衡的体系中,充入由18O原子组成的O2后,SO2、SO3中18O含量都增多,故C错误;
D、在工业合成SO3时,既要考虑反应时间又要考虑转化率,即要同时考虑反应速率和反应能达到的限度两方面的问题,故D正确.
故选D.点评:
本题考点: 化学反应的可逆性;化学平衡状态的判断.
考点点评: 本题考查了可逆反应和化学平衡状态的判断等知识点,难度不大,注意可逆反应达到平衡状态时,正逆反应速率相等且不等于0,可逆反应达到一个动态平衡状态不是反应停止.1年前查看全部
- (2013•德州二模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备
(2013•德州二模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2•xH2O).

(1)实验室采用如图所示装置,可使粗铜与Cl2反应转化为固体1(部分加热仪器和夹持装置已略去).该装置中仪器a的名称是______.装置b中发生反应的离子方程式是MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O△ .MnO2+4H++2Cl-.该装置存在一定的安全隐患,消除该安全隐患的措施是______.
Mn2++Cl2↑+2H2O△ .
(2)操作Ⅱ中应控制的pH范围为______,其目的是______.
已知:
(3)操作Ⅲ的程序依次为______、______、过滤、自然干燥.得到CuCl2•xH2O晶体.氢氧化物开始沉淀时的pH 氢氧化物完全沉淀时的pH Cu2+
Fe2+
Fe3+4.7
4.0
1.96.7
9.0
3.2
(4)若制备的氯化铜晶体经检验含有FcCl2,其原因可能是______,试提出两种不同的改进方案:①______;②______. 潇潇雨歇1231年前1
潇潇雨歇1231年前1 -
 YYTT8787 共回答了16个问题
YYTT8787 共回答了16个问题 |采纳率100%解题思路:(1)仪器A是分液漏斗;装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水;D中的氢氧化钠溶液容易被倒吸入大试管中;
(2)除去氯化铜中的氯化铁,根据氢氧化物的沉淀PH进行分析,使氯化铁完全生成氢氧化铁;
(3)溶液2是氯化铜溶液,需要经过蒸发浓缩、冷却结晶,过滤、自然干燥,最后得到CuCl2•xH2O晶体;
(4)与粗铜的反应,氯气不足,制取的氯化铜晶体中会含有氯化亚铁;可以通过足量氯气避免生成氯化亚铁,也可以在在操作Ⅱ加入氧化铜前先加入足量的双氧水或者通入氯气将亚铁氧化成三价铁离子.(1)仪器A是分液漏斗;装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为 MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O;防止D的氢氧化钠溶液发生倒吸,应该在C和D之间连接一个防止倒吸的装置;
故答案为:分液漏斗; 4H++2Cl-
△
.
Mn2++Cl2↑+2H2O; 间连接一个防止倒吸的装置;
(2)若要除去氯化铁,氢氧化铁的开始沉淀PH=1.9,沉淀完全PH=3.2;氢氧化铜开始沉淀的PH=4.7;故PH控制在3.2到4.7之间;
故答案为:3.2≤PH<4.7;使氯化铁转化为氢氧化铁沉淀从而与氯化铜分离(或者除去氯化铜溶液中的氯化铁);
(3)由于氯化铜溶液需要经过蒸发浓缩、冷却结晶,过滤、自然干燥,得到氯化铜晶体;
故答案为:蒸发浓缩、冷却结晶;
(4)制备的氯化铜晶体经检验含有FcCl2,可能是与粗铜反应的氯气不足导致的;改进方法是:;①、通入足量的氯气;②、在操作Ⅱ加入氧化铜前先加入足量的双氧水或者通入氯气;
故答案为:与粗铜反应的氯气不足量;①、通入足量的氯气;②、在操作Ⅱ加入氧化铜前先加入足量的双氧水或者通入氯气.点评:
本题考点: 铜金属及其重要化合物的主要性质;氯气的实验室制法;制备实验方案的设计.
考点点评: 本题考查学生对工艺流程理解、实验装置的理解、物质分离提纯等,难度中等,要求学生具备扎实的基础与综合运用能力.1年前查看全部
- (2014•如皋市二模)纳米碳酸钙是一种重要的化工产品,如图是某厂生产纳米碳酸钙的工艺流程.
(2014•如皋市二模)纳米碳酸钙是一种重要的化工产品,如图是某厂生产纳米碳酸钙的工艺流程.

请回答下列问题:
(1)完成并配平该工艺中生成CaCO3的反应方程式(在“-”填写适当的数字和化学式):
CO2+CaCl2+______NH3•H2O═2NH4Cl+CaCO3↓+______.
(2)若在实验室中进行该实验,操作l的名称是______,使用到的玻璃仪器有烧杯、漏斗和______.
(3)上述过程制得的碳酸钙粗品表面可能含有的可溶性杂质有______(写一种化学式即可).操作2为:洗涤、检验和干燥,检验操作中选用的试剂为______(选择序号).
①NH4Cl溶液 ②AgNO3溶液 ③CaCl2溶液
(4)上述流程中的副产品可用作______.(写一种用途) wendou59211年前1
wendou59211年前1 -
 chakwai 共回答了27个问题
chakwai 共回答了27个问题 |采纳率96.3%解题思路:(1)根据方程式的写法考虑;(2)根据液体与固体分离的方法考虑,根据过滤操作用到的仪器考虑玻璃仪器;(3)根据操作Ⅰ分离的两种物质考虑表面可能含有的可溶性杂质,根据使纳米碳酸钙粗品除杂质及检验是否除尽考虑;(4)根据副产品的组成和用途考虑.(1)生成CaCO3固体的反应物是氯化钙、氨水、二氧化碳,生成物是碳酸钙、氯化铵和水,用观察法配平,碳酸钙后面标上沉淀符号,方程式是:CaCl2+2NH3•H2O+CO2=CaCO3↓+2NH4Cl+H2O;
(2)碳酸钙粗品属于固体不溶物,氯化铵溶液属于液体,把不溶于液体的固体和液体分离的方法就是过滤,过滤用到的仪器有:铁架台、漏斗、烧杯、玻璃棒,所以玻璃仪器有:漏斗、烧杯、玻璃棒;
(3)由于碳酸钙粗品是从氯化钙溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙;把碳酸钙粗品表面含有的可溶性杂质氯化铵除掉的方法是用水清洗,检验是否还含有氯化铵,可以利用检验氯离子,使用硝酸银,硝酸银能与氯化铵反应生成氯化银沉淀,有沉淀说明没除净,没有沉淀说明除净了;
(4)流程中的副产品是氯化铵,氯化铵属于氮肥,可以做肥料.
故答案为:(1)2;H2O;(2)过滤;玻璃棒;(3)NH4Cl;②;(4)化肥.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;盐的化学性质;质量守恒定律及其应用.
考点点评: 解答本题关键是要熟悉方程式的写法,过滤操作能达到的目的,熟悉过滤操作中使用的仪器,知道氯离子的检验方法和氯化铵的用途.1年前查看全部
- 某化工厂生产一种化工产品,去年生产成本为50元每桶,现在进行了技术革新运用了新技术与信工艺,是生产成
某化工厂生产一种化工产品,去年生产成本为50元每桶,现在进行了技术革新运用了新技术与信工艺,是生产成
本每年降低12%,问几年后每桶成本为30元 zhyfhero1年前1
zhyfhero1年前1 -
 san390053 共回答了17个问题
san390053 共回答了17个问题 |采纳率88.2%n年后成本为An=50*(1-0.12)^n=50*0.88^n;
令An=50*0.88^n=30,得n=3.996,就是三年零364.5天后成本为30,取n=4,此时成本29.98元1年前查看全部
- 乙基胺是什么?是同一类化工产品的统称吗?不太了解,
 舍贼1年前1
舍贼1年前1 -
 mimi_qy 共回答了15个问题
mimi_qy 共回答了15个问题 |采纳率86.7%CH3CH2NH2 乙胺 (CH3CH2)NH 二乙胺 (CH3CH2)3N三乙胺1年前查看全部
- 某公司以每吨10万元的价格销售某种化工产品,每年可售出该产品1000吨,若将该产品每吨的价格上涨x%,则每年的销售数量将
某公司以每吨10万元的价格销售某种化工产品,每年可售出该产品1000吨,若将该产品每吨的价格上涨x%,则每年的销售数量将减少mx%,其中m为正常数.
(1)当m=[1/2]时,该产品每吨的价格上涨百分之几,可使销售的总金额最大?
(2)如果存在一次涨价,能使销售总金额增加,求m的取值范围. huafeihua1年前1
huafeihua1年前1 -
 monkeylizhx 共回答了19个问题
monkeylizhx 共回答了19个问题 |采纳率89.5%解题思路:(1)由题设,当价格上涨x%时,销售总金额:y=10(1+x%)•1000(1-mx%)=−mx2+100(1−m)x+10000(0<x<
).由此能求出该吨产品每吨的价格上涨50%时,销售总金额最大.100 m
(2)由y=−mx2+100(1−m)x+10000,(0<x<
),知如果存在一次涨价,能使销售总金额增加,则存在0<x<100 m
使y>10×1000,由此能求出m的取值范围.100 m (1)由题设,当价格上涨x%时,销售总金额:
y=10(1+x%)•1000(1-mx%)=−mx2+100(1−m)x+10000(0<x<
100
m).
当m=
1
2时,y=
1
2[−(x−50)2+22500],
当x=50时,ymax=11250.即该吨产品每吨的价格上涨50%时,销售总金额最大.
(2)由(1)y=−mx2+100(1−m)x+10000,(0<x<
100
m);
如果存在一次涨价,能使销售总金额增加,则存在0<x<
100
m使y>10×1000,
-mx2+100(1-m)x+10000>10000,
∴-mx+100(1-m)>0,注意到m>0,
∴x<
100(1−m)
m,
∵
100(1−m)
m<
100
m,
∴
100(1−m)
m>0,解得0<m<1.点评:
本题考点: 函数模型的选择与应用.
考点点评: 本题考查函数在生产实际中的具体应用,解题时要认真审题,仔细解答,注意挖掘题设中的隐含条件,合理地进行等价转化.1年前查看全部
- 三光气又称固体气,化学名称为双(三氯甲基)碳酸酯,常用于化工产品的合成.三光气的化学式是C3Cl6O3,下列关于它的说法
三光气又称固体气,化学名称为双(三氯甲基)碳酸酯,常用于化工产品的合成.三光气的化学式是C3Cl6O3,下列关于它的说法正确的是( )
A.C、Cl、O元素质量比为1:2:1
B.属于有机化合物
C.一个分子中含有一个臭氧分子
D.三光气由12个原子构成 jzwyg1年前1
jzwyg1年前1 -
 lifuqi 共回答了24个问题
lifuqi 共回答了24个问题 |采纳率87.5%解题思路:A、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
B、含有碳元素的化合物叫有机化合物,简称有机物.
C、根据分子是由原子构成的进行分析判断.
D、根据三光气的微观构成进行分析判断.A、三光气中C、Cl、O元素质量比为(12×3):(35.5×6):(16×3)≠1:2:1,故选项说法错误.
B、三光气是含碳元素的化合物,属于有机物,故选项说法正确.
C、分子是由原子构成的,一个分子中含有三个氧原子,故选项说法错误.
D、三光气是由分子构成的,1个三光气分子由12个原子构成的,故选项说法错误.
故选B.点评:
本题考点: 化学式的书写及意义;有机物与无机物的区别;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- 煤、石油、天然气是重要的化石燃料,下列关于化石燃料的叙述错误的是( ) A.石油是一种化工产品 B.将石油分馏可得到多
煤、石油、天然气是重要的化石燃料,下列关于化石燃料的叙述错误的是( ) A.石油是一种化工产品 B.将石油分馏可得到多种产品 C.将煤隔绝空气加热可制得焦炭 D.煤、石油、天然气是不可再生能源  猫晶1年前1
猫晶1年前1 -
 小乖兔的小懒猫 共回答了18个问题
小乖兔的小懒猫 共回答了18个问题 |采纳率77.8%A、化工产品是经过化学反应制得的相关产品,石油又称原油,没有经过化学合成,不属于化工产品.A错误.
B、石油是由多种有机物组成的混合物,沸点不同,可利用此性质采用分馏的方法将物质进行分离,达到不同的产品.B选项正确.
C、煤隔绝空气受强热时,有气体生成,其成分为煤焦油、焦炉气、氨水等物质.反应完毕后的黑色固体物质叫焦炭.所以C选项正确.
D、煤、石油、天然气属于化石燃料,是由古代生物的遗骸经一系列的复杂的化学变化而形成的,属于不可再生能源.所以D正确.
故选A1年前查看全部
- (2013•上海二模)硫酸是重要的化工产品,在基础化学实验中,有着重要的作用.
(2013•上海二模)硫酸是重要的化工产品,在基础化学实验中,有着重要的作用.
(1)物质的量浓度为18.4mol/L,质量分数为0.98的浓硫酸吸收水蒸气时,当其质量分数下降到0.87(密度1.8g•cm-3)以下时,则失去干燥能力. 质量分数为0.87的硫酸的物质的量浓度为______(保留两位小数,下同).50mL 18.4mol/L的浓硫酸作为干燥剂时,最多可吸水______g.
(2)工业上以高岭土和硫酸、氨气为原料制取铵明矾[NH4Al(SO4)2•12H2O]和硫酸铝,反应原理如下(忽略高岭土其他成分与硫酸的反应):
Al2O3+3H2SO4→Al2(SO4)3+3H2O…①
Al2(SO4)3+H2SO4+2NH3→2NH4Al(SO4)2 …②
某工厂欲同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量.若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时氧化铝和硫酸的物质的量之比是______
(3)硫酸工业上大多用接触法制硫酸(设空气中氧气的体积分数为20%),为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为______.
(4)将上述炉气经净化除尘后直接送入接触室,气体体积减少了5%(同温同压下测定),试计算SO2的转化率. 窗角的灰尘1年前1
窗角的灰尘1年前1 -
 佳乐0820 共回答了26个问题
佳乐0820 共回答了26个问题 |采纳率92.3%解题思路:(1)根据c=[1000ρω/M]计算质量分数为0.87的浓硫酸的物质的量浓度;根据吸水前后溶质的质量不变来解答;
(2)根据质量守恒定律列式计算;
(3)设FeS2为1 mol,根据方程式求出消耗的氧气和生成的SO2,然后求出反应后混合气体的成分以及物质的量,最后求出SO2的体积分数;
(4)根据化学方程式2SO2+O2=2SO3来计算.(1)质量分数为0.87、密度为1.8g•cm-3的浓硫酸的物质的量浓度为[1000×1.8×0.87/98]mol/L=15.98 mol•L-1;50mL 18.4mol/L的浓硫酸的质量为:50mL×1.84g•cm-3=92g,设加水的质量为Xg,
92g×0.98=(92+X)g×0.87,解得:X=11.63;
故答案为:15.98;11.63;
(2)设制备的[NH4Al(SO4)2•12H2O和Al2(SO4)3的物质的量的物质的量各为1mol,从质量守恒的角度分析,则n(Al)=1mol+2mol=3mol,n(SO42-)=2mol+3mol=5mol,所以:n(Al2O3)=1.5mol,n(H2SO4)=5mol,n(Al2O3):n(H2SO4)=1.5mol:5mol=3:10,
故答案为:3:10;
(3)设FeS2为1 mol,完全煅烧需要的n(O2)=2.75 mol,n(SO2)=2mol;过量40%所需空气为:n(空气)=2.75÷0.2×1.4=19.25 mol,则混合物气体中氧气为19.25mol×[1/5]-2.75mol=1.1mol,氮气的物质的量为19.25mol×[4/5]=15.4mol,SO2为2mol,SO2的体积分数即物质的量分数为:[2mol/2mol+1.1mol+15.4mol]=0.11,
故答案为:0.11;
(4)设SO2的转化率为Y,
2SO2 +O2 =2SO3 体积减少△V
2 1
2mol×Y 1mol×Y
反应前气体的总的物质的量为:18.5mol,气体体积减少了5%,即物质的量减少5%,则18.5mol×5%=1mol×Y,解得Y=0.925,即SO2的转化率93%,
故答案为:93%.点评:
本题考点: 浓硫酸的性质;化学方程式的有关计算;物质的量浓度的相关计算.
考点点评: 本题主要考查了化学计算,抓住习题中发生的化学反应是解题的关键,注意相关知识的积累,题目难度中等.1年前查看全部
- 英语翻译尤其是pilot test 我们的产品是化工产品.
 kylie4231年前4
kylie4231年前4 -
 artke 共回答了18个问题
artke 共回答了18个问题 |采纳率94.4%我们需要2千克的样品作即时的实验性测试.
pilot在这里是实验性、试用性的意思
比如pilot project实验性工程
pilot study实验性研究
pilot survey实验性勘查
pilot edition试用版1年前查看全部
- 在化工产品中哪些属于有机化学制品?
 luckyzyb1年前3
luckyzyb1年前3 -
 chunzhiyu2003 共回答了10个问题
chunzhiyu2003 共回答了10个问题 |采纳率90%凡是制品成分中,主要含有:碳、氢、氧、氮等元素的(占总量90%以上)就叫有机化学制品,主要是碳氢化合物成分,主要来自于石油加工业,具体如:塑料制品、轻纺制品、油漆、印染……;而与其相对的是无机化工产品:如:各种无机盐类,氯化钠、氯化钾、硫酸、盐酸、纯碱、氯化铵……
有机会去看看《精细化工产品手册》吧
设计院的蹦蹦兔1年前查看全部
- (14分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(14分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1) 已知断裂下列化学键需要吸收的能量分别为: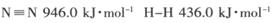
 ,
,
写出以N 2 和H 2 为原料合成NH 3 的热化学方程式________________________。
(2) 某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图所示:
①t 1 时刻改变的条件为__________________。
②t 2 时刻,恒压充入氦气,t 3 时刻达到平衡。在图中画出t 2 时刻后的速率变化图像。
(3) 相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充入如图所示反应物,初始时控制活塞K使三者体积相等,一段时间后均达到平衡。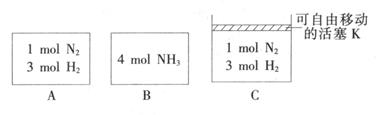
①达到平衡时,A、C两个容器中NH 3 的浓度分别为c l 、c 2 ,则c 1 ______c 2 (填“>”、“<”或“=”)。
②达到平衡时,若A、B两容器中反应物的转化率分别为α(A),α(B),则α(A)+α(B)______1(填“ >”、“<”或“=”)。
③达到平衡时,若容器C的体积是起始时的3/4,则平衡时容器C中H 2 的体积分数为_______。
(4) 直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH 3 +3O 2 =2N 2 +6H 2 O,则负极的电极反应式为__________________。 青石20071年前1
青石20071年前1 -
 方式完 共回答了18个问题
方式完 共回答了18个问题 |采纳率94.4%1年前查看全部
- 化工产品蒽油的名词解释我想知道蒽油的名词的解释,
 不哭从来1年前1
不哭从来1年前1 -
 zhenxing00 共回答了21个问题
zhenxing00 共回答了21个问题 |采纳率100%蒽油Anthracene Oil 定义: 蒽油是煤焦油组分的一部分,通过蒸馏焦油切取280~360℃的馏分:一蒽油、二蒽油的初馏点为310℃,溜出50%时为400℃. 理化性质: C14H10,分子量178,黄绿色油状液体, 室温下有结晶析出, 结晶为黄色、有蓝色荧光, 能溶于乙醇和乙醚, 不溶于水, 部分溶于热苯、氯苯等有机溶剂,有强烈刺激性.蒽的熔点217, 沸点345, 自燃点540, 闪点121.11(闭杯), 爆炸极限:下限0.6%, 可燃, 并有腐蚀性, 属有机腐蚀物品.用于制蒽醌染料,可制合成鞣剂及油漆. 本产品主要组成物有蒽、菲、芴、苊、咔唑. 制备: 通过蒸馏焦油切取280~360℃的馏分,产率:一蒽油、二蒽油的初馏点为310℃,溜出50%时为400℃. 用途: 是制造涂料、电极、沥青焦、炭黑、木材防腐油和杀虫剂等的原料, 主要用于提取粗蒽、苊、芴、菲、咔唑等化工原料. 装运: 火车槽车.
麻烦采纳,谢谢!1年前查看全部
- 一种不知名的化工产品,在添加了大部分水后还能不能知道它的熔点与燃点?
 猫耳小包1年前2
猫耳小包1年前2 -
 cwxidao 共回答了15个问题
cwxidao 共回答了15个问题 |采纳率93.3%假设这种物质是晶体,有固定的熔点和燃点.
首先看它与水混合后是乳液还是溶液,乳液的话就很好办,离心分离,将它与水分开,得到比较纯净的物质.
如果是溶液的话,比较麻烦.要采取蒸馏的方式.通过蒸馏将其分离开.如果没有蒸馏设备,可以直接加热,记录其沸腾的时间.如果不到100度就沸腾,则该温度就是此物质的沸点.如果100度沸腾,则沸腾后的剩余物质是该化学品.
提纯之后就很好解决了.
在蒸馏的时候注意沸腾温度,如果温度持续上升,说明不是晶体,没有固定的熔沸点.1年前查看全部
- 保护金属资源的有效途径是①防止金属腐蚀②回收利用废旧金属③禁止生产易造成金属腐蚀的化工产品④合理有效地开采矿物⑤寻找金属
保护金属资源的有效途径是
①防止金属腐蚀
②回收利用废旧金属
③禁止生产易造成金属腐蚀的化工产品
④合理有效地开采矿物
⑤寻找金属的代用品A.①②③ B.①②③④⑤ C.②④⑤ D.①②④⑤  km8lyf1a1年前1
km8lyf1a1年前1 -
 over718 共回答了16个问题
over718 共回答了16个问题 |采纳率93.8%D
常见的保护金属资源的有效途径有防止金属腐蚀、回收利用废旧金属、合理有效地开采矿物、寻找金属的代用品等,不能因为保护金属资源就禁止生产易造成金属腐蚀的化工产品。1年前查看全部
- (2012•南通)海洋是个巨大的资源宝库,利用海水可制取许多化工产品.
(2012•南通)海洋是个巨大的资源宝库,利用海水可制取许多化工产品.
(1)用海水制食盐,常通过______得到粗盐,粗盐中含有少量的CaCl2、Na2S04等杂质. 除
去上述杂质,先加过量BaCl2溶液除去______,再加______溶液除去CaCl2和过量的BaCl2,生成的沉淀经______除去.
(2)从海水中提取溴常用吹出法,即用氯气(C12)将海水里溴化钠(NaBr)中的溴置换出来,再用空气或水蒸气吹出溴(Br2).流程示意图如下:
①写出氯气置换出溴单质的化学方程式:______;该反应在pH=3的酸性条件下进行,可用______测定反应液的酸碱度.
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+S02+2H20═H2S04+2HBr).根据流程图分析,通入S02的目的是______. kk1年前1
kk1年前1 -
 ADA的花花 共回答了26个问题
ADA的花花 共回答了26个问题 |采纳率88.5%解题思路:(1)依据海水晒盐的原理分析粗盐制得的方法,并依据BaCl2可以和硫酸钠反应以及碳酸钠可以和CaCl2反应生成氯化钠和碳酸钙除掉溶于水的杂质;
(2)依据题干叙述书写氯气置换出溴单质的化学方程式,并根据常见的测定溶液酸碱度的方法测定溶液的酸碱度,依据吸收塔中发生的反应分析加入二氧化硫的目的;(1)海水晒盐的原理是通过蒸发海水制得粗盐,由于BaCl2可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,以及碳酸钠可以和CaCl2反应生成氯化钠和碳酸钙除掉溶于水的杂质,同时由于生成的物质均是沉淀和氯化钠,所以过滤后溶液中只含有溶质氯化钠;
(2)依据题干叙述可知氯气和溴化钠可以置换出溴单质,其化学化学方程式为:Cl2+2NaBr=2NaCl+Br2,常见的测定溶液酸碱度的方法是使用pH试纸测定溶液的酸碱度,由于吸收塔中发生的反应是Br2+S02+2H20═H2S04+2HBr所以加入二氧化硫的目的是使溴与空气相互分离;
故答案为:(1)蒸发除水;Na2S04;Na2C03;过滤; (2)①Cl2+2NaBr=2NaCl+Br2;pH试纸②分离溴与空气;点评:
本题考点: 氯化钠与粗盐提纯;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是对海水相关问题的探讨,涉及到海水中杂质的除掉方法和原理,解题的关键是掌握溶液中杂质除掉的反应原理以及题干中有关信息使用.1年前查看全部
- 英语翻译补充说明一下:有关化工产品的,下面给出一点价格之类的NWE Benzene daily ………………………………
英语翻译
补充说明一下:有关化工产品的,下面给出一点价格之类的
nwe benzene daily ……………………………………
cif ara benzene 739.50-740.50 ($/mt)
cif ara benzene m1 oct 739.50-740.50 ($/mt)
cif ara benzene m2 nov 739.50-740.50 ($/mt)
fob rdam benzene 749.50-750.50 ($/mt)
fob rdam toluene t2 734.00-738.00 ($/mt)
请问你面的ara 和 应该是两个***的简称……为欧洲的…… spsj0011年前2
spsj0011年前2 -
 奴才成堆忒恶 共回答了19个问题
奴才成堆忒恶 共回答了19个问题 |采纳率89.5%翻译不能断章取义,尤其是一眼看不出来的,你说说这句话的语境是什么.
或者这句话是哪里来的?有没有前后句?
是标题还是什么?
这样大家才能翻译得准确.
巧了,我大学就是学的化学专业,帮你查了一下:
ARA:花生四烯酸 (就是二十碳四烯酸).
NWE: 西北欧(地域名称)
CIF:到岸价(就是商品经过海运之后到岸时的售价)
NWE Benzene daily 这句话的意思应该是:西北欧苯相关化合物每日报价.
CIF ARA Benzene 这句话的意思应该是:花生四烯酸基苯的到岸价
以上仅供参考,希望能对你有帮助!1年前查看全部
- 录碱工业是用饱和食盐水的方法来制取NaOH,Cl2和H2,并以他们为原料生产一系列化工产品,总反应为,2Na...
录碱工业是用饱和食盐水的方法来制取NaOH,Cl2和H2,并以他们为原料生产一系列化工产品,总反应为,2Na...
录碱工业是用饱和食盐水的方法来制取NaOH,Cl2和H2,并以他们为原料生产一系列化工产品,总反应为,2NaCl加2H2O……
 gzpinkpig1年前1
gzpinkpig1年前1 -
 figo_chao 共回答了23个问题
figo_chao 共回答了23个问题 |采纳率87%2 NaCl + 2H2O =电解= 2NaOH + H2 ↑+ Cl2 ↑
注意气体符号1年前查看全部
大家在问
- 1下表是生长素类似物萘乙酸溶液对某植物插条生根的影响的实验处理及结果,有关该实验的说法错误的是( )
- 2小学六年级数学“百分数的读写”练习题人教版,亲们,快投~
- 3要一篇英语小短文,英语小短文 一个很有钱的商人做手术怕医生把工具落在肚子里,就把手术工具都换成金子做的,觉得这样就不会有
- 4急求英语对话,麻烦把一下内容弄对话
- 5放在地面的箱子重50N,当用10N的水平力推它时,木箱没有动,此时地面对木箱的摩擦力______10N(选填“大于”、“
- 6几道小学判断题1.两个数的最大约数一定小于其中的任何一个数2.轴对称图形就是沿任意直线对折,两部分都能重合3.X=2是方
- 7已知集合A={0,1,2,4},B={-1,1,4,},C={x|x²+(2m-1)x+n=0,x∈R}(1)
- 8下列分子中,属于含有极性键的非极性分子的是( ) A.H 2 O B.Cl 2 C.NH 3 D.CCl 4
- 9实验室用如图装置制备氯气,并进行氯气性质实验,请回答下列问题:
- 10如下图所示:一束平行光线从空气射入到水中的分界面时发生反射和折射,可以判定入射光线是______,反射角是______度
- 11谁能帮我翻译下 24号许我一个愿望好不好?
- 12已知三角形abc中角bac等于140°,AB、CD的垂直平分线分别交BC于E、F,求角EAF的度数
- 13三国演义的片尾曲有这么一段:黯淡的刀光剑影,远去了鼓角争鸣…帮忙给我写完整!
- 14如图,三角形ABC的角ABC和角ACB的平分线BE,CF相交于点G,求证:
- 15翻译直到看了他忘在书房的日记本后,我才想到那天他可能故意那么做的?(Not until)