气化炉生成的气体与将物质直接燃烧,火焰有什么不同
 阿塔叶华2022-10-04 11:39:541条回答
阿塔叶华2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 06_26 共回答了24个问题
06_26 共回答了24个问题 |采纳率95.8%- 气化炉淡黄或淡蓝颜色浅无烟物质直接燃烧深黄色到橙色伴有黑烟
- 1年前
相关推荐
- 英语翻译煤气化高压煤浆泵流量突降故障及处理案例摘要:高压煤浆泵是煤气化的重要设备,流量突降造成气化炉单系列事故停车,补油
英语翻译
煤气化高压煤浆泵流量突降故障及处理案例摘要:高压煤浆泵是煤气化的重要设备,流量突降造成气化炉单系列事故停车,补油阀均压孔堵塞是造成停车的主要原因,计划检修时应注意清洗检查补油阀及控制杆.
关键词:高压煤浆泵;补油阀;控制杆
COAL GASIFICATION IN HIGH-PRESSURE COAL SLURRY PUMP FLOW SUDDEN FAULT AND PROCESSING CASE
Abstract:high-pressure coal slurry pump is the important equipment of coal gasification,gasification furnace flow drop caused by single series accident shutdown,the fill oil valve pressure equalizing hole plug is the main reason causing the parking,maintenance should pay attention to clean and check the fill oil valve and a control lever.
Key words:high-pressure coal slurry pump; oil supplementary valve; control lever fxgjxfgjfx1年前1
fxgjxfgjfx1年前1 -
 xtfjso 共回答了18个问题
xtfjso 共回答了18个问题 |采纳率88.9%我把文章翻译一遍,供您参考:
煤气化高压煤浆泵流量突降故障及处理案例
A Case Study for the Fault and Handling of Sudden Drop in the Flow Rate of High-pressure Coal Slurry Pump for Coal Gasification.
摘要:高压煤浆泵是煤气化的重要设备,流量突降造成气化炉单系列事故停车,补油阀均压孔堵塞是造成停车的主要原因,计划检修时应注意清洗检查补油阀及控制杆.
Abstract:High pressure coal slurry pump is important equipment for coal gasification; the sudden drop of the flow rate will result in the failure shutdown of the single series gasification furnace and the main reason for the shutdown is caused by the blockage of the pressure-balancing holes of the oil supplementary valve.So when conducting planned maintenance,particular attention should be focus on the cleansing of oil supplementary valve and the control lever.
关键词:高压煤浆泵;补油阀;控制杆
Key words:high-pressure coal slurry pump; oil supplementary valve; control lever.
注:停车被翻译为parking,您是否借助机器翻译啦?
【英语牛人团】1年前查看全部
- 气化炉火焰温度为多少
 我妹妹好靓1年前1
我妹妹好靓1年前1 -
 60650260 共回答了16个问题
60650260 共回答了16个问题 |采纳率93.8%火焰颜色相对应的温度
最低可见红色,温度是475℃
最低可见红色到深红色,温度是475~650℃
深红色到樱桃红色,温度是650~750℃
樱桃红色到发亮樱桃红色,温度是750~825℃
发亮樱桃红色到橙色,温度是825~900℃
橙色到黄色,温度是900~1090℃
黄色到浅黄色,温度是1090~1320℃
浅黄色到白色,温度是1320~1540℃
白色到耀眼白色,温度是1540℃
根据火焰颜色自己可以判断气化炉火焰温度.1年前查看全部
- (2013•包头模拟)“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续
(2013•包头模拟)“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达12500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
(1)已知:C(s)+O2 (g)=CO2 (g)△H1=-393.5kJ•mol-1①
2H2 (g)+O2 (g)=2H2O(g)△H2=-483.6kJ•mol-1 ②
C(s)+H2O(g)=CO(g)+H2 (g)△H3=+131.3kJ•mol-1 ③
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=______kJ•mol-1.标准状况下的煤炭气(CO、H2)33.6L与氧气完全反应生成CO2和H2O,反应过程中转移______mol e-.
(2)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体为正极燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料电池电极)为催化剂制成的.负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为______.
(3)密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:
CO(g)+2H2 (g)⇌CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示.
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K=
L2/mol2V2 100 ;A、B两点时容器中,n(A)总:n(B)总=______.
L2/mol2V2 100
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA______tC(填“大于”、“小于”或“等于”).
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是______. 芸菲芸1年前1
芸菲芸1年前1 -
 白白的仁仁 共回答了23个问题
白白的仁仁 共回答了23个问题 |采纳率91.3%解题思路:(1)依据热化学方程式和盖斯定律来计算得到;依据n=[V/22.4]计算物质的量结合化学方程式的电子转移计算;
(2)燃料电池中燃料在负极失电子发生氧化反应,正极上是氧气得到电子发生还原反应;
(3)①A、B点是同温度下的平衡,转化率变化,但平衡常数不变,结合化学平衡三段式列式计算A处的平衡常数,A点一氧化碳转化率为50%,B点一氧化碳转化率为70%;
②C点温度高速率达,达到平衡所需要的时间短;
③提高CO的转化率可采取的措施是改变条件促使平衡正向进行.(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol①
C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol②
由盖斯定律①-②得到CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=-524.8KJ/mol;
在标准状况下,33.6L的煤炭合成气物质的量为1.5mol,与氧气完全反应生成CO2和H2O,反应过程中2mol合成气完全反应电子转移4mol,所以1.5mol合成气反应转移电子3mol;
故答案为:-524.8; 3;
(2)燃料电池中燃料在负极失电子发生氧化反应,正极上是氧气得到电子发生还原反应,空气与CO2的混合气体为正极燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的,正极反应是氧气得到电子发生还原反应,电极反应为:O2+4e-+2CO2=2CO32-;
故答案为:O2+4e-+2CO2=2CO32-;
(3)CO(g)+2H2(g)⇌CH3OH(g),图象分析温度越高,一氧化碳转化率减小,逆向进行,正反应是放热反应;
①依据图象分析可知AB是同温度下的平衡,平衡常数随温度变化,所以平衡常数不变,A点一氧化碳转化率为50%,B点一氧化碳转化率为70%,密闭容器中充有10mol CO与20mol H2,A点平衡常数结合平衡三段式列式计算;
CO(g)+2H2 (g)⇌CH3OH(g)
起始量(mol) 10 20 0
变化量(mol) 5 10 5
平衡量(mol) 5 10 5
平衡常数K=
(
5mol
VL)
5mol
VL×(
10mol
VL)2=
V2
100L2/mol2;
B点一氧化碳转化率为70%,结合平衡三段式列式计算
CO(g)+2H2 (g)⇌CH3OH(g)
起始量(mol) 10 20 0
变化量(mol)7 14 7
平衡量(mol)36 7
A、B两点时容器中,n(A)总:n(B)总=(5+10+5):(3+6+7)=20:16=5:4;
故答案为:
V2
100L2/mol2;5:4;
②达到A、C两点的平衡状态所需的时间,C点温度高反应速率快达到反应速率需要的时间短,tA>tC,故答案为:大于;
③反应是气体体积减小的放热反应,提高CO的转化率可采取的措施是降温、加压、分离出甲醇,故答案为:降温、加压、将甲醇从混合体系中分离出来.点评:
本题考点: 化学平衡的计算;用盖斯定律进行有关反应热的计算;原电池和电解池的工作原理.
考点点评: 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡标志判断,图象分析,影响平衡的因素分析判断,化学平衡移动原理是解题关键,题目难度中等.1年前查看全部
- 英语翻译摘要:以二氧化碳作为煤气化的气化剂,在理论上完全可行,不会对气化炉的煤气化反应造成影响,那么我们用二氧化碳代替粗
英语翻译
摘要:以二氧化碳作为煤气化的气化剂,在理论上完全可行,不会对气化炉的煤气化反应造成影响,那么我们用二氧化碳代替粗煤气对碎煤加压煤气化炉煤锁升压,使二氧化碳进入气化炉,用二氧化碳代替粗煤气作为煤锁升压气体,能够消除煤锁以粗煤气作为煤锁升压气体中氢气、一氧化碳、硫化氢等气体的存在,消除气化炉煤锁运行危险;提高二氧化碳利用效率,减少温室气体二氧化碳的放空.延长设备运行周期.去除粗煤气回收系统,延长变换触媒使用寿命,降低净化工艺气量,提高净化效果;去除粗煤气储柜、煤锁气洗涤塔以及洗涤液泵等设备,降低设备投资,降低气化炉煤锁系统操作强度,减少设备维护检修,降低煤锁系统运行消耗. 找地球1年前1
找地球1年前1 -
 yuki137 共回答了25个问题
yuki137 共回答了25个问题 |采纳率88%Abstract: taking carbon dioxide as gasification agent of coal gasification, is completely feasible in theory, will not affect the gasifier coal gasification reaction, then we use carbon dioxide instead of crude gas booster of broken coal pressurized coal gasifier coal lock, carbon dioxide into the gasifier, using carbon dioxide instead of crude gas lock as coal gas booster, can eliminate gas as coal on coal lock to lock booster hydrogen, carbon monoxide and hydrogen sulfide gas in the gas, eliminate risk run coal gasifier lock; To raise efficiency of utilization of carbon dioxide to reduce the greenhouse gas carbon dioxide vent. Extend the operation cycle. Remove thick coal gas recovery system, prolong the service life of transformation catalyst, reducing gas purification process, improve the effect of purification; Remove thick coffer, coal gas lock tower of gas cleaning and washing liquid pump equipment, reduce equipment investment, reduce the intensity of coal gasifier lock system operation, reduce the equipment maintenance, reduce consumption of coal lock system is running.1年前查看全部
- 科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出了高热值的煤炭气,主要成分是CO和H2.
 科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出了高热值的煤炭气,主要成分是CO和H2.
科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出了高热值的煤炭气,主要成分是CO和H2.
(1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1①
2H2(g)+O2(g)=2H2O(g)△H2=-483.6kJ•mol-1②
C(s)+H2O(g)=CO(g)+H2(g)△H3=+131.3kJ•mol-1③
①反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),△H=______kJ•mol-1.
②标准状况下33.6L煤炭气(CO、H2)与氧气完全反应生成CO2和H2O,反应过程中转移______mol e-.
(2)某种熔融盐燃料电池,两电极分别通煤炭气(CO、H2)、空气与CO2的混合气体,Li2CO3和Na2CO3混合物做电解质.若负极的气体按物质的量之比为1:1参与反应,该电极反应式为______.
(3)恒容密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)⇌CH3OH(g);
CO的平衡转化率(α)与温度、压强的关系如图所示.
①若在A点时容器的体积为VAL,则该温度下的平衡常数K=
L2•mol-2Va2 100 ;
L2•mol-2Va2 100
②自反应开始到达平衡状态所需的时间tA______tC(填“大于”、“小于”或“等于”).
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是______. 神仙的宝贝1年前1
神仙的宝贝1年前1 -
 才富李文琦 共回答了19个问题
才富李文琦 共回答了19个问题 |采纳率89.5%解题思路:(1)依据热化学方程式和盖斯定律来计算得到;依据n=[V/22.4]计算物质的量结合化学方程式的电子转移计算;
(2)该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水;
(3)①A、B点是同温度下的平衡,转化率变化,但平衡常数不变,根据A点温度下的转化率求平衡时各种物质的浓度,依据平衡常数概念计算得到;
②C点温度高速率达,达到平衡所需要的时间短;
③提高CO的转化率可采取的措施是改变条件促使平衡正向进行.(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol①
C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol③
由盖斯定律①-③得到CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=-524.8KJ/mol;
在标准状况下,33.6L的煤炭合成气物质的量为1.5mol,与氧气完全反应生成CO2和H2O,反应过程中2mol合成气完全反应电子转移4mol,所以1.5mol合成气反应转移电子3mol;
故答案为:-524.8;3;
(2)该燃料电池中,负极的气体按物质的量之比为1:1参与反应,则负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,
故答案为:CO+H2-4e-+2CO32-=3CO2+H2O;
(3)①依据图象分析可知AB是同温度下的平衡,平衡常数随温度变化,所以平衡常数不变;
CO(g)+2H2(g)⇌CH3OH(g)
初起浓度 [10/Va]mol/L[20/Va] mol/L 0
变化量 [5/Va]mol/L[10/Va]mol/L [5/Va]mol/L
平衡量 [5/Va]mol/L[10/Va]mol/L [5/Va]mol/L
故K=
5
Va
5
Va•(
10
Va)2L2•mol-2,
故答案为:
Va2
100L2•mol-2;
②达到A、C两点的平衡状态所需的时间,C点温度高反应速率快达到反应速率需要的时间短,tA>tC,故答案为:大于;
③反应是气体体积减小的放热反应,提高CO的转化率可采取的措施是降温、加压、分离出甲醇,故答案为:降温、加压、将甲醇从混合体系中分离出来.点评:
本题考点: 热化学方程式;化学电源新型电池;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡标志判断,图象分析,影响平衡的因素分析判断,化学平衡移动原理是解题关键,题目难度中等.1年前查看全部
- (2014•广西模拟)科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热
(2014•广西模拟)科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中发生的主要反应有:
C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)“气化炉”中CO2与C反应转化为CO,该反应的热化学方程式是______
(2)用煤炭气合成甲醇的反应为:CO(g)+H2(g)⇌CH3OH(g).在密闭容器中,将CO和H2按一定的物质的量混合,进行反应,如图1是该反应在不同温度下CO的转化率随时间变化的曲线.
①生成甲醇的反应是______反应(填“放热”或“吸热”).
②若该反应在绝热、恒容的密闭体系中进行,如图2中3个图中,既正确又能说明反应在t1时刻达到平衡状态的是______(填正确答案标号)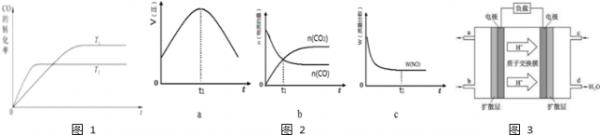
③在不改变原料用量的前提下,为提高CO的转化率,可以采取的措施是______(答对一种措施即可).
(3)近年来,中国科学院长春应用化学研究所在甲醇燃料电池技术研究方面获得新突破,组装出了自呼吸电池及上推式电堆,甲醇燃料电池的工作原理如图3所示.
①该电池工作时,b口通入的物质为______,c口通入的物质为______.
②该电池正极的电极反应式为______.
③工作一段时间后,当6.4克甲醇完全反应生成CO2时,转移的电子数目为______. 3327094701年前1
3327094701年前1 -
 刺绣裙子 共回答了21个问题
刺绣裙子 共回答了21个问题 |采纳率90.5%解题思路:(1)依据热化学方程式和盖斯定律计算所需热化学方程式;
(2)①分析图象,先拐先平,温度高,一氧化碳转化率随温度升高减小,平衡逆向进行;
②a、到达平衡后正、逆速率相等,不再变化;
b、t1时刻后二氧化碳、CO的物质的量发生变化,最后不再变化;
c、到达平衡后各组分的含量不发生变化;
③温度升高,CO的转化率降低,说明升高温度平衡向逆反应方向移动;增大压强,平衡向正反应方向移动;
(3)①根据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料;
②负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
③根据甲醇和转移电子之间的关系式计算.(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ•mol-1,
利用盖斯定律将①-②可得C(s)+CO2(g)=2CO(g)△H=+172.5 kJ•mol-1,
故答案为:C(s)+CO2(g)=2CO(g)△H=+172.5 kJ•mol-1;
(2)①分析图象,先拐先平,温度高,T2>T1,一氧化碳转化率随温度升高减小,平衡逆向进行,逆向是吸热反应,正反应为放热反应;
故答案为:放热;
②a、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、t1时刻后二氧化碳、CO的物质的量发生变化,t1时刻未到达平衡状态,故b错误;
d、NO的质量分数为定值,t1时刻处于平衡状态,故c正确,
故答案为:c;
③增大反应物的转化率,只能使平衡向正向移动,而影响平衡移动的因素只有三个,温度、压强、浓度,本题只能是降温或加压,或分离出甲醇;
故答案为:降温或加压;
故答案为:降低温度(或增大压强、分理出甲醇等);
(3)①据氢离子移动方向知,右侧电极为正极,c口通氧气,左侧电极为负极,b口为负极上通入燃料甲醇,故答案为:CH3OH,O2;
②正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e-=2H2O,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为2CH3OH-12e-+2H2O=2CO2↑+12H+,故答案为:O2+4H++4e-=2H2O;
③根据2CH3OH-12e-+2H2O=2CO2+12H+知,甲醇和转移电子之间的关系式得,当6.4g甲醇完全反应生成CO2时,转移电子的物质的量=[6.4g/32g/mol]=1.2mol,则转移电子个数为1.2NA,
故答案为:1.2NA;点评:
本题考点: 热化学方程式;常见化学电源的种类及其工作原理;化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查了盖斯定律求焓变、化学平衡影响因素、原电池原理分析判断,化学反应速率概念计算应用,注意平衡的条件分析和原电池电极名称是解题关键,题目难度中等.1年前查看全部
- 气化炉是如何将固态物质汽化的,生成什么气体
 wingp71年前1
wingp71年前1 -
 meixia620 共回答了17个问题
meixia620 共回答了17个问题 |采纳率82.4%简单的来说,就是将生物质原料加热,在缺氧燃烧的条件下,使较高分子量的有机碳氢化合物链断裂,变成低的烃类、co和氢等.这种气体是一种混合燃气,含有一氧化碳、氢气、甲烷等,亦称生物质气.1年前查看全部
大家在问
- 1写出四个的全神贯注意思差不多的词语
- 2光在真空中的传播速度为3×108m/s,它代表的物理意义是( )
- 3求高一英语必修1课本后面的不规则动词,加上翻译
- 4sam is a naught boy对划线部分提问
- 5要铸造一个直径12cm、高9cm的圆锥形零件,应截取直径为4cm的圆柱形钢多少厘米?
- 675的因数有?
- 7呵护世界读后感我曾经在一个开满鲜花的公园里散步,当我走近一座花坛时,一个像鲜花一样美丽的小女孩挡住了我,轻轻地说:“叔叔
- 8若函数f(x)=ex-2x-a在R上有两个零点,则实数a的取值范围是________.
- 9关于 地点状语North of the Himalayas lies the great tableland of xz
- 1010kg物体沿x轴无摩擦运动,t=0物体静止原点,物体在F=(3+4t)作用下运动了2秒,2秒后的速度是多少
- 11蛋白质变性(加入重金属离子)是化学变化么?
- 121-2/1-4/1-8/1-16/1-32/1-64/1-128/1-256/1等于多少
- 13(10分)根据如下图所示的实验装置图,按要求回答有关问题:
- 14下列判断正确的是:A.直线的一半是射线 B.方向相反的两条射线可以看作是一条直线 C.射线AB可以记作射线BA
- 15shania twain 的im gonna getcha good中文意思是什么啊?
