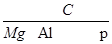铁的外围电子排布式是3d6 4s2,变成+3价铁之后失去3个电子.还有两个空轨道.按理说只能接受2对孤对电子.
 sosin2022-10-04 11:39:542条回答
sosin2022-10-04 11:39:542条回答为什么能形成【FeF6】3-

已提交,审核后显示!提交回复
共2条回复
 hhh43210 共回答了12个问题
hhh43210 共回答了12个问题 |采纳率83.3%- Fe3+ 3d5 它可以利用 4s 4p 4d 轨道形成配位键,轨道有的是
FeF63- 中Fe3+ 是sp3d2 杂化,这个杂化里面p轨道是 4p轨道,d轨道是 4d轨道 - 1年前
 微酸的桔子 共回答了26个问题
微酸的桔子 共回答了26个问题 |采纳率- 这个是大学无机化学里面的属于-配位,即配合物。只有达到八电子或者0电子或者4个电子,才是稳定存在的,也成半满和全满规则
- 1年前
相关推荐
- 下列基态原子的外围电子排布式中,正确的是( )
下列基态原子的外围电子排布式中,正确的是( )
A.3d54s1
B.3d44s2
C.3d94s2
D.3s13p6 catt_gon1年前1
catt_gon1年前1 -
 355199247 共回答了20个问题
355199247 共回答了20个问题 |采纳率95%解题思路:原子或离子核外电子排布属于基态排布应满足构造原理:1s、2s2p;3s3p;4s3d4p;5s4d5p;6s4f5d6p;7s5f6d7p按此顺序填充,注意满足半满、全满、全空稳定状态,洪特规则、泡利原理.A.3d54s1是基态原子,故A正确;
B.3d44s2违背了半充满时为稳定状态,应为3d54s1,故B错误;
C.3d94s2违背了全充满时为稳定状态,应为3d104s1,故C错误;
D.3s13p6违背了能量最低原理,应先排3s再排3p,故D错误.
故选:A.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查核外电子排布规律,难度不大,掌握核外电子排布规律与常见电子排布式书写.1年前查看全部
- 铁原子的外围电子排布式是什么①铁原子的外围电子排布式:②铁原子最外层有几个不同运动状态的电子?
 matongtoto1年前1
matongtoto1年前1 -
 海南vv队员 共回答了23个问题
海南vv队员 共回答了23个问题 |采纳率95.7%1.3d^6 4s^2
2.8种,每种电子的运动运动状态都是不同的,有几个电子就有几个不同运动状态的电子.1年前查看全部
- 原子的外围电子排布式,价电子排布式,最外层电子排布式不用写Ar么
 水蜜桃9991年前1
水蜜桃9991年前1 -
 纯白黛黑 共回答了17个问题
纯白黛黑 共回答了17个问题 |采纳率88.2%写个0族原子在前面的是简化电子排布式1年前查看全部
- 外围电子排布式:是指将过渡元素原子的电子排布式中符合稀有气体的原子的电子排布的部分(原子实)或主族、0族元素的内层电子排
外围电子排布式:是指将过渡元素原子的电子排布式中符合稀有气体的原子的电子排布的部分(原子实)或主族、0族元素的内层电子排布省略后剩下的式子.
 咿哑千年1年前1
咿哑千年1年前1 -
 ff无戒 共回答了17个问题
ff无戒 共回答了17个问题 |采纳率88.2%你按照能量最低原理、保里原理、洪特规则写出过渡元素核外电子排布式的时候,你会发现其中必然有一部分(靠前的较长一串)与某种稀有气体原子的电子排布式完全相同,这部分电子能量很低,不活波,不参与化学反应,所以通常没有必要把它们都罗列出来,只写剩余部分,称为外围电子排布式.前面的一串电子和原子核共同构成所谓的原子实.
过渡元素的次外层有未填满(可以参与化学反应的)能量较高的电子,因此不能像主族或零族原子那样,只保留最外层电子,而应将这些可以参与反应的部分次外层电子也写出来(f区的原子还应写出倒数第三层的部分电子).1年前查看全部
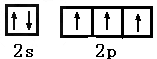
- (1)下列原子的外围电子排布式(或外围轨道表示式)中,那一种状态的能量较低?
(1)下列原子的外围电子排布式(或外围轨道表示式)中,那一种状态的能量较低?
并指出处于能量较低状态时原子中的未成对电子数
①氦原子:A.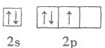 B.
B.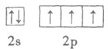 ______
______
②钠原子:A.小u1 B.小p1______
③铬原子:A.小d14u1 B.小d小4uh______
(h)小1号元素镓(Ga)是半导体材料之一.
①写出镓原子的电子排布式______,指出镓元素在元素周期表中的位置______;
②写出镓元素的最高价氧化物、氯化物的化学式______. yan06201年前1
yan06201年前1 -
 liuww1206 共回答了22个问题
liuww1206 共回答了22个问题 |采纳率72.7%解题思路:(1)遵循洪特规则、泡利不相容原理、能量最低原理的基态原子排布能量最低;
(2)①镓是31号元素,其原子核外有31个电子,根据构造原理书写其基态原子核外电子排布式,元素周期数等于其电子层数,主族元素中,原子最外层电子数等于其族序数;
②镓元素最外层有3个电子,在化合物中显+3价,再根据化合物中化合价的代数和为0确定其氧化物、氯化物化学式.(1)遵循洪特规则、泡利不相容原理、能量最低原理少基态原子排布能量最低,
①A违反了洪特规则,基态原子少电子总是优先单独占据十个原子轨道,且自旋状态相同,所以能量低少为A,故选B;未成对电子个数是中,
故答案为:B,中;
②中s能级少能量比中p能量低,电子尽可能占据能量最低少轨道,不符合能量最低原理,原子处于能量较高少激发态,所以能量最低少是A,未成对电子个数是1,
故答案为:A,1;
③原子轨道处于全满、半满、全空时,原子最稳定,原子越稳定,其能量越低,所以能量最低少是A,未成对电子个数是十,故答案为:A,十;
(y)①镓是中1号元素,其原子核外有中1个电子,根据构造原理知,其基态原子核外电子排布式为:1Sy ySy yP十 中Sy 中P十 中d1多 4Sy 4P1,元素周期数等于其电子层数,主族元素中,原子最外层电子数等于其族序数,所以镓位于第四周期第IIIA族,
故答案为:1Sy ySy yP十 中Sy 中P十 中d1多 4Sy 4P1;第四周期ⅢA族;
②镓元素易失去最外层中个电子而显+中价,氧化物中氧元素显-y价,氯化物中氯元素化合价为-1价,所以氧化镓、氯化镓少化学式分别为qayO中、qaCl中,
故答案为:qayO中、qaCl中.点评:
本题考点: 原子核外电子排布;位置结构性质的相互关系应用.
考点点评: 本题考查了原子核外电子排布,根据能量最低元素、洪特规则、构造原理等知识点来分析解答,易错点是铬原子核外电子排布式,注意其3d电子是5个而不是6个.1年前查看全部
- 5.A、B、C、D四种短周期元素,A元素原子的外围电子排布式为2s22p2,B元素与A元素位于同一周期,其原子的原子核外
5.A、B、C、D四种短周期元素,A元素原子的外围电子排布式为2s22p2,B元素与A元素位于同一周期,其原子的原子核外有三个未成对电子,C元素位于第2周期,电负性仅次于氟,D元素在短周期元素中第一电离能最小.(1)A、B、C、D四种元素分别是____________.(2)A的最高价氧化物的电子式是________________.(3)A、B、C、D四种元素电负性由大到小的顺序是____________.(4)B、C两种元素气态氢化物的稳定性大小的顺序是____________.
 beebeekk1年前1
beebeekk1年前1 -
 随疯而动 共回答了18个问题
随疯而动 共回答了18个问题 |采纳率77.8%4)H2O>NH31年前查看全部
- 具有下列外围电子排布式的基态原子中,最容易形成离子的是: A.3s 2 3p 1 B.2s 2 2p 2 C.3s 2
具有下列外围电子排布式的基态原子中,最容易形成离子的是:
A.3s 2 3p 1 B.2s 2 2p 2 C.3s 2 D.4s 2 4p 3  bolivia541年前1
bolivia541年前1 -
 穆懿 共回答了15个问题
穆懿 共回答了15个问题 |采纳率100%1年前查看全部
- 若某原子在处于能量最低状态时,外围电子排布式为4d35s2,则下列说法不正确的是( )
若某原子在处于能量最低状态时,外围电子排布式为4d35s2,则下列说法不正确的是( )
A.该元素原子最外层共有2个电子
B.该元素原子核外共有5个电子层
C.该元素原子的M能层共有18个电子
D.该元素原子处于能量最低状态时,原子中共有5个未成对电子 无心无知1年前1
无心无知1年前1 -
 jianghh_hm 共回答了21个问题
jianghh_hm 共回答了21个问题 |采纳率95.2%解题思路:外围电子排布式为4d35s2,说明原子核外有5的电子层,最外层电子数为2原子,原子核外电子排布为[Kr]4d35s2,以此解答该题.A.最外层电子数为5s2,说明最外层共有2个电子,故A正确;
B.最大能级为5s,说明原子核外共有5个电子层,故B正确;
C.该元素原子的M能层共有2×32=18个电子,故C正确;
D.该元素原子处于能量最低状态时,原子中未成对电子应为4d3的电子,为3个,故D错误.
故选D.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查原子核外电子排布,题目难度不大,注意把握价层电子的分析和判断,可根据价层电子判断元素在周期表中的位置.1年前查看全部
- 已知:元素A的原子外围电子排布式为nSnnPn+1,元素B的+2价离子电子排布式为1S22S22P63S23P6,元素D
已知:元素A的原子外围电子排布式为nSnnPn+1,元素B的+2价离子电子排布式为1S22S22P63S23P6,元素D的原子第二电子层上只有一个空轨道,元素E的原子最外层电子数是内层电子数的3倍.G为短同期元素,且与E同族.所有气态氢化物中X的氢化物最稳定.
(1)E、G、X电负性由大到小的顺序是(用元素符号表示)______A、E、X第一电离能由大到小的顺序是(用元素符号表示)______
(2)E、G、X形成的简单离子半径由大到小的顺序是(用离子符号表示)______
(3)比较下列物质熔沸点高低(用化学式表示)BE和BG______;E和G分别形成的最简单氢化______;D和同族、短同期元素Y分别形成的最简单氢化物______. 5542241年前1
5542241年前1 -
 chenchuang_2000 共回答了13个问题
chenchuang_2000 共回答了13个问题 |采纳率92.3%解题思路:元素A的原子外围电子排布式为nSnnPn+1,s能级容纳2个电子,则n=2,故A原子外围电子排布式为2S22P3,则A为N元素;元素B的+2价离子电子排布式为1S22S22P63S23P6,则B元素质子数为20,B为Ca元素;元素D的原子第二电子层上只有一个空轨道,则其核外电子排布为1S22S22P2,D为碳元素;元素E的原子最外层电子数是内层电子数的3倍,则E原子有2个电子层,最外层电子数为6,E为O元素.G为短同期元素,且与E同族,则G为S元素;所有气态氢化物中X的氢化物最稳定,则X为F元素,据此解答.元素A的原子外围电子排布式为nSnnPn+1,s能级容纳2个电子,则n=2,故A原子外围电子排布式为2S22P3,则A为N元素;元素B的+2价离子电子排布式为1S22S22P63S23P6,则B元素质子数为20,B为Ca元素;元素D的原子第二电子层上只有一个空轨道,则其核外电子排布为1S22S22P2,D为碳元素;元素E的原子最外层电子数是内层电子数的3倍,则E原子有2个电子层,最外层电子数为6,E为O元素.G为短同期元素,且与E同族,则G为S元素;所有气态氢化物中X的氢化物最稳定,则X为F元素,
(1)同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性F>O>S,
同周期自左而右第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能F>N>O,
故答案为:F>O>S;F>N>O;
(2)电子层越多离子半径越大,电子层结构相同核电荷数越大离子半径越小,故离子半径S2->O2->F-,
故答案为:S2->O2->F-;
(3)氧离子半径小于硫离子半径,故晶格能CaO>CaS,故熔沸点CaO>CaS;由于H2O分子之间存在氢键,故熔沸点H2O>H2S;CH4与SiH4都形成分子晶体,相对分子质量越大,分子间作用力越强,故熔沸点CH4<SiH4,
故答案为:CaO>CaS;H2O>H2S;CH4<SiH4.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构性质位置关系应用,涉及核外电子排布规律、电负性、电离能、半径比较、晶体类型与性质等,难度中等,注意全面、半满稳定状态对电离能的影响.1年前查看全部
- 写出符合下列条件的元素原子的外围电子排布式:
写出符合下列条件的元素原子的外围电子排布式:
(1)电负性最大的元素的原子______________。
(2)自然界中最活泼的金属元素的原子______________。
(3)第四周期0族元素的原子______________。
(4)能形成自然界中最硬的单质的元素原子______________。 身在欧洲1年前1
身在欧洲1年前1 -
 landeli 共回答了22个问题
landeli 共回答了22个问题 |采纳率95.5%(1)2s 2 2p 5 (2)6s 1 (3)4s 2 4p 6 (4)2s 2 2p 2
(1)电负性最大的元素为F;(2)自然界中最活泼的金属元素为Cs(Fr自然界中不存在);(3)Kr;(4)自然界中最硬的单质为金刚石,因此为C。1年前查看全部
- 具有下列外围电子排布式的基态原子中,最容易形成离子的是( )
具有下列外围电子排布式的基态原子中,最容易形成离子的是( )
A. 3s23p1
B. 2s22p2
C. 3s2
D. 4s24p3 南极的天空1年前2
南极的天空1年前2 -
 1双桥 共回答了18个问题
1双桥 共回答了18个问题 |采纳率77.8%解题思路:元素原子最外层电子数越少,越易失电子,越容易形成离子.元素原子最外层电子数越少,越易失电子,越容易形成离子,3s23p1最外层有3个电子,2s22p2最外层有4个电子,3s2最外层有2个电子,3s2最外层有5个电子,C的最外层电子数最少,最易形成离子.
故选:C.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查了元素的得失电子难易的问题,难度不大,注意相关基础知识的积累.1年前查看全部
- 下列符号中表达正确的是( )A.25Mn的原子结构示意图:B.24Cr的外围电子排布式:3d44s2C.次氯酸的电子式
下列符号中表达正确的是( )
A.25Mn的原子结构示意图:
B.24Cr的外围电子排布式:3d44s2
C.次氯酸的电子式:
D.C的轨道表示式:
 小猪莎拉1年前1
小猪莎拉1年前1 -
 指纹探长 共回答了25个问题
指纹探长 共回答了25个问题 |采纳率96%解题思路:A.Mn的原子序数为25,4个电子层,最外层电子数为2;
B.Cr的3d电子半满为稳定结构;
C.次氯酸的结构式为H-O-Cl;
D.C的2p电子优先占据1个轨道,且自旋方向相同.A.Mn的原子序数为25,4个电子层,最外层电子数为2,25Mn的原子结构示意图为
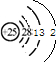 ,故A错误;
,故A错误;
B.Cr的3d电子半满为稳定结构,24Cr的外围电子排布式为3d54s1,故B错误;
C.次氯酸的结构式为H-O-Cl,次氯酸的电子式为 ,故C正确;
,故C正确;
D.C的2p电子优先占据1个轨道,且自旋方向相同,则C的轨道表示式为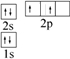 ,故D错误;
,故D错误;
故选C.点评:
本题考点: 电子式、化学式或化学符号及名称的综合.
考点点评: 本题考查化学用语,为高频考点,涉及原子结构示意图、电子排布式、电子式、轨道表示式,侧重原子结构与性质的考查,注意化学用语的规范使用及区别,题目难度中等.1年前查看全部
- 若某原子的外围电子排布式为4d 1 5s 2 ,则下列说法正确的是 A.该元素在元素周期表中的位置为第五周期IIIB B
若某原子的外围电子排布式为4d 1 5s 2 ,则下列说法正确的是
A.该元素在元素周期表中的位置为第五周期IIIB B.该元素位于s区 C.该元素原子为非金属 D.该元素原子N能层共有8个电子  kafeiggw91年前1
kafeiggw91年前1 -
 adali99 共回答了22个问题
adali99 共回答了22个问题 |采纳率86.4%A
1年前查看全部
- Fe的外围电子排布式怎么写?为什么是 1s22s22p63s23p63d64s2而不是 1s22s22p63s23p64
Fe的外围电子排布式怎么写?
为什么是 1s22s22p63s23p63d64s2
而不是 1s22s22p63s23p64s23d6 ,这是根据构造原理写的.
为什么4s2要写在外面,3d6要写在里面? shqtzzfjdshjjk4t1年前2
shqtzzfjdshjjk4t1年前2 -
 cai有类 共回答了24个问题
cai有类 共回答了24个问题 |采纳率91.7%根据构造原理:4s比3d的能量小,先填4s,再填3d
但失电子时,却是先失4s上的电子,说明填入电子后4s比3d的能量大,所以填入电子后,4s2要写在外面,3d6要写在里面1年前查看全部
- (12分)X、Y、Z、W、N五种元素中,X原子核外的M层中只有两个成对电子,Y原子的外围电子排布式为ns n np n+
(12分)X、Y、Z、W、N五种元素中,X原子核外的M层中只有两个成对电子,Y原子的外围电子排布式为ns n np n+1 ,Z是地壳内含量(质量分数)最高的元素,W的核电荷数是X与Z的核电荷数之和,N在元素周期表的各元素中电负性最大。
(1)Z元素基态原子的电子排布图为
(2)W的元素符号是 ,在周期表中的位置是 ,其基态原子的电子排布式为 ,在形成化合物时它的最高化合价为
(3)Y的氢化物的VSEPR模型是 ,属于 分子(填极性或非极性),
(4)X的氢化物的沸点 Z的氢化物的沸点(填大于、小于或等于)
原因是
(5)用氢键表示式写出N的氢化物溶液中存在的所有氢键
 zlj691年前1
zlj691年前1 -
 紫色的我 共回答了19个问题
紫色的我 共回答了19个问题 |采纳率94.7%(12分)(1)电子排布图:
(2) Cr , 第四周期第 V I B 族 , 1s 2 2s 2 p 6 3s 2 3p 6 3d 5 4s 1 , +6 价
(3)VSEPR模型是 四面体形 ,属于 极性 分子
(4)X的氢化物的沸点 小于 Z的氢化物的沸点(填大于、小于或等于)
原因是 水分子间能形成氢键使水的沸点大于硫化氢
(5)F—H … F F—H … O O—H … F O—H … O
略1年前查看全部
- D元素的+2价阳离子的3d亚层半充满,则D的元素符号为(),D原子的外围电子排布式为?D元素的外围电子排布式为
D元素的+2价阳离子的3d亚层半充满,则D的元素符号为(),D原子的外围电子排布式为?D元素的外围电子排布式为
外围电子排布式不是3d74s2吗?3d轨道比4s轨道能量高 不是应该先失能量高得轨道的电子吗 6543zhang1年前2
6543zhang1年前2 -
 xiaoqing117 共回答了21个问题
xiaoqing117 共回答了21个问题 |采纳率95.2%D应该是Mn,Mn原子的价电子3d5 4s2,Mn2+离子的价电子3d5
排布电子按照最低能量原理进行,先4s后3d,所以Mn原子的价电子3d5 4s2,
但失电子按电子层进行,最外层电子先失去.
因此Mn失电子先失4s,Mn2+价电子为3d5
实际情况就是这样,记住就好啦.虽然也能通过计算说明,但这已经超出高中化学的要求了.
化学系的结构化学课程中才会学到1年前查看全部
- 若某基态原子的外围电子排布式为3d14s2,则下列说法正确的是( )
若某基态原子的外围电子排布式为3d14s2,则下列说法正确的是( )
A.该元素基态原子中存在电子的原子轨道共有2个
B.该元素原子核外有4个电子层
C.该元素原子中运动状态不同的电子共有21种
D.该元素原子M电子层共有18个电子 wyp_19731年前1
wyp_19731年前1 -
 不遮太阳伞 共回答了29个问题
不遮太阳伞 共回答了29个问题 |采纳率89.7%解题思路:若某基态原子的外围电子排布式为3d14s2,应为Sc元素,其核外有21个电子,位于周期表第四周期、第ⅢB族,以此解答该题.若某基态原子的外围电子排布式为3d14s2,应为Sc元素,其核外有21个电子,根据核外电子排布规律,该元素基态原子的电子排布式为1s22s22p63s23p63d14s2.
A.该元素基态原子中存在电子的原子轨道共有11个,故A错误;
B.该元素原子核外有4个电子层,故B正确;
C.该元素原子核外有21个电子,所以原子中运动状态不同的电子共有21种,故C正确;
D.该元素原子M能层共有9个电子,故D错误.
故选BC.点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查核外电子排布规律,难度中等,注意构造原理写出元素基态原子的电子排布式,根据电子排布式分析.1年前查看全部
- (18分)(一)按要求作答:(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为:
(18分)(一)按要求作答:
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为: 。
(2)3d能级为半充满的正三价离子,该离子的电子排布式为 。
(二)A、B、C、D、E五种元素为1~18号元素。已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30。它们两两形成的化合物有甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:
(1)E - 的结构示意图是________________。B原子核外有________个未成对电子,它们的能量______________(填“相等”或“不相等”)。甲 乙 丙 丁 化合物中各元素原子个数比 A和C 1∶1 B和A 1∶2 D和E 1∶3 B和E 1∶4
(2)向甲的水溶液中加入MnO 2 可用于实验室制备C的单质,其化学方程式是____________________。
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为___________。
(4)丙的水溶液呈酸性,与饱和NaHCO 3 溶液反应会产生大量的气体和难溶物,有关离子方程式是____________________。 匪鉴1年前1
匪鉴1年前1 -
 whwh0032 共回答了20个问题
whwh0032 共回答了20个问题 |采纳率95%(一)(6分,每空3分)
(1)3d 5 4s 1 (2)1s 2 2s 2 2p 6 3s 2 3p 6 3d 5
(二) (12分,每空2分)
(1) 2 相等
(2)2H 2 O 2 = 2H 2 O+O 2 ↑
(3)CH 2 =CH 2
(4)Al 3+ +3HCO - 3 ====Al(OH) 3 ↓+3CO 2 ↑
1年前查看全部
- 若某原子的外围电子排布式为4d 1 5s 2 ,则下列说法正确的是 A.该元素基态原子中共有3个电子 B.该元素原子核外
若某原子的外围电子排布式为4d 1 5s 2 ,则下列说法正确的是
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个能层 C.该元素原子最外层共有3个电子 D.该元素原子M能层共有8个电子  xiaofei821年前1
xiaofei821年前1 -
 爱苹果的女孩 共回答了10个问题
爱苹果的女孩 共回答了10个问题 |采纳率90%B
1年前查看全部
- A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s 2 ;B原子的L电子层的P能级上
A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s 2 ;B原子的L电子层的P能级上有一个空轨道; C元素的基态原子最外层有3个未成对电子,次外层有2个电子; D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为___________ 。C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为__________;分子的VSEPR模型名称为___________;阴离子的立体构型为______________。
(2)G的价电子排布式为___________。用电子式表示化合物AE2的形成过程________。
(3)F与BD易形成配合物F(BD) 5 ,在F(BD) 5 中F的化合价为_______;与BD分子互为等电子体的分子和离子分别为____________和____________(填化学式)。
(4)E有多种含氧酸根①EO - ②EO 2 - ③EO 3 - ④EO 4 - ,其中空间构型为四面体型的是__________。(填序号)
(5)B、C、D、E原子相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子:______________________(写分子式) 池水清清1年前1
池水清清1年前1 -
 djdudan 共回答了17个问题
djdudan 共回答了17个问题 |采纳率82.4%1年前查看全部
- 铁是26号元素,铁原子的M电子层有14个电子,则其外围电子排布式为 A 4s2 B 3d54s2 C 3d64s2 D
铁是26号元素,铁原子的M电子层有14个电子,则其外围电子排布式为 A 4s2 B 3d54s2 C 3d64s2 D 3p63d6
 cleve1年前3
cleve1年前3 -
 cdl512 共回答了21个问题
cdl512 共回答了21个问题 |采纳率90.5%C
Fe是过渡元素,外围电子不仅仅是最外层电子,其实就是它的价电子1年前查看全部
- 比较氮原子外围电子排布式的两种情况
比较氮原子外围电子排布式的两种情况
1:2S轨道排满,2P轨道有一个成对电子和一个未成对电子
2:2S排满,2P上排三个轨道,都为未成对电子
哪一种能量较低,为什么? jianyao1231年前2
jianyao1231年前2 -
 微笑的阿紫 共回答了10个问题
微笑的阿紫 共回答了10个问题 |采纳率90%第二情况能量低
洪特规则:在能量相等的轨道上,自旋平行的电子数目最多时,原子的能量最低.所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道.1年前查看全部
- X、Y、Z、W、Q五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子外围电子排布式为ns n np 2
X、Y、Z、W、Q五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子外围电子排布式为ns n np 2n ,W原子核外的M层中只有两对成对电子,Q的核电荷数是Z与W的核电荷数之和.请回答下列问题:
(1)X、W的元素符号依次为______、______;
(2)写出Y 2 的电子式______;
(3)WZ 2 与XZ 2 分子的空间结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式);
(4)Q在元素周期表______区(填s、p、d、ds、f),其外围电子排布式为______,在形成化合物时它的最高化合价为______. 不穿ll不敢上1年前1
不穿ll不敢上1年前1 -
 楚江春夜 共回答了19个问题
楚江春夜 共回答了19个问题 |采纳率94.7%X、Y、Z、W、Q五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,故L层有4个电子,故X为C元素;Z原子外围电子排布式为ns n np 2n ,s能级最多容纳2个电子,故Z原子外围电子排布式为2s 2 2p 4 ,故Z为O元素;Y的原子序数介于C、O元素之间,故Y为N元素;W原子核外的M层中只有两对成对电子,则外围电子排布式为3s 2 3p 4 ,故W为S元素;Q的核电荷数是Z与W的核电荷数之和,故Q的核电荷数为8+16=24,为Cr元素.
(1)由上述分析可知,X为C元素,W为S元素.
故答案为:C;S.
(2)Y为N元素,氮气分子中N原子之间形成3对共用电子对,电子式为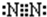 .
.
故答案为: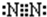 .
.
(3)WZ 2 为SO 2 ,杂化轨道数为
6
2 =3,采取sp 2 杂化,含有1对孤对电子,故空间结构为V形;XZ 2 为CO 2 ,杂化轨道数为
4
2 =2,采取sp杂化,没有对孤对电子,故空间结构为直线型;SO 2 是极性分子,CO 2 是非极性分子,水是极性分子,根据形似相溶原理,SO 2 在水中的溶解度较大.
故答案为:V形;直线型;SO 2 .
(4)Q的核电荷数为24,是Cr元素,处于周期表第四周期第ⅥB族,在元素周期表d区,其外围电子排布式为 3d 5 4s 1 ,在形成化合物时它的最高化合价为+6价.
故答案为:d;3d 5 4s 1 ;+6.1年前查看全部
- 若某原子在处于能量最低状态时,外围电子排布式为4d 3 5s 2 ,则下列说法不正确的是( ) A.该元素原子最外层共
若某原子在处于能量最低状态时,外围电子排布式为4d 3 5s 2 ,则下列说法不正确的是( ) A.该元素原子最外层共有2个电子 B.该元素原子核外共有5个电子层 C.该元素原子的M能层共有18个电子 D.该元素原子处于能量最低状态时,原子中共有5个未成对电子  sy8687121年前1
sy8687121年前1 -
 山上的老狐狸 共回答了18个问题
山上的老狐狸 共回答了18个问题 |采纳率88.9%A.最外层电子数为5s 2 ,说明最外层共有2个电子,故A正确;
B.最大能级为5s,说明原子核外共有5个电子层,故B正确;
C.该元素原子的M能层共有2×3 2 =18个电子,故C正确;
D.该元素原子处于能量最低状态时,原子中未成对电子应为4d 3 的电子,为3个,故D错误.
故选D.1年前查看全部
- X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的外围电子排布式为nS n nP n+2 。
X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的外围电子排布式为nS n nP n+2 。Z原子的核电荷数是最外层电子数的三倍。下列说法正确的是
A.原子序数由大到小的顺序为Z<Y<X B.Y元素最高价氧化物对应水化物的化学式可表示为H 3 YO 4 C.3种元素的气态氢化物中Z的气态氢化物最稳定 D.原子半径由大到小的顺序为Z>Y>X  钱涌南1年前1
钱涌南1年前1 -
 又是一个星期五 共回答了23个问题
又是一个星期五 共回答了23个问题 |采纳率82.6%1年前查看全部
- 某基态原子的外围电子排布式为4d1 5s2 ,则
某基态原子的外围电子排布式为4d1 5s2 ,则
A该原子最外层有3个电子
B其原子核外有5个电子层
C该元素M层公8个电子 jxzxd88871年前3
jxzxd88871年前3 -
 cc的鲜花 共回答了25个问题
cc的鲜花 共回答了25个问题 |采纳率92%B 正确 ,本题考查电子的排布中同层电子的能量高低 从4d1 推断该元素为过渡元素 M层应该是18个电子 5s2说明共5层,最外层2
所以该元素的电子排布 2、8、18、9、2 9说明4层是4S2、4P6、4D11年前查看全部
- D元素的+2价阳离子的3d亚层半充满,则D的元素符号为(),D原子的外围电子排布式为()
D元素的+2价阳离子的3d亚层半充满,则D的元素符号为(),D原子的外围电子排布式为()
是正2价,不是正3价 apple_R1年前1
apple_R1年前1 -
 yang002468 共回答了20个问题
yang002468 共回答了20个问题 |采纳率80%D的元素符号为(Mn),D原子的外围电子排布式为(3d^5 4s^2 )
希望我的回答能对你的学习有帮助!1年前查看全部
- 外围电子排布式有具体的定义么?是就等于最外层电子数,还是怎么?
 白兔赤乌1年前2
白兔赤乌1年前2 -
 meizi030975 共回答了21个问题
meizi030975 共回答了21个问题 |采纳率90.5%外围电子排布式:是指将过渡元素原子的电子排布式中符合稀有气体的原子的电子排布的部分(原子实)或主族、0族元素的内层电子排布省略后剩下的式子.
如Cl:1s2 2s2 2p6 3s2 3p5将"1s2 2s2 2p6"(Ne的电子排布式)省略,"3s2 3p5"即为氯原子的外围电子排布式.同理,K原子的外围电子排布式为4s1(省略了1s2 2s2 2p6 3s2 3p6)、Fe原子外围电子排布式为
3d6 4s2(省略了1s2 2s2 2p6 3s2 3p6).
在化学反应中发生变化的是外围电子,而“原子实”不受影响,外围电子排布式能更简捷地、直接地反映原子的电子层结构.1年前查看全部
- 高中化学关于铬原子的外围电子排布式
高中化学关于铬原子的外围电子排布式
3d^5,4s^1和3d^4,4s^2两者哪种状态的能量较低,书上答案是前者.但前者遵循构造原理吗?我觉得4s能量低应该应该优先排满4s呀
铬原子外围电子排布的实际情况是什么?是半充满? jutang1年前2
jutang1年前2 -
 小豆因果 共回答了14个问题
小豆因果 共回答了14个问题 |采纳率92.9%铬外围电子式是3d5 4s1铬外层电子从内层开始排布,内层全部排满后轮到能量相对更低的4S,然后才是3d,但原子外层电子排布遵循3个原则(泡利不相容、能量最低、红特规则),虽然先排布能量低的轨道,但还有一个原理是:原...1年前查看全部
- 我想知道Ca离子和S离子的原子序数和电子排布式 另请问它们为什么没有外围电子排布式?
我想知道Ca离子和S离子的原子序数和电子排布式 另请问它们为什么没有外围电子排布式?
另外我想问下有4个电子层,最外层有2个电子的元素有哪些 他们的元素符号是什么
(只要写出它们的元素符号就行) yuanshidian1年前1
yuanshidian1年前1 -
 贪玩一族 共回答了10个问题
贪玩一族 共回答了10个问题 |采纳率70%20 16
(+20)288
(+16)288
Ca Sc Ti V Mn Fe Co Ni Zn1年前查看全部
- 下表为长式周期表的一部分,其中的序号代表对应的元素。 (1)写出上表中元素⑨原子的外围电子排布式__________。
下表为长式周期表的一部分,其中的序号代表对应的元素。 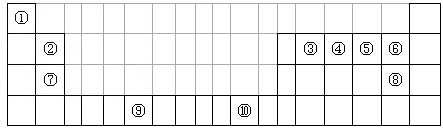
(1)写出上表中元素⑨原子的外围电子排布式__________。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为__________杂化;元素⑦与⑧形成的化合物的晶体类型是__________。
(3)元素④的第一电离能__________元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式__________(各写一种)。
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为 __________。
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为__________;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。
 weiweiweiting1年前1
weiweiweiting1年前1 -
 点点14 共回答了18个问题
点点14 共回答了18个问题 |采纳率94.4%(1)3d 5 4s 1
(2)sp 2 ;离子晶体
(3)> ; 三角锥形;CO, C 2 2-
(4)HF气态时会形成(HF)n分子(或HF分子间会形成氢键)
(5)4Mg+10HNO 3 =4Mg(NO 3 ) 2 +NH 4 NO 3 +3H 2 O
(6)Cu 2+ +4NH 3 =[Cu(NH 3 ) 4 ] 2+ 或 Cu 2+ +2OH - =Cu(OH) 2 ↓ ,Cu(OH) 2 +4NH 3 =[Cu(NH 3 ) 4 ] 2+ +OH - ;21年前查看全部
- (12分)(1)下列原子的外围电子排布式(或外围轨道表示式)中,那一种状态的能量较低?并指出处于能量较低状态时原子中的未
(12分)(1)下列原子的外围电子排布式(或外围轨道表示式)中,那一种状态的能量较低?并指出处于能量较低状态时原子中的未成对电子数

(2)31号元素镓(Ga)是半导体材料之一。
①写出镓原子的电子排布式,指出镓元素在元素周期表中的位置。
②写出镓元素的最高价氧化物、氯化物的化学式。 缘始人1年前1
缘始人1年前1 -
 cyolj9 共回答了26个问题
cyolj9 共回答了26个问题 |采纳率80.8%(1)①B 3个 ②A 1 ③A 6个(共6分)
(2)①1S 2 2S 2 2P 6 3S 2 3P 6 3d 10 4S 2 4P 1 (2分)
第四周期ⅢA族(2分)
②Ga 2 O 3 GaCl 3 (2分)
(1)①因为轨道中的电子处于全充满或半充满是稳定的,B稳定,其中未成对电子数3个,答案选B。
②3s的轨道的能量低于3p的,能量越低越稳定,A正确,其中未成对电子数是1个,答案选A。
③因为轨道中的电子处于全充满或半充满是稳定的,A正确,其中未成对电子数是6个,答案选A。
(2)①根据构造原理可知,镓原子的电子排布式为1S 2 2S 2 2P 6 3S 2 3P 6 3d 10 4S 2 4P 1 ,所以镓元素在元素周期表中的位置第四周期ⅢA族。
②第ⅢA元素的最高价是+3价,所以最高价氧化物、氯化物的化学式分别是Ga 2 O 3 、GaCl 3 。1年前查看全部
- 原子外围电子排布式 与 价电子排布式的关系
原子外围电子排布式 与 价电子排布式的关系
麻烦分主族元素和副族元素来回答 sand200620061年前1
sand200620061年前1 -
 nicoandyu 共回答了18个问题
nicoandyu 共回答了18个问题 |采纳率94.4%原子核外电子指的是核外面所有的电子,而价电子一般来说,对于主族元素就是最外层电子数,而对副族来说,价电子可能是最外层电子以外,还包括次外层和倒数第三层的电子.例如:Na 它的价电子就是它的最外层电子数,即1个,其外围轨道排布式为:1S2 2S22P6 3S1;它的价电子排布式为:3S1(即最外层电子只有1个) 而过渡元素例如Fe,其外围轨道排布式为:1S2 2S22P6 3S23P6 4S2 3d6;它的价电子排布式为:4S2 3d6(你可以参看元素周期表)1年前查看全部
- 元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为________;一种铜金合金晶体具有立方最密
元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为________;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是________.
 gyzh83101年前1
gyzh83101年前1 -
 sos_anita 共回答了27个问题
sos_anita 共回答了27个问题 |采纳率81.5%Cu原子核外有29个电子,其核外电子排布式为[Ar]3d104s1,Au与Cu同族,则Au原子的外围电子排布式为5d106s1.铜金合金晶体具有立方最密堆积结构,晶胞中Cu原子处于面心、Au原子处于顶点,则每个晶胞中含有Cu原子个数为1/2 ×6=3个,含有Au原子个数为1/8 ×8=1个,故Cu、Au原子个数比为3∶1.铜金合金属于金属晶体,原子之间的作用力为金属键.1年前查看全部
大家在问
- 1求2道几何题的解 1.若AD和A'D'分别为两三角形之高,角1=角1′,角2=角2′,试证三角
- 2长江三峡建成后,为了保持水道航运畅通,在大呗边上在建一个船闸,它是世界上最大的船闸,全长6.4千米,约
- 3已知AD是△ABC的高∠B=2∠BAD=4∠DAC求∠C的度数.
- 4在老师的帮助下,同学们利用下面的装置,通过实验证明二氧化碳与氢氧化钾确实发生了化学反应.分别取氢
- 5英语相关念法提问我知道像school是念g那么s在中间的单词如abstain是念t还是d呢
- 6what you 连读的时候发音是|hwɑ tʃ ju|吗,我听出来的不知道准切嘛
- 7.把由7个1、5个0.1和9个|%组成的数写成小数是( ),写成百分数是( ).
- 8一个社交网络有500万个用户,每人每天至少上线一次,在8点到晚上十二点之间成幂率分布,忽略晚十二点到次日早上八点这段时间
- 9已知x>0,y>0,若4x^2+y^2+xy=1,则2x+y的最大值
- 10一道算术题帮忙算算,即化到最简2a乘<(1+x%)的二次方>” 减 a 乘<(1-x%)的二次方>.用初中一年级下册有关
- 11只需列出方程,餐桌桌面是长为160cm,宽为100cm的长方形.妈妈准备设计一块桌布,面积是桌面的2倍,且使四周垂下的边
- 12complain过去时 过去分词是什么 是complaint吗?
- 13过去时和过去分词过去式和过去分词,谢谢!beatbecomebeginblowbreakbringbuybaildbur
- 14“典藏”一词翻译成英文,最恰当用哪个单词?
- 15一大容器中有水,水中有一小容器,小容器中有石块,若将小容器中的石子拿出,放入大容器的水中,则