铅酸钠的分子式是什么?在这里,铅是几价的?
 我把ss当夜宵2022-10-04 11:39:541条回答
我把ss当夜宵2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 82687378 共回答了13个问题
82687378 共回答了13个问题 |采纳率92.3%- 分子式Na2PbO3
一般以Na2PbO3.3H2O(3水合物)存在
铅为+4价 - 1年前
相关推荐
- 高铁酸钠与高铁酸钾哪个溶解度大
 羲远1年前2
羲远1年前2 -
 与命运交手 共回答了21个问题
与命运交手 共回答了21个问题 |采纳率95.2%高铁酸钠的溶解度比高铁酸钾打
工业上一般都是先制得高铁酸钠
然后在低温下
向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾
可以制备的原因就是因为高铁酸钾溶解度比高铁酸钠小1年前查看全部
- 高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+.已
高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+.已知制取高铁酸钠的化学方程式为:
2Fe(NO3)3+16NaOH+3Cl2===2Na2FeO4+6NaNO3+6NaCl+8H2O,回答下列问题:
(1)该反应中________得到电子,表现____________(填“氧化性”或“还原性”),Na2FeO4为________(填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”).
(2)若有1 mol Cl2参加反应,则反应中转移电子的物质的量为________.
(3)Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是
反应物Fe(NO3)3中铁显+3价,生成物Na2FeO4中铁显+6价,Fe(NO3)3中的
Fe3+失去电子,表现还原性,而反应物Cl2中氯显0价,生成物NaCl中氯显-1价,Cl2得到电子,表现氧化性,因铁的化合价反应后升高,故Na2FeO4为氧化产物.
答案 (1)Cl2 氧化性 氧化产物 (2)2 mol (3)六价铁被还原成三价铁,三价铁水解生成氢氧化铁胶体,具有较大的表面积,能吸附杂质而沉降下来达到净水的目的
第2题的计算过程要详细点 pipi79781年前2
pipi79781年前2 -
 zhtlc 共回答了15个问题
zhtlc 共回答了15个问题 |采纳率86.7%解析
反应物Fe(NO3)3中铁显+3价,生成物Na2FeO4中铁显+6价,Fe(NO3)3中的Fe3+失去电子,表现还原性,而反应物Cl2中氯显0价,生成物NaCl中氯显-1价,Cl2得到电子,表现氧化性,因铁的化合价反应后升高,故Na2FeO4为氧化产物.
答案
(1)Cl2 氧化性 氧化产物 、
(2)2 mol
(3)六价铁被还原成三价铁,三价铁水解生成氢氧化铁胶体,具有较大的表面积,能吸附杂质而沉降下来达到净水的目的1年前查看全部
- 在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
A. 高铁酸钠是氧化物
B. 高铁酸钠中铁元素的化合价为+6价
C. 高铁酸钠是一种新型的有机化合物
D. 高铁酸钠是由2个钠元素、1个铁元素、4个氧元素组成的物质 天使ww_58581年前1
天使ww_58581年前1 -
 骆驼ci 共回答了13个问题
骆驼ci 共回答了13个问题 |采纳率100%解题思路:A、氧化物是指含有两种元素且其中一种是氧元素的化合物,由铁酸钠的化学式进行分析判断.
B、根据在化合物中正负化合价代数和为零,结合铁酸钠的化学式进行解答本题.
C、根据含有碳元素的化合物叫有机化合物,简称有机物,据此进行分析判断.
D、利用元素不能用个数进行计数解决此题.A、氧化物是由两种元素组成且含有氧元素的化合物,根据高铁酸钠(Na2Fe04),高铁酸钠由钠、铁、氧三种元素组成,不属于氧化物;故此答案错误.B、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负...
点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;有机物与无机物的区别;有关元素化合价的计算.
考点点评: 本题难度不大,掌握氧化物的特征、有机物的特征、利用化合价的原则计算指定元素的化合价的方法是正确解答本题的关键.1年前查看全部
- (2007•定西)高铁酸钠(Na2FeO4)是一种高效多功能的水处理剂.它和水反应不可能生成( )
(2007•定西)高铁酸钠(Na2FeO4)是一种高效多功能的水处理剂.它和水反应不可能生成( )
A.氧气
B.碳酸钠
C.氢氧化钠
D.氢氧化铁 wolaikankan51881年前1
wolaikankan51881年前1 -
 luankk 共回答了13个问题
luankk 共回答了13个问题 |采纳率76.9%解题思路:本题考查的是质量守恒定律,反应前后元素的种类和质量不变.本题中高铁酸钠(Na2FeO4)与水反应时,反应前有钠、铁、氧、氢四种元素,因此反应后也是钠、铁、氧、氢四种元素,而碳酸钠中有碳元素,因此不可能生成碳酸钠;反应前有氧元素,因此反应后可能生成氧气;反应前有钠、氧、氢元素,因此反应后可能生成氢氧化钠;反应前有铁、氧、氢元素,因此反应后可能生成氢氧化铁.A、反应前有钠、铁、氧、氢四种元素,因此反应后可能生成氧气,故选项错误;
B、高铁酸钠(Na2FeO4)与水反应时,反应前有钠、铁、氧、氢四种元素,因此反应后也是钠、铁、氧、氢四种元素,而碳酸钠中有碳元素,因此不可能生成碳酸钠,故选项正确;
C、反应前有钠、氧、氢元素,因此反应后可能生成氢氧化钠,故选项错误;
D、反应前有铁、氧、氢元素,因此反应后可能生成氢氧化铁,故选项错误;
故选:B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本考点是有关质量守恒定律的实验探究,有关质量守恒定律的考题在中考中经常出现,要抓住要点:五个一定不变,一个一定变.本考点经常出现在选择题、填空题和实验题中.1年前查看全部
- 用高铁酸钠(Na 2 FeO 4 )对河水、湖水消毒,是城市饮用水消毒的新技术。已知制备高铁酸钠的反应为Fe
用高铁酸钠(Na 2 FeO 4 )对河水、湖水消毒,是城市饮用水消毒的新技术。已知制备高铁酸钠的反应为Fe 2 O 3 +3Na 2 O 2 =2Na 2 FeO 4 +Na 2 O,下列说法正确的是
A.Na 2 O 2 既是氧化剂,又是还原剂 B.Fe 2 O 3 在反应中得到电子 C.3 mol Na 2 O 2 参加反应,转移的电子总数为12mol D.Na 2 FeO 4 能消毒杀菌,因其具有强氧化性  stevenshenxn1年前1
stevenshenxn1年前1 -
 bear7 共回答了16个问题
bear7 共回答了16个问题 |采纳率93.8%D
1年前查看全部
- 如何制取氢氧化钠?1.除了电解,氢氧化钙和碳(氢)酸钠,金属钠与水还有什么?最好简单一点2.电解有杂质的食盐水后都用铁电
如何制取氢氧化钠?
1.除了电解,氢氧化钙和碳(氢)酸钠,金属钠与水还有什么?
最好简单一点
2.电解有杂质的食盐水后都用铁电极,过了好几个小时,水没有完全电离,正极铁渐渐变为氯化铁腐蚀,溶液有红色、墨绿色、褐色,过滤后为淡黄色透明液体,问这是什么?是氢氧化钠还是次氯酸钠?加入铝和塑料的混合球后,为什么几乎得不到氢气,如何电解才能得到浓度较高的氢氧化钠? 胡家富1年前3
胡家富1年前3 -
 慕容夫2004 共回答了15个问题
慕容夫2004 共回答了15个问题 |采纳率86.7%最常见的,纯碱和氢氧化钙.
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
土法制烧碱1年前查看全部
- 新型净水剂铁酸钠的化学式是Na 2 FeO 4 ,则该化合物中铁元素的化合价是(
新型净水剂铁酸钠的化学式是Na 2 FeO 4 ,则该化合物中铁元素的化合价是()
A.+2 B.+3 C.0 D.+6  renrendy1年前1
renrendy1年前1 -
 唐玉翔 共回答了17个问题
唐玉翔 共回答了17个问题 |采纳率70.6%D
Na 2 FeO 4 由Na、Fe、O三种元素组成,其中,Na的化合价是+1价,O的化合价为-2价,设Fe的化合价为x,则
(+1)×2+x+(-2)×4=0,x=+61年前查看全部
- 新型净水剂高铁酸钠Na2[小写FeO4[小写〕中铁元素化合价是多少,
 子夜念寒冬1年前2
子夜念寒冬1年前2 -
 maggiemeng87 共回答了31个问题
maggiemeng87 共回答了31个问题 |采纳率83.9%+6
+1*2+x-2*4=0
x=+61年前查看全部
- (2009•肇庆二模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4
(2009•肇庆二模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂.工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
干法制备的主要反应方程为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
则下列有关说法正确的是( )
A.高铁酸钾中铁显+6价
B.湿法中FeO42-是还原产物
C.干法中每生成1mol Na2FeO4 转移4mol电子
D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 bluemen1年前1
bluemen1年前1 -
 dudubear1 共回答了17个问题
dudubear1 共回答了17个问题 |采纳率94.1%解题思路:A、根据化合物中正负化合价的代数和为0进行解答;
B、还原产物是氧化剂被还原得到的产物;
C、化合价升高数=化合价降低数=转移电子数;
D、依据高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂分析.A、根据高铁酸钾的化学式(K2FeO4)可知,设铁元素的化合价为x,则+1×2+x+(-2)×4=0,解得x=+6,故A正确;
B、湿法中FeO42-是氧化产物,故B错误;
C、反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,铁元素化合价升高,每生成2molNa2FeO4,转移电子总数=化合价升高总数=化合价降低总数=8mol,所以每生成1molNa2FeO4共转移4mol电子,同时1molNa2O2变化生成1molO2,化合价升高,转移电子物质的量为2mol,所以共转移电子10mol,故C错误;
D、K2FeO4具有氧化性所以能杀菌,H2S、NH3具有还原性被氧化,高铁酸钾与水反应时生成的Fe(OH)3(胶体)具有净水作用,故D正确;
故选AD.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算;氧化还原反应的计算.
考点点评: 本题考查了氧化还原反应的化合价变化判断,概念分析和电子转移数计算,熟练掌握氧化还原反应的特征是化合价变化是关键.1年前查看全部
- (2009•西城区二模)高铁酸钠是一种新型净水剂,它的化学式为Na2FeO4,高铁酸钠主要通过如下反应制取:2Fe(OH
(2009•西城区二模)高铁酸钠是一种新型净水剂,它的化学式为Na2FeO4,高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O.
(1)物质X的化学式为NaClNaCl.
(2)若某化工厂需要生产332t高铁酸钠,则需要氢氧化钠的质量为多少? ly73771年前1
ly73771年前1 -
 mophyc 共回答了19个问题
mophyc 共回答了19个问题 |采纳率94.7%(1)因为反应前后各元素原子个数相等,X的化学式为NaCl
(2)根据化学方程式,通过物质间的比例关系,可用高铁酸钠的质量计算氢氧化钠的质量:答案为:
设:需要NaOH的质量为x.
2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O
160 332
x 332t
160
x=
332
332t
x=160t
答:需要NaOH的质量为160t.1年前查看全部
- 用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进
用二氧化氯(clo2)、铁酸钠(na2feo4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂cl2对淡水进行消毒是城市饮用水处理新技术.clo2和na2feo4在水处理过程中分别被还原为cl-和fe3+.
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,clo2、na2feo4、cl2三种消毒杀菌剂的消毒效率由大到小的顺序是______>______>______.
(2)na2feo4溶于水会放出一种***气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为______.
(3)工业以ch3oh与naclo3为原料在酸性条件下制取clo2,同时产生co2气体,已知该反应分为两步进行,第一步为2clo3-+2cl-+4h+=2clo2↑+cl2↑+2h2o.
①写出第二步反应的离子方程式______.
②工业生产时需在反应物中加少量cl-,其作用是______.
③生产中会发生副反应clo3-+cl-+h+-cl2↑+h2o(未配平),若测得反应后的混合气体中cl2的体积分数为[3/73],则起始投料时ch3oh与naclo3的物质的量之比为______.
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.clo2也可以看做是亚氯酸(hclo2)和氯酸(hclo3)的混合酸酐.工业上用稍潮湿的kclo3和草酸在60℃时反应制得.某学生用如图所示的装置模拟工业制取及收集clo2,其中a为clo2的发生装置,b为clo2的凝集装置,c为尾气吸收装置.请问: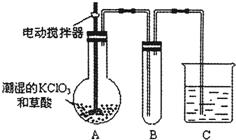
①a部分还应添加温度控制(如水浴加热)装置,b部分还应补充什么装置______;
②c中应装的试剂为______.c中发生反应的化学方程式为:______. porpo_01年前1
porpo_01年前1 -
 nr2a8j 共回答了19个问题
nr2a8j 共回答了19个问题 |采纳率78.9%解题思路:(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,消毒效率分别为[m/67.5]×5、[m/166]×3、[m/71]×2×1;
(2)高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子能发生氧化还原反应生成氧气,同时生成氢氧化铁,氢氧化铁具有吸附性;
(3))①由题中给出的反应物和生成物写出总的离子方程式再叠减第一步的离子方程式得出第二步的离子方程式;
②Cl-为反应的催化剂;
③结合反应的方程式计算;
(4)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应降低温度;
②C为尾气吸收装置,可选择碱来吸收尾气,发生氧化还原反应.(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别为[m/67.5]×5、[m/166]×3、[m/71]×2×1,所以由大到小的顺序为ClO2>Cl2>Na2FeO4,故答案为:ClO2;Cl2;Na2FeO4;
(2)高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子和水反应生成氢氧化铁胶体,胶体具有吸附性是,所以能净水,反应方程式为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑,
故答案为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑;
(3)①由题中给出的反应物和生成物写出总的离子方程式再叠减第一步的离子方程式得出第二步的离子方程式为CH3OH+3Cl2+H2O=6Cl-+CO2+6H+,
故答案为:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
②通过分析离子方程式得出,Cl-没有参加反应,作为催化剂,故答案为:催化剂;
③工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,(一般用硫酸酸化)涉及反应的化学方程式为①CH3OH+6NaClO3+3H2SO4→6ClO2+CO2+3Na2SO4+5H2O,生产中会发生副反应②ClO3-+5Cl-+6H+=3Cl2↑+3H2O,生成气体为ClO2、CO2和Cl2,若测得反应后的混合气体中Cl2的体积分数为[3/73],由①可知,如ClO2为60mol,则CO2为10mol,Cl2为3mol,则需要10molCH3OH,(60+1)molNaClO3,则二者体积之比为10:61=1:6.1,
故答案为:1:6.1;
(4)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应补充(冰水)冷凝装置,故答案为:(冰水)冷凝;
②C为尾气吸收装置,可选择NaOH溶液来吸收尾气,发生氧化还原反应为2ClO2+2NaOH═NaClO2+NaClO3+H2O,
故答案为:NaOH溶液;2ClO2+2NaOH═NaClO2+NaClO3+H2O.点评:
本题考点: 制备实验方案的设计;氯、溴、碘及其化合物的综合应用;性质实验方案的设计.
考点点评: 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.1年前查看全部
- 干粉灭火器中的干粉主要成分是碳酸氢钠,受热时分解为酸钠,二氧化碳和水。则在灭火过程中,二氧化碳的作用是〈 〉;水的作用是
干粉灭火器中的干粉主要成分是碳酸氢钠,受热时分解为酸钠,二氧化碳和水。则在灭火过程中,二氧化碳的作用是〈 〉;水的作用是〈 〉?
 大海的心涂鸦1年前1
大海的心涂鸦1年前1 -
 半坛醋 共回答了1个问题
半坛醋 共回答了1个问题 |采纳率100%隔绝氧气 降低着火点1年前查看全部
- (2012•朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧
 (2012•朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
(2012•朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: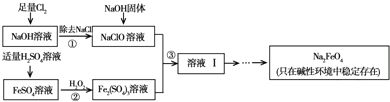
回答下列问题:
(1)氢氧化钠的电子式是______.
(2)经过步骤①后,加入NaOH固体的原因是______.
(3)步骤②反应的离子方程式是______.
(4)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为______.
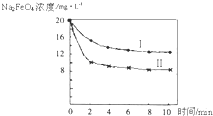
(5)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH______(填“高”或“低”).
(6)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的______(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是______(答出两点即可). gou7891年前1
gou7891年前1 -
 daocaoren_home 共回答了23个问题
daocaoren_home 共回答了23个问题 |采纳率78.3%解题思路:(1)依据氢氧化钠的化学键的形成过程和电子式书写方法写出电子式;
(2)加入氢氧化钠可以调节溶液显碱性,易生成高铁酸钠;
(3)依据流程分析判断,步骤②是加入过氧化氢在酸性溶液中氧化亚铁离子为铁离子的过程,依据电子守恒、电荷守恒和原子守恒反应的离子方程式;
(4)碱溶液中次氯酸根离子氧化铁离子为高铁酸根离子,反应的离子方程式依据氧化还原反应电子守恒和原子守恒配平得到;
(5)依据高铁酸根离子发生的还原反应分析判断;
(6)依据高铁酸钠和氯气得到电子转化关系计算分析,根据高铁酸钠是强氧化剂,得到电子生成氢氧化铁胶体分析判断;(1)氢氧化钠是两种化合物,由钠离子和氢氧根离子构成,氢氧根中氧原子和氢原子形成共价键,电子式为:
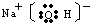 ;
;
故答案为: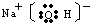
(2)步骤①是制备次氯酸钠的过程,加入氢氧化钠目的是调节溶液显碱性,因为Na2FeO4只在碱性环境中稳定存在;
故答案为:Na2FeO4只在碱性环境中稳定存在,所以加入氢氧化钠可以调节溶液显碱性;
(3)步骤②是加入过氧化氢在酸性溶液中氧化亚铁离子为铁离子的过程,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)反应③是碱溶液中次氯酸根离子氧化铁离子为高铁酸根离子,反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(5)依据高铁酸钠在碱性溶液中稳定存在,发生的反应为:FeO42-+3e-+4H2O⇌Fe(OH)3+5OH-,污水的PH越高平衡逆向进行,PH越小平衡正向进行,依据图象分析Ⅱ先达到平衡需要的时间短,反应速率快,说明污水PH小,曲线I比曲线II对应的污水的PH高;
故答案为:高;
(6)FeO42-+3e-+4H2O⇌Fe(OH)3+5OH-,单位质量得到电子[3/166]=0.018
Cl2+2e-=2Cl-,单位质量得到电子[2/71]=0.028,所以Na2FeO4的消毒效率比氯气低,高铁酸钠代替氯气作净水消毒剂,利用氧化性起到杀菌消毒作用,利用生成的氢氧化铁胶体起到净水作用;
故答案为:低,既能消毒杀菌又能净水(或无毒或方便保存等);点评:
本题考点: 制备实验方案的设计;铁盐和亚铁盐的相互转变.
考点点评: 本题考查了物质制备实验流程的分析判断,主要是物质性质,题干信息的应用,离子方程式 的书写是解题关键,题目难度中等.1年前查看全部
- 一种制备铁酸钠的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O
一种制备铁酸钠的方法可用化学方程式表示如下:2feso4+6na2o2=2na2feo4+2na2o+2na2so4+o2↑正确的是
na2feo4是一种高效多功能水处理剂,应用前景广阔.一种制备铁酸钠的方法可用化学方程式表示如下:2feso4+6na2o2=2na2feo4+2na2o+2na2so4+o2↑,对此反应下列说法中正确的是( )
a.na2o2在反应中只作氧化剂
b.na2feo4既是氧化物又是还原产物
c.o2是还原产物
d.2molfeso4发生反应时,反应***有8mol电子转移
书上解析式6mol转移 不能理解
还有一道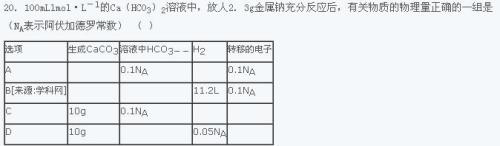
hco3-不应该是0.1mol吗,为什么解析上说没有了? _ǒ_1年前1
_ǒ_1年前1 -
 抽抽_在在hero 共回答了18个问题
抽抽_在在hero 共回答了18个问题 |采纳率94.4%应该是10mol电子转移答案错了:亚铁离子→6价铁离子 转移2*4mol电子,一价氧离子→氧气 2mol电子 总共10mol电子
第2题如果忽略温度影响的话应该还剩下0.1molHCO3- 题目应该是没写出来而已1年前查看全部
- 求炭酸钠与盐酸混合的离子方程式
 bright12231年前4
bright12231年前4 -
 tswan 共回答了17个问题
tswan 共回答了17个问题 |采纳率94.1%盐酸 少量不足 CO32-+H+=HCO3-
盐酸过量之后 CO32-+2H+=CO2↑+H2O
PS 重点在这儿
要是盐酸记不过量 也不足量的话 就是 两个式子的某种代数和
举例 第一个方程式 两边同时乘以2 第二个同时乘以3 然后再相加
2CO32-+8H+ + 3CO32-=2HCO3-+3CO2↑ +3H2O
所以必须知道的是条件 要门过量 要么不足 要么就告诉盐酸 碳酸钠的物质的量之比 否则无法出方程式
类似的还有 硝酸 与 铁的反应 等等
希望能够帮忙 不明白可以Hi一下 哟1年前查看全部
- 高铁酸钠(NA2FEO4)是一种高效的饮用水处理剂,工业上可由下列方法制得
高铁酸钠(NA2FEO4)是一种高效的饮用水处理剂,工业上可由下列方法制得
Fe2o3+3Na2O2=2Na2FeO4+Na2O 生成一mol Na2FeO4,有6mol电子转移.这个应该怎么判断,铅球详解
 炭烧虾1年前1
炭烧虾1年前1 -
 我们三儿 共回答了24个问题
我们三儿 共回答了24个问题 |采纳率100%错了,应该是 每生成1 mol Na2FeO4转移 3 mol e-
Fe的化合价升高 +3→+6,Fe2O3中有2个Fe,所以Fe2O3失去6 e-,
O的化合价降低 -1→-2,3 Na2O2中有6个Na,所以Na2O2得到6 e-,
即反应转移电子数为 6e-,
每生成2 mol Na2FeO4转移 6 mol e-,所以 每生成1 mol Na2FeO4转移 3 mol e-1年前查看全部
- 高铁酸钠(Na2FeO4)中铁元素的化合价为?
 njsn1年前2
njsn1年前2 -
 春风风人夏雨雨人 共回答了16个问题
春风风人夏雨雨人 共回答了16个问题 |采纳率75%NA2FEO4
2NA+
4O2-
2-8=-6
FE6+铁的化合价是正六价.1年前查看全部
- 高铁酸钠的净水离子方程式高铁酸钠加入水中,能杀死微生物和细菌,并能产生类似明矾的净水作用,其离子反应方程式是?
 huangding1年前1
huangding1年前1 -
 4037790 共回答了20个问题
4037790 共回答了20个问题 |采纳率90%还原剂是什么没有告知,只能写半反应式
(FeO4)2- + 8H+ + 3e→ Fe3+ + 4H2O
还原产物Fe3+可以水解生成Fe(OH)3胶体,吸附杂质净水1年前查看全部
- 质量为w的碳酸氢钠和碳酸氢铵加热放出气体后质量为以前的一半(2分之w) 问碳氢酸钠与碳酸氢铵质量比
 noelhelen1年前1
noelhelen1年前1 -
 MaliyaQ 共回答了18个问题
MaliyaQ 共回答了18个问题 |采纳率88.9%设加热后生成的 Na2CO3 的质量为x
NH4HCO3 ==NH3 + H2O + CO2 (生成的全部是气体)
2NaHCO3 == Na2CO3 + H2O + CO2
168 106
y=168x/106 x
则NH4HCO3的质量为2x-168x/106
碳氢酸钠与碳酸氢铵质量比为:168x/106 / (2x-168x/106)=42/111年前查看全部
- 炭酸氢钠与哪些物质反应可生成炭酸钠?
 adsnld1年前1
adsnld1年前1 -
 张先映 共回答了17个问题
张先映 共回答了17个问题 |采纳率94.1%炭酸氢钠受热就会分解成炭酸钠,炭酸氢钠溶于水也会生成炭酸氢钠1年前查看全部
- 在碱性溶液中用NACLO氧化Fe(OH)3生成高铁酸钠,NACL和另一种常见化合物,求离子方程.
在碱性溶液中用NACLO氧化Fe(OH)3生成高铁酸钠,NACL和另一种常见化合物,求离子方程.
另外请解释下为什么铁(高铁酸钠)能到+6价呢,最高价不是+3价么. 公主伊佃园1年前2
公主伊佃园1年前2 -
 双重喜庆OK 共回答了20个问题
双重喜庆OK 共回答了20个问题 |采纳率85%2Fe(OH)3+3ClO-+4OH-=2FeO4 2-+3Cl-+5H2O
过度金属元素,很多都能生成高价态的化合物,比如高锰酸钾,通常的锰离子也就只有2价1年前查看全部
- (2014•松江区一模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂.湿法制备的离子反应方程式:2Fe(
(2014•松江区一模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂.湿法制备的离子反应方程式:2Fe(OH)3+3ClO-+4OH-→2FeO42-+3Cl-+5H2O;干法制备化学反应方程式:2FeSO4+4Na2O2→2Na2FeO4+2Na2SO4.有关分析错误的是( )
A.等物质的量Na2FeO4氧化能力优于次氯酸钠
B.湿法中氢氧化铁被氧化
C.干法中每生成1mol Na2FeO4转移3mol电子
D.高铁酸钠的氧化性大于次氯酸钠 欢喜虫虫1年前1
欢喜虫虫1年前1 -
 等待你的猫 共回答了21个问题
等待你的猫 共回答了21个问题 |采纳率90.5%解题思路:A.根据等物质的量的氧化剂得电子数目判断;
B.湿法中铁元素化合价升高;
C.铁元素化合价由+2价升高到+6价;
D.根据氧化剂氧化性大于氧化产物的氧化性判断.A.用作净水剂时,1molNa2FeO4可到3mol电子,被还原生成Fe(OH)3,1molNaClO得2mol电子,被还原生成Cl-,则等物质的量Na2FeO4氧化能力优于次氯酸钠,故A正确;
B.湿法中铁元素化合价升高,被氧化,故B正确;
C.干法制备中铁元素化合价由+2价升高到+6价,则每生成1mol Na2FeO4转移4mol电子,故C错误;
D.氧化还原反应中,氧化剂氧化性大于氧化产物的氧化性,可知次氯酸钠的氧化性较强,故D错误.
故选CD.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应知识,为高考高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度解答该类题目,难度不大.1年前查看全部
- (2005•乐山一模)铁酸钠(Na2FeO4)是一种新型净水剂,制取铁酸钠的离子反应方程式为:Fe3++OH-+Cl2→
(2005•乐山一模)铁酸钠(Na2FeO4)是一种新型净水剂,制取铁酸钠的离子反应方程式为:Fe3++OH-+Cl2→FeO
+Cl-+H2O,该反应的离子方程式中H2O的化学计量数是( )2−4
A.4
B.6
C.10
D.8 lemon01091年前1
lemon01091年前1 -
 紫风傲剑狂刀 共回答了21个问题
紫风傲剑狂刀 共回答了21个问题 |采纳率90.5%解题思路:先分析化合价变化,铁元素化合价:+3价→+6,化合价升高了3价;氯元素化合价:0→-1,化合价降低了1价,根据化合价升高降低相等计算出铁离子和氯离子的化学计量数,再根据电荷守恒计算出氢氧根离子的计量数,最后根据氢原子守恒计算出水的化学计量数.反应Fe3++OH-+Cl2→FeO42-+Cl-+H2O中,铁元素化合价:+3价→+6,化合价升高了3价;氯元素化合价:0→-1,Cl2参加反应,化合价降低了1×2价,化合价变化的最小公倍数为6,所以Fe3+的化学计量数为2、Cl2的化学计量数为3,根据氯原子守恒,Cl-的计量数为6,即2Fe3++OH-+3Cl2→2FeO42-+6Cl-+H2O,根据电荷守恒,OH-的计量数为16,根据氢原子守恒,水的化学计量数为为:[16/2]=8,
故选D.点评:
本题考点: 离子方程式的书写;氧化还原反应.
考点点评: 本题考查了氧化还原反应的配平,题目难度中等,注意配平氧化还原反应中电子守恒、电荷守恒的应用,该题是高考中的高频题,侧重对学生能力的培养和训练;该题有助于培养学生分析问题、解决问题的能力及灵活应用所学知识能力.1年前查看全部
- 关于叠氮酸钠3molNaN3受撞击会生成4mol氮气和一种离子化合物Na3N,下列有关叙述不正确的是:a,NaN3受撞击
关于叠氮酸钠
3molNaN3受撞击会生成4mol氮气和一种离子化合物Na3N,下列有关叙述不正确的是:
a,NaN3受撞击时,NaN3既是氧化剂又是还原剂
b,NaN3跟水反应时有氨气生成
c,NaN3中N3-比Na+例子半径大
d,NaN3中,既存在离子键又存在非极性共价键
请问为什么错
对的有为什么对? 嘿嘿我是丫丫1年前2
嘿嘿我是丫丫1年前2 -
 雨中男子 共回答了25个问题
雨中男子 共回答了25个问题 |采纳率92%叠氮化钠的结构式是Na+[N=N=N]-
其中氮元素的化合价不是负三价,所以水解后不会生成氨气1年前查看全部
- 笨钾酸钠和山梨酸钾使用上的区别虽然两者都是防腐剂但不太清楚两者间的区别以及作用,我看很多食品和别的一些用品都会加入两者中
笨钾酸钠和山梨酸钾使用上的区别
虽然两者都是防腐剂但不太清楚两者间的区别以及作用,我看很多食品和别的一些用品都会加入两者中的一种但为什么呢两者的特性是什么谁能说明下谢谢 流泪风1年前1
流泪风1年前1 -
 如烟浩缪 共回答了19个问题
如烟浩缪 共回答了19个问题 |采纳率78.9%笨钾酸钠是一种防腐剂,多见于一些腌制品.如香肠,榨菜,豆腐干等.大量摄入对人有害.我们应该尽量少吃那些含笨钾酸钠高的食品
我们在选购包装(或罐装)食品时,配料一项中常常看到“山梨酸”或“山梨酸钾”的字样,人们往往会误认为可能是水果“梨”的成份.其实他们是常用的食品添加剂!不管他们对人体有没有危害,明明白白的消费确是非常必要的,以下是有关山梨酸、山梨酸钾的有关资料仅供参考:
山梨酸 (化学名称:2,4-己二烯酸 分子式:C6H8O2 〕
山梨酸钾 (化学名称:2,4-己二烯酸钾〕 分子式:C6H7KO2 )
山梨酸、山梨酸钾性能、用途相似:
【简介】山梨酸是国际粮农组织和卫生组织推荐的高效安全的防腐保鲜剂,广泛应用于食品、饮料、烟草、农药、化妆品等行业,作为不饱和酸,也可用于树脂、香料和橡胶工业.
【防腐性】
山梨酸(钾)能有效地抑制霉菌,酵母菌和好氧性细菌的活性,还能防止肉毒杆菌、葡萄球菌、沙门氏菌等
有害微生物的生长和繁殖,但对厌氧性芽孢菌与嗜酸乳杆菌等有益微生物几乎无效,其抑止发育的作用比杀菌作
用更强,从而达到有效地延长食品的保存时间,并保持原有食品的风味.
其防腐效果是同类产品苯甲酸钠的5-10倍.
【安全性】
由于山梨酸(钾)是一种不饱和脂肪酸(盐)它可以被人体的代谢系统吸收而迅速分解为二氧化碳和
水,在体内无残留.
ADI 0-25mg/kg (以山梨酸计,FAO/WHO 1994)
LD50 4920mg/kg (大鼠、经口)
GRAS (FDA,182.3640 1994)
其毒性仅为食盐的1/2,是苯甲酸钠的1/40
【稳定性】
山梨酸(钾)在密封状态下稳定,暴露在潮湿的空气中易吸水,氧化而变色.山梨酸钾对热稳定性较好,分
解温度高达270℃.
【使用范围】
目前已广泛地用于食品、饮料、酱菜、烟草、医药、化妆品、农产品、饲料等行业中,从发展趋势看,其应
用范围还在不断扩大.
山梨酸(钾)属酸性防腐剂,在接近中性(PH6.0-6.5)的食品中仍有较好的防腐作用,而苯甲酸(钠)的防腐
效果在PH>4时,效果已明显下降,且有不良味道.
【使用方式】
在使用时可以用直接添加,喷洒,浸渍,干粉喷雾,在包装材料上处理等多种方式.1年前查看全部
- 五氰一羰基合铁酸钠 和 氯化二氯三氨一水合钴 的化学式!
 项五项1年前1
项五项1年前1 -
 qazwsxedc123321 共回答了16个问题
qazwsxedc123321 共回答了16个问题 |采纳率87.5%五氰一羰基合铁酸钠:Na2[Fe(CN)5(CO)]
氯化二氯三氨一水合钴 [CoCl2(NH3)3(H2O)]Cl1年前查看全部
- 在水的净化处理中,铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于铁酸钠说法正确的是( )
在水的净化处理中,铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于铁酸钠说法正确的是( )
A.铁酸钠属于氧化物
B.河水用铁酸钠处理后变为纯水
C.铁酸钠中铁元素的化合价为+6价
D.铁酸钠中铁元素的化合价为+3价 兰若寺的高小胖1年前1
兰若寺的高小胖1年前1 -
 8美丽8 共回答了26个问题
8美丽8 共回答了26个问题 |采纳率92.3%解题思路:A、氧化物是指含有两种元素且其中一种是氧元素的化合物,由铁酸钠的化学式进行分析判断;
B、根据纯净物与混合物的区分方法进行分析判断;
C、根据化合价的计算方法判断;
D、根据在化合物中正负化合价代数和为零,结合铁酸钠的化学式进行解答本题.A、氧化物是由两种元素组成且含有氧元素的化合物,根据铁酸钠(Na2Fe04),铁酸钠由钠、铁、氧三种元素组成,不属于氧化物;故A错;
B、用铁酸钠处理后的河水中含有可溶性的钙镁化合物等,属于混合物;故B错;
C、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可知铁酸钠中铁元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6,故C正确;
D、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可知铁酸钠中铁元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6;故D错.
故选C.点评:
本题考点: 从组成上识别氧化物;有关元素化合价的计算.
考点点评: 本题难度不大,掌握氧化物的特征、纯净物与混合物的区分方法、有机物的特征、利用化合价的原则计算指定元素的化合价的方法是正确解答本题的关键.1年前查看全部
- 请写一下这个方程式的化合价,指出氧化剂和还原剂,若其中有1mol电子转移,生成高铁酸钠质量为
请写一下这个方程式的化合价,指出氧化剂和还原剂,若其中有1mol电子转移,生成高铁酸钠质量为
2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O 凉拌冰淇淋1年前3
凉拌冰淇淋1年前3 -
 lx000 共回答了22个问题
lx000 共回答了22个问题 |采纳率90.9%只看氯气就行了,3个氯气都变成6个氯离子,氯气为氧化剂,硝酸铁变成高铁酸钠,铁升价所以硝酸铁是还原剂.高铁酸钠的相对分子质量为2×23﹢56×2﹢16×4=222.该反应转移6mol电子,所以进行1/6的反应即;高铁酸钠的质量为222×1/6=371年前查看全部
- (2006•自贡模拟)1702年德国化学家Georg Stahl最先发现并报道了高铁酸钠,随后对高铁酸钠的研究
(2006•自贡模拟)1702年德国化学家Georg Stahl最先发现并报道了高铁酸钠,随后对高铁酸钠的研究报道一直没有中断过.研究表明Na2FeO4是一种高效多功能水处理剂,应用前景广阔.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑对此反应下列说法中不正确的是( )
A.O2是氧化产物
B.Na2FeO4既是氧化产物又是还原产物
C.2mol FeSO4发生反应时,共有10mol电子转移
D.Na2O2在反应中只作氧化剂 xuql1年前1
xuql1年前1 -
 coldstars81 共回答了11个问题
coldstars81 共回答了11个问题 |采纳率100%解题思路:反应2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑中,Fe元素化合价由+2价变为+6价,升高,被氧化,反应中Na2O2中的O元素化合价由-1价变为0价和-2价,既升高,又降低,Na2O2既是氧化剂又是还原剂,以此解答该题.A.该反应中,过氧化钠中氧元素的化合价由-1价变为氧气中的0价,所以这部分过氧化钠作还原剂,则氧气是氧化产物,故A正确;
B.反应中Na2O2为氧化剂,FeSO4在反应中作还原剂,则Na2FeO4既是氧化产物又是还原产物,故B正确;
C.2molFeSO4发生反应时,化合价升高的有Fe和O,其中Fe化合价升高2×(6-2)=8,需要4molNa2O2为氧化剂,另2molNa2O2自身发生氧化还原反应,生成1molO2,转移电子2mol电子,共转移10mol电子,故C正确;
D.该反应中Na2O2中的O元素化合价由-1价变为0价和-2价,既升高,又降低,Na2O2既是氧化剂又是还原剂,故D错误;
故选:D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,易错选项是C,注意该反应中不仅硫酸亚铁失电子,部分过氧化钠还失电子,为易错点.1年前查看全部
- 二氧化炭与炭酸钠反应方程式是?
 kingjrr1年前1
kingjrr1年前1 -
 罗裙383 共回答了20个问题
罗裙383 共回答了20个问题 |采纳率85%Na2CO3+CO2+H2O=2NaHCO3
如果能反应的话就是这个了.1年前查看全部
- (2013•永春县模拟)高铁酸钠(Na2FeO4)是一种饮用水的高效消毒剂,可由下列方法制得:Fe2O3+3Na2O2&
(2013•永春县模拟)高铁酸钠(Na2FeO4)是一种饮用水的高效消毒剂,可由下列方法制得:Fe2O3+3Na2O2
2Na2FeO4+Na2O,关于该反应说法正确的是( )高温 .
A.Na2FeO4属于共价化合物
B.反应中Na2O2是氧化剂
C.生成1mol Na2FeO4,有6mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性 真是麻烦啊啊啊啊1年前1
真是麻烦啊啊啊啊1年前1 -
 GRILL 共回答了16个问题
GRILL 共回答了16个问题 |采纳率87.5%解题思路:首先判断元素的化合价,从化合价变化的角度分析氧化还原反应,根据化合价的变化判断电子转移的数目并判断物质的性质.A.Na2FeO4属于离子化合物,故A错误;
B、Na2O2中O元素的化合价由-1价变为-2价,被还原,Na2O2为氧化剂,故B正确;
C、反应中Fe元素的化合价由+3价升高到+6价,Na2FeO4被氧化,生成1mol Na2FeO4,有3mol电子转移,故C错误;
D、在Na2FeO4中Fe为+6价,具有强氧化性,故D错误.
故选:B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度不大,本题注意从化合价变化的角度分析.1年前查看全部
- 四氢和铅酸钠和双氧水的反应方程式 五氧化二锑和盐酸的反应方程式 氧化亚锡和盐酸的反应方程式
 小雪的影子651年前1
小雪的影子651年前1 -
 whuben 共回答了13个问题
whuben 共回答了13个问题 |采纳率84.6%没有四氢和铅酸钠,叫四氯铅酸钠Na2PbCl4吧
和双氧水反应,中性环境下H2O2貌似没有能力将二价铅氧化成四价铅,所以必须碱性:
Na2PbCl4 + H2O2 + 2NaOH === PbO2 + 4NaCl + 2H2O
五氧化二锑与盐酸反应要加热:
Sb2O5 + 6HCI ==加热== 2SbOCI3 + 3H2O
直接想转化成五氯化锑有些困难,在溶液里
氧化亚锡和盐酸反应好办:
SnO + 2HCI === H2O + SnCI21年前查看全部
- 偏铝酸钠和偏镓酸钠中,由于偏镓酸钠的酸性强于偏镓酸钠,所以先产生氢氧化铝沉淀,那么是否可以说
偏铝酸钠和偏镓酸钠中,由于偏镓酸钠的酸性强于偏镓酸钠,所以先产生氢氧化铝沉淀,那么是否可以说
是否可以说酸性强的物质会先产生沉淀? 固态冰1年前1
固态冰1年前1 -
 1110111 共回答了16个问题
1110111 共回答了16个问题 |采纳率93.8%AlO2-和Ga(OH)6-均为碱性,若你说的是金属离子,的确如此.1年前查看全部
- 蜡酸钠与碱石灰共热制甲烷的化学方程式
 youshili1年前1
youshili1年前1 -
 koala_au 共回答了20个问题
koala_au 共回答了20个问题 |采纳率95%CH3COONa+NaOH加热(CaO)CH4+Na2CO3
CaO属于条件:可以降低体系的碱性,其碱性较纯NaOH弱,避免玻璃仪器的损坏;也可以吸收固体中的水分,此反应若有水,则不能进行;也可以使固体混合物的结构松散一些,便于气体的生成和逸出.1年前查看全部
- 将二氧化碳通入到偏铝酸钠和偏镓酸钠中,为何先产生氢氧化铝
 ya01611年前1
ya01611年前1 -
 小_冬 共回答了15个问题
小_冬 共回答了15个问题 |采纳率86.7%氢氧化铝的碱性比氢氧化镓的要弱,所以先产生1年前查看全部
- 求电解制备高铁酸钠的方程式,电解池阳极和阴极反应方程式各是什么?以铁和铂作为电极,氢氧化钠做电解质
 何足道51751年前2
何足道51751年前2 -
 佛渡金身 共回答了14个问题
佛渡金身 共回答了14个问题 |采纳率85.7%电解法制备
以铁为工作电极,通过电解NaOH溶液(12.0mol·L^-1)制备高铁酸钠,在体系温度为20-50℃,电流密度为500-2000A·m^-2条件下,探讨了超声作用对高铁酸钠反应速率的影响.实验结果表明,超声能够提高高铁酸钠的生成速率;超声作用的效应随着操作电流密度的增加而增强,在实验条件下,40℃时超声作用对高铁酸钠生成的影响最大.
次氯酸盐氧化法制备
采用次氯酸盐氧化法,在10.00 mL质量分数为8%的次氯酸钠溶液中加入5.5 g氢氧化钠和0.70 g硫酸铁,可制备摩尔浓度(物质的量浓度)为0.01 mol/L的高铁酸钠.
NaOH + Fe(NO3)3 + NaClO === Na2FeO4 + NaCl + NaNO31年前查看全部
- 高铁酸钠中的铁元素几价?
 蓝岸1年前1
蓝岸1年前1 -
 iceblue冰 共回答了24个问题
iceblue冰 共回答了24个问题 |采纳率91.7%Na2FeO4中Na是+1价,O是-2价,可得Fe为+6价1年前查看全部
- 铁酸钠与水反应的化学方程式?铁酸钠与水反应的化学方程式是什么?
 k_nana1年前1
k_nana1年前1 -
 luyao1984 共回答了23个问题
luyao1984 共回答了23个问题 |采纳率87%如果你的问题是高铁酸钠 那么反应为4Na2FeO4+10H2O=4Fe(OH)3+3O2+8NaOH
磁性材料的前体铁酸钠 Na2O.Fe2O3不与水反应1年前查看全部
- 过氧化钠和盐酸如何反应?严重的胃溃疡可以用炭酸钠,炭酸氢钠或者氢氧化铝吗?
 qq2690431681年前1
qq2690431681年前1 -
 16947398 共回答了18个问题
16947398 共回答了18个问题 |采纳率94.4%过氧化钠先和盐酸中的水反应,生成氢氧化钠和氧气.然后氢氧化钠再和盐酸反应,生成氯化钠、水和二氧化碳.最终产物是氧气、水和氯化钠.胃溃疡患者氢氧化铝可用,碳酸盐不可用,会生成二氧化碳刺激胃酸分泌可能穿孔1年前查看全部
- 氯化锌,炭酸钠化学式
 bluetaro1年前6
bluetaro1年前6 -
 tim581 共回答了19个问题
tim581 共回答了19个问题 |采纳率89.5%氯化锌:ZnCl2
碳酸钠:Na2CO3
数字都是下标1年前查看全部
- 苯酚酸钠的标准摩尔生成焓是多少?
 小妖叮叮1年前1
小妖叮叮1年前1 -
 39930074 共回答了23个问题
39930074 共回答了23个问题 |采纳率87%-165.02KJ/mol1年前查看全部
- 偏铝酸钠能和哪种最高价含氧酸钠盐反应?PS:此种钠盐也可以与碳酸氢钠反应……
 m1f1h11年前2
m1f1h11年前2 -
 nancy1818 共回答了19个问题
nancy1818 共回答了19个问题 |采纳率78.9%NaHSO4能电离出氢离子,相当于一元强酸,能与偏铝酸根和碳酸氢根反应1年前查看全部
- 如何制备苯甲酸使用重烙酸钠硫酸体系氧化苯乙酮制备苯甲酸
 管仁健1年前1
管仁健1年前1 -
 昆仑东路 共回答了18个问题
昆仑东路 共回答了18个问题 |采纳率100%1.在500ml三颈烧瓶中加入250ml水和5.4ml甲苯加几粒沸石.
2.装上回流冷凝管,加热至沸腾.
3.分批加入17g KMnO4,回流加热1.5-2h至回流液中无明显油珠为止.
4.趁热抽滤.(若滤液有颜色可加入NaHSO3固体至无色为止).
5.冷却至室温.给滤液滴加1:1HCl,至酸性为止.
6.抽滤、干燥、称重、计算产率.1年前查看全部
- 在物质的量浓度相同的溶液:氨水、氯化铵、氢氧化钾、炭酸钠、硫酸氢钠、醋酸钠、硝酸钠中:
在物质的量浓度相同的溶液:氨水、氯化铵、氢氧化钾、炭酸钠、硫酸氢钠、醋酸钠、硝酸钠中:
呈酸性的溶液有:碱性的有:PH由大到小的顺序是? 垣风1年前1
垣风1年前1 -
 hytbbb 共回答了17个问题
hytbbb 共回答了17个问题 |采纳率94.1%酸性:NaHSO4、NH4Cl
中性:NaNO3
碱性:NH3·H2O、KOH、Na2CO3、CH3COONa
排列:
KOH>NH3·H2O>Na2CO3>CH3COONa>NaNO3>NH4Cl>NaHSO41年前查看全部
- 高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2
高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________.
我想知道的是 仅凭题目给的条件 我怎么知道要选NAOH? 电子翅膀1年前1
电子翅膀1年前1 -
 浓仪 共回答了12个问题
浓仪 共回答了12个问题 |采纳率91.7%肯定要选含Na的,不选硫酸钠是因为这样得不到纯净的高铁酸钠,选氢氧化钠,当OH-放电完毕之后,溶液中就没有其他杂质了.1年前查看全部
- (2013•盐城一模)用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知获得高铁酸钠的反应为:Fe2O
(2013•盐城一模)用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知获得高铁酸钠的反应为:Fe2O3+mNa2O2=nNa2FeO4+Na2O,下列说法中正确的是( )
A.Na2FeO4中,铁元素的化合价+6价
B.消毒的作用是除去水中可溶性杂质
C.化学计量数m=n
D.高铁酸钠中铁元素质量分数最大 清波11年前1
清波11年前1 -
 uwanna 共回答了17个问题
uwanna 共回答了17个问题 |采纳率88.2%解题思路:A、根据在化合物中元素化合价的代数和为零的原则进行分析判断.
B、根据消毒的作用进行分析判断.
C、根据质量守恒定律:反应前后原子种类和数目均不变,进行分析判断.
D、根据化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,进行分析判断.A、钠元素显+1价,氧元素显-2价,设Na2FeO4中铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价,故选项说法正确.
B、消毒的作用是除去有害细菌,不是除去水中可溶性杂质,故选项说法错误.
C、根据质量守恒定律,反应前有2个铁原子,2n=2,则n=2;钠的原子个数为2×2+2=6个,2m=6,m=3;m与n不相等,故选项说法错误.
D、高铁酸钠中钠原子的相对原子质量之和为23×2=46,铁原子的相对原子质量之和为56,氧原子的相对原子质量之和为16×4=64,氧元素的相对原子质量之和最大,则氧元素的质量分数最大,故选项说法错误.
故选A.点评:
本题考点: 化学方程式的配平;有关元素化合价的计算;元素的质量分数计算.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法、质量守恒定律、有关化学式的计算等是正确解答本题的关键.1年前查看全部
- 杭州哪里有磺酸,三聚磷,酸钠,等化工买?
 惆怅的cc1年前2
惆怅的cc1年前2 -
 chuang_ye123 共回答了21个问题
chuang_ye123 共回答了21个问题 |采纳率81%杭州市上城区天骏五金化工商店
供应信息分类:直接染料 通用有机试剂 脱模剂 硫酸盐 磷酸盐 一元醇 净水絮凝剂 羧酸盐 柠檬酸 氟硅酸盐 洗涤剂 苯甲酸 醋酸 硅橡胶 热稳定剂 活性炭 纤维素 硼酸 其他无机酸 等等.1年前查看全部
- 高铁酸钠(Na2FeO4)是一种绿色环保高效的饮水消毒剂.高铁酸钠中铁元素的化合价为
 scyber1年前1
scyber1年前1 -
 rainxing 共回答了18个问题
rainxing 共回答了18个问题 |采纳率88.9%+61年前查看全部
- 1 现有石灰石、水、残酸钠,怎样制取烧碱(不能引入其他物质),写出有关化学式.
1 现有石灰石、水、残酸钠,怎样制取烧碱(不能引入其他物质),写出有关化学式.
2 用锌粒、盐酸、氧化铁、硫酸铜为原料制取硫酸亚铁,写出有关化学式.
3 试用6种不同的方法制备氯化锌,写出有关化学式. lkmnjq21341年前1
lkmnjq21341年前1 -
 mafst 共回答了19个问题
mafst 共回答了19个问题 |采纳率89.5%1.高温煅烧石灰石生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙.氢氧化钙和碳酸钠反应生成氢氧化钠和碳酸钙沉淀.
2. Fe2O3+6HCl=2FeCl3+3H2O
3Zn+2FeCl3=3ZnCl2+2Fe
Fe+CuSO4=Cu+FeSO4
3. Zn+2HCl=ZnCl2+H2 气体
ZnO+2HCl=ZnCl2+H2O
Zn(OH)2+2HCl=ZnCl2+2H2O
锌放如氯化铜中
Zn+FeCl2=ZnCl2+Fe
硫化锌放如稀盐酸中1年前查看全部
大家在问
- 1如图,在平面直角坐标系中,一次函数y=kx+b(k≠0)的图象与反比例函数y=m/x(m≠0﹚的图象相交于A,B两点.
- 2北京和上海距1200千米车从北京和上海开出两车速度相同6小时相遇,它的速度是多少?
- 3There _____ a lot of tigers there,but now they are endangere
- 4写出满足下列条件的直线的方程.(1)斜率是√3/3(三分之更号三),经过点A(8,-2)(2)斜率为-4,在Y轴上的截距
- 5america's next top model的英文介绍
- 6仔细观察下面这幅漫画,按要求回答下面的问题。
- 7did you see my book (anywhere)?Sorry,i did not
- 8王老师用10N的水平力推着重150N的购物车在超市的水平地面上做匀速直线运动,这时购物车受到的摩擦力是______N.当
- 9soda的意思
- 1006cet4一道听力题不懂,13.BW:I hear that the Edwards are thinking of
- 11Old Richard,
- 122014河南省第六届英语翻译大赛的获奖名单或成绩怎么查?
- 13行列式解方程D,已知D=0,第一行a,b,c,d+x第二行a,b,c+x第三行a,b+x,c,d第四行a+x,b,c,d
- 142010²º¹º×(2010/1)²º¹º
- 15如题 文言文 《鸿门宴》吾得兄事之 得读音
