镀锌铁发生析氢腐蚀,有0.2mol电子发生转移,问有多少金属被腐蚀
 3641199342022-10-04 11:39:541条回答
3641199342022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 dikcy 共回答了14个问题
dikcy 共回答了14个问题 |采纳率85.7%- 无论铁或是锌反应都是变成正二价,所以是0·1摩尔.
- 1年前
相关推荐
- 镀锌厂一年用多少钝化液
 duangflu1年前2
duangflu1年前2 -
 msbab811 共回答了11个问题
msbab811 共回答了11个问题 |采纳率90.9%要看镀锌厂年产量的,它是有使用比例的.不是说死的,一年用一吨两吨计.1年前查看全部
- 彩钢瓦的外表面有镀层,镀层下面才是镀锌层,镀锌层厚度怎么测定.
彩钢瓦的外表面有镀层,镀层下面才是镀锌层,镀锌层厚度怎么测定.
镀锌层上面的镀层如何有效去除且不影响镀锌层厚度. 张良辰1年前1
张良辰1年前1 -
 一个人的上海 共回答了24个问题
一个人的上海 共回答了24个问题 |采纳率91.7%你好,下次提问一定要给分.
因为我希望知识是有报酬的.
彩钢瓦其实就是彩钢板通过一系列折弯形成的.
彩钢板有下面几层,最下面的钢板,上面的镀锌层,最上面的油漆层.
首先你说的是去除掉油漆层,也就是最上面的彩涂层,你需要查一下彩涂层的成分:比方说富锌漆和苏丹铁红就是不一样的东西.然后根据醇类比较溶解在醛类溶剂中类似的方法,通过溶液就能清洗掉,比方说“汽油很容易洗掉油漆”道理一样,需要你问厂商,最上面的图镀层是什么漆.
然后说另一个问题.
测镀锌层厚度,常用的有2种方法:一种是重量法,另一种是测厚仪.
重量法更加准确,测厚仪比较快捷.
方法你可以找你的供货商问,步骤等 他们都会知道的,由于过程很繁琐,我就不一一说明了.1年前查看全部
- 阳极:Zn阴极:Fe电解质溶液:ZnCl2想问,为什么这个装置可以在铁上镀锌?H+的氧化性应该大于Zn2+吧,Zn2+怎
阳极:Zn
阴极:Fe
电解质溶液:ZnCl2
想问,为什么这个装置可以在铁上镀锌?
H+的氧化性应该大于Zn2+吧,Zn2+怎么可能在阴极上被还原呢? joke011年前2
joke011年前2 -
 让蚊子咬了 共回答了21个问题
让蚊子咬了 共回答了21个问题 |采纳率85.7%要知道Zn2+、Fe2+、Sn2+、Pb2+大量存在时是比H+先被还原的,这是规则,记好啦1年前查看全部
- 下列说法正确的是 ( )。 A.原电池工作时,阴离子移向正极 B.铁片表面镀锌,铁片接电源负极 C.用Cu
下列说法正确的是 ( )。
A.原电池工作时,阴离子移向正极 B.铁片表面镀锌,铁片接电源负极 C.用Cu作电极电解H 2 O,阳极反应为:4OH - -4e - ===2H 2 O+O 2 ↑ D.向AgCl饱和溶液中加入NaCl固体,c (Cl - )增大,K sp 增大  菜3松1年前1
菜3松1年前1 -
 person3 共回答了18个问题
person3 共回答了18个问题 |采纳率100%B
原电池中阴离子向负极移动,阳离子向正极移动,故A错误;电镀中镀件作阴极,接电源负极,故B正确;阳极反应为Cu-2e - ===Cu 2 + ,故C错误;K sp 只随温度改变而改变,故D错误。1年前查看全部
- 两个电极,正极是铜,负极可以是镀锌吗?
 combro1年前1
combro1年前1 -
 kaisa2005 共回答了24个问题
kaisa2005 共回答了24个问题 |采纳率83.3%可以1年前查看全部
- 一只底面直径是1256平方厘米的圆柱形镀锌槽,内有一定量的液体,现将10个同样的圆锥形金属零件浸没其中,
一只底面直径是1256平方厘米的圆柱形镀锌槽,内有一定量的液体,现将10个同样的圆锥形金属零件浸没其中,
面上升了1厘米.如果零件每立方分米重7.5克,每个零件重多少克? cslanyi1801年前1
cslanyi1801年前1 -
 i777 共回答了28个问题
i777 共回答了28个问题 |采纳率85.7%放入零件后增加的体积 v=pai*D^2*h/4, 每个零件所占体积为 v/10,
每个零件重 m=(v/10)*7.5,
注意求体积时把单位换成分米.1年前查看全部
- (2013•宝应县一模)如图所示的镀锌铁皮材料ABCD,上沿DC为圆弧,其圆心为A,圆半径为2米,AD⊥AB,BC⊥AB
 (2013•宝应县一模)如图所示的镀锌铁皮材料ABCD,上沿DC为圆弧,其圆心为A,圆半径为2米,AD⊥AB,BC⊥AB,且BC=1米.现要用这块材料裁一个矩形PEAF(其中P在圆弧DC上、E在线段AB上,F在线段AD上)做圆柱的侧面,若以PE为母线,问如何裁剪可使圆柱的体积最大?其最大值是多少?
(2013•宝应县一模)如图所示的镀锌铁皮材料ABCD,上沿DC为圆弧,其圆心为A,圆半径为2米,AD⊥AB,BC⊥AB,且BC=1米.现要用这块材料裁一个矩形PEAF(其中P在圆弧DC上、E在线段AB上,F在线段AD上)做圆柱的侧面,若以PE为母线,问如何裁剪可使圆柱的体积最大?其最大值是多少?  一个人的夜晚1年前0
一个人的夜晚1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2014•常州模拟)如图1所示为用镀锌铁片制成的日常用品.镀锌铁是指通过镀锌工艺在铁皮上进行镀锌而制成的一种产品,热镀
(2014•常州模拟)如图1所示为用镀锌铁片制成的日常用品.镀锌铁是指通过镀锌工艺在铁皮上进行镀锌而制成的一种产品,热镀锌产品广泛用于建筑、家电、车船、容器制造业、机电业等,几乎涉及到衣食住行各个领域.为测定铁片镀锌层的厚度实验过程如下.

【实验步骤】
(1)剪取一片镀锌铁片,量得长度=2.0cm,宽度=1.9cm.
(2)用电子天平称量质量0.857g.
(3)实验中需要溶质质量分数为10%的稀盐酸200mL(密度=1.05g/mL),需要量取溶质质量分数为37%的浓盐酸(密度=1.18g/mL)______mL(保留至小数点后1位),然后稀释.
(4)将镀锌铁片放入溶质质量分数为10%盐酸中.当观察到______,可以判断镀锌层恰好反应.
(5)将溶液中的铁片取出清洗、擦干、烘干后用电子天平称量质量0.837g.
【计算结果】
(1)铁片镀锌层的质量有______g.
(2)已知锌的密度7.1g/cm3,计算出铁片镀锌层厚度mm(保留至小数点后2位).
【实验反思】
实际计算结果偏大,同学们分析,这是因为很难通过观察现象判断镀锌层恰好反应,造成镀锌铁片浸泡在盐酸中时间______.(填“偏长”、“偏短”)
【实验改进】
资料卡片:如图2所示,两种金属活动性不同的金属放入酸碱盐溶液中,会有电子的流动,从而产生电流.
将上述实验改进成如图3的装置,当观察到______,此时锌层恰好反应. 叉烧_pan1年前1
叉烧_pan1年前1 -
 hxujiu 共回答了20个问题
hxujiu 共回答了20个问题 |采纳率90%【实验步骤】
(3)设需取用37%(ρ=1.18g/cm3)的盐酸的体积为x
10%×200mL×1.05g/mL=37%×1.18g/mLx
x≈48.1mL;
(4)当锌镀层完全反应后就是铁与盐酸反应,由于锌和铁的活泼性不同,反应速率就不同,可观察到产生气泡的速率明显下降;
【计算结果】
(1)铁片镀锌层的质量是:0.857g-0.837g=0.02g;
(2)根据题意可知锌的质量为0.02g,锌的密度为7.1g/cm3.
所以锌镀层的厚度是:
0.02g
7.1g/cm3
2×2.cm×1.9cm≈0.037cm=0.37mm;
【实验反思】铁也会与盐酸反应产生氢气,当镀锌铁片浸泡在盐酸中时间过长时,锌反应完毕,铁就会与盐酸反应,所以经过称量得到锌的质量偏大;
【实验改进】两种金属活动性不同的金属放入酸碱盐溶液中,会有电子的流动,从而产生电流.当电子停止流动时,电流为0.
故答案是:【实验步骤】48.1mL;气泡产生的速率突然减慢;
【计算结果】(1)0.02;(2)0.37mm;
【实验反思】偏长;
【实验改进】电流计指针指向“0”.1年前查看全部
- 下列叙述不正确的是( )A.白铁(镀锌铁)镀层破损后,先被腐蚀的是铁B.锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加
下列叙述不正确的是( )
A.白铁(镀锌铁)镀层破损后,先被腐蚀的是铁
B.锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
C.钢铁表面常易锈蚀生成Fe2O3•nH2O
D.金属的腐蚀主要是电化学腐蚀 无知很可怕1年前1
无知很可怕1年前1 -
 大雪将至 共回答了15个问题
大雪将至 共回答了15个问题 |采纳率80%解题思路:A、Zn、Fe构成原电池是,Zn比Fe活泼,失电子;
B、形成原电池能加快反应速率;
C、钢铁发生电化学腐蚀最终生成铁锈;
D、金属中一般含有杂质,易发生电化学腐蚀.A、Zn、Fe构成原电池是,Zn比Fe活泼,Zn失电子被腐蚀,铁被保护,故A错误;
B、锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液,Zn置换出Cu,Zn与Cu、硫酸形成原电池,形成原电池能加快反应速率,故B正确;
C、钢铁发生电化学腐蚀最终生成铁锈,铁锈的成分为Fe2O3•nH2O,故C正确;
D、金属中一般含有杂质,易发生电化学腐蚀,所以金属的腐蚀主要是电化学腐蚀,故D正确.
故选A.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题考查了金属的电化学腐蚀,题目难度不大,注意把握原电池原理以及正负极的判断方法.1年前查看全部
- 塑料度光怎样分离?如 度光酒瓶盖子 金属镀锌分离?
塑料度光怎样分离?如 度光酒瓶盖子 金属镀锌分离?
怎么还有这种抽奖的事?故弄玄虚 怎么还有广告啊?难道这就是答案么 百度 你怎么不管管?什么都上? wangjiede1年前1
wangjiede1年前1 -
 kuner_jill 共回答了13个问题
kuner_jill 共回答了13个问题 |采纳率69.2%1.热分法
利用加热后改变塑料性实现纸塑分离的方法
(1)热筒法:分离装置由电加热镀铬料筒与内装的带刮刀的空心筒(转鼓)组成,刮刀与加热筒壁相接,二者逆向旋转,筒底部连接一料槽.材料从投料加入,其中的塑料成分与热筒一旦接触开始熔融,附着在筒壁上,用刮刀刮下,落入料槽中.此法可将90%以上的塑料与纸分开,已分离的塑料含纸量很小,可控制在1% 以下.
(2)热气流法:利用塑料薄膜遇热收缩,减小比面积的原理实现塑性薄膜与纸的分离.将薄膜与纸的混合物送至加热区,加热箱可以是一台农用谷物干燥机,呈颗粒状,从而使其表面积减小,再将它与纸的混合物送入空气分离器,空气流将混合物中的纸带走,而热塑性塑料颗粒便落在分离器的底部.此法几乎可以把塑料与纸完全分开.
2.湿分法
将从干分法分离设备得到的轻质材料送入搅碎机,被搅碎的纸浆从分选板上的小孔中流出,留下的塑料则从一分离出口排出,然后送入脱水机脱水,再送入空气分离器中进行分离.
3.电动分离法
将纸与塑料的混合物由一台振动喂料器送入分离机中,落入旋转的碾碎鼓,然后送到由电线电极与碾碎之间形成的电晕区,纸被吸向电极,而塑料仍然贴在转鼓上,随着鼓的转动塑性落到它的底部收集起来.采用此法时湿度对分离结果有很大影响,混合物湿度为15%时,虽可使纸和塑料分离,但塑性仍会被大量的纸污染,当湿度提高至50%以上时,便可使塑性和纸完全分离.1年前查看全部
- 镀锌铁和镀锡铁的镀层破坏后,铁都易腐蚀吗?
 良好的市民1年前1
良好的市民1年前1 -
 qidaoaime 共回答了17个问题
qidaoaime 共回答了17个问题 |采纳率82.4%这个要看金属的活动性顺序.K、Ca、Na、Mg、Al、ZN、Fe、Sn、Pb、Cu、Hg、Ag、Pt、Au. 若镀锌铁镀层被破坏后.铁金属暴露.但是锌和铁会组成原电池锌会作为牺牲阳极.继续被消耗.例如轮船也是镶嵌着锌块作为牺牲阳极.(这是轮船若要镀锌的话会很麻烦的原因). 而镀锡铁则不同.因为锡比铁要稳定.此时.若镀层被破坏.锡和铁就会组成原电池.铁会作为牺牲阳极保护锡.所以镀锡铁虽然一开始不易被腐蚀..但是铁一旦暴露后就会加快腐蚀..而锌虽然一开始比较容易被腐蚀..但是即使铁被暴露后也可以继续保护铁以防被腐蚀..1年前查看全部
- 下列叙述正确的是( )A.在电解池的阴极和原电池的负极上都发生氧化反应B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀C.用
下列叙述正确的是( )
A.在电解池的阴极和原电池的负极上都发生氧化反应
B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2
D.用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH baijian871年前1
baijian871年前1 -
 youqm 共回答了24个问题
youqm 共回答了24个问题 |采纳率79.2%解题思路:A.电解池的阴极发生还原反应;
B.镀锡铁板更易腐蚀;
C.用惰性电极电解KOH溶液,阴、阳两极产物分别为氢气和氧气;
D.用惰性电极电解饱和NaCl溶液,发生:2NaCl+2H2O
H2↑+Cl2↑+2NaOH.通电 .A.电解池的阴极发生还原反应,原电池负极发生氧化反应,故A错误;
B.铁比锡活泼,镀锡铁板更易腐蚀,锌比铁活泼,镀锌铁板更耐腐蚀,故B错误;
C.用惰性电极电解KOH溶液,阴、阳两极产物分别为氢气和氧气,物质的量之比为2:1,故C错误;
D.用惰性电极电解饱和NaCl溶液,发生:2NaCl+2H2O
通电
.
H2↑+Cl2↑+2NaOH,若有1mol电子转移,则生成1molNaOH,故D正确.
故选:D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查原电池和电解池知识,侧重于学生的分析能力的考查,注意把握原电池和电解池的反应原理和两极变化,难度不大.1年前查看全部
- 铁表面镀锌,铁做阳极为什么错 消耗阳极保护阴极和消耗负极保护正极不是一个概念么,
铁表面镀锌,铁做阳极为什么错 消耗阳极保护阴极和消耗负极保护正极不是一个概念么,
‘铁表面镀锌,铁做阳极’这句话为什么错?
消耗阳极保护阴极法和消耗负极保护正极法不是一个概念么,选择题里选了一个,另一个肯定要选的,那么为什么不可以说铁做阳极 小太白1年前3
小太白1年前3 -
 一剑笑江湖 共回答了14个问题
一剑笑江湖 共回答了14个问题 |采纳率100%铁在阳极失电子,锌是度不上去的.另外两种保护法当然不同,一种是原电池原理,一种是电解池原理,是本质上的区别.建议你好好看书,这些应该是书上最基本的概念.1年前查看全部
- 下列事实不能用电化学理论解释的是 A. 镀锌铁比镀锡铁更耐用 B. 铝片可以露置在空气中存放 C. 轮船吃水线
下列事实不能用电化学理论解释的是 A. 镀锌铁比镀锡铁更耐用 B. 铝片可以露置在空气中存放 C. 轮船吃水线
下列事实不能用电化学理论解释的是
A. 镀锌铁比镀锡铁更耐用
B. 铝片可以露置在空气中存放
C. 轮船吃水线以下的船壳上装有一定数量的锌块
D. 纯锌与稀硫酸反应制取氢气时,滴入少量的硫酸铜溶液使反应速率加快
答案加解释,O(∩_∩)O谢谢大家! jijxing1年前2
jijxing1年前2 -
 风帆2280 共回答了11个问题
风帆2280 共回答了11个问题 |采纳率90.9%B
A C D都是可以解释的,哪个不知道追问
B 铝在空气中可以放置是因为,铝可以形成致密氧化膜,组织内部继续被氧化,和电化学没有关系1年前查看全部
- (2010•肇庆二模)“纸质电池”的纸片内充入的是水和氧化锌组成的电解液;纸的一边镀锌、另一边镀二氧化锰;电池总反应为:
(2010•肇庆二模)“纸质电池”的纸片内充入的是水和氧化锌组成的电解液;纸的一边镀锌、另一边镀二氧化锰;电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH).下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化作用
C.当0.1mol Zn完全溶解时,流经电解液的电子个数为1.204×1023
D.电池正极反应式为:2MnO2+2e-+2H2O═2MnO(OH)+2OH- 七_夏1年前1
七_夏1年前1 -
 流浪城市的ll 共回答了14个问题
流浪城市的ll 共回答了14个问题 |采纳率92.9%解题思路:由电池总反应Zn+2MnO2十H2O=ZnO+2MnO (OH)可知,Zn被氧化,为原电池的负极,
电极反应为Zn-2e-+2OH-=ZnO+H2O,MnO2被还原,为原电池的正极,电极反应为MnO2+H2O+e-=MnO(OH)+OH-.A、从电池反应可知,锌被氧化,失去电子,所以是负极,故A错误;
B、该电池反应中二氧化锰发生了还原反应,二氧化锰得到电子,被还原,为原电池的正极,故B错误;
C、当有0.1mol锌溶解时,失去电子数为 0.1×2×6.02×1023=1.204×1023,但电子由负极经外电路流向正极,不流经电解液,故C错误;
D、电池的正极反应式为MnO2+H2O+e-=MnO(OH)+OH-,或2MnO2+2e-+2H2O=2MnO(OH)十2OH-,故D正确.
故选D.点评:
本题考点: 化学电源新型电池;电极反应和电池反应方程式.
考点点评: 本题考查化学电源新型电池,侧重于电极反应方程式的考查,题目难度中等,注意从正负极发生的变化结合电解质的特点书写电极反应式.本题易错点为C,注意电子与溶液中离子的移动的区别.1年前查看全部
- 镀锌表面质量等级FA,FB,FC是指什么?
 bvb2111年前1
bvb2111年前1 -
 g_sniper 共回答了15个问题
g_sniper 共回答了15个问题 |采纳率93.3%表面质量代号:FA-普通级、FB-较高级、FC-高级
标注字母A、B、C、D,表示钢材质量等级不同,含s、P的量依次降低,钢材质量依次提高1年前查看全部
- 锌的化学性能比较活泼,在铁的表面镀锌不能防止生锈,这句话对吗?
 淡泊人生-悟1年前1
淡泊人生-悟1年前1 -
 jlj7925202 共回答了17个问题
jlj7925202 共回答了17个问题 |采纳率94.1%不对
镀锌是通过牺牲锌来保护铁防止铁生锈1年前查看全部
- 阳极为锌,阴极为铁,电解质溶液为硫酸锌,为什么可以在铁上镀锌?氢离子不是比锌离子更先放电吗
 创维行销1年前1
创维行销1年前1 -
 randr 共回答了19个问题
randr 共回答了19个问题 |采纳率84.2%因为电解质溶液中水电离出的氢离子很少,而含有大量锌离子,所以锌离子在阴极上得电子变成锌单质1年前查看全部
- 镀锌铁镀层破损后铁更易被腐蚀为什么会构成原电池呢?不是原来有锌,所以先和锌反应,但由于镀层被破坏,所以可直接与铁反应了吗
镀锌铁镀层破损后铁更易被腐蚀
为什么会构成原电池呢?
不是原来有锌,所以先和锌反应,但由于镀层被破坏,所以可直接与铁反应了吗? morris131年前1
morris131年前1 -
 qqj526 共回答了16个问题
qqj526 共回答了16个问题 |采纳率100%楼主,你的问题就出错了,应该是铁仍然不被腐蚀.因为锌的活泼性更强,形成原电池后形成牺牲阳极的阴极保护法.海水与锌反应,电子流到铁极,使得铁失去的电子得到补充,不发生反应.1年前查看全部
- 镀锌铁表面破损后镀锌铁表层破损后仍有较强的抗腐蚀性
 gougouf1年前1
gougouf1年前1 -
 采访dd 共回答了21个问题
采访dd 共回答了21个问题 |采纳率95.2%不对.没有了锌层后会在破损处发生电化学反应,Fe被变成3价Fe生成铁锈,如果是轮船,Fe就会慢慢释放到海里了,时间长了就会形成腐蚀孔,要漏水的.
你说的抗腐蚀是什么意思呢?如果是遇到盐酸之类的酸,锌层也一样被腐蚀,而如果在干燥的低氧环境铁也比较抗腐蚀.1年前查看全部
- 白铁、马口铁是什么东西?为什么白铁比马口铁耐腐蚀?白铁 镀锌铁的俗称.将干净的铁片浸在熔化的液体锌里而制得.锌虽然比较活
白铁、马口铁是什么东西?
为什么白铁比马口铁耐腐蚀?
白铁
镀锌铁的俗称.将干净的铁片浸在熔化的液体锌里而制得.锌虽然比较活泼,但在含有CO2的潮湿空气里能生成一层碱式碳酸锌4Zn+2O2+3H2O+CO2→ZnCO3·3Zn(OH)2
这层碱式碳酸锌薄膜较紧密,可作保护膜,防止内部锌不再被继续氧化.如果镀锌层一旦被破坏后,发生电化腐蚀时,由于锌比铁活泼,锌将作为原电池的负极发生氧化反应而损耗,铁受到保护.
马口铁:Zn、Fe合金(Zn是镀层)
特性及优点 1.不透光性2.良好的密封性3.锡的还原作用4.提供有效铁的来源马口铁的用途:食品及饮料的包装材、油脂罐、化学品罐以及其他的杂罐,马口铁的优点及特点提供内容物在物理及化学性质上很好的保护.1.食品罐头2.饮料罐3.油脂罐/4.化学品罐5.喷雾及其他杂罐. 苼萿1年前1
苼萿1年前1 -
 海蔓 共回答了21个问题
海蔓 共回答了21个问题 |采纳率90.5%白铁:镀锌铁.日常用品用白铁.如箱子,水管等.
马口铁:镀锡铁.一般用于食品包装.如罐头.
当镀层破损后与周围的水,氧气等构成原电池.锌是负极被氧化,白铁中铁是正极,不参与反应被保护.因锌比铁活泼,活泼金属是负极.
在马口铁形成的原电池中,因铁比锡活泼,所以铁是负极,被氧化.
因此,在镀层破损以后,白铁比马口铁耐腐蚀.1年前查看全部
- 镀锌之后为什么要进行钝化处理?
 Carrie35861年前1
Carrie35861年前1 -
 我是谁的mm 共回答了9个问题
我是谁的mm 共回答了9个问题 |采纳率100%由于锌是电位较负的活泼金属,本身就很容易氧化,在用作镀层时,与正电位金属在一起更会加速腐蚀速度,锌如果很快被腐蚀,就起不到对基体的防护作用.这时如果对其进行钝化处理,让表面电位发生变化,就会大大提高其表面的抗腐蚀能力,增强镀层对基体的保护作用,因此所有镀锌层基本上都要经过各种钝化处理,才能达到防护效果.对于汽车零件等要求更为严格的镀锌产品,有时还要在钝化膜外再涂覆有机膜层,以进一步提高其抗腐蚀性能,出于成本和操作效率等方面的考虑,这种膜已经不是以往的有机物膜,而是水溶性膜,有时还是极薄的单分子膜层.1年前查看全部
- 在镀锌时,溶液应选硫酸锌等镀层金属的盐溶液,那还需要加入什么试剂才能使还原性弱的锌离子锌析出呢?
 電车男1年前2
電车男1年前2 -
 guolicctv2008 共回答了17个问题
guolicctv2008 共回答了17个问题 |采纳率94.1%硫酸钠、氯化钾和光亮剂1年前查看全部
- 铝阳极氧化和镀锌分别用在什么情况
 联想FANS1年前3
联想FANS1年前3 -
 8094440 共回答了20个问题
8094440 共回答了20个问题 |采纳率90%铝阳极分很多种,作为功能性来说,主要是为装饰或者耐磨,阳极膜的优点是硬,要是是挤型铝,通过一些机械的前处理,再做阳极,阳极层外观非常的漂亮,缺点是不导电,假如有需要局部导电,需要采用遮蔽区域或者阳极后去除该区域的阳极膜
电镀锌价格便宜,外观可以通过化学钝化生成蓝色,五彩,黑色等外观,一般应用才铁材的耐腐蚀防护上,有一定的外观效果,但是比较低档1年前查看全部
- 如图是一个铁制零件的三视图及尺寸标注,若零件表面每平方厘米需镀锌0.5克,请计算制造1万个这样的零件需多少千克锌.(不计
如图是一个铁制零件的三视图及尺寸标注,若零件表面每平方厘米需镀锌0.5克,请计算制造1万个这样的零件需多少千克锌.(不计损耗,精确到0.01kg)
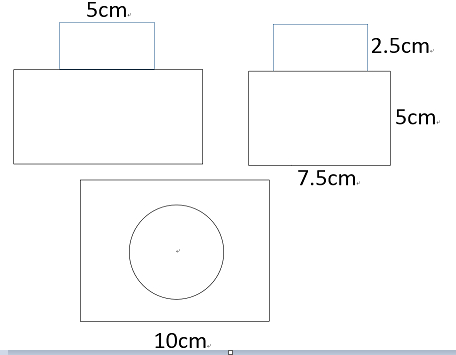
 sanmubos1年前2
sanmubos1年前2 -
 woqusi574 共回答了20个问题
woqusi574 共回答了20个问题 |采纳率90%解题思路:易得该几何体下层为长10cm,宽7.5cm,高5cm的长方体,上层为半径5÷2=2.5cm,高2.5cm的圆柱,根据长方体的体积=长×宽×高,圆柱的体积=底面积×高,求出1个零件的体积,进一步即可求解.观察图形可知,该几何体下层为长10cm,宽7.5cm,高5cm的长方体,上层为半径5÷2=2.5cm,高2.5cm的圆柱,
10×7.5×5+3.14×(5÷2)2×2.5
=375+3.14×2.52×2.5
=375+3.14×15.625
=375+49.0625
=324.0625(平方厘米),
324.0625×0.5×10000÷1000≈1620.31(千克).
答:制造1万个这样的零件大约需1620.31千克锌.点评:
本题考点: 由三视图判断几何体.
考点点评: 考查了由三视图判断几何体,由三视图想象几何体的形状,首先,应分别根据主视图、俯视图和左视图想象几何体的前面、上面和左侧面的形状,然后综合起来考虑整体形状.1年前查看全部
- 镀锌的铁片完全溶于盐酸后,加入过量的 NaOH 溶液,放置一段时间后,滤出沉 淀物将其放在氧气中灼烧,最后得红棕色粉未,
镀锌的铁片完全溶于盐酸后,加入过量的 NaOH 溶液,放置一段时间后,滤出沉 淀物将其放在氧气中灼烧,最后得红棕色粉未,干燥称量,这种粉未的质量与原镀锌铁片 的质量相等,则原白铁片上锌的质量百分含量为 A 62.8% B 42.1% C 30% D 24.6%
 lingyun1671年前2
lingyun1671年前2 -
 第一百个豆 共回答了16个问题
第一百个豆 共回答了16个问题 |采纳率87.5%选C.
最终得到的Fe2O3固体,Fe2O3的质量与原镀锌铁片的质量相等,所以Zn的质量=O的质量,所以原白铁片上锌的质量百分含量是16*3/160*100%=30%1年前查看全部
- 【高中化学】为什么镀层破坏后,镀锡铁板比镀锌铁板更易腐蚀?
 sageson1年前4
sageson1年前4 -
 赢回我失去的爱 共回答了22个问题
赢回我失去的爱 共回答了22个问题 |采纳率81.8%因为铁比锡活泼,构成原电池,使铁腐蚀的更快.而锌又比铁活泼所以先腐蚀锌,这样就可以保护铁了.1年前查看全部
- 请问:铁质品上镀锌层.锌作阳极铁作阴极溶液中有锌离子.为什么是锌析出不是氢离子放电?
 3699161年前3
3699161年前3 -
 绿茶321 共回答了23个问题
绿茶321 共回答了23个问题 |采纳率82.6%镀锌过程中,锌离子和氢离子的放电还原时同时存在的.不过在电流密度较低或者锌离子浓度太低的时候是不会有锌离子的沉积还原的1年前查看全部
- 如图是一个铁制零件的三视图及尺寸标注,若零件表面每平方厘米需镀锌0.5克,请计算制造1万个这样的零件需多少千克锌(不计损
如图是一个铁制零件的三视图及尺寸标注,若零件表面每平方厘米需镀锌0.5克,请计算制造1万个这样的零件需多少千克锌(不计损耗,精确到0.01kg)
图片在这里:http://zhidao.baidu.com/question/331031322.html
 dabing72161年前1
dabing72161年前1 -
 我丑但我很温柔 共回答了25个问题
我丑但我很温柔 共回答了25个问题 |采纳率84%顶面积=长×宽=10×7.5=75(平方厘米)
底面积=长×宽=10×7.5=75(平方厘米)
侧面积=长×高×2 + 宽×高×2 + π×直径×高
=10×7.5×2 + 7.5×5×2 + π×5×2.5
≈150+75+39.25
≈264.25(平方厘米)
表面积=75+75+264.25=414.25(平方厘米)
需镀锌=414.25×0.5×0.001×10000=2071.25(千克)1年前查看全部
- 将锌块与铜块同时投到电解质溶液中,是不是不会形成原电池?那为什么在铁的表面镀锌后锌层破损接触电解质溶液时会形成原电池继续
将锌块与铜块同时投到电解质溶液中,是不是不会形成原电池?那为什么在铁的表面镀锌后锌层破损接触电解质溶液时会形成原电池继续保护铁?不都是全部接入了电解质溶液吗?
 shootingstar0011年前1
shootingstar0011年前1 -
 珍珠酱 共回答了18个问题
珍珠酱 共回答了18个问题 |采纳率100%1.会形成原电池
2.因为保护层破坏后,原电池依然存在,锌的电位比铁高,先牺牲阳极,因为有电势差,所有铁原本要失去的电子由锌通过金属内部传输给铁,最后还是锌被氧化
不过也不能说的太绝对,要是隔得很远的地方,电势差会衰减,还有电阻等很多因素,铁就得不到锌的保护1年前查看全部
- 为什么锌元素的氧化性很强,镀锌后又能防锈呢
 檬雨1年前1
檬雨1年前1 -
 baijia2007 共回答了20个问题
baijia2007 共回答了20个问题 |采纳率85%锌元素的金属性很强,单质还原性很强,镀锌后又能防锈是由于原电池,使锌将内部的铁或铜置换出来1年前查看全部
- 镀锌铁锌层破损后,铁更容易被腐蚀
镀锌铁锌层破损后,铁更容易被腐蚀
为什么错误 跟原电池有什么关系
不好意思 在做综合题时遇到的 但以前的知识好像忘了 yesor1281年前4
yesor1281年前4 -
 开心痞子99 共回答了29个问题
开心痞子99 共回答了29个问题 |采纳率96.6%这句话错啦.
锌破损后,会构成原电池,锌的活动性大于铁,所以锌做负极,铁做正极.两极方程式如下:
负极:Zn - 2e-==Zn2+
正极:2H + 2e- ==H2(气体) 酸性
O2 + 4e- + 2H2O==4OH- 碱性、中性
所以正极的铁不会反应,简单说,铁被锌保护了!1年前查看全部
- 测镀锌铁皮锌层厚度时,让镀锌铁玻与盐酸反应时,要不断地翻动铁皮.为什么?
测镀锌铁皮锌层厚度时,让镀锌铁玻与盐酸反应时,要不断地翻动铁皮.为什么?
这是高中《实验化学》上的一个操作,书本说是为了让两面的镀留锌层反应均匀.可是,这个反应的结束是以“产生气体速率明显变慢”为判断依据的.这是因为锌反应完时,原电池效应结束.那样的话,就算边反应不均匀,只要有一边的锌还在,原电池就在,铁就作正极受保护,不与盐酸反应.故两边反应不均似乎也应该是没有关系的啊. bluerainfairy1年前1
bluerainfairy1年前1 -
 ksy1214 共回答了21个问题
ksy1214 共回答了21个问题 |采纳率95.2%因为靠近电极处的反应进行的较为剧烈,因此在此处的氢离子浓度下降较快,这就可能引起反应速率的降低,对判断有干扰作用.不断翻动铁皮是为了保证电极周围氢离子的浓度,提高反应灵敏度.1年前查看全部
- 铁钉镀锌的电镀液电镀液的成分是氯化锌、氯化钾、硼酸.用氯化锌是显然的,但为什么要用氯化钾和硼酸呢?如果硼酸是为了调节PH
铁钉镀锌的电镀液
电镀液的成分是氯化锌、氯化钾、硼酸.用氯化锌是显然的,但为什么要用氯化钾和硼酸呢?如果硼酸是为了调节PH为酸性,为什么不用盐酸? 遭遇健忘1年前1
遭遇健忘1年前1 -
 kinghuang08 共回答了14个问题
kinghuang08 共回答了14个问题 |采纳率85.7%氯化锌是主盐,氯化钾是导电盐,又是锌离子的弱配位体氯离子的来源.硼酸是缓冲剂,调节PH在5左右.稀盐酸也可以调节ph1年前查看全部
- (2009•徐汇区二模)某学生用质量为a g、边长为b cm的正方形镀锌铁片与过量盐酸反应测定镀层厚
 (2009•徐汇区二模)某学生用质量为a g、边长为b cm的正方形镀锌铁片与过量盐酸反应测定镀层厚度,并将实验结果绘图示意,反应完毕后铁片质量为c g(已知锌的密度为ρ g/cm3).下列叙述错误的是( )
(2009•徐汇区二模)某学生用质量为a g、边长为b cm的正方形镀锌铁片与过量盐酸反应测定镀层厚度,并将实验结果绘图示意,反应完毕后铁片质量为c g(已知锌的密度为ρ g/cm3).下列叙述错误的是( )
A.t1时刻锌镀层已完全反应
B.锌镀层的厚度为[a−c/ρb2]
C.反应放热也是影响OA段的反应速率的因素之一
D.有原电池反应发生,负极的电极反应式为2H++2e→H2↑ mengxindan1年前1
mengxindan1年前1 -
 zhongxiao1964 共回答了18个问题
zhongxiao1964 共回答了18个问题 |采纳率94.4%解题思路:A、锌比铁活泼,在盐酸中,Zn与Fe构成原电池,反应速率减慢,当反应速率显著减小时,说明Zn与盐酸反应完成.
B、根据题意可知锌的质量为(a-c)g,根据m=ρV计算出锌的体积,体积除以锌的面积即得锌镀层的厚度.
C、反应放热,温度升高反应速率加快,故反应中段速率加快.
D、在盐酸中,Zn与Fe构成原电池,锌比铁活泼,锌为负极,Zn失去电子被氧化.A、在盐酸中,Zn与Fe构成原电池,因为Zn的活泼性比Fe的强,Zn失去电子被氧化,随着Zn的消耗,原电池作用减弱,反应速率减慢,当反应速率显著减小时,说明Zn与盐酸反应完成,故A正确;
B、根据题意可知锌的质量为(a-c)g,锌的密度为ρ g/cm3,所以锌的体积为
(a−c)g
ρ g/cm3=[a−c/ρ]cm3,边长为b cm的正方形镀锌铁片,所以锌片面积为2b2cm2,所以锌镀层的厚度为
a−c
ρcm3
2b2cm2=
a−c
2ρb2cm,故B错误;
C、反应中段速率加快,说明反应放热使OA段的反应速率,故C正确;
D、在盐酸中,Zn与Fe构成原电池,锌比铁活泼,锌为负极,Zn失去电子被氧化,电极反应式为Zn-2e-═Zn2+,故D错误.
故选:BD.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 考查原电池的应用、电极反应式书写、反应速率影响因素、有关计算,难度较大,关键是清楚测量原理,当反应速率显著减小时,说明Zn与盐酸反应完成.B选项为易错点,容易把锌片面积按b2cm2计算,忽略铁片是两面镀锌.1年前查看全部
- 1、不同金属镀层对金属的保护作用一样么?如果分别在铁制品上镀锌或锡,分析,当镀层局部破坏时,锌镀层和锡镀层还能对铁制品起
1、不同金属镀层对金属的保护作用一样么?如果分别在铁制品上镀锌或锡,分析,当镀层局部破坏时,锌镀层和锡镀层还能对铁制品起保护作用么?
2、电化学的方法使金属钝化:将被保护金属接到外加电源的正极上,并使电压维持在该金属发生钝化作用的范围内.这里我没看到,它是如何钝化的呢,求例子和讲解!
3、在电解池中有CD两个电极,CD是一张湿Na2SO4滤纸,滤纸中间滴有KMnO4液滴,发生反应后,为什么KMnO4液滴会向阳极移动呢?求原理! ff8881年前1
ff8881年前1 -
 1812bear 共回答了20个问题
1812bear 共回答了20个问题 |采纳率90%1、当镀层局部破坏时,锌镀层仍能起保护作用,因为锌比铁活泼,先失电子,只有锌全部被氧化后,才是铁失电子.锡就不一样了,因为铁比锡活泼,一旦锡层被破坏,那么就是铁失电子,就不能起到保护作用了.
2、将被保护金属接到外加电源的正极上,那么阳极金属就失电子,生成致密的氧化物,该氧化物不导电,隔绝内部金属与外界的接触.这就是钝化,与冷的浓硫酸与浓硝酸使铁铝钝化一样,只不过前者是利用电化学,后者直接化学反应.
3、其实看到的是高锰酸根离子移动了,高锰酸根是紫色;高锰酸根离子是阴离子,向阳极移动.1年前查看全部
- 镀锌工艺中,硝酸根离子从出光水中带入到钝化液中 这对钝化液会有影响么
镀锌工艺中,硝酸根离子从出光水中带入到钝化液中 这对钝化液会有影响么
镀锌完成后,经水洗-出光-钝化-水洗-热水-干燥过程
会有大量的硝酸根离子从出光水中带入到钝化液中 这对钝化液会有影响么 钝化效果有影响么 scdylyz1年前1
scdylyz1年前1 -
 Tony_1980 共回答了20个问题
Tony_1980 共回答了20个问题 |采纳率85%由于镀锌钝化液中本身就有硝酸根离子,并且随着使用在消耗,所代入的硝酸根离子可以部分弥补硝酸根离子的损耗,至少不会有太大的危害.1年前查看全部
- 问一下化学里面的电解镀锌~电镀的时候,假如电解液用硫酸锌,阳极用锌棒,阴极用惰性电极,那锌能被镀到阴极上去吗?阴极为什么
问一下化学里面的电解镀锌~
电镀的时候,假如电解液用硫酸锌,阳极用锌棒,阴极用惰性电极,那锌能被镀到阴极上去吗?阴极为什么不先产生氢气?水里面的氢离子氧化性应该比锌离子强啊?不解... roziho19861年前4
roziho19861年前4 -
 郁闷De蚂蚁 共回答了27个问题
郁闷De蚂蚁 共回答了27个问题 |采纳率88.9%在溶液浓度大时,氢离子的放电顺序就要排到锌离子的后面.这样,工业上就可以实现镀锌,镀镍等一些活动性比较强的金属.1年前查看全部
- 比较铁腐蚀的快慢 A铁 B生铁 C镀锌铁 顺序
 zyhlzx1年前3
zyhlzx1年前3 -
 麻辣草民 共回答了16个问题
麻辣草民 共回答了16个问题 |采纳率81.3%B>A>C
生铁是铁碳原电池,铁作为活泼金属做负极,被加快腐蚀
镀锌铁是铁锌原电池,锌比铁活泼做负极,铁作正极被保护1年前查看全部
- 镀锌铁皮烟筒,年年换,有什么有效的防腐蚀的方法.最好能解释下防腐蚀的原理.
镀锌铁皮烟筒,年年换,有什么有效的防腐蚀的方法.最好能解释下防腐蚀的原理.
这个方法要比较便于实现的.像电化学方法,普通家庭怎么实现?
另外,我认为腐蚀烟筒的罪魁祸首是硫以及含硫的酸性物质,防止硫和烟筒的铁接触就行.刷漆可以,但是不知道刷漆能不能抵抗含硫的酸性物质的腐蚀? rr等于狗1年前1
rr等于狗1年前1 -
 zhzzxc 共回答了21个问题
zhzzxc 共回答了21个问题 |采纳率100%放几块废电池皮到烟桶里面就可以拉,几年都不会坏,让那些腐蚀的物质去咬锌,烟桶就保住了,什么刷油漆的说法很搞笑,一股漆味还怎么吸烟1年前查看全部
- 中小型镀锌厂应怎样解决在不污染周边水源的前提下使用水?
 温泊1年前1
温泊1年前1 -
 junelovetao 共回答了20个问题
junelovetao 共回答了20个问题 |采纳率85%参考值:58.0----100.0.儿童的参考值范围:大于77umol/l.谢谢你认真地看完我的答案,1年前查看全部
- 柴油对生料带腐蚀吗?我要焊制一个容量两吨的油箱用来盛柴油,往外边引管时,使用镀锌铁管,连接时使用生料带,柴油会不会腐蚀生
柴油对生料带腐蚀吗?
我要焊制一个容量两吨的油箱用来盛柴油,往外边引管时,使用镀锌铁管,连接时使用生料带,柴油会不会腐蚀生料带. lovemyb1年前2
lovemyb1年前2 -
 nn911 共回答了16个问题
nn911 共回答了16个问题 |采纳率100%四氟乙烯生料带耐腐蚀柴油对生料带没有腐蚀1年前查看全部
- 以KCL和ZnCL2混合液为电镀液在铁制品上镀锌
以KCL和ZnCL2混合液为电镀液在铁制品上镀锌
因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 这句话为什么是错的?
我这么想的,本来一定的电子,被导线的电阻消耗掉一部分后,不能确定多少能通过去啊? luoyuping853331年前2
luoyuping853331年前2 -
 空荡荡的秋千 共回答了23个问题
空荡荡的秋千 共回答了23个问题 |采纳率87%根据法拉第定律,电镀时通过的电量与析出的金属量有确定关系.1年前查看全部
- 科学研究小组的同学在用一定浓度的硫酸溶液处理废金属材料(主要是生铁、镀锌铁皮)时,溶液发烫并闻到了刺激性气味,这种反常现
科学研究小组的同学在用一定浓度的硫酸溶液处理废金属材料(主要是生铁、镀锌铁皮)时,溶液发烫并闻到了刺激性气味,这种反常现象引起了同学们的思考.从组成物质的元素角度分析,他们猜测气体可能是SO2、CO、CO2、H2中的一种或几种.为了确定该气体的成分,他们进行了如下探究.
查阅资料:
Ⅰ.SO2、CO2都能与碱溶液反应生成盐和水,CaSO3难溶于水;
Ⅱ.SO2能与酸性高锰酸钾溶液反应并使它褪色,上述其它气体不能.
实验探究:
(1)甲同学为了验证处理废金属材料产生的气体中是否含有CO2,把它直接通入澄清石灰水,并观察实验现象.
乙同学认为甲同学的做法不合理.请用化学方程式表示其原因______.
(2)同学们设计了一套合理的实验装置,如图所示(铁架台已略去).请你从下列试剂中选择所需药品并完成实验(药品可重复选用):澄清石灰水,氢氧化钠溶液,酸性高锰酸钾溶液,浓硫酸,无水硫酸铜,碱石灰 (假设每步反应都是完全的)
①写出E装置中试剂的名称或化学式______.
②若观察到______(填装置序号)中澄清石灰水变浑浊,证明原气体中有CO2;
③若观察到______现象,证明原气体中有H2无CO. klgua1cqc65_e51年前1
klgua1cqc65_e51年前1 -
 wwzy1028 共回答了25个问题
wwzy1028 共回答了25个问题 |采纳率96%解题思路:(1)二氧化硫也能使澄清石灰水变浑浊,根据气体中可能含有二氧化硫分析;
(2)要检验水的存在用无水硫酸铜;检验二氧化碳的存在用澄清石灰水,但要首先除去二氧化硫.(1)二氧化碳可使澄清石灰水变浑浊,但混合气体中可能含有二氧化硫,二氧化硫能与石灰水反应生成亚硫酸钙沉淀,也可以使澄清石灰水变浑浊,化学反应式是:SO2+Ca(OH)2═CaSO3↓+H2O,所以甲同学的做法不合理,
故答案为:SO2+Ca(OH)2═CaSO3↓+H2O;
(2)①E装置中试剂的名称应该是无水硫酸铜,可以检验经过D装置后有无水生成,从而检验氢气的存在;
故答案为:无水硫酸铜;
②要证明原气体中有CO2,首先装置A中的试剂应该是酸性高锰酸钾溶液,除去可能存在的二氧化硫,因为二氧化硫也可以使澄清的石灰水变浑浊;然后在装置B中加入澄清石灰水,澄清石灰水遇二氧化碳变浑浊,检验二氧化碳的存在,所以要观察到B中的澄清石灰水变浑浊,证明原气体中有CO2.
故答案为:B;
③D装置中黑色粉末变成红色,说明有还原气体存在,E中的无水硫酸铜变蓝,说明有水生成,继而说明混合气体中含有氢气;再就是F中的石灰水不变浑浊,说明没有二氧化碳生成,就是说混合气体中没有一氧化碳.就可证明原气体中有H2无CO,
故答案为:D装置中黑色粉末变成红色,E中的无水硫酸铜变蓝,F中的石灰水不变浑浊.点评:
本题考点: 常见气体的检验.
考点点评: 做好本题应该了解二氧化硫、无水硫酸铜可以检验水的存在、澄清石灰水检验二氧化碳的存在、一氧化碳和氢气具有还原性等性质,看似复杂的题目更需要同学们静心思考,方可迎刃而解.1年前查看全部
- 白铁皮(镀锌和铁)与马口铁(镀锡和铁)哪种更不容易生锈?用方程式解释
 重庆商业1年前1
重庆商业1年前1 -
 jinny_love 共回答了22个问题
jinny_love 共回答了22个问题 |采纳率90.9%镀锌板如果局部破损,则会加速降低其耐腐蚀的性能.马口铁则不会存在这种情况;另外,热镀锌板的镀层厚度要厚的多,而马口铁镀层一般只有2.8g/平方米,二者用途不同,可比性不大1年前查看全部
- 下列叙述正确的是 A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 B.在铁上镀锌时,锌棒作阴极,且电解液硫
下列叙述正确的是
A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 B.在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 C.用惰性电极电解Na 2 SO 4 溶液,阴阳两极产物的物质的量之比为1: 2 D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH  十月听雨1年前1
十月听雨1年前1 -
 谁也不会ff 共回答了13个问题
谁也不会ff 共回答了13个问题 |采纳率76.9%D
1年前查看全部
- 下列叙述中正确的是( )①锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液能加快反应速率;②镀层破损后,白铁(镀锌的铁)比
下列叙述中正确的是( )
①锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液能加快反应速率;②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)铁更易被腐蚀;③电镀时,应把待镀件置于电解槽的阴极;④用电解法精炼精铜时,粗铜作阳极,纯铜作阴极;⑤钢铁吸氧腐蚀时的正极反应式为2H2O+O2-4e-=4OH-.
A.①②④
B.①③④
C.①③④⑤
D.②④⑤ 自家的田地1年前1
自家的田地1年前1 -
 huazhong99 共回答了25个问题
huazhong99 共回答了25个问题 |采纳率100%解题思路:①根据原电池能加速负极金属和电极质的反应速率来回答;
②在原电池中,活泼金属做负极,负极金属更易腐蚀,正极金属被保护;
③根据电镀原理中,镀件和电镀液的选择原则来回答;
④用电解法精炼精铜时,粗铜作阳极,纯铜作阴极;
⑤钢铁吸氧腐蚀时的正极发生氧气得电子的反应.①锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液后,金属锌可以置换金属铜,形成原电池,原电池能加速负极金属和电极质的反应速率,故①正确;
②白铁(镀锌的铁)中,镀层破损后,Zn为负极,被腐蚀的是Zn,Fe被保护,马口铁(镀锡的铁)中,Fe为负极,被腐蚀的是Fe,Zn被保护,所以镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)铁更耐腐蚀,故②错误;
③根据电镀原理中,镀件作阳极,待镀件置于电解槽的阴极,故③正确;
④用电解法精炼精铜时,粗铜作阳极,纯铜作阴极,故④正确;
⑤钢铁吸氧腐蚀时的正极发生氧气得电子的反应,即2H2O+O2+4e-=4OH-,故⑤正确.
故选B.点评:
本题考点: 原电池和电解池的工作原理;金属的电化学腐蚀与防护.
考点点评: 本题是一道综合知识题目,考查学生对原电池原理的应用知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 帮忙算一下焊管和镀锌焊管的壁厚!
帮忙算一下焊管和镀锌焊管的壁厚!
规格 理论重量KG/M 壁厚
DN25 1.866
DN32 2.333
DN40 3.083
DN50 4.083
DN65 5.333
DN80 6.5
DN100 9.166
DN150 13.00
知道一个求理论重量的公式:理论重量=0.0246*壁厚*(外径-壁厚) 密码提示的问题1年前1
密码提示的问题1年前1 -
 cat991449 共回答了25个问题
cat991449 共回答了25个问题 |采纳率76%有一本书叫《化工机械基础》,you need it.第四章,第五章,oyes!i still remember.1年前查看全部
- 不锈钢与锌接触腐蚀不锈钢与镀锌件接触置于空气中,是否存在阳极氧化,谁先被腐蚀?说明原因不懂的或初中文化水平的不要乱说
 枫叶_飘泪1年前2
枫叶_飘泪1年前2 -
 afmarrage 共回答了22个问题
afmarrage 共回答了22个问题 |采纳率90.9%不锈钢已经不是铁单质了.他的成分已经变了.所以楼上说的不对1年前查看全部
大家在问
- 1本人中学生,求一句用韵的励志座右铭
- 2已知y=ax^2-bx+5(a≠0),当x=2时,y有最小值1,求a.b的值.
- 3什么是写意篆刻
- 4初中化学怎样检验某些酸和碱(题如下)
- 5与黄梁一梦有关的成语此成语要在意思上与黄梁一梦类似或相近
- 6初唐,盛唐,中唐和晚唐分别在公元几年?如题
- 7数列{an}为等差数列,化简0Cn*a1+1Cn*a2+...+nCn*a(n+1)
- 8含风花雪月的诗句
- 91平方公里等于多少米
- 10《父子性刚》中的第一句''有父子俱性刚不肯让人者''用现代汉语翻译出来
- 11玛丽居里白净端庄的脸庞显出坚定又略带淡泊的神情怎样缩句
- 12贝多芬为什么要作 月光曲
- 13SO2和CL2用石蕊试剂能不能鉴别 为什么呢
- 14间苯二酚试剂与各种糖类混匀,沸水加热后有颜色变化的原因是?
- 151.Where are you __?2.i'm going to Dalian.(go do going doing)
