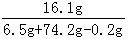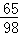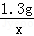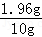把48.5g锌铜合金投入足量盐酸中,恰好完全反应,得到0.5molH2.试计算:
 谷晓强2022-10-04 11:39:541条回答
谷晓强2022-10-04 11:39:541条回答(1)该合金中锌的质量______;(2)该合金中锌、铜的物质的量之比______.

已提交,审核后显示!提交回复
共1条回复
 甜心小猪 共回答了12个问题
甜心小猪 共回答了12个问题 |采纳率91.7%- 解题思路:(1)铜不与盐酸反应,锌与盐酸反应生成氢气,根据反应方程式Zn+2HCl═ZnCl2+H2↑计算出锌的物质的量及质量;
(2)根据合金的总质量、锌的质量计算出铜的质量,根据n=[m/M]计算出铜的质量,再计算出锌、铜的物质的量之比.(1)把48.5g锌铜合金投入足量盐酸中,铜不与盐酸反应,氢气为锌与盐酸反应生成的,
据反应方程式Zn+2HCl═ZnCl2+H2↑可知,生成0.5mol氢气消耗Zn的物质的量为0.5mol,
需要锌的质量为:m(Zn)=65g/mol×0.5mol=32.5g,
故答案为:32.5g;
(2)48.5g锌铜合金中含有32.5g锌,则含有铜的质量为:48.5g-32.5g=16g,
16g铜的物质的量为:n(Cu)=[16g/64g/mol]=0.25mol,
则合金中锌、铜的物质的量之比为:0.5mol:0.25mol=2:1,
故答案为:2:1.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查了混合物反应的计算,侧重基础知识的考查,题目难度不大,注意掌握物质的量与摩尔质量等物理量之间的关系,明确反应原理即可解答. - 1年前
相关推荐
- 一块锌铜合金的质量是840g,现在按锌.铜1比2的比重新熔铸,需添加120g的铜,这块合金锌铜多少克?
 chyewn1年前1
chyewn1年前1 -
 笨笨文竹 共回答了13个问题
笨笨文竹 共回答了13个问题 |采纳率100%1年前查看全部
- (2013•永修县模拟)黄铜是锌铜合金,在生活中被广泛应用,小斌同学为测定其组成,从冶金厂称取25.0g黄铜屑逐滴加入稀
(2013•永修县模拟)黄铜是锌铜合金,在生活中被广泛应用,小斌同学为测定其组成,从冶金厂称取25.0g黄铜屑逐滴加入稀硫酸至黄铜屑的质量不再发生变化,一共用去稀硫酸80.0g,同时收集到气体4.49L(气体密度为0.089g/L),请计算:
(1)该黄铜片中铜的质量是多少?
(2)稀硫酸溶质的质量分数是多少?
(3)小斌将反应后剩余的固体置于坩埚中加热烘干后称量,发现质量大于上述计算所得单质铜的质量,你觉得其原因可能是______. chenai9151年前1
chenai9151年前1 -
 幸福地扬起嘴角 共回答了15个问题
幸福地扬起嘴角 共回答了15个问题 |采纳率86.7%解题思路:(1)根据锌与硫酸反应的化学方程式和氢气的质量可以求出锌的质量,进而求得铜的质量;
(2)根据锌与硫酸反应的化学方程式和氢气的质量可以求出稀硫酸中溶质的质量,进而求质量分数;
(3)在将反应后剩余的固体置于坩埚中加热烘干过程中,有一部分铜与氧气反应生成氧化铜,导致质量增加.氢气的质量为:4.49L×0.089g/L=0.4g
设黄铜中Zn的质量为x,稀硫酸中溶质质量为y
Zn+H2SO4═ZnSO4+H2↑
6598 2
x y 0.4g
[65/x=
98
y=
2
0.4g]
x=13g,y=19.6g
(1)该黄铜片中铜的质量是:
25g−13g
25g×00%=48%;
答:该黄铜片中铜的质量是48%;
(2)稀硫酸溶质的质量分数是:
19.6g
80g×100%=24.5%;
答:稀硫酸溶质的质量分数是24.5%;
(3)在将反应后剩余的固体置于坩埚中加热烘干过程中,有一部分铜与氧气反应生成氧化铜,导致质量增加;
故答案为:铜与氧气反应生成氧化铜.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查根据化学方程式的计算,注意格式要规范.1年前查看全部
- 某化学兴趣小组的同学将一块锌铜合金加工成粉末,并称取相同质量的样品数份,用稀硫酸和下图所示的适当装置进行实验,粗略测定合
某化学兴趣小组的同学将一块锌铜合金加工成粉末,并称取相同质量的样品数份,用稀硫酸和下图所示的适当装置进行实验,粗略测定合金中铜和锌的质量分数.

实验方案如下:
(1)甲同学的方案:取定量样品一份,加入稀硫酸至气体不再产生,测出氢气体积,求出氢气质量,再根据化学方程式进行计算.采用该方案进行实验,应选用的装置有(用字母表示)______,组装装置时导管口的连接顺序是(填导管接口处序号)______.
(2)乙同学的方案:取定量样品一份,加入足量的稀硫酸充分反应,称出铜的质量,再进行计算.采用该方案进行实验,需要增加的玻璃仪器有______.
(3)丙同学认为只选用D、F进行实验,也可以粗略的测定出合金中锌和铜的质量分数.请分析丙同学的实验方案,采用该方案进行实验,如果要称量的次数最少,应该称量的数据有______. SOUTH小朱1年前1
SOUTH小朱1年前1 -
 8b45346e0a092e0e 共回答了20个问题
8b45346e0a092e0e 共回答了20个问题 |采纳率90%解题思路:(1)本题要求有制取氢气的装置,收集氢气的装置,还需要间接的测量氢气的体积的装置;连接的顺序关键在于④⑤两步.
(2)由题意知还需要增加一个过滤装置.
(3)由题意知,丙同学的方案是通过反应前后的质量差求出氢气的质量,所以称量的数据就是反应前金属、烧杯和溶液的总质量,反应后烧杯、溶液和剩余金属的总质量.答:(1)由题意知所选择的装置有制取氢气的装置,收集氢气的装置,还需要间接的测量氢气的体积的装置,装置连接的顺序是产生的气体①从⑤进入,气体增加产生压力把水排出,从②进入量筒,即可测出水的体积,也就是氢气的体积.故答案为;A、E、B,①⑤④②
(2)由题意知还需要增加一个过滤装置,过滤需要的仪器有,铁架台、漏斗、烧杯、玻璃棒,故答案为:漏斗、玻璃棒
(3)丙同学的方案是通过反应前后总质量的差求出氢气的质量,所以要测量的数据就是反应前金属、烧杯和溶液的总质量,反应后烧杯、溶液和剩余金属的总质量.故答案为:反应前金属、烧杯和溶液的总质量,反应后烧杯、溶液和剩余金属的总质量点评:
本题考点: 实验探究物质的组成成分以及含量;仪器的装配或连接;常用仪器的名称和选用;金属活动性顺序及其应用;酸的化学性质.
考点点评: 本题贵在考查常用仪器的选配,以及正确的连接,要求学生在平时的实验课中认真操作,培养自己动手、动脑的能力.1年前查看全部
- 络合滴定问题在pH=5~6时,以二甲酚橙作指示剂,用EDTA测定黄铜(锌铜合金)中锌的质量分数,现有以下几种方法标定ED
络合滴定问题
在pH=5~6时,以二甲酚橙作指示剂,用EDTA测定黄铜(锌铜合金)中锌的质量分数,现有以下几种方法标定EDTA溶液的浓度.
1.a.以氧化锌作基准物质,在pH=10.0的氨性缓冲溶液中,以铬黑T作指示剂,标定EDTA溶液
b.以碳酸钙作基准物质,在pH=12.0时,以KB指示剂指示终点,标定EDTA溶液
c.以氧化锌作基准物质,在pH=6.0时,以二甲酚橙作指示剂,标定EDTA溶液
试问,用上述哪一种方法标定EDTA溶液的浓度最合适?试简要说明其理由. 活到老唱到老1年前1
活到老唱到老1年前1 -
 b0608006 共回答了16个问题
b0608006 共回答了16个问题 |采纳率81.3%都可以,因为金属离子与EDTA都是以1:1络合的,只不过最好还是在条件相同的环境下测定,避免酸度不同造成的误差——水解作用的干扰.所以,最适宜的应该是1、C.1年前查看全部
- (2013•黄冈二模)有两块锌铜合金的质量分别为10千克、15千克,这两块合金的含铜的质量分数不同,现分别从这两块合金中
(2013•黄冈二模)有两块锌铜合金的质量分别为10千克、15千克,这两块合金的含铜的质量分数不同,现分别从这两块合金中各切下一块质量相同的合金,交换后分别与另一块合在一起熔化,冷却后测得这两块合金含铜的质量分数相同,求切下的一块合金的质量.
 verygoodvest1年前1
verygoodvest1年前1 -
 傻根2046 共回答了24个问题
傻根2046 共回答了24个问题 |采纳率79.2%解题思路:设切下的一块重量是x千克,设10千克和15千克的合金的含铜的质量分数为a,b,则交换后第一块合金含铜的质量为(10-x)a+xb,第二块合金含铜量为(15-x)b+xa,根据交换后两块合金含铜的质量分数相同,可得出方程,解出即可.设切下的一块重量是x千克,设10千克和15千克的合金的含铜的百分比为a,b,
则交换后第一块合金含铜的质量为(10-x)a+xb,第二块合金含铜量为(15-x)b+xa,
由题意得:
(10−x)a+xb
10=
(15−x)b+xa
15,
整理得:(b-a)x=6(b-a),
解得:x=6.
答:切下的一块合金的质量为6千克.点评:
本题考点: 一元一次方程的应用.
考点点评: 此题主要考查了用一元一次方程解决实际问题,根据熔炼后两者含铜的百分比恰好相等得到相应的等量关系是解决本题的关键,注意一些必须的量没有时,应设其未知数,在解答过程中消去无关未知数.1年前查看全部
- 将15g锌铜合金放入100g稀硫酸中,恰好完全反应,称的剩余物质的总质量是114.6g,则此合金中锌的质量分数是
 ll的猫ll1年前1
ll的猫ll1年前1 -
 粉红璎珞 共回答了15个问题
粉红璎珞 共回答了15个问题 |采纳率93.3%铜与稀硫酸不反应,
Zn + H2SO4 =ZnSO4 +H2 质量变化
65 98 161 2
m 15+100-114.6=0.4g
Zn的质量=13g
质量分数=13/15*100%=87%1年前查看全部
- 锌铜合金20g 逐滴加入9.8%的稀硫酸至反应完全 产生气体的质量为0.2g反应后溶液中溶质的质量分数为多少?(
锌铜合金20g 逐滴加入9.8%的稀硫酸至反应完全 产生气体的质量为0.2g反应后溶液中溶质的质量分数为多少?(
原题:测定锌铜合金的组成,称取该样品20g,向其中逐滴加入9.8%的稀硫酸至反应完全,此时产生气体的质量为0.2g.那么反应后溶液中溶质的质量分数为多少?(结果保留至0.1%)
 吴hh1年前1
吴hh1年前1 -
 帅帅霆锋 共回答了23个问题
帅帅霆锋 共回答了23个问题 |采纳率78.3%锌反应,铜不反应
Zn+H2SO4=ZnSO4+H2
65 98 161 2
x z y 0.2g
65/x=161/y=2/0.2g=98/z
x=6.5g
y=16.1g
z=9.8g
反应后溶液中溶质的质量分数为 16.1g/(6.5g+9.8g/9.8%-0.2g)*100%=15.3%1年前查看全部
- (2011•鞍山)小宇的妈妈买了一条黄金项链,小宇想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂
(2011•鞍山)小宇的妈妈买了一条黄金项链,小宇想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂是( )
A.AlCl3溶液
B.Cu(NO3)2溶液
C.H2SO4溶液
D.AgNO3溶液 junior_lai1年前1
junior_lai1年前1 -
 qfying2005 共回答了17个问题
qfying2005 共回答了17个问题 |采纳率82.4%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.A、锌铜与AlCl3溶液都不反应,无法证明,故A错误;
B、合金中的锌能与硝酸铜反应生成铜,表面有红色固体析出,故B正确;
C、合金中的锌能与硫酸反应生成氢气,有气泡冒出,故C正确;
D、锌和铜能与硝酸银反应生成银,表面有银白色固体析出,故D正确,
故选:A.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 将一块锌铜合金投入74.2g稀H2SO4中,恰好完全反应,生存氢气0.2g
将一块锌铜合金投入74.2g稀H2SO4中,恰好完全反应,生存氢气0.2g
求:(1)所用稀硫酸的溶质的质量分数
(2)反应后所得溶液的溶质质量分数
(3)实验室现有98%的浓硫酸20g,需要多少克才能配制这种浓度的稀盐酸 天天向上111年前1
天天向上111年前1 -
 放屁ing 共回答了19个问题
放屁ing 共回答了19个问题 |采纳率89.5%(1)所用稀硫酸的溶质的质量分数
0.2×98/2/74.2=13.2%
(2)反应后所得溶液的溶质质量分数
161×0.2/2/(74.2-0.2+65×0.2/2)=20%
(3)体面有错.是否是这样:
实验室现有98%的浓硫酸20g,需要加水多少克才能配制这种浓度的稀硫酸
20×(98/13.2-1)=128.5克1年前查看全部
- 锌铜合金与盐酸反应,怎么计算产生的电量?
 hnwczx1年前1
hnwczx1年前1 -
 sdzbxiaoyu 共回答了15个问题
sdzbxiaoyu 共回答了15个问题 |采纳率100%根据产生的氢气的多少,1mol氢气转移2mol电子,再乘以1个电子的电量,就可以了.加油!1年前查看全部
- 某黄铜(锌铜合金)10g ,与足量的稀硫酸反应,放出氢气0.2g ,求该黄铜中锌的纯度?
某黄铜(锌铜合金)10g ,与足量的稀硫酸反应,放出氢气0.2g ,求该黄铜中锌的纯度?
怎么算 写清楚点
求出锌的质量后除黄铜的质量 为什么要除?怎么不是10g-6.5g呢? 4908698201年前2
4908698201年前2 -
 xiasister 共回答了13个问题
xiasister 共回答了13个问题 |采纳率92.3%铜不与硫酸反应,放出的氢气则完全由锌铜合金中的Zn和H2SO4反应生得
Zn+H2SO4=ZnSO4H2(气标)
设Zn x g
(Zn的相对原子质量):(氢气的相对分子质量)=x:0.2
求出锌的质量后除黄铜的质量再乘100%
x10*100%
晚安同学~1年前查看全部
- 将15g锌铜合金放入100g稀硫酸中,恰好完全反应,称的剩余物质的总质量是114.6g,则此合金中锌的质量分数是多少.
 138748723321年前1
138748723321年前1 -
 nhh6av 共回答了24个问题
nhh6av 共回答了24个问题 |采纳率83.3%反应减少的质量是生成H2的质量,是15+100-114.6=0.4g
设合金中锌的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
65/x=2/0.4
x=13g
锌的质量分数=13/15*100%=86.7%
答:此合金中锌的质量分数是86.7%1年前查看全部
- 小宇的妈妈买了一条黄金项链,小宇想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂是( ) A.A
小宇的妈妈买了一条黄金项链,小宇想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂是( ) A.AlCl 3 溶液 B.Cu(NO 3 ) 2 溶液 C.H 2 SO 4 溶液 D.AgNO 3 溶液  lovejjyy5201年前1
lovejjyy5201年前1 -
 萧极雨 共回答了19个问题
萧极雨 共回答了19个问题 |采纳率89.5%A、锌铜与AlCl 3 溶液都不反应,无法证明,故A错误;
B、合金中的锌能与硝酸铜反应生成铜,表面有红色固体析出,故B正确;
C、合金中的锌能与硫酸反应生成氢气,有气泡冒出,故C正确;
D、锌和铜能与硝酸银反应生成银,表面有银白色固体析出,故D正确,
故选A.1年前查看全部
- 小雨的妈妈买了一条黄金项链,小雨想通过实验探究这条黄金项链是否为锌铜合金制成的纺制品,他不能选的试剂是()A.氯化铝溶液
小雨的妈妈买了一条黄金项链,小雨想通过实验探究这条黄金项链是否为锌铜合金制成的纺制品,他不能选的试剂是()A.氯化铝溶液B.硝酸铜溶液C.硫酸溶液D.硝酸银溶液
 高山流水任我游1年前3
高山流水任我游1年前3 -
 只剩肉一个 共回答了1个问题
只剩肉一个 共回答了1个问题 |采纳率d1年前查看全部
- 将一块锌铜合金投入74.2g稀H 2 SO 4 中,恰好完全反应,生成氢气0.2g。求:
将一块锌铜合金投入74.2g稀H 2 SO 4 中,恰好完全反应,生成氢气0.2g。求:
(1)求锌铜合金中锌的质量;
(2)反应后所得溶液的溶质质量分数;
(3)实验室现有98%的浓硫酸20 g,需要多少克水才能配制成19.6%的稀硫酸? itx1001年前1
itx1001年前1 -
 jasonl55 共回答了22个问题
jasonl55 共回答了22个问题 |采纳率95.5%1年前查看全部
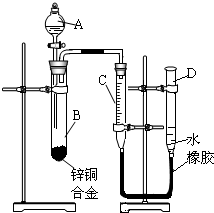
- 某学习小组用如右图所示装置测定锌铜合金中锌、铜的质量分数.
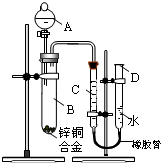 某学习小组用如右图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如右图所示装置测定锌铜合金中锌、铜的质量分数.
(1)实验前,先将锌铜合金在稀酸中浸泡片刻,其目的是:______.
(2)实验操作步骤有:检查气密性,将药品和水装入各仪器中,连接好装置后,再进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性.上述再进行的操作的顺序是______
(填序号);记录C的液面位置时,除视线平视外,还应______;
(3)B中发生反应的化学方程式为:______;
(4)若实验用锌铜合金的质量为ag,与酸充分反应后,测得氢气体积为VL,为求出合金中锌、铜的质量分数,还缺少的一个数据是______.
A.反应前加入稀酸的体积B.反应前加入稀酸的质量分数C.实验前反应装置中空气的体积D.实验条件下氢气的密度
(5)若实验用锌铜合金的质量为ag,与酸充分反应后,B中剩余固体的质量为bg,则锌的质量分数为
×100%a−b a ;
×100%a−b a
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得锌的质量分数将______(填“偏大”“偏小”或“不受影响”). 5984267611年前1
5984267611年前1 -
 hwbsxiaoy 共回答了17个问题
hwbsxiaoy 共回答了17个问题 |采纳率94.1%解题思路:(1)实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;
(2)根据C的位置的变化判断水的体积变化,从而得知气体的体积,读数时左右液面要持平;
(3)依据锌能与酸反应生成氢气而铜不可以来进行可书写化学方程式;
(4)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度;
(5)求出锌的质量从而可以求得锌的质量分数,以此进行判断;
(6)未洗涤过滤所得的不溶物,会导致铜的质量偏大,锌的质量偏小.(1)铜锌合金表面有氧化膜,实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜,故答案为除去合金表面的氧化膜;
(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,记录C的液面位置时,除视线平视外,还应使D和C的液面相平,故答案为:⑤①④③②;使D和C的液面相平;
(3)依据锌能与酸反应生成氢气而铜不可以来进行,所用的酸可以是稀盐酸也可以是硫酸,反应方程式为:Zn+H2SO4═ZnSO4+H2↑或(Zn+2HCl═ZnCl2+H2↑),
故答案为:Zn+H2SO4═ZnSO4+H2↑;
(4)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度,故答案为:D;
(5)铜锌合金的质量为ag,B中剩余固体的质量为bg,则锌的质量为(a-b)g,从而可以求得锌的质量分数为
a−b
a×100%,故答案为:
a−b
a×100%;
(6)未洗涤过滤所得的不溶物,会导致铜的质量偏大,从而锌的质量偏小,得到锌的质量分数将偏小,故答案为:偏小.点评:
本题考点: 探究物质的组成或测量物质的含量;化学方程式的书写;化学方程式的有关计算;常见金属的活动性顺序及其应用;生活中常见合金的组成;化学实验操作的先后顺序.
考点点评: 本题探究了铜锌合金中铜和锌的质量分数的测定,完成此题,可以依据铜和锌的性质,根据题干提供的信息进行.1年前查看全部
- 某学习小组用如右图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如右图所示装置测定锌铜合金中锌、铜的质量分数.

(1)实验前,先将锌铜合金在稀酸中浸泡片刻,其目的是:______.
(2)实验操作步骤有:检查气密性,将药品和水装入各仪器中,连接好装置后,再进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性.上述再进行的操作的顺序是______
(填序号);记录C的液面位置时,除视线平视外,还应______;
(3)B中发生反应的化学方程式为:______;
(4)若实验用锌铜合金的质量为ag,与酸充分反应后,测得氢气体积为VL,为求出合金中锌、铜的质量分数,还缺少的一个数据是______.
A.反应前加入稀酸的体积B.反应前加入稀酸的质量分数C.实验前反应装置中空气的体积D.实验条件下氢气的密度
(5)若实验用锌铜合金的质量为ag,与酸充分反应后,B中剩余固体的质量为bg,则锌的质量分数为______;
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得锌的质量分数将______(填“偏大”“偏小”或“不受影响”). 临安1年前1
临安1年前1 -
 若木拂日 共回答了15个问题
若木拂日 共回答了15个问题 |采纳率100%解题思路:(1)实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;
(2)根据C的位置的变化判断水的体积变化,从而得知气体的体积,读数时左右液面要持平;
(3)依据锌能与酸反应生成氢气而铜不可以来进行可书写化学方程式;
(4)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度;
(5)求出锌的质量从而可以求得锌的质量分数,以此进行判断;
(6)未洗涤过滤所得的不溶物,会导致铜的质量偏大,锌的质量偏小.(1)铜锌合金表面有氧化膜,实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜,故答案为除去合金表面的氧化膜;
(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,记录C的液面位置时,除视线平视外,还应使D和C的液面相平,故答案为:⑤①④③②;使D和C的液面相平;
(3)依据锌能与酸反应生成氢气而铜不可以来进行,所用的酸可以是稀盐酸也可以是硫酸,反应方程式为:Zn+H2SO4═ZnSO4+H2↑或(Zn+2HCl═ZnCl2+H2↑),
故答案为:Zn+H2SO4═ZnSO4+H2↑;
(4)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度,故答案为:D;
(5)铜锌合金的质量为ag,B中剩余固体的质量为bg,则锌的质量为(a-b)g,从而可以求得锌的质量分数为
a−b
a×100%,故答案为:
a−b
a×100%;
(6)未洗涤过滤所得的不溶物,会导致铜的质量偏大,从而锌的质量偏小,得到锌的质量分数将偏小,故答案为:偏小.点评:
本题考点: 探究物质的组成或测量物质的含量;化学方程式的书写;化学方程式的有关计算;常见金属的活动性顺序及其应用;生活中常见合金的组成;化学实验操作的先后顺序.
考点点评: 本题探究了铜锌合金中铜和锌的质量分数的测定,完成此题,可以依据铜和锌的性质,根据题干提供的信息进行.1年前查看全部
- 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
(1)实验前,先将锌铜合金在稀酸中浸泡片刻,其目的是:______;
(2)实验操作步骤有:检查气密性,将药品和水装入各仪器中,连接好装置后,再进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性.
上述再进行的操作的顺序是______ (填序号);
(3)若实验用锌铜合金的质量为ag,与稀硫酸充分反应后,测得氢气体积为V L,为求出合金中锌、铜的质量分数,还缺少的一个数据是______;
A.反应前加入稀硫酸的体积 B.反应前加入稀硫酸的质量分数
C.实验前反应装置中空气的体积 D.实验条件下氢气的密度
(4)B中发生反应的化学方程式为______;
(5)实验过程中,若未洗涤过滤所得的不溶物,则测得锌的质量分数将______ (填“偏大”、“偏小”或“不受影响”).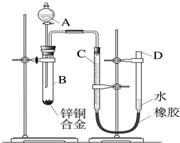
 浪漫小羽1年前1
浪漫小羽1年前1 -
 熊熊大火31 共回答了21个问题
熊熊大火31 共回答了21个问题 |采纳率95.2%(1)实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行...1年前查看全部
- 将一块锌铜合金投入74.2克稀硫酸中,恰好完全反应,生成氢气0.2克.
将一块锌铜合金投入74.2克稀硫酸中,恰好完全反应,生成氢气0.2克.
(1)求所用稀硫酸的溶质质量分数.
(2)求反应后所得溶液的溶质质量分数.
(3)实验室现有98%的浓硫酸20克,需要多少克水才能配制成这种浓度的稀硫酸? gaohongchen1年前1
gaohongchen1年前1 -
 香水枣枣 共回答了19个问题
香水枣枣 共回答了19个问题 |采纳率100%Zn + H2SO4 = ZnSO4+ H2
65 98 161 2
Z=6.5g X=9.8g Y=16.1g 0.2g
求所用稀硫酸的溶质质量分数== 9.8g÷74.2g×100%=
求反应后所得溶液的溶质质量分数=16.1g÷(74.2g+6.5g-0.2g)×100%1年前查看全部
- 一块锌铜合金,铜锌比是2比3,加入6克锌,得到新合金中铜与锌的比是1比2,求原来合金的质量.
 lzxivy20051年前2
lzxivy20051年前2 -
 乖崽崽 共回答了15个问题
乖崽崽 共回答了15个问题 |采纳率86.7%原来合金的质量是30g.
设原来合金的质量为x,铜的质量是x*2/5=0.4x,锌的质量是x-0.4x=0.6x
0.4x/(0.6x+6)=1/2
x=30g1年前查看全部
- 50克锌铜合金样品 放入100克稀硫酸中 恰好完全反应 产生氢气一克 试计算(1)所用稀硫酸中溶质的质量分数.
50克锌铜合金样品 放入100克稀硫酸中 恰好完全反应 产生氢气一克 试计算(1)所用稀硫酸中溶质的质量分数.
(2)上述100克稀硫酸若用98%的浓硫酸配制 需要多少克 hexife1年前1
hexife1年前1 -
 yxzq 共回答了14个问题
yxzq 共回答了14个问题 |采纳率85.7%已知铜不能跟稀硫酸反应,所以只有锌跟硫酸反应产生H2
Zn +H2SO4==ZnSO4 + H2
98 2
X 1 设定反应了Xg硫酸,解得X=49g 由于恰好反应,所以硫酸没有剩余
质量分数为49/100 x100%=49%
(2)设需要浓硫酸为Xg 那么0.98X=49 X=50g 所以需要98%硫酸50g.1年前查看全部
- 将一块锌铜合金投入74.2稀H2SO4中,恰好完全反应,生存氢气0.2g
将一块锌铜合金投入74.2稀H2SO4中,恰好完全反应,生存氢气0.2g
求:(1)所用稀硫酸的溶质的质量分数
(2)反应后所得溶液的溶质质量分数
(3)实验室现有98%的浓硫酸20g,需要多少克才能配制这种浓度的稀盐酸
用方程解 老搞不懂 哎. ii9988_01年前1
ii9988_01年前1 -
 kaka19870122 共回答了16个问题
kaka19870122 共回答了16个问题 |采纳率93.8%不懂74.2是什么
说说思路吧
生成氢气0.2克就是0.1mol说明有0.1mol锌和0.1mol硫酸反应了,生成了0.1mol硫酸锌,用溶质的质量除以溶液质量得到质量分数
一定要列方程的话设锌、硫酸、硫酸锌分别为x,y,zmol,得到x/1=y/1=z/1=0.1/1(因为化学计量数都是1啊)
第三题是指水吗,那么设其为ag
硫酸共20*98%g 有20*98%/(a+20)=某某浓度(前面算出来的)就行了1年前查看全部
- (2006•玄武区二模)测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄
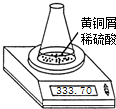 (2006•玄武区二模)测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):
(2006•玄武区二模)测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):
(1)反应生成H2的总质量为______g.反应时间/min 0 1 2 3 4 5 6 7 8 锥形瓶及所盛物质总质量/g 335.70 335.54 335.44 335.38 335.34 335.32 335.31 335.30 335.30
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.若该数据用a表示,求黄铜屑中锌的质量分数(写出计算过程).
(3)请你再设计一个测定黄铜屑中锌的质量分数的方案. 飞飞狒狒1年前1
飞飞狒狒1年前1 -
 小鸟Q一人 共回答了17个问题
小鸟Q一人 共回答了17个问题 |采纳率100%解题思路:(1)根据质量守恒定律,反应生成的H2的总质量为反应前后烧杯及所盛物质总质量之差.
(2)黄铜屑中锌的质量可以根据锌与硫酸的反应,结合产生的氢气的质量计算得到,计算锌的质量分数,还必须知道黄铜屑的总质量(用a表示).
(3)根据锌与铜的化学性质知,锌与稀盐酸也可以发生反应,而铜与稀盐酸不发生反应.(1)因为锌铜合金中的锌可以与稀硫酸反应生成氢气,结合表中所给数据可知,锥形瓶总质量的减少量即为氢气的生成量,即:反应生成氢气的总质量:335.70g-335.30g=0.4g
故答案为:0.4g;
(2)锌的质量分数=[锌的质量/黄铜的质量]×100%,而锌的质量可以通过释放氢气的质量求出,但缺少黄铜的质量;
故答案为:黄铜屑的质量;
设:锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
[65/x]=[2/0.4g],
解得x=13g
锌的质量分数=[锌的质量/黄铜的质量]×100%=[13/a]×100%
答:黄铜屑中锌的质量分数为 [13/a]×100%.
(3)称取一定量黄铜屑,与足量盐酸反应后,洗涤不溶物,干燥,称重,从而计算锌的质量分数.点评:
本题考点: 根据化学反应方程式的计算;实验探究物质的组成成分以及含量.
考点点评: 本题以硫酸和金属(Zn)的反应为实验原理,将实验数据以表格的形式呈现,考查了阅读、分析、处理数据和化学计算的能力.1年前查看全部
- 小宇为妈妈买了一条黄金项链,小宇想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂或方法是( )
小宇为妈妈买了一条黄金项链,小宇想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂或方法是( )
A.AlCl3溶液
B.灼烧
C.稀硫酸
D.AgNO3溶液 sivar1年前1
sivar1年前1 -
 J_J_cool 共回答了11个问题
J_J_cool 共回答了11个问题 |采纳率81.8%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.A、锌铜与AlCl3溶液都不反应,无法证明,故A错误;
B、灼烧后合金中的铜能与氧气反应生成氧化铜,表面变黑色,但是真金不会,故B正确;
C、合金中的锌能与硫酸反应生成氢气,有气泡冒出,故C正确;
D、锌和铜能与硝酸银反应生成银,表面有银白色固体析出,故D正确,
故选:A.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 一块锌铜合金的质量是840g.若按锌与铜1:2的比重新熔铸,则需要再添加120g铜.这块合金中原有锌,铜各有多少克?
 想请教高手1年前1
想请教高手1年前1 -
 深情2 共回答了22个问题
深情2 共回答了22个问题 |采纳率95.5%我会1年前查看全部
- 小宇的妈妈买了一条黄金项链,小宇想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂是( )
小宇的妈妈买了一条黄金项链,小宇想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂是( )
A. AlCl3溶液
B. Cu(NO3)2溶液
C. H2SO4溶液
D. AgNO3溶液 浅浅深深1年前10
浅浅深深1年前10 -
 葵花弄 共回答了15个问题
葵花弄 共回答了15个问题 |采纳率93.3%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.A、锌铜与AlCl3溶液都不反应,无法证明,故A错误;
B、合金中的锌能与硝酸铜反应生成铜,表面有红色固体析出,故B正确;
C、合金中的锌能与硫酸反应生成氢气,有气泡冒出,故C正确;
D、锌和铜能与硝酸银反应生成银,表面有银白色固体析出,故D正确,
故选:A.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- (2013•厦门)为测定锌铜合金中锌的含量,取该合金放入如图 盛有稀硫酸的锥形瓶中,发生反应:Zn
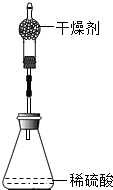 (2013•厦门)为测定锌铜合金中锌的含量,取该合金放入如图盛有稀硫酸的锥形瓶中,发生反应:Zn+H2SO4=ZnSO4+H2↑.多次实验后,取平均值所得数据如下表:
(2013•厦门)为测定锌铜合金中锌的含量,取该合金放入如图盛有稀硫酸的锥形瓶中,发生反应:Zn+H2SO4=ZnSO4+H2↑.多次实验后,取平均值所得数据如下表:
若不考虑干燥剂吸收空气中的水蒸气,计算:反应前 充分反应后装置及反应剩余物质质量 装置和足量的稀硫酸质量 锌铜合金质量 342.10g 16.00g 357.70g
(1)根据质量守恒定律求生成氢气的质量.
(2)该合金中锌的质量分数. 中年女人1年前1
中年女人1年前1 -
 wwl9661 共回答了20个问题
wwl9661 共回答了20个问题 |采纳率95%解题思路:(1)根据锌和硫酸反应生成氢气而铜不反应,所以反应前后质量减少的质量就是氢气的质量进行解答;
(2)根据氢气的质量求出该合金中锌的质量以及该合金中锌的质量分数进行解答.(1)依题意可得
氢气的质量=342.10g+16.00g-357.70g
=0.4g
答:氢气的质量为0.4g
(2)设该合金中锌的质量分数为x.
Zn+H2SO4 ═ZnSO4+H2↑
65 2
16.00g×x 0.4g
[65/16.00g×x=
2
0.4g]
x=81.25%
答:该合金中锌的质量分数为81.25%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 解此题的关键是审清题意,找出突破口,再结合方程式进行计算,可以得到问题答案.1年前查看全部
- 黄铜的外观与黄金及其相似,但其化学成分是锌铜合金.(1)写出如何识别真假黄金的方法(物理方法1种,化学方法2种).(2)
黄铜的外观与黄金及其相似,但其化学成分是锌铜合金.(1)写出如何识别真假黄金的方法(物理方法1种,化学方法2种).(2)取10克黄铜,加入足量的盐酸溶液,充分反应,产生气体0.2克,分析该黄铜的成分.(H1 Cu64 Zn65)
 陪伴1年前1
陪伴1年前1 -
 vc15love 共回答了19个问题
vc15love 共回答了19个问题 |采纳率78.9%(1)物理:测密度.化学:滴加稀HCl看是否有气体生成;放在酒精灯上加热,看是否有变化(真金不怕火炼)
(2)Zn + 2HCl = ZnCl2 + H2(箭头)
65 2
xg 0.2g
65/x=2/0.2 解得:x=6.5g
mCu=10g-6.5g=3.5g
Zn%=65%,Cu%=35%
成分:锌65% 铜35%1年前查看全部
- 锌+铜+碳=锌铜合金的化学方程式
 迂民1年前1
迂民1年前1 -
 海南真美 共回答了18个问题
海南真美 共回答了18个问题 |采纳率94.4%锌+铜+碳——加热熔合——形成锌铜合金
这不是化学变化,所以上述式子不是化学方程式,
只是合金形成的一种文字表达式而已
仅供参考,如帮到了你,
【你的10分满意,我们团队的无限动力】1年前查看全部
- 将一块锌铜合金投入74.2g稀H2SO4中,,恰好完全反应声称氢气0.2g求反映后所得溶液的溶质质量分数?
将一块锌铜合金投入74.2g稀H2SO4中,,恰好完全反应声称氢气0.2g求反映后所得溶液的溶质质量分数?
实验室现有98%的浓硫酸20g,需要多少克水才能配制19.6%的稀硫酸?
 心宝贝1年前1
心宝贝1年前1 -
 tt买房子 共回答了12个问题
tt买房子 共回答了12个问题 |采纳率100%1.硫酸锌的质量:0.2*161/2=16.1
锌的质量:0.2*65/2=6.5
16.1/6.5+74.2-0.2
2. 20*98%/19.6%-20*98%1年前查看全部
- 小雨为妈妈买了一条黄金项链,小雨想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选的试剂是( )
小雨为妈妈买了一条黄金项链,小雨想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选的试剂是( )
A.AlCl3溶液
B.Cu(NO3)3溶液
C.稀硫酸
D.AgNO3溶液 zhuxiaomei20001年前1
zhuxiaomei20001年前1 -
 f一8809 共回答了17个问题
f一8809 共回答了17个问题 |采纳率100%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.A、锌铜与AlCl3溶液都不反应,无法证明,故A错误;
B、合金中的锌能与硝酸铜反应生成铜,表面有红色固体析出,故B正确;
C、合金中的锌能与硫酸反应生成氢气,有气泡冒出,故C正确;
D、锌和铜能与硝酸银反应生成银,表面有银白色固体析出,故D正确,
故选:A.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- (2012•巴中)某化学兴趣小组同学为测定锌铜合金中锌的质量分数,称取8.0克合金样品,将60.0克稀硫酸分6次加入样品
(2012•巴中)某化学兴趣小组同学为测定锌铜合金中锌的质量分数,称取8.0克合金样品,将60.0克稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称量.得到实验数据如下.
(1)表格中,m=______克.稀H2SO4用量 剩余固体质量 第一次加入10.0克 m 第二次加入10.0克 5.4克 第三次加入10.0克 4.1克 第四次加入10.0克 2.8克 第五次加入10.0克 1.6克 第六次加入10.0克 1.6克
(2)该锌铜合金锌的质量分数为______.
(3)计算所用稀H2SO4中溶质的质量分数.(请写出计算过程,结果精确到0.1%) a4079491581年前1
a4079491581年前1 -
 sunwell_dl 共回答了23个问题
sunwell_dl 共回答了23个问题 |采纳率87%解题思路:(1)根据表格中的数据可分析出与10克稀硫酸恰好完全反应的镁的质量,进而可确定m的值.
(2)反应前后固体物质减少的质量为锌的质量,根据[锌的质量/锌铜合金的质量]×100%,求出锌铜合金中锌的质量分数.
(3)根据表格中数据分析可知10克稀硫酸与1.3克锌恰好完全反应,利用锌与硫酸反应的化学方程式,根据锌的质量求出10克稀硫酸中溶质的质量,然后根据[硫酸的质量/稀硫酸的质量]×100%,求出稀硫酸中溶质的质量分数.(1)根据表格中的数据可分析出10克稀硫酸与1.3克锌恰好完全反应,则m的值为:8g-1.3g=6.7g;
故答案为:6.7g;
(2)因为铜不与硫酸反应,最后剩余的固体的成分是铜,所以锌铜合金中锌的质量为:8g-1.6g=6.4g
锌铜合金中锌的质量分数为 [6.4g/8g]×100%=80%; 故答案为:80%;
(3)每10.0g稀硫酸与1.3g锌恰好完全反应
设10.0g稀硫酸中溶质的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
1.3g x
[65/98]=[1.3g/x]解得 x=1.96g
稀硫酸中溶质的质量分为 [1.96g/10g]×100%=19.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题是一道有关表格分析的综合计算题,解本题的关键是根据表格中的数据分析出参加反应的两种物质的质量关系.1年前查看全部
- 求:有锌铜合金10克,其中有100克9.8%稀硫酸,生成氢气0.1克恰好反应
求:有锌铜合金10克,其中有100克9.8%稀硫酸,生成氢气0.1克恰好反应
(1)求锌铜合金中铜的质量分数?
(2)求消耗了稀硫酸多少克?
写的好有追加 牡丹情缘1年前1
牡丹情缘1年前1 -
 123AAAxx 共回答了25个问题
123AAAxx 共回答了25个问题 |采纳率88%设锌铜合金中锌的质量为x,消耗硫酸的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x 9.8%y 0.1g
65/x=98/9.8%y=2/0.1
x=3.25g
y=50g
铜的质量是10-3.25=6.75g,质量分数是6.75/10*100%=67.5%
答:(1)锌铜合金中铜的质量分数是67.5%
(2)消耗了稀硫酸50g.1年前查看全部
- (6分)(2012•巴中)某化学兴趣小组同学为测定锌铜合金中锌的质量分数,称取8.0克合金样品,将60.0克稀硫酸分6次
(6分)(2012•巴中)某化学兴趣小组同学为测定锌铜合金中锌的质量分数,称取8.0克合金样品,将60.0克稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称量.得到实验数据如下.
(1)表格中,m= _________ 克.稀H 2 SO 4 用量 剩余固体质量 第一次加入10.0克 m 第二次加入10.0克 5.4克 第三次加入10.0克 4.1克 第四次加入10.0克 2.8克 第五次加入10.0克 1.6克 第六次加入10.0克 1.6克
(2)该锌铜合金锌的质量分数为 _________ .
(3)计算所用稀H 2 SO 4 中溶质的质量分数.(请写出计算过程,结果精确到0.1%) 桔子绿了1年前1
桔子绿了1年前1 -
 紫悠兰 共回答了16个问题
紫悠兰 共回答了16个问题 |采纳率100%1年前查看全部
- 某学习小组用图示装置测定黄铜屑(锌铜合金)的组成,取一定量的黄铜屑放入烧杯中,并加入足量稀硫酸。不同时间电子天平的读数如
某学习小组用图示装置测定黄铜屑(锌铜合金)的组成,取一定量的黄铜屑放入烧杯中,并加入足量稀硫酸。不同时间电子天平的读数如下表所示(不考虑H 2 O逸出); 

(1)反应生成H 2 的总质量为 g。
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是 ;
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程)。 舞彩小妖1年前1
舞彩小妖1年前1 -
 流过的风 共回答了27个问题
流过的风 共回答了27个问题 |采纳率88.9%(1)0.4
(2)黄铜屑的总质量
(3)Zn+H 2 SO 4 ==ZnSO 4 +H 2
65 2
m(Zn) 0.4g
m(Zn)=13g
13g/a×100%=13g/a%1年前查看全部
- 小雨的妈妈买了一条黄金项链,小雨想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂是( )
小雨的妈妈买了一条黄金项链,小雨想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂是( )
A.AlCl3溶液
B.Cu(NO3)2溶液
C.H2SO4溶液
D.AgNO3溶液 liumanliu1年前1
liumanliu1年前1 -
 心里有茶 共回答了13个问题
心里有茶 共回答了13个问题 |采纳率100%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.A、锌铜与AlCl3溶液都不反应,无法证明,故A错误;
B、合金中的锌能与硝酸铜反应生成铜,表面有红色固体析出,故B正确;
C、合金中的锌能与硫酸反应生成氢气,有气泡冒出,故C正确;
D、锌和铜能与硝酸银反应生成银,表面有银白色固体析出,故D正确,
故选:A.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
(1)实验前,先将锌铜合金在稀酸中浸泡片刻,其目的是:______;
(2)实验操作步骤有:检查气密性,将药品和水装入各仪器中,连接好装置后,再进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性.上述再进行的操作的顺序是______(填序号);记录C的液面位置时,除视线平视外,还应______;
(3)B中发生反应的化学方程式为______;
(4)若实验用锌铜合金的质量为a g,与酸充分反应后,测得氢气体积为V L,为求出合金中锌、铜的质量分数,还缺少的一个数据是______;
A.反应前加入稀酸的体积 B.反应前加入稀酸的质量分数
C.实验前反应装置中空气的体积D.实验条件下氢气的密度
(5)若实验用锌铜合金的质量为a g,与酸充分反应后,B中剩余固体的质量为b g,则锌的质量分数为______;
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得锌的质量分数将______(填“偏大”“偏小”或“不受影响”). 明白一点什么1年前1
明白一点什么1年前1 -
 黄华791108 共回答了20个问题
黄华791108 共回答了20个问题 |采纳率95%解题思路:(1)实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;
(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理;注意读数的方法;
(3)测定铜锌合金中锌、铜的质量分数,可以依据锌能与酸反应生成氢气而铜不可以来进行,所用的酸可以是稀盐酸也可以是稀硫酸,则可书写化学方程式;
(4)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度;
(5)铜锌合金的质量为ag,B中剩余固体的质量为bg,则锌的质量为(a-b)g,从而可以求得锌的质量分数;
(6)未洗涤过滤所得的不溶物,会导致锌的质量偏小.(1)实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;
(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,所以本题答案为:⑤①④③②;);记录C的液面位置时,除视线平视外,还应 使D和C的液面相平;
(3)依据锌能与酸反应生成氢气而铜不可以来进行,所用的酸可以是稀盐酸也可以是硫酸,所以本题答案为:Zn+2HCl═ZnCl2+H2↑(或Zn+H2SO4═ZnSO4+H2↑);
(4)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度,所以本题答案为:D;
(5)铜锌合金的质量为ag,B中剩余固体的质量为bg,则锌的质量为(a-b)g,从而可以求得锌的质量分数为 [a−b/a]×100%,所以本题答案为:[a−b/a]×100%;
(6)未洗涤过滤所得的不溶物,会导致铜的质量偏大,从而锌的质量偏小,得到锌的质量分数将偏小,所以本题答案为:偏小.
故答为:
(1)除去合金表面的氧化膜
(2)⑤①④③②;使D和C的液面相平
(3)Zn+H2SO4═ZnSO4+H2↑
(4)D
(5)(a-b)/a×100%
(6)偏小点评:
本题考点: 实验探究物质的组成成分以及含量;实验数据处理或者误差分析的探究;量气装置;金属的化学性质.
考点点评: 本题探究了铜锌合金中铜和锌的质量分数的测定,完成此题,可以依据铜和锌的性质,根据题干提供的信息进行.1年前查看全部
- 初一方程应用题一块锌铜合金重24千克,放在水中称只有21又1/9千克,已知铜在水中称时重量减少1/9,锌在水中称时重量减
初一方程应用题
一块锌铜合金重24千克,放在水中称只有21又1/9千克,已知铜在水中称时重量减少1/9,锌在水中称时重量减少1/7,问这块合金中铜、锌各多少千克? 海角卫士1年前1
海角卫士1年前1 -
 cashfirst 共回答了17个问题
cashfirst 共回答了17个问题 |采纳率94.1%设这块合金中铜x千克
(1-1/9)x +(1-1/7)×(24-x)= 21又1/9
8/9x+6/7×(24-x)= 21又1/9
8/9x+20又4/7x= 21又1/9
wa.真麻烦 ,剩下的你自己算吧1年前查看全部
- 小雨的妈妈买了一条黄金项链,小雨想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂是 [
小雨的妈妈买了一条黄金项链,小雨想通过实验探究这条黄金项链是否为锌铜合金制成的仿制品,她不能选用的试剂是 [ ]A.AlCl 3 溶液
B.Cu(NO 3 ) 2 溶液
C.H 2 SO 4 溶液
D.AgNO 3 溶液 luckyzhangyan1年前1
luckyzhangyan1年前1 -
 mumianshukuaile 共回答了19个问题
mumianshukuaile 共回答了19个问题 |采纳率89.5%A1年前查看全部
- (8分)某化学兴趣小组使用下图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入15.0g合金
(8分)
某化学兴趣小组使用下图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入15.0g合金样品开始计时,并将电子天平的读数记录在下表中,完成下列计算:
(1)反应完全后产生氢气的质量是多少?
(2)锌铜合金中铜的质量是多少?
(3)反应完全后溶液中溶质的质量分数是多少?空烧杯 加入硫酸后 加入合金后
5分钟加入合金后
10分钟加入合金后
30分钟读数(g) 21.3 169.7 184.6 184.3 184.3  阿瑞斯1年前1
阿瑞斯1年前1 -
 yjysh2 共回答了18个问题
yjysh2 共回答了18个问题 |采纳率72.2%(1)0.4g (2)2g (3)20%
1年前查看全部
- 锌铜合金与AgNO3反应变色吗,铜置换出银变蓝,可是锌又能把铜置换出来啊,还变色吗
 88311年前1
88311年前1 -
 天下行狼 共回答了16个问题
天下行狼 共回答了16个问题 |采纳率75%锌铜合金与AgNO3反应是否变色,要看反应用量,如果锌铜合金少量,溶液变色,如果硝酸银溶液过量,溶液不变色.
因为锌铜合金与硝酸银溶液反应时,活泼金属先反应,只有活泼金属完全反应后,较活泼金属才反应,即只有锌完全反应后,如果硝酸银溶液有剩余,铜才能反应,否则铜不参加反应.(高中可用先强后弱解释,即还原性强的先反应,当还原性强的物质完全反应,还原性弱的才能参加反应,铁的还原性大于铜的还原性)
综上所述,当硝酸银溶液不足时,只有锌与硝酸银溶液反应,所以不存在溶液变色问题;
当硝酸银溶液过量时,开始反应溶液不变色,过一会溶液由无色逐渐变为蓝色.因为开始时锌与硝酸银溶液反应,当锌完全反应后,铜与硝酸银反应时,溶液才有变色.
希望我的回答能对你的回答有帮助!1年前查看全部
- 30克锌铜合金与210克稀硫酸恰好完全反应,反应后所得溶液中氢元素的质量为20克
30克锌铜合金与210克稀硫酸恰好完全反应,反应后所得溶液中氢元素的质量为20克
求①参加反应的锌的质量,②反应后溶液中溶质质量分数
按标准格式解答,格式和过程皆正确的另外追加分. shame691年前1
shame691年前1 -
 海馨 共回答了16个问题
海馨 共回答了16个问题 |采纳率93.8%恰好完全反应说明硫酸被完全反应了,剩下的氢元素都是水中的氢元素
所以水的质量=20g/(2/18)=180g
210克稀硫酸溶质质量为 210g-180g=30g
铜不与稀硫酸反应
Zn + H2SO4 === ZnSO4 + H2↑
65 98 161
x 30g y
65/x=98/30g=161/y
x=19.9g
y=49.3g
①参加反应的锌的质量19.9g,
②反应后溶液中溶质质量分数49.3g/(49.3g+180g)*100%=21.5%1年前查看全部
- 锌铜合金放置于潮湿的空气中发生电化学腐蚀吗
 大八卦玩家1年前1
大八卦玩家1年前1 -
 轻风抚柳 共回答了24个问题
轻风抚柳 共回答了24个问题 |采纳率95.8%会的啊,锌做负极:Zn-2e=Zn2+
铜为正极 ::O2+4e-+2H2O=4OH-1年前查看全部
- 将15g锌铜合金放入100g稀硫酸中,恰好完全反应,称的剩余物质的总质量是114.6g,则此合金中锌的质量分数是多少.
 erehnam1年前1
erehnam1年前1 -
 lansono 共回答了20个问题
lansono 共回答了20个问题 |采纳率95%Zn+H2SO4=ZnSO4+H2↑
65 2
x 100+15-114.6
x=13g
13/15=86.7%1年前查看全部
- 有些不法商家用锌铜合金仿造黄金欺骗消费者,下列方法不易区别真金与锌铜合金的是A 灼烧 B加入王水 答...
有些不法商家用锌铜合金仿造黄金欺骗消费者,下列方法不易区别真金与锌铜合金的是A 灼烧 B加入王水 答...
有些不法商家用锌铜合金仿造黄金欺骗消费者,下列方法不易区别真金与锌铜合金的是A 灼烧 B加入王水 为什么? xdbq1年前1
xdbq1年前1 -
 大润 共回答了15个问题
大润 共回答了15个问题 |采纳率86.7%锌铜合金在空气中灼烧反应生成物颜色相近
但是铜离子是绿色的 所以 选A1年前查看全部
- 将一块锌铜合金投入74.2g稀H2SO4中,恰好完全反应,生成氢气0.2g.求:反应后所得溶液的质量
 meinvdiandian1年前1
meinvdiandian1年前1 -
 miscke 共回答了26个问题
miscke 共回答了26个问题 |采纳率80.8%设锌铜合金中锌的质量为X.
Zn + H2SO4 === ZnSO4 + H2↑
65 = 2
X 0.2
X=6.5
溶液质量=74.2克-0.2克+6.5克=80.5克
答:反应后所得溶液的质量是80.5克.1年前查看全部
- (2012•宝应县二模)某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)
 (2012•宝应县二模)某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)
(2012•宝应县二模)某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)
(1)实验前,先将锌铜合金在稀酸中浸泡片刻,其目的是______;
(2)实验操作步骤有:检查气密性,将药品和水装入各仪器中,连接好装置后,再进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温后,记录C的液面位置;③由A向B滴加足量试剂;④检查气密性.
上述再进行的操作的顺序是______(填序号);
(3)该装置的气密性的检验方法是打开分液漏斗旋塞,从D管注入经济易得的______,使U型管左右液面相平,关闭分液漏斗旋塞,提高D管,______,说明装置的气密性好;
(4)待B中不再有气体产生,记录C的液面位置前,需将温度恢复至室温和______;
(5)若实验用锌铜合金的质量为ag,与稀硫酸充分反应后,测得氢气体积为V L,为求出合金中铜的质量分数,还缺少的一个数据是______;
A.反应前加入稀硫酸的体积 B.反应前加入稀硫酸的质量分数
C.实验前反应装置中空气的体积 D.实验条件下氢气的密度
(6)若a为0.4g,V为80mL,求合金中铜的质量分数.(在实验条件下,H2的密度为0.09g/L)
(7)实验过程中,若未冷却就读取气体体积,则测得锌的质量分数将______(填“偏大”、“偏小”或“不受影响”).
(8)可指导老师认为,利用上述实验装置,测量结果总会偏小,原因是______,改进方法是______. 99999n1年前1
99999n1年前1 -
 longxingtyre 共回答了18个问题
longxingtyre 共回答了18个问题 |采纳率83.3%解题思路:实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理;注意读数的方法;在乳胶管上夹上弹簧夹,向量气管加适量水,提高量气管,一段时间后,若量气管内液面不下降,说明气密性良好.测定铜锌合金中锌、铜的质量分数,可以依据锌能与酸反应生成氢气而铜不可以来进行;要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度;铜锌合金的质量为ag,若a为0.4g,V为80mL,则氢气的质量=0.08L×0.09g/L=0.0072g,从而可以求得铜的质量分数;利用上述实验装置,测量结果总会偏小,原因是有一部分氢气留在试管和导管中;改进方法是:可以加水把氢气赶过去.(1)实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;故答案为:除去合金表面的氧化膜
(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,所以是④①③②,故答案为:④①③②
(3)在乳胶管上夹上弹簧夹,向量气管加适量水,提高量气管,一段时间后,若量气管内液面不下降,说明气密性良好.故答案为:水;观察到液面不再下降
(4)待B中不再有气体产生,记录C的液面位置前,需将温度恢复至室温和关闭分液漏斗的活塞;故答案为:关闭分液漏斗的活塞
(5)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度,故答案为:D
(6)铜锌合金的质量为ag,若a为0.4g,V为80mL,则氢气的质量=0.08L×0.09g/L=0.0072g,根据化学方程式的计算可以求出锌的质量,设锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
652
x0.0072g [65/2=
x
0.0072g]
x=0.234g,从而可以求得铜的质量分数=
0.4g−0.234g
0.4g×100%=41.5%,故答案为:41.5%
(7)实验过程中,若未冷却就读取气体体积,体积会偏大,计算出的锌的质量分数也会偏大,故答案为:偏大
(8)利用上述实验装置,测量结果总会偏小,原因是有一部分氢气留在试管和导管中;改进方法是:可以加水把氢气赶过去.故答案为:有一部分氢气留在试管和导管中;可以加水把氢气赶过去点评:
本题考点: 实验探究物质的组成成分以及含量;检查装置的气密性;金属的化学性质;根据化学反应方程式的计算.
考点点评: 本题探究了铜锌合金中铜和锌的质量分数的测定,完成此题,可以依据铜和锌的性质,根据题干提供的信息进行.有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.1年前查看全部
- 选取3克锌铜合金与足量的稀硫酸,反应完全后,得到气体的体积为0.1L,求锌,铜合金中锌的质量分数是多少?
选取3克锌铜合金与足量的稀硫酸,反应完全后,得到气体的体积为0.1L,求锌,铜合金中锌的质量分数是多少?
氢气的密度为0.089g/L uu小混混1年前1
uu小混混1年前1 -
 做男人真难 共回答了23个问题
做男人真难 共回答了23个问题 |采纳率82.6%设得到气体的体积为0.1LH2需要X克锌
Zn+H2SO4=ZnSO4+H2
65-----------------------22.4
X--------------------------0.1
X=0.29克
锌,铜合金中锌的质量分数是:
0.29/3=9.7%1年前查看全部
- 有两块锌铜合金的质量分别为10千克、15千克,这两块合金的含铜的质量分数不同,现分别从这两块合金中各切下一块质量相同的合
有两块锌铜合金的质量分别为10千克、15千克,这两块合金的含铜的质量分数不同,现分别从这两块合金中各切下一块质量相同的合金,交换后分别与另一块合在一起熔化,冷却后测得这两块合金含铜的质量分数相同,求切下的一块合金的质量.
 twp19811年前1
twp19811年前1 -
 瑞津zzww 共回答了14个问题
瑞津zzww 共回答了14个问题 |采纳率92.9%解题思路:设切下的一块重量是x千克,设10千克和15千克的合金的含铜的质量分数为a,b,则交换后第一块合金含铜的质量为(10-x)a+xb,第二块合金含铜量为(15-x)b+xa,根据交换后两块合金含铜的质量分数相同,可得出方程,解出即可.设切下的一块重量是x千克,设10千克和15千克的合金的含铜的百分比为a,b,
则交换后第一块合金含铜的质量为(10-x)a+xb,第二块合金含铜量为(15-x)b+xa,
由题意得:
(10−x)a+xb
10=
(15−x)b+xa
15,
整理得:(b-a)x=6(b-a),
解得:x=6.
答:切下的一块合金的质量为6千克.点评:
本题考点: 一元一次方程的应用.
考点点评: 此题主要考查了用一元一次方程解决实际问题,根据熔炼后两者含铜的百分比恰好相等得到相应的等量关系是解决本题的关键,注意一些必须的量没有时,应设其未知数,在解答过程中消去无关未知数.1年前查看全部
大家在问
- 1peter is never late for the first class in the afternoon 改为同
- 2下图表示的是“生物进化示意图”,据图回答问题。 (1)请把图中1―5所表示的动物类别填写在下列横线上。
- 3英语翻译越南语翻译中文.1.anh..ghet..viet..nam..khong..anh 2.chu..chung.
- 4已知a,b,c是三角形ABC的三边长,关于x的方程ax^2-2*(根号下c^2-b^2)*x-b=0
- 5植物的茎间和节间有什么区别?如题,书上提到的植物茎间是指哪些部分?和节间有什么不同?
- 6用if造主将从现的英语句字用if 主将从现
- 7那天,我失去了你 用英文怎么说?
- 81)(2x^2)^4+(-3x^3)^2·x^5+x^2·(-3x^3)^2 2)(5x^2y)^3+(-xy)^3·x
- 9世界上第三大金字塔是如图.
- 10mark in the correct stress of thewords in italics
- 11本溪市是一个空气污染非常严重的城市,请你给市长写一个报告,就如何改善我市的空气质量提出具体的建议(至少3点).
- 12一盒粉笔,第一次用去2分之一,第二次用去剩下的3分之二,一共用去了这盒粉笔的几分几?
- 13—Hi, Lily and Kate, are you classmates? —Yes, ________
- 14打个比方,x的3次方等于4,我要算X,请问用计算器怎么算啊?
- 15小学六年级英语一共有什么式。如过去式等 未来进行时等