将铁屑溶于过量的稀盐酸后,再加入下列物质,会有Fe3+生成的是( )
 芝麻662022-10-04 11:39:542条回答
芝麻662022-10-04 11:39:542条回答A. 硫酸
B. 氯水
C. 硫酸锌
D. 氯化铜

已提交,审核后显示!提交回复
共2条回复
 WOAI131 共回答了14个问题
WOAI131 共回答了14个问题 |采纳率85.7%- 解题思路:铁屑溶于过量盐酸后,生成亚铁离子,加入氧化性的物质可将亚铁离子氧化为铁离子,以此来解答.
铁屑溶于过量盐酸后,生成亚铁离子,
A.再加硫酸,不发生反应,不会有三价铁生成,故A不选;
B.再加氯水,将亚铁离子氧化为铁离子,故B选;
C.加硫酸锌,不发生反应,故C不选;
D.再加氯化铜,不发生反应,故D不选;
故选B.点评:
本题考点: 铁的化学性质;铁盐和亚铁盐的相互转变.
考点点评: 本题以铁的化学性质考查氧化还原反应,把握物质的性质及氧化性为解答的关键,侧重分析与应用能力的考查,题目难度不大. - 1年前
 无心言语 共回答了137个问题
无心言语 共回答了137个问题 |采纳率- B 氧化性
- 1年前
相关推荐
- 铁屑溶于过量盐酸后,再分别加入下列物质,不会有三价铁生成的是:A硫酸 B氯水 C硝酸锌 D溴水
铁屑溶于过量盐酸后,再分别加入下列物质,不会有三价铁生成的是:A硫酸 B氯水 C硝酸锌 D溴水
为什么答案上选A? 福临门20081年前5
福临门20081年前5 -
 jiangxj1980 共回答了18个问题
jiangxj1980 共回答了18个问题 |采纳率88.9%选A
铁屑溶于过量盐酸后生成的是Fe2+(二价铁)Fe+2HCl==FeCl2+H2
稀硫酸不能氧化Fe2+,故A可以
B、氯水有强氧化性,可将Fe2+氧化成Fe3+(三价铁) Cl2+2Fe2+ ==2Fe3+ +2Cl-
C、硝酸锌中含有NO3-,和过量的盐酸中的H+组成HNO3(硝酸),HNO3有强氧化性,可将Fe2+氧化成Fe3+
D、溴水也有强氧化性,可将Fe2+氧化成Fe3+ Br2+2Fe2+ ==2Fe3+ +2Br-1年前查看全部
- 制摩尔盐时加入少量什么物质可加快铁屑的溶解?加入硫酸后趁热过滤的原因?
 hjj6121年前1
hjj6121年前1 -
 天外飞秒 共回答了14个问题
天外飞秒 共回答了14个问题 |采纳率100%加入少量的CuSO4可以形成原电池加快溶解
趁热过滤是为避免莫尔盐结晶出来被过滤掉了.1年前查看全部
- 为什么不能用硫酸铜溶液用来除去铜屑中的少量铁屑
 玫瑰故事1年前5
玫瑰故事1年前5 -
 GNNDB 共回答了18个问题
GNNDB 共回答了18个问题 |采纳率77.8%因为置换出的单质铜会覆盖的在铁屑的表面,最终会阻止铁屑中心部分的铁的反应,导致铁的残留.1年前查看全部
- 向含有硝酸银的废液中加入过量的铁屑,充分反应后过滤,滤除固体和滤液分别是什么?
 脆脆1年前3
脆脆1年前3 -
 远走的孩子不回头 共回答了19个问题
远走的孩子不回头 共回答了19个问题 |采纳率73.7%加入过量的铁屑,滤除固体有 铁和银 滤液是硝酸亚铁溶液1年前查看全部
- 含有硝酸银的液体中加入铁屑,锌屑后,得到固体和浅绿色滤液,滤液中溶质的组成有何物质
 JEFH1年前2
JEFH1年前2 -
 ystmxw 共回答了21个问题
ystmxw 共回答了21个问题 |采纳率85.7%固体 银、铁
浅绿色溶液:Fe2+、Zn2+1年前查看全部
- 天平两盘内各放一只质量相等的小烧杯,杯内各盛有足量且质量分数相等的盐酸,向左边烧杯中加入2.8g铁屑,则若要使天平仍保持
天平两盘内各放一只质量相等的小烧杯,杯内各盛有足量且质量分数相等的盐酸,向左边烧杯中加入2.8g铁屑,则若要使天平仍保持平衡,向右边烧杯中加入碳酸钙的质量为()
A 5.63g B7.8g C 2.8g D 4.82g shannlei1年前1
shannlei1年前1 -
 ysy_s 共回答了23个问题
ysy_s 共回答了23个问题 |采纳率73.9%质量守恒 2Fe+2Hcl=Fecl2+H2
2*56 56+71 1*2
2.8g y x 得x=0.05g 是氢气 y=3.175g
因为盐酸是足量的二价的铁离子会被盐酸继续氧化成铁离子:
2Fecl2+2Hcl=2Fecl3+H2
2*127 2
3.175g z 得z=0.025g 所以产生氢气的质量一共是0.075g,左边小烧杯中实际增加了2.725g的重量
右边加碳酸钙的质量减去生成二氧化碳的质量也应该等于2.725g所以
CaCO3+2Hcl=Cacl2+H2O+CO2
100 44
a a-2.725 a约等于4.86g
我觉得步骤没错呀 可能还有人会吧 只能帮你到这了 大家共同学习 楼主在研究研究吧 选项D是最接近的 最好问问老师吧 嘿嘿~1年前查看全部
- 天平两盘内各放一只质量相等的小烧杯,杯内各盛有足量的溶质质量分数相同的盐酸,若向左边加入2.8g铁屑
天平两盘内各放一只质量相等的小烧杯,杯内各盛有足量的溶质质量分数相同的盐酸,若向左边加入2.8g铁屑
则要使天平保持平衡,应向右盘加碳酸钙的质量是( )
A 7.8g
B 5.63g
C 4.82g
D 2.8g
别复制别人的过程我看过了看不懂 hellium1年前1
hellium1年前1 -
 晓晓0510 共回答了20个问题
晓晓0510 共回答了20个问题 |采纳率90%铁与盐酸反应:
Fe+2HCl=FeCl2+H2(气体符号)
56 2
2.8 X
据:56/2.8=2/x
解出:X=0.1g
即,加入2.8g铁,生成0.1g氢气,氢气跑掉后,总质量增加:
2.8-0.1=2.7g
另一侧的反应方程如下,设CaCO3的质量是X,则:
CaCO3+2HCl=CaCl2+H2O+CO2(气体符号)
100 44
X Y
即:100/x=44/y,且有Y=11x/25
据题意知:X-y=2.7
即:X-11X/25=2.7
化简:14X/25=2.7
解得:X≈4.82g1年前查看全部
- 实验室里用苯和铁屑制取溴苯,在双球U形管内盛放CCl4,其作用是?
 69062391年前2
69062391年前2 -
 zhuixin520 共回答了13个问题
zhuixin520 共回答了13个问题 |采纳率84.6%吸收多余的未反应的单质溴.1年前查看全部
- 实验室制溴苯加铁屑有何作用?
 英yy斯特拉福德1年前2
英yy斯特拉福德1年前2 -
 zzmzhou88 共回答了18个问题
zzmzhou88 共回答了18个问题 |采纳率83.3%三溴化铁是催化剂.有利于溴代的发生.1年前查看全部
- 天平两盘内各放一只质量相等的小烧杯,杯内各盛有足量的溶质质量分数相同的盐酸,若向左边加入2.8g铁屑,
天平两盘内各放一只质量相等的小烧杯,杯内各盛有足量的溶质质量分数相同的盐酸,若向左边加入2.8g铁屑,
则要使天平保持平衡,应向右盘加碳酸钙的质量是( )
A 7.8g
B 5.63g
C 4.82g
D 2.8g hbczljx1年前1
hbczljx1年前1 -
 scsnyb 共回答了24个问题
scsnyb 共回答了24个问题 |采纳率91.7%C 4.82g
向左边加入2.8克的铁屑要产生0.1g氢气,溶液质量增加2.8g-0.1g=2.7g
要使天平平衡,右边也要增加2.7g
CaCO3+2HCl=CaCl2+H2O+CO2 溶液质量增加
100 44 100-44=56
x 2.7g
100/x=56/2.7g
x=4.82g1年前查看全部
- 杯内有足量的质量分数稀盐酸,若向左边加入2.8克的铁屑要使天平平衡,应向右盘加多少碳酸钙
 彭加丽1年前1
彭加丽1年前1 -
 zhangzihao 共回答了13个问题
zhangzihao 共回答了13个问题 |采纳率100%向左边加入2.8克的铁屑要产生0.1g氢气,溶液质量增加2.8g-0.1g=2.7g
要使天平平衡,右边也要增加2.7g
CaCO3+2HCl=CaCl2+H2O+CO2 溶液质量增加
100 44 100-44=56
x 2.7g
100/x=56/2.7g
x=4.82g1年前查看全部
- 制溴苯时为什么先加苯后加液溴最后加铁屑
 vvrycoq1年前1
vvrycoq1年前1 -
 波普鱼 共回答了15个问题
波普鱼 共回答了15个问题 |采纳率100%因为液溴密度比苯的密度大,先加苯后加溴可以充分混合,最后加铁屑是为了催化,也可以减少负反应1年前查看全部
- 请你设计两种不同的化学方案出去铜屑中的少量铁屑 (只用化学方程式表示)
 自告奋勇1年前4
自告奋勇1年前4 -
 binghun83 共回答了16个问题
binghun83 共回答了16个问题 |采纳率87.5%物理方法:磁铁吸出铁屑
化学方法:Fe+CuSO4=Cu+FeSO4
Fe+H2SO4(稀)=H2↑+FeSO41年前查看全部
- 下列化学方程式正确的是 A.铁屑溶于稀硫酸:2Fe+3H 2 SO 4 ═Fe 2 (SO 4 ) 3 +3H 2 ↑
下列化学方程式正确的是
A.铁屑溶于稀硫酸:2Fe+3H 2 SO 4 ═Fe 2 (SO 4 ) 3 +3H 2 ↑ B.食盐溶于硝酸钾溶液:NaCl+KNO 3 ═NaNO 3 +KCl C.用稀盐酸除去铁制品表面的铁锈:2HCl+FeO═FeCl 2 +H 2 O D.向纯碱溶液中滴加氯化钙溶液:Na 2 CO 3 +CaCl 2 ═CaCO 3 ↓+2NaCl  冰封的玫瑰1年前1
冰封的玫瑰1年前1 -
 朔月十三 共回答了18个问题
朔月十三 共回答了18个问题 |采纳率94.4%D
A、铁在置换反应中显+2价而不显+3价,正确方程式为:Fe+H 2 SO 4 ═FeSO 4 +H 2 ↑,故A错误;
B、食盐和硝酸钾反应的生成物中没有沉淀或气体或水,不符合复分解反应的条件,故B错误;
C、铁锈的主要成分是氧化铁而不是氧化亚铁,正确的方程式为6HCl+Fe 2 O 3 =2FeCl 3 +3H 2 O,故C错误;
D、该方程式应用原理正确,化学式符号客观规律,满足质量守恒定律,故D正确;故选D.1年前查看全部
- 在苯中加入浓溴水,经振荡再用分液漏斗分液,在上层液体中加入铁屑,产生的现象是
在苯中加入浓溴水,经振荡再用分液漏斗分液,在上层液体中加入铁屑,产生的现象是
溶有溴水的苯为什么能与铁反应 一切都是云烟1年前1
一切都是云烟1年前1 -
 地球不一定是圆的 共回答了23个问题
地球不一定是圆的 共回答了23个问题 |采纳率87%不反应
苯的溴代要求严格无水环境,这里苯不可避免的带有水分1年前查看全部
- 现有废硫酸98t(H2SO4的质量分数为10%),与足量的废铁屑起反应,可生产硫酸亚铁的质量是多少?
 依寒露1年前1
依寒露1年前1 -
 PVWGSAAA 共回答了22个问题
PVWGSAAA 共回答了22个问题 |采纳率86.4%98t*10%=9.8t
Fe+H2SO4==FeSO4+H2
98 152
9.8t x
98/9.8t=152/x
x=15.2t1年前查看全部
- 将50g含铁70%的铁屑和70g50%的硫酸反应,可制的绿矾多少克
 粉耗呆1年前1
粉耗呆1年前1 -
 小可爱小可爱 共回答了19个问题
小可爱小可爱 共回答了19个问题 |采纳率89.5%Fe+H2SO4→FeSO4+H2↑
n(Fe)=50×70%/56=0.625mol
n(H2SO4)=70×50%/98=0.357mol
所以铁过量
S守恒,有H2SO4→FeSO4→FeSO4·7H2O
m(FeSO4·7H2O)=0.357×278=99.29g1年前查看全部
- 除去FeSO4溶液中的少量CuSO4:加入足量铁屑,充分反应后过滤 错误 这是为什么
 huahua1401年前2
huahua1401年前2 -
 zxc12333 共回答了19个问题
zxc12333 共回答了19个问题 |采纳率84.2%生成的铜会包在铁表面,使反应停止.不节约1年前查看全部
- 找一种过滤粉类的工业机器 就是把粉中的沙子,铁屑过滤出来
找一种过滤粉类的工业机器 就是把粉中的沙子,铁屑过滤出来
桌子形状 50lmX1M
长方体形状
 xx之铁1年前1
xx之铁1年前1 -
 samural167 共回答了17个问题
samural167 共回答了17个问题 |采纳率94.1%你要找到设备叫---振动筛.根据您描述的设备的形状应该叫直线振动筛.具体你可以到网上浏览直线振动筛主要用途1. 金属粉末:铝.铅、锌、铜、铁、镍、合金、磁性材料等金属为粉末.2. 树脂、塑料、橡胶助剂...1年前查看全部
- 向盛有氯化铜和氯化铁混合溶液的烧杯中加入过量的铁屑,反应后,溶液中含量最多的金属离子是?
向盛有氯化铜和氯化铁混合溶液的烧杯中加入过量的铁屑,反应后,溶液中含量最多的金属离子是?
铜离子
氯离子
亚铁离子
铁离子
答案是第三个,请问为什么? freeczp1年前3
freeczp1年前3 -
 不语BABY 共回答了15个问题
不语BABY 共回答了15个问题 |采纳率93.3%很明显 两者都要和铁反应
CuCl2 + Fe == FeCl2 + Cu
2 FeCl3 + Fe == 3 FeCl2
包括
Cu + 2 FeCl3 == CuCl2 + 2 FeCl2
看看最后生成的物质
是不是只有Fe 2 +
所以 ………………
还可以根据 氧化还原来判断
先判断氧化性的强弱
Fe3+ > Cu2+ > Fe2+ > Cu > Fe
所以最后只剩下氧化性适中的
最中间那个 Fe2+
和两边的都不反应
其他的都不能共存1年前查看全部
- 废铁屑与稀硫酸反应为什么要控制温度
 taozhiyaoyaoya1年前0
taozhiyaoyaoya1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 氯化钠,二氧化硅,铁屑和碳酸钙混合物怎么提取
氯化钠,二氧化硅,铁屑和碳酸钙混合物怎么提取
求详细提取四种物质的过程 pcwork1年前2
pcwork1年前2 -
 mjpui 共回答了17个问题
mjpui 共回答了17个问题 |采纳率100%第一步,磁铁吸引出铁屑;
第二步,加水搅拌过滤,对滤液蒸干处理,得到氯化钠;
第三步,向第二步得到的滤渣中加盐酸,稀释并过滤得到二氧化硅;
第四步,向第三步得到的滤液中通入二氧化碳,过滤,烘干滤渣得到碳酸钙.1年前查看全部
- 制FeSO4 处理过量的铁屑加过量的稀硫酸溶液,目的 1使铁屑充分反应反正生成的二价铁水解,还有氧化?
制FeSO4 处理过量的铁屑加过量的稀硫酸溶液,目的 1使铁屑充分反应反正生成的二价铁水解,还有氧化?
同上 有防止被氧化的目的么? kokofun1年前4
kokofun1年前4 -
 臭静静 共回答了16个问题
臭静静 共回答了16个问题 |采纳率93.8%抑制水解,防止生成Fe(OH)2,Fe(OH)2,容易被氧化.1年前查看全部
- 什么是化学效应?化学效应是不是就是化学反应?通电螺线管能吸引铁屑、这是电流的 A 电磁感应现象 B 磁效应 C D 热效
什么是化学效应?
化学效应是不是就是化学反应?
通电螺线管能吸引铁屑、这是电流的
A 电磁感应现象 B 磁效应 C D 热效应
我知道是选B, sdllhehe1年前3
sdllhehe1年前3 -
 vk不是真的 共回答了23个问题
vk不是真的 共回答了23个问题 |采纳率91.3%化学效应就是发生化学反应产生一系列发光,发热,变色,沉淀…等等.比喻说镁条燃烧产生耀眼的白光,生成黑色氧气镁,效应就是反应过程中的一些变化1年前查看全部
- 初三科学内能内容,有一只瓶子,里面装着一些铁屑,如果没有看到内能改变的过程,单凭铁屑温度的升高,能判断用了什么方法改变内
初三科学内能内容,
有一只瓶子,里面装着一些铁屑,如果没有看到内能改变的过程,单凭铁屑温度的升高,能判断用了什么方法改变内能吗
即课本上的讨论题,浙教版的
 ccckobe1年前1
ccckobe1年前1 -
 孤独的红色 共回答了17个问题
孤独的红色 共回答了17个问题 |采纳率94.1%不能,因为温度升高,也就是说内能增加了.而改变内能的方式有两种,做功和热传递都可以.在这里无法判断.1年前查看全部
- 将密度为1.05g/cm3、质量分数为14%的稀硫酸溶液250mL与足量的铁屑充分反应.计算:(1)硫酸溶液中的氢离子的
将密度为1.05g/cm3、质量分数为14%的稀硫酸溶液250mL与足量的铁屑充分反应.计算:(1)硫酸溶液中的氢离子的物质的量浓度?(2)生成的氢气在标准状况下的体积为多少?
 左单眼皮右三眼皮1年前1
左单眼皮右三眼皮1年前1 -
 诺言kiki 共回答了20个问题
诺言kiki 共回答了20个问题 |采纳率80%(1)n(H+)=2n(H2SO4)=V*c(H2SO4)=250*1.05*14%*2/98=0.75mol
c(H+)=n/V=3mol/L
(1)Fe + H2SO4==FeSO4 + H2
V(H2)=n(H2)*22.4=n(H2SO4)*22.4=0.75*22.4/2=8.4L1年前查看全部
- 稀硫酸中加入铁屑ph值为什么会变大
 jeahon1年前1
jeahon1年前1 -
 十一腿的螃蟹 共回答了15个问题
十一腿的螃蟹 共回答了15个问题 |采纳率93.3%铁与H+ 反应,氢离子浓度减小,ph值为什么会变大1年前查看全部
- 铁在硫酸铜溶液中碎了我把磨好铁钉放硫酸铜溶液里泡着,几天以后,硫酸铜变成铁锈一样的色,铁钉变成了一堆铁屑.怎么回事
 吹笛人hester1年前3
吹笛人hester1年前3 -
 7829109 共回答了16个问题
7829109 共回答了16个问题 |采纳率87.5%因为铁和硫酸铜能反应,
首先是 Fe+CuSO4 ==FeSO4 +Cu
形成了FeSO4溶液,而空气中O2把部分Fe2+氧化成Fe3+,溶液就是黄色的了.
同时铁钉被溶解成小颗粒了.1年前查看全部
- 在标准状况下,11.20g铁屑和6.944L氯气反应,能得到纯度为90%的氯化铁多少克?吸收多余氯气,需要消耗氢氧化钠的
在标准状况下,11.20g铁屑和6.944L氯气反应,能得到纯度为90%的氯化铁多少克?吸收多余氯气,需要消耗氢氧化钠的质量为多少克?
请问那一种对?为什么?
【主要疑问:对“纯度为90%的氯化铁”的理解,是直接÷90%还是以Fe为杂质列式求解】 水木天成_玫玫1年前1
水木天成_玫玫1年前1 -
 海南人在ee 共回答了19个问题
海南人在ee 共回答了19个问题 |采纳率78.9%n(Fe)=11.2/56=0.2mol
n(Cl2)=6.944/22.4=0.31mol
m(FeCl3)=0.2*162.5/90%=36.1g
m(NaOH)=80*0.01=0.8g1年前查看全部
- 物理实验中,实验员不小心把碘与一些铁屑混在一起,此时能用什么办法?
物理实验中,实验员不小心把碘与一些铁屑混在一起,此时能用什么办法?
相关知识内容是物态变化) 英子听雨1年前1
英子听雨1年前1 -
 zxtgp 共回答了20个问题
zxtgp 共回答了20个问题 |采纳率80%加温后碘会升华,留下铁1年前查看全部
- 利用废铁屑与一定质量分数的稀硫酸反应制取硫酸亚铁,把16.8gFe放入500ml足量稀硫酸中,计算:
利用废铁屑与一定质量分数的稀硫酸反应制取硫酸亚铁,把16.8gFe放入500ml足量稀硫酸中,计算:
(1)16.8gFe的物质的量.(2)在标准状况下生成H2的体积.(3)反应后所制得的溶液中硫酸亚铁的物质的量浓度.(反应前后溶液体积不变) boboboyu1年前1
boboboyu1年前1 -
 juckymao 共回答了16个问题
juckymao 共回答了16个问题 |采纳率87.5%1 16.8/56=0.3
2 0.3*22.4=6.72L
3 0.3/0.5=0.6mol/L1年前查看全部
- 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑和6mol•L-1的硫酸,其他试
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑和6mol•L-1的硫酸,其他试剂任选.填写下列空白:

(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是______,A中反应的离子方程式是______.
(2)实验开始时应先将活塞E______(填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是______.
(3)关闭活塞E及分液漏斗上的活塞加入适量硫酸,硫酸与铁屑接触后产生气体.待收集到足量气体后关闭活塞E,现象是______.
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:______. sk1982751年前1
sk1982751年前1 -
 lihaitie 共回答了27个问题
lihaitie 共回答了27个问题 |采纳率92.6%解题思路:(1)A中应预先盛放固态反应物,铁和稀硫酸发生氧化还原反应生成硫酸亚铁和氢气;
(2)实验开始时,应先打开活塞,使生成的氢气充满整套实验装置中而排出空气,防止氢氧化亚铁被氧化;C中的气体的主要成分为铁和稀硫酸反应生成的氢气;
(3)关闭活塞时,在气体压强的作用下,A中溶液进入B装置中,A中溶液含有硫酸亚铁,可能含有硫酸,硫酸和硫酸亚铁都和氢氧化钠溶液反应.
(4)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀.(1)A中应预先盛放固态反应物铁屑,铁和稀硫酸反应生成硫酸亚铁和氢气,离子反应方程式为:Fe+2H+=Fe2++H2↑,
故答案为:铁屑;Fe+2H+=Fe2++H2↑;
(2)实验开始时,应先打开活塞,使生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化;氢气不和水反应,所以C中收集的氢气主要是铁和稀硫酸反应生成的氢气,
故答案为:打开;H2;
(3)关闭活塞时,在气体压强的作用下,A中溶液进入B装置中,A中溶液含有硫酸亚铁,硫酸亚铁都和氢氧化钠溶液反应.发生的离子反应方程式为:
Fe2++2OH-=Fe(OH)2↓,因此B中产生白色沉淀,
故答案为:A中液面逐渐沿导管上升并进入B中,产生白色沉淀;
(4)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀,所以看到的现象是:白色沉淀先转化为灰绿色最后转化为红褐色,反应方程式为:
4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.点评:
本题考点: 制取氢氧化铁、氢氧化亚铁.
考点点评: 本题考查了氢氧化亚铁的制取,难度不大,氢氧化亚铁极易被氧气氧气,所以制取氢氧化亚铁时注意必须在无氧气条件下进行反应,这是高中化学中较重要的一个实验,是学习重点.1年前查看全部
- 工厂利用废铁屑与废硫酸反应制取硫酸亚铁.假设1t废铁屑能与9.8t废硫酸反映得到10.78t固液废硫酸质量分数
 Rewinke1年前1
Rewinke1年前1 -
 DDAAVV 共回答了18个问题
DDAAVV 共回答了18个问题 |采纳率94.4%FE+ H2SO4= FESO4 +H21年前查看全部
- 工厂利用废铁屑与废硫酸起反应来制取硫酸亚铁.现有废硫酸19.6t(硫酸的质量分数为20%)
工厂利用废铁屑与废硫酸起反应来制取硫酸亚铁.现有废硫酸19.6t(硫酸的质量分数为20%)
工厂利用回收废铁屑与废硫酸来制取硫酸亚铁.现有废硫酸19.6t(硫酸的质量分数为20%)与足量的废铁屑起反应,求生产含杂量5%的硫酸亚铁的质量.
 imoda1年前1
imoda1年前1 -
 cengduan 共回答了16个问题
cengduan 共回答了16个问题 |采纳率93.8%硫酸与硫酸亚铁是1:1的关系,质量比是98:152.
那么硫酸亚铁的量应该是19.6×20%÷98×152=6.08吨
因为含5%杂质,所以最终产量是6.08÷95%=6.4吨1年前查看全部
- 绿矾(FeSO 4 ·7H 2 O)可用于色谱分析剂、净水、照相制版等方面。下面是以铁屑(含少量锡等杂质)生产绿矾的一种
绿矾(FeSO 4 ·7H 2 O)可用于色谱分析剂、净水、照相制版等方面。下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法:

己知:在H 2 S饱和溶液中,SnS沉淀完全时的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时溶液的pH为5.5。
(1)操作Ⅱ中用pH试纸测定溶液pH的操作是:
(2)操作Ⅱ中用硫酸酸化至pH=2的目的是
(3)操作Ⅲ中需要的玻璃仪器是烧杯、 。
(4)通入硫化氢至饱和的目的是:①除去操作Ⅰ所得溶液中含有的Sn 2+ 等杂质离子;
②
(5)操作IV的顺序依次为: 、冷却结晶、 。
(6)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。 单独出旅1年前1
单独出旅1年前1 -
 深山妖狐 共回答了20个问题
深山妖狐 共回答了20个问题 |采纳率100%(1)将pH试纸放在干净、干燥的表面皿上,用干净、干燥的玻璃棒蘸取少量待测液滴在pH试纸中间,观察颜色并与比色卡比较
(2)使溶液中的Sn 2+ 完全转化为SnS,而Fe 2+ 不生成FeS沉淀
(3)玻璃棒、漏斗
(4)将溶液中的Fe 3+ 离子转化为Fe2+离子
(5)蒸发浓缩 过滤 (6)降低绿矾的溶解度,减少绿矾的损失
1年前查看全部
- HNO3与过量铁屑反应的化学式和离子式
 freebird121年前2
freebird121年前2 -
 津睿 共回答了15个问题
津睿 共回答了15个问题 |采纳率93.3%化学式:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
离子式:3Fe+8H+ +2NO3-=3Fe2+ +2NO↑+4H2O1年前查看全部
- 实践与运用题!help me 在实验的桌上有铁屑、沙子、木屑各一小瓶.小芳把这三瓶物质到在了一个大瓶子里,混在一起.这是
实践与运用题!help me
在实验的桌上有铁屑、沙子、木屑各一小瓶.小芳把这三瓶物质到在了一个大瓶子里,混在一起.这是却不知道怎么把它么分开,请写出你的办法! 青鸟8889681年前1
青鸟8889681年前1 -
 KGGB 共回答了21个问题
KGGB 共回答了21个问题 |采纳率95.2%1.用磁铁把铁屑分开
2.用水把沙子分开
3.1年前查看全部
- 向过量稀硫酸种加入除去油污的废铁屑,是否是制备硫酸亚铁的可行方案?
向过量稀硫酸种加入除去油污的废铁屑,是否是制备硫酸亚铁的可行方案?
RT,为什么? sskkxx1年前1
sskkxx1年前1 -
 kim_1214 共回答了22个问题
kim_1214 共回答了22个问题 |采纳率90.9%稀硫酸过量,加入废铁屑后生成硫酸亚铁是不假,但是里面还有稀硫酸呢?怎么分离出稀硫酸来?如果废铁屑过量,那这就是一个制备硫酸亚铁的好方法了.1年前查看全部
- 用含15%硫酸的废液2500kg与足量的铁屑反应,可生成绿矾(FeSO4 · 7H2O)多少千克?
 吃了tt1年前2
吃了tt1年前2 -
 yanbozhang 共回答了23个问题
yanbozhang 共回答了23个问题 |采纳率87%m(H2SO4)=2500kg*15%=375kg
m(SO4^2-)=375kg*96/98=18000/49 kg
由题意可知,硫酸与足量铁反应,即硫酸中的硫酸根离子全部变成绿钒中的硫酸根离子,于是有
m(FeSO4·7H2O)=18000/49 kg*278/96=52125/49≈1063.78kg
这道题要掌握的就是硫酸根的守恒 因为我们知道绿钒中的硫酸根全部都是由硫酸而来的 这样楼主还有什么疑问可以追加( # ▽ # )祝学习进步1年前查看全部
- 把铁屑融化后浇铸成铁块,比热容变了吗
 flamma20061年前2
flamma20061年前2 -
 末血 共回答了20个问题
末血 共回答了20个问题 |采纳率90%不变
比热容是物质具有的物理属性,是不会随着时间,地点,形状,大小,状态等而改变的.
多谢!1年前查看全部
- 用铁屑显示磁场磁感线形状时为什么选择玻璃板
 周盛1年前3
周盛1年前3 -
 cheerful2006 共回答了27个问题
cheerful2006 共回答了27个问题 |采纳率85.2%玻璃半透明可以看见磁体放置情况,并且不会影响磁性1年前查看全部
- FeCl3 和 CuCl2的混合溶液中加入铁屑 铁屑先和那个反应 为什么
 womendeshequ1年前3
womendeshequ1年前3 -
 一生囿祢 共回答了19个问题
一生囿祢 共回答了19个问题 |采纳率94.7%先和铁离子,因为还原性铁大于铜,所以氧化性铁小于铜,所以离子的氧化性铁大于铜,所以先反应.1年前查看全部
- 小明利用如图所示的装置探究磁化过程,图中窗口内装的是一些铁屑,架上所夹的是一根较长的软铁棒.
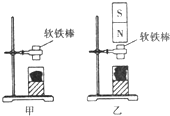 小明利用如图所示的装置探究磁化过程,图中窗口内装的是一些铁屑,架上所夹的是一根较长的软铁棒.
小明利用如图所示的装置探究磁化过程,图中窗口内装的是一些铁屑,架上所夹的是一根较长的软铁棒.
(1)比较甲、乙两图中现象可知:当磁极程靠近软铁棒时,软铁棒由于被磁化而显出______.
(2)小明从图乙中拿开条形磁铁,发现软铁棒下端的铁屑纷纷落下来,这说明软铁棒获得的磁性______(填“能够”或“不能够”)保持. 羽翼琴子1年前1
羽翼琴子1年前1 -
 无话可说000 共回答了24个问题
无话可说000 共回答了24个问题 |采纳率95.8%解题思路:(1)物体具有吸引铁、钴、镍等物质的性质叫磁性,原来没有磁性的物体,在磁体或电流的作用下带上磁性的过程叫磁化.
(2)物体被磁化后离开磁体或电流后,能够长时间保持磁性的叫硬磁性材料,不能长时间保持磁性的叫软磁性材料.(1)软铁棒被磁体磁化后具有了吸引铁屑的性质,所以具有磁性.
(2)磁体离开软铁棒后,它就不具有吸铁屑的性质了,所以磁性不能够保持.
故答案为:(1)磁性;(2)不能够.点评:
本题考点: 磁化.
考点点评: 本题通过实验现象考查磁性和软磁性材料的特点,是一道基础题.1年前查看全部
- 为什么配置FeSO4溶液要加少量铁屑呢
 洛西20411年前1
洛西20411年前1 -
 gaoyurong51 共回答了24个问题
gaoyurong51 共回答了24个问题 |采纳率95.8%因为溶液中的铁离子呈正二价
二价铁容易被氧化成三价铁
这样就会生成Fe2(SO4)3
溶液不纯了
又因为2Fe(3+)+Fe=3Fe(2+)
所以
配置FeSO4溶液要加少量铁屑1年前查看全部
- 一堆铁屑、木屑、沙子和食盐的混合物,请问用什么方法可以把它们一一分开?
 lpeig1年前1
lpeig1年前1 -
 正常假人 共回答了18个问题
正常假人 共回答了18个问题 |采纳率100%将碎屑放到一纸上,用磁铁在纸下将铁屑分离出来,之后将碎屑倒入一杯中,加水,充分搅拌,把木屑捞出,再过滤得沙子,最后将杯中的水用火加热,水分蒸干即得食盐.1年前查看全部
- 把12.1克铁屑与锌粒的混合物投入足量的稀硫酸中,充分反应后,金属全部溶解,在标准状况下
把12.1克铁屑与锌粒的混合物投入足量的稀硫酸中,充分反应后,金属全部溶解,在标准状况下
共收集到气体4.48升,求混合物中铁的质量分数 wwm4311年前1
wwm4311年前1 -
 1986120212 共回答了19个问题
1986120212 共回答了19个问题 |采纳率78.9%设混合物中含锌的物质的量为x、含铁的物质的量为y
则有:65g/mol × x + 56g/mol × y =12.1g ----(1)
Zn + H2SO4=ZnSO4 + H2 ↑
1 1
x x
Fe+ H2SO4=FeSO4 + H2 ↑
1 1
y y
x + y = 4.48L ÷ 22.4L/mol=0.2mol --------(2)
联立(1)(2)解得
X=0.1mol Y=0.1mol
则混合物中铁的质量=0.1mol × 56g/mol=5.6g
混合物中铁的质量分数=5.6g ÷ 12.1g × 100%=46.3%
答:混合物中铁的质量分数为46.3%1年前查看全部
- 下列化学方程式正确的是( ) A.铁屑溶于稀硫酸:2Fe+3H 2 SO 4 ═Fe 2 (SO 4 ) 3 +3H
下列化学方程式正确的是( )
A.铁屑溶于稀硫酸:2Fe+3H 2 SO 4 ═Fe 2 (SO 4 ) 3 +3H 2 ↑
B.检验二氧化碳的存在:CO 2 +2NaOH═Na 2 CO 3 +H 2 O
C.用稀盐酸除去铁制品表面的铁锈:FeO+HCl═FeCl 2 +H 2 O
D.向纯碱溶液中滴加氯化钙溶液:Na 2 CO 3 +CaCl 2 ═2NaCl+CaCO 3 ↓ lihaixia1年前1
lihaixia1年前1 -
 鬼囡囡 共回答了15个问题
鬼囡囡 共回答了15个问题 |采纳率100%A、铁和硫酸反应生成硫酸亚铁和氢气,正确的化学方程式应为Fe+H 2 SO 4 ═FeSO 4 +H 2 ↑.
B、检验二氧化碳常用澄清的石灰水,正确的化学方程式应为CO 2 +Ca(OH) 2 ═CaCO 3 ↓+H 2 O.
C、铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,正确的化学方程式是:Fe 2 O 3 +6HCl═2FeCl 3 +3H 2 O.
D、该化学方程式书写完全正确.
故选D.1年前查看全部
- 加入铁屑生成氢气的共存离子组是?
加入铁屑生成氢气的共存离子组是?
A OH- Cu2+ N03- Mg2+
B NO3- Ba2+ CI- SO4+
C CO3 2+ K+ Na+ CI-
D No3- Na+ SO4 2- Mg2+ 拉法荷日1年前3
拉法荷日1年前3 -
 我一片冰心在玉壶 共回答了11个问题
我一片冰心在玉壶 共回答了11个问题 |采纳率100%答案是( D )
加入铁屑生成氢气,则溶液必然显酸性
A OH- Cu2+ N03- Mg2+ ——溶液中有OH-,溶液显碱性
B NO3- Ba2+ CI- SO4+ ——溶液为中性(离子全部为强酸强碱含有的离子)
C CO3 2+ K+ Na+ CI- ——溶液中有CO3 2-,溶液显碱性
D No3- Na+ SO4 2- Mg2+ ——溶液中有Mg2+,弱碱性离子,而NO3- 、SO4 2- 都为强酸性离子,溶液显酸性1年前查看全部
- (2006•永州)如图所示,当滑动变阻器滑片P向______端移动时,铁钉吸引铁屑的能力增强.
 bing2ding21年前1
bing2ding21年前1 -
 lhj0931 共回答了21个问题
lhj0931 共回答了21个问题 |采纳率95.2%解题思路:电磁铁磁性强弱影响因素:电流大小、线圈匝数多少、有无铁芯.在电流和铁芯一定时,线圈的匝数越多,电磁铁磁性越强;在线圈和铁芯一定时,电流越大,电磁铁磁性越强;在线圈和电流一定时,有铁芯时电磁铁磁性越强.铁钉吸引铁屑的能力增强,应增大通过线圈的电流,所以减小滑动变阻器的阻值,则滑片应向a端移动.
故答案为:a.点评:
本题考点: 影响电磁铁磁性强弱的因素.
考点点评: 此题考查了影响电磁铁磁性强弱的因素,同时涉及到了滑动变阻器的使用.1年前查看全部
大家在问
- 1《许多事不必在乎》这篇议论文的中心论点和分论点是什么
- 2悱徊在诚实的叉路口 作文
- 3英语翻译上个星期六我买了一条黑色裤子,绿色T-shirt他们一共花了我75元,因为他们在打折,正常价格是裤子119元,T
- 4以跟被人提建议(预防感冒的)为题的英语作文。谢谢。
- 5找出100到200的无暇素数无暇素数是一个数的逆序数也是素数大神们帮我把
- 6216,-27,-5,0.216,的立方根?
- 7如何证明:limf(x)=0( x趋向于X)的充分必要条件是lim|f(x)|=0 (x趋向于X). 灰常感谢~
- 8设x∈R,用[x]表示不超过x的最大整数,已知函数f(x)=2x,g(x)=f-1(x),数列{an}的通项公式为an=
- 9肯定没有核糖参与组成的结构或物质是( )
- 10写出下面句子中加粗词的反义词。1.考试时不要 紧张 。( ) 2.这个问题很 复杂 吗?( )3.这
- 11如图,有长为24米的篱笆,一面利用墙(墙的最大可用长度为11米),围成中间隔有一道篱笆的长方形花圃.
- 12(八0手二•三元区模拟)鹦鹉“说话”和菜青虫“吃菜”,这两种行为分别属于动物的( )
- 13小学四年级数学题8(x-3.5)=44求解
- 140.48×0.25简便计算0.072*1.25
- 15难忘的一件事(转载) 作文
