铝的第一电离能比硅的大还是小?
 luoy89022022-10-04 11:39:541条回答
luoy89022022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 狂舞天空168 共回答了12个问题
狂舞天空168 共回答了12个问题 |采纳率100%- 大、
- 1年前
相关推荐
- 下列说法正确的是( ) A.Mg的第一电离能低于Al B.ns、np、nd、nf能级的能量依次升高 C.ns、np、n
下列说法正确的是( ) A.Mg的第一电离能低于Al B.ns、np、nd、nf能级的能量依次升高 C.ns、np、nd、nf能级拥有的轨道数分别为2、6、10、14 D.电子云图通常用小黑点的疏密表示核外空间的单位体积内电子出现的概率大小  黄水杯1年前1
黄水杯1年前1 -
 zhangdongmiao 共回答了24个问题
zhangdongmiao 共回答了24个问题 |采纳率95.8%A、镁的3s能级有2个电子,轨道是全充满,能量低比较稳定,所以镁元素的第一电离能高于同周期相邻元素的第一电离能,故A错误
B、同一内层中的s、p、d、f能级能量依次升高,故B正确;
C、s、p、d、f能级拥有的轨道数分别为1、3、5、7,容纳的电子数最多分别为2、6、10、14,与内层无关,故C错误;
D、电子云图通常用小黑点的疏密表示核外空间的单位体积内电子出现的概率大小,小黑点本身没有意义,故D正确.
故选:BD.1年前查看全部
- 为什么C、N、O的第一电离能由小到大是C
 wjhhb20081年前1
wjhhb20081年前1 -
 ggywww 共回答了18个问题
ggywww 共回答了18个问题 |采纳率94.4%一般来说非金属性越强,所以O>N>C.
但是因为p轨道半充满体系具有很强的稳定性.
N的p轨道本来就是半充满的.
O的p轨道失去一个电子才是半充满的.
所以O比N容易失去电子.1年前查看全部
- 下列对各组物质性质的比较中,正确的是 A.第一电离能:Na<Mg<Al B.熔点:金刚石>晶体硅>碳化硅 C
下列对各组物质性质的比较中,正确的是
A.第一电离能:Na<Mg<Al B.熔点:金刚石>晶体硅>碳化硅 C.硬度:Li>Na>K D.空间利用率:六方密堆<面心立方<体心立方  junjun0501年前1
junjun0501年前1 -
 xuanwind 共回答了21个问题
xuanwind 共回答了21个问题 |采纳率100%C
1年前查看全部
- 同一周期元素的原子(除稀有气体),半径越大越容易失去电子 但是第一电离能N却比C大 两者矛盾吗?
同一周期元素的原子(除稀有气体),半径越大越容易失去电子 但是第一电离能N却比C大 两者矛盾吗?
根据原子的电子排布中的原则 N的第一电离能大于C的 但是为什么同一周期元素的原子(除稀有气体),半径越大越容易失去电子
改为 O比N更容易失电子 虫子-虫子1年前1
虫子-虫子1年前1 -
 ytmfdht 共回答了17个问题
ytmfdht 共回答了17个问题 |采纳率100%不矛盾,这是两回事情
我们先说一下半径的事情,确实是越往后,半径越小,越不容易失去电子
再说一下第一电离能,是指失去第一个电子的难易程度
看似矛盾,实则不然,有个半饱和稳定不知道你有没有学过,当电子排列属于饱和,或者半饱和的时候,最为稳定
而N 2s2 2p3属于半饱和,很稳定,很难失去那一个电子,所以造成了这一情况,所有的第五主族的元素都有这个现象
希望可以帮助你,不懂继续吧~1年前查看全部
- 1 Cu的第一电离能大于第二点离能用核外电子排布解释.2 NO2+与NO3-中N原子杂化类型为?
 zlp29618051年前2
zlp29618051年前2 -
 水溅轩辕 共回答了22个问题
水溅轩辕 共回答了22个问题 |采纳率90.9%铜原子核外电子构型是3d104s1,其最外层的4s轨道上只有1个电子,容易失去.但若要失去第2个电子,则要失去3d轨道上的电子,而铜原子3d轨道处于全充满状态,很稳定,所以失去第2个电子所需能量要大于失去第1个电子的能量
NO2+价电子对数是2,sp杂化
NO3-价电子对数是3,sp2杂化
若有不解,欢迎追问,1年前查看全部
- 下列说法正确的是( )A.Mg的第一电离能低于AlB.ns、np、nd、nf能级的能量依次升高C.ns、np、nd、n
下列说法正确的是( )
A.Mg的第一电离能低于Al
B.ns、np、nd、nf能级的能量依次升高
C.ns、np、nd、nf能级拥有的轨道数分别为2、6、10、14
D.电子云图通常用小黑点的疏密表示核外空间的单位体积内电子出现的概率大小 御剑云霄1年前1
御剑云霄1年前1 -
 lpd_06 共回答了21个问题
lpd_06 共回答了21个问题 |采纳率90.5%解题思路:A、镁的3s轨道是全充满,能量低比较稳定.
B、同一内层中的s、p、d、f能级能量依次升高.
C、s、p、d、f能级拥有的轨道数分别为1、3、5、7.
D、电子云图通常用小黑点的疏密表示核外空间的单位体积内电子出现的概率大小.A、镁的3s能级有2个电子,轨道是全充满,能量低比较稳定,所以镁元素的第一电离能高于同周期相邻元素的第一电离能,故A错误
B、同一内层中的s、p、d、f能级能量依次升高,故B正确;
C、s、p、d、f能级拥有的轨道数分别为1、3、5、7,容纳的电子数最多分别为2、6、10、14,与内层无关,故C错误;
D、电子云图通常用小黑点的疏密表示核外空间的单位体积内电子出现的概率大小,小黑点本身没有意义,故D正确.
故选:BD.点评:
本题考点: 原子核外电子的能级分布;元素电离能、电负性的含义及应用.
考点点评: 考查核外电子排布规律、元素周期律、电子云等,难度不大,注意电子云图中小黑点本身没有意义,不代表1个电子也不代表出现一次,小黑点的疏密程度有意义,表示核外空间的单位体积内电子出现的概率大小.1年前查看全部
- 高三化学,判断正误:1、短周期主族元素XY的原子半径X>Y,Y的第一电离能可能大于X2、无论原子种类是否相同,基态原子的
高三化学,判断正误:
1、短周期主族元素XY的原子半径X>Y,Y的第一电离能可能大于X
2、无论原子种类是否相同,基态原子的能量总是低于激发态原子的能量
3、多电子原子,N层电子的能量肯定比M层电子的能量高
4、碳碳键的键长乙烯大于苯(这个我不懂,乙烯加成更容易,那键能应该更小,键长更长才对呀?)
5、分子晶体、离子晶体、原子晶体一般的熔点各为多少?
6、N、S的半径怎么比较?
7、钠、镁、铝的熔点比较?
8、Na Cu Si H C N单质的熔点比较?
1234是判断 娇女1年前6
娇女1年前6 -
 youhl001 共回答了22个问题
youhl001 共回答了22个问题 |采纳率95.5%那么楼主,我就说后四道了
原子晶体熔点一般很高,都在2000多度以上
离子晶体熔点差距较大,但一般在几百度左右,高的也能达到1000多度
分子晶体熔点较低,几十度的算是高的,也有零下的,很常见啊,如气体
N,S的半径还不好比较吗?楼主可能被迷惑了,两个元素的周期都不一样,最外电子层数就不一样,那当然是电子层数多的半径大啊,所以S>N
7楼上正解,我就不多说了
8的话要看的,因为C的单质种类较多,如果是金刚石熔点就最高,如果是石墨熔点就不高了,比N高,其他的话Si最高,单质属原子晶体,其次是Cu,Na,两种气体的话不是很好比,结果是氮气大于氢气,我下面的解释仅供参考
从分子间力的角度解释,因为氮气分子量比氢气大,所以熔点高
从键的结构来看,因为氮气中的氮氮三键非常稳定,不易被破坏,所以导致其熔点要高1年前查看全部
- 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.(1)N、P、S的第一电离能由小到大的顺序为__
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.(1)N、P、S的第一电离能由小到大的顺序为__
 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.
(1)N、P、S的第一电离能由小到大的顺序为______.
(2)组成蛋白质的最简单的氨基酸(HOOCCH2NH2)介子中,π键数目为______.
(3)Zn2+、Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物.
①基态Zn2+的价电子(外围电子)排布式为______.
②[Zn(H2O)4]SO4中不存在的化学键类型有______.(填序号).
a.配位键b.金属键c.共价键d.氢键e.离子键
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为______.
a.平面正方形b.正四面体c.三角锥形d.V形
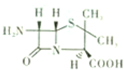
(4)由上述几种元素组成的6一氨基青霉烷酸的结构如图,其中采用sp3杂化的原子除了S外,还有______.
(5)紫外光的光子所具有的能量约为399kJ?mol-根据下表有关蛋白质分子中主要化学键的键能信息,说明人体长时间照射紫外光后皮肤易受伤害的原因是______(填序号).
共价键 C-C C-N C-S 键能/(kJ?mol-1) 347 305 259
 kuechler1年前1
kuechler1年前1 -
 hmilzhu5219 共回答了16个问题
hmilzhu5219 共回答了16个问题 |采纳率93.8%(1)同周期自左而右元素的电离能增大,但同周期第ⅡA、ⅤA元素出现反常,同主族从上往下电离能减小,所以电离能大小的顺序为S<P<N,
故答案为:S<P<N;
(2)H2NCH2COOH,结构中只有1个C=O双键,即π键数目为为1,故答案为:1;
(3)①锌原子核外有30个电子,所以基态Zn2+的价电子(外围电子)排布式为3d10,故答案为:3d10;
②[Zn(H2O)4]SO4中锌离子与水分子之间形成配位键,水分子中氧原子与氢原子之间形成极性共价键,络离子与硫酸根离子形成离子键,配体之间形成氢键,故选b;
③形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,故答案为:a;
(4)因为杂化杂道是用来容纳σ键与孤电子对,其中采用sp3杂化的原子,σ键数目与孤电子对数目之和为4,故答案为:C、N、O;
(5)紫外光的光子所具有的能量比蛋白质中主要化学键C-C、C-N和C-S的键能都大,紫外线的能量足以使这些化学键断裂,从而破坏蛋白质分子,
故答案为:紫外光的光子所具有的能量比蛋白质中主要化学键C-C、C-N和C-S的键能都大,紫外线的能量足以使这些化学键断裂,从而破坏蛋白质分子.1年前查看全部
- 为什么Mg的第一电离能大于Al,但是活泼性却大于Al?
 风风三1年前2
风风三1年前2 -
 wuyuan2002 共回答了18个问题
wuyuan2002 共回答了18个问题 |采纳率83.3%继上面回答,虽然Mg的第一电离能大,但是它形成的离子是不稳定的,很容易再失电子,而Al是第一电力能小,失去一个电子后不稳定还要失去,但是相较而言,它剩下的能级是充满状态,所以失去较难,最终形成三价离子难度越大,得到它的金属性实际更弱1年前查看全部
- B O C N 四个元素中,第一电离能最大的是?为什么
B O C N 四个元素中,第一电离能最大的是?为什么
O 是N最大 但是为什么 具体的 epqe1年前2
epqe1年前2 -
 lialr 共回答了19个问题
lialr 共回答了19个问题 |采纳率89.5%啊哈,我知道了,第五主族和第六主族反常!另外第二第三主族也是反常的.《物质结构与性质》上面有的1年前查看全部
- X、Y为两种元素的原子,X的阴离子与Y的阳离子有相同的电子层结构,x元素的第一电离能>y元素 为什么错
 ww逍遥侯1年前1
ww逍遥侯1年前1 -
 sentence 共回答了20个问题
sentence 共回答了20个问题 |采纳率95%根据X元素的阳离子与Y元素的阴离子具有相同的电子层结构则可以确定,X元素位于Y元素的下一个周期,且X为金属元素,Y为非金属元素.
再根据同周期元素从左到右第一电离能依次增大,同主族元素从上往下第一电离能依次减小的规律,可以确定X的第一电离能一定小于Y的第一电离能.
如钠原子、镁原子、铝原子第一电离能就小于氟原子、氧原子、氮原子,钾原子、钙原子第一电离能小于硫原子、氯原子的.
因此,你的命题不对的.
这是第一电离能图1年前查看全部
- 元素周期表中0族元素的第一电离能是零么
元素周期表中0族元素的第一电离能是零么
印象当中好像看过 规定0族的第一电离能是 0 像是 幻觉 谁能 给我确定的 三ke1年前3
三ke1年前3 -
 特爱看超女 共回答了16个问题
特爱看超女 共回答了16个问题 |采纳率87.5%不可能.如果第一电离能是0,意味着不需要能量就会有一个电子脱离原子核的束缚.可是如果真的是那样,那么这个电子根本就不能认为属于这个原子,因为原子核对它没有引力可言.那么又何来电离这种说法.所以任何原子的第一电离能不可能是0.0族的第一电离能很大.
那个之所以叫做0族,估计是因为化合价一般都是0.也就是以单质形态存在.当然,其实是可以反应的,但是化合物种类很少.1年前查看全部
- 下列物质中,第一电离能最大的是?A F2 B O2 C O2+ D N2
 yan过无痕1年前2
yan过无痕1年前2 -
 ush15e6hb__1ef6 共回答了14个问题
ush15e6hb__1ef6 共回答了14个问题 |采纳率92.9%是A,元素从左到右电离能是递增的,越靠右越不容易失电子,越靠左越容易失电子1年前查看全部
- 为什么铍元素的第一电离能大于硅元素
 xuhonglan1年前1
xuhonglan1年前1 -
 hkdell 共回答了14个问题
hkdell 共回答了14个问题 |采纳率85.7%用slater规则计算就行了.2s2电子稳定性很高的,3s23p2的电离能算什么1年前查看全部
- X、Y为两种元素的原子,X的阴离子与Y的阳离子有相同的电子层结构,x元素的第一电离能>y元素 为什么错
 wks66001年前2
wks66001年前2 -
 娃哈哈9303 共回答了16个问题
娃哈哈9303 共回答了16个问题 |采纳率93.8%X、Y为两种元素的原子,X的阴离子与Y的阳离子有相同的电子层结构,x元素的第一电离能>y元素是对的.1年前查看全部
- 为什么副族元素第一电离能变化不大
 vincen20051年前2
vincen20051年前2 -
 d4aa 共回答了30个问题
d4aa 共回答了30个问题 |采纳率96.7%副族元素随着核电荷数递增电子填充在次外层或者倒数第三层.虽然核电荷数增加,核对最外层电子的吸引力增加,但电子填充在次外层或倒数第三层,对最外层排斥力也增加,抵消了核对最外层吸引力增大的影响.副族元素原子半径变化不大,最外层电子的第一电离能的变化也不大.1年前查看全部
- 但有句话:元素的第一电离能越小,金属性越强.是正确的,这怎么理解?和刚才的说法矛盾……
 wawwj0031年前4
wawwj0031年前4 -
 luckfanfan 共回答了20个问题
luckfanfan 共回答了20个问题 |采纳率90%你这句话说的是半截话吧
元素的第一电离能越小,金属性越强,这句话本身是不正确的,只适用于同一主族元素,对于同一周期元素则不适用.比如氧的第一电离能为1314KJ/MOL,氮的为1400KJ/MOL,但氧的非金属性更强1年前查看全部
- 钠离子电离能比氖大吗第一电离能
 cainaries1年前1
cainaries1年前1 -
 28633996 共回答了16个问题
28633996 共回答了16个问题 |采纳率93.8%当然.Na+和Ne电子构型相同,而Na+比Ne的核电荷数大,因此Na+原子核对核外电子的吸引力大于Ne原子核对核外电子的吸引力,Na+更难失去电子.
也就是说,Na+的电离能(实际上是Na的第二电离能)大于Ne的第一电离能.1年前查看全部
- 电负性高的元素是不是第一电离能高
 毕力格图1年前2
毕力格图1年前2 -
 jordanjixue 共回答了17个问题
jordanjixue 共回答了17个问题 |采纳率100%不一定1年前查看全部
- 镁,铝,硫,磷的第一电离能为何会反常呢?与电子轨道半充满全充满有关吗?
镁,铝,硫,磷的第一电离能为何会反常呢?与电子轨道半充满全充满有关吗?
第一电离能不是原子半径越小,电离能越大吗? hunterZD1年前2
hunterZD1年前2 -
 偶们要闪亮1 共回答了15个问题
偶们要闪亮1 共回答了15个问题 |采纳率93.3%有关系.镁的原子轨道是半充满状态,能量大.故镁的第一电离能比铝大.1年前查看全部
- 怎么判断电负性和第一电离能的大小?
 哭泣的水煮鱼1年前1
哭泣的水煮鱼1年前1 -
 小愚919 共回答了15个问题
小愚919 共回答了15个问题 |采纳率86.7%越靠近周期表右上角,电负性越强,左下角越弱1年前查看全部
- 镁离子的第三电离能为什么比氖的第一电离能要低
镁离子的第三电离能为什么比氖的第一电离能要低
镁离子的电子组态和氖的一样
给两个原因, y2k10251年前2
y2k10251年前2 -
 afei5 共回答了23个问题
afei5 共回答了23个问题 |采纳率95.7%因为镁失去两个电子后最外层已经达到8电子稳定结构,和氖的电子结构相似,镁的原子核电荷数比氖多两个,所以镁原子核对核外电子的吸引力大于氖原子核对核外电子的吸引力,所以镁离子的第三电离能比氖的第一电离能要低.1年前查看全部
- 为什么元素间的第一电离能相差很小就有可能反应呢?
 gg杭城版主1年前1
gg杭城版主1年前1 -
 搭车额都 共回答了24个问题
搭车额都 共回答了24个问题 |采纳率83.3%因为反应就是价电子的得失
一旦第一电离能很小,那么反应的能量就很小,很可能反应1年前查看全部
- 为什么锗的第一电离能大于锂
 Outgrow1年前1
Outgrow1年前1 -
 wrx1969 共回答了13个问题
wrx1969 共回答了13个问题 |采纳率100%Ge的最外层是4个电子,而Li只有1个,当然是Li失去1个电子达到2电子稳定结构比你Ge要一次性失去4个要容易啦.1年前查看全部
- Li和Ba的第一电离能谁大?
 fishlz1年前1
fishlz1年前1 -
 一夫之用 共回答了15个问题
一夫之用 共回答了15个问题 |采纳率86.7%Li为5.39eV,Ba为5.21eV,所以是Li大.虽然Li失去一个电子能形成稳定结构,但Ba毕竟半径大,原子核对外层电子的吸引作用是比较差的.1年前查看全部
- Na离子和Ne是等离子体,为什么他们的第一电离能数值差别较大
 feier5baobei1年前2
feier5baobei1年前2 -
 twtynky 共回答了9个问题
twtynky 共回答了9个问题 |采纳率100%基本概念
在化学变化中,电中性的原子经常会得到或者失去电子而成为带电荷的微粒,这种带电的微粒叫做离子[1].
原子是由原子核和核外电子构成,原子核带正电荷,绕核运动的电子则带相反的负电荷.原子的核电荷数与核外电子数相等,因此原子显电中性.如果原子从外获得的能量超过某个壳层电子的结合能,那么这个电子就可脱离原子的束缚成为自由电子.一般最外层电子数小于4的原子、或半径较大的原子,较易失去电子(一般为金属元素;而最外层电子数不少于4的原子(一般为非金属元素,如:硼元素,碳元素等)则较易获得电子.当原子的最外层电子轨道达到饱和状态(第一周期元素2个壳层电子、第二第三周期元素8个电子)时,性质最稳定,一般为稀有气体.
分类
当原子得到一个或几个电子时,核外电子数多于核电荷数,从而带负电荷,称为阴离子.
当原子失去一个或几个电子时,核外电子数少于核电荷数,从而带正电荷,称为阳离子.
(络离子是指由某些分子、原子或阳离子通过配位键与电中性分子或阴离子形成的复杂离子,例如水合离子.络离子本身可以属于阳离子或阴离子.)
相关属性 在化合物的原子间进行电子转移而生成离子的过程称为电离,电离过程所需或放出的能量称为电离能.电离能越大,意味着原子越难失去电子.
离子化合物,即阴、阳离子间以离子键组成的化合物,如可溶于水的酸、碱、盐,当在水中溶解并电离时,恒定条件下,处于离子状态的比例和处于分子状态的比例达到动态平衡,称为离子平衡.
发现简史
1887年,28岁的阿仑尼乌斯在前人研究的基础上提出了电离理论.但他的导师,著名科学家塔伦教授不认同他的观点,严厉抨击了他的论文,结果电离学说在数年后才受到公认.阿仑尼乌斯荣获1903年诺贝尔化学奖.
后来物理学家德拜对离子作了进一步研究并获得1936年诺贝尔化学奖.
等离子态与气体放电
在绝对温度不为零的任何气体中都有一定数量的原子被电离.在气体放电过程中以及受控聚变装置产生的高温等离子体中,有大量的工作气体原子和杂质原子被剥离了最外层电子,成为离子.例如氧原子,若失去一个电子记作OⅡ,若失去两电子记作OⅢ,以此类推.
SV-2023 离子棒
SV-2023离子棒 是一种固定式消除静电的专用设备.属棒式除静电产品的一种.具有安装简易、工作稳定、消除静电速度快的特点.
作用原理:
离子棒可产生大量的带有正负电荷的气流,可以将物体上所带的电荷中和掉,当物体表面所带电荷为负电荷时,它会吸引气流中的正电荷,当物体表面所带电荷为正电荷时,它会吸引气流中的负电荷,从而使物体表面上的静电被中和,达到消除静电的目的.
电离器件:
电离器件在高压发生器产生的低电流高电压作用下,形成一个稳定的高强电场,电离空气形成离子体,到达物体表面,达到中和静电和除尘目的.
离子棒其强离子清除物体表面的静电,属工业类,适用于平面物体的除静电,应用窗帘遮光原理设计的外观,安装在洁净车间流水线入口,窗帘式的离子可有效的隔离洁净车间内外的空气混流.需配高SV-2060高压发生器使用.
离子的检验
Cl-(在溶液中)———在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子.
SO42-(在溶液中)———在被测溶液中加入硝酸钡(或氯化钡、或氢氧化钡)溶液,如果生成不溶于硝酸(或盐酸)的白色沉淀,则原被测液中含硫酸根离子.
CO32-(1)(固体或溶液)———在被测物质中加入稀酸溶液,如果产生能使澄清石灰水变浑浊的气体,则原被测物质中含碳酸根离子.
Fe3+ (溶液中)———在被测物质中加入KSCN溶液,如果产生血红色沉淀,则远被测溶液中含有铁离子.
Na+ (固体或溶液)———用焰色反映检验,如果其火焰为黄色,则原物质中含有钠离子.
K+ (固体或溶液)———用焰色反映检验,如果其火焰为紫色(透过蓝色钴玻璃,滤去黄光),则原物质中含有钾离子.
Br- (溶液)———在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的浅黄色沉淀,则原被测液中含溴离子.
I- (溶液)———在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的黄色沉淀,则原被测液中含碘离子.
NH4+ (溶液或固体)———在被测物质中加入强碱如NaOH,研磨或加热,如果放出刺激性气体,且该气体能使湿润的石蕊试纸变蓝,则原物质中含有铵根离子.
Fe2+ (溶液)———在被测溶液中加入新制氯水,然后加入KSCN溶液,如果产生血红色沉淀,则原被测溶液中含有亚铁离子.
(2)(在溶液中)———在被测溶液中加入氯化钡或硝酸银溶液,如果产生能溶于硝酸的白色沉淀,且同时生成能使澄清的石灰水变浑浊的气体,则原被测溶液中含碳酸根离子.
注:1、在鉴别Cl和SO4时,用氯化钡溶液,不要用硝酸银溶液,这是因为硫酸银为微溶性物质,使鉴别现象不明显.
2、在一未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含银离子也可能含硫酸根离子,所以应先加盐酸酸化并排除银离子
人烧伤失去的离子多还是水多,要分情况而论,一方面“离子”和“水”的衡量单位不一样,所以不好确切说明.但另一方面人体内的“体液”是等渗状态的,所以从这个方面来讲就比较好说了,即“人烧伤失去的离子和水是等渗的”,因此也有等渗性脱水、低渗性脱水、高渗性脱水之说.所以,烧伤时,人体应该随时补充当时丢失的离子和水,保持内环境的稳定.1年前查看全部
- 按第一电离能从小到大排列这几个化学元素Mg,Ca,Ba
 ckvoaisdufoasidu1年前1
ckvoaisdufoasidu1年前1 -
 loseboy318 共回答了11个问题
loseboy318 共回答了11个问题 |采纳率90.9%第一电离能:Ba>Ca>Mg1年前查看全部
- 已知20摄氏度时1molNa失去1mol电子所需的能量为650kJ,则Na的第一电离能为650kj,为什么不对?
 drzb8321年前2
drzb8321年前2 -
 ibmp650 共回答了19个问题
ibmp650 共回答了19个问题 |采纳率78.9%气态电中性基态原子失去一个电子转化为气态基态正离子所需要的能量叫做第一电离能
20度的时候钠不是气态的1年前查看全部
- 下列说法正确的是( )A. 第一电离能越小的元素其单质金属活泼性一定越大B. 电负性越小的元素金属性一定越强C. 元素
下列说法正确的是( )
A. 第一电离能越小的元素其单质金属活泼性一定越大
B. 电负性越小的元素金属性一定越强
C. 元素电负性相差小于1.7的元素之间形成的化学键一定为共价键
D. 制造光电材料的元素主要从IA族中寻找其主要原因是IA的第一电离能比较低 zhoumin0201年前1
zhoumin0201年前1 -
 若水之南xu 共回答了16个问题
若水之南xu 共回答了16个问题 |采纳率93.8%解题思路:A、同周期从左到右第一电离能增大,但第IIIA和第VA族反常;
B、有的元素没有金属性;
C、元素电负性相差小于1.7的元素之间形成的化学键一般为共价键,但是也有例外;
D、第IA元素的第一电离能比较低,容易失电子.A、同周期从左到右第一电离能增大,但第IIIA和第VA族反常,如第一电离能:Mg>Al,Al的第一电离能越小,但Al的金属活泼性弱,故A错误;
B、有的元素没有金属性,电负性越小的元素的非金属性越弱,故B错误;
C、元素电负性相差小于1.7的元素之间形成的化学键一般为共价键,但是也有例外,如F与B的电负性差为2,BF3属于共价化合物,故C错误;
D、第IA元素的第一电离能比较低,容易失电子,所以制造光电材料的元素主要从IA族中寻找,故D正确.
故选D.点评:
本题考点: 元素电离能、电负性的含义及应用.
考点点评: 本题考查了第一电离能和电负性,题目难度不大,注意同周期第一电离能的变化规律及电负性的含义.1年前查看全部
- 下列说法中正确的是( )A.所有主族元素中,氟的电负性最大B.钠的第一电离能比镁的第一电离能大C.第三周期所包含的元素
下列说法中正确的是( )
A.所有主族元素中,氟的电负性最大
B.钠的第一电离能比镁的第一电离能大
C.第三周期所包含的元素中钠的原子半径最小
D.电子云示意图中的每个小黑点都表示一个电子 cfy611年前1
cfy611年前1 -
 kazuya 共回答了23个问题
kazuya 共回答了23个问题 |采纳率95.7%解题思路:A.元素的非金属性越强,其电负性越大;
B.同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但IIA族、第VA族元素第一电离能大于其相邻元素;
C.同一周期元素,原子半径随着原子序数增大而减小;
D.电子云示意图中的每个小黑点表示电子出现在核外空间中的概率.A.元素的非金属性越强,其电负性越大,F元素非金属性最大,所以其电负性最大,故A正确;B.同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但IIA族、第VA族元素第一电离能大于其相邻元素,则Na元素...
点评:
本题考点: 元素电离能、电负性的含义及应用.
考点点评: 本题考查元素周期律、电子云等知识点,属于基本概念、基本理论知识,注意第一电离能规律中的异常现象,为易错点.1年前查看全部
- Mg的第一电离能比Al大,为什么熔沸点比它小?
Mg的第一电离能比Al大,为什么熔沸点比它小?
第一电离能,跟什么有关?
有点茫,既然跟物理性质有关,那干嘛跟沸点无关? 深蓝未来的梦1年前2
深蓝未来的梦1年前2 -
 iktnfn2007 共回答了15个问题
iktnfn2007 共回答了15个问题 |采纳率86.7%第一电离能是指一个气态原子失去一个电子形成一个气态离子所吸收的能量
根据这个定义可以看出,第一电离能越大,失去电子的能力就越弱,说明这种元素的还原性越弱,金属性也越弱
但是也不尽然,镁和铝就是一个典型的例外,
铝核外本来是3s2 3p1,失去一个电子后,核外电子变成 3s2
这是一种稳定的结构,物质当然趋向于形成稳定的结构,所以铝失去第一个电子比镁要容易,但是以后的第二电离能,就是铝比镁大了
这种特例,还有O<N ,S<P 原因与上面所说的相似
熔点是由晶格能所决定的,镁和铝的晶体结构不一样,原子半径也不一样,因此造成了他们熔沸点的不同.
所以不能看他们的第一电离能1年前查看全部
- 气态原子生成 1价气态阳离子所需要的能量称为第一电离能.元素的第一电离能是衡
气态原子生成 1价气态阳离子所需要的能量称为第一电离能.元素的第一电离能是衡
气态原子生成+1价气态阳离子所需要的能量称为第一电离能.元素的第一电离能是衡量元素金属性强弱的一种尺度.下列有关说法不正确的是?
答案的D选项:金属单质跟酸反应的难易,除跟该金属元素的第一电离能有关外,还与该单质中固态金属原子以及该金属原子失去电子后在水溶液里形成水合离子的变化有关?
后半句怎么理解?金属阳离子的水解?求指点〜 紫色藕荷1年前2
紫色藕荷1年前2 -
 月子 共回答了18个问题
月子 共回答了18个问题 |采纳率88.9%金属性只跟电离能有关,注意电离能强调了是变成气态金属阳离子.
但是溶液中明显不可能是气态,而是水合离子.在气态离子的水合过程中需要放热,这个叫做水合能.
所以会出现什麽问题,就是Na电离能1年前查看全部
- N的第一电离能比O的大,且第一电离能和电负性越大,都是越难失电子,请问:为何O的电负性比N的大呢?
 xiexu10041年前1
xiexu10041年前1 -
 小肥1 共回答了18个问题
小肥1 共回答了18个问题 |采纳率94.4%N的第一电离需要破坏2P半充满的低能状态
O的第一电离形成了 2P半充满的低能状态,所以N的第一电离能比O的大
O的非金属性比N强所以O的电负性比N的大.1年前查看全部
- 关于电离能大小的比较问题我们知道按一般规律随原子半径变小第一电离逐渐变大但N的第一电离能比O大的原因是N的2p轨道半充满
关于电离能大小的比较问题
我们知道按一般规律随原子半径变小第一电离逐渐变大但N的第一电离能比O大的原因是N的2p轨道半充满更稳定而O是2P4 所以 N的第一电离能比O大.但是老师说Al 的电力能比Mg和Na都大 我就有点迷惑了.按N和O的分析方法分析 ,Na 3s轨道半充满,Mg 3S 全满 而AL是3s2 3p1 不是全满 全空或者半空 为什么电离能是Al大?
 唯美如月1年前1
唯美如月1年前1 -
 husiling 共回答了20个问题
husiling 共回答了20个问题 |采纳率80%原子半径变小电离能变大,这是正确的.
不过同一周期元素的原子半径几乎相同.s、p、d、f不是亚壳层,
只是不同电子数时的不同组合结构,因此电离能大小除与原子半
径有关还与电子轨道的空间结构有关.
元素电离能、离子的电离能能都是可以准确计算的,甚至原子、离
子的半径等也是可以准确计算的,具体可到下面的网点看看:
http://wenku.baidu.com/view/07958e31f111f18583d05a37.html1年前查看全部
- 我们化学书上说同一周期从左到右第一电离能一次变大,那为什么镁的第一电离能比铝大?
 好想摆脱1年前1
好想摆脱1年前1 -
 kuge31 共回答了8个问题
kuge31 共回答了8个问题 |采纳率87.5%镁的电子排布是[Ne]3s^2,3p轨道全空较稳定,而铝是[Ne]3s^2 3p^1则不是全满,全空,半空中任意一种情况,不稳定,故铝的第一电离能比镁小.1年前查看全部
- 如何判断Cr与Co的第一电离能大小关系
如何判断Cr与Co的第一电离能大小关系
Cr为24号元素 Co为27号元素 书上答案是Cr wuying8891年前2
wuying8891年前2 -
 nbaa51666 共回答了18个问题
nbaa51666 共回答了18个问题 |采纳率88.9%第一电离能,Cr小于Co(今年江苏一模考到的)
全空、半满、全满结构时,相对较稳定,是和相邻元素比,不能太过头.
所以Mg的第一电离能比Na和Al大,但比Si仍旧小.N的第一电离能比C、O大,但仍旧小于F.1年前查看全部
- 电离能是指由蒸气状态的孤立原子失去形成阳离子需要的能量.从中性原子中移去第一个电子所需的能量为第一电离能(I1),移去第
电离能是指由蒸气状态的孤立原子失去形成阳离子需要的能量.从中性原子中移去第一个电子所需的能量为第一电离能(I1),移去第二个电子所需要的能量成为第二个电离能(I2),依次类推.
元素 I1/eV I2/eV I3/eV
A 13.0 23.9 40.0
B 4.3 31.9 47.8
C 5.7 47.4 71.8
D 7.17 15.1 80.3
E 21.6 41.1 65.2
现在五种元素.A、B、C、D、E,其中 I1~I3 分别如上表.根据表中数据判断其中的稀有气体元素有_______,最活泼的金属元素是________. sadfouawrgjtrh1年前3
sadfouawrgjtrh1年前3 -
 lipanda 共回答了22个问题
lipanda 共回答了22个问题 |采纳率95.5%稀有气体元素有___E、A____,
最活泼的金属元素是___B_____.1年前查看全部
- 为什么同一原子的第二电离能比第一电离能大?
为什么同一原子的第二电离能比第一电离能大?
第二主族的元素最外层有两个电子,失去第一个电子后还剩一个,再失去这个电子就达到稳定了,这么看来第二电离能应该比第一电离能小才对啊~ hrb1061年前4
hrb1061年前4 -
 一记尘歌 共回答了18个问题
一记尘歌 共回答了18个问题 |采纳率88.9%首先说 关于“稳定”一词的理解.化学中一般说某某物质稳定,指的是某某处于低能量状态.
不过这个稳定,无法解决你想要搞明白的问题.
要想弄明白这个问题.要了解原子轨道的一些知识.
第二主族的元素最外层有两个电子,当原子失去一个电子后,也就失去了这个电子的屏蔽效应.因此另一个电子所能感受到的有效电荷更多了.也可以理解为静电引力更大了(正电荷多了).
所以第二电离能会比第一电离能大.1年前查看全部
- 有关于第一电离能周期性变化规律的问题
有关于第一电离能周期性变化规律的问题
同周期元素,电子层数相同,核电荷数增大,原子半径减小,原子核对外层电子的有效吸引力作用增强,失去第一个电子的趋势变难.但是能量相同的原子轨道在全满、半满、全空时体系能量最低,原子较稳定,因此价电子排布处于半满的轨道的元素,其第一电离能比临近原子的第一电离能大,比如N原子的第一电离能大于O原子的第一电离能.
这个大的范围是多少?比如N和后面的F比谁的第一电离能更大一些? oceanrider1年前2
oceanrider1年前2 -
 诺易斯 共回答了13个问题
诺易斯 共回答了13个问题 |采纳率100%一般会大于它后面第一个的电离能而又小于后面第二个的电离能
一般没有去比较相隔一个的电离能大小,但是N的电离能是小于F的,其它类似情况也是一样的1年前查看全部
- 为什么同元素的第一电离能小于第二电离能小于第三电离能?
为什么同元素的第一电离能小于第二电离能小于第三电离能?
不是说同元素的原子半径 负价态>中性>正价态
那么假设Mg 则原子半径Mg>Mg1+>Mg2+
那么Mg失去了一个电子后变成Mg1+时半径变大,原子核对它的束缚力不是变小了吗? song2001sg1年前1
song2001sg1年前1 -
 jacc 共回答了20个问题
jacc 共回答了20个问题 |采纳率95%因为第二和第三个电子距离原子核更近,所以原子核对它们的束缚更强,所以第一电离能比第二第三电离能要小.1年前查看全部
- 为什么磷的第一电离能比硫高呢?
 leonado19851年前1
leonado19851年前1 -
 1382314 共回答了24个问题
1382314 共回答了24个问题 |采纳率91.7%因为磷原子核外电子排布1s^2 2s^2 2p^6 3s^2 3p^3
硫原子核外电子排布1s^2 2s^2 2p^6 3s^2 3p^4
洪特规则告诉我们:
在能量相等的轨道上,自旋平行的电子数目最多时,原子的能量最低.所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道.例如碳原子核外有6个电子,按能量最低原理和保里不相容原理,首先有2个电子排布到第一层的1S轨道中,另外2个电子填入第二层的2s轨道中,剩余2个电子排布在2个p轨道上,具有相同的自旋方向,而不是两个电子集中在一个p轨道,自旋方向相反.作为洪特规则的补充,能量相等的轨道全充满、半充满或全空的状态比较稳定.
3p轨道有x、y、z3个,每个轨道最多容纳2个电子,自旋反平行,总共能容纳6个电子,半满为3,全空为0,所以当3p轨道电子数0、3、6时,原子较稳定.我们可以看到,磷原子3个3p轨道上分别被3个电子占据,是半充满的状态,能量较低,失去一个电子需要吸收的能量(第一电离能)较高;而硫原子3p轨道上有4个电子,当3个电子分别占据3个3p轨道后,第4个电子就要与其余3个电子中的1个电子配对,自旋反平行,这时候3p不是半充满的状态,电子之间会相互排斥,能量较高,失去一个电子需要吸收的能量(第一电离能)较低,而失去一个电子后产生的离子3p轨道是半充满的,较稳定,所以硫原子比磷原子失去一个电子更容易,第一电离能较低1年前查看全部
- 磷和硫谁的第一电离能大,为什么?
 yutang25hao1年前1
yutang25hao1年前1 -
 36161601 共回答了17个问题
36161601 共回答了17个问题 |采纳率100%磷大,磷的电子排布是[Ne]3s^2 3p^3,3p轨道半空较稳定,而硫是[Ne]3s^2 3p^4则不是全满,全空,半空中任意一种情况,不稳定,故磷的第一电离能比硫大.1年前查看全部
- 元素的第一电离能一定小于元素的第二电离能.这句话对吗?
 dreamtoucher1年前1
dreamtoucher1年前1 -
 就用宝蓝怎么着 共回答了21个问题
就用宝蓝怎么着 共回答了21个问题 |采纳率95.2%原子的第一电离能比第二电离能小,这句话是对的.
因为当原子失去一个电子后已经变成带有一个单位正电荷的阳离子了,再从阳离子那拿走一个电子,会受到较大的“异性相吸”的电性引力而显得困难很多.1年前查看全部
- 同一周期元素的第一电离能,元素原子越往左半径越小最外面的电子的能量越小,第一电离能应该减小,可书上使用吸引力的只是解释的
同一周期元素的第一电离能,元素原子越往左半径越小最外面的电子的能量越小,第一电离能应该减小,可书上使用吸引力的只是解释的,得出的结论与我正好相反,我的分析到底哪出错了?
 vald20081年前3
vald20081年前3 -
 garfieler 共回答了18个问题
garfieler 共回答了18个问题 |采纳率88.9%要考虑原子核内质子的数量,和原子半径的大小,引力和距离也是有很大关系的
越往右,原子半径越大,引力实际上越小1年前查看全部
- 下列说法中正确的是( )A.所有元素中钠的第一电离能最小B.铝的第一电离能比镁的第一电离能大C.在所有元素中,氟的第一
下列说法中正确的是( )
A.所有元素中钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能和电负性值都是最大
D.氮、氧、氟的原子半径小,电负性值大,与氢形成的共价键极性强,容易形成氢键 viken831年前1
viken831年前1 -
 coco_com 共回答了13个问题
coco_com 共回答了13个问题 |采纳率92.3%解题思路:A、同周期稀有气体的第一电离能最大,同族自上而下第一电离能降低;
B、镁原子的3s能级处于全满稳定状态,能量较低,第一电离能比Al元素高;
C、同周期稀有气体的第一电离能最大,同族自上而下第一电离能降低;
D、根据形成氢键的原理分析.A、稀有气体的原子结构是稳定结构,同周期稀有气体的第一电离能最大,同族自上而下第一电离能降低,故Cs元素的第一电离能最小,故A错误;
B、镁原子的3s能级处于全满稳定状态,能量较低,第一电离能比Al元素高,故B错误;
C、稀有气体的原子结构是稳定结构,同周期稀有气体的第一电离能最大,同族自上而下第一电离能降低,故氦元素的第一电离能最大,故C错误;
D、因为氮、氧、氟的原子半径小,电负性值大,与氢形成的共价键极性强,所以容易形成氢键,故D正确;
故选D.点评:
本题考点: 元素电离能、电负性的含义及应用.
考点点评: 本题考查第一电离能的变化规律等,比较基础,注意同周期主族元素能级处于半满、全满的稳定特殊情况第一电离能增大的特殊情况.1年前查看全部
- 第一电离能同周期从左到右逐渐增大,有什么特例,是不是所有的元素电离能都是从左到右依次增大?
 alohahu1年前1
alohahu1年前1 -
 引刀成一块 共回答了24个问题
引刀成一块 共回答了24个问题 |采纳率95.8%ⅡA和ⅤA是特例1年前查看全部
- 请根据分子轨道理论解释为什么CO的第一电离能比NO的高
 fxh7907291年前1
fxh7907291年前1 -
 月上柳梢头_无言 共回答了24个问题
月上柳梢头_无言 共回答了24个问题 |采纳率87.5%NO有15电子,π反键轨道上有一个单电子,键级=2.5;失去一个电子为NO+,键级=3,变得更加稳定.CO和NO+是等电子体,失去成键轨道中的成对电子其中的一个,比较困难.所以如你的问题所述.1年前查看全部
- 铝的第三电离能比氦的第一电离能大为什么 铝比氦容易反应
 ss喜欢玩1年前2
ss喜欢玩1年前2 -
 lin285291225 共回答了21个问题
lin285291225 共回答了21个问题 |采纳率81%在第三电离能时,已经有了两个正电荷,所以电离更困难1年前查看全部
- 在元素第一电离能的周期性变化中,如何解释氦,铍,氖,镁,氮,磷几种元素的第一电离能比它们的相邻元素高?
 titanata1年前2
titanata1年前2 -
 马麝 共回答了11个问题
马麝 共回答了11个问题 |采纳率100%He.最外层2电子稳定状态..不易失去电子
Be.Mg.L层的s能级充满了电子.(能量最低)
N.P p能级半充满状态.比较稳定(能量最低原理)1年前查看全部
大家在问
- 1一项工程,甲乙两队合作需要12天完成,这项工程如果先由做18天,余下的由乙队做8天也正好完成,甲对单独
- 2eat and sleep( ).you can grow quickly
- 3勇敢的近义词和反意词?
- 44个小正方形是由12根火柴组成的,想想怎样拿掉2根火柴变成2个正方形
- 5煤块在皮带盘上的摩擦痕迹如图 u=0.4 物块10m/s向左 皮带盘5m/s恒定速度向右 g取
- 6五年级数书76页8题
- 7爱之吟 作文
- 8求老师解答:阅读下面的文言文,完
- 9设命题P:不等式(13)x+4>m>2x−x2对一切实数x恒成立;命题q:函数f(x)=-(7-2m)x是R上的减函数.
- 10P在y^2=4x上,过P点做园C:(x+1)^2+y^2=1的切线,这两条切线与Y轴交与M,N两点,求|MN|最大值.
- 11KMnO2+HCl-KCl+MnCl2+Cl2+H2O得失电子配平
- 12一个三角形的底是46厘米,高是12厘米,面积是多少厘米?
- 13送东阳马生序有哪些通假字,一词多意,古今异议,重点句式...
- 14问一下sinacosa=负60/169而sina+cosa=负7/13.a在第二象限.求sina和cosa的值
- 15初一数学题,答对必有重谢!A=(-1996/1)的2003次幂*1996的2004次幂 B=(-5)的2003次幂*(-
