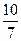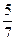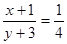在恒温恒压、不做功时,反应A+B═C+D在下列哪种情况下,一定能自发进行( ) A.△H<0,△S<0 B.△H>0,
 kfdzh2022-10-04 11:39:541条回答
kfdzh2022-10-04 11:39:541条回答 在恒温恒压、不做功时,反应A+B═C+D在下列哪种情况下,一定能自发进行( )
|

已提交,审核后显示!提交回复
共1条回复
 louisehhh 共回答了13个问题
louisehhh 共回答了13个问题 |采纳率92.3%- A、在恒温恒压、不做功时△H<0、△S<0,△H-T△S不一定小于0,故A不符合;
B、在恒温恒压、不做功时△H>0、△S<0,△H-T△S>0,反应一定不能自发进行,故B不符合;
C、在恒温恒压、不做功时△H<0、△S>0,△H-T△S<0,反应一定能自发进行,故C符合;
D、在恒温恒压、不做功时△H>0、△S>0,△H-T△S不一定小于0,故D不符合;
故选C. - 1年前
相关推荐
- 等效平衡中 恒温恒压条件下充入惰性气体,这时的总体积要算上稀有气体的吗
 简单纯粹1年前3
简单纯粹1年前3 -
 andyliu222 共回答了21个问题
andyliu222 共回答了21个问题 |采纳率100%恒温恒压 充入惰性气体 那么体系的压强要保持不变,体积必须增大 造成反应物和产物的实际浓度下降,总体积当然要考虑充入的惰性气体1年前查看全部
- I是恒温恒压密闭容器,II是恒温恒容密闭容器,其它条件相同时,在I,II中分别加入5MOL Z,起始时容器体积均为v L
I是恒温恒压密闭容器,II是恒温恒容密闭容器,其它条件相同时,在I,II中分别加入5MOL Z,起始时容器体积均为v L,发生如下反应并达到平衡:(X,Y状态未知)
aX(?)+2Y(?)=====3Z(g)此时II中XYZ的物质的量比为3:2:2.则下列说法一定正确的是:
B 若XY不均为气态,则平衡时X的产率:III
这俩都不对,B我明白,所以只需要粗略分析下就行了,主要是分析下C选项,我怎么觉得这个是对的= ht7771年前2
ht7771年前2 -
 Masise 共回答了17个问题
Masise 共回答了17个问题 |采纳率88.2%B如果不均为气态,那么逆反应时体积减小的反应,那么恒压有利较恒容更有利于X的生成,所以应该是1大于2,所以错
C,如果均为气态,根据初始5MOLZ,后来比为3:2:2,则A=3
那么逆反应是体积变大的反应,你注意,这个选项问的是平衡的时间,平衡的时间和反映速率有关系,同样是体积增大,第一个压强不变,第二个因为是恒容压强一直在变大,压强大了反应速率就会变快,但是由于两者不达到同一个平衡,所以没办法说第二个就先到达平衡,所以是错的1年前查看全部
- 已知N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.在一恒温恒压的密闭容器里充入2mol
已知N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3.现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ.则x、y的值为( )
A. 1.5,6.5
B. 2,8
C. 5,21
D. 3,13 roomz1年前1
roomz1年前1 -
 williamfwn 共回答了13个问题
williamfwn 共回答了13个问题 |采纳率84.6%解题思路:N2(g)+3H2(g)⇌2NH3(g)
开始2 8 0
相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ,
则二者为等效平衡,所以
N2(g)+3H2(g)⇌2NH3(g)
开始xy 2
等效x+1 y+3
则[x+1/y+3]=[2mol/8mol],以此来解答.N2(g)+3H2(g)⇌2NH3(g)
开始2 8 0
转化0.51.5 1
平衡1.5 6.51
氮气的转化率为[0.5mol/2mol]×100%=25%,放出热量为46.2kJ;
相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ,
则二者为等效平衡,所以
N2(g)+3H2(g)⇌2NH3(g)
开始xy 2
等效x+1y+3
则[x+1/y+3]=[2mol/8mol]=[1/4],
解得4x+1=y,
A.4×1.5+1≠6.5,故A错误;
B.4×2+1≠8,故B错误;
C.5×4+1=21,由放出的热量设氮气转化nmol,则92.4n-92.4=46.2,所以n=1.5mol,氮气的转化率为25%,故C正确;
D.3×4+1=13,由放出的热量设氮气转化nmol,则92.4n-92.4=46.2,所以n=1.5mol,氮气的转化率为37.5%,故D错误;
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,题目难度较大,注意利用等效平衡及化学平衡的三段法计算来解答,明确氮气的转化率及反应放出的热量是解答的关键,易错选D.1年前查看全部
- 关于化学平衡问题,对于同一反应,恒温恒压,恒温恒容平衡后一些物质的质量分数为什么会不同?可以举例
关于化学平衡问题,对于同一反应,恒温恒压,恒温恒容平衡后一些物质的质量分数为什么会不同?可以举例
?
 hezdc1年前1
hezdc1年前1 -
 rubbish_ren 共回答了18个问题
rubbish_ren 共回答了18个问题 |采纳率88.9%举例说明
对于同一个反应N2+3H2可逆号2NH3来说,假设都假如1molN2和3molH2作为起始反应物
恒温恒容的时候反应月进行气体分子数越小(见方程式),故压强越小,越对正反应不利,故转化率越低
恒温恒压时对正反应就没有这种限制
但这种区别主要是对于非等体积反应的(指反应前后化学计量数不相等)
对于等体积反应没有这种限制,例如:H2+I2=2HI1年前查看全部
- 气体可逆反应的平衡移动问题一个气体可逆反应达到平衡后,通入反应气体或生成气体,其他条件不变,恒温恒压(容积可变),反应向
气体可逆反应的平衡移动问题
一个气体可逆反应达到平衡后,通入反应气体或生成气体,其他条件不变,恒温恒压(容积可变),反应向哪一边移动 stand8881年前4
stand8881年前4 -
 looktwice 共回答了20个问题
looktwice 共回答了20个问题 |采纳率80%根据勒夏特列原理知道,充入那种物质,反应就行使这种物质减少的方向移动.
充入反应气体,反应向正向移动;充入生成气体,反应向逆向进行.1年前查看全部
- 在恒温恒压条件下充入氦气 这时的反应物的体积分数怎么算 总体积包括氦气吗
 龙王0641年前1
龙王0641年前1 -
 探险书生 共回答了14个问题
探险书生 共回答了14个问题 |采纳率85.7%反应物体积分数=反应物体积/(原来的体积+充入氦气体积)
总体积有包括氦气体积1年前查看全部
- 某化学反应在恒温恒压、非体积功为零条件下反应,问焓如何变化?为什么?
 美丽心情80231年前1
美丽心情80231年前1 -
 SHOUHUOKUAILE 共回答了22个问题
SHOUHUOKUAILE 共回答了22个问题 |采纳率81.8%如果反应放热,就降低,△H为负.吸热相反1年前查看全部
- 已知N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.在一恒温恒压的密闭容器里充入2mol
已知N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3.现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ.则x、y的值为( )
A.1.5,6.5
B.2,8
C.5,21
D.3,13 bigcat91年前1
bigcat91年前1 -
 卖兜见卖兜 共回答了15个问题
卖兜见卖兜 共回答了15个问题 |采纳率93.3%解题思路:N2(g)+3H2(g)⇌2NH3(g)
开始2 8 0
相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ,
则二者为等效平衡,所以
N2(g)+3H2(g)⇌2NH3(g)
开始xy 2
等效x+1 y+3
则[x+1/y+3]=[2mol/8mol],以此来解答.N2(g)+3H2(g)⇌2NH3(g)
开始2 8 0
转化0.51.5 1
平衡1.5 6.51
氮气的转化率为[0.5mol/2mol]×100%=25%,放出热量为46.2kJ;
相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ,
则二者为等效平衡,所以
N2(g)+3H2(g)⇌2NH3(g)
开始xy 2
等效x+1 y+3
则[x+1/y+3]=[2mol/8mol]=[1/4],
解得4x+1=y,
A.4×1.5+1≠6.5,故A错误;
B.4×2+1≠8,故B错误;
C.5×4+1=21,由放出的热量设氮气转化nmol,则92.4n-92.4=46.2,所以n=1.5mol,氮气的转化率为25%,故C正确;
D.3×4+1=13,由放出的热量设氮气转化nmol,则92.4n-92.4=46.2,所以n=1.5mol,氮气的转化率为37.5%,故D错误;
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,题目难度较大,注意利用等效平衡及化学平衡的三段法计算来解答,明确氮气的转化率及反应放出的热量是解答的关键,易错选D.1年前查看全部
- (6分)已知T℃、P kPa时,在容积为V L密闭容器内充有1 mol A和1 mol B.保持恒温恒压,使反应:A(g
(6分)已知T℃、P kPa时,在容积为V L密闭容器内充有1 mol A和1 mol B.保持恒温恒压,使反应:A(g)+B(g)
 C(g) 达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) 达到平衡时,C的体积分数为40%。试回答有关问题:
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2 mol C,则反应达到平衡时,容器的容积为___________,C的体积分数为_________.
(2)若另选一容积固定不变的密闭容器,仍控制温度为T℃,使1 mol A和1 mol B反应达到平衡状态时,C的体积分数仍为40%,则该密闭容器的容积为_________. lanzi811年前1
lanzi811年前1 -
 骆铃子 共回答了16个问题
骆铃子 共回答了16个问题 |采纳率93.8%(1)10V/7;40%;(2)5V/7
略1年前查看全部
- 关于压强改变,为什么总压一定,反应不一定达平衡?老师讲的时候,分了两种情况.一种恒温恒压(不论气体体积是否改变若总压一定
关于压强改变,为什么总压一定,反应不一定达平衡?老师讲的时候,分了两种情况.一种恒温恒压(不论气体体积是否改变若总压一定反应不一定达平衡)一种恒温恒容(气体体积不变时若总压一定不一定平衡;气体体积改变反应一定达平衡).
学这块的时候脑子全是乱的.谁能帮我讲讲怎么学啊?我们已经学完化学平衡这一节了(也讲了勒夏特列原理)可我分析不出来题也不会做. zhangben21年前1
zhangben21年前1 -
 more3288 共回答了13个问题
more3288 共回答了13个问题 |采纳率92.3%总压一定的时候 如果气体分子数不改变的话 体系内的压强是不会变化的 而且 如果是恒温恒压 压强也不会改变.1年前查看全部
- 同一反应在恒温恒压和恒温恒容两种情况下,反应物的转化率如何变化?
 说些么子1年前1
说些么子1年前1 -
 枯井不波 共回答了14个问题
枯井不波 共回答了14个问题 |采纳率92.9%只讨论气态的 压强对非气态的无影响 分三种情况讨论 反应物的系数大 小 等于生成物的系数 恒压对大于有促进作用 因为随着反应的进行 气体会减少 恒压就相等于加压 如合成氨 要在高压下进行 小于反之 等于无影响 实例是碘与氢气合成氢碘酸1年前查看全部
- 高中化学 平衡问题在 恒温恒压 下,增加反应物的量(气体).1:如果是 一种反应物,书上说是 转化率不变,为什么 ?2:
高中化学 平衡问题
在 恒温恒压 下,增加反应物的量(气体).1:如果是 一种反应物,书上说是 转化率不变,为什么 ?2:如果多种反应物,按照 比例同倍数 增加 ,转化率不变,为什么? 如果 多种反应物,我只增加 一种物质的 量,各转化率会怎样变?
谢谢了 wcc9802151年前3
wcc9802151年前3 -
 不知路 共回答了20个问题
不知路 共回答了20个问题 |采纳率80%平衡问题都是说起来费劲的
1和2都是等效平衡,因此转换率不变
3要是只增加一种,怎么变就得看情况.比如固体液体,分子比例等等1年前查看全部
- 高二化学难题有两只密闭容器A和B,A能保持恒温恒压,B能保持恒温恒容.起始时向容器A、B中分别通入体积比为2:1的等量的
高二化学难题
有两只密闭容器A和B,A能保持恒温恒压,B能保持恒温恒容.起始时向容器A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应:2SO2+O2=2SO3并达到平衡. (1)起始时两容器中的反应速率:v(A)___ v(B),反应过程中的反应速率:v(A)___v(B)(大于等于小于) (2)达到平衡时,在两容器中分别通入等量的Ar气.A中的化学平衡向___反应方向移动(正或逆),B中的化学反应速率___(增大减小或不变)
 spotol1年前1
spotol1年前1 -
 jackyl0000 共回答了19个问题
jackyl0000 共回答了19个问题 |采纳率84.2%1.相等,一开始通入的浓度是一样的!大于,A反应的体积不断减小,B是不变的,导致A里的浓度增大,速率就更大!
2.逆,A是恒压的,充稀有气体体积变大,相当于压强减小了,那么平衡向体积增大的方向移动,就是像逆了!不变,恒容充稀有气体容器体积不变,浓度不变,故速率不变!1年前查看全部
- 在恒温恒压密闭容器内·对于同一个反应的同一种反应物,如果加入的量有一小一大两种情况比较,那么反应达到平衡所需时间哪个更快
在恒温恒压密闭容器内·对于同一个反应的同一种反应物,如果加入的量有一小一大两种情况比较,那么反应达到平衡所需时间哪个更快?
原因· linshi171年前2
linshi171年前2 -
 swedee 共回答了16个问题
swedee 共回答了16个问题 |采纳率100%这个要看不同的反应的,如果是零级反应且反应物只有一个的,那么加入a的反应达到平衡所需的时间更多
如果是一级反应且反应物只有一个的,那么加入反应达到平衡所需的时间相等1年前查看全部
- 已知T K和P kPa时,在容积为V L的密闭容器中充有1 mol A和1 mol B,保持恒温恒压,使反应: A(g)
已知T K和P kPa时,在容积为V L的密闭容器中充有1 mol A和1 mol B,保持恒温恒压,使反应: A(g)+B(g)
 C(g)达到平衡时, C的体积分数为40%。试完成下列有关问题:
C(g)达到平衡时, C的体积分数为40%。试完成下列有关问题:
(1)若使温度和压强在上述条件下恒定不变,在密闭容器中充入2 mol A和2 mol B,则反应达到平衡时,容器的体积为________,C的体积分数为________。
(2)若另选一容积固定不变的密闭容器,仍然控制温度为T K,使1 mol A和1 mol B反应达到平衡状态时, C的体积分数仍然为40%,则该密闭容器的体积为________。 cd_home1年前1
cd_home1年前1 -
 有意闯入 共回答了16个问题
有意闯入 共回答了16个问题 |采纳率93.8%1年前查看全部
- 化学中有关可逆反应中恒温恒容和恒温恒压有什么不同?
化学中有关可逆反应中恒温恒容和恒温恒压有什么不同?
如题所示 像转化率 平衡移动和等效平衡中这两个因素有什么不同影响 最好列出具体例子 如果还有别的问题的异同涉及这两个因素也请列出来 如果说得好 我会追分的 我有120分 但不要把百科上的复制过来
二楼的大哥阿 你说的那些不同是学过初中的都能从字面上理解 fenylt1年前1
fenylt1年前1 -
 miaomiao8392 共回答了12个问题
miaomiao8392 共回答了12个问题 |采纳率91.7%类别 恒温恒容 恒温恒压
相同点:温度一定
不同点:体积一定,压强可能改变 压强一定,体积可能改变
对平衡的影响:
CO +H2O(g) = CO2 + H2 压强改变,平衡不移动 体积改变,平衡不移动(因为△=0)
N2 + 3 H2 = 2NH3 加压,平衡向右移动,转化率增加 体积增加,平衡向左移动,转化率降低
(因为该反应△>0)
△是指气体反应物前面的系数之和 减去 气体生成物前面系数之和,如△>0是指1+3—2>01年前查看全部
- 在恒温恒压条件下,在密闭容器中发生反应
在恒温恒压条件下,在密闭容器中发生反应
在恒温恒压条件下,在密闭的容器中发生反应,3H2+N2 2NH3,到达平衡,测得N2,H2,NH3分别为5mol,2mol,2mol,容器的体积为10L,现在向容器中通入1.8molN2,平衡将 A.向右移动 B.向左移动 C.不移动 D.无法判断
答案是选择B.具体计算的那个老师上课讲过了,老师上课还讲了一个快捷的方法,说通入N2了后,具体我忘记了,好象是说只看氢气和氨气,氢气的系数大则浓度降低的倍率大,则平衡逆向移动.后面这个方法是什么?没明白.还有不能单独看加入N2后反应物浓度增大则平衡正向移动吗?为什么这样做是错误的呢?
希望有人能解释下! haiming7121年前1
haiming7121年前1 -
 popyu 共回答了16个问题
popyu 共回答了16个问题 |采纳率81.3%恒压反应加入N2后体积增大,所以并不能简单地理解为反应物浓度增大
一个反应的反应物摩尔比等于化学计量数之比时,平衡含量最大,对于合成氨反应来说,当氢气比氮气(摩尔比)等于3的时候平衡正向移动到最大值,也就是说,任何使摩尔比靠近3的操作都使平衡右移,反之左移.
题中氢气比氮气=2/5,加入1.8的氮气后比值是2/6.8,比原来更远离3,平衡左移1年前查看全部
- C6H6气体经过恒温恒压液化成C6H6液体,热力学能U的变化量为什么不等于0?
C6H6气体经过恒温恒压液化成C6H6液体,热力学能U的变化量为什么不等于0?
热力学能不是仅仅是温度T的函数吗?如果是恒温的话,那U应该是不变的才对啊, 愁为子1年前2
愁为子1年前2 -
 吃葡萄的猫咪 共回答了21个问题
吃葡萄的猫咪 共回答了21个问题 |采纳率90.5%"热力学能仅仅是温度T的函数"这是指同一相态而言,也就是没有相变的情况,相变是一个吸热或放热的过程,必然伴随热力学能的变化,所以得相变后,热力学能是发生变化的1年前查看全部
- 惰性气体对化学反应速率的影响对于气体反应体系,恒温恒压条件下,加入惰性气体相当于增大反应体系的体积,减小反应物的浓度,速
惰性气体对化学反应速率的影响
对于气体反应体系,恒温恒压条件下,加入惰性气体相当于增大反应体系的体积,减小反应物的浓度,速率减小.
恒温恒容时,充入稀有气体,尽管压强增大了,但是参加反应的各物质的浓度是不变的,所以这种压强的改变是无效的,平衡不会移动,反应速率不变
解释一下为什么恒温恒压条件下,加入惰性气体相当于增大反应体系的体积?
为什么尽管压强增大了,但是参加反应的各物质的浓度是不变的,所以这种压强的改变是无效的? 一名高职老师1年前4
一名高职老师1年前4 -
 chjxm 共回答了19个问题
chjxm 共回答了19个问题 |采纳率94.7%在温度和压强一定的情况下,气体的增加会相应的增加体积,就像催泡泡一样,外界压强和温度没有变化,吹进去的气体会使泡泡体积变大.很好理解
当温度和容积固定的时候,增加气体的时候,多余的气体会导致压强增加,但多余的气体充斥在反应物中间,并没有使反应物的浓度增加,所以这种压强不会改变反应速率,因此是无效的.1年前查看全部
- 在恒温恒压的条件下,向密闭容器中充入4molA2molB,发生如下反应2Ag+Bg=2Cg,若反应平衡后生成1,6mol
在恒温恒压的条件下,向密闭容器中充入4molA2molB,发生如下反应2Ag+Bg=2Cg,若反应平衡后生成1,6molC若反应平衡后加入等物质的量的A.C后,的转化率怎么变化
 junjun00051年前1
junjun00051年前1 -
 mofir 共回答了23个问题
mofir 共回答了23个问题 |采纳率91.3%2A + B = 2C
起始: 4 2 0
转化: 1.6 0.8 1.6
平衡: 2.4 1.2 1.6
K=1.6^2/(2.4^2*1.2)=0.37
假设A和C都增加1摩尔
2A + B = 2C
起始: 3.4 1.2 2.6
转化: 2X X 2X
平衡: 3.4-2X 1.2-X 2.6+2X
K=(2.6+2X)^2/[(3.4-2X)^2(1.2-X)]=0.37
解出X, 如果是正值,平衡正向移动,如果是负值,平衡逆向移动.1年前查看全部
- 判断化学平衡的标志 为什么分了 等体反应和非等体反应?这两部分里又分了 恒温恒压 和恒温恒容?这些因素和化学平衡有什么关
判断化学平衡的标志 为什么分了 等体反应和非等体反应?这两部分里又分了 恒温恒压 和恒温恒容?这些因素和化学平衡有什么关系?
麻烦您都说清楚一点 何岂哉1年前1
何岂哉1年前1 -
 lovelypig 共回答了17个问题
lovelypig 共回答了17个问题 |采纳率82.4%克拉伯龙方程式Pv=nRT(P代表压强 V代表体积 N代表物质的量 R代表一个常数 T代表绝对温度)
恒温恒压时T和P不变 R为常数 当V变大 则N变大 浓度变大 平衡移动
恒温恒容时T和V不变 R为常数 当P变大 则N变大 浓度变大 平衡移动
还有 增大P有很多途径 要仔细考虑1年前查看全部
- 可逆反应N2+3H2==2NH3达平衡后,恒温恒压冲入氨气平衡移动吗
 碎梦之舟1年前1
碎梦之舟1年前1 -
 065668 共回答了16个问题
065668 共回答了16个问题 |采纳率68.8%充入氨气相当于增加了氨气浓度,减少了氢气和氮气的浓度
所以平衡逆向移动.
相比体积变化,浓度变化更加明显1年前查看全部
- 化学平衡的移动2)在恒温恒压,一个化学反应达到平衡,在加入一样反应物,(有2种反应物),平衡如何移动?加入了一种物质,它
化学平衡的移动
2)在恒温恒压,一个化学反应达到平衡,在加入一样反应物,(有2种反应物),平衡如何移动?
加入了一种物质,它的浓度和容积都变了, 甄丽娜1年前2
甄丽娜1年前2 -
 bianselong0303 共回答了15个问题
bianselong0303 共回答了15个问题 |采纳率80%对于增大体积平衡右移的反应或增大体积平衡不移动的反应(即正反应气体分子数增多或不变的反应),增加一个反应物平衡就必然右移.
但对于气体分子数减少的反应,就不一定了.以N2+3H22NH3为例,假设充入N2让N2分子数变成原来的K倍(K>1),N2、H2、NH3的原分子数分别为n1、n2、n3,总压为p,则N2分压从p*n1/(n1+n2+n3)变为p*Kn1/(Kn1+n2+n3),H2分压从p*n2/(n1+n2+n3)变为p*n2/(Kn1+n2+n3),NH3从p*n3/(n1+n2+n3)变为p*n3/(Kn1+n2+n3).原来达到平衡,平衡常数k={(p*n3)/[(n1+n2+n3)p0)]^2}/({p*n1/[(n1+n2+n3)p0]}{p*n2/[(n1+n2+n3)p0)]^3}),同理可写出充N2后的浓度积q表达式,q={(p*n3)/[(Kn1+n2+n3)p0)]^2}/({p*Kn1/[(Kn1+n2+n3)p0]}{p*n2/[(Kn1+n2+n3)p0)]^3}),两式相除,k/q=(Kn1+n2+n3)^2/[K(n1+n2+n3)^2],此数是否大于1是不一定的,即不知平衡怎么移动,要根据n1、n2、n3的具体数字来定.
表达式比较复杂,看不清楚可以Hi.1年前查看全部
- 按物质的量1:3的N2和H2进行合成氨反应,已达到平衡状态.此时,恒温恒压,充入N2会发生什么
 孙约瀚1年前2
孙约瀚1年前2 -
 阳光好天气 共回答了10个问题
阳光好天气 共回答了10个问题 |采纳率90%楼上说明的是实际生产情况,楼主问的是一个关于反应平衡的问题.
若在假设的情况下充入氮气,若密闭容器内整体压力上升则从反应平衡来看,增加了氮气的分压,会提高氢的利用率,氨的含量也会有所上升.若按照压力不变考虑充入氮气,则会造成反应向左移动,氨含量下降.1年前查看全部
- 在一定温度和压强下,向体积为VL的密闭容器中,充入1molA和1molB,保持恒温恒压使反应:A(g)+ B(g) C(
在一定温度和压强下,向体积为VL的密闭容器中,充入1molA和1molB,保持恒温恒压使反应:A(g)+ B(g) C(g)达到平衡时,C的体积分数为40%.
怎么算达到平衡时的容器体积 wokin1年前0
wokin1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知N 2 (g)+3H 2 (g) 2NH 3 (g);Δ H =-92.4kJ/mol。在一恒温恒压的密闭容器里充入
已知N 2 (g)+3H 2 (g)
 2NH 3 (g);Δ H =-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol N 2 和8mol H 2 达到平衡时生成1mol NH 3 。现在相同条件下的同一容器中充入 x mol N 2 , y mol H 2 和2mol NH 3 ,达到平衡时,NH 3 的质量分数与原来相同,且放出热量46.2kJ。则 x 、 y 的值为
2NH 3 (g);Δ H =-92.4kJ/mol。在一恒温恒压的密闭容器里充入2mol N 2 和8mol H 2 达到平衡时生成1mol NH 3 。现在相同条件下的同一容器中充入 x mol N 2 , y mol H 2 和2mol NH 3 ,达到平衡时,NH 3 的质量分数与原来相同,且放出热量46.2kJ。则 x 、 y 的值为A.5,21 B.3,13 C.2,8 D.1.5,6.5  油桐1年前1
油桐1年前1 -
 冷文天成 共回答了12个问题
冷文天成 共回答了12个问题 |采纳率91.7%1年前查看全部
- [紧急求助]等效平衡中的恒温恒容、恒温恒压分别针对哪些情况?
 wyxzbt_1471年前1
wyxzbt_1471年前1 -
 浪_迹天ya 共回答了13个问题
浪_迹天ya 共回答了13个问题 |采纳率100%恒温恒容是指容器的总体积不变,这样在做题时要考虑气体物质的量增加或减少的问题,平衡向体积减少的方向移动;而恒温恒压是指总压强不变,这样容器的体积就会随气体分子物质的量的增大而增大(减小而减小).1年前查看全部
- N2+3H2=可逆=2NH3(恒温恒压),随着c(Ar)的增加,H2的转化率怎么变?
 zz无缰1年前2
zz无缰1年前2 -
 wuyiqun12 共回答了10个问题
wuyiqun12 共回答了10个问题 |采纳率80%因为体系是恒温恒压,所以随着c(Ar)的增加体系体积变大平衡向气体系数之和增大的方向移动,也就是向逆向移动,所以H2的转化率应该变小.1年前查看全部
- 在一个可逆反应中,恒温恒压条件下,
在一个可逆反应中,恒温恒压条件下,
增加反应物相当于增加压强,应该向气体体积减小方向移动,有时就会与向正方向移动矛盾,这是为什么呢? peterqzl1年前2
peterqzl1年前2 -
 牛B了 共回答了18个问题
牛B了 共回答了18个问题 |采纳率94.4%在恒压的情况下,增加反应物,容器的体积会扩大,各物质的浓度均会发生变化,但由于增加反应物,所以反应物的浓度相对生成物来说减少得少一些,所以反应只能向正反应方向移动.
你也应该学到了平衡常数,还可以用Qc与K的相对大小来判断反应只能向正向移动.1年前查看全部
- 已知N2+3H2=2NH3是可逆反应,正反应放热,将等物质的量的两反应物充入一密闭容器中,在适当催化剂和恒温恒压条件下反
已知N2+3H2=2NH3是可逆反应,正反应放热,将等物质的量的两反应物充入一密闭容器中,在适当催化剂和恒温恒压条件下反应.则...反应过程中,N2的体积分数始终为50%.
为什么?答案说是对的,我不知道为什么对. woshilql6701年前1
woshilql6701年前1 -
 花颜月 共回答了28个问题
花颜月 共回答了28个问题 |采纳率89.3%当然是对的拉,就算下就知道拉
设H2和N2都是XMOL
所以一开始时N2的体积分数为X/2X=0.5(体积比等于物量比,这里不解析了.)
而设N2减少了YMOL,所以H2减少了3YMOL,而NH3增加了2YMOL
所以这时候
N2为X-YMOL
H2为X-3YMOL
NH2为2YMOL
所以总的物量是X-Y+X-3Y+2Y=2(X-Y)MOL
而N2为X-YMOL,所以这时候的体积分数为
(X-Y)/2(X-Y)=0.5
所以是一样D1年前查看全部
- 1.相同条件下气体的密度相同?2.在某温度时,一定量的元素A的氢化物AH3,在恒温恒压的密封容器中完全分解为两种气态单质
1.相同条件下气体的密度相同?
2.在某温度时,一定量的元素A的氢化物AH3,在恒温恒压的密封容器中完全分解为两种气态单质,此时容器的体积变为原来的7/4,则A单质的分子式为( ),AH3分解反应的化学方程式为( )
3.化学方程式中的“加热”,应写成文字“加热”还是“△”?上了高中不少方程式的“加热”有时候写成了文字,有时候写成△,初中都是些△,为什么不一样?
4.一般实验都要使用饱和溶液?为什么?
5. luo24899211年前7
luo24899211年前7 -
 chen3512786 共回答了13个问题
chen3512786 共回答了13个问题 |采纳率92.3%1.想想也知道不对,应该是“相同温度压强体积,气体分子数相同,密度与相对分子质量成正比”
2.P4,4PH3=P4+6H2
3.加热跟△没有区别,有可能是教材版本的问题,你也可以随便写
4.除非个别试验,一般我们都用稀溶液,饱和溶液容易结晶析出从而获得不想要的效果,普通的化学反应稀溶液就够了.1年前查看全部
- 在恒温恒压条件下,加入N2和H2,平衡后NH3的体积分数的变化
在恒温恒压条件下,加入N2和H2,平衡后NH3的体积分数的变化
N2+3H2=(可逆符号)NH3
在恒温恒压条件下,加入N2和H2
为什么如果是N2:H2=1:3,那无论加生成物,还是加反应物(N2:H2=1:3),浓度、体积分数都不变?
如果是N2:H2不等于1:3,那无论加生成物,还是加反应物,浓度、体积分数都改变?
不不不,我感觉好像我题目表达有些偏差了,
我通俗地说一下,就是一开始什么都没有,加入1mol的N2和3mol 的H2,等到反应平衡后,在恒温恒压的条件下,再加入NH3,则再次平衡时NH3的体积分数是怎么变的? yourstaozi1年前1
yourstaozi1年前1 -
 empemp 共回答了20个问题
empemp 共回答了20个问题 |采纳率95%1.在恒温恒压条件下,如果是N2:H2=1:3,那无论加生成物,还是加反应物(N2:H2=1:3),折算成一边(反应物)都成比例,都是N2:H2=1:3,即等效平衡,所以浓度、体积分数都不变.2.如果是N2:H2不等于1:3,那无论加生成物...1年前查看全部
- 对于一个前后体积分数不变的反应,恒温恒压加入稀有气体平衡会怎么移动?
 落寞风情1年前1
落寞风情1年前1 -
 王雅楠 共回答了20个问题
王雅楠 共回答了20个问题 |采纳率90%平衡不变,当物质的量不变(没有加入反应物或生成物)时,因为是气体且体积分数不变,所以物质的量浓度不变,即平衡不变1年前查看全部
- 为什么体系中恒温恒压充入氮气 体积增大 浓度减小 平衡会向左移动呢?针对N2+3H2——2NH3
为什么体系中恒温恒压充入氮气 体积增大 浓度减小 平衡会向左移动呢?针对N2+3H2——2NH3
打错了,不是充的氮气,是惰性气体 氦气 心有辰宇1年前6
心有辰宇1年前6 -
 趴趴六号 共回答了13个问题
趴趴六号 共回答了13个问题 |采纳率84.6%速率、平衡题中,凡是涉及到气体的反应,一定要注意前提----恒容、恒压
恒容,就是容器不会变化,体积不变
恒压,则是压强不变,所以容器是带活塞的,可以前后移动
现在是恒压,充入He气,所以活塞会向外动,对原来的气体来讲,相当于是增大体积,减小压强,所以平衡向着气体体积增大的方向,即逆反应方向移动1年前查看全部
- 为什么恒温恒容的容器中加惰性气体,平衡不移动?而恒温恒压就有可能改变.
为什么恒温恒容的容器中加惰性气体,平衡不移动?而恒温恒压就有可能改变.
压强增大,浓度自然应该增大呀? heheii1年前1
heheii1年前1 -
 nn招展 共回答了19个问题
nn招展 共回答了19个问题 |采纳率94.7%恒温恒容条件下加惰性气体 反应物的物质的量没变 总体积没变 物质的量浓度没变 所以平衡不移动 恒温恒压条件下加惰性气体 要想保持恒压 体积必然增大 物质的量浓度改变 平衡就移动了1年前查看全部
- 已知恒温恒压 X+Y=3Z 平衡后通入氩气,请问此时的正反应速率与你反应速率大小比较 说明理由
 jjz08011年前1
jjz08011年前1 -
 天堂与风 共回答了10个问题
天堂与风 共回答了10个问题 |采纳率90%正反应速率大于逆反应速率,平衡正向移动.
通入氩气后,体积增大,浓度下降.1年前查看全部
- 甲烷燃烧反应 恒温恒压 熵变(>0
 qzlzt1231年前1
qzlzt1231年前1 -
 朴ww欢 共回答了25个问题
朴ww欢 共回答了25个问题 |采纳率96%熵变小于零,气体体积减小嘛,熵值气体是大于液体的1年前查看全部
- 化学中封闭体系指的是恒温恒压还是恒温恒容?
 冰峰图腾1年前2
冰峰图腾1年前2 -
 股神的眼泪 共回答了19个问题
股神的眼泪 共回答了19个问题 |采纳率78.9%恒温恒压指的是:体系总的压强保持恒定.气体的总浓度是恒定的.
恒温恒容指的是:反应的总体积不发生变化.这时气体的总压强是可能变化的.如果是等系数的反应,则总压强保持恒定.请设置“好评”,)1年前查看全部
- 恒温恒压于恒温恒容的等效平衡恒温恒容条件下 加入3mol氨气所达的平衡后氨的体积分数为m 为什么恒温恒压条件下加入的氨气
恒温恒压于恒温恒容的等效平衡
恒温恒容条件下 加入3mol氨气所达的平衡后氨的体积分数为m 为什么恒温恒压条件下加入的氨气只要大于0mol达平衡后氨的体积分数还是m 恒容条件下的反应进行时压强应该是在增大氨的体积分数应该比恒容条件下的大阿 loll00941年前1
loll00941年前1 -
 sdzbbslh 共回答了23个问题
sdzbbslh 共回答了23个问题 |采纳率100%既然题中堤到恒容那么压强就是不改变的,怎么能增大呢?1年前查看全部
- 化学平衡与转化率的 问题1:在 恒温恒压 下,反应物只有一种.加入反应物 后,(气体) 书上 说等效于 增大了 压强,认
化学平衡与转化率的 问题
1:在 恒温恒压 下,反应物只有一种.加入反应物 后,(气体) 书上 说等效于 增大了 压强,认为是 通过增大压强 来 判断 转化率 的变化 ,请问这个 是怎么 来的? 如果 增大了 反应物 ,他的浓度 也上升 ,这样 正反应 加快,如果 正反应是 体积增大的话 ,逆反应 又增强,到底 平衡向哪边 移动?为什么 仅仅 看 压强 ?(书上的 证明 是 在另个 容器建立等效平衡啥的.没 理解,)
2:在 反应物是多种时,增大一个反应物 量,他的 转化 率 下降,其他 反应物的 转化率上升,那个上升能理解,但是那个 转化率下降应该怎么理解啊?有证明吗? 南极森林1年前3
南极森林1年前3 -
 senlin1996 共回答了17个问题
senlin1996 共回答了17个问题 |采纳率88.2%这是等效平衡问题,我在百度知道回答了好几次,结果都是因为图片要审核,忙了半天不显示,直接到我网站(hlghx后缀是.com)去看吧,在原创论文栏目下---何罗庚神奇教学模板之等效平衡1年前查看全部
- 填空:用热力学函数符号表示下列状态的热力学特征,恒温恒压条件下,放热反应的(1)小于零;
填空:用热力学函数符号表示下列状态的热力学特征,恒温恒压条件下,放热反应的(1)小于零;
填空:用热力学函数符号表示下列状态的热力学特征,恒温恒压条件下,放热反应的( )小于零;标准状态,298.15K时,稳定单质的( )和( )等于零;在0K时,纯净完美晶体的( )等于零;自发进行的反应( )小于零. 坠天羽翼1年前1
坠天羽翼1年前1 -
 Sweetpea 共回答了22个问题
Sweetpea 共回答了22个问题 |采纳率95.5%第一个是△H,第二个是标准摩尔焓变,第三个是标准摩尔熵,第四个是△G.1年前查看全部
- 一个化学反应生成物是1mol气体,生成了2mol气体,在恒温恒压条件下通入惰性气体,为什麽相当于减压?
 bangduozhen1年前2
bangduozhen1年前2 -
 ranse9999 共回答了18个问题
ranse9999 共回答了18个问题 |采纳率94.4%这是一个分压的概念,可以用浓度来理当总溶液增加了(加水),某溶质的质量分数会减小.加入其它物质气体,总体积增加了,分压就减小了.1年前查看全部
- 在恒温恒压条件下,向可变的密闭容器中充入3LA和2LB发生如下反应3A(g)+2B(g)⇌xC(g)+yD(g),达到平
在恒温恒压条件下,向可变的密闭容器中充入3LA和2LB发生如下反应3A(g)+2B(g)⇌xC(g)+yD(g),达到平衡时C的体积分数为m%.若维持温度不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%.则x、y的值分别为( )
A.x=3、y=1
B.x=4、y=1
C.x=5、y=1
D.x=2、y=3 butterflyinpair1年前1
butterflyinpair1年前1 -
 Urbino 共回答了17个问题
Urbino 共回答了17个问题 |采纳率82.4%解题思路:恒温恒压下,向容积可变的密闭容器中,
状态Ⅰ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始量 3 2
状态Ⅱ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始 1.2 0.8 3 0.6
两种状态下到平衡时混合气体中D的体积分数均为W%,
则二者为等效平衡状态,利用极限转化为起始量时,A、B的物质的量之比为3:2,以此来解答.由题意可知恒温恒压下,向容积可变的密闭容器中,
状态Ⅰ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始量 3 2
状态Ⅱ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始 0.6 0.4 4 0.8
两种状态下到平衡时混合气体中D的体积分数均为W%,
则二者为等效平衡状态,利用极限转化为起始量时,A、B的物质的量之比为3:2,
所以状态Ⅱ:3A(g)+2B(g)⇌xC(g)+yD(g)
起始 0.6+[1.2/x] 0.4+[1.6/y]
(0.6+[1.2/x] ):(0.4+[1.6/y])=3:2,
解得x:y=5:1,
显然只有D中x=5、y=1符合,
故选:C.点评:
本题考点: 等效平衡.
考点点评: 本题考查化学平衡的计算及等效平衡,明确两种状态达到平衡时混合气体中D的体积分数均为W%,将第二种状态利用极限转化为起始量成正比即可解答,题目难度中等.1年前查看全部
- 在恒温恒压条件下,在密闭的容器中发生反应,3H2+N2⇌2NH3,到达平衡时,测得N2、H2、NH3分别为5mol、2m
在恒温恒压条件下,在密闭的容器中发生反应,3H2+N2⇌2NH3,到达平衡时,测得N2、H2、NH3分别为5mol、2mol、2mol,容器的体积为10L,现往容器中再通入N21.8mol,平衡将( )
A.向右移动
B.向左移动
C.不移动
D.无法判断 口天一个金1年前1
口天一个金1年前1 -
 yayawu70 共回答了18个问题
yayawu70 共回答了18个问题 |采纳率83.3%解题思路:先依据题干条件计算 平衡浓度,结合平衡常数概念计算,加入氮气后加水此时的浓度商和平衡常数比较判断反应进行的方向;在恒温恒压条件下,在密闭的容器中发生反应,3H2+N2⇌2NH3,到达平衡时,测得N2、H2、NH3分别为5mol、2mol、2mol,容器的体积为10L,此时平衡常数K=
0.22
0.5×0.23=10,现往容器中再通入N21.8mol,恒压容器中气体物质的量之比等于体积之比,9:10=(9+1.8):V,此时气体体积V=12L,此时Q=
(
2
12)2
6.8
12×(
2
12)3=10.6>K=10平衡将逆向进行;
故选B.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了化学平衡常数计算和影响平衡的因素,掌握基础注意恒压容器体积分数变化分析判断,题目难度中等.1年前查看全部
- 2 已知在一定温度(t)压强下,在容积为V L的密闭容器内充有1molA和1molB,保持恒温恒压,使反应:A(g)
2 已知在一定温度(t)压强下,在容积为V L的密闭容器内充有1molA和1molB,保持恒温恒压,使反应:A(g)
2 已知在一定温度(t)压强下,在容积为V L的密闭容器内充有1molA和1molB,保持恒温恒压,使反应:
A(g)+B(g)===C(g),达到平衡是,C的体积分数为40%,试回答:
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充有2molA和2molB则反应达到平衡时,则反应达到平衡时容器的容积为_____.
(1)若另选一容积固定不变的密闭容器,仍控制温度相同不变,使1molA与1molB反应达到平衡时,C的体积分数仍是40%,则该容器的容积为_____. dxz1982981年前1
dxz1982981年前1 -
 rangany 共回答了21个问题
rangany 共回答了21个问题 |采纳率85.7%(1)2V(温度和压强相同,转换率相同)
(2)V(转换率和温度相同,压强相同)1年前查看全部
- 恒温恒容两边气体系数和相等与不等的等效平衡,到底各自等的是什么?恒温恒压两边气体系数和相等与不等的等效平衡,各自等的又是
恒温恒容两边气体系数和相等与不等的等效平衡,到底各自等的是什么?恒温恒压两边气体系数和相等与不等的等效平衡,各自等的又是什么?
 k87541年前1
k87541年前1 -
 梦的儿子 共回答了23个问题
梦的儿子 共回答了23个问题 |采纳率100%等效平衡的等指的都是各物质的体积分数,也就是各物质在体系中所占比例相等,不是绝对量.当然绝对量相等也是等效平衡,那个叫全等平衡.懂啦!1年前查看全部
- 在恒温恒压条件下,ΔH(焓变)可以表示过程的热力学能变 那可逆反应中吸放热不到ΔH 这不是和定义
在恒温恒压条件下,ΔH(焓变)可以表示过程的热力学能变 那可逆反应中吸放热不到ΔH 这不是和定义
在恒温恒压条件下,ΔH(焓变)可以表示过程的热力学能变 那可逆反应中吸放热不到ΔH 这不是和定义不符了吗? 特种陶瓷1年前2
特种陶瓷1年前2 -
 gdlyj 共回答了16个问题
gdlyj 共回答了16个问题 |采纳率93.8%怎么类?可逆反应都伴有能量的消耗肯定不到△H啊1年前查看全部
- 等温等压和恒温恒压是不是一个意思?
等温等压和恒温恒压是不是一个意思?
原电池在等温等压可逆的条件下放电时,其在过程中与环境交换的热量为什么?请各位化学学的比较好的给我一个答案吧,随便说说解释
现在我的分不够, 孟老大1年前1
孟老大1年前1 -
 sallylzu 共回答了20个问题
sallylzu 共回答了20个问题 |采纳率95%不是一个意思.等温等压是相对于其他容器而言的,恒温恒压是指同一个容器里面的压力和温度在不同时间都不变1年前查看全部
- 关于化学平衡的一个小小的疑惑.①.恒温恒压条件下,2SO2+O2=2SO3这个反应已经达到平衡以后,往体系中加入同温度的
关于化学平衡的一个小小的疑惑.
①.恒温恒压条件下,2SO2+O2=2SO3这个反应已经达到平衡以后,往体系中加入同温度的气态SO3,请问化学平衡如何移动,反应如何进行?
另外想问一下,存在反应一直逆向进行,但是结果最后平衡正移的吗? youbing9991年前1
youbing9991年前1 -
 我爱米妮 共回答了19个问题
我爱米妮 共回答了19个问题 |采纳率89.5%先回答你的一个问题:
加入SO3后,由于SO3量的增加,压强的增加,使得反应向相反的方向移动,也就是消耗SO3,即:逆反应方向
其实在化学平衡的题中,只要始终牢记:化学平衡的原则就是外因导致增加或减少,内因往相反的方向移动.1年前查看全部
大家在问
- 1凡牧民者,必加其疾 翻译
- 2简便计算 要过程不要直接等于 7÷1.25 16÷2.5
- 3表示做事不考虑周到 干了再说时用
- 4阅读下面两段文言文,完成后面题目。
- 56.5g锌粒与100稀盐酸恰好完全反应生成硫酸锌和氢气,求生成氢气的质量,求参加反应的硫酸的质量,求稀硫酸溶液中溶质的质
- 6串雅的串是什么意思 求高手解答
- 76月22日下列各地正午太阳高度未达到最大值的是?
- 8补写出下列名篇名句中的空缺部分。
- 9梁标注中KL后面加个Y是什么意思?
- 10英语阅读 Tommy hated school and was always looking for excuse no
- 11in和for的在表达“表达一段时间”这一概念的区别
- 12抓知了 作文
- 13表示想要做某事的英语短语
- 14一枚1元硬币平放在水平桌面上压强大约为多少?
- 15物理如图所示是小型建筑工地上使用的"罐笼式"提升机,用它能将放在罐笼A中的建筑材