在线路板(PCB)的一大块料上,每个部件与部件的间隔距离后面加的TYP是指?
 lhkey2022-10-04 11:39:541条回答
lhkey2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 哥布林martin 共回答了8个问题
哥布林martin 共回答了8个问题 |采纳率100%- TYP是TYPICAL的缩写,意为典型、代表、象征,这是英制图纸上常见的标注方式,与GB"X-X.XX"或"X*X.XX"相当.是指在一张图纸上会有多个尺寸或位置关系相同的特征,比如说零件上打几个DIA 8.00的孔,此时只要表示出其中一个的尺寸后缀TYP即可,但要说明的是其他的孔径大小要与其略有区别,否则看图人可有的麻烦了.
或者说是相同的图元的个数.如Φ30 typ 5,表示有5个这样的图元. - 1年前
相关推荐
- 氧化还原反应在生产生活和科学研究中有重要的用途,电子工业中常用FeCl3溶液腐蚀线路板.小明对某种印刷线路板废液成分进行
氧化还原反应在生产生活和科学研究中有重要的用途,电子工业中常用FeCl3溶液腐蚀线路板.小明对某种印刷线路板废液成分进行如下探究.1 取少量废液加KSCN溶液显红色.2 取10ml废液加入足量的AgNO3溶液析出沉淀12.915g 3 再取10ml废液加铁片充分反应,测得铁片质量没变,再加KSCN不变色.问废液中正3价铁离子和正2价铜离子物资的量比为多少(郑州市2013-2014年高一期末化学测试题)
 杀出一片天1年前1
杀出一片天1年前1 -
 akguozongwei 共回答了25个问题
akguozongwei 共回答了25个问题 |采纳率88%2:7
涉及到的反应方程式如下:
Fe+2FeCl3=3FeCl2
Fe+CuCl2=Cu+FeCl2
由测得测得铁片质量不变,可得参与反应的铁的质量与析出的铜的质量相等
假设铜离子物质的量为amol,由以上反应方程式得
参与正3价铁离子反应的单质Fe的物质的量为(64a-56a)÷56=a/7mol
因此正3价铁离子物质的量为2a/7mol
所以正3价铁离子和正2价铜离子物质的量比为2:71年前查看全部
- 跪求节能灯根据线路板画电子线路图的绝妙方法
跪求节能灯根据线路板画电子线路图的绝妙方法
本人需了解一下节能灯电路,曾根据其线路板画电路图多次,因线路交叉,短路,零件方向弄错而扰乱思绪,特请高手指点画图决窍,小弟先行谢过! yuhan050081年前1
yuhan050081年前1 -
 zywxa963 共回答了20个问题
zywxa963 共回答了20个问题 |采纳率85%这哪有什么绝妙方法,如果需要理解原理,就看一下它的本质电路“自激式半桥开关电路”或看一下节能灯的电路原理,每个厂家的都可能不一样,但是也差不了很多的,1年前查看全部
- 如图所示为学校航模兴趣小组的同学正在练习用电烙铁在线路板上进行焊接的情形,有关这一情形的说法中正确的是 [ &
如图所示为学校航模兴趣小组的同学正在练习用电烙铁在线路板上进行焊接的情形,有关这一情形的说法中正确的是  [ ]
[ ]A.焊锡主要发生的物态变化是升华和凝华
B.焊锡具有熔点高、易导电的特点
C.为防止触电,手应该拿在电烙铁的绝缘手柄处
D.电烙铁工作是将电能转化为机械能 梦里有你8807701年前1
梦里有你8807701年前1 -
 大nn熊 共回答了17个问题
大nn熊 共回答了17个问题 |采纳率94.1%C1年前查看全部
- 电视机线路板上有什么金属,本人不懂请高手帮忙分析
 值得19781年前1
值得19781年前1 -
 三福公寓 共回答了15个问题
三福公寓 共回答了15个问题 |采纳率93.3%楼上正解,一般电路板为强化导电性都是有金的,不过很少1年前查看全部
- 在线路板上有边长为1厘米的方格,在方格的交叉点上有2个结点(图一),要求用一根导线将各结点由A到B连接起来,导线长不得超
在线路板上有边长为1厘米的方格,在方格的交叉点上有2个结点(图一),要求用一根导线将各结点由A到B连接起来,导线长不得超过19厘米,图二和图三为两种连法,但导线长度都超过了规定,你又办法连好吗?请在图四中画出图形.
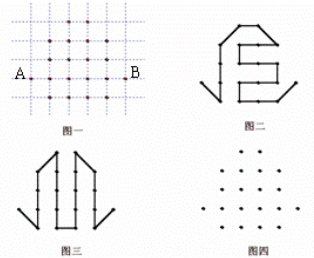
 liaojp1年前1
liaojp1年前1 -
 喵喵1980 共回答了17个问题
喵喵1980 共回答了17个问题 |采纳率88.2%1年前查看全部
- 电子符号识别?我现在在学修电子线路板!我之前就懂一点点!可实践了才知道自己的道行太浅了!想请叫前辈!这些符号代表的意思!
电子符号识别?
我现在在学修电子线路板!我之前就懂一点点!可实践了才知道自己的道行太浅了!想请叫前辈!这些符号代表的意思!GND Vcc ARP1 J TCK TDD TMS TIM DUT X1 Q1 LN AREF Vh WD JBQ G5RL SV2 E9 U1 P1 OSC1 B1 IRF(G D S) IRF(9540) TIP122 LM358 TLP521-4 5PIN OUTSIDE INSIDE POWER TL7726CN G6S_2 IMP813 CPA TLC1543CN T4HCOV W78E58 26PIN DS122OY T4HC373 TLC7226CN 晚辈是个初级电工,可现在的工作需要这个,在下感激不尽! liu48224611年前1
liu48224611年前1 -
 啊问 共回答了20个问题
啊问 共回答了20个问题 |采纳率100%引脚名称,IC型号1年前查看全部
- 线路板上的ACN,ACL代表交流电的什么?
 王道王道1年前1
王道王道1年前1 -
 korla69k 共回答了20个问题
korla69k 共回答了20个问题 |采纳率95%代表交流电的两个接线端,L----火线、N----零线,一般要求不严格,可以互换的,要求严格的话就要先判断火线零线了1年前查看全部
- (2014•邯郸一模)为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%
(2014•邯郸一模)为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
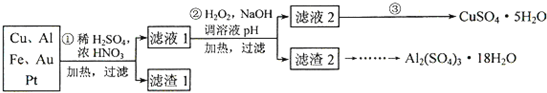
(1)第①步Cu与混酸反应的离子方程式为Cu+4H++2NO3-
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-△ .
3Cu2++2NO↑+4H2O△ .Cu+4H++2NO3-.得到滤渣1的主要成分为______.
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-△ .
3Cu2++2NO↑+4H2O△ .
(2)第②步中加入H2O2的作用是______,使用H2O2的优点是______;调溶液pH的目的是______.
(3)简述第③步由滤液2得到CuSO4•5H2O的方法是______.
(4)由滤渣2制取Al2(SO4)3•18H2O,设计了以下三种方案: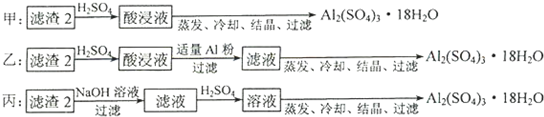
上述三种方案中,______方案不可行,原因是______;从原子利用率角度考虑,______方案更合理.
(5)用滴定法测定CuSO4•5H2O含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用
c mol/L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:
Cu2++H2Y2-→CuY2-+2H+.写出计算CuSO4•5H2O质量分数的表达式ω=
×100%c×b×10-3×250×5 a .
×100%c×b×10-3×250×5 a  幸福到来1年前1
幸福到来1年前1 -
 草晕的aa 共回答了17个问题
草晕的aa 共回答了17个问题 |采纳率100%解题思路:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(5)依据滴定实验和反应离子方程式计算得到.(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:Cu+4H++2NO3-
△
.
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
△
.
3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以是滤渣;
故答案为:Cu+4H++2NO3-
△
.
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
△
.
3Cu2++2NO↑+4H2O,Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;使Fe3+、Al3+沉淀除去;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
故答案为:加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,
甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,
所以从原子利用率和是否产生杂质考虑知,乙更合理,
故答案为:甲;所得产品中含有较多Fe2(SO4)3杂质;乙.
(5)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
铜离子物质的量和标准液物质的量相同,则20mL溶液中铜离子的物质的量=cmol/L×b×10-3L=bc×10-3mol;
则ag样品中CuSO4•5H2O的质量=c×b×10-3mol×250g/mol×5,所以CuSO4•5H2O质量分数的表达式=
c×b×10-3×250×5
a×100%.
故答案为:
c×b×10-3×250×5
a×100%.点评:
本题考点: 制备实验方案的设计;化学方程式的有关计算;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查离子分离的方法,实验设计,试剂选择,中和滴定的简单计算和误差的分析,离子性质的熟练掌握是解题关键,题目大.1年前查看全部
- (2012•天津)信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理
(2012•天津)信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如图1制备硫酸铜和硫酸铝晶体的路线:
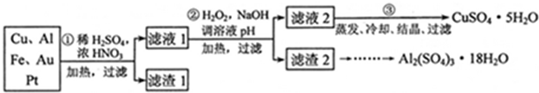
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为Cu+4H++2NO3-
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-加热 .
3Cu2++2NO↑+4H2O加热 .Cu+4H++2NO3-;
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-加热 .
3Cu2++2NO↑+4H2O加热 .
得到滤渣1的主要成分为______.
(2)第②步加H2O2的作用是______,使用H2O2的优点是______;调溶液pH的目的是使______生成沉淀.
(3)用第③步所得CuSO4•5H2O制备无水CuSO4的方法是______.
(4)由滤渣2制取Al2(SO4)3•18H2O,探究小组设计了三种方案: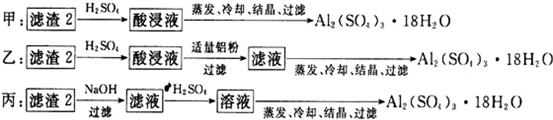
上述三种方案中,______方案不可行,原因是______:从原子利用率角度考虑,______方案更合理.
(5)探究小组用滴定法测定CuSO4•5H2O (Mr=250)含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4•5H2O质量分数的表达式ω=
×100%c mol•L−1×b×10−3L×250g•mol−1×5 ag ;
×100%c mol•L−1×b×10−3L×250g•mol−1×5 ag
下列操作会导致CuSO4•5H2O含量的测定结果偏高的是______.
a.未干燥锥形瓶b.滴定终点时滴定管尖嘴中产生气泡c.未除净可与EDTA反应的干扰离子. infotime1年前1
infotime1年前1 -
 且纵歌声穿山去 共回答了17个问题
且纵歌声穿山去 共回答了17个问题 |采纳率100%解题思路:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(5)依据滴定实验和反应离子方程式计算得到;滴定实验误差分析依据标准溶液消耗的多少进行分析判断;(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:Cu+4H++2NO3-
加热
.
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
加热
.
3Cu2++2NO↑+4H2O;Au、Pt;
故答案为:Cu+4H++2NO3-
加热
.
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
加热
.
3Cu2++2NO↑+4H2O;Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+;过氧化氢做氧化剂不引入杂质,对环境无污染;调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;Fe3+、Al3+;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
故答案为:加热脱水;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费;
故答案为:甲;所得产品中含有较多Fe2(SO4)3杂质;乙;
(5)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
铜离子物质的量和标准液物质的量相同=cmol/L×b×10-3L=bc×10-3mol;依据元素守恒得到:
则20ml溶液中含有的CuSO4•5H2O物质的量为bc×10-3mol;100ml溶液中含bc×10-3mol×5=5bc×10-3mol;
所以CuSO4•5H2O质量分数的表达式=
c mol•L−1×b×10−3L×250g•mol−1×5
ag×100%;
a.未干燥锥形瓶对实验结果无影响;
b.滴定终点时滴定管尖嘴中产生气泡说明消耗标准液读数偏小,结果偏低;
c.未除净可与EDTA反应的干扰离子,消耗标准液多,结果偏高;
故答案为:
c mol•L−1×b×10−3L×250g•mol−1×5
ag×100%;c.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查离子分离的方法,实验设计,试剂选择,中和滴定的简单计算和误差的分析,离子性质的熟练掌握是解题关键,题目难度中等.1年前查看全部
- CRT彩电线路板上面的各部分电路,以及每块电路里面的各个的电压是多少.(例如:开关管 行管 视放管 等等)
CRT彩电线路板上面的各部分电路,以及每块电路里面的各个的电压是多少.(例如:开关管 行管 视放管 等等)
想这些固定的电压都跟我说下,我记得不是很清楚.能说多详细就说多详细.记住线路板上每块电路的固定电压都要说全. cecilia8281年前1
cecilia8281年前1 -
 zyj123456 共回答了20个问题
zyj123456 共回答了20个问题 |采纳率85%这样的东西电压不一定是固定的,关键地方的电压一般电路图上会有注明,你现在需要的是产品的线路图,例如行电压小尺寸的可能是105V,大尺寸的可能是135V.说全的话估计没人说得全.1年前查看全部
- (2013•常州一模)信息时代产生的大量电子垃圾对环境构成了威胁.某研究性学习小组将一批废弃的线路板简单处理后,得到含7
(2013•常州一模)信息时代产生的大量电子垃圾对环境构成了威胁.某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
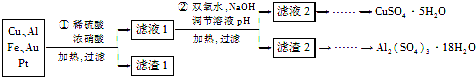
(1)第①步Cu与酸反应的离子方程式为______.
(2)第②步加H2O2的作用是______.
(3)该探究小组提出两种方案测定CuSO4•5H2O晶体的纯度.
方案一:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol•L-1Na2S2O3标准溶液滴定(原理为I2+2S2O2-═2I-+S4O2-),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①滴定过程中可选用______作指示剂,滴定终点的现象是______.
②CuSO4溶液与KI反应的离子方程式为______.
方案二:取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2- )标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2-═CuY2-+2H+.
③写出计算CuSO4•5H2O质量分数的表达式w=[7.5c/a]×100%[7.5c/a]×100%.
④下列操作会导致CuSO4•5H2O含量的测定结果偏高的是______(填字母).
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡 c.未除净可与EDTA反应的干扰离子. 7gfhx1年前1
7gfhx1年前1 -
 阿榭 共回答了26个问题
阿榭 共回答了26个问题 |采纳率92.3%解题思路:(1)Cu和浓HNO3的离子反应
(2)双氧水作氧化剂把Fe2+氧化为Fe3+
(3)有碘参加反应,因此可以选用淀粉溶液作指示剂,根据滴定终点的判断方法分析;
(4)铜离子被I-还原为亚铜离子,根据原子守恒和得失电子守恒书写;
(5)根据方程式计算;(1)Cu和浓HNO3的离子反应为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)双氧水作氧化剂把Fe2+氧化为Fe3+;故答案为:把Fe2+氧化为Fe3+;
(3)①有碘参加反应,因此可以选用淀粉溶液作指示剂,根据滴定终点的判断方法,要求蓝色刚好褪去,且半分钟内不恢复蓝色;故答案为:淀粉溶液、蓝色刚好褪去,且半分钟内不恢复蓝色;
②铜离子被I-还原为亚铜离子,碘离子被氧化为I2,根据原子守恒和得失电子守恒书写离子方程式为;2Cu2++4I-═2CuI↓+I2;故答案为:2Cu2++4I-═2CuI↓+I2;
③根据方程式可知20.00mL溶液中n(CuSO4•5H2O)=n(EDTA)=c×6×10-3mol;所以m(CuSO4•5H2O)=c×6×10-3mol×250g/mol=1.5c g,因此100mL溶液中CuSO4•5H2O的质量为:1.5c×5=7.5cg,所以w=[7.5cg/ag]×100%,故答案为:[7.5c/a]×100%;
④根据CuSO4•5H2O质量分数的表达式:[7.5c/a]×100% 分析;
a.未干燥锥形瓶,对滴定无影响;
b.滴定终点时滴定管尖嘴中产生气泡,读数时标准溶液体积偏小,结果偏小;
c.未除净可与EDTA反应的干扰离子,导致消耗的EDTA偏多,计算结果偏大,
故答案为:c;点评:
本题考点: 铜金属及其重要化合物的主要性质;镁、铝的重要化合物;中和滴定;探究物质的组成或测量物质的含量.
考点点评: 本题考查了金属与强氧化性酸的反应,中和滴定实验,氧化还原反应,根据方程式的计算等,综合性较强.1年前查看全部
- 开关电源线路板上字母VR是指什么元器件
 瘦茉莉1年前1
瘦茉莉1年前1 -
 dabear000 共回答了19个问题
dabear000 共回答了19个问题 |采纳率94.7%取样可调电阻1年前查看全部
- 一个LED功率为0.25W 用4.5V的电压 这个线路板上加多少大的阻值才可以
一个LED功率为0.25W 用4.5V的电压 这个线路板上加多少大的阻值才可以
原先没有加电阻 电流太大 耗电太快 甚至要烧LED jinna111年前1
jinna111年前1 -
 cattywendy 共回答了15个问题
cattywendy 共回答了15个问题 |采纳率86.7%串联一个200欧可调电阻,调节一下,使LED端电压与电流乘积不大于0.25W1年前查看全部
- 这个线路板上的电阻是多大的读数?
这个线路板上的电阻是多大的读数?



以第一张图为准,由缺角处开始从左到右4个电阻的读数分别是多少?下面两张为参考.
电阻上色环有5道,但第五道环不完整,只有一点。 在情场1年前1
在情场1年前1 -
 清香美禄 共回答了27个问题
清香美禄 共回答了27个问题 |采纳率85.2%看1图全是四环电阻,从左至右编为r1(这个第三环看不太清,是棕色是560欧,黑色侧是56欧,r2=.r3=100欧.r4=510欧1年前查看全部
- 铜丝从线路板掉了,有没有不用焊笔连接的其他连接方式?比如替代品粘起来
 198588881年前1
198588881年前1 -
 wkjn6jm 共回答了10个问题
wkjn6jm 共回答了10个问题 |采纳率100%把线接长点 绑在等电位点上 就OK1年前查看全部
- (2014•广东模拟)信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单
(2014•广东模拟)信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4.
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):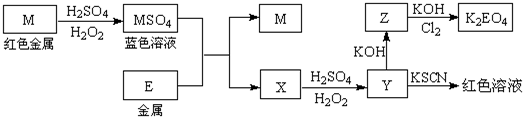
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式:______.
(2)检验X中阳离子的方法和现象是______.
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色.写出与上述变化过程相关的离子方程式:______、______.
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有______、______、______(填写仪器名称).
(5)某同学利用H2还原MO来测定M的相对原子质量,如图是测定装置示意图,A中试剂是盐酸.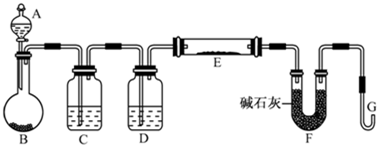
①仪器B中应装入______,装置D的作用______;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体”?______
在这两步之间还应进行的操作是______. 傲雪飘飞1年前1
傲雪飘飞1年前1 -
 西风tf 共回答了21个问题
西风tf 共回答了21个问题 |采纳率85.7%解题思路:根据题中信息,红色金属与稀H2SO4和H2O2反应生成蓝色溶液,生成的溶液中含有铜离子,所以M为金属铜;由于金属E反应后进入溶液X,X被双氧水氧化成Y,Y与硫氰化钾显示红色,证明金属E为铁,X为硫酸亚铁,Y为硫酸铁,
(1)铜和硫酸在双氧水的作用下发生反应生成硫酸铜和水;
(2)检验X中阳离子为亚铁离子,亚铁离子具有还原性,铁离子能与硫氰化钾溶液反应生成血红色的络合物;
(3)取X的溶液在空气中放置后,溶液中的亚铁离子被氧化成了铁离子,铁离子具有氧化性,能够氧化碘离子;
(4)根据实验操作选取仪器;
(5)①烧瓶盛放固体,浓硫酸有吸水性;
②氢气是可燃性气体,加热前需要检验氢气的纯度.根据题中信息,红色金属与稀H2SO4和H2O2反应生成蓝色溶液,生成的溶液中含有铜离子,所以M为金属铜;由于金属E反应后进入溶液X,X被双氧水氧化成Y,Y与硫氰化钾显示红色,证明金属E为铁,X为硫酸亚铁,Y为硫酸铁,
(1)铜和硫酸在双氧水的作用下发生反应生成硫酸铜和水,即Cu+H2O2+2H+=Cu2++2H2O,
故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(2)检验X中阳离子,就是检验溶液中存在亚铁离子,方法为:取X溶液少许于试管中,滴入几滴KSCN溶液,溶液不显红色,再向试管中加入几滴新制氯水,溶液显红色,
故答案为:取X溶液少许于试管中,滴入几滴KSCN溶液,溶液不显红色,再向试管中加入几滴新制氯水,溶液显红色;
(3)由于X的溶液在空气中放置后,溶液中的亚铁离子被氧化成了铁离子,离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,铁离子具有氧化性,能够氧化碘离子,发生的反应为:2Fe3++2I-=2Fe2++I2,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;2Fe3++2I-=2Fe2++I2;
(4)由于硫酸铜溶液获得硫酸铜晶体,需要经过蒸发浓度、冷却结晶等操作,用到的仪器有酒精灯、烧杯、玻璃棒、漏斗、铁架台和蒸发皿,
故答案为:烧杯、漏斗、玻璃棒;
(5)①烧瓶中应该装入固体颗粒锌,D装置盛有浓硫酸,作用是干燥氢气,
故答案为:锌粒;吸收水蒸气,干燥H2;
②氢气还原氧化铜,必须先通氢气赶走空气再加热,避免发生危险,所以应该先从A瓶中逐滴加入液体;加热前需要检验氢气的纯度,否则易产生氨气事故,
故答案为:从A瓶中逐滴加入液体;检验H2的纯度.点评:
本题考点: 铜金属及其重要化合物的主要性质;铁盐和亚铁盐的相互转变.
考点点评: 本题考查了铜及其化合物性质,涉及离子的检验、仪器的选取、氧化还原反应、实验操作等知识点,铁离子、亚铁离子的检验是学习重点,要会描述实验现象,难度中等.1年前查看全部
- (2013•无锡一模)信息时代产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到
(2013•无锡一模)信息时代产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到主要含Cu、Al及少量Fe、Au、Pt等金属的混合物,设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
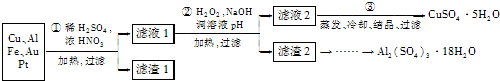
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:沉淀物 Fe(OH)2 Fe(OH)3 Al(OH)3 Cu(OH)2 开始沉淀 5.8 1.1 4.0 5.4 完全沉淀 8.8 3.2 5.2 6.7
(1)第①步操作前需将金属混合物进行粉碎,其目的是______.
(2)某学生认为用H2O2代替浓HNO3更好,理由是______;
请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式:______.
(3)第②步中应将溶液pH调至______.
(4)由滤渣2制取Al2(SO4)3•18H2O,探究小组设计了两种方案: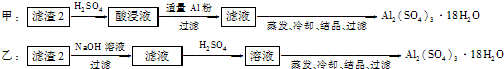
你认为______种方案为最佳方案,理由是______、______.
(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.100 0mol•L-1Na2S2O3标准溶液滴定至终点,共消耗14.00mLNa2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2S2O
+I2═2I-+S4O2−32−6
①样品中硫酸铜晶体的质量分数为______.
②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是______. k198761年前1
k198761年前1 -
 lovelywcm 共回答了25个问题
lovelywcm 共回答了25个问题 |采纳率92%解题思路:(1)将金属混合物进行粉碎增大固体接触面积增大反应速率;
(2)过氧化氢做氧化剂被还原为水,产物无污染,硝酸做氧化剂会被还原生成氮氧化物污染空气;铜在酸溶液中被过氧化氢氧化为铜离子,本身被还原为水,依据原子守恒、电荷守恒配平写出离子方程式;
(3)依据流程分析加入氧化剂氧化亚铁离子为铁离子后,加入氢氧化钠调节溶液PH使铁离子和铝离子全部沉淀,铜离子不沉淀;
(4)滤渣2的成分为氢氧化铁和氢氧化铝,依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(5)①依据滴定实验发生的反应的定量关系进行计算样品中所含铜离子物质的量,结合元素守恒计算硫酸铜 晶体质量分数;
②样品中含有硫酸钠,测定硫酸根离子含量不能计算得到硫酸铜晶体的含量;(1)第①步操作前需将金属混合物进行粉碎,其目的是增大固体与酸的接触面积增大反应速率;
故答案为:增大金属和酸的接触面积,加快反应速率;
(2)过氧化氢做氧化剂被还原为水,产物无污染,硝酸做氧化剂会被还原生成氮氧化物污染空气;铜在酸溶液中被过氧化氢氧化为铜离子,本身被还原为水,反应的离子方程式为:Cu+H2O2+2H+═Cu2++2H2O;
故答案为:不产生对环境有污染的气体; Cu+H2O2+2H+═Cu2++2H2O;
(3)加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀,依据图表数据分析可知,溶液PH调节为5.2~5.4,使Fe3+和Al3+形成沉淀,铜离子不沉淀,所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;故答案为:5.2~5.4;
(4)制备硫酸铝晶体的甲、乙两种方法中,甲方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;乙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案甲最合理,因为乙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,
所以上述两种方案中:从原子利用率和是否产生杂质考虑知,甲方案更合理,
故答案为:甲; 甲得到产品纯度高、原子利用率高;
(5)①2Cu2++4I-═2CuI(白色)↓+I22S2O
2−3+I2═2I-+S4O
2−6
反应的定量关系为2Cu2+~I2 ~2S2O32-
1.4×10-3mol0.100 0mol•L-1×0.014.00L=1.4×10-3mol
100ml溶液中含硫酸铜晶体物质的量为1.4×10-2mol,所以硫酸铜晶体的质量分数=
1.4×10−2mol×250g/mol
4.0g×100%=87.5%;
故答案为:87.5%;
②依据流程分析判断,样品中含有硫酸钠,不能通过测定硫酸根离子的方法计算得到硫酸铜晶体的质量分数;
故答案为:样品中含有Na2SO4等杂质;点评:
本题考点: 铜金属及其重要化合物的主要性质;镁、铝的重要化合物;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了铜铁铝及其化合物的分离方法和流程分析判断,试剂选择的方法应用,离子分离的过程分析和计算,题目难度中等.1年前查看全部
- 有没有简单的方法分离出线路板的金属.电解法最好.
 zcs11年前1
zcs11年前1 -
 另类的虫子 共回答了17个问题
另类的虫子 共回答了17个问题 |采纳率88.2%线路板中主要铜,可用 硫酸铁Fe2(SO4)3溶液浸泡,再用铁粉置换.或电解,电解时与直流电负极相连得为铜片,与正极相连的用石墨棒.可电解精炼铜.
原理:Fe3+ + Cu = Fe2+ + Cu2+
阳极(与正极相连):4 OH- -- 4e- ===O2 + 2H2O
阴极(与负极相连):Cu2+ + 2e- = Cu
注意:铜片和石墨棒不要放错,要直流电1年前查看全部
- 请问下线路板废水里,电导率跟PH,铜的关系?
 qepwqntau1年前1
qepwqntau1年前1 -
 雪舞轻轻 共回答了18个问题
雪舞轻轻 共回答了18个问题 |采纳率88.9%PH值表示为酸碱性值 ,PH值一帮以7表示为中性,越偏离这个值,那么电导率也是越高的,应为酸碱性物质都会在通电的情况下分离处H+,OH- 离子;
至于跟铜的关系,不是非常明白,应该说电导率越强的话,铜的导电会越好吧!1年前查看全部
- 我想问下,锡炉第二次重浸线路板时,线路板的焊盘上锡过多,很多毛剌,短路现像.不知是什么原因?
 猪头xx_gz1年前1
猪头xx_gz1年前1 -
 wnl55 共回答了14个问题
wnl55 共回答了14个问题 |采纳率92.9%1.锡锅温度低!
2.助焊剂不够!
3.锡与助焊剂不良!
4.印版遮掩膜不良!
5.机械控制浸锡时间不对!
--寂寞大山人1年前查看全部
- 书面检讨书我要怎么写犯了错误该如何检讨我们厂生产的是线路板我的工位是IPQC昨天晚上不小心漏了一台坏机一块板的三极管上粘
书面检讨书我要怎么写
犯了错误该如何检讨我们厂生产的是线路板我的工位是IPQC昨天晚上不小心漏了一台坏机一块板的三极管上粘了一个小电容被QA抽到了要求写检讨100字就行 danshenya0241年前1
danshenya0241年前1 -
 寻找避风的地方 共回答了18个问题
寻找避风的地方 共回答了18个问题 |采纳率94.4%楼主,您好! 由于您写的检讨是你的亲身经历! 我们真的帮不了您! 您写出真情实感就好了! 希望你能好好写出一份检讨书! 谢谢采纳!1年前查看全部
- 硫酸铜是怎么提取的?怎样在线路板厂的烛刻液里提取硫酸铜?他需要什么设备和工艺?
 小小江南才子1年前1
小小江南才子1年前1 -
 爱上教主 共回答了12个问题
爱上教主 共回答了12个问题 |采纳率91.7%高中化学课本里有1年前查看全部
- 急!就一道初三物理计算题!某电子线路板上有个标有100欧的电阻,现将一只电压表并界在该电阻两端,可以测量该线路板工作时该
急!就一道初三物理计算题!
某电子线路板上有个标有100欧的电阻,现将一只电压表并界在该电阻两端,可以测量该线路板工作时该电阻两端的电压,结果发现,电池用久了,电压表的示数会减小,当电压表的示数减小2伏时,通过该电阻的电流减小多少毫安?
过程,谢谢~~! astar09301年前1
astar09301年前1 -
 发888888 共回答了23个问题
发888888 共回答了23个问题 |采纳率91.3%设最初电压为X
(X/100)-(X-2/100)=X/100-X/100+2/100=0.02A
也就是20毫安1年前查看全部
- 某研究小组将一批废弃的线路板经浓硝酸和稀硫酸处理后得到一混合溶液,其中含有Cu2+、Fe3+、Fe2+、Al3+等金属离
某研究小组将一批废弃的线路板经浓硝酸和稀硫酸处理后得到一混合溶液,其中含有Cu2+、Fe3+、Fe2+、Al3+等金属离子,并设计了以下两种流程以分别制取CuSO4•5H2O晶体和AlCl3溶液(如图1):流程
已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
请回答下列问题:离子 Fe3+ Fe2+ Al3+ Cu2+ pH范围 2.2~3.2 5.5~9.0 4.1~5.0 5.3~6.6
(1)加入H2O2的作用是______,
(2)欲使制取的CuSO4•5H2O晶体较为纯净,pH至少应调至______;
(3)写出H2O2在酸性条件下与Fe2+反应的离子方程式:______;
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3______(填:能或不能),原因是______;
(5)取体积为V(L)的酸浸液,向其中滴加1mol•L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系图2.请用V1、V2、V3表示所取的酸浸液中n(Fe3+):n(Al3+)4V2−V1−3V3 3(V3−V2) .4V2−V1−3V3 3(V3−V2) 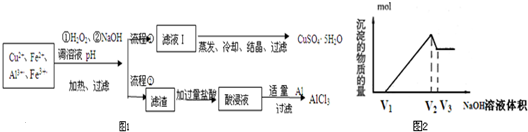
 爱吃热板栗1年前1
爱吃热板栗1年前1 -
 洪叶 共回答了19个问题
洪叶 共回答了19个问题 |采纳率89.5%解题思路:加H2O2把Fe2+氧化为Fe3+,加氢氧化钠调节pH,生成氢氧化铁和氢氧化铝沉淀,过滤得滤渣中含氢氧化铁和氢氧化铝,加过量盐酸生成氯化铝、氯化铁,酸浸液加入适量铝把铁置换出来,过滤得到氯化铝;对于滤液I,含硫酸铜,通过蒸发浓缩、冷却结晶、过滤洗涤得到硫酸铜晶体.
(1)加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染;
(2)滤渣c是氢氧化铝,根据部分阳离子以氢氧化物形式沉淀时溶液的pH表,选择使氢氧化铝沉淀完全且氢氧化铜不沉淀的PH;
(3)双氧水具有氧化性,能够将亚铁离子氧化成铁离子;
(4)氯化铝属于强酸弱碱盐,会水解;
(5)根据图象结合反应原理进行计算.(1)第②步加H2O2的作用是将Fe2+氧化为Fe3+,过氧化氢做氧化剂不引入杂质,对环境无污染,故答案为:将Fe2+氧化为Fe3+,不引入杂质,产物对环境无污染;
(2)加入氢氧化钠溶液调节PH=x,目的是生成氢氧化铝沉淀,氢氧化铝开始沉淀PH=4,沉淀完全PH=5.0,氢氧化铜开始沉淀PH=5.4,所以选择的PH范围是:5.0≤X<5.4,pH至少应调至5.0,故答案为:5.0;
(3)亚铁离子被双氧水氧化成铁离子,反应的离子方程式为H2O2+2Fe2++2H+═2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(4)氯化铝为强酸弱碱盐,水解反应方程式为:AlCl3+3H2O⇌Al(OH)3+3HCl水解为吸热反应,加热使水解平衡向水解方向移动,蒸干,氯化氢挥发,得到氢氧化铝,灼烧得到氧化铝;故答案为:不能;直接加热AlCl3溶液,会发生水解反应,最终得到氧化铝;
(5)0--V1阶段,滴加的NaOH用于中和剩余的HCl,发生反应是:HCl+NaOH=NaCl+H2O,
设Fe3+、Al3+物质的量分别为y、x,
V1--V2阶段,继续滴加的NaOH与Fe3+、Al3+反应:
Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓
x 3xx y 3y
则3x+3y=(V2-V1)×1
V2--V3阶段,继续滴加的NaOH与Al(OH)3反应,沉淀量开始减少,发生反应:
Al(OH)3+NaOH=NaAlO2+2H2O
x x
则x=(V3-V2)×1=V3-V2
y=
4V2−V1−3V3
3,
y:x=
4V2−V1−3V3
3(V3−V2),故答案为:
4V2−V1−3V3
3(V3−V2).点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查金属混合物的分离和提纯,关键是提取题中的信息和反应原理,根据所学知识完成,本题难度中等.1年前查看全部
- 线路板5vin甚么意思线路板VCC、5VIN、GND、RIN、LIN、GND定义
 ohhzck1年前1
ohhzck1年前1 -
 凯歌5 共回答了18个问题
凯歌5 共回答了18个问题 |采纳率88.9%线路板VCC、5VIN、GND、RIN、LIN、GND定义 查看原帖1年前查看全部
- 看了看线路板,桥式整流二极管电路上有6个1000PF的独石电容,其中四个电容分别并联在每个二极管上,
看了看线路板,桥式整流二极管电路上有6个1000PF的独石电容,其中四个电容分别并联在每个二极管上,
承蒙各位关照,早上叙述的不够细致,晚上回来看了看线路板,桥式整流二极管电路上有6个1000PF的独石电容,其中有四个电容分别并联在每个二极管上,另外两个电容连着整流桥的两端接地(不是输入端),其中4个电容起什么作用,另两个有什么作用? coulor1年前1
coulor1年前1 -
 vvee 共回答了11个问题
vvee 共回答了11个问题 |采纳率90.9%都是旁路高频干扰信号的,因为电源中有许多高次谐波,会干扰用电器,桥式整流二极管上的4个电容在电源通电时会瞬间短路保护二极管免受电流冲击损坏,有两种作用,这样就明白了吧,理性理解,不要扣字眼,这些都是专家说的话.我们只能这样看待.1年前查看全部
- 黄金提纯,线路板粉末中含有黄金 怎么提纯
黄金提纯,线路板粉末中含有黄金 怎么提纯
我有很多线路板粉末~
里面有金 锡 铜还有塑料~
我想知道怎么自己能把这些粉末中的金提出来~ plnunu5021年前2
plnunu5021年前2 -
 yzg812592 共回答了14个问题
yzg812592 共回答了14个问题 |采纳率85.7%你可以参考电解铜处理阳极泥的方法,
湿法流程
阳极泥脱硒后,用湿法处理,主要工序为:
①在空气搅拌条件下,用硫酸溶液浸出铜,并加入盐酸使溶出的银生成不溶的氯化银(AgCl),含铜的浸出液经浓缩结晶,产出硫酸铜;
②脱铜后的阳极泥用碳酸钠和氨水浸出,银成络氨盐〔Ag(NH3)2Cl〕进入溶液,并使铅转变为碳酸铅;
③银浸出液用水合肼(H2NNH2·H2O)还原,产出银粉;
④浸出银后的氨浸渣用硝酸溶液浸出铅;
⑤向分离铅后的脱铅渣加入盐酸、食盐和氯酸钠溶液溶解金,含金溶液用SO2还原,析出金粉;
⑥还原金后的溶液用锌块置换得到铂、钯精矿.
你对比着成分删掉几个步骤就可以用了.1年前查看全部
- 无线电兴趣小组的同学,用电烙铁将零件焊在线路板上,在焊接过程中焊锡发生的物态变化有______.
 wishes00811年前1
wishes00811年前1 -
 阿衣拉恰 共回答了25个问题
阿衣拉恰 共回答了25个问题 |采纳率84%解题思路:要解决此题,需要知道熔化和凝固现象.熔化是物体由固态变成液态的过程;凝固是物体由液态变为固态的过程.
在整个焊接过程中,焊锡发生的物态变化是:固态的焊锡变为液态的焊锡是熔化过程,反之是凝固过程.在焊接过程中,零件和线路板间的焊锡吸收电烙铁传递的热量熔化成液态;将电烙铁拿开后,焊锡会放热凝固,使零件与线路板粘合在一起.
故答案为:熔化和凝固.点评:
本题考点: 熔化与熔化吸热特点;凝固与凝固放热特点.
考点点评: 此题考查的是凝固和熔化在生活中的应用,是一道理论联系实际的题目.这在中考时经常会考到.1年前查看全部
- 怎么算在线路板插多大的电容比如直流电12那么是不是插16v的电解电容就可以了
怎么算在线路板插多大的电容比如直流电12那么是不是插16v的电解电容就可以了
要考虑多少uf.的吗 weishaaaa1年前1
weishaaaa1年前1 -
 jiake811031 共回答了19个问题
jiake811031 共回答了19个问题 |采纳率89.5%是的.只要电容承受的电压比直流电压大就可以了.1年前查看全部
- 灯泡板一点亮,我线路板上的一个电阻就发烫,是不是功率不够大
 single叶开1年前4
single叶开1年前4 -
 onelily 共回答了16个问题
onelily 共回答了16个问题 |采纳率87.5%是电阻功率不够.1年前查看全部
- 怎么清除线路板上残留的焊锡膏我有一块线路板输入为220V,正负两端在板上的空隙太小,由于焊接的时候经常会有残留的焊锡膏在
怎么清除线路板上残留的焊锡膏
我有一块线路板输入为220V,正负两端在板上的空隙太小,由于焊接的时候经常会有残留的焊锡膏在上面,受热后焊锡膏融化引起短路,烧坏很多板,请教高手,怎么清除残留的焊锡膏或者有什么好的解决途径~~~~~~~~~~~~
 dg1239d1年前1
dg1239d1年前1 -
 xuguanhau 共回答了16个问题
xuguanhau 共回答了16个问题 |采纳率100%这不用急,我门修手机经常遇到这个问题,不过我们有专门的吸锡丝.你也可以买一个来用,如果买不到的话,那吸锡丝就是一些细铜线,买不到我建议你找个电线,就是里面有细铜丝的那种,把外面皮去掉,然后用那细铜丝把多余的焊锡膏吸掉,1年前查看全部
- (2011•景德镇模拟)如图所示为学校航模兴趣小组的同学正在练习用电烙铁在线路板上进行焊接的情形,有关这一情形的说法中正
 (2011•景德镇模拟)如图所示为学校航模兴趣小组的同学正在练习用电烙铁在线路板上进行焊接的情形,有关这一情形的说法中正确的是( )
(2011•景德镇模拟)如图所示为学校航模兴趣小组的同学正在练习用电烙铁在线路板上进行焊接的情形,有关这一情形的说法中正确的是( )
A.焊锡主要发生的物态变化是升华和凝华
B.焊锡具有熔点高、易导电的特点
C.为防止触电,手应该拿在电烙铁的绝缘手柄处
D.电烙铁工作是将电能转化为机械能 如是横波1年前1
如是横波1年前1 -
 chudadi 共回答了15个问题
chudadi 共回答了15个问题 |采纳率93.3%解题思路:物质由固态变成液态叫做熔化,物质由液态变成固态叫凝固.
焊锡具有熔点低、易导电的特点.
根据导电性的不同,材料可分为导体,半导体,绝缘体三大类,容易导电的物体叫导体,不容易导电的物体叫绝缘体,导电性能介于导体与绝缘体之间的叫半导体.
电流通过用电器将电能转化为其他形式的能.进行焊接时,焊锡先由熔化再凝固.故A错误.
焊锡较容易熔化,所以熔点低.故B错误.
电烙铁手柄处是绝缘体,可防止触电,故C正确.
电烙铁工作消耗了电能,电烙铁温度升高,内能增加,所以是将电能转化为内能.故D错误.
故选C.点评:
本题考点: 绝缘体;熔化与熔化吸热特点;凝固与凝固放热特点;能量转化的现象.
考点点评: 本题通过用电烙铁在线路板上进行焊接的情形,把物态变化、导体和绝缘体、能的转化等问题涉及到里面,扩大了对学生的考查面,又联系了实际是一道好题.1年前查看全部
- 镀化学镍金是不是化金?PCB(线路板)
 yujuchun1年前2
yujuchun1年前2 -
 hidayatt 共回答了18个问题
hidayatt 共回答了18个问题 |采纳率94.4%不是,电镀镍金是物理反应(中间也含有部分化学反应),化金是化学金的简称,他是化学反应.1年前查看全部
- 废弃物的综合利用既有利于节约资源,又有利于保护环境.利用废弃的线路板(含70%Cu、25%Al、4%Fe及少量碳单质,设
废弃物的综合利用既有利于节约资源,又有利于保护环境.利用废弃的线路板(含70%Cu、25%Al、4%Fe及少量碳单质,设计出制备硫酸铜晶体和氢氧化铝操作流程如下:
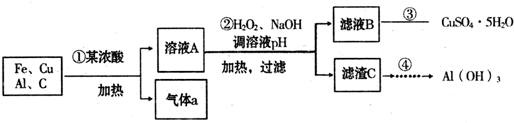
供选试剂:
a.澄清石灰水b.品红溶液c.酸性高锰酸钾溶液d.碳酸氢钠溶液e.氢氧化钠溶液f.硫氰化钾溶液g.氯水
(1)检验气体a的成分,将气体a依次通入试剂的先后顺序为:
b→______→b→______(填写供选试剂的代号).判断气体a中含有二氧化碳的实验现象为______.
(2)第③步实验操作步骤为蒸发浓缩、冷却结晶、______(填操作名称)、洗涤.如图所示,蒸发操作中的一处错误是______.
(3)第②步加H2O2的作用是______;调溶液pH的目的是使______生成沉淀.
(4)请依照上图形式设计从滤渣C中获得Al(OH)3固体最简步骤的流程图:(提示:在箭头上方或下方标出所用试剂或实验操作)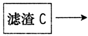 ______.
______.  **king1年前1
**king1年前1 -
 baoming004 共回答了22个问题
baoming004 共回答了22个问题 |采纳率81.8%解题思路:(1)用铜制取硫酸铜需要硫酸,则某浓酸是硫酸,在加热条件下,浓硫酸和碳反应生成二氧化碳、二氧化硫和水,铜和浓硫酸反应生成二氧化硫,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,但二氧化硫能使品红溶液褪色;
(2)从溶液中制取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤的方法,用蒸发皿制取晶体;
(3)加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染;调溶液PH的目的是使Fe3+和Al3+形成沉淀;
(4)C中含有氢氧化铁、氢氧化铝,氢氧化铝能溶于强碱生成偏铝酸盐,向偏铝酸盐中通入二氧化碳即可得到氢氧化铝沉淀.(1)用铜制取硫酸铜需要硫酸,则某浓酸是硫酸,在加热条件下,浓硫酸和碳反应生成二氧化碳、二氧化硫和水,铜和浓硫酸反应生成二氧化硫,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,但二氧化硫能使品红溶液褪色,检验气体a的成分,要先将a气体通入品红溶液检验含有二氧化硫,二氧化硫具有还原性,能被酸性高锰酸钾氧化,所以可以用酸性高锰酸钾溶液吸收二氧化硫,再次用品红溶液检验不存在二氧化硫,然后将气体通入澄清石灰水,如果澄清石灰水变浑浊,则证明含有二氧化碳,所以将气体a依次通入试剂的先后顺序为:b→c→b→a,判断气体a中含有二氧化碳的实验现象为第二份品红不褪色,并且澄清石灰水变浑浊,
故答案为:c,a;第二份品红不褪色,并且澄清石灰水变浑浊;
(2)从溶液中制取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤的方法,用蒸发皿制取晶体,坩埚用于灼烧固体,故答案为:过滤,不能用坩埚;
(3)加H2O2的作用是将Fe2+氧化为Fe3+,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:将Fe2+氧化为Fe3+,Fe3+、Al3+;
(4)C中含有氢氧化铁和氢氧化铝,氢氧化铝是两性氢氧化物能溶于强碱氢氧化钠溶液,氢氧化铁不溶于氢氧化钠溶液,氢氧化铝和氢氧化钠溶液反应生成偏铝酸钠溶液,将反应后的溶液进行过量,将二氧化碳通入滤液中,二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤即可得到氢氧化铝,
所以从滤渣C中获得Al(OH)3固体最简步骤的流程图为: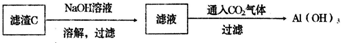 ,
,
故答案为: .
.点评:
本题考点: 制备实验方案的设计;镁、铝的重要化合物;铜金属及其重要化合物的主要性质.
考点点评: 本题考查物质的分离、实验设计、试剂选择等知识点,明确离子的性质是解本题关键,注意二氧化碳和二氧化硫都能使澄清石灰水变浑浊,为易错点.1年前查看全部
- 220伏的20颗led串联我计算出的限流电阻的阳值是7800Ω 功3.12瓦我在线路板上应该用的电阻是7800欧姆吗
 yefa111年前2
yefa111年前2 -
 小瓶盖达达 共回答了22个问题
小瓶盖达达 共回答了22个问题 |采纳率90.9%LED灯最大电流是30MA,最小得10MA,只要不超过这电流就可以用.每个LED灯得用3V左右的电压.3*20=60v,(220-60)/20=8k.7800欧是可以的.1年前查看全部
- 怎么才能学会化学我初中的时候就没上学了、所以化学一点没有接触过、现在我在别人电子线路板厂里上班.需要做化验、但是我一点都
怎么才能学会化学
我初中的时候就没上学了、所以化学一点没有接触过、现在我在别人电子线路板厂里上班.需要做化验、但是我一点都不会、怎么才能尽快学会啊、
在工厂里 我 看别的人 都拾先在药水槽里 装一点药水去化验 那个是做什么的? 1986121729321年前3
1986121729321年前3 -
 yuan老实人28 共回答了22个问题
yuan老实人28 共回答了22个问题 |采纳率100%最快的办法是跟着别人学,同时自己哪里不明白,补哪里,化学重要的事一些元素符号必须记住,不让你看不懂得.所以你先补补基础1年前查看全部
- 电子线路板上U501表示什么啊电子线路板上U501,、U503、U503等,这些都表示什么元器件呀
 cxz1281年前1
cxz1281年前1 -
 simmd 共回答了24个问题
simmd 共回答了24个问题 |采纳率91.7%一般U是代表芯片吧.也有代表三极管的时候.
也有直接写IC+数字来代表芯片的
R代表电阻
C代表电容 电解电容 钽电容等
D代表二极管
J代表座子
Q代表三极管
有的时候这些写的都不一样 只是比较常见1年前查看全部
- 线路板中的字母wht是什么意思?
 扶风起浪1年前1
扶风起浪1年前1 -
 mmm123999 共回答了29个问题
mmm123999 共回答了29个问题 |采纳率79.3%首先该阶段,构成线电路回路的相位;相位是缺乏相线,即电路是开放的,并没有形成一个封闭的,一般是指在空气开关故障,还有一个相线未封闭;断相是由于短路或其他外力造成线的相位是否断开形式开路1年前查看全部
- 电阻并联问题我有一个线路板上的电阻为100K,我想把这个电阻变成75K,请问我要并多大的电阻才能得到75K呢(也就是说;
电阻并联问题
我有一个线路板上的电阻为100K,我想把这个电阻变成75K,请问我要并多大的电阻才能得到75K呢(也就是说; “x” 100 是原有数,是已知的 “y ”75 是我想变成的数也是已知的 “z”是未知的,求“z”
那位大侠能帮帮忙,请给一个公式 gaozhi1年前3
gaozhi1年前3 -
 oceax 共回答了18个问题
oceax 共回答了18个问题 |采纳率88.9%并联电阻的计算公式是:1/r=1/R1+1/R2(可改写为:r=R1R2/(R1+R2))
1/75=1/100+1/r
解方程得:r=300K1年前查看全部
- 我的台灯的线路板烧了!请问谁有台灯的线路图!我的台灯是-百利威-MT612型的.
我的台灯的线路板烧了!请问谁有台灯的线路图!我的台灯是-百利威-MT612型的.
昨天,我的台灯正亮着呢!突然不亮了,我以为是没电,所以我拔下灯管用万用表测测灯管那是否有电,可没想到台灯内的线路板噼里啪啦烧了,我拆开看那里边烧坏了1个三极管(三极管烧断了一根引脚,是最边下的),4个电阻.电阻我侧过都有阻值(原来的阻值我不知道).原来的三极管是13001 s6d,我没有这种,所以我换上了一个13001eb,可是一启动时电压表顺时针波动一次,关掉电源是指针向逆时针波动一次(幅度很小).请问这是怎么了?
我想知道那个台灯灯管的电压。台灯的电流是0.65A、功率是11W,经过P=UI得U=P/I算得U等于162V(约等于)。那这162V是直流还是交流呢? 无籽西瓜1年前1
无籽西瓜1年前1 -
 年方十八 共回答了16个问题
年方十八 共回答了16个问题 |采纳率87.5%是交流的电压多少我没测过,换不块新线路板吧,有卖的3-5元一个1年前查看全部
- 线路板上的那些个电阻其阻值是用不同的颜色圈表示的,请问颜色对应的阻值是好多咯?
线路板上的那些个电阻其阻值是用不同的颜色圈表示的,请问颜色对应的阻值是好多咯?
比如红色对应多少,金黄对应多少,白色又对应多少?
麻烦各位尽量弄的齐全点哈,小弟在此先谢过了哈! hapbit1年前1
hapbit1年前1 -
 冬眠的蛇 共回答了14个问题
冬眠的蛇 共回答了14个问题 |采纳率85.7%电阻的数值、色标和挑选
一、电阻的数值系列
电子元件中的电阻,其数值按其容许误差大小可分为很多系列.每个系列可将同一数量级的各种数值的电阻值,用少数几个数来表示,这很便于生产和使用.
E系列中容许误差为士20%的E6,有1、1.5、2.2、3.3、4.7、6.8六个数;E12的容差为士10%,有12个数;E24容差为士5%,有24个数.均见表1所示.
表(一)
E6 E12 E24 E6 E12 E24
1.0 1.0 1.0
1.1
3.3 3.3 3.3
3.6
1.2 1.2
1.3
3.9 3.9
4.3
1.5 1.5 1.5
1.6
4.7 4.7 4.7
5.1
1.8 1.8
2.0
5.6 5.6
6.2
2.2 2.2 2.2
2.4
6.8 6.8 6.8
7.5
2.7 2.7
3.0
8.2 8.2
9.1
同一系列相邻两个数的比值基本相等.E6的比值约1.5.E12的比值约为1.2.E24的比值约为1.1等.系列中相邻数的正负偏差所涵盖的范围是衔接的或稍有重叠.例如E6系列中2.2的负偏差最大为2.2x(1-20%)-1.7,1.5的正偏差最大为 1.5X(1+20%)-1.8,稍有重叠;2.2的正偏差最大为2.2x(1+20%)-2.64,3.3的负偏差最大为3.3 X(1-20%)-2.64,正好衔接.
每个系列同一数量级的电阻,可用少数几个数来表示.例如E6系列对千欧级的电阻只用lk、1.5k、 2.2k、3.3k、4.7k、6.8k就可将0.8k到8k的电阻值表示出来.生产时只需将千欧级电阻分为六档,分别注出 电阻值,它给生产带来很大方便.使用时如果不要求电阻值很精确,则选用E6系列,因为容许误差大的电阻价格也低.如果计算时计算结果不等于系列值,则选用相近的系列值.
二、怎样读电阻的色标
由于电子元件日趋小型化,电阻上的标注又从直接注数值的数标方式,转而采用色环或色点的色标方 式.实际上用色标识别电阻的数量级、首位数甚至二、三位数,速度远远胜过数标.在一盘乱放的电阻中用眼看色标找出所需电阻是最容易的,可免去逐个翻看电阻上的数字,或用欧姆计选择时的繁杂费时.读者可实际比较其差别.色标与数标的共同缺点,例如磨损后无法识别的问题差不多,但色标需熟练掌握,才能运用灵活,不如数标直截了当.因此学会读电阻的色标很重要.它也为学会识别其他电子元件的色标打下基础.
初学者学习色标(色环、色点)的内容和步骤如下.
1.色标颜色代表的数值、倍率和误差要记忆.
色标含义如表2所示.应记忆:黑0棕1红2橙3黄4绿5蓝6紫7灰8白9,及金、银、无色的含义.再结合表2和图1读出色标的含义.
表2 (..表示依次类推,-表示无意义)
颜色 黑 棕 红 橙 黄 绿 蓝 紫 灰 白 金 银 无色
数值 0 1 2 3 4 5 6 7 8 9 - - -
倍率 1 10 100 1000 10000 ..........1/10 1/100
容差10% - 士1 士2 - - 士0.5 士0.25 士0.1 - +5
-20
士5 士10 士20
2.最靠未端的色标是首位色标,依此定出其右边的第二、三、四和第五位色标
常用的有三环、四环、五环色标.实际上三环或四环色标的前二环表示电阻值的前二位数 值,第三环为倍率乘数(以欧姆为单位).三环色标标称值的容差为20%,四环色标的第四环表示容差,也可把三环色依次为棕绿棕,则为15X10=150(士20%).
这里请不要小看首位色标位置的确定,因为随意放置的电阻时并不一定首为色标在左边,如果首位错定为另一端则数据全错.实际情况是,色标与电阻两端的距离差别往往很小,需仔细辨认比较,才能确定.
3.先熟悉前六个色标,再全面掌握
初学时先记住前六个色标,即记住黑棕红橙黄绿的次序及其应用.因为不管是数值上或者倍率上,常用 电阻在这个范围比较多,故是最有用的.熟练运用它们以后,也容易掌握表1的其它内容.
例1.三环电阻为绿棕橙.第一、二环为绿棕,即51,第三环为橙,即量级为10x10x10,故51x10x10x10=51千欧,士20%.在一堆电阻内寻找此阻值的电阻时,先盯往第三环为橙色,即为10千欧量级,再看第一、二环为绿棕色,即可找到51千欧的电阻.
例2.三环电阻为红红绿.即2.2M欧,士20%.兆欧级电阻的第三环为绿色,更大一个量级的电阻,例如 10M欧为棕黑蓝,第三环为蓝色,已很少用.
例3.三环电阻为黄紫棕.即470欧,士20%.
例4.三环电阻为橙橙黑.即33欧,士20%.注意第三环为黑,倍率为1,故33x1=33欧.
例5.四环电阻为蓝灰黄银.即680k欧,士10%.
例6.四环电阻为棕红红金.即1.2k欧,士5%.
例7.五环电阻为红黄白银棕.注意五环电阻的前三位代表数值,第四环才是倍率乘数,银代表的倍率为 1/100.第五环是容差,棕为1%.故为249X1/100=2.49欧,士1%.1年前查看全部
- 怎样给手机电池换电路我有一块一样大的旧电池由于接触点不对,想换成一样的线路板,可是就是按照电路的正负极接上之后就不通反向
怎样给手机电池换电路
我有一块一样大的旧电池由于接触点不对,想换成一样的线路板,可是就是按照电路的正负极接上之后就不通反向接出来的正负极就反了,不知为什么,
谢谢你的提醒,我认为无论是啥品牌的电池正负极是一样的,只不过保护电路不同罢了,我换电池芯是先将原来电池芯拆下并记好正负极,再将新电池按记的正负极联上的,可是我不明白的是我比照着一样换,换完没电,反过来有电但是正负极反了,不知哪位大侠遇到过这类问题, 等待毛毛的容容1年前1
等待毛毛的容容1年前1 -
 公子白床单 共回答了14个问题
公子白床单 共回答了14个问题 |采纳率78.6%建议你,如果不是特别精通不要自己乱弄容易出问题.所有手机电池都是有锂电芯和保护电路组成的,由于手机品牌型号众多,手机电池款式也特别多,你要是换电池芯可以先将原来电池芯拆下并记好正负极,再将新电池新按记的正负极联上.因为你不是专业,所以只能用本品牌型号的电池保护线路板,不能用别的替代.
是的,只是保护电路不同,首先你必须用原来的保护电路板,电池芯与电路板只有正负极相连,注意不要短路.
你的问题我想是这样的,你原来连得是正确的,之所以不通是因为电池进入保护状态了,你在连接时出现短接了使保护电路板进入保护状态了,这是你量电池触点电压为零,实际是保护电路板关闭了电流输出.
解决方法:用手机维修稳压电源激活一下就行了.1年前查看全部
- 有可能运输造成线路板上的插头松动或脱落,可以打开底盖后看一下线路板上的插头是不是有脱落或松动的.
有可能运输造成线路板上的插头松动或脱落,可以打开底盖后看一下线路板上的插头是不是有脱落或松动的.
求这就话的英文翻译 密迹金刚1年前1
密迹金刚1年前1 -
 qwe11223 共回答了22个问题
qwe11223 共回答了22个问题 |采纳率90.9%May cause the plug of the circuit board to transport loose or fall off, can open after base see circuit board to plug is the fall off or loose.1年前查看全部
- 有关铜的化学反映想做个线路板因为没有三氯化铁,没法制作有谁知道的告诉几种反应快点的在这里谢谢了什么是双氧水
 二4额31年前1
二4额31年前1 -
 LZJCL 共回答了23个问题
LZJCL 共回答了23个问题 |采纳率91.3%稀硫酸+双氧水1年前查看全部
- 学校无线电兴趣小组的同学用电烙铁在线路板上焊接过程中,焊锡发生的物态变化是什么?
 nn梦儿20031年前1
nn梦儿20031年前1 -
 正常假人 共回答了18个问题
正常假人 共回答了18个问题 |采纳率100%物理变化.焊锡是低熔点的合金,在常温下是固态,被烙铁头加热后变成液态.1年前查看全部
- 是说线路板的孔大对加工过的线路板检查标准,孔大小于limit
 hailianni1年前3
hailianni1年前3 -
 yingzhizi 共回答了18个问题
yingzhizi 共回答了18个问题 |采纳率94.4%limit
KK: []
DJ: []
n.[C]
1. 界线;界限
That fence is the limit of the schoolyard.
那堵围墙是校园的界限.
2. 限度;限制;极限
He knows his own limits.
他自知能力有限.
3. 范围,境界[P]
Drive slowly within the city limits.
在市区内车子要开得慢点.
4. 【口】使人无法容忍的人(或事物)[the S]
That man's the limit.
那人真叫人无法容忍.
5. (渔猎等的)限额
vt.
1. 限制;限定[(+to)]
The teacher limited his students to 500 words for their compositions.
老师把学生的作文限制在五百字以内.
We must limit ourselves to one cake each.
我们必须限定每人只吃一块蛋糕.
以上结果由 Dr.eye译典通字典 提供1年前查看全部
大家在问
- 1X光片怎样提银有步骤吗
- 2抛物线y^2=x 上p点到准线的距离等于它到顶点的距离 P点的坐标?
- 3我顿时觉得我是世界上最可怜的人了,用英语怎么说
- 41.函数f(x)=﹛-x-1 (x≤-2)
- 5物质与氧气发生的反应一定都是氧化反应吗
- 6.The house rent is increasing sharply nowadays. I’ve got abo
- 77分之13分数单位是7分之1,至少要添上()个这样的分数单位就变成了一个整数
- 8(1)用配方法解方程:x2-10x+9=0.
- 9下图从0到9这十个数字的发明者和传播者是 [ ] A.罗马人和阿拉伯人
- 10已知a-b/x=b-c/y=c-3/z≠0,求x+y+z的值
- 11bottom sweep measured
- 12A社区居民具有共同区域身份 B社区居民具有些相同的看法 C.社区居民彼此利益相关交往比较密切
- 13北京是中国的首都用英语怎么说?&托尼不在我们班!
- 14只有往前看才会忘记过去的英文翻译
- 15大家猜猜这是什么四字成语?

