电离常数和水解常数后有单位名称吗?
 teegreen2022-10-04 11:39:541条回答
teegreen2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 老华字典 共回答了18个问题
老华字典 共回答了18个问题 |采纳率94.4%- 电离常数和水解常数都没有单位名称
- 1年前
相关推荐
- 25℃时,几种弱酸的电离常数如下:
25℃时,几种弱酸的电离常数如下:
弱酸的化学式 CH 3 COOH HCN H 2 S 电离常数(25℃) 1.8×10 -5 4.9×10 -10 K 1 =1.3×10 -7
K 2 =7.1×10 -15
25℃时,下列说法正确的是()
A.等物质的量浓度的各溶液pH关系为:pH(CH 3 COONa)> pH(Na 2 S) > pH(NaCN)
B.a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na + )>c(CN - ),则a一定大于b
C.NaHS和Na 2 S的混合溶液中,一定存在c(Na + )+c(H + )=c(OH - )+c(HS - )+2c(S 2- )
D.某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH - )=10 -d mol/L kuangliu161年前1
kuangliu161年前1 -
 smarthhd 共回答了17个问题
smarthhd 共回答了17个问题 |采纳率94.1%C
1年前查看全部
- 弱酸电离常数的测定1乙酸的起始浓度是如何获得的,用甲基红作指示剂可以吗2测定PH值时,为什么要按从稀到浓的次序3如何计算
弱酸电离常数的测定
1乙酸的起始浓度是如何获得的,用甲基红作指示剂可以吗
2测定PH值时,为什么要按从稀到浓的次序
3如何计算未知一元弱酸的电离常数,其测定原理是什么 chang_sang1年前1
chang_sang1年前1 -
 outstarman 共回答了18个问题
outstarman 共回答了18个问题 |采纳率94.4%1年前查看全部
- 已知25℃时,下列酸的电离常数:醋酸:1.75×10-5 氢氰酸:4.93×10-10
已知25℃时,下列酸的电离常数:醋酸:1.75×10-5 氢氰酸:4.93×10-10氢氟酸:7.2×10-4 甲酸:1.77×10-4 则物质的量浓度均为0.1mol•L-1的上述溶液酸性最强的是( )
A.醋酸
B.氢氰酸
C.氢氟酸
D.甲酸 ylvo1年前1
ylvo1年前1 -
 Asgeng 共回答了17个问题
Asgeng 共回答了17个问题 |采纳率100%解题思路:相同浓度的酸,酸的电离常数越大,电解质的酸性越强,据此分析解答.相同浓度的酸,酸的电离常数越大,说明酸的电离程度越大,则酸的酸性越强,根据题意知,氢氟酸的电离平衡常数最大,所以氢氟酸的酸性最强,故选C.
点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查弱电解质的电离,题目难度不大,本题注意电离平衡常数与酸性的强弱判断.1年前查看全部
- 关于电离常数二元弱酸第二步电离时,电离常数小是因为第一步电离对第二步有抑制.但是在带有弱酸酸根的盐中,如碳酸氢钠.为什么
关于电离常数
二元弱酸第二步电离时,电离常数小是因为第一步电离对第二步有抑制.但是在带有弱酸酸根的盐中,如碳酸氢钠.为什么碳酸氢根的电离常数和在碳酸中第二步电离常数一样?明明就没有第一部的抑制吗? 红袖添香_8402021年前2
红袖添香_8402021年前2 -
 samfeiyang 共回答了16个问题
samfeiyang 共回答了16个问题 |采纳率93.8%电离常数是一个只与温度有关的平衡常数,与各离子的浓度无关.所以,H2CO3的二级电离常数和NaHCO3中HCO3-的电离常数是一样的.1年前查看全部
- 若改变所测醋酸溶液的浓度或温度对电离常数有无影响
 可木新田1年前2
可木新田1年前2 -
 jc6vh7iue 共回答了18个问题
jc6vh7iue 共回答了18个问题 |采纳率83.3%改变温度,对电离常数有影响的.1年前查看全部
- 电离常数中水的浓度问题为什么在化学平衡常数时,说对于固体和纯液体浓度认为是1.水也认为是1电离平衡常数类似于化学平衡常数
电离常数中水的浓度问题
为什么在化学平衡常数时,说对于固体和纯液体浓度认为是1.水也认为是1
电离平衡常数类似于化学平衡常数,而在电离平衡时,则认为水的浓度是55.6mol/L,这是为什么?
我也问过一些人但是他们解释中都有些强加给我的观点,让我无法理解透彻.
化学平衡常数的计算,是生成物与反应物的浓度系数次幂之比,本来就是浓度呀,跟质量分数有什么关系呀?
化学平衡常数计算里,固体和纯液体的浓度是常数,并且都看成是1,这是在资料里说过的,原因不详。电离平衡常数计算里,水这个纯液体就不是1了。纠结! baobao11081年前4
baobao11081年前4 -
 克里桑斯美美菊花 共回答了21个问题
克里桑斯美美菊花 共回答了21个问题 |采纳率71.4%老生常谈的是一种理解方法,就是水作为溶剂时,或者其它的液体作为溶剂时,它们的浓度是不会变化的,是一个常数,所以可以归到K里面,因此在表达式中就不再出现它们的浓度了.
如,CH3COOH + H2O H3O+ + CH3COO-
平衡常数,K=[H3O+][CH3COO-]/[CH3COOH][H2O]
但是,由于平衡研究的都是稀溶液,H2O作为溶剂,相当于1L溶液,就是1L水,就是1000mL,就是1000g,就是55.6mol,即H2O的浓度几乎没有变化,一直是55.6mol/L,所以是一个常数.
所以,K*[H2O]=[H3O+][CH3COO-]/[CH3COOH]=Ka
实际上,对于平衡常数K,应当是另一种理解.
高中的平衡常数,是浓度的系数次幂的乘积,所以,从高中的K的定义可以发现K是有单位的,而且单位会与方程式的前后系数之差有关系,是(mol/L)^n,n是生成物的系数之和减去反应物的系数之和.
但是,若是这样的话,那么K就没有一定的原则了,就没法比较了.
所以,K的实际意义是标准平衡常数,是物质的浓度除以标准浓度c.后的数值,再系数次幂的乘积,从这个角度看,K就都是没有单位的了,或者单位是1.
K=([H3O+]/c.)([CH3COO-]/c.)/([CH3COOH]/c.)
c.=1mol/L
所以,H2O等溶剂也有浓度,但是它们的浓度在反应的前后几乎没有变化,是一个常数,所以被归到了K中.1年前查看全部
- 水的电离的水的量浓度如何推算?水的电离的离子积常数等于电离常数乘以水的物质的量浓度,计算时物质的量浓度为常数,这个常数是
水的电离的水的量浓度如何推算?
水的电离的离子积常数等于电离常数乘以水的物质的量浓度,计算时物质的量浓度为常数,这个常数是多少,如何推算.好像推算是55.6.那么这个数值表示的是什么含义?就是说它的意义. 三级用户1年前3
三级用户1年前3 -
 孤独的小子 共回答了18个问题
孤独的小子 共回答了18个问题 |采纳率77.8%1L水的质量是1000g,物质的量为1000g/18g/mol=55.6mol,故表示1L水中H2O的物质的量浓度为55.6mol/L
水的电离方程式为H2O=可逆=H+ + OH-
平衡常数K等于生成物的浓度冥之积除以反应物的浓度冥之积,如此算的话,水的电离平衡常数就是
K=c(H+)c(OH-)/c(H2O)=10^-7x10^-7/55.6
水的浓度55.6mol/L是常数,故Kw=K/55.6=10^-7x10^-7也是常数,也就是水的离子积常数了1年前查看全部
- 电导法如何测醋酸溶液的平衡电离常数
 意儿241年前1
意儿241年前1 -
 lost124125 共回答了20个问题
lost124125 共回答了20个问题 |采纳率95%实验原理:1.电离平衡常数Kc的测定原理在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务.在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为,可以用离子的极限摩尔电导率相加而得.而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力.二者之间有如下近似关系: (1)式中为弱电解质的电离度.对AB型弱电解质,如乙酸(即醋酸),在溶液中电离达到平衡时,其电离平衡常数Kc与浓度c和电离度α的关系推导如下: CH3COOH →CH3COO- + H+ 起始浓度 c 0 0 平衡浓度 c(1-α) cα cα则 (2) 以式(1)代入上式得: (3)因此,只要知道∧m∞和∧m就可以算得该浓度下醋酸的电离常数Kc.将式(2)整理后还可得: (4)由上式可知,测定系列浓度下溶液的摩尔电导率∧m,将∧mc对1/Λm作图可得一条直线,由直线斜率可测出在一定浓度范围内的平均值.2.摩尔电导率∧m的测定原理电导是电阻的倒数,用G表示,单位S(西门子).电导率则为电阻率的倒数,用k表示,单位为G·m-1.摩尔电导率的定义为:含有一摩尔电解质的溶液,全部置于相距为1m的两个电极之间,这时所具有的电导称为摩尔电导率.摩尔电导率与电导率之间有如下的关系.∧m= κ/c (5)式中c为溶液中物质的量浓度,单位为mol·m-3.在电导池中,电导的大小与两极之间的距离l成反比,与电极的面积A成正比.G = κA/ l (6)由(6)式可得κ=Kcell G (7)对于固定的电导池,l和A 是定值,故比值l/A为一常数,以Kcell表示,称为电导池常数,单位为m-1.为了防止极化,通常将铂电极镀上一层铂黑,因此真实面积A无法直接测量,通常将已知电导率κ的电解质溶液(一般用的是标准的0.01000mol·L-1KCl溶液)注入电导池中,然后测定其电导G即可由(7)式算得电导池常数Kcell.当电导池常数Kcell确定后,就可用该电导池测定某一浓度c的醋酸溶液的电导,再用(7)式算出κ,将c、κ值代入(5)式,可算得该浓度下醋酸溶液的摩尔电导率.在这里的求测是一个重要问题,对于强电解质溶液可测定其在不同浓度下摩尔电导率再外推而求得,但对弱电解质溶液则不能用外推法,通常是将该弱电解质正、负两种离子的无限稀释摩尔电导率加和计算而得,即: (8)不同温度下醋酸的值见表1.表1 不同温度下醋酸的 (S·m2·mol-1)温度/K298.2303.2308.2313.2×1023.9084.1984.4894.7791年前查看全部
- 如何通过电离常数来计算溶液的ph值?以HAc 为例,0.1mol/L的HAc溶液电离常数为1.8*10^-5,其ph值为
如何通过电离常数来计算溶液的ph值?以HAc 为例,0.1mol/L的HAc溶液电离常数为1.8*10^-5,其ph值为多少?
 health9271年前1
health9271年前1 -
 liuhong7311 共回答了17个问题
liuhong7311 共回答了17个问题 |采纳率88.2%[H+]=[OAc-]
[HOAc]=0.1mol/L
Ka=[H+][OAc-]/[HOAc]
[H+]=(1.8*10^-5*0.1)^(1/2)mol/L=0.00134mol/L
pH=-lg[H+]=2.87
水电离的H+相对于乙酸电离的可以忽略,而乙酸根的浓度相对于乙酸分子的浓度可以忽略不计1年前查看全部
- 关于化学中的酸碱平衡计算溶液的ph值(是需要考虑电离问题的)0.01mol/L的硫酸溶液 (K=0.012)查过电离常数
关于化学中的酸碱平衡
计算溶液的ph值(是需要考虑电离问题的)
0.01mol/L的硫酸溶液 (K=0.012)
查过电离常数,硫酸只有一个二级电离常数就是0.012,其实是硫酸氢根的电离.
答案是PH=1.84
希望有人能解答 tearsofeos1年前1
tearsofeos1年前1 -
 366966 共回答了14个问题
366966 共回答了14个问题 |采纳率85.7%先是第一步完全电离产生0.01mol的H+,再是第二步,我这不好写,就是很简单的写一下电离方程,下面写上平衡时的浓度(H+为0.01+x,SO42-为x,HSO4-为0.01-x),和K2一起解一个方程,就可以得到结果了,算出的0.01+x即为所要求的H+浓度.1年前查看全部
- 化学竞赛题,求详解1。25℃时水溶液中肼与强酸反应结合一个质子的平衡常数为0.00000003。求肼的碱式电离常数及其共
化学竞赛题,求详解
1。25℃时水溶液中肼与强酸反应结合一个质子的平衡常数为0.00000003。求肼的碱式电离常数及其共轭酸的酸式电离常数。
2.H2O与D20谁的键能大?
3,氯气能溶于水,并与水反应生成次氯酸,氯离子和氢离子。设第一个平衡常数为K1,第二个平衡常数为K2,总反应K3。已知在25℃和氯的分压为100KPa下达成平衡,K3=1.8*10的十次方,溶液里溶解的氯的总量为6.0g/L。若把达成平衡的氯水迅速注入一密闭容器,使溶液占一半的体积(氯无逃逸),问达新平衡时氯气的分压。
 风中超短裙1年前1
风中超短裙1年前1 -
 yanjiushi 共回答了13个问题
yanjiushi 共回答了13个问题 |采纳率76.9%1. 肼结合一个质子:N2H4+H+N2H5+
水电离:H2OH++OH-
肼碱式电离:N2H4+H2ON2H5++OH-,为上面两个的加和,所以Kb=K1*Kw=0.00000003*10^-14=3*10^-22
共轭酸的电离就是第一个反应的逆反应,所以Ka=1/K1=3.33*10^7
2.H2O键能大,因为D的半径比H大1年前查看全部
- 化学中电离常数是什么?怎样计算?
 爱上夏洛特的鱼1年前1
爱上夏洛特的鱼1年前1 -
 小妖00000618 共回答了16个问题
小妖00000618 共回答了16个问题 |采纳率93.8%其定义为,当弱电解质电离达到平衡时,电离的离子浓度的乘积与未电离的分子浓度的比值叫做该弱电解质的电离平衡常数.一种弱电解质的电离平衡常数只与温度有关,而与该弱电解质的浓度无关.因为弱电解质通常为弱酸或弱碱,所以在化学上,可以用Ka、Kb分别表示弱酸和弱碱的电离平衡常数.
用HA表示弱酸,则其电离方程式为HA——H+A,则电离常数Ka=[H]*[A]/HA
电离常数K与电离度α的关系可近似的表示为K=cα2(α平方)其中c为弱电解质溶液的浓度.1年前查看全部
- 谭老师:请问“相同温度下,醋酸在液氨和水中的电离常数的大小关系”应当从什么角度去考虑?
 MIGICAL31年前1
MIGICAL31年前1 -
 t_upb2fdao2e2b 共回答了13个问题
t_upb2fdao2e2b 共回答了13个问题 |采纳率76.9%醋酸与液氨反应,所以电离度增大(100%电离)1年前查看全部
- 苯酚与对苯二酚苯酚和对苯二酚哪个酸性更强,最好给出电离常数
 hybtlp1年前1
hybtlp1年前1 -
 迷失男人 共回答了19个问题
迷失男人 共回答了19个问题 |采纳率94.7%苯酚 Ka = 1.0*10^-10 pKa = 9.98
对苯二酚 Ka = 1.1*10^-10 pKa = 9.96
邻苯二酚 Ka1 = 4.0*10^-10
间苯二酚 Ka1 = 5.0*10^-10
因为对苯二酚是高度对称结构 无极性 苯基吸电子 所以对苯二酚酸性较弱 但是有两个羟基的缘故 略强于苯酚1年前查看全部
- 已知磷酸浓度及其各级电离常数,如何计算磷酸根的浓度?
 harely19791年前1
harely19791年前1 -
 水底双鱼 共回答了16个问题
水底双鱼 共回答了16个问题 |采纳率100%最终的方程可以看作是
H3PO4=PO4(3-)+3H+
K1K2K3=氢离子浓度的立方乘以磷酸根离子浓度
由于只有一种溶质,氢离子浓度等于三倍的磷酸根浓度,代入上式就可得磷酸根离子浓度.1年前查看全部
- 化学中电离常数是什么?怎样计算?
 zhaohy1111年前1
zhaohy1111年前1 -
 zkm520 共回答了12个问题
zkm520 共回答了12个问题 |采纳率66.7%其定义为,当弱电解质电离达到平衡时,电离的离子浓度的乘积与未电离的分子浓度的比值叫做该弱电解质的电离平衡常数.一种弱电解质的电离平衡常数只与温度有关,而与该弱电解质的浓度无关.因为弱电解质通常为弱酸或弱碱,所以在化学上,可以用Ka、Kb分别表示弱酸和弱碱的电离平衡常数.
用HA表示弱酸,则其电离方程式为HA——H+A,则电离常数Ka=[H]*[A]/HA
电离常数K与电离度α的关系可近似的表示为K=cα2(α平方)其中c为弱电解质溶液的浓度.1年前查看全部
- 高中化学----如何用电离常数判断产物
 liuxing3181年前1
liuxing3181年前1 -
 hongwen111 共回答了28个问题
hongwen111 共回答了28个问题 |采纳率82.1%通过K值判断反应产物
电离常数又叫电离平衡常数,用Ki表示.其定义为,当弱电解质电离达到平衡时,电离的离子浓度的乘积与未电离的分子浓度的比值叫做该弱电解质的电离平衡常数.一种弱电解质的电离平衡常数只与温度有关,而与该弱电解质的浓度无关.因为弱电解质通常为弱酸或弱碱,所以在化学上,可以用Ka、Kb分别表示弱酸和弱碱的电离平衡常数.
用HA表示弱酸,则其电离方程式为HA——H+A,则电离常数Ka=[H]*[A]/HA
电离常数K与电离度α的关系可近似的表示为K=cα2(α平方)其中c为弱电解质溶液的浓度.
你可以参考一下如下数据:
盐酸是强酸,HCl在水中几乎是全部电离的
苯酚的电离是C6H5OHC6H5O+H(+)
常数大约是10
碳酸的一级电离,也就是H2CO3HCO3(-)+H(+)
电离常数是6.35
二级电离,也就是HCO3(-)CO3(2-)+H(+)
电离常数是10.33
电离常数反映的就是酸性的大小,电离的能力
电离常数越大,酸性越弱,电离出氢离子的能力越差
而苯酚的电离常数在碳酸和碳酸氢根之间
所以苯酚的酸性小于碳酸,大于碳酸氢根
简单的说,碳酸相对更容易与氢离子分开,形成碳酸氢根和氢离子,而反过来,氢离子和碳酸氢根结合形成碳酸的能力相对要弱一些,而苯酚的氢离子相比碳酸稍难些分离,而氢离子和苯酚根相比碳酸氢根稍容易些结合成苯酚,而碳酸氢根非常难电离出氢离子,而碳酸根相对于苯酚根,非常容易与氢离子结合成碳酸氢根.
【 已知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)要大.则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:
AlO2-+ SO2+ 2 H2O → Al(OH)3↓+HSO3- 】1年前查看全部
- 醋酸电离常数包括考虑醋酸根的水解影响?
 mm橘子1年前1
mm橘子1年前1 -
 爱的图腾 共回答了14个问题
爱的图腾 共回答了14个问题 |采纳率85.7%电离的过程本身已经”涵盖“水解了,
电离常数是电离(包括水的电离)和水解都达到平衡状态下,即各物质的量都稳定时测量的.1年前查看全部
- 分级电离中的电离常数怎么计算?计算各级电离方程中的重复物质的浓度时,按什么取值?
 设计设计再设计1年前1
设计设计再设计1年前1 -
 没人信没人信 共回答了22个问题
没人信没人信 共回答了22个问题 |采纳率90.9%一般地要把反应相加进行计算.中间物质便可以消掉!只要用起始的数值即可1年前查看全部
- 计算电离常数的公式是什么?最好能把公式上的每一项都说明一下……
 cg10401年前1
cg10401年前1 -
 zoeleelu 共回答了20个问题
zoeleelu 共回答了20个问题 |采纳率100%电离出的离子浓度的系数次方的乘积1年前查看全部
- 求碳酸第二步电离的电离常数表达式
求碳酸第二步电离的电离常数表达式
是第二步的. 白小虎1年前1
白小虎1年前1 -
 妖颜魅生 共回答了15个问题
妖颜魅生 共回答了15个问题 |采纳率93.3%K=[H+][CO32-]/[HCO3-]1年前查看全部
- 电导法测定弱电解质的电离常数时为什么要恒温
 vivian-lall1年前1
vivian-lall1年前1 -
 大智慧ddyy 共回答了21个问题
大智慧ddyy 共回答了21个问题 |采纳率95.2%电离常数是温度的函数.1年前查看全部
- 化学离子积,溶度积,电离常数用什么符号表示?
 zhenhaoqi1年前4
zhenhaoqi1年前4 -
 zjzangel 共回答了21个问题
zjzangel 共回答了21个问题 |采纳率85.7%化学离子积Kw,溶度积Ksp,电离常数K1年前查看全部
- 电导率法测定弱电解质的9电离常数实验中,为什么要测量水的电导率?
 一粒猪1年前1
一粒猪1年前1 -
 东化飞天 共回答了20个问题
东化飞天 共回答了20个问题 |采纳率90%水的电导率相对弱电解质的电导率是不能忽略的,因此要测定水的电导率.1年前查看全部
- 同一温度下,弱电解质的电离常数越大,则溶液中的离子浓度越大,但溶液的导电性不一定越强?
同一温度下,弱电解质的电离常数越大,则溶液中的离子浓度越大,但溶液的导电性不一定越强?
离子浓度越大,为什么导电性不一定越强? 小冲风1年前1
小冲风1年前1 -
 a1gm 共回答了20个问题
a1gm 共回答了20个问题 |采纳率95%离子运动才导电啊,有的离子在相同的条件下离子运动有快慢宏观表现出来就是导电性不一样.1年前查看全部
- 在已经平衡的醋酸中 加入冰醋酸 电离常数为什么会下降
在已经平衡的醋酸中 加入冰醋酸 电离常数为什么会下降
实在对不起 同志们 我把电离程度想成电离常数了 非常抱歉 那么又是为什么程度会下降呢? 方陈三十一1年前1
方陈三十一1年前1 -
 jiyanxin 共回答了26个问题
jiyanxin 共回答了26个问题 |采纳率84.6%电离常数只和温度有关,浓度变化不影响(否则干嘛叫常数.)
加入冰醋酸后下降的是电离度,弱酸浓度越高电离度越小
[HAc]==[H]+[Ac]
电离常数Ka=[H]*[Ac]/[HAc]
加入冰醋酸后氢离子浓度上升,为了保持Ka不变,[Ac]/[HAC]就要减小
也可以理解为加入冰醋酸后氢离子浓度增大了,抑制了HAc中氢离子的电离1年前查看全部
- 100度水的电离程度100度时水应该为气态,为何存在电离常数?说错了,是为何存在电离 还有就是为什么在水中加入naoh后
100度水的电离程度
100度时水应该为气态,为何存在电离常数?
说错了,是为何存在电离
还有就是为什么在水中加入naoh后不影响水的电离平衡 coldwind71年前1
coldwind71年前1 -
 iglu 共回答了22个问题
iglu 共回答了22个问题 |采纳率86.4%水作为弱电解质,所以发生微弱的电离1年前查看全部
- 氢氧化镁、氢氧化铝作为弱碱的电离常数是多少?怎么算氯化铝、氯化镁的溶液pH?
 yier19631年前2
yier19631年前2 -
 xzw1210 共回答了31个问题
xzw1210 共回答了31个问题 |采纳率87.1%1这些都是弱电解质,在水的不同温度下溶解度不同,电力常数也是不同,这也只是针对饱和溶液说的,具体情况只能具体来求.K=(Mg2+)X(OH-)/(Mg(OH)2) =(OH-) 即为氢氧根的离子摩尔浓度
()代表摩尔浓度
2 取样品体积Y的相应溶液,蒸干得到M质量固体,如ALCL3,那这个溶液ALCL3分子浓度为N=M/(27+3x35)Y,(AL)=N (OH-)=3N 假设水的电离常数为10-14方 那么水电离出(H+)=10-14/3N(在氢离子浓度远小于溶液中氢氧根浓度时)PH=-Log(10-14/3N)1年前查看全部
- K、Ki、KW分别表示化学平衡常数、电离常数和水的离子积,下列判断正确的是( )
K、Ki、KW分别表示化学平衡常数、电离常数和水的离子积,下列判断正确的是( )
A.25℃时,pH均为4的盐酸和NH4I(aq)中,前者KW一定等于后者
B.室温下K(HCN)<K(CH3COOH),说明相同浓度的溶液CH3COONa溶液的pH值一定比NaCN小
C.在500℃、20MPa、5L的密闭容器中进行合成氨的反应,使用催化剂后K值增大
D.2SO2+O2⇌2SO3平衡后,改变某条件K值不变,SO2的转化率就一定不变 luoye4191年前1
luoye4191年前1 -
 夏天的黄昏 共回答了16个问题
夏天的黄昏 共回答了16个问题 |采纳率100%解题思路:A.温度相同,水的离子积常数相同,与溶液酸碱性无关;
B.相同温度下,酸的电离平衡常数越小,其酸根离子水解程度越大,酸根离子水解程度越大,相同浓度的钠盐溶液的pH越大;
C.化学平衡常数只与温度有关,温度不变化学平衡常数不变;
D.可逆反应中,化学平衡常数不变,说明其温度不变,但不能说明平衡不移动.A.水的离子积常数只与温度有关,与溶液酸碱性无关,温度相同,所以水的离子积常数相同,故A错误;
B.相同温度下,酸的电离平衡常数越小,其酸根离子水解程度越大,酸根离子水解程度越大,相同浓度的钠盐溶液的pH越大,室温下K(HCN)<K(CH3COOH),则水解程度:CN->CH3COO-,所以相同浓度的溶液CH3COONa溶液的pH值一定比NaCN小,故B正确;
C.化学平衡常数只与温度有关,温度不变化学平衡常数不变,催化剂只改变化学反应速率不改变平衡移动,温度不变,其化学平衡常数不变,所以使用催化剂后K值不变,故C错误;
D.2SO2+O2⇌2SO3平衡后,改变某条件K值不变,说明改变条件不是温度,只要改变条件后平衡移动,则SO2的转化率就一定改变,故D错误;
故选B.点评:
本题考点: 离子积常数;化学平衡常数的含义;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查平衡常数含义,平衡常数只与温度有关,与物质浓度、电解质强弱等都无关,知道催化剂不影响平衡移动,只影响反应速率,为易错点.1年前查看全部
- 化学系的前辈,水解常数*电离常数=水的离子积常数,这三者乘积关系是怎样推出的(不要复制)高分
化学系的前辈,水解常数*电离常数=水的离子积常数,这三者乘积关系是怎样推出的(不要复制)高分
我以弱酸HA和它的酸根A-为例子.有人说是约分推出的即:Ka=C(A-)*C(H+)/C(HA),Kh=C(HA)*C(OH-)/C(A-);然后Kh*Ka分子分母相约分,结果为C(H+)*C(OH-)就是Kw即水的离子积常数.但是我认为这个是有漏洞的,因为一定温度下,前者的是酸,C(H+)浓度是大于10的负7次方,后者显碱性,C(OH-)也大于10的负7次方,二者相乘怎么会等于Kw呢?还有一种说法是方程叠加说就是将酸根的水解方程与酸的电离方程相加,消去,然后最后得出水的电离方程式,所以他们就相乘等于Kw了,对于这种说法,我也有一个疑问,就是两个分反应的总反应的离子积常数为何是两个分反应水解、电离常数的乘积呢?为何不是和或商什么的?这是实验公理还是理论推断?我很困惑,老师很脆弱,问他几问,他自己先糊涂了……唉! 曾经ii难为水1年前1
曾经ii难为水1年前1 -
 vvlvv 共回答了20个问题
vvlvv 共回答了20个问题 |采纳率80%是推理出来的.
你第一个推理就错了,弱酸的Kh中c(OH-)肯定小于10的负7次,你忽略了溶液背景是HA弱酸溶液中A-的水解.
按照你写的第一个“有人说”推就是对的.你一定注意,这两个平衡是同一个溶液里的.
你的第二个说法也是对的,因为是在同一溶液里,所以,c(X),X表示溶液中任意粒子,这个值在水解、电离方程式里都是相等的.
你再推推看.1年前查看全部
- (2014•奉贤区二模)在25℃时两种酸的电离常数如下:H2CO3:Ki1=4.2×10-7,Ki2=5.6×10-11
(2014•奉贤区二模)在25℃时两种酸的电离常数如下:H2CO3:Ki1=4.2×10-7,Ki2=5.6×10-11;H2S:Ki1=5.7×10-8,Ki2=1.2×10-15,则下列反应可能发生的是( )
A.NaHCO3+NaHS→Na2CO3+H2S↑
B.H2S+Na2CO3→NaHS+NaHCO3
C.Na2S+H2O+CO2→Na2CO3+H2S↑
D.H2S+NaHCO3→NaHS+H2CO3 江东小甬1年前1
江东小甬1年前1 -
 kikilau161 共回答了21个问题
kikilau161 共回答了21个问题 |采纳率95.2%解题思路:25℃时两种酸的电离常数如下:H2CO3:Ki1=4.2×10-7,Ki2=5.6×10-11;H2S:Ki1=5.7×10-8,Ki2=1.2×10-15,可知碳酸与氢硫酸都是弱酸,电离平衡常数越大,酸性越强,所以酸性H2CO3>H2S>HCO3->HS-,结合强酸制弱酸与物质的性质判断.25℃时两种酸的电离常数如下:H2CO3:Ki1=4.2×10-7,Ki2=5.6×10-11;H2S:Ki1=5.7×10-8,Ki2=1.2×10-15,可知碳酸与氢硫酸都是弱酸,电离平衡常数越大,酸性越强,所以酸性H2CO3>H2S>HCO3->HS-,
A.H2S>HCO3-,不符合强酸制弱酸原理,故A错误;
B.H2S>HCO3-,所以H2S与Na2CO3反应能生成NaHS和NaHCO3,故B正确;
C.H2S>HCO3-,所以H2CO3与Na2S反应不生成Na2CO3,应该生成NaHCO3,故C错误;
D.H2CO3>H2S,所以不能由H2S和NaHCO3生成H2CO3,故D错误.
故选B.点评:
本题考点: 弱电解质在水溶液中的电离平衡;离子反应发生的条件.
考点点评: 本题考查电离平衡常数的运用及酸性强弱的判断,题目难度不大,注意强酸制弱酸原理的应用.1年前查看全部
- 现有0.175mol/L醋酸钠溶液500mL(已知醋酸的电离常数Ka=1.75×10-5)
现有0.175mol/L醋酸钠溶液500mL(已知醋酸的电离常数Ka=1.75×10-5)
(1)写出醋酸钠水解反应的化学方程式______.
(2)下列图象能说明醋酸钠的水解反应达到平衡的是______.
(3)在醋酸钠溶液中加入下列少量物质,水解平衡向正反应方向移动的有______.
A.冰醋酸B.纯碱固体C.醋酸钙固体D.氯化铵固体
(4)在醋酸钠溶液中加入少量冰醋酸后,溶液中微粒浓度的关系式能成立的有______.
A.c(CH3COO-)+c(CH3COOH)>c(Na+) B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)D.c(CH3COO-)>c(H+)>c(OH-)>c(Na+)
(5)欲配制0.175mol/L醋酸钠溶液500mL,可采用以下两种方案:
方案一:用托盘天平称取______g无水醋酸钠,溶于适量水中,配成500mL溶液.
方案二:用体积均为250mL且浓度均为______的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和).
(6)在室温下,0.175mol/L醋酸钠溶液的PH约为______(已知醋酸根的水解反应的平衡常数K=
).Kw Ka(CH3COOH)  woly_wu1年前1
woly_wu1年前1 -
 小小皇马 共回答了19个问题
小小皇马 共回答了19个问题 |采纳率89.5%解题思路:(1)醋酸钠是强碱弱酸盐,醋酸钠水解生成醋酸和氢氧化钠;
(2)醋酸钠溶液中醋酸根离子水解生成醋酸,所以溶液中醋酸根离子浓度逐渐减小直至达到平衡状态,溶液的PH逐渐增大直至不变,水的离子积常数、钠离子数都不变;
(3)增大反应物的浓度或减小生成物浓度,则水解反应向正反应方向移动;
(4)在醋酸钠溶液中加入少量冰醋酸后,溶液中存在物料守恒、电荷守恒,据此解答;
(5)根据m=CVM计算溶质的质量;
(6)根据水解平衡常数K=
进行计算.KW Ka(CH3COOH) (1)醋酸钠水解生成醋酸和氢氧化钠,化学方程式为CH3COONa+H2O⇌CH3COOH+NaOH,故答案为:CH3COONa+H2O⇌CH3COOH+NaOH;
(2)A.钠离子不水解,所以浓度始终不变,故A错误;
B.醋酸根离子开始时水解速率最大,后逐渐减小,平衡时不再变化,故B正确;
C.随着水解的逐渐进行,pH逐渐增大,平衡时不再变化,故C正确;
D.KW是一温度常数,温度不变,KW不变,故D错误;
故选BC;
(3)A.加入冰醋酸溶液中醋酸浓度增大,平衡左移,故A错误;
B.加入纯碱固体,对平衡体系的离子浓度无影响,平衡不移动,故B错误;
C.加入醋酸钙固体,溶液在醋酸根离子浓度增大,平衡右移,故C正确;
D.加入氯化铵固体,铵根离子与水解生成的氢氧根离子结合成一水合氨,使溶液中氢氧根离子浓度减小,平衡右移,故D正确;
故选CD;
(4)A.加入冰醋酸,使醋酸根离子浓度增大,但钠离子浓度不变,所以存在c(CH3COO-)+c(CH3COOH)>c(Na+),故A正确;
B.加入少量冰醋酸,平衡左移,醋酸根离子浓度增大,大于钠离子浓度,故B错误;
C.加入冰醋酸,当溶液中醋酸浓度较大时,醋酸的电离大于醋酸根离子的水解程度,醋酸根离子浓度增大,溶液呈酸性,故C正确;
D.无论是否电离程度大于水解程度,都不会存在c(OH-)>c(Na+),故D错误;
故选AC.
(5)有m=nM=CVM=0.175mol/L×0.5L×82g/mol=7.175g,所以托盘天平称量的质量为7.2g,
醋酸与氢氧化钠等浓度等体积混合,混合后的溶液浓度减半为0.175mol/L,所以原来的浓度为0.35mol/L,
故答案为:7.2;0.35mol/L;
(6)水解平衡常数K=
KW
Ka(CH3COOH)=
c(H+).c(OH−)
c(H+).c(CH3COO−)
c(CH3COOH)=
c2(OH−)
c(CH3COO−)=
10−14
1.75×10−5,C(OH-)=10-3 mol/L,则溶液的pH=9,故答案为:9.点评:
本题考点: 离子浓度大小的比较;化学平衡状态的判断;弱电解质在水溶液中的电离平衡;溶液的配制.
考点点评: 本题考查较综合,涉及水解平衡常数的计算、盐类水解平衡移动方向的判断等知识点,难点是水解平衡常数公式的灵活变换,注意(5)题托盘天平的感量,为易错点.1年前查看全部
- 请教一道求溶液PH值的问题~醋酸的电离常数为2*10^-5,问0.5mol/L的醋酸溶液的PH值是多少?1.02.0 2
请教一道求溶液PH值的问题~
醋酸的电离常数为2*10^-5,问0.5mol/L的醋酸溶液的PH值是多少?
1.0
2.0
2.5
3.0
7.5
不知道电离常数跟PH有什么关系, fatlow1231年前2
fatlow1231年前2 -
 不相信还重名 共回答了17个问题
不相信还重名 共回答了17个问题 |采纳率100%设电离产生的H+的浓度是c,由于电离度很小,醋酸浓度看做近似不变
c^2/0.5=2*10^(-5)
c=10^(-5/2)
pH=-lgc=2.51年前查看全部
- 碳酸的电离常数大于碳酸氢根的电离常数的原因
 浅草茶1年前1
浅草茶1年前1 -
 玻璃塔上的蜗牛 共回答了22个问题
玻璃塔上的蜗牛 共回答了22个问题 |采纳率81.8%碳酸根离子比碳酸氢根离子的极化性强,也就是碳酸根离子比碳酸氢根离子更容易得到氢离子.因此碳酸的电离常数大于碳酸氢根的电离常数.1年前查看全部
- 我想知道,化学平衡常数与电离常数有什么相似处和差异?
 叼那省1年前1
叼那省1年前1 -
 wxp2216680 共回答了21个问题
wxp2216680 共回答了21个问题 |采纳率90.5%化学平衡常数适用一切可逆反应,K为温度常数,K值的大小,表示一定温度下,该反应达到平衡时,反应进行的程度.K值越大,表示反应进行的程度越大.电离平衡常数适用弱电解质在一定条件下的电离平衡.影响电离平衡的因素:a.内因:电解质分子内共价键的键能.键能越大,电离常数越小,键能越小,电离常数越大.b.外因:其他条件一定时,温度越高电离常数越大;温度越低电离常数越小.两个常数都受温度影响,这些公式推导过程相似,同属于物理热力学范畴.多元弱酸(多元弱碱)的各级电离常数逐渐减小且一般差别很大,所以其水溶液中的氢离子(或氢氧根离子)主要是由第一步电离产生.1年前查看全部
- 下列关于弱电解质的说法正确的是:A.弱电解质的相对强弱可由相同温度下的电离常数值的大小来判断 B.同一弱电解质,浓度越大
下列关于弱电解质的说法正确的是:A.弱电解质的相对强弱可由相同温度下的电离常数值的大小来判断 B.同一弱电解质,浓度越大,电离程度越大 C.升高温度,弱电解质的电离程度减小 D.通常,电解质越弱,则其溶液的导电能力就越差
答案给的是第一项 D为什么错 啊宝杯1年前1
啊宝杯1年前1 -
 大头囡囡 共回答了20个问题
大头囡囡 共回答了20个问题 |采纳率95%A、正确.电离常数越小,说明电离趋势越小,说明弱电解质越弱
B、错误.越弱越电离.
C、错误.弱电解质电离吸热,加热促进电离.
D、错误.与浓度有关.很稀的强电解质,很浓的弱电解质,也有可能是 弱电解质导电能力强.
选 A1年前查看全部
- 六大强酸的电离常数多少
 tiihl1年前3
tiihl1年前3 -
 旷野上的猫 共回答了18个问题
旷野上的猫 共回答了18个问题 |采纳率88.9%在水中都很接近100%电离
六大强酸相对强弱(不同资料略有出入)
HClO4>HI>HBr>H2SO4>HCl>HNO3
不过HClO4,HI肯定第一第二
HNO3,HCl肯定是倒数第一第二1年前查看全部
- 碳酸电离常数k1,k2,改变条件使k1减小,k2一定减小.为什么?
 moomoo哞哞1年前1
moomoo哞哞1年前1 -
 我要当老总 共回答了20个问题
我要当老总 共回答了20个问题 |采纳率85%一种弱电解质的电离平衡常数只与温度有关,你因果关系没搞清,k2的减小不是由于k1减小了,而是因为温度改变了.若该弱电解质电离放热,则其电离常数(不管是k1还是k2)随温度升高而降低;若该弱电解质电离吸热,则其电离常数随温度升高而升高.1年前查看全部
- 则此时NH3•H2O的电离常数Kb=……
则此时NH3•H2O的电离常数Kb=……
0.005怎么来的?数据是怎么回事? liangapril1年前1
liangapril1年前1 -
 2008X 共回答了13个问题
2008X 共回答了13个问题 |采纳率46.2%等体积混合后,体积增大一倍,则溶液减小一倍,所以c(Cl-)=0.01/2=0.005mol/L
而c(NH4+)=c(Cl-)=0.005mol/L1年前查看全部
- 某温度下HF的电离常数Ka=3.3×10-4 mol/L,CaF2的溶度积常数Ksp=1.46×10-10(m
某温度下HF的电离常数Ka=3.3×10-4 mol/L,CaF2的溶度积常数Ksp=1.46×10-10(mol/L)3.在该温度下取浓度为0.31mol/L的HF与浓度为0.002mol/L的CaCl2溶液等体积混合.下列说法正确的是( )
A.该温度下,0.31 mol•L HF溶液的pH=2
B.升高温度或增大浓度,HF的电离平衡常数都将增大
C.两溶液混合后不会产生沉淀
D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小 米花饭团ux1年前1
米花饭团ux1年前1 -
 荡漾de花 共回答了19个问题
荡漾de花 共回答了19个问题 |采纳率94.7%解题思路:A.HF为弱电解质,不能完全电离,根据HF的电离常数Ka求算;B.溶度积只受温度的影响;C.根据溶度积计算是否有沉淀生成;加入CaCl2溶液促进HF的电离;D.根据饱和的CaF2溶液加水后变成不饱和溶液.A.电离常数Ka(HF)=3.3×10-4 ,HF为弱电解质,不能完全电离,某温度下,0.1mol•L-1HF溶液中c(H+)=
Ka×c(F−)=
3.3×10−4×0.31mol/L=1×10-2mol/L,所以溶液的pH=2,故A正确;
B.溶度积只受温度的影响,不随浓度的变化而变化,故B错误;
C.某温度下浓度为0.31mol•L-1的HF溶液中c(H+)=c(F-)=1×10-2mol/L,在该温度下将浓度为0.31mol•L-1的HF溶液与浓度为0.0O2 mol•L-1的CaCl2溶液等体积混合,c(F-)=0.5×10-2mol/L,c(Ca2+)=1×10-3mol/L,c2(F-)×c(Ca2+)=0.25×10-4×1×10-3=2.5×10-8>1.46×10-10,该体系中有CaF2沉淀产生,故C错误;
D.饱和的CaF2溶液加水后变成不饱和溶液,所以c(Ca2+)一定比加水前小,故D正确;
故选AD.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了弱电解质电离平衡常数的应用,难溶电解质的溶解平衡的计算和判断,题目难度中等,本题注意把握溶度积常数的计算公式的运用.1年前查看全部
- 电导法如何测醋酸溶液的平衡电离常数
 江北侠客1年前1
江北侠客1年前1 -
 俞辛一起付远方 共回答了24个问题
俞辛一起付远方 共回答了24个问题 |采纳率100%实验原理:1.电离平衡常数Kc的测定原理在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务.在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为,可以用离子的极限摩尔电导率相加而得.而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力.二者之间有如下近似关系:(1)式中为弱电解质的电离度.对AB型弱电解质,如乙酸(即醋酸),在溶液中电离达到平衡时,其电离平衡常数Kc与浓度c和电离度α的关系推导如下:CH3COOH →CH3COO- + H+ 起始浓度 c 0 0 平衡浓度 c(1-α) cα cα则 (2) 以式(1)代入上式得:(3)因此,只要知道∧m∞和∧m就可以算得该浓度下醋酸的电离常数Kc.将式(2)整理后还可得:(4)由上式可知,测定系列浓度下溶液的摩尔电导率∧m,将∧mc对1/Λm作图可得一条直线,由直线斜率可测出在一定浓度范围内的平均值.2.摩尔电导率∧m的测定原理电导是电阻的倒数,用G表示,单位S(西门子).电导率则为电阻率的倒数,用k表示,单位为G·m-1.摩尔电导率的定义为:含有一摩尔电解质的溶液,全部置于相距为1m的两个电极之间,这时所具有的电导称为摩尔电导率.摩尔电导率与电导率之间有如下的关系.∧m= κ/c (5)式中c为溶液中物质的量浓度,单位为mol·m-3.在电导池中,电导的大小与两极之间的距离l成反比,与电极的面积A成正比.G = κA/ l (6)由(6)式可得κ=Kcell G (7)对于固定的电导池,l和A 是定值,故比值l/A为一常数,以Kcell表示,称为电导池常数,单位为m-1.为了防止极化,通常将铂电极镀上一层铂黑,因此真实面积A无法直接测量,通常将已知电导率κ的电解质溶液(一般用的是标准的0.01000mol·L-1KCl溶液)注入电导池中,然后测定其电导G即可由(7)式算得电导池常数Kcell.当电导池常数Kcell确定后,就可用该电导池测定某一浓度c的醋酸溶液的电导,再用(7)式算出κ,将c、κ值代入(5)式,可算得该浓度下醋酸溶液的摩尔电导率.在这里的求测是一个重要问题,对于强电解质溶液可测定其在不同浓度下摩尔电导率再外推而求得,但对弱电解质溶液则不能用外推法,通常是将该弱电解质正、负两种离子的无限稀释摩尔电导率加和计算而得,即:(8)不同温度下醋酸的值见表1.1年前查看全部
- 求0.1mol/L的醋酸溶液的pH(已知醋酸的电离常数=0.000018)求过程
 virgocmg1年前0
virgocmg1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 关于电离常数比如说一道题目醋酸.K1=1.8*10(-5)碳酸.K1=4.3*10(-7)K2=5.6*10(-11)氢
关于电离常数
比如说一道题目
醋酸.K1=1.8*10(-5)
碳酸.K1=4.3*10(-7)
K2=5.6*10(-11)
氢硫酸.K1=9.1*10(-8)
K2=1.1*10(-12)
H3PO4.K1=7.5*10(-3)
K2=6.5*10(-8)
K3=2.2*10(-13)
如果比较H3PO4和H2CO3不是应该拿 碳酸的K1*K2和H3PO4的K1*K2*K3比较么.这样的话酸性不是碳酸强么.(可能问题有点幼稚,但是我化学不好,真的搞不懂) simon浪子1年前2
simon浪子1年前2 -
 suwei0112 共回答了19个问题
suwei0112 共回答了19个问题 |采纳率100%我们用电离常数比较酸性,都是用K1来比较,因为多元酸的第2、3个氢离子更难电离,从同一种酸的K1与k2比较要相差10(5)以上的倍数,所以对H离子的浓度影响很小,可以忽略不计.1年前查看全部
- 判断下面几个电离常数的大小已知如图的几个方程式,假设H2CO3的电离常数K1=a,K2=b,H2S的电离常数K1=c,K
判断下面几个电离常数的大小
已知如图的几个方程式,假设H2CO3的电离常数K1=a,K2=b,H2S的电离常数K1=c,K2=d,则在相同温度下a、b、c、d由小到大的顺序为:
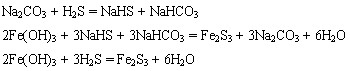
 zhuzhu983111年前1
zhuzhu983111年前1 -
 asdgouwarkjgseg 共回答了14个问题
asdgouwarkjgseg 共回答了14个问题 |采纳率92.9%硫处于第三周期,原子半径较大,外层电子比较松散,与质子结合就比较紧密,不易电离.电离出的S2-和HS-离子的水合能力也不够强.所以其酸性比对应的碳酸还弱.一级电离弱于碳酸的一级电离,二级电离也同样弱于碳酸的二级电离.1年前查看全部
- 氨水电离常数的测定包括试剂用量,相关计算式
 虚花1年前1
虚花1年前1 -
 王者V归来 共回答了19个问题
王者V归来 共回答了19个问题 |采纳率84.2%可以用pH计(注意不是pH试纸,如果没有要用“精密pH试纸”)
就是取1mol/L氨水,然后测定pH
得出[OH-]浓度,然后再计算
K=[OH-]^2/[NH3]1年前查看全部
- (2014•普陀区一模)运用表中电离常数判断可以发生的反应是( )
(2014•普陀区一模)运用表中电离常数判断可以发生的反应是( )
酸 电离常数(25℃) 碳酸 Ki1=4.3×10-7Ki2=5.6×10-11 次溴酸 Ki=2.4×10-9
A.HBrO+Na2CO3→NaBrO+NaHCO3
B.2HBrO+Na2CO3→2NaBrO+H2O+CO2↑
C.HBrO+NaHCO3→NaBrO+H2O+CO2↑
D.NaBrO+CO2+H2O→NaHCO3+HBrO 06062145321年前1
06062145321年前1 -
 永尾丸子 共回答了20个问题
永尾丸子 共回答了20个问题 |采纳率90%解题思路:相同温度下,酸的电离平衡常数越大,酸的酸性越强,一般来说,强酸能和弱酸的盐反应生成弱酸,据此分析解答.相同温度下,酸的电离平衡常数越大,酸的酸性越强,一般来说,强酸能和弱酸的盐反应生成弱酸,根据表中数据知,酸的酸性强弱顺序是:H2CO3>HBrO>HCO3-,
A.HBrO的酸性大于HCO3-,所以HBrO+Na2CO3→NaBrO+NaHCO3能发生,故A正确;
B.酸性H2CO3>HBrO,所以碳酸钠和次溴酸反应不能生成二氧化碳,故B错误;
C.酸性H2CO3>HBrO,所以次溴酸和碳酸氢钠不反应,故C错误;
D.酸性H2CO3>HBrO>HCO3-,所以碳酸钠能和次溴酸钠反应生成碳酸氢钠和次溴酸,故D正确;
故选AD.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了弱电解质的电离,明确酸的电离平衡常数与酸的酸性强弱关系是解本题关键,再结合强酸制取弱酸来分析解答,难度中等.1年前查看全部
- 0.5MOL/L氯化铵的PH值是多少?给出氨水的电离常数是K1.
 heixingjie1年前1
heixingjie1年前1 -
 非繁 共回答了20个问题
非繁 共回答了20个问题 |采纳率90%c(H+) = [ Kh* c(NH4+) ] ^1/2
= [ (Kw / K1)* 0.5 ] ^1/2
= [ 10^-14/ 1.77*10^-5]^1/2
= 2.38 *10^-5
pH = 4.61年前查看全部
- 已知下列弱酸的电离常数:H2CO3:Ka1=4.3×10-7;Ka2=5.61×10-11H2SO3:Ka1=1.51×
已知下列弱酸的电离常数:
H2CO3:Ka1=4.3×10-7;Ka2=5.61×10-11
H2SO3:Ka1=1.51×10-2;Ka2=1.02×10-7
HClO:Ka1=2.95×10-8
下列离子在溶液中结合H+的能力不正确的是( )
A.HCO3->HSO3-
B.CO32->SO32-
C.HCO3->ClO-
D.ClO->HSO3- caozhe2341年前1
caozhe2341年前1 -
 xxyyzzz 共回答了28个问题
xxyyzzz 共回答了28个问题 |采纳率82.1%解题思路:酸的电离常数越大,酸的酸性越强,其阴离子结合氢离子能力越小,据此分析解答.酸的电离常数越大,酸的酸性越强,其阴离子结合氢离子能力越小,酸的电离常数大小顺序是:H2SO3>H2CO3>HSO3->HClO>HCO3-,所以其阴离子结合氢离子能力大小顺序是:CO32->ClO->SO32->HCO3->HSO3-,
所以不正确的是C,故选C.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查弱电解质的电离,明确电离常数、酸性强弱、其阴离子结合氢离子能力之间的关系是解本题关键,难度中等,为易错题.1年前查看全部
- 为什么电离常数与溶液浓度无关既然电离常数可以判断电离程度,而电离程度又跟浓度有关,那为什么电离常数与浓度无关?
 zqlovelylily1年前1
zqlovelylily1年前1 -
 mounianmouri 共回答了17个问题
mounianmouri 共回答了17个问题 |采纳率100%反过来想,否则就不叫常数了.也不需要电离度了.1年前查看全部
大家在问
- 1300道解比例计算题,要计算题,不要应用题.
- 2为什么糖在水中加热溶解度增大?而氧气在水中加热溶解度减少?
- 3求y=(sinx)^2k+(cosx)^2k 的值域
- 4湿润的氨气是氨气还是一水合氨
- 5阅览室里有400本故事书,360本科技书,科技书比故事书少()%,故事书比科技书多()%
- 6扇形的圆心角能不能超过360度
- 7.有人问我王水(混合强酸)是怎么来的,我也不知道怎么来的.为什么人们会发现王水这个东西,又
- 8曲线y= 2sinx在点(π,0)处的切线的斜率为
- 9质量相同的氢气、氮气、氧气和二氧化碳四瓶气体,含分子数最少的是?
- 10多少质量的氢气燃烧才可以产生一吨水?
- 11暖国的雨,向来没有变过冰冷的坚硬的灿烂的雪花.博识的人们觉得他单调,他自己也以为不幸否耶?江南的雪
- 12如图,已知平行四边形ABCD,点P在对角线BD上,EF‖BC,GH‖AB,点E,H,F,G分别是在边AB,BC,CD,A
- 13计算题,三角形坡多长的问题一个台子,高是80cm ,α是10°就是想知道我的这个坡度需要多长,大概就行直角三角形竖着的边
- 14已经集合A={x|(a-1)x^2+3x-2=0},那么是否存在这样的实数a,使得对应的集合A有且仅有两个子集?若存在,
- 15已知集合A={x|-1≤x≤2},B={y|y=2x-a,a属于R,x属于A},C={z|z=x^2,x属于A},是否存

