Fe(oh)2加硫酸加臭氧(O3)反应方程式?
 浪主2022-10-04 11:39:541条回答
浪主2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 xzp25238 共回答了20个问题
xzp25238 共回答了20个问题 |采纳率100%- 6Fe(OH)2+9H2SO4+O3=3Fe2(SO4)3+15H2O
- 1年前
相关推荐
- 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol/L硫酸
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol/L硫酸溶液,其他试剂任选.填写下列空白:

(1)D仪器的名称______,该仪器中需要放入______溶液,B中盛有一定量的NaOH溶液,A中应预先加入的试剂是______,A中反应的离子方程式为______.
(2)实验开始时应先将活塞E______(填“打开”或“关闭”),在C中收到的气体主要为______;待装置中空气排尽后,将活塞E______(填“打开”或“关闭”),此刻B瓶中可能发生的化学反应(用离子方程式表示)是______、______.
(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:______. 冰爽好心情1年前1
冰爽好心情1年前1 -
 遣悲怀三首之二 共回答了18个问题
遣悲怀三首之二 共回答了18个问题 |采纳率88.9%解题思路:(1)D的名称是分液漏斗,该仪器中需要放入液态反应物,A中应预先盛放固态反应物,铁和稀硫酸发生氧化还原反应生成硫酸亚铁;
(2)实验开始时,应先打开活塞,使生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化;
关闭活塞时,A中溶液进入B装置中,A中溶液含有硫酸亚铁,可能含有硫酸,硫酸和硫酸亚铁都和氢氧化钠溶液反应;
(3)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀.(1)D的名称是分液漏斗,该仪器中需要放入液态反应物6mol/L硫酸,A中应预先盛放固态反应物Fe,铁和稀硫酸反应生成硫酸亚铁和氢气,离子反应方程式为:Fe+2H+=Fe2++H2↑,
故答案为:分液漏斗;6mol/L硫酸;Fe;Fe+2H+=Fe2++H2↑;
(2)实验开始时,应先打开活塞,使生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化,氢气不和水反应,所以C中收集的氢气主要是氢气,关闭活塞时,在气体压强的作用下,A中溶液进入B装置中,A中溶液含有硫酸亚铁,可能含有硫酸,硫酸和硫酸亚铁都和氢氧化钠溶液反应,所以发生的离子反应方程式可能为:H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓,
故答案为:打开;H2;关闭;H++OH-=H2O;Fe2++2OH-=Fe(OH)2↓;
(3)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀,所以看到的现象是:白色沉淀先转化为灰绿色最后转化为红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.点评:
本题考点: 制取氢氧化铁、氢氧化亚铁.
考点点评: 本题考查了氢氧化亚铁的制取,难度不大,氢氧化亚铁极易被氧气氧气,所以制取氢氧化亚铁时注意必须在无氧气条件下进行反应,这是高中化学中较重要的一个实验,是学习重点.1年前查看全部
- 制取氢氧化亚铁用Fe2O3、HCl、NaOH、H2O为原料,制取Fe(OH)2.写方程式
 ghost_flame1年前1
ghost_flame1年前1 -
 jiang_zhiting 共回答了20个问题
jiang_zhiting 共回答了20个问题 |采纳率100%2H2O==通电==2H2+O2
Fe2O3+3H2==高温==3H2O+2Fe
Fe+2HClFe(OH)2沉淀+2NaCl
因为氧化铁无法直接转化成二价铁,所以非常麻烦.而且最后一部时最好将溶液煮沸赶走溶解氧,这样效果较好.1年前查看全部
- 下面这些怎么理解?1.CuO,Fe2O3什么颜色?2.Cu(OH)2会分解成什么?Fe(OH)2会分解成什么?3.Na+
下面这些怎么理解?
1.cuo,fe2o3什么颜色?
2.cu(oh)2会分解成什么?fe(oh)2会分解成什么?
3.na+s可能会***?而na+cl2或na+o2不会?
4.ag(co)m(h2)ncx在o2中燃烧,固体增重大于ag;ag(co)m(h2)nox在o2中燃烧,固体增重小于ag,
5.na2o2先与co2反应再与h2o反应? 刘艾云1年前4
刘艾云1年前4 -
 Uruz_7 共回答了23个问题
Uruz_7 共回答了23个问题 |采纳率100%1.黑,红棕
2.难溶性碱加热生成对应氧化物
5.先和CO2反应.若与H2O反应生成NaOH,NaOH与CO2反应又有水不符1年前查看全部
- Fe(OH)3和Fe(OH)2分别和稀硝酸和HI的反应方程式?
 yhf164dlx73d6_1年前2
yhf164dlx73d6_1年前2 -
 -宫- 共回答了16个问题
-宫- 共回答了16个问题 |采纳率81.3%Fe(OH)3+3HNO3==Fe(NO3)3+3H2O
3Fe(OH)2+10HNO3==3Fe(NO3)3+NO↑+5H2O
2Fe(OH)3+6HI==2FeI2+I2+6H2O
Fe(OH)2+2HI==FeI2+2H2O1年前查看全部
- FeSO4加NaOH生成的Fe(OH)2为什么是白色沉淀,2价铁不都是绿色的吗?
FeSO4加NaOH生成的Fe(OH)2为什么是白色沉淀,2价铁不都是绿色的吗?
rt, 受不了啦呀1年前2
受不了啦呀1年前2 -
 kuangfengxiao 共回答了14个问题
kuangfengxiao 共回答了14个问题 |采纳率92.9%水合亚铁离子是绿色的,形成的氢氧化亚铁就不含水合亚铁离子了,就不是绿色的了.1年前查看全部
- 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol/L
 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol/L H2SO4溶液和NaOH溶液.填写下列空白:
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol/L H2SO4溶液和NaOH溶液.填写下列空白:
(1)B中盛有一定量的______,A中应预先加入的试剂是______,A中反应的化学方程式为______.
(2)实验开始时应先将活塞E______(填“打开”或“关闭”),目的是______
(3)A反应一段时间后将活塞E______(填“打开”或“关闭”),目的是______
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化.若反应过程中转移了0.04mol电子,则参加反应的氧气的体积为______L(标准状况). 飞翔秘密1年前1
飞翔秘密1年前1 -
 WAHE2 共回答了23个问题
WAHE2 共回答了23个问题 |采纳率100%解题思路:(1)铁和稀硫酸反应能生成硫酸亚铁和氢气;B中盛有一定量的NaOH溶液;
(2)氢氧化亚铁不稳定,易被空气中氧气氧化生成氢氧化铁,先将活塞E打开需让生成的氢气排走装置和溶液中的空气;
(3)A反应一段时间后将活塞E关闭A装置内气压升高,反应生成的Fe2+沿导管进入B装置与NaOH反应生成白色沉淀Fe(OH)2;
(4)根据化合价的升降判断氧化剂、还原剂,根据转移电子与参加反应的氧气的关系计算气体体积.(1)制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化,需先制取氢氧化亚铁,需用铁和硫酸反应制氢气,关闭活塞E,导致A装置中压强增大使FeSO4溶液被压入B瓶中进行反应生成氢氧化亚铁,所以B中盛有一定量的NaOH溶液;制取硫酸亚铁需要铁屑,所以在烧瓶中应该先加入铁屑,铁和稀硫酸反应的化学方程式为:Fe+H2S04=FeS04+H2↑,
故答案为:NaOH溶液;铁屑;Fe+H2SO4═FeSO4+H2↑;
(2)Fe(OH)2很容易被空气中的氧气氧化,实验开始时应先将活塞E打开,让生成的氢气排走装置和溶液中的空气,并且通过出气口排出,使氢氧化亚铁不能与氧气充分接触,从而达到防止被氧化的目的,
故答案为:打开;让生成的氢气排走装置和溶液中的空气;
(3)A装置中Fe与H2SO4反应生成H2充满整个装置,反应一段时间后关闭活塞E,A装置内气压升高,反应生成的Fe2+沿导管进入B装置与NaOH反应生成白色沉淀Fe(OH)2,
故答案为:关闭;把A中FeSO4溶液压入B中反应;
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,氢氧化亚铁不稳定,容易被空气中的氧气氧化生成红褐色的氢氧化铁,4molFe(OH)2变成4molFe(OH)3失去4mol电子,1mol氧气得到4mol电子,
设转移了0.04mol电子参加反应的氧气在标准状况下的体积为XL,
4Fe(OH)2+O2+2H2O=4Fe(OH)3,电子转移 4e-
22.4L 4mol
xL 0.04mol x=0.224
故答案为:0.224.点评:
本题考点: 制取氢氧化铁、氢氧化亚铁.
考点点评: 本题考查了氢氧化亚铁的制取,氢氧化亚铁极易被氧气氧气,制取氢氧化亚铁时必须在无氧气的条件下进行反应,注意该题(4)转移的电子数目与氧气体积的关系,题目难度中等.1年前查看全部
- 对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H=-444.3kJ•mol-1 △
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H=-444.3kJ•mol-1 △S=-280.1J•mol-1•K-1在常温、常压下反应能自发进行,对反应的方向起决定性作用的是( )
A. 熵变
B. 温度
C. 压强
D. 焓变 覆雨翻云_ss1年前1
覆雨翻云_ss1年前1 -
 8367 共回答了17个问题
8367 共回答了17个问题 |采纳率94.1%解题思路:反应放热,且熵值减小,根据△G=△H-T•△S判断影响因素.反应4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)△H=-444.3kJ/mol,△H<0,且△S<0,
而反应能自发进行,说明△H-T•△S<0,焓变对反应的方向起决定性作用.
故选D.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查焓变和熵变,题目难度不大,注意反应能否自发进行取决于焓变和熵变,注意△G来判断反应的方向.1年前查看全部
- Fe(OH)2固体啥颜色?
 心相印手牵手1年前4
心相印手牵手1年前4 -
 eeeegg 共回答了22个问题
eeeegg 共回答了22个问题 |采纳率86.4%我刚才回答了,怎么没有显示?
1、2楼的人都理解错了
这个东西有固体,白色
但在空气中会先变成绿色,最后变成红棕色.
方程式写下来
4Fe(OH)2+O2+2H2O==4Fe(OH)3
要知道其他物质的颜色,请看我的回答1年前查看全部
- 用铁做电极电解nacl,会有fe(oh)2吗?如果用铅做电极呢?
用铁做电极电解nacl,会有fe(oh)2吗?如果用铅做电极呢?
用铁的话有橙色的沉淀,如果用铅的话有黑色的沉淀,那些沉淀是什么? ceciliapy1年前0
ceciliapy1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2011•佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.
 (2011•佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.
(2011•佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸溜水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入______.
(2)除去蒸馏水中溶解的O2常采用______的方法.
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是______.
方法二:在如图装置中,用NaOH溶液、铁屑、稀NaSO4等试剂制备.
(1)在试管I里加入的试剂是______.
(2)在试管Ⅱ里加入的试剂是______.
(3)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是______. zhouzixin1年前1
zhouzixin1年前1 -
 吕洞宾11 共回答了21个问题
吕洞宾11 共回答了21个问题 |采纳率90.5%解题思路:Fe(OH)2遇到氧气会被氧气氧化成Fe(OH)3,所以在制取氢氧化亚铁时,要隔绝氧气,无论是方法一还是方法二都是隔绝氧气.方法一:(1)用硫酸亚铁晶体配制FeSO4溶液时要防止亚铁离子的水解和被氧气的氧化,所以要加入稀H2SO4来防止水解,加铁屑来防止被氧化,故答案为:稀H2SO4、铁屑;
(2)蒸馏水中的氧气可以通过煮沸的方法除去,故答案为:煮沸;
(3)Fe(OH)2遇到氧气会被氧气氧化成Fe(OH)3,用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,可以避免氢氧化亚铁生成后被氧气氧化,故答案为:避免生成的Fe(OH)2沉淀接触O2;
方法二:(1)铁与硫酸反应生成氢气,关闭止水夹,会使装置Ι中压强变大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁,所以在试管I里加入试剂稀H2SO4、铁屑,获得硫酸亚铁溶液,故答案为:稀H2SO4、铁屑;
(2)试管I里加入试剂稀H2SO4、铁屑,获得硫酸亚铁溶液,并能产生氢气,当氢气使装置Ι中压强变大,使Ι中的药品硫酸亚铁进入Ⅱ中,与Ⅱ中的药品氢氧化钠反应得到氢氧化亚铁,故答案为:NaOH溶液;
(3)试管Ⅰ中反应生成的H2充满了试管I和试管Ⅱ,且外界空气不容易进入,这样获得的氢氧化亚铁可以不被氧气氧化而变质,故答案为:试管Ⅰ中反应生成的H2充满了试管I和试管Ⅱ,且外界空气不容易进入.点评:
本题考点: 铁的氧化物和氢氧化物;制备实验方案的设计.
考点点评: 获得氢氧化亚铁隔绝空气是关键,要求学生学会看图,能看懂题目中所给的装置图,每一部分的作用,只有这样才能明确反应是怎么进行的.1年前查看全部
- na2o2有强化性,能把二价铁氧化成三价铁.可是方程式是fe(oh)2与o2和h2o反应的
na2o2有强化性,能把二价铁氧化成三价铁.可是方程式是fe(oh)2与o2和h2o反应的
怎么不是 fe(oh)2+na2o2的呢,不是na2o2把二价铁氧化的吗?就得跟na2o2反应啊.我很费解 markfox1年前2
markfox1年前2 -
 looksam 共回答了14个问题
looksam 共回答了14个问题 |采纳率92.9%Na2O2溶于水有如下反应:2Na2O2+2H2O=4NaOH+O21年前查看全部
- 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
 某研究性学习小组在研究由fe2+制备fe(oh)2的过程中,设计了如下实验方案:
某研究性学习小组在研究由fe2+制备fe(oh)2的过程中,设计了如下实验方案:
按照右图进行实验,容器a中的反应开始时,活塞c处于打开状态,一段时间后,关闭活塞c,容器a中的反应仍在进行.最终在______容器中观察到白色沉淀(填“a”或“b”)
[探究思考]实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到fe(oh)2如下信息:
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:______资料中提及的微绿色fe3(oh)8,用氧化物的形式表示可写成______.资料名称 物理性质描述 化学性质描述 《化学辞典》,顾翼东编,***年版p637 白色无定形粉末或白色至淡绿色六方晶体 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 《大学普通化学(下册)》傅鹰著p637 白色沉淀 此沉淀易被氧化成微绿色fe3(oh)8 《普通化学教程》(下册)p788 白色 能强烈吸收o2,迅速变成棕色fe(oh)3.这时作为氧化的中间产物为土绿色,其中含有fe2+、fe3+.
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成fe(oh)2•nh2o所致.用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势.
加热时,“方法一”中弹簧夹c应处于打开状态,容器a中的反应须处于发生状态.该实验中支持乙同学观点的化学方程式:fe(oh)2•nh2o
fe(oh)2+nh2o.△ .
(3)欢迎你参加该研究小组的讨论,请提出一种在研究由fe2+制备fe(oh)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路.______. 碰我很危险1年前1
碰我很危险1年前1 -
 yuurui 共回答了17个问题
yuurui 共回答了17个问题 |采纳率70.6%解题思路:根据所设计实验装置,关闭活塞C会使铁与硫酸反应放出的氢气不能排出而致使瓶A内压强增大,A瓶内压强增大使该瓶内溶液压入B瓶,并与B瓶内氢氧化钠发生反应;
(1)根据资料中关于Fe(OH)2与Fe(OH)3的颜色信息,可判断实验中出现的灰绿色或绿色现象既非Fe(OH)2也非Fe(OH)3,而应该是二者混合的结果;根据铁元素的化合价,由物质Fe3(OH)8中铁元素化合价总和应为+8,可推断该物质的分子中含+2价Fe2+一个、+3价Fe3+二个,把铁、氢元素与氧元素结合成氧化物,而改写其化学式;
(3)根据沉淀由“白”变“绿”的现象是由于Fe(OH)2部分被氧化而混入少量的Fe(OH)3的缘故分析,因此可采取向Fe2+和Fe3+的混合液中加入NaOH溶液生成其混合物或直接把两种物质混合,观察颜色的方法以验证沉淀由“白”变“绿”的原因.关闭活塞C,A瓶内铁粉与稀硫酸反应放出的氢气不能排出而使瓶内气体增加,压强逐渐增大,把反应生成的硫酸亚铁溶液压入B瓶内,氢氧化钠与硫酸亚铁发生反应而生成氢氧化亚铁的沉淀;因此,在B瓶内观察到沉淀产生;
(1)由资料信息可知,氢氧化亚铁为白色而氢氧化铁为棕色,二者的混合物呈现出绿色,因此实验中出现灰绿色或绿色的现象应是生成的Fe(OH)2部分被氧化而混入少量的Fe(OH)3的缘故;资料中提及的微绿色Fe3(OH)8,可理解为Fe(OH)2与Fe(OH)3的结合起的一种物质,其中既有+2价铁也有+3价铁,因此改写为氧化物的形式时,8个氢原子应结合成4H2O,所以应写成:FeO•Fe2O3•4H2O;
(3)由于出现的沉淀由白变绿是因为形成了Fe(OH)2与Fe(OH)3的混合沉淀,因此可利用向Fe2+和Fe3+的混合液中直接加入NaOH溶液,反应生成Fe(OH)2与Fe(OH)3的混合沉淀物,观察此时沉淀物的颜色,或直接取Fe(OH)2与Fe(OH)3进行混合,观察混合后颜色的方法,以解释沉淀由“白”变“绿”的现象.
故答案为:
B;
(1)由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3;FeO•Fe2O3•4H2O;
(3)向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色.[或者将Fe(OH)3和Fe(OH)2混合后观察其颜色.](合理答案均给分)点评:
本题考点: 酸、碱、盐的鉴别;化学实验方案设计与评价;有关化学式的计算和推断.
考点点评: 根据实验的装置图及所提供资料的分析,正确理解实验的目的及出现现象的原因,对于解答此新知识的探究型问题是尤其重要的.1年前查看全部
- (2010•北京)医用热敷袋使用时要轻揉,袋内的反应可看作是铁粉、空气和水相互作用,产生氢氧化亚铁[Fe(OH)2],最
(2010•北京)医用热敷袋使用时要轻揉,袋内的反应可看作是铁粉、空气和水相互作用,产生氢氧化亚铁[Fe(OH)2],最终转化为氢氧化铁[Fe(OH)3].下列说法不正确的是( )
A.热敷袋放出的热量是由化学反应产生的
B.总反应为2Fe+O2+3H2O=2Fe(OH)3
C.上述含铁物质中铁元素的化合价有0、+2、+3
D.热敷袋中的铁粉与水在未使用时要分别密封保存 来点实际的不胡扯1年前1
来点实际的不胡扯1年前1 -
 yh1128008 共回答了17个问题
yh1128008 共回答了17个问题 |采纳率88.2%解题思路:分析题干提供的内容,首先是铁粉、空气和水相互作用,产生氢氧化亚铁[Fe(OH)2],然后生成的氢氧化亚铁转化为氢氧化铁.A、热敷袋内的物质为铁粉、空气和水,共同发生化学反应生成氢氧化亚铁,该变化为化学变化,故A正确;
B、该反应中反应前后原子的个数不守恒,故B错误;
C、铁粉中铁为0价,氢氧化亚铁中铁元素为+2价,氢氧化铁中铁为+3价,故C正确;
D、铁粉与水接触,有氧气存在即发生化学反应,所以未使用时要分装,故D正确,
故选B.点评:
本题考点: 金属的化学性质;常见元素与常见原子团的化合价;物质发生化学变化时的能量变化.
考点点评: 本题考查了铁的化学性质,完成此题,要依据已有的知识进行.1年前查看全部
- Fe(OH)2胶体中加HI稀溶液现象是什么?
 cheng2221年前1
cheng2221年前1 -
 qq佳人谁来邀 共回答了12个问题
qq佳人谁来邀 共回答了12个问题 |采纳率100%1.HI是电解质,胶体遇电解质产生沉淀
2.HI溶解了沉淀,接下来Fe3+溶于水使溶液显示黄色
3.2Fe3+ + 2I- = 3Fe2+ + I2 部分碘单质溶于水中颜色变深4.没有 生成的Cl2颜色和Fe3+差不多 不能看到现象1年前查看全部
- 关于fe(oh)2的制备能成功的是.
关于fe(oh)2的制备能成功的是.
A .fecl2滴入naoh
B.feso4滴入氨水
C.在feso4液面下用滴管挤出naoh
D.取新配置的feso4,铺植物油.再用胶头滴管向试管内部加naoh
求原因…… nascacurve1年前1
nascacurve1年前1 -
 狂追十三年 共回答了23个问题
狂追十三年 共回答了23个问题 |采纳率87%选D
因为Fe2+,和氢氧化亚铁都很容易被氧气氧化,所以成功的关键就是怎么让O2最少.
新配的:还没遇到很多O2 .植物油:漂在溶液上面,隔绝O2 .
伸到试管内加氢氧化钠:防止液滴下落时带来O2
而且最好用煮沸的蒸馏水配溶液,除掉水中O21年前查看全部
- 如图1所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化,实验时必须使用铁屑和6mol/L的硫酸,其他
如图1所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化,实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入试剂是______.A中反应的
离子方程式是______.
(2)实验开始时应先将活塞a______(填“打开”、“关闭”).
(3)简述生成Fe(OH)2的操作过程______.
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为______.
(5)下列图2各图示中______能较长时间看到Fe(OH)2白色沉淀.
 zxf121611年前1
zxf121611年前1 -
 公平的眼泪 共回答了25个问题
公平的眼泪 共回答了25个问题 |采纳率100%解题思路:(1)A中应预先盛放固态反应物,铁和稀硫酸发生氧化还原反应生成硫酸亚铁和氢气;
(2)实验开始时,应先打开活塞,使生成的氢气充满整套实验装置中而排出空气,防止氢氧化亚铁被氧化;
(3)关闭活塞时,在气体压强的作用下,A中溶液进入B装置中,A中溶液含有硫酸亚铁,可能含有硫酸,硫酸和硫酸亚铁都和氢氧化钠溶液反应,硫酸亚铁和氢氧化钠溶液反应生成氢氧化亚铁;
(4)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀;
(5)要较长时间保存Fe(OH)2沉淀,只要满足在制取过程中尽可能减少和空气接触即可;(1)A中应预先盛放固态反应物铁屑,铁和稀硫酸反应生成硫酸亚铁和氢气,离子反应方程式为:Fe+2H+=Fe2++H2↑,
故答案为:铁屑;Fe+2H+=Fe2++H2↑;
(2)实验开始时,应先打开活塞,使生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化,
故答案为:打开;
(3)A中反应发生后,为保证硫酸亚铁进入B中和氢氧化钠混合,要借助氢气产生的压强,所以需要关闭活塞a,在气体压强的作用下,A中含有硫酸亚铁溶液被压人B中,硫酸亚铁和氢氧化钠溶液反应,发生的离子反应方程式为:Fe2++2OH-=Fe(OH)2↓,生成Fe(OH)2白色沉淀,
故答案为:关闭活塞a,在气体压强的作用下,A中含有硫酸亚铁溶液被压人B中,硫酸亚铁和氢氧化钠溶液反应;
(4)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀,所以实验完毕,打开b处活塞,放入一部分空气,出现白色沉淀先转化为灰绿色最后转化为红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)根据题中信息可知要较长时间保存Fe(OH)2沉淀,必须在制取过程中尽可能减少和空气接触,对比四个选项明显可以发现选项③、④加入有机物作隔离层和空气接触少,②中Fe和稀硫酸生成氢气能排出装置中的氧气,所以也能减少与氧气接触,而①不能减少与氧气接触,
故答案为:②③④;点评:
本题考点: 制取氢氧化铁、氢氧化亚铁.
考点点评: 本题考查了氢氧化亚铁的制取,题目难度不大,氢氧化亚铁极易被氧气氧气,所以制取氢氧化亚铁时注意必须在无氧气条件下进行反应,这是高中化学中较重要的一个实验,是学习重点.注意4Fe(OH)2+O2+2H2O=4Fe(OH)3.1年前查看全部
- Fe(OH)2的颜色?
 妖精培培1年前11
妖精培培1年前11 -
 tt道哥 共回答了15个问题
tt道哥 共回答了15个问题 |采纳率100%纯氢氧化亚铁是白色的,但一般很难看到,常常见到的是浅绿色.
因为溶液中溶解有氧气且反应体系(开放性的体系)与外界存在着物质交换与能量交换,不断有空气中的氧气溶解到溶液中,新生成的氢氧化亚铁很快就被氧化成氢氧化铁,所以在实验过程中很难观察到有白色的氢氧化亚铁沉淀生成,只能看到被氧化了的氢氧化亚铁与刚生成的氢氧化亚铁组成的混合物:一些灰绿色的絮状沉淀.
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)31年前查看全部
- 向白色的Fe(OH)2沉淀中加入NaOH溶液后,观察到百色沉淀需素变为灰绿色,最后变成红褐色
向白色的Fe(OH)2沉淀中加入NaOH溶液后,观察到百色沉淀需素变为灰绿色,最后变成红褐色
(1)沉淀由白色变为红褐色的化学方程式是
(2)为保持沉淀尽可能保持白色,可采取的措施有: 芷莘20051年前2
芷莘20051年前2 -
 士心5196 共回答了22个问题
士心5196 共回答了22个问题 |采纳率95.5%(1) 4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3
(2)为保持沉淀尽可能保持白色,可采取的措施有:
隔绝空气(如油封),加入还原性物质等1年前查看全部
- 化学,如图为什么不能用图装置制备Fe(OH)2并能较长时间观察其颜色
 sshh1年前1
sshh1年前1 -
 意大利不要哭泣 共回答了12个问题
意大利不要哭泣 共回答了12个问题 |采纳率83.3%因为这里用的是铁做为阴极,而阴极属于保护极,这个装置实际上真正电解的是水,阳极是氢氧根放电,阴极是水提供的氢离子放电
要想制备氢氧化亚铁,只需要把电极互换,让铁电极连接电源正极,从而使铁作为阳极,失电子生成亚铁离子,而碳电极连接电源负极做阴极,让水提供的氢离子放电,溶液中有大量的氢氧根离子聚集到阳极下方,所以在阳极下方产生氢氧化亚铁白色沉淀1年前查看全部
- 用下面两种方法可以制得白色的Fe(OH)2沉淀.
 用下面两种方法可以制得白色的Fe(OH)2沉淀.
用下面两种方法可以制得白色的Fe(OH)2沉淀.
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入少量铁屑,目的是______;
(2)除去蒸馏水中溶解的O2常采用______的方法;
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是______.
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
(1)在试管Ⅰ里加入的试剂是______;
(2)在试管Ⅱ里加入的试剂是______;
(3)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是______(填字母);
A.H2将空气中的氧气反应消耗了.
B.试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,外界空气不容易进入.
(4)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是______. mj小逗号1年前1
mj小逗号1年前1 -
 笨熊8969 共回答了18个问题
笨熊8969 共回答了18个问题 |采纳率88.9%解题思路:方法一(1)FeSO4易被空气中的氧气氧化成硫酸铁,加入铁粉可以防止亚铁离子被氧化;
(2)根据气体的溶解度随温度的升高而减小解答;
(3)氢氧化亚铁不与氧气接触,避免了氢氧化亚铁被氧化成氢氧化铁;
方法二(1)根据实验的基本原理回答,该方法的原理是利用稀H2SO4和铁屑产生氢气,先赶净装置中空气,防止空气中的氧气把二价铁氧化为三价铁,确定赶净空气后再夹紧止水夹,通过H2产生的压强将FeSO4压入NaOH溶液中去,从而产生的白色Fe(OH)2沉淀;
(2)根据(1)的分析可知在试管Ⅱ里加入的试剂为氢氧化钠溶液;
(3)氢气有还原性,可防止空气进入装置把氢氧化亚铁氧化;
(4)根据生成的氢气使装置中的气压变大,才能把反应生成的硫酸亚铁压入氢氧化钠溶液中回答.方法一 (1)配制FeSO4溶液时,需加入稀硫酸和铁屑,目的是抑制Fe2+的水解、防止Fe2+被空气中的O2氧化为Fe3+,
故答案为:防止FeSO4被氧化;
(2)煮沸蒸馏水可除去蒸馏水中溶解的O2,
故答案为:煮沸;
(3)Fe(OH)2很容易被空气中的氧气氧化,实验时生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,
故答案为:避免生成的 Fe(OH)2沉淀接触O2;
方法二(1)试管Ⅰ中提供还原性气体氢气和硫酸亚铁溶液,可用硫酸和铁屑反应生生成,
故答案为:稀H2SO4、铁屑;
(2)试管Ⅱ中应为NaOH溶液,与试管Ⅰ中生成的FeSO4溶液反应生成Fe(OH)2沉淀,
故答案为:NaOH溶液;
(3)由于装置中充满H2,外界空气不易进入,所以沉淀的白色可维持较长时间,故答案为:试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入,所以B正确,
故答案为:B;
(4)打开止水夹,Fe与H2SO4反应生成H2充满整个装置,反应一段时间后关闭止水夹,左侧试管内气压升高,反应生成的Fe2+沿导管进入右侧试管与NaOH反应生成白色沉淀Fe(OH)2;若过早关闭止水夹,使左侧试管中的硫酸压入右侧试管中,将NaOH中和,则得不到Fe(OH)2溶液,
故答案为:检验试管Ⅱ出口处排出的氢气的纯度.当排出的H2纯净时,再夹紧止水夹.点评:
本题考点: 制取氢氧化铁、氢氧化亚铁.
考点点评: 本题考查了氢氧化亚铁的制备方法,题目难度中等,Fe(OH)2很容易被空气中的氧气氧化,这是Fe(OH)2的重要性质,本题是在原有性质基础上进行了改编,设计成了探究型实验题,此题考查的内容比较多,既有水解方面的问题,又有氧化还原方面的问题,还有实验中的实际问题,同时还考查了实验的设计,是一道较好的题目.1年前查看全部
- Fe(OH)2胶体中加HI稀溶液现象是什么?
 seeker1231年前1
seeker1231年前1 -
 hwsun2000 共回答了20个问题
hwsun2000 共回答了20个问题 |采纳率80%1.HI是电解质,胶体遇电解质产生沉淀
2.HI溶解了沉淀,接下来Fe3+溶于水使溶液显示黄色
3.2Fe3+ + 2I- = 3Fe2+ + I2 部分碘单质溶于水中颜色变深4.没有 生成的Cl2颜色和Fe3+差不多 不能看到现象1年前查看全部
- 分用下面两种方法可以制得白色的Fe(OH)2沉淀.
分用下面两种方法可以制得白色的Fe(OH)2沉淀.
方法一:
用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入______.
(2)除去蒸馏水中溶解的O2常采用______的方法.
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是______.
方法二:
在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
(1)在试管Ⅰ里加入的试剂是______.
(2)在试管Ⅱ里加入的试剂是______.
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是______.
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是______. xiaowei18661年前1
xiaowei18661年前1 -
 3692587 共回答了25个问题
3692587 共回答了25个问题 |采纳率88%解题思路:方法一:(1)根据FeSO4易被空气中的氧气氧化和易水解的特点回答.
(2)根据气体的溶解度随温度的升高而减小回答.
(3)根据氢氧化亚铁极易被空气中的氧气氧化成氢氧化铁回答.
方法二:(1)根据实验的基本原理回答,该方法的原理是利用稀H2SO4和铁屑产生氢气,先赶净装置中空气,防止空气中的氧气把二价铁氧化为三价铁.确定赶净空气后再夹紧止水夹,通过H2产生的压强将FeSO4压入NaOH溶液中去,从而产生的白色Fe(OH)2沉淀.
(2)分析同(1).
(3)根据生成的氢气使装置中的气压变大,才能把反应生成的硫酸亚铁压入氢氧化钠溶液中回答.
(4)根据氢气有还原性,可防止空气进入装置把氢氧化亚铁氧化回答.方法一:(1)根据FeSO4具有易被氧化和易水解的特点,在配制其溶液时还需加入稀H2SO4防止 发生水解反应,同时加入铁屑防止硫酸亚铁被氧化.
(2)蒸馏水中若溶有O2,则会加速Fe(OH)2氧化,由于氧气的溶解度随温度的升高而减小,因此可采用加热煮沸的方法除去.
(3)为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的.
方法二:该方法的原理是利用稀H2SO4和铁屑产生氢气,先赶净装置中空气,防止空气中的氧气把二价铁氧化为三价铁.确定赶净空气后再夹紧止水夹,通过H2产生的压强将FeSO4压入NaOH溶液中去,从而使产生的白色Fe(OH)2沉淀在H2的还原性气氛中得以较长时间保持.所以(1)在试管Ⅰ里加入的试剂是稀H2SO4和铁屑,目的是通过二者反应生成氢气;(2)在试管Ⅱ里加入的试剂是NaOH溶液,目的是让它与试管Ⅰ中生成的硫酸亚铁反应,生成氢氧化亚铁沉淀;(3)在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:先检验试管Ⅱ出口处排出的氢气的纯度,防止装置中仍有空气.当排出的H2纯净时,再夹紧止水夹,以便产生高压,把硫酸亚铁溶液压入氢氧化钠溶液中;(4)由于装置中始终充满氢气,外界空气不容易进入,所以Fe(OH)2沉淀能较长时间保持白色.
故答案为:
方法一:
(1)稀H2SO4;铁屑;(2)煮沸;(3)避免生成的Fe(OH)2沉淀接触O2;
方法二:
(1)稀H2SO4;铁屑;(2)NaOH溶液;(3)检验试管Ⅱ出口处排出的氢气的纯度.当排出的H2纯净时,再夹紧止水夹;(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入.点评:
本题考点: 物质的相互转化和制备.
考点点评: 实验方案的设计与评价是化学考查的热点题目之一,难度较大,要加强练习,透彻理解教材上的实验原理,掌握方案设计的基本思路和方法,注重培养对比分析的思维能力,问题便会迎刃而解.1年前查看全部
- Fe(OH)2+H+生成Fe2+的方程式
 yatouangel1年前4
yatouangel1年前4 -
 北溟魚 共回答了19个问题
北溟魚 共回答了19个问题 |采纳率89.5%Fe(OH)2 + 2H+ =Fe2+ + 2H2O1年前查看全部
- 5、下列物质不能通过化合反应制备的是 ( ) A、Fe(NO3)3 B、Fe(OH)3 C、Fe(OH)2 D、 Fe2
5、下列物质不能通过化合反应制备的是 ( ) A、Fe(NO3)3 B、Fe(OH)3 C、Fe(OH)2 D、 Fe2(SO4)3
希望有具体的答案!也不知道是不是题错了! like_winds1年前4
like_winds1年前4 -
 zz二次方 共回答了19个问题
zz二次方 共回答了19个问题 |采纳率100%选ACD?不是吧?
A、不行,复分解反应Fe2O3 + 6 HNO3 = 2 Fe(NO3)3 + 3 H2O
B、可以.Fe(OH)2 + O2 + 2 H2O = 4 Fe(OH)3
C、不行.复分解反应FeCl2 + 2 NaOH = Fe(OH)2↓ + 2 NaCl
D、不行.复分解反应Fe2O3 + 3 H2SO4 = Fe2(SO4)3 + 3 H2O1年前查看全部
- (2014•衡阳模拟)对反应X+3NaOH=3Y+Fe(OH)2↓的分析,不正确的是( )
(2014•衡阳模拟)对反应X+3NaOH=3Y+Fe(OH)2↓的分析,不正确的是( )
A.X中含有三价元素
B.X可能是Fe2O3
C.Y中一定含有钠元素
D.Y可能是NaNO3 ying88481年前1
ying88481年前1 -
 我爱向日葵123 共回答了19个问题
我爱向日葵123 共回答了19个问题 |采纳率94.7%解题思路:根据质量守恒定律中的元素种类不变和元素化合价在复分解反应中不变的特点,可得出本题答案.A、根据质量守恒定律中的元素种类不变,可推知:本题化学方程式中的三价铁元素来自物质X,即X中含有三价铁元素,故对;
B、需要和氢氧化钠反应,所以X必须是可溶性的物质,所以不会是Fe2O3,故错;
C、本题化学方程式中的钠元素一定进入了物质Y中,即物质Y一定含有钠元素,故对;
D、由于钠元素为正一价元素,所以Y中的阴离子一定为负一价的原子或原子团,又由于Y中的阴离子来自X,Y中的阴离子可能是负一价的硝酸根,即Y可能是硝酸钠,故对.
答案:B.点评:
本题考点: 碱的化学性质;质量守恒定律及其应用.
考点点评: 本题主要考查质量守恒定律的应用和元素化合价在复分解反应中的特点,题目稍难.本题能加深学生对质量守恒定律中元素种类不变的认识,同时培养了学生的抽象思维能力.1年前查看全部
- 对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H=-444.3kJ•mol-1 △
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H=-444.3kJ•mol-1 △S=-280.1J•mol-1•K-1在常温、常压下反应能自发进行,对反应的方向起决定性作用的是( )
A. 熵变
B. 温度
C. 压强
D. 焓变 sdubjl1年前1
sdubjl1年前1 -
 停电 共回答了16个问题
停电 共回答了16个问题 |采纳率81.3%解题思路:反应放热,且熵值减小,根据△G=△H-T•△S判断影响因素.反应4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)△H=-444.3kJ/mol,△H<0,且△S<0,
而反应能自发进行,说明△H-T•△S<0,焓变对反应的方向起决定性作用.
故选D.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查焓变和熵变,题目难度不大,注意反应能否自发进行取决于焓变和熵变,注意△G来判断反应的方向.1年前查看全部
- 下列碱不能分解成对应的碱性氧化物和水的是 a.NaOH b.Fe(OH)2 c.Mg(OH)2 d.Al(OH)3
下列碱不能分解成对应的碱性氧化物和水的是 a.NaOH b.Fe(OH)2 c.Mg(OH)2 d.Al(OH)3
希望有详解 弦弦一音1年前3
弦弦一音1年前3 -
 magi_tang 共回答了19个问题
magi_tang 共回答了19个问题 |采纳率94.7%选A,因为强碱是不能分解的,其他选项的弱碱是可以的,你可以倒推,想想都是哪些选项里的氧化物合水反应的,反应是不是可逆的,然后得出结论1年前查看全部
- 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.

(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是______,A中反应的离子方程式是______.
(2)实验开始时就先将活塞E______(填“打开”或“关闭”),C中收集到气体的主要成分是______.
(3)简述生成Fe(OH)2的操作过程______.
(4)拔去装置B中的橡皮塞,使空气进入,预期观察到的现象是:______. 313777771年前1
313777771年前1 -
 oO柴达木Oo 共回答了23个问题
oO柴达木Oo 共回答了23个问题 |采纳率95.7%解题思路:制取氢氧化亚铁使用的试剂是硫酸亚铁和氢氧化钠溶液,但是一定要注意隔绝氧气的氧化,所以B装置中是氢氧化钠,A是产生硫酸亚铁的装置,保证其进入B中,要借助氢气产生的压强,根据实验试剂以及原理来回答分析即可.制取氢氧化亚铁使用的试剂是硫酸亚铁和氢氧化钠溶液,但是一定要注意隔绝氧气的氧化,所以B装置中是氢氧化钠,A是产生硫酸亚铁的装置,可以用金属铁和稀硫酸之间的反应来获得,为保证硫酸亚铁进入B中和氢氧化钠混合,要借助氢气产生的压强.
(1)A中应预先加入的试剂是铁,再滴入酸即可,发生反应为:Fe+2H+=Fe2++H2↑,故答案为:铁屑;Fe+2H+=Fe2++H2↑;
(2)为保证酸顺利滴下,一定在实验开始时就先将活塞E打开,A中反应为:Fe+2H+=Fe2++H2↑,最后产生的氢气被C装置收集,故答案为:打开;H2;
(3)A中反应发生后,为保证硫酸亚铁进入B中和氢氧化钠混合,要借助氢气产生的压强,所以需要关闭活塞E,使硫酸亚铁溶液压入B瓶中进行反应,故答案为:关闭活塞E,使硫酸亚铁溶液压入B瓶中进行反应;
(4)氢氧化亚铁可以被氧气氧化为氢氧化铁,现象是白色沉淀变为灰绿色,最后变为红褐色,故答案为:白色沉淀变为灰绿色,最后变为红褐色.点评:
本题考点: 制取氢氧化铁、氢氧化亚铁.
考点点评: 本题考查了氢氧化亚铁的制取,难度不大,氢氧化亚铁极易被氧气氧气,所以制取氢氧化亚铁时注意必须在无氧气条件下进行反应,这是高中化学中较重要的一个实验,是学习重点.1年前查看全部
- 对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ/mol,且熵减
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ/mol,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是( )
A.焓变
B.温度
C.压强
D.熵变 WARRIOR_ti1年前1
WARRIOR_ti1年前1 -
 yinghuo85 共回答了19个问题
yinghuo85 共回答了19个问题 |采纳率78.9%解题思路:反应放热,且熵值减小,根据△G=△H-T•△S判断影响因素.反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ/mol,△H<0,且△S<0,
而反应能自发进行,说明△H-T•△S<0,焓变对反应的方向起决定性作用.
故选A.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查焓变和熵变,题目难度不大,注意反应能否自发进行取决于焓变和熵变,注意△G来判断反应的方向.1年前查看全部
- 化学反应方程式:FeS+2NaOH=Fe(OH)2+Na2S那里错了?(Fe(OH)2又沉淀符号)
 fffqqq1年前6
fffqqq1年前6 -
 xzyazj 共回答了10个问题
xzyazj 共回答了10个问题 |采纳率100%FeS本身就是沉淀,与NaOH不反应,1年前查看全部
- fecl2如何变成fe(oh)2
 xuzhao1年前3
xuzhao1年前3 -
 基本有点傻 共回答了18个问题
基本有点傻 共回答了18个问题 |采纳率94.4%方程式:FeCl2+2NaOH=Fe(OH)2↓+2NaCl
【注意:环境一定要是还原性的,比如说配制溶液的水,一定要是蒸馏水,然后加试剂的时候要液封.】1年前查看全部
- (2000•江西)Fe(OH)2的读法是( )
(2000•江西)Fe(OH)2的读法是( )
A.一铁氧氢二
B.二氢氧化铁
C.氢氧化亚铁
D.氢氧化铁 cyjuni3211年前1
cyjuni3211年前1 -
 拽拽的原子 共回答了16个问题
拽拽的原子 共回答了16个问题 |采纳率93.8%解题思路:因为OH根的化合价是-1,在Fe(OH)2中Fe元素的化合价是+2,所以Fe(OH)2应读作氢氧化亚铁.A、化合物的读法应倒着读作“某化某”,所以A不正确;
B、OH根是原子团,原子团的数目一般不读出,所以B不正确;
C、由化学式Fe(OH)2知,Fe元素的化合价是+2,所以Fe(OH)2应读作氢氧化亚铁,故C正确;
D、氢氧化铁中Fe元素为+3,所以D不正确.
故选C.点评:
本题考点: 化学式的书写及意义.
考点点评: 本题是通过化学式推某元素的化合价,同时应掌握+2价的铁元素和+3价的铁元素的读法.1年前查看全部
- 铁锈的形成的过程写化学方程式.还有Fe(OH)2不稳定 然后 会和O2反应?生成什么.
 卿本嫁人1年前1
卿本嫁人1年前1 -
 拔剑依沧海 共回答了29个问题
拔剑依沧海 共回答了29个问题 |采纳率93.1%2 Fe+2H20+O2=2Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)31年前查看全部
- Fe(OH)2如何制取 设计为电解池阳极为铁,阴极为碳
 dfjh5741年前1
dfjh5741年前1 -
 hgh626288 共回答了19个问题
hgh626288 共回答了19个问题 |采纳率100%那么,生成Fe(OH)2所需的OH-从哪里来呢,就是从电解水来,
就是说 阳极:Fe-2e-=Fe2+ 阴极:2H2O +2e-=H2+ 2OH-
(然后Fe2+再和OH-反应.)
总式:Fe+H2O ===== Fe(oH)2 +H2
但是,一般的水导电性差,所以会以稀的食盐水代替,你问为什么用稀的盐水.那是因为,浓的话,CL-也会放电生成Cl2,这与你平时学的理论有所不同,一般我们都会认为是Fe先放电,直到Fe消耗完CL-才放电.其实在实际中不是这样的.浓度增大,可以提高某种物质的放电能力;浓度减少,可以减弱某种物质的放电能力(至于具体能使放电能力增大多少,你要在大学才会学).
由于Fe(OH)2易被空气氧化,因此,在铁上才会加入苯,来隔绝空气.不仅如此,还会在反应前把电解液煮沸(驱除溶解氧).为了防止在反应的过程中氧气再进入,除了在铁上加入苯,还会在溶液上加上苯(或之类比水轻不溶于水的有机物),因为Fe(OH)2是在溶液中间生成,而不是在铁电极上生成,只在铁上加入苯是不够的.1年前查看全部
- FeSO4+NH3.H2O=Fe(OH)2+NH4SO4
FeSO4+NH3.H2O=Fe(OH)2+NH4SO4
这方程可行的吗? 9851231年前1
9851231年前1 -
 天之Ss虎 共回答了17个问题
天之Ss虎 共回答了17个问题 |采纳率100%这是一个复分解反应,不是氧化还原反应,复分解反应化合价没升降,题好像出错了.但是Fe(OH)2不稳定,遇空气会氧化成Fe(OH)3!1年前查看全部
- Nio2+Fe+2H2O=Fe(OH)2+Ni(OH)2发生氧化反应的物质
 sphoar1年前1
sphoar1年前1 -
 空心树被占用 共回答了16个问题
空心树被占用 共回答了16个问题 |采纳率93.8%铁做还原剂,1mol铁失去2mol电子,NiO2做氧化剂,相应的得2电子1年前查看全部
- 铁做阳极电解饱和的NaCl的总反应为什么不是 Fe+2H2O=Fe(OH)2+H2
 wuliao11081年前3
wuliao11081年前3 -
 沉没的夜叉 共回答了11个问题
沉没的夜叉 共回答了11个问题 |采纳率100%总反应就是:Fe+2H2O=Fe(OH)2+H2
怎么不是?1年前查看全部
- 在制备Fe(OH)2时,为什么要用新制备的FeSO4溶液
 milier19801年前3
milier19801年前3 -
 torrytong 共回答了14个问题
torrytong 共回答了14个问题 |采纳率100%如果是旧的FeSO4溶液,Fe2+有可能被空气中的氧气氧化成了Fe3+
所是要用新制的FeSO4溶液1年前查看全部
- (2011新课标全国卷)铁镍蓄电池又称爱迪生电池,放电反应 Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
(2011新课标全国卷)铁镍蓄电池又称爱迪生电池,放电反应 Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2 则
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
正极反应是不是 Ni2O3+2H+H2O+2e-==2Ni(OH)2
A项的碱性溶液是怎么推出来的 绿豆荚1年前2
绿豆荚1年前2 -
 爱的无厘头 共回答了25个问题
爱的无厘头 共回答了25个问题 |采纳率96%这道题是让选错误的吧?只有C是错的,其他都是对的
放电时,正极反应 Ni2O3 + 3H2O + 2e- = 2Ni(OH)2 + 2OH-
负极反应 Fe + 2OH- - 2e- = Fe(OH)2
充电时,阳极反应 2Ni(OH)2 + 2OH- -2e- = Ni2O3 + 3H2O
阴极反应 Fe(OH)2 + 2e- = Fe + 2OH-
A对,电解液是碱性的,因为有放电反应可以看出,生成物为Fe(OH)2和Ni(OH)2,这两种产物在酸性条件下会溶解,在碱性条件下才会生成.从放电反应可以看出,Fe失去电子,是负极;Ni2O3得到电子,是正极.
BD都对,参见我写的反应式
C错,从充电的阴极反应可以看出,阴极区有OH-生成,pH是升高的1年前查看全部
- 1、一块铁铝合金与足量盐酸反应,加入过量NaOH溶液后,最终产物是( )A、Fe(OH)2和Al(OH)3 B、Fe(O
1、一块铁铝合金与足量盐酸反应,加入过量NaOH溶液后,最终产物是( )A、Fe(OH)2和Al(OH)3 B、Fe(OH)3和Al(OH)3 C.Fe(OH)3和NaAlO2 D.Fe(OH)2和NaAlO2答案C
 hismsc1年前5
hismsc1年前5 -
 似猫乃虎 共回答了18个问题
似猫乃虎 共回答了18个问题 |采纳率94.4%铁铝合金与足量盐酸反应:
Fe + 2 HCl = FeCl2 + H2↑
2 Al + 6 HCl = 2 AlCl3 + 3 H2↑
加入 过量 NaOH
FeCl2 + 2 NaOH = Fe(OH)2 ↓ + 2 NaCl
4 Fe(OH)2 +O2 + 2 H2O = 4 Fe(OH)3(氢氧化亚铁不稳定,极易氧化)
AlCl3 + 3 NaOH = Al(OH)3 ↓ + 3 NaCl
Al(OH)3 + NaOH = NaAlO2 + 2 H2O
选择C1年前查看全部
- 制取Fe(OH)2时为什么可以将有NaOH溶液的滴管插入盛有FeSO4溶液的试管中?
 ecardtoon1年前4
ecardtoon1年前4 -
 天子挟 共回答了25个问题
天子挟 共回答了25个问题 |采纳率92%方程NAOH中带有O2`使氢氧化亚铁被氧化成氢氧化铁,使实验失败,制作时可以往溶液里加些铁粉,或者是更换实验装置,``因为没图,把原理说了,就是反应生成气体,把NAOH溶液沿导管压向装有硫酸亚铁的仪器里,记得一开始要打开止水夹先排进容器里的空气,至于选择什么生成气体,随便你`只要生成H2就可以了~!1年前查看全部
- 在实验室制取Fe(OH)2在实验室中 怎么制取Fe(OH)2
 本人2情1年前2
本人2情1年前2 -
 supergua 共回答了17个问题
supergua 共回答了17个问题 |采纳率82.4%实验内容
氢氧化亚铁的制备实验
操作方法
在试管里注入少量新制备的硫酸亚铁溶液,再向其中滴入几滴煤油,用胶头滴管吸取氢氧化钠溶液,将滴管尖端插入试管里溶液液面下,逐滴滴入氢氧化钠溶液,观察现象.另外,为使氢氧化亚铁的制备成功,先将硫酸亚铁溶液加热,除去溶解的氧气.
现象
滴入溶液到硫酸亚铁溶液中有白色絮状沉淀生成.白色沉淀放置一段时间,振荡后迅速变成灰绿色,最后变成红褐色.1年前查看全部
- 为什么Fe(OH)2呈白色?三价二价铁离子不是浅绿色吗?
 鱼素素1年前1
鱼素素1年前1 -
 傲气狂魔 共回答了17个问题
傲气狂魔 共回答了17个问题 |采纳率100%颜色和粒子是有关的,亚铁离子的显色是亚铁离子的特殊形式有关的,现在变成了沉淀,粒子变了,所以不一定有之间相关.事实上,颜色是跟粒子对光子的影响有关的.1年前查看全部
- 医用热敷袋使用时要轻揉,袋内的反应可看作是铁粉、空气和水相互作用,产生氢氧化亚铁[Fe(OH)2],最终转化为氢氧化铁[
医用热敷袋使用时要轻揉,袋内的反应可看作是铁粉、空气和水相互作用,产生氢氧化亚铁[Fe(OH)2],最终转化为氢氧化铁[Fe(OH)3].下列说法不正确的是( )
A. 热敷袋放出的热量是由化学反应产生的
B. 总反应为2Fe+O2+3H2O=2Fe(OH)3
C. 上述含铁物质中铁元素的化合价有0、+2、+3
D. 热敷袋中的铁粉与水在未使用时要分别密封保存 eong1年前1
eong1年前1 -
 智成爱立学 共回答了20个问题
智成爱立学 共回答了20个问题 |采纳率90%解题思路:分析题干提供的内容,首先是铁粉、空气和水相互作用,产生氢氧化亚铁[Fe(OH)2],然后生成的氢氧化亚铁转化为氢氧化铁.A、热敷袋内的物质为铁粉、空气和水,共同发生化学反应生成氢氧化亚铁,该变化为化学变化,故A正确;
B、该反应中反应前后原子的个数不守恒,故B错误;
C、铁粉中铁为0价,氢氧化亚铁中铁元素为+2价,氢氧化铁中铁为+3价,故C正确;
D、铁粉与水接触,有氧气存在即发生化学反应,所以未使用时要分装,故D正确,
故选B.点评:
本题考点: 金属的化学性质;常见元素与常见原子团的化合价;物质发生化学变化时的能量变化.
考点点评: 本题考查了铁的化学性质,完成此题,要依据已有的知识进行.1年前查看全部
- 下列装置能达到实验目的是 A.干燥氨气 B.实验室制取氨气 C.制备纯净的Fe(OH)2 D.用乙醇提取碘水中的碘A.A
下列装置能达到实验目的是
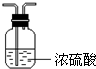
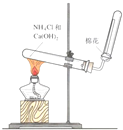
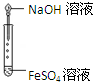
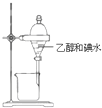
A.干燥氨气 B.实验室制取氨气 C.制备纯净的Fe(OH)2 D.用乙醇提取碘水中的碘
A.A
B.B
C.C
D.D 麦兜的故事1年前1
麦兜的故事1年前1 -
 骂骂人跳跳舞 共回答了19个问题
骂骂人跳跳舞 共回答了19个问题 |采纳率84.2%解题思路:A.浓硫酸与氨气反应;
B.氯化铵与氢氧化钙加热反应生成氨气,氨气利用向下排空气法收集,棉花浸有稀硫酸可防止氨气逸出;
C.生成的氢氧化亚铁易被氧化;
D.乙醇与水不分层.A.浓硫酸与氨气反应,则不能利用浓硫酸干燥氨气,故A错误;
B.氯化铵与氢氧化钙加热反应生成氨气,氨气利用向下排空气法收集,棉花浸有稀硫酸可防止氨气逸出,图中制取氨气的方案合理,故B正确;
C.胶头滴管应伸到液面下,且生成的氢氧化亚铁易被氧化,没有隔绝空气,故C错误;
D.乙醇与水不分层,不能作萃取剂,故D错误;
故选B.点评:
本题考点: 化学实验方案的评价.
考点点评: 本题考查化学实验方案的评价,为高频考点,把握实验装置图的作用、物质的性质为解答的关键,侧重干燥、物质制备、萃取等实验操作和原理的考查,注意实验的操作性、评价性分析,题目难度不大.1年前查看全部
- 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑和6mol•L-1的硫酸,其他试
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑和6mol•L-1的硫酸,其他试剂任选.填写下列空白:

(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是______,A中反应的离子方程式是______.
(2)实验开始时应先将活塞E______(填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是______.
(3)关闭活塞E及分液漏斗上的活塞加入适量硫酸,硫酸与铁屑接触后产生气体.待收集到足量气体后关闭活塞E,现象是______.
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:______. sk1982751年前1
sk1982751年前1 -
 lihaitie 共回答了27个问题
lihaitie 共回答了27个问题 |采纳率92.6%解题思路:(1)A中应预先盛放固态反应物,铁和稀硫酸发生氧化还原反应生成硫酸亚铁和氢气;
(2)实验开始时,应先打开活塞,使生成的氢气充满整套实验装置中而排出空气,防止氢氧化亚铁被氧化;C中的气体的主要成分为铁和稀硫酸反应生成的氢气;
(3)关闭活塞时,在气体压强的作用下,A中溶液进入B装置中,A中溶液含有硫酸亚铁,可能含有硫酸,硫酸和硫酸亚铁都和氢氧化钠溶液反应.
(4)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀.(1)A中应预先盛放固态反应物铁屑,铁和稀硫酸反应生成硫酸亚铁和氢气,离子反应方程式为:Fe+2H+=Fe2++H2↑,
故答案为:铁屑;Fe+2H+=Fe2++H2↑;
(2)实验开始时,应先打开活塞,使生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化;氢气不和水反应,所以C中收集的氢气主要是铁和稀硫酸反应生成的氢气,
故答案为:打开;H2;
(3)关闭活塞时,在气体压强的作用下,A中溶液进入B装置中,A中溶液含有硫酸亚铁,硫酸亚铁都和氢氧化钠溶液反应.发生的离子反应方程式为:
Fe2++2OH-=Fe(OH)2↓,因此B中产生白色沉淀,
故答案为:A中液面逐渐沿导管上升并进入B中,产生白色沉淀;
(4)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀,所以看到的现象是:白色沉淀先转化为灰绿色最后转化为红褐色,反应方程式为:
4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.点评:
本题考点: 制取氢氧化铁、氢氧化亚铁.
考点点评: 本题考查了氢氧化亚铁的制取,难度不大,氢氧化亚铁极易被氧气氧气,所以制取氢氧化亚铁时注意必须在无氧气条件下进行反应,这是高中化学中较重要的一个实验,是学习重点.1年前查看全部
- 铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2.下列有关该电池
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2.下列有关该电池的说法不正确的是( ).
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH- -2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH- -2e-=Ni2O3+3H2O 依然拉拉1年前6
依然拉拉1年前6 -
 cash518584 共回答了25个问题
cash518584 共回答了25个问题 |采纳率100%由放电时的反应可以得出铁做还原剂失去电子,
Ni2O3做氧化剂得到电子,因此选项AB均正确;
充电可以看作是放电的逆过程,即阴极为原来的负极,
所以电池放电时,负极反应为:Fe + 2OH--2e-=== Fe(OH)2,
所以电池充电过程时阴极反应为Fe(OH)2 + 2e-=== Fe + 2OH-,
因此电池充电过程中,阴极附近溶液的pH会升高,C不正确;同理分析选项D正确.
选择C1年前查看全部
- 已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化成Fe(OH)3红褐色沉淀.右图为Fe(OH)2制备实验的改进
已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化成Fe(OH)3红褐色沉淀.右图为Fe(OH)2制备实验的改进装置,使用该装置能在较长时间内观察到生成的Fe(OH)2白色絮状沉淀.
(2)A试管中反应开始时,打开止水夹,B试管中看到的现象是
(3)若要在该装置中得到Fe(OH)2白色絮状沉淀,并在一定时间内放置被氧化成Fe(OH)3红褐色沉淀,下一步的实验操作是
答案是(2)导管口有气泡产生(3)关紧止水夹
分析下
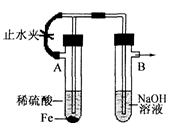
 kuangkuangtang1年前6
kuangkuangtang1年前6 -
 atxdx 共回答了18个问题
atxdx 共回答了18个问题 |采纳率88.9%A试管中反应:Fe+H2SO4=FeSO4+H2,打开止水夹,氢气经左边的支管到B中的溶液中,再从溶液中逸出,赶走了B中的空气
关闭止水夹后,A中氢气在试管A中使得A中压强增大,把FeSO4溶液经中间导管压到B中,与氢氧化钠反应,没有氧气故见到白色沉淀1年前查看全部
- 某化工厂排出的废水中含有AgNO3、Ba(NO3)2、Cu(NO3)2重金属盐,已知白色的Fe(OH)2固体在潮湿的空气
某化工厂排出的废水中含有AgNO3、Ba(NO3)2、Cu(NO3)2重金属盐,已知白色的Fe(OH)2固体在潮湿的空气中的水、氧气反应可生成红褐色的Fe(OH)3,某同学设计了一个除去废水中重金属离子的实验方案如下:
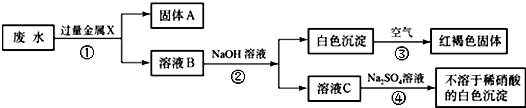
(1)固体A中一定含有的物质为______(写化学式).
(2)B溶液中的溶质一定含有______(写化学式).
(3)请写出③、④的化学方程式:______、______. 水ww泉1年前1
水ww泉1年前1 -
 yetta2008 共回答了25个问题
yetta2008 共回答了25个问题 |采纳率84%解题思路:由题中的框图可知:已知红褐色固体是氢氧化铁,可知X是金属铁,铁把银、铜置换出来,故固体A为Ag、Cu、Fe;又由于加入过量的铁和出现的白色沉淀,所以B溶液中一定有Fe(NO3)2和Ba(NO3)2.书写化学方程式时要注意配平和沉淀符号.(1)由题中的图知:废水加过量固体X,然后向滤液中加氢氧化钠,产生白色沉淀又变成红褐色沉淀,由题中信息知白色沉淀是氢氧化亚铁,红褐色沉淀是氢氧化铁;可知金属X是铁,废水中含有银离子、钡离子和铜离子,铁可将银离子和铜离子置换出来,还有过量的铁,所以固体A中一定含有Fe、Ag和Cu;
(2)溶液中含有没参加反应的硝酸钡和生成的硝酸亚铁,硝酸铜和硝酸银完全被过量的铁置换出来,所以B溶液中的溶质一定含有Fe(NO3)2、Ba(NO3)2;
(3)反应③是白色的Fe(OH)2固体在潮湿的空气中的水、氧气反应可生成红褐色的Fe(OH)3,因此反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
溶液C为Ba(NO3)2,加入硫酸钠发生反应的方程式为:Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3.
故答案为:(1)Fe、Cu、Ag;(2)Ba(NO3)2、Fe(NO3)2;(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3;Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3 .点评:
本题考点: 物质的鉴别、推断;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.1年前查看全部
大家在问
- 1在平面直角坐标系中,△ABC的边AB在x轴上,且AB=3,点A的坐标为(-5,0),点C的坐标为(2,5).
- 2什么是频率?为什么周期和频率互为倒数? 解释一下~谢谢!谁能告诉下 周期和频率的严格定义!
- 3先化简 再求值:[4(xy-1)^2-(xy+2)(2-xy)]1/4xy,其中x=-2,y=1/2
- 4要改变父母子女之间的关系,当代青少年要多与父母交谈,掌握一些同父母交往的技巧。这些技巧包括 [ &
- 5The bank on this street.可不可以说是The bank at this street.
- 6检验碳酸钠为什么用氯化钡不用氯化钙
- 7歇后语:火车拉汽笛___()?如题
- 8(2013•丹徒区二模)某一个生态系统中的水受到污染,对其它生态系统没有什么影响.______.(判断对错)
- 9110人参加体育达标测试,有三人不及格,及格率是多少
- 10已知y1=2x平方-3X+1,y2=4x平方+4x+7,求x为何值时,y1=y2
- 11已知f(x)=x 3 -ax在[1,+∞)上是单调增函数,则a的最大值是______.
- 121.A:Does she draw______?画画 好看
- 13it forms lakes and o-----.we can f----water everywhere.A----
- 14我在北极光下 作者描述的北极光的出现,按时间顺序分为(),(),和()三个阶段.
- 15英语翻译zara(某西班牙服装品牌公司)组织结构 1 zara(某西班牙服装品牌公司)的组织结构中各个部门的分布过于趋于
