在200 mL含Mg 2+ 、Al 3+ 、NH 4 + 、H + 、Cl - 等离子的溶液中,逐滴加入4mol/L的氢
 david8806292022-10-04 11:39:541条回答
david8806292022-10-04 11:39:541条回答| 在200 mL含Mg 2+ 、Al 3+ 、NH 4 + 、H + 、Cl - 等离子的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是() 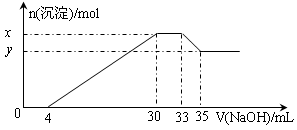
|

已提交,审核后显示!提交回复
共1条回复
 油油o 共回答了18个问题
油油o 共回答了18个问题 |采纳率94.4%- D
- 1年前
相关推荐
- 某工厂的污水中含有Zn2 ,Cu2 ,Hg2 ,Fe2 等离子,为了充分利用资源和保护环境,需要回收污水中的铜和汞.请你
某工厂的污水中含有Zn2 ,Cu2 ,Hg2 ,Fe2 等离子,为了充分利用资源和保护环境,需要回收污水中的铜和汞.请你设计一个回收的实验方案,要求写明简要的操作步骤和有关化学反应方程式或离子方程式.
在线等! 光明顶传檄使1年前1
光明顶传檄使1年前1 -
 pxqs2008 共回答了16个问题
pxqs2008 共回答了16个问题 |采纳率100%①取污水加过量的铁粉,充分搅拌后过滤,可得滤渣,即铜、汞及残留铁粉的混合物:
Cu2+ + Fe=Fe2+ + Cu Hg2+ + Fe=Hg + Fe2+
②用过量稀盐酸洗涤滤渣,过滤,再用水洗涤滤渣,即得Cu和Hg的混合物:
Fe + 2H+ = Fe2+ + H2(气体符号)
③加热Cu和Hg的混合物,汞变成蒸气,经冷却装置,可回收汞,同时铜被氧化为CuO:
2Cu+O2==加热==2CuO
④用氢气还原CuO,可回收铜:
CuO+H2==加热==Cu+H2O
望采纳o,亲!1年前查看全部
- 某厂的酸性工业废水中含有一定量的FE3+\CU2+\CU3+等离子,
某厂的酸性工业废水中含有一定量的FE3+CU2+CU3+等离子,
工业废水①铁屑→A(→E)②稀硫酸?作用是什么? koni421年前1
koni421年前1 -
 蛙子 共回答了17个问题
蛙子 共回答了17个问题 |采纳率100%1、加Fe是为了把Cu都析出,先除去Cu2+,并把Fe3+转化为Fe2+,便于下一步处理
2、加稀H2SO4是为了把剩余的过量Fe除去,便于下一步处理1年前查看全部
- 8.在pH=5.0时, 用EDTA溶液滴定含有Al3+,Zn2+,Mg2+和大量F-等离子的溶液, 已知lgK(AlY)
8.在pH=5.0时, 用EDTA溶液滴定含有Al3+,Zn2+,Mg2+和大量F-等离子的溶液, 已知lgK(AlY)=16.3, lgK(ZnY)=16.5, lgK(MgY)=8.7, lgY(H)=6.5, 则测得的是 ( )
(A) Al,Zn,Mg总量 (B) Zn和Mg的总量
(C) Zn的含量 (D) Mg的含量
配位滴定的条件是什么? 双色枫叶1年前2
双色枫叶1年前2 -
 xuchunyu520 共回答了24个问题
xuchunyu520 共回答了24个问题 |采纳率95.8%你是华理的吧?
有F-在,铝离子和镁离子会被掩蔽,分析化学书122页表5-5,自己看吧1年前查看全部
- (2014•宿迁模拟)三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2
(2014•宿迁模拟)三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF.下列有关该反应的说法正确的是( )
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体 hme2gxd61年前1
hme2gxd61年前1 -
 lililiyong 共回答了24个问题
lililiyong 共回答了24个问题 |采纳率91.7%解题思路:3NF3+5H2O=2NO+HNO3+9HF反应中,只有N元素的化合价发生变化,NF3既是氧化剂又是还原剂,从化合价的变化的角度分析氧化还原反应.A.只有N元素的化合价发生变化,NF3既是氧化剂又是还原剂,故A错误;
B.NF3生成NO,被还原,NF3生成HNO3,被氧化,还原剂与氧化剂的物质的量之比为1:2,故B错误;
C.生成0.2molHNO3,转移的电子的物质的量为0.2mol×(5-3)=0.4mol,故C错误;
D.生成的NO易与空气中氧气反应生成红棕色气体二氧化氮,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度中等,注意化合价的升降为氧化还原反应的特征,注意从化合价的角度分析.1年前查看全部
- 某待测溶液中可能含有Ag+K+Ba2+NH4+Cl-NO3-等离子,进行如下实验
某待测溶液中可能含有Ag+K+Ba2+NH4+Cl-NO3-等离子,进行如下实验
(1)加入过量的稀盐酸,有白色沉淀生成
(2)过滤,在滤液中加入过量的稀硫酸,又白色沉淀生成
(3)过滤,取少量滤液,加入NaOH至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝的气体
问,待测液中一定含有,一定不含有,可能含有, 唐朝小公主1年前3
唐朝小公主1年前3 -
 sdsd1993 共回答了13个问题
sdsd1993 共回答了13个问题 |采纳率84.6%从(1)得有Ag+,从(2)得有Ba2+,从(3)得有NH4+,剩下的是不一定有的1年前查看全部
- (2013•泸州)某无色溶液中可能有Na+、Mg2+、Fe3+、Cl-、OH-、SO42-等离子中的一种或几种,经pH试
(2013•泸州)某无色溶液中可能有Na+、Mg2+、Fe3+、Cl-、OH-、SO42-等离子中的一种或几种,经pH试纸测定,该溶液的pH为11.由此可知,该溶液中一定存在的阴离子有______,一定不存在的阳离子有______.
 cxcgdy1年前1
cxcgdy1年前1 -
 酒仙剑 共回答了21个问题
酒仙剑 共回答了21个问题 |采纳率90.5%解题思路:pH为11的水溶液显碱性,水溶液中含有大量的OH-;根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存;本题还要注意溶液呈无色溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.据此进行分析判断即可.pH为11的水溶液显碱性,该溶液的水溶液中一定存在大量的OH-;Mg2+、Fe3+和OH-在溶液中分别能结合生成氢氧化镁沉淀、氢氧化铁沉淀,不能大量共存;OH-、Na+、Cl-、SO42-等离子不能结合成沉淀、气体或水,能大量共存.
故答案为:OH-;Mg2+、Fe3+.点评:
本题考点: 离子或物质的共存问题.
考点点评: 本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意是在碱性溶液中共存及特定离子的颜色.1年前查看全部
- 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的NaOH溶液,所加Na
 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示.下列叙述错误的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示.下列叙述错误的是( )
A.x与y的差值为0.01mol
B.原溶液中c(Cl-)=0.85mol•L-1
C.原溶液的c(H+)=0.1mol•L-1
D.原溶液中n(Mg2+):n(Al3+)=5:1 LXF518881年前1
LXF518881年前1 -
 dermot 共回答了14个问题
dermot 共回答了14个问题 |采纳率100%解题思路:在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=[0.004L×5mol/L/0.2L]=0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则C(NH4+)=
=0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,(0.033−0.03)L×5mol/L 0.2L
则c(Mg2+)=
=0.25mol/L,c(Al3+)=[0.002L×5mol/L/0.2L]=0.05mol/L,0.02L×5mol/L 2 0.2L
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,据此分析解答.在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=0.004L×5mol/L0.2L=0.1mol/L,继续滴加NaOH溶液...
点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题考查物质之间的反应,明确离子反应先后顺序是解本题关键,知道铝离子转化为氢氧化铝沉淀、偏铝酸钠时消耗NaOH的体积之比,结合电荷守恒解答,题目难度中等.1年前查看全部
- 这个楞次定律的方向是什么等离子气流由左方连续以v0射入Pl和P2两板间的匀强磁场中,ab直导线与Pl、P2相连接,线圈A
这个楞次定律的方向是什么
等离子气流由左方连续以v0射入Pl和P2两板间的匀强磁场中,ab直导线与Pl、P2相连接,线圈A与直导线cd连接.线圈A 内有随图乙所示的变化磁场,且磁场B 的正方向规定为向左,如图甲所示,则下列叙述正确的是 ( )
A.0~ls内ab、cd导线互相排斥
B.1~2s内ab、cd导线互相吸引
C.2~3s内ab、cd导线互相吸引
D.3~4s内ab、cd导线互相排斥
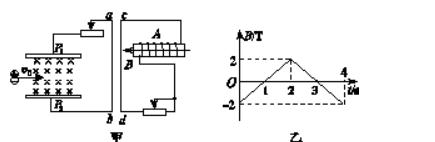
 yujingzhang1年前2
yujingzhang1年前2 -
 m8889537 共回答了17个问题
m8889537 共回答了17个问题 |采纳率88.2%BD对.
由于等离子是连续以V0速度进入两板间,可知两板区域的“电源”的电动势是恒定的,导线ab中的电流是恒定直流电,方向从a到b(向下).
由乙图知:
0--2秒时间内,线圈产生的感应电流在右边回路中是逆时针的,即通过导线cd的电流方向是向下(大小恒定).
在2--4秒时间内,线圈产生的感应电流在右边回路中是顺时针的,即通过导线cd的电流方向是向上(大小恒定).
对ab、cd两根导线而言,在0--2秒时间内,它们的电流方向都是向下,知它们是相互吸引的.
在2--4秒时间内,它们的电流方向一个向下、另一个向上,知它们是排斥的.1年前查看全部
- 我想问一下托克马克为什么进行微波加热前还要将等离子气体欧姆加热一段时间?
 第二只猴子1年前1
第二只猴子1年前1 -
 我的安安 共回答了24个问题
我的安安 共回答了24个问题 |采纳率79.2%因为欧姆加热是一种比较简单有效的加热方法,只是在等离子体温度变高的时候效率会逐渐下降.
而微波加热比欧姆加热复杂,成本高.1年前查看全部
- (12分)将含有Ag + 、Mg 2+ 、Al 3+ 、Na + 等离子的稀溶液,按下列实验步骤进行离子的依次分离。填写
(12分)将含有Ag + 、Mg 2+ 、Al 3+ 、Na + 等离子的稀溶液,按下列实验步骤进行离子的依次分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)
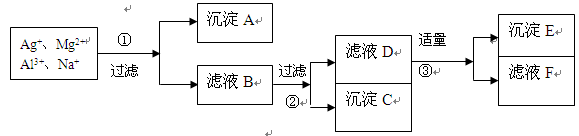
(1)沉淀A是 ___ ,沉淀C ___ ,沉淀E是 ;
(2)加入试剂①是 ____ ,②是________________,③是______________。 哥哥的小孩1年前1
哥哥的小孩1年前1 -
 xym315 共回答了14个问题
xym315 共回答了14个问题 |采纳率85.7%AgCl Mg(OH) 2 Al(OH) 3 NaCl NaOH HCl
略1年前查看全部
- 等离子焊接的离子气加氢气与不加氢气的区别?
等离子焊接的离子气加氢气与不加氢气的区别?
板材是不锈钢,离子气中含有氢气对焊缝成形有什么影响?
在等离子焊接中,起弧部未渗透是什么原因? o0乘风蹈海0o1年前1
o0乘风蹈海0o1年前1 -
 walker_cao 共回答了15个问题
walker_cao 共回答了15个问题 |采纳率93.3%等离子焊接,保护气体中加入适量的氢气(5%-7%),一般是提高电弧的温度,焊缝中的热输入,但是氢气含量过多时,焊缝中容易引起气孔或裂纹.
等离子焊接属于穿透型焊接,但是起弧部未渗透,要么是焊接电流小,起始部位母材温度不够.1年前查看全部
- 目前世界上正在研究一种新型发电机叫磁流体发电机,它可以把气体的内能直接转化为电能.如图所示为它的发电原理图.将一束等离子
目前世界上正在研究一种新型发电机叫磁流体发电机,它可以把气体的内能直接转化为电能.如图所示为它的发电原理图.将一束等离子体(即高温下电离的气体,含有大量带正电和负电的粒子,从整体上来说呈电中性)喷射入磁感应强度为B的匀强磁场,磁场中有两块面积为S,相距为d的平行金属板与外电阻R相连构成一电路.设气流的速度为v,气体的电导率(电阻率的倒数)为g,则流过外电阻R的电流强度I及电流方向为( ) A.I=
,A→R→BBdv R B.I=
,A→R→BBdvSg gSR+d C.I=
,B→R→ABdv R D.I=
,B→R→ABdvS SR+gd 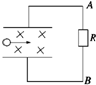
 luckyfeifei1年前1
luckyfeifei1年前1 -
 gghhy5 共回答了19个问题
gghhy5 共回答了19个问题 |采纳率84.2%根据左手定则知正电荷向上偏,负电荷向下偏,上极板带正电,下极板带负电,所以流过外电阻R的电流方向为A→R→B.最终电荷处于平衡有:qvB=q
E
d ,解得电动势E=Bdv.内电阻r= ρ
d
S =
d
gs ,根据闭合电路欧姆定律有: I=
E
R+r =
Bdv
R+
d
gS =
BdvSg
gSR+d .故B正确,A、C、D错误.
故选B.1年前查看全部
- 如何除去溶液中镍、铅、镉等离子的干扰?(保留汞)
 1987joecy1年前2
1987joecy1年前2 -
 kk1360 共回答了18个问题
kk1360 共回答了18个问题 |采纳率100%用硫酸使铅变成硫酸铅沉淀
然后生成硫酸汞溶液
电解硫酸汞,阴极聚集汞,就得到纯的汞1年前查看全部
- 19.(6分)某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
19.(6分)某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成.
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成.
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现.
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体.
根据实验现象回答:待测液中一定含有 离子,一定不含有 离子,还有一种离子不能确定是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程)
19.Ag+、Ba2+、NH4+ (各1分,共3分)
Fe3+ (1分)
焰色反应,产生紫色火焰 皆如梦1年前1
皆如梦1年前1 -
 找自我 共回答了18个问题
找自我 共回答了18个问题 |采纳率94.4%首先:加入过量的稀盐酸,有白色沉淀生成肯定有:Ag+了吧!
然后在滤液中加入过量的稀硫酸,又有白色沉淀生成肯定有:Ba2+了吧!
接着滴入2滴KSCN溶液,没有明显的现象出现说明:一定没有Fe3+
最后取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体.说明产生的是氨气,说明一定有:NH4+(NH4++OH-会产生氨气)
所以还有
K+,钾离子检验的唯一办法就是颜色反应.
所以检验K+的方法:颜色反应,产生紫色火焰说明有存在,反之不存在,题中说要检验存在,所以就是产生紫色火焰1年前查看全部
- 谁知道等离子电解抛光设备的工作原理,能不能加工小工件的不锈钢?
 焉轲1年前1
焉轲1年前1 -
 所谓成熟 共回答了19个问题
所谓成熟 共回答了19个问题 |采纳率94.7%领升金属电解抛光设备
电解抛光的原理
电解抛光设备是在特定的溶液中进行阳极处理,使金属表面平滑并产生金属光泽的工艺过程.
电抛光后零件性能的变化:
并可以提高零件的抗蚀性、表面的反光能力,同时又可以使金属的电子冷发射能力降低.
电解抛光的特点:
1.适于对形状复杂,线材,薄板和细小零件的抛光
2.生产效率高
3.电解过程中有氧析出,会使被抛光表面形成一层氧化膜,更提高其抗蚀性.
电解抛光与机械抛光的比较:
机械抛光是对被抛光表面进行磨削变形而得到平滑表面的进程.这样在工件表面有一层冷却硬化的变形层,同时还会夹杂一些抛光时剩下残馀的磨料.
电解抛光则是通过电解化学溶解使被抛光表面得到整平的过程,表面没有变形层产生,也不会夹杂外来物质.
但无法除去零件表面的深划痕,麻点等表面缺陷.1年前查看全部
- 火到底是什么东西啊?火,网上说是由等离子状态的物质组成的,那也就是说火是一种物质.我们物理老师说世界上的东东的构成可以分
火到底是什么东西啊?
火,网上说是由等离子状态的物质组成的,那也就是说火是一种物质.我们物理老师说世界上的东东的构成可以分为分子、原子、离子.化学老师说那些化学反应是这些微粒的重组,那为什么那么多不同微粒的物质都能产生火焰?火的温度和外界有关吗?火焰的三层的温度为什么书上都能说出准确的温度?为什么火焰会有温度,而且温度很高?既然火焰也受重力影响,为什么在风吹摇摆之后会复原而不是下垂?网上说火是固态、液态、气态以外的状态,就是等离子的状态吧?这到底是什么东西啊?同样是火,为什么有可燃物与不可燃物?是不是等离子状态的东东与这些可燃物的微粒有反应?为什么温度高金属会变红变亮像火焰一样?为什么水这种分子组成的东西能够克制火这个比较另类的东西?是不是火也适用于那些对于物质的理论? 芝麻在刷代码图1年前1
芝麻在刷代码图1年前1 -
 yxgood_hi 共回答了18个问题
yxgood_hi 共回答了18个问题 |采纳率100%呵呵,楼主的问题太多.这样多的问题建议分为几题,由浅入深分别提出,否则很难有人愿意深入回答,这种问题不深入回答差不多等于没答,你看百科或知道问答不得要领的原因就在于此,这个问题牵涉的知识很多,没有几千字是搞不定的.
在此我先回答你的基本问题,细节问题你可重新提问.
对火的本质,我的认识是物质的一种运动方式或由这种运动方式产生的一种现象,仅理解为一种物质并不恰当.因为在“火”这种现象中的物质和其它现象中的物质并无本质区别,“火”并不是什么特殊物质(象古人认为的那样是一种基本物质,火原子),只是普通物质的一种特殊运动.当然其中涉及的物质和普通状态下的物质在结构上也是有区别的,但这种区别并不是本质的.
通常说的火都是可燃物在有氧化剂存在时燃烧形成的.对于这种“火”,我们可以下个如下的定义:一种由可燃物燃烧产生的高温气体所发生的相对稳定的发光发热现象.下面仅讨论这种“火”.
对这个定义,有必要进一步解释几点:
1.高温来自于可燃物和氧化剂之间强烈的氧化还原反应释放的大量热量(即所谓的化学能),这些热量被转化为反应物、生成物系统的热运动能,使分子的平均动能急剧增大,从而温度增高.在高温的作用下(实质上是分子间的剧烈碰撞下),反应物和生成物迅速被汽化(假定原先不是气体.如原先就是气体时,在常压下体积必然急剧膨胀),从而形成高温气体.
2.这里的高温气体究竟是什么东西?对此,网上很多说法并不确切.从组成来说,高温气体包括了反应物气体、氧化剂气体,反应中间产物气体、最终反应产物气体(通常为二氧化碳和水).气体的组成与温度有关,温度又与众多因素有关,其间的关系很复杂,难以准确说明.同种火焰的不同部位的组成和温度都不相同,不同种火焰更不相同.
3.什么是等离子体?所谓的等离子体,是物质的第四种聚集状态,当分子或原子的动能足够大时,分子或原子间的碰撞将可能使电子的能量高于其电离能,电子将可能被打出分子原子成为游离的自由电子,原子失去电子变成相应的阳离子,分子失去电子成为分子离子.由于整个气体呈电中性,而自由电子和离子又并不结合在一起(不像普通的气体、液体、固体那样),这样的物质状态,我们称之为等离子体.
4.高温气体是中性分子的聚集体(即普通气体)还是等离子体?网上很多人说是等离子体,这是错误的说法.准确的说,火焰气体中既有中性分子又有等离子体.在火焰温度较低时(通常的火焰温度低于2000摄氏度),火焰气体中绝大部分以中性分子的形式存在.当温度达到摄氏5000度附近或更高(这么高的温度通常靠化学反应难以达到,可采用电弧、核反应等物理方法实现),等离子体才显著,即便如此,仍是中性分子占据大部分.根据玻尔兹曼分布可知,当气体中有一半分子或原子变为等离子体所需的温度就要趋于无穷大.
5.“火”为什么能发光发热?
任何物体在任何时刻都在发光发热,人体也不例外.只是人发的光肉眼不可见,属于红外光,实际上我们说人或其他物体在发热,讲的就是发红外光.光和热没有本质区别,都是电磁波,只是频率不同而已.一般说的光指可见光,频率较红外光大一些.除了可以发红外光以外,实际上其它频率的电磁波也同时被发射,只是通常温度下,其它频率的辐射强度极小以致实际上观测不到或可忽略而已.当发光体的温度较低时(低于700-800度),主要发射红外光或频率更小的光,当温度达到700-800度时,将有肉眼可分辨的红光产生.例如,铁、玻璃烧到红热大致就是这样的温度.温度更高时,将发射更高频率的电磁波.蓝色火焰温度大致有2000度附近.一般来说,常见的发光体发射的电磁波波长都是连续的,即蓝色火焰实际上同时发出了蓝色以及其它颜色的可见光和红外光,只是蓝色的部分强度更高一些.温度再高,将可发射紫外光或频率更高的电磁波(可见光和红外光同时存在).太阳的“火焰”大致就是这种情况.
6.发光、发热的机理
限于篇幅就不再进一步深入讨论,楼主可参见百度百科或知道回答,如有不明,可进一步提问.
看了一下百度百科http://baike.baidu.com/view/19105.htm?fr=ala0_1_1#5,其中关于火焰的一段(靠近最后)描述还算科学,楼主可参考.其余部分属于常识性描述,并非准确的科学描述,其中有不少错误认识.1年前查看全部
- 能分别将含有铜,铁,铝,镁,亚铁,钠等离子的七种溶液一次性鉴别开来的试剂是
能分别将含有铜,铁,铝,镁,亚铁,钠等离子的七种溶液一次性鉴别开来的试剂是
碳酸氢钠溶液
氢氧化钠溶液
硫化钾溶液
氨水 lt1974191年前3
lt1974191年前3 -
 nancyyy 共回答了21个问题
nancyyy 共回答了21个问题 |采纳率90.5%氢氧化钠溶液
首先,铜,铁,亚铁离子的溶液可以通过颜色判断,铜为蓝色,铁为淡黄色,亚铁为浅绿色,当然,也可以通过沉淀颜色
其次,氢氧化钠溶液加入镁离子后,会有沉淀现象
而加入铝离子后先看到沉淀,然后沉淀溶解
最后么,没有任何现象的是钠离子的溶液1年前查看全部
- 金属钛与四氟化碳反应吗特别是四氟化碳在等离子状态下
 蕾在oo1年前2
蕾在oo1年前2 -
 谋天下 共回答了16个问题
谋天下 共回答了16个问题 |采纳率93.8%你好,金属钛只可能与等离子状态下的四氟化碳发生反应.因为常温下四氟化碳是很稳定的气体,不与金属发生反应.在等离子状态下,可用于各种金属的蚀刻,是目前用量最大的等离子蚀刻气体.1年前查看全部
- 电解法精练铜的过程 ZN等离子怎么变化的
电解法精练铜的过程 ZN等离子怎么变化的
如果电极是FE 和含杂质的CU 离子会怎样变 mitac12211年前3
mitac12211年前3 -
 gigiyan 共回答了17个问题
gigiyan 共回答了17个问题 |采纳率94.1%在电解精炼铜的时候,在阳极上铜和比铜活泼的金属失去电子变成离子进入溶液,没有铜活泼的金属不失去电子溶解,而是沉在阳极附近形成阳极泥.在溶液中,金属阳离子向阴极方向移动,由于溶液中铜离子的氧化性最强,于是铜离子变成金属铜附着在阴极上.
如果阴极是铁和含杂质的铜,由于阴极上铁有外加电流提供电子,因此不会被腐蚀,发生的反应不变.而如果阳极是铁和含杂质的铜,那么亚铁离子将进入溶液中,铜离子和铁离子均向阴极方向移动,最终铜离子得电子变成金属铜,溶液变为硫酸亚铁溶液.1年前查看全部
- 除去Nacl中含有的Ca2+,mg2+,So42-,Hco3-等离子,通常使用以下四种试剂,应是怎样的顺序?才能除去
除去Nacl中含有的Ca2+,mg2+,So42-,Hco3-等离子,通常使用以下四种试剂,应是怎样的顺序?才能除去
1Na2co3 2Bacl2 3Naoh 4hcl 为你不花1年前1
为你不花1年前1 -
 太阳雨228 共回答了23个问题
太阳雨228 共回答了23个问题 |采纳率91.3%2,1,3,41年前查看全部
- 王水能不能溶解氯化银~我想从电镀污泥中回收金 污泥中含有金、 银、铜等离子.因金只能溶解王水 但王水是硝酸跟盐酸1:3
王水能不能溶解氯化银~
我想从电镀污泥中回收金 污泥中含有金、 银、铜等离子.因金只能溶解王水 但王水是硝酸跟盐酸1:3 混合产生的,故有氯离子 会与银离子发生反应生成氯化银沉淀 回收金后 怎样才能回收银? sytlmh1年前1
sytlmh1年前1 -
 周xx松 共回答了26个问题
周xx松 共回答了26个问题 |采纳率92.3%王水中可以溶解,卤化银还可以在硝酸中用活泼金属置换1年前查看全部
- 一道高一离子共存问题··某电解质溶液中,可能大量存在有Ag+ H+ Cu2+ CO32- OH- Cl-等离子,你认为一
一道高一离子共存问题··
某电解质溶液中,可能大量存在有Ag+ H+ Cu2+ CO32- OH- Cl-等离子,你认为一定有的离子是_______________________;一定没有的离子是_________________________;还需要进一步确认的离子是__________________________________;怎样判断有无此离子? 别老拿钱说事1年前1
别老拿钱说事1年前1 -
 spark12 共回答了19个问题
spark12 共回答了19个问题 |采纳率84.2%一定有的是 Cl-一定没有的是Ag+ CO32- OH-可能存在的是 H+ Cu2+首先要知道的是碳酸银 氢氧化银是不存在的 因为是见光分解 氯化银是沉淀.氢离子和碳酸根离子 氢氧根离子不能共存 碳酸铜 氢氧化铜沉淀 所以得出结论:银...1年前查看全部
- 氯离子的检验不能排除硫酸根等离子的干扰.因此?
 y1lkzituixmqs41年前2
y1lkzituixmqs41年前2 -
 乐乐糖果 共回答了19个问题
乐乐糖果 共回答了19个问题 |采纳率84.2%氯离子的检验不能排除硫酸根等离子的干扰.因此必须在加入硝酸酸化的硝酸银(而不是只有硝酸银)即可排除干扰.1年前查看全部
- 讲一下微观世界的介绍,如原子 分子 离子 等离子,而它们又是怎么组成的?
讲一下微观世界的介绍,如原子 分子 离子 等离子,而它们又是怎么组成的?
请各位认真回答. edisonwong1年前1
edisonwong1年前1 -
 熊出没人小心 共回答了19个问题
熊出没人小心 共回答了19个问题 |采纳率94.7%基本粒子数量很多.请看百度百科中的资料.zhidao.baidu.com/...%D7%D3世界上t我们周围所有的客观存在都是物质dh除了粒子是客观存在外,场也是客观存在的,只是粒子是以拥有质量的形式成为物质,场是以能量的形式成为物质,当然质量和能量本质上是相通的(E=mc²)l对于你说的磁场和电场,它们是电磁场的两个表现形式,它也是一能量的形式成为客观存在的不过在量子场论中,电磁场也被量子化为了“粒子”bfjn这个“粒子”就是光子,光子没有质量,但有能量61年前查看全部
- 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
 A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42-和Na+
C. 原溶液中SO42-的物质的量至少为3.5mol
D. 反应最后形成的溶液中含有的溶质为Na2SO4 小依可1年前2
小依可1年前2 -
 花不再香 共回答了21个问题
花不再香 共回答了21个问题 |采纳率95.2%解题思路:A、根据生成沉淀的物质的量随NaOH溶液的体积变化的图象来确定存在的离子;
B、根据电荷守恒结合A选项的内容来确定存在的离子;
C、根据消耗氢氧化钠的量和生成沉淀的量来确定离子的物质的量的多少;
D、根据溶液中离子之间的反应来确定含有的溶质.A、根据图象第一段,沉淀不是马上出现,可知一定有氢离子,酸碱中和反应是一切反应的优先反应,生成沉淀在后面溶解一部分,一定有铝离子,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,从纵坐标可看出与1mol沉淀溶解,故原溶液中铝离子为1mol,所以形成氢氧化铝用了3mol的氢氧化钠,还有3mol的氢氧化钠被其他离子消耗,根据图象生成1mol沉淀消耗3mol氢氧化钠,故原溶液含1mol铁离子,无Mg2+,即原溶液中含有的阳离子一定有H+、Fe3+、NH4+、Al3+,故A错误;
B、根据A的推断,一定含有的阳离子是H+、NH4+、Fe3+、Al3+,一定不含碳酸根离子,溶液中需要正、负离子,故一定有阴离子SO42-,不能确定钠离子是否存在,故B错误;
C、根据坐标得氢氧化铝溶解用了1体积的氢氧化钠,而氢氧化铝的物质的量为1mol,故1体积氢氧化钠含氢氧化钠的物质的量为1mol,沉淀达到最大量共消耗7体积氢氧化钠,即消耗7mol氢氧化钠,此时溶液中溶质为硫酸钠和硫酸铵,根据钠守恒,硫酸钠的物质的量为3.5mol,硫酸铵中还存在硫酸根离子1mol,因不确定原溶液是否存在钠离子,故原溶液中SO42-的物质的量至少为4.5mol,故C正确;
D、根据溶液中的离子的存在情况可知道,最后溶液中含有的溶质除了Na2SO4,还有偏铝酸钠,故D错误.
故选C.点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题是一道有关离子检验的综合知识题目,考查角度很广,难度较大.氢氧化铝是两性氢氧化物溶于强碱是解题关键.1年前查看全部
- (2014•山东一模)某工业废水中含有CN-和Cr2O 2−7等离子,需经污水处理达标后才能排放,污水处理厂拟
(2014•山东一模)某工业废水中含有CN-和Cr2O
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:2−7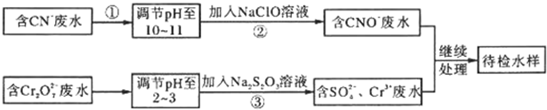
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为______.
(2)步骤③的反应为
+Cr2OS2O 2−3
+H+→2−7
+Cr3++H2O(未配平),则每消耗0.4 mol Cr2OSO 2−4
转移______mol e-.2−7
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是______.
(4)在25℃下,将a mol•L-1的NaCN溶液与0.01mol•L-1的盐酸等体积混合,反应后测得溶液pH=7,则a______0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______.
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量
Na2S溶液,蓝色沉淀转化成黑色沉淀.该过程中反应的离子方程是______. 花飘飞1年前1
花飘飞1年前1 -
 捌贰年 共回答了15个问题
捌贰年 共回答了15个问题 |采纳率80%解题思路:(1)步骤②中,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
(2)根据0.4 mol Cr2O72-等转化为Cr3+即可计算出转移电子的物质的量;
(3)加入熟石灰进一步处理,调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)反应后测得溶液pH=7,则可推知NaCN过量,根据电荷守恒和物料守恒即可计算出CN-和HCN的浓度,进而计算出Ka﹦(100a-1)×10-7 mol•L-1;
(5)待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).(1)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,离子反应为:CN-+ClO-═CNO-+Cl-;故答案为:CN-+ClO-═CNO-+Cl-;(2)根据0.4 mol Cr2O72-等转化为Cr3+,铬元素化合价降低3价,0.4...
点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题以工艺流程为载体,侧重化学基本概念、基本理论,考查了氧化还原反应及离子方程式的书写,水溶液中的离子平衡、离子浓度、电离常数、沉淀溶解平衡等电解质溶液的相关知识.考查学生的知识运用能力、灵活分析处理实际问题的能力.1年前查看全部
- 等离子体是什么?等离子是热能吗?空气中有等离子吗?
 美丽的大地的孩子1年前2
美丽的大地的孩子1年前2 -
 syzlsyf 共回答了13个问题
syzlsyf 共回答了13个问题 |采纳率84.6%将固体加热到熔点时,粒子的平均动能超过晶格的结合能,固体会变成液体;
将液体加热到沸点时,粒子的动能会超过粒子之间的结合能,液体会变成气体.
如果把气体进一步加热,气体则部分电离或完全电离,即原子的外层电子会摆脱原子核的束缚成为自由电子,而失去外层电子的原子变成离子.当带电粒子的比例超过一定程度时,电离气体凸现出明显的电磁性质,而其中的正离子和负离子(电子)的数目相等,因此被称为等离子体(plasma),又叫物质的第四态.
等离子体是处于等离子态的物质的总称,当然不是热量.
空气是气体,不是等离子体.但是空气中是存在少量电离的离子的.
本人是等离子体专业的研究生,上述内容准确可靠.
参考资料:《等离子体物理学》(高教)1年前查看全部
- (2012•上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子
 (2012•上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
(2012•上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质为Na2SO4 serenesun1年前1
serenesun1年前1 -
 hehuixu 共回答了19个问题
hehuixu 共回答了19个问题 |采纳率84.2%解题思路:A、根据生成沉淀的物质的量随NaOH溶液的体积变化的图象来确定存在的离子;
B、根据电荷守恒结合A选项的内容来确定存在的离子;
C、根据消耗氢氧化钠的量和生成沉淀的量来确定离子的物质的量的多少;
D、根据溶液中离子之间的反应来确定含有的溶质.A、根据图象第一段,沉淀不是马上出现,可知一定有氢离子,酸碱中和反应是一切反应的优先反应,生成沉淀在后面溶解一部分,一定有铝离子,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,一定不含碳酸根离子和镁离子,即原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,故A错误;
B、根据A的推断,解题图象第二段和最后剩余沉淀的量,可以知道氢氧化铝的沉淀量和另一沉淀的量是相等的,即一定是三价铁离子,一定不含有镁离子,所以含有的阳离子是H+、NH4+、Fe3+、Al3+,一定不含碳酸根离子,溶液中需要正、负离子,故一定有阴离子SO42-,不能确定钠离子是否存在,故B错误;
C、根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了1体积的氢氧化钠,所以形成氢氧化铝用了3体积的氢氧化钠,还有3体积的氢氧化钠一定是被三价铁离子消耗,原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,故C正确;
D、加入NaOH溶液,钠离子实际不参加反应,则反应后溶液中钠离子一定存在,所以最后溶液中含有的溶质不一定为Na2SO4,故D错误.
故选C.点评:
本题考点: 常见阳离子的检验;常见阴离子的检验.
考点点评: 本题是一道有关离子检验的综合知识题目,考查角度很广,难度较大.1年前查看全部
- 能将分别含有Cu2+,Fe3+,Mg2+,NH4+,Na+等离子的5种溶液一次性鉴别开来的试剂是
能将分别含有Cu2+,Fe3+,Mg2+,NH4+,Na+等离子的5种溶液一次性鉴别开来的试剂是
1.稀盐酸 2.NaOH溶液 3.稀氨水 4.稀硫酸
请指出上面哪项正确,哪项有误,并麻烦给出各项原因说明,该如何操作. 楚狂笑笑生1年前3
楚狂笑笑生1年前3 -
 携手共游人间 共回答了24个问题
携手共游人间 共回答了24个问题 |采纳率91.7%只有2.NaOH溶液正确
Cu2+蓝色沉淀,Fe3+黄色沉淀,Mg2+白色沉淀,NH4+气泡,Na+无现象
1.稀盐酸3.稀氨水 4.稀硫酸 都不能区分NH4+,Na+1年前查看全部
- 21.卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子,已卤块为原料制取轻质氧化镁的工艺流程如下
21.卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子,已卤块为原料制取轻质氧化镁的工艺流程如下:
卤块——1、加水后充分搅拌,加入试剂x——溶液——2、加入试剂y,调节溶液ph=9.8,搅拌、过滤——滤液——3、加入碳酸钠充分沉淀后加水煮沸——(有气体生成)沉淀——4、灼烧——轻质氧化镁
Fe2+氢氧化物成絮状,不易从溶液中除去,故常将它氧化成Fe3+,生成Fe(OH)3沉淀除去.
我现在已知x是漂液(含25%NaClO),作用是将Fe2+氧化为Fe3+
第二步之后滤液中剩余物质有什么?
加入碳酸钠后发生的离子方程式是?为什么会发生这样的反应? 极浦青萱1年前2
极浦青萱1年前2 -
 工124 共回答了16个问题
工124 共回答了16个问题 |采纳率87.5%Fe (2+) + ClO(-) + 2 H(+) ====== Fe (3+) + Cl(-) + H2O第二步后滤液中剩余Na+、Mg2+、Mn2+、Cl-、OH-,可能还有ClO-Mg (2+) +CO3 (2-) ==MgCO3 ↓Mn2+与碳酸根相遇,水解平衡被打破,发生双水Mn(2+) +CO3(2+) +H2O =...1年前查看全部
- 某溶液中可能含有Na+,K+,Mg2+,I-,SO3 2- SO4 2-等离子
某溶液中可能含有Na+,K+,Mg2+,I-,SO3 2- SO4 2-等离子
第19题中怎么判断的一定不存在的离子是mg2+ lewder1年前1
lewder1年前1 -
 biaoo 共回答了17个问题
biaoo 共回答了17个问题 |采纳率82.4%5里讲取原溶液与Ba(NO)3混合的白色沉淀,说明有硫酸根,硫酸根与镁不大量共存,所以没有镁离子1年前查看全部
- 强碱性溶液中一定没有大量的 ( ) 等离子 强酸性溶液中一定没有大量的( )等离子
 缘分下的天空1年前4
缘分下的天空1年前4 -
 小蛮妖的温柔mm 共回答了18个问题
小蛮妖的温柔mm 共回答了18个问题 |采纳率100%氢离子 铵根离子 银离子等……
氢氧根 碳酸跟 碳酸氢跟 硅酸跟 硫离子等……1年前查看全部
- 溶液中含有NH4+F-HSO3-K+等离子.向其中加入少量NaClO后溶液中离子数目肯定增加的是
溶液中含有NH4+F-HSO3-K+等离子.向其中加入少量NaClO后溶液中离子数目肯定增加的是
A.F- B.ClO- C.HSO3- D.NH4+
请逐一分析 xianyadan8881年前2
xianyadan8881年前2 -
 静w静 共回答了15个问题
静w静 共回答了15个问题 |采纳率93.3%加入NaClO,可发生如下反应:ClO-+HSO3-=SO42- +Cl- +H .
酸性增加 F-水解,浓度降低;
HSO3-反应了,浓度降低;
ClO-反应了
酸性增加,抑制了NH4+的水解,浓度增加
选D1年前查看全部
- 植物细胞所需要的钾离子、硝酸离子等离子有土壤溶液进入细胞内不一定必须有的条件是
植物细胞所需要的钾离子、硝酸离子等离子有土壤溶液进入细胞内不一定必须有的条件是
A、土壤溶液中的浓度一定大于细胞液浓度
B、根细胞呼吸产生的二氧化碳
C、相应的载体
D、根细胞呼吸作用产生的能量
并说明理由。 lsyhaoxinqing1年前2
lsyhaoxinqing1年前2 -
 1984春 共回答了15个问题
1984春 共回答了15个问题 |采纳率100%A和B
根吸收钾离子和硝酸根离子属于主动运输,要消耗能量、需要载体.可以逆浓度梯度进行.
所以A不一定需要.1年前查看全部
- 有一瓶澄清溶液,其中可能含有K+,Mg2+,Na+,Ba2+.Fe3+,Cl-,CO32-,SO42-等离子,取该溶液进
有一瓶澄清溶液,其中可能含有K+,Mg2+,Na+,Ba2+.Fe3+,Cl-,CO32-,SO42-等离子,取该溶液进行以下实验
1.用PH试纸检验溶液,呈强酸性,可以排除 存在
2.另取部分溶液逐滴加入氢氧化钠溶液,使溶液从酸性变成碱性溶液均无沉淀产生,则可排除 的存在
3.取部分上述碱性溶液,加入少量碳酸钠溶液,有白色沉淀生成,可排除 的存在
4.该溶液中肯定存在的离子是 ,肯定不存在的离子是 ,可能存在的离子是 . 真田真田1年前1
真田真田1年前1 -
 蔓佗萝 共回答了15个问题
蔓佗萝 共回答了15个问题 |采纳率80%1.用PH试纸检验溶液,呈强酸性
说明有较大浓度的氢离子,不和氢离子共存的有CO32-
2.无沉淀说明没有Mg2+,Fe3+
3.只能有钡离子,钡离子不和硫酸根离子共存,说明不含硫酸根离子
4.肯定存在:Ba2+,Cl-,H+(必须有阴离子的存在)
肯定不存在的离子是:CO32-,SO42-,Mg2+,Fe3+
可能的有:Na+,k+1年前查看全部
- 【质疑】硫酸根离子的检验a.向未知溶液中滴加HCl溶液(排除Ag+,SO32-,CO32-等离子的干扰).b.若生成了白
【质疑】硫酸根离子的检验
a.向未知溶液中滴加HCl溶液(排除Ag+,SO32-,CO32-等离子的干扰).
b.若生成了白色沉淀,则应予以过滤.
c.再向过滤所得的溶液中加入BaCl2溶液检验.
此时若生成的沉淀不溶解,则能判断溶液中确实含有SO42-.
提出疑问:
若原溶液中同时含有亚硫酸根离子和硝酸根离子,当盐酸加入后,溶液是酸性的(H+),则亚硫酸根离子仍会被NO3-氧化成硫酸根离子,从而对检验结果造成干扰.
如何解决? 栀子981年前4
栀子981年前4 -
 巴条 共回答了19个问题
巴条 共回答了19个问题 |采纳率89.5%在高中范围内的除杂是狭隘的,在没有暗示和提示的情况下,只要考虑:Cu2+、Fe2+、Fe3+、H+、NO3-、SO4-、Cl-、Ag+、I-、Br-、(CO3)2-、HCO3-、Al3+、Mg2+、S2-、HS-.
关于你的问题如果将知识范围扩大,就会出问题,如:原溶液中有:(SO3)2-、NO3-;HSO3-、NO3-;AlO2-;H2PO4-;(HPO4)2-;(PO4)3-;[Zn(OH)4]2-等等
反正有问题要多问,只有这样才能将你的经验与相对狭隘的中学题目磨合.这也是应试教育的弊端,如果是素质教育,只要你说的出你正确的理由,老师是不会给你大叉的.
如果你要解决你的问题的话,可以加入过量的Na2S溶液再逐滴加入过量盐酸,供参考:NO3- +S2-+4H+===NO+S↓+H2O,(SO3)2- +2S2- +6H+===3S↓+3H2O.
因为Na2S过量,NO3-在酸性环境中先与(在中学阶段这样认为)S2-反应,于是NO3-被除尽,(SO3)2-也与S2-反应而被除尽,剩余的S2-与H+结合,生成溶解度极小的H2S从溶液中逸出.
再将S滤除,至此(SO3)2-、NO3-就无法干扰实验现象了.1年前查看全部
- (2012•徐州一模)等离子气流由左方连续以v0射入Pl和P2两板间的匀强磁场中,ab直导线与Pl、P2相连接,线圈A与
 (2012•徐州一模)等离子气流由左方连续以v0射入Pl和P2两板间的匀强磁场中,ab直导线与Pl、P2相连接,线圈A与直导线cd连接.线圈A 内有随图乙所示的变化磁场.且磁场B 的正方向规定为向左,如图甲所示,则下列说法正确的是( )
(2012•徐州一模)等离子气流由左方连续以v0射入Pl和P2两板间的匀强磁场中,ab直导线与Pl、P2相连接,线圈A与直导线cd连接.线圈A 内有随图乙所示的变化磁场.且磁场B 的正方向规定为向左,如图甲所示,则下列说法正确的是( )
A.0~ls内ab、cd导线互相排斥
B.1~2s内ab、cd导线互相排斥
C.2~3s内ab、cd导线互相排斥
D.3~4s内ab、cd导线互相排斥 失忆症1年前1
失忆症1年前1 -
 我烦不想讲 共回答了19个问题
我烦不想讲 共回答了19个问题 |采纳率94.7%解题思路:等离子流通过匀强磁场时,正离子向上偏转,负离子向下偏转,因此将形成从a到b的电流,线圈A中磁场均匀变化,形成感应电流,根据楞次定律判断出流经导线cd的电流方向,然后根据推论:导线中的电流同向时相互吸引,反向时相互排斥判断导线之间作用力情况.左侧实际上为磁流体发电机.等离子流通过匀强磁场时,由左手定则判断可知,正离子向上偏转,负离子向下偏转,将在ab中形成从a到b的电流.由图乙可知,0~2s内磁场均匀变化,根据楞次定律可知将形成从c到d的电流,同理2~4s形成从d到c的电流,且电流大小不变,故0~2s秒内电流同向,相互吸引,2~4s电流反向,相互排斥,故AB错误,CD正确.
故选:CD.点评:
本题考点: 导体切割磁感线时的感应电动势;法拉第电磁感应定律.
考点点评: 利用法拉第电磁感应定律E=s[△B/△t]时,注意B-t图象中斜率的物理意义.注意感应电动势的大小看磁通量的变化率,而非磁通量大小或者磁通量的变化量.1年前查看全部
- 1.在除Ca2+、Mg2+、SO2-4等离子时,为什么要先加BaCl2溶液,后加Na2CO3溶液?能否先加Na2CO3溶
1.在除Ca2+、Mg2+、SO2-4等离子时,为什么要先加BaCl2溶液,后加Na2CO3溶液?能否先加Na2CO3溶液?
2. 如何检验SO42-是否沉淀完全?
3. 怎样除去实验过程中所加的过量沉淀剂BaCl2,NaOH和Na2CO3? mapleco1年前1
mapleco1年前1 -
 酒吧舞妖 共回答了21个问题
酒吧舞妖 共回答了21个问题 |采纳率85.7%因为加氯化钡得过量才能保证硫酸根彻底反应完全,而过量的钡离子得处理掉所以碳酸钠就很重要了既沉淀了钙离子又沉淀了钡离子,如果先加碳酸钠那么过量的钡离子将无法除掉,第二题向澄清的液体里加入硫酸少量产生沉淀即证明氯化钡过量所以说明沉淀完全,第三先加氯化钡再加氢氧化钠或碳酸钠最后加的是盐酸.最后盐酸只需要加热即可挥发除去!1年前查看全部
- 物理有关磁场的题:等离子气体喷入磁场,正负离子在洛仑磁力作用下发生上下偏转而聚集到A.B板上
 伏牛山新人1年前1
伏牛山新人1年前1 -
 玫瑰茶中的女人 共回答了16个问题
玫瑰茶中的女人 共回答了16个问题 |采纳率100%带点离子发生器.离子加速器物质存在的方式——离子.场电场对存在其中的带电离子产生力的作用应用;喷塑,印刷等1年前查看全部
- 在溶液中有浓度均为0.01mol•L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:
在溶液中有浓度均为0.01mol•L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31;
Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11;
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小( )
A. Fe3+
B. Zn2+
C. Cr3+
D. Mg2+ 有空晒晒太阳1年前1
有空晒晒太阳1年前1 -
 wugang19830209 共回答了15个问题
wugang19830209 共回答了15个问题 |采纳率86.7%解题思路:根据Ksp计算出不同离子形成沉淀所需C(OH-),C(OH-)越小,溶液的pH越小;根据金属离子的浓度和溶度积常数可知,四种离子开始沉淀时的OH-浓度分别是:
3
2.6×10 −39
0.01
=6.38×10-13mol•L-1;
3
7.0×10 −31
0.01
=4.12×10-10mol•L-1;
1.0×10 −17
0.01=3.16×10-8mol•L-1,
1.8×10 −11
0.01=4.24×10-5mol•L-1,所以当氢氧化物开始沉淀时,铁离子所需溶液的pH最小,故选:A.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 该题注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力.1年前查看全部
- 科学:(一道初二化学题)在K+、NH4+、Ag+、Al3+、Cl-、OH-、SO42-等离子中,能在同一种溶液中
科学:(一道初二化学题)在K+、NH4+、Ag+、Al3+、Cl-、OH-、SO42-等离子中,能在同一种溶液中
在K+、NH4+、Ag+、Al3+、Cl-、OH-、SO42-等离子中,能在同一种溶液中大量共存的五种离子是___________,要配制成这种溶液,可将________和_________两种物质(写成化学式)溶于水.
答案是:K+、NH4+、Al3+ Cl-、SO42- NH4Cl KAl(SO4)2·12H2O
求原因,求高手 所保各不违1年前1
所保各不违1年前1 -
 zhaonanjing 共回答了22个问题
zhaonanjing 共回答了22个问题 |采纳率90.9%原因:
Ag+ 与 Cl-,SO42-不能共存 ,会有AgCl沉淀与Ag2SO4沉淀.
NH4+ 或 Al3+ 与 OH-不能和OH-共存,会有NH3.H2O生成,Al(OH)3沉淀
只要避开这两个条件就可以了
所以
能在同一种溶液中大量共存的五种离子是:
K+、NH4+、Al3+ Cl-、SO42-
第二问 五种离子组合一下
NH4Cl KAl(SO4)2·12H2O 溶于水可以得到
不明白HI1年前查看全部
- 在K+、NH4+、Ag+、Al+、Cl-、OH+、SO42-等离子中,能在同一溶中大量共存的五种离子是_____,要配制
在K+、NH4+、Ag+、Al+、Cl-、OH+、SO42-等离子中,能在同一溶中大量共存的五种离子是_____,要配制这种溶液,可将____和____两种物质(写成化学式)溶于水.
 lirnlun1年前3
lirnlun1年前3 -
 4wgaoc 共回答了17个问题
4wgaoc 共回答了17个问题 |采纳率100%K+、NH4+、Al+、Cl-、SO42 KAL[SO4]2硫酸铝钾和 NH4CL 老大 明矾是十二水硫酸铝钾1年前查看全部
- 书上说磁流体发电机本来没有电场,只有磁场,等离子气体不断喷入,才开始有电场,最后粒子受到的洛伦兹力等于电场力.
书上说磁流体发电机本来没有电场,只有磁场,等离子气体不断喷入,才开始有电场,最后粒子受到的洛伦兹力等于电场力.
我觉得这和下图这道题类似,应该不会有受力平衡的时候啊,临界值不是在边上飞出吗?

 10qq131年前4
10qq131年前4 -
 shafeng119 共回答了12个问题
shafeng119 共回答了12个问题 |采纳率83.3%我不是刷题,只是这道题在非团队提问中已经回答了,能不能请你把这里处理掉?
磁流体发电机随着等离子体的喷射,在磁场作用下在金属板上不断聚集电荷形成电势差,产生电压,当电势差达到最大,也就是满足qvB=qE,由于发电机最终会将电能储存或转化,也就是说电势差会有减少的趋势,但由于等离子体不断喷射,电荷补充,理论上就能得到稳定电压满足qvB=qE
只要两板长度足够就可以啦,且洛伦兹力和重力不一样,重力是恒定方向的,洛伦兹力是随速度方向而改变的,受不断增强的电场影响粒子所受合力会不断改变,运动轨迹是很难用我们现有的知识理想地推测的.我们老师常说很多这些应用以及第十三章的微观量子等,大部分背就对了,因为以我们现有的有限知识是很难解释和理解透彻,否则你都可以去做深入研究了.1年前查看全部
- Na+、H+、SO3-2、SO4-2等离子在溶液中能大量共存吗?
 半熟男1年前1
半熟男1年前1 -
 迷惘anhy 共回答了13个问题
迷惘anhy 共回答了13个问题 |采纳率84.6%H+,SO32-不能
会产生SO22
SO32-+2H+=SO2↑+H2O1年前查看全部
- 某澄清溶液中,可能含有NH4+、Mg2+、Na+、Fe2+、Ag+、OH–、Cl–、I–、NO3–和SO42–等离子中的
某澄清溶液中,可能含有NH4+、Mg2+、Na+、Fe2+、Ag+、OH–、Cl–、I–、NO3–和SO42–等离子中的几种,现进行如下实验:
(1)用pH试纸检验时,试纸呈深红色.
(2)取溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,得上、下两层澄清溶液,其中上层呈黄色,下层呈紫色.
(3)向(2)所得溶液中加入AgNO¬3溶液,有白色沉淀生成.
(4)另取原溶液,调节pH使其呈中性后,加入适量的Na2S溶液,滤去产生的黑色沉淀;在滤液中继续加碱至是强碱性,得白色沉淀;过滤后给滤液加热,有刺激性气味的气体产生.
由此判断原溶液中一定有大量的 离子,一定没有 离子.不能确定有无 离子.
昨天我已提过这个问题,可是却不见了,希望有人帮忙再回答一下,最好详细写出分析过程. 潇湘情歌1年前2
潇湘情歌1年前2 -
 babe_2000 共回答了13个问题
babe_2000 共回答了13个问题 |采纳率76.9%(1)说明呈酸性,所以OH-不会大量存在
(2)说明一定含I-,一定没有Ag+,同时由于是酸性溶液,所以一定没有NO3-,否则会将I-氧化
(3)说明不了什么问题
(4)调节pH使其呈中性后,加入适量的Na2S溶液说明含有一定含有Fe2+(黑色沉淀排除了Ag2S,只能是FeS);继续加强碱,得白色沉淀,说明一定含有Mg2+;再加热有刺激性气体产生,为NH3,一定含有NH4+
一定有的:I-、Fe2+、Mg2+、NH4+
一定没有的:Ag+、NO3-
不能确定的:Na+、Cl、SO42-
OH-比较难以归到上面哪一类,是属于一定存在但不能大量存在的.有点纠结.1年前查看全部
- 目前世界上正在研究一种新型发电机叫磁流体发电机,它可以把气体的内能直接转化为电能.如图所示为它的发电原理图.将一束等离子
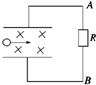 目前世界上正在研究一种新型发电机叫磁流体发电机,它可以把气体的内能直接转化为电能.如图所示为它的发电原理图.将一束等离子体(即高温下电离的气体,含有大量带正电和负电的粒子,从整体上来说呈电中性)喷射入磁感应强度为B的匀强磁场,磁场中有两块面积为S,相距为d的平行金属板与外电阻R相连构成一电路.设气流的速度为v,气体的电导率(电阻率的倒数)为g,则流过外电阻R的电流强度I及电流方向为( )
目前世界上正在研究一种新型发电机叫磁流体发电机,它可以把气体的内能直接转化为电能.如图所示为它的发电原理图.将一束等离子体(即高温下电离的气体,含有大量带正电和负电的粒子,从整体上来说呈电中性)喷射入磁感应强度为B的匀强磁场,磁场中有两块面积为S,相距为d的平行金属板与外电阻R相连构成一电路.设气流的速度为v,气体的电导率(电阻率的倒数)为g,则流过外电阻R的电流强度I及电流方向为( )
A.I=[Bdv/R],A→R→B
B.I=[BdvSg/gSR+d],A→R→B
C.I=[Bdv/R],B→R→A
D.I=[BdvS/SR+gd],B→R→A wy4646461年前1
wy4646461年前1 -
 bocai530 共回答了15个问题
bocai530 共回答了15个问题 |采纳率93.3%解题思路:电离的气体含有大量带正电和负电的粒子,进入磁场受洛伦兹力发生偏转,根据左手定则判断出正负电荷的偏转方向,从而确定极板的正负极,确定出电流在外电路中的流向.最终电荷受电场力和洛伦兹力处于平衡,根据平衡求出电动势的大小,从而根据闭合电路欧姆定律求出电流的大小.根据左手定则知正电荷向上偏,负电荷向下偏,上极板带正电,下极板带负电,所以流过外电阻R的电流方向为A→R→B.最终电荷处于平衡有:qvB=q[E/d],解得电动势E=Bdv.内电阻r=ρ
d
S=
d
gs,根据闭合电路欧姆定律有:I=
E
R+r=
Bdv
R+
d
gS=
BdvSg
gSR+d.故B正确,A、C、D错误.
故选B.点评:
本题考点: 霍尔效应及其应用;闭合电路的欧姆定律.
考点点评: 本题综合考查了电阻定律、闭合电路欧姆定律以及磁场的知识,关键掌握左手定则判断洛伦兹力的方向,以及通过平衡求出电源的电动势.1年前查看全部
- (2014•静安区一模)溶液中含有NH4+、F-、HSO3-、K+等离子.向其中加入少量NaClO后,溶液中离子数目肯定
(2014•静安区一模)溶液中含有NH4+、F-、HSO3-、K+等离子.向其中加入少量NaClO后,溶液中离子数目肯定增加的是( )
A. F-
B. ClO-
C. HSO3-
D. NH4+ 樱桃酒心巧克力1年前7
樱桃酒心巧克力1年前7 -
 陈运进 共回答了17个问题
陈运进 共回答了17个问题 |采纳率88.2%解题思路:本题根据电解质的电离、盐的水解、离子反应发生的条件解决.向溶液中加入次氯酸钠发生电离:NaClO═Na++ClO-,次氯酸根离子水解:H2O+ClO-⇌HClO+OH-,溶液的碱性增强,再结合①NH4++H2O⇌NH3•H2O+H+,②F-+H2O⇌HF+H+,③HSO3-+H2O⇌H2SO3+OH-,由于加入次氯酸钠后,次氯酸根离子的水解,使溶液中氢氧根离子的浓度增加,①平衡向左移动,②向右移动,K+无影响.同时亚硫酸根离子有还原性,次氯酸钠具有氧化性,发生氧化还原反应,将亚硫酸根离子氧化成硫酸根离子.A.由于向溶液中加入次氯酸钠后,NaClO有强氧化性,氧化HSO3-,本身被还原成HCl,酸性增强,又有F-+H2O⇌HF+OH-反应向右移动,氟离子数目减小,故A错误.
B.当向溶液中加入次氯酸钠后发生NaClO═Na++ClO-反应,而使溶液中ClO-根离子的浓度增加,但由于次氯酸钠具有强氧化性,将亚硫酸氢根离子氧化为硫酸根离子,使ClO-离子数目减小,故B错误.
C.向溶液中加入次氯酸钠后,尽管存在HSO3-+H2O⇌H2SO3+OH-这一反应,但由于次氯酸钠具有强氧化性,将亚硫酸氢根离子氧化为硫酸根离子,使得亚硫酸根离子减小,故C错误.
D.由于向溶液中加入次氯酸钠后,NaClO有强氧化性,氧化HSO3-,本身被还原成HCl,酸性增强,NH4++H2O⇌NH3•H2O+H+反应向左移动,NH4+肯定增加,故D正确.
故选D.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;离子反应发生的条件.
考点点评: 本题考查了电解质的电离,盐的水解,盐水解平衡的移动氧化还原反应的应用.要将这些知识条理清晰,思维也要清晰否则易出错.1年前查看全部
- 如图甲所示,等离子气流(由高温高压的等电量的正、负离子组成)由左方连续不断地以速度v 0 射入P 1 和P 2 两极板间
如图甲所示,等离子气流(由高温高压的等电量的正、负离子组成)由左方连续不断地以速度v 0 射入P 1 和P 2 两极板间的匀强磁场中,ab直导线与P 1 、P 2 相连接,线圈A与直导线cd相连接,线圈A内存在如图乙所示的变化磁场,且磁感应强度B的正方向规定为向左,则下列叙述正确的是( ) 
A.0~1s内ab、cd导线互相排斥 B.1~2s内ab、cd导线互相吸引 C.2~3s内ab、cd导线互相吸引 D.3~4s内ab、cd导线互相排斥  derivy1年前1
derivy1年前1 -
 雪羡冰凌 共回答了21个问题
雪羡冰凌 共回答了21个问题 |采纳率90.5%左侧实际上为等离子体发电机,将在ab中形成从a到b的电流,由图乙可知,0-2s内磁场均匀变化,根据楞次定律可知将形成从c到d的电流,同理2-4s形成从d到c的电流,且电流大小不变,故0-2s秒内电流同向,相互吸引,2-4s电流反向,相互排斥,故AC错误,BD正确.
故选BD.1年前查看全部
- 高一化学,请化学老师进入,谢谢3.除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种
高一化学,请化学老师进入,谢谢
3.除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④HCl.加入试剂合理的操作顺序是 ( )
A.①②③④ B.③①②④ C.④②①③ D.③②①④
5.在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为 ( )
A.0.1mol B.0.5mol C.0.15mol D.0.25mol
19.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为 ( )
A.5∶3 B.5∶4 C.1∶1 D.3∶5
我要详细的解析,谢谢 纵马怒剑吼西风1年前1
纵马怒剑吼西风1年前1 -
 yihua123 共回答了15个问题
yihua123 共回答了15个问题 |采纳率86.7%D.先用③NaOH 沉淀Mg2+并将HCO3-变成CO32-;再用②BaCl2沉淀SO42-、CO32-;再用①Na2CO3 沉淀Ca2+和多余的Ba2+;最后用④HCl除去CO32-和OH-.B.根据电荷平衡的原理,正电荷1.5*1+0.5*2=负电荷1.5*1+X *2 X =0.5...1年前查看全部
大家在问
- 1英语翻译还有应该用什么时态?我将在口语里描述一个小孩
- 2必修二物理,哥哥姐姐好为什么 匀速圆周运动是线速度不变的运动 这句话为什么是错的
- 3小球圆周运动轻杆模型:小球受到的弹力方向一定延杆的方向吗?
- 4五年级思维题方程快放寒假了,小红想用节约的零用钱给幼儿园小班的小朋友每人买一件礼物:如果每人买一件2元钱的礼物,则差6元
- 5今年五月,汶川大地震带来了灾难性后果,为了防止疫情等次生在灾害的发生,灾后要对环境消毒.《广州日报》6月6日报道,针对“
- 6电路方面的问题在连接电路时,开关要处于( )状态,滑动变阻器要处于阻值( )处,这样做的目的是为了( ).
- 7糖份,淀粉,蛋白质,碳水化合物,哪样最容易转化成脂肪?
- 8Many teachers to teach fewer students,and let them study bet
- 9大伙儿都把袖子举起来,就连成一片云所代表的成语是什么
- 1062乘以271等于?
- 11把一个圆的半径扩大2倍后,面积增加了28.26平方厘米.原来圆的面积是多少?3Q
- 12紫色石蕊溶液只能用于测定溶液的___,而pH试纸可用于测定溶液的___.溶液的___常用pH来表示,pH的范围通
- 13谁能给我地理复习提纲?初二下!!!急
- 14已知函数y=(m−1)x的 m²-1次方 +m,
- 15有关蒲公英的作文
