钛镍合金 用途如题 副:自行车上使用了那些合金 与纯金属
 啸月20042022-10-04 11:39:541条回答
啸月20042022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 水仙与水草 共回答了12个问题
水仙与水草 共回答了12个问题 |采纳率91.7%- 兄弟是镍钛合金吧?
镍钛合金是一种形状记忆合金,形状记忆合金是能将自身的塑性变形在某一特定温度下自动恢复为原始形状的特种合金.它的伸缩率在20%以上,疲劳寿命达107次,阻尼特性比普通的弹簧高10倍,其耐腐蚀性优于目前最好的医用不锈钢,因此可以满足各类工程和医学的应用需求,是一种非常优秀的功能材料.
记忆合金除具有独特的形状记忆功能外,还具有耐磨损、抗腐蚀、高阻尼和超弹性等优异特点. - 1年前
相关推荐
- 氢气是理想的清洁能源,但储存和运输都比较困难.研究发现镧和镍的一种合金是储氢材料.下列有关这种镧镍合金的说法正确的是(
氢气是理想的清洁能源,但储存和运输都比较困难.研究发现镧和镍的一种合金是储氢材料.下列有关这种镧镍合金的说法正确的是( )
A.是镧和镍反应生成的一种新金属,其熔点比镧和镍高,硬度也比镧和镍大
B.是镧和镍反应生成的一种新金属,其熔点比镧和镍低,硬度也比镧和镍大
C.是镧和镍熔合的一种混合物,其熔点比镧和镍高,硬度比镧和镍大
D.是镧和镍熔合的一种混合物,其熔点比镧和镍低,硬度比镧和镍大 香草微醉1年前1
香草微醉1年前1 -
 我想爱简单 共回答了25个问题
我想爱简单 共回答了25个问题 |采纳率96%解题思路:合金就是一种或多种金属或非金属(其中必须至少有一种金属)经过混合熔融冷却后形成的一种或多种金属的混合物.
合金的性质:1、硬度大,合金的硬度一般比组成合金的成分金属的硬度大; 2、熔点低,许多合金的熔点比它的成分金属的熔点要低.合金就是一种或多种金属或非金属(其中必须至少有一种金属)经过经过混合熔融冷却后形成的一种或多种金属的混合物.故合金是混合物而不是一种新金属,较之混合前合金的性质也会发生变化主要有:1、硬度大,合金的硬度一般比组成合金的成分金属的硬度大; 2、熔点低,许多合金的熔点比它的成分金属的熔点要低.
故选D点评:
本题考点: 合金与合金的性质.
考点点评: 此题是对合金的概念及性质的考查,对合金知识的全面认识是解题的关键,属基础性知识考查题.1年前查看全部
- 镍合金有哪些?具体的牌号是什么?
 gdjmsz1年前1
gdjmsz1年前1 -
 岚毅 共回答了19个问题
岚毅 共回答了19个问题 |采纳率94.7%请查阅国家标准《加工镍及镍合金化学成分和产品形状》GBT5235-2007,上面非常齐全.1年前查看全部
- 日常生活中的金属炊具和医院中的金属医疗器械的主要成分是( ) A.锰合金钢 B.钨合金钢 C.钴镍合金钢 D.硅合金钢
 受伤的孤单1年前1
受伤的孤单1年前1 -
 爷板 共回答了12个问题
爷板 共回答了12个问题 |采纳率83.3%日常生活中的金属炊具和医院中的金属医疗器械的主要成份是不锈钢(钴镍合金钢),因为不锈钢不容易生锈,能使用很长时间.
故选C1年前查看全部
- (1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式______.
 (1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式______.
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式______.
(2)富勒烯衍生物由于具有良好的光电性能.富勒烯(C60)的结构如图1,分子中碳原子轨道的杂化类型为______;1mol C60分子中σ键的数目为______.科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示.该化合物中的K原子和C60分子的个数比为______.
(3)砷化镓是人工合成的新型半导体材料,其晶体结构与金刚石相似.
①GaAs晶体中,每个As与______个Ga相连.
②第一电离能:As______Se(填“>”、“<”或“=”).
(4)Na3AsO4可作杀虫剂.AsO43-的空间构型为______,与其互为等电子体的一种分子为______. marchesem1年前1
marchesem1年前1 -
 memory_lei 共回答了19个问题
memory_lei 共回答了19个问题 |采纳率94.7%解题思路:(1)镍原子核外有28个电子,根据构造原理书写其基态镍原子的核外电子排布式;
(2)根据每个碳原子含有的σ键个数确定其杂化方式,利用均摊法计算σ键个数;根据均摊法计算晶胞中K原子、C60分子数目,确定数目之比;
(3)①金刚石晶体中每个C与 4个C相连
②同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但注意第VA族元素大于相邻元素的第一电离能;
(4)AsO43-中,成键数为4,孤对电子数为(5+3-2×4)×[1/2]=0,为sp3杂化;等电子体的原子数和价电子数相同;(1)镍原子核外有28个电子,其基态镍原子的核外电子排布式为:1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)每个碳原子形成3个σ键个数且不含孤电子对,所以采用sp2 杂化,每个碳原子含有的σ键个数为[3/2],所以1mol C60分子中σ键的数目=1mol×60×[3/2]×NAmol-1=90NA,
晶胞中K原子数目=2×6×[1/2]=6、C60分子数目=1+8×[1/8]=2,故晶胞中K原子、C60分子数目之比=6:2=3;1,
故答案为:sp2;90NA;3:1;
(3)①金刚石晶体中每个C与 4个C相连,砷化镓晶体结构与金刚石相似,故GaAs晶体中,每个As与4个Ga相连;
故答案为:4;
②As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,As原子4p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于Se,
故答案为:>;
(4)AsO43-中含有的孤电子对数是0,中心原子有4个共价键,所以其构型是正四面体形.原子总数相同.价电子总数相同的分子称为等电子体.AsO43-中含有5个原子,32个价电子,所以与其互为等电子体的一种分子为四氯化碳,
故答案为:正四面体形;CCl4点评:
本题考点: 原子核外电子排布;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题是对物质结构的考查,涉及核外电子排布式、杂化轨道、化学键、电离能、配合物、晶胞计算等知识点,会利用均摊法进行晶胞有关计算,注意配位键形成条件.1年前查看全部
- (2013•奉贤区二模)工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使成为Fe2+、Co2
(2013•奉贤区二模)工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使成为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co3+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂):NaClO+A+B→NaCl+C+H2O
NaClO3+A+B→NaCl+C+H2O.
(1)请完成以上化学方程式:______,______.并回答实际生产上采用NaClO3来氧化Fe2+比较合算的理由:______.
(2)配平下列离子方程式,并回答问题:
______Fe(OH)3+______ClO-+______OH-→______FeO4n-+______Cl-+______H20
(3)已知有3.21g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=______.
(4)根据上述(2 ),(3)题推测FeO4n-能与下列哪些物质反应(只填序号)______.
A.Cl2 B.SO2 C.H2S D.O2 men80081年前1
men80081年前1 -
 yangang_117 共回答了14个问题
yangang_117 共回答了14个问题 |采纳率85.7%解题思路:(1)根据题意知,次氯酸钠和氯酸钠都是氧化剂,A是还原剂,则A失电子化合价升高,且溶液中含有硫酸,根据元素守恒判断A物质、C物质,然后根据氧化还原反应中得失电子数相等结合电荷守恒、原子守恒配平方程式;根据电子得失守恒可知相同质量NaClO3和NaClO,NaClO3得到的电子多,氧化更多的Fe2+来分析;
(2)根据氧化还原反应中得失电子数相等结合电荷守恒、原子守恒配平方程式;
(3)根据化合价确定反应中电子转移的数目,然后根据电子转移的数目与氢氧化铁质量之间的关系式计算n值;
(4)根据高铁酸根离子中铁元素的化合价知高铁酸根离子具有强氧化性,能和强还原性的物质反应.(1)根据题意知,次氯酸钠和氯酸钠都是氧化剂,A是还原剂,则A失电子化合价升高,且溶液中含有硫酸,所以A中含有还原性离子,实验的目的是把Fe2+氧化为Fe3+从而使Fe3+转化为某种沉淀析出知,A是硫酸亚铁,B是硫酸,结合元素守恒知,C是硫酸铁,
在反应NaClO+FeSO4+H2SO4→NaCl+Fe2(SO4)3+H2O中,铁元素的化合价+2→+3,失去1个电子,氯元素的化合价+1→-1价,得到2个电子,得失电子的最小公倍数是2,所以FeSO4的计量数是2,次氯酸根离子的计量数是1,然后根据原子守恒配平方程式得:NaClO+2FeSO4+H2SO4=NaCl+Fe2(SO4)3+H2O;
在反应NaClO3+FeSO4+3H2SO4→NaCl+Fe2(SO4)3+H2O中,铁元素的化合价+2→+3,失去1个电子,氯元素的化合价+5→-1价,得到6个电子,得失电子的最小公倍数是6,所以FeSO4的计量数是6,氯酸根离子的计量数是1,然后根据原子守恒配平方程式得:NaClO3+6FeSO4+3H2SO4=NaCl+3Fe2(SO4)3+3H2O
相同质量NaClO3和NaClO,NaClO3得到的电子多,氧化更多的Fe2+,
故答案为:NaClO+2FeSO4+H2SO4=NaCl+Fe2(SO4)3+H2O;NaClO3+6FeSO4+3H2SO4=NaCl+3Fe2(SO4)3+3H2O;相同质量NaClO3比NaClO氧化更多的Fe2+;
(2)该反应中铁元素的化合价+3→+(8-n),失去(5-n)个电子,氯元素的化合价+1→-1价,得到2个电子,得失电子的最小公倍数是2(5-n),所以氢氧化铁的计量数是2,次氯酸根离子的计量数是5-n,然后根据原子守恒配平方程式得:2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(n+3)H2O,故答案为:2、5-n、2n、2、5-n、n+3;
(3)在反应2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(n+3)H2O中电子转移的数目为(5-n)×2,即2molFe(OH)3转移电子(5-n)×2mol,所以3.21g (即0.03mo)Fe(OH)3参加反应,共转移了电子(5-n)×0.03mol,则(5-n)×0.03mol×6.02×1023mol-1=5.418×1022,解得n=2,故答案为:2;
(4)FeO42-中铁元素化合价是最高价,所以该离子具有强氧化性,能和强还原性的物质反应,氯气和氧气具有强氧化性,所以不能和高铁酸根离子反应,二氧化硫和硫化氢具有强还原性,所以能和高铁酸根离子反应,故答案为:B、C.点评:
本题考点: 氧化还原反应方程式的配平;氧化还原反应的计算;铁盐和亚铁盐的相互转变.
考点点评: 本题考查了氧化还原反应及其配平,难度不大,根据得失电子数相等来配平方程式即可,抓住元素化合价的变化是解题的关键.1年前查看全部
- 物质的分类与性质镧镍合金能大量吸收氢气形成金属氢化物,可以做储氢材料.这句话为什么是对的?氢气都反应掉了,怎么储氢呢?碱
物质的分类与性质
镧镍合金能大量吸收氢气形成金属氢化物,可以做储氢材料.这句话为什么是对的?氢气都反应掉了,怎么储氢呢?
碱性氧化物与金属氧化物的关系?金属氧化物都是碱性氧化物吗?
 hbwzz342821年前2
hbwzz342821年前2 -
 jstzd 共回答了21个问题
jstzd 共回答了21个问题 |采纳率95.2%一定条件下,镍镧合金能与H2反应,从而吸收氢气 LaNi5 + x H2 = LaNi5·xH2.
在另一个条件下,产物又能分解放出H2.
从而实现储氢.
碱性氧化物都是金属氧化物,但金属氧化物不都是碱性氧化物.
比如CrO3、Mn2O7是酸性氧化物,Al2O3、ZnO是两性氧化物1年前查看全部
- (12分)(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式
(12分)
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 。
(2)富勒烯衍生物由于具有良好的光电性能。富勒烯(C 60 )的结构如图1,分子中碳原子轨道的杂化类型为 ;1 mol C 60 分子中σ键的数目为 。科学家把C 60 和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示。该化合物中的K原子和C 60 分子的个数比为 。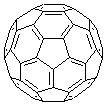
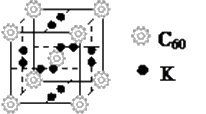
图1 图2
图2
(3)砷化镓是人工合成的新型半导体材料,其晶体结构与金刚石相似。
①GaAs晶体中,每个As与 个Ga相连。
②第一电离能:As Se(填“>”、“<”或“=”)。
(4)Na 3 AsO 4 可作杀虫剂。AsO 4 3- 的空间构型为 ,与其互为等电子体的一种分子为 。 mary蹄儿1年前1
mary蹄儿1年前1 -
 jiepi2000 共回答了17个问题
jiepi2000 共回答了17个问题 |采纳率76.5%(12分)
(1)[Ar]3d 8 4s 2 (2分)
(2)sp 2 (2分) 90mol(2分) 3:1(2分)
(3)①4 (1分) ②>(1分)
(4)正四面体形(1分) CCl 4 (1分)(或其他合理答案)
1年前查看全部
- 为什么镁镍合金可做储氢材料
 爱笔爱到心坎里1年前1
爱笔爱到心坎里1年前1 -
 哪个名字没注册 共回答了18个问题
哪个名字没注册 共回答了18个问题 |采纳率94.4%镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料.
20世纪70年代以来,在氢能研究中发现某些过渡金属合金具有可逆吸放氢的功能,如镧镍金属间化合物:LaNi5+3H2LaNi5H6,可用这类合金材料作为储氢材料,来装载和运输氢气.
储氢材料有三个重要系列:镍基合金,如 LaNi6、LnNi5(Ln为混合稀土元素)、LaNi4Cu等;铁基合金,如TiFe、Ti(Fe1-xMnx)、Ti(Fe1-xNix) 等;镁基合金,如Mg2Cu、Mg2Ni等.
金属或合金(用M代表)与氢作用可以生成金属氢化物(MHn).其反应方程式为:M+nH2=MHn+△H(生成热)
该反应是一个可逆过程、正向反应时,金属吸氢,并放出热量;逆向反应时,金属氢化物释氢,吸收热量.这样,只需要改变温度与压力,就能使反应向正向或逆向反复进行.达到金属(合金)储氢或释氢的日的.当然,不是任何金属或合金都只有上述的功能,所以发现合适的金属和合金是获得储氢材料的关键问题了.1年前查看全部
- 请问如果用于高温反应容器,铝合金,镍合金,不锈钢谁的耐腐蚀性最强?
 卓狼1年前3
卓狼1年前3 -
 yuye8 共回答了24个问题
yuye8 共回答了24个问题 |采纳率95.8%镍合金1年前查看全部
- 防弹衣是由什么材料制成的[1] 软不透钢 [2] 钨合金钢 [3] 镍合金钢 [4] 陶瓷玻璃钢我只要一个确切的答案,不
防弹衣是由什么材料制成的
[1] 软不透钢
[2] 钨合金钢
[3] 镍合金钢
[4] 陶瓷玻璃钢
我只要一个确切的答案,不要理由~ blueeyeno11年前1
blueeyeno11年前1 -
 口是心非abcd 共回答了27个问题
口是心非abcd 共回答了27个问题 |采纳率81.5%有用玻璃钢的…1年前查看全部
- [最高分]求Inconel 625和Inconel 600两种镍合金材料的高温氧化属性!
[最高分]求Inconel 625和Inconel 600两种镍合金材料的高温氧化属性!
我将用这两种材料的其中一种来做机械夹具,这夹具在实际应用中,是放到高温环境的模具里的,由于温度高达1100摄氏度,时间长了在夹具的表面会起氧化,会脱落一些毛刺.
我是想问哪种材料在上述高温下,被氧化产生表面脱落产生毛刺的时间长一些,我将会采购时间长(抗氧化好)的这种做该夹具.这里请大家介绍下这两种材料在高温下的抗氧化的强度,到底哪个好?
ps:薄板材
我自己搜集了一些这两种材料的信息,可供大家做参考:
Inconel 625:
镍含量58% 铬含量:20-23% 铁含量:5% 熔点:1290-1350摄氏度 布氏硬度: cherrysummer1年前1
cherrysummer1年前1 -
 桑吉娜娃 共回答了16个问题
桑吉娜娃 共回答了16个问题 |采纳率87.5%当然选择Inconel 600.镍越多对合金在高温的晶粒长大,奥氏体相保持越好.我就是搞镍基合金的.另外你做夹具肯定要保持高温材料的强度,Inconel 600镍会阻滞晶粒长大,同时含铁稍多,这也有利于在高温下保证强度.在氧化方面从理论和你提供的数据都说明了Inconel 600的抗氧化性能.
要是还有问题,可以在百度发信息我.1年前查看全部
- 下列几中物质,能被磁化的是哪个() A.石墨 B.铁,钴镍合金C. 紫铜D.氧化铝
下列几中物质,能被磁化的是哪个() A.石墨 B.铁,钴镍合金C. 紫铜D.氧化铝
请告诉一下为什么! anta0081年前6
anta0081年前6 -
 阿里山电脑6 共回答了16个问题
阿里山电脑6 共回答了16个问题 |采纳率93.8%B
这个记住就可以了,这三种是磁性元素.
具体的原因要到你上大学学物理的话可能会接触到.1年前查看全部
- (1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式______.
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式______.
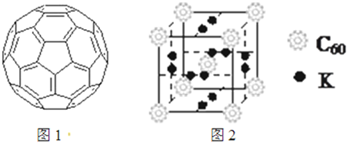
(2)富勒烯衍生物由于具有良好的光电性能.富勒烯(C60)的结构如图1,分子中碳原子轨道的杂化类型为______;1mol C60分子中σ键的数目为______.科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示.该化合物中的K原子和C60分子的个数比为______.
(3)砷化镓是人工合成的新型半导体材料,其晶体结构与金刚石相似.
①GaAs晶体中,每个As与______个Ga相连.
②第一电离能:As______ Se(填“>”、“<”或“=”).
(4)Na3AsO4可作杀虫剂.AsO43-的空间构型为______,与其互为等电子体的一种分子为______. 你们都还好1年前1
你们都还好1年前1 -
 exlude2335 共回答了12个问题
exlude2335 共回答了12个问题 |采纳率91.7%解题思路:(1)镍是28号元素,根据原子核外电子排布规律可以写出核外电子排布式;
(2)根据价层电子对互斥理论确定杂化方式,利用均摊法计算每个碳原子含有几个σ键,从而计算1mol C60分子中σ键的数目,利用均摊法确定K原子和C60分子的个数比;
(3)①晶体结构与金刚石相似,则为原子晶体,以共价键形成空间网状结构;
②同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素;
(4)AsO43-中,成键数为4,孤对电子数为(5+3-2×4)×[1/2]=0,为sp3杂化;等电子体的原子数和价电子数相同;(1)镍是28号元素,根据原子核外电子排布规律可以写出核外电子排布式为:[Ar]3d84s2,故答案为:[Ar]3d84s2;
(2)每个碳原子含有的σ键个数且不含孤电子对,所以采用sp2 杂化,每个碳原子含有的σ键个数为[3/2],所以1mol C60分子中σ键的数目=[3/2]×60NA=90NA,该晶胞中C60个数=1+8×[1/8]=2,6×2×[1/2]=6,所以K原子和C60分子的个数比为6:2=3:1,故答案为:sp2,90NA,3:1;
(3)①金刚石形成的晶体属于原子晶体,碳原子可以形成4个碳碳单键,所以每个As应与4个Ga相连,故答案为:4;
②同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,所以As、Se两种元素的第一电离能:As>Se,故答案为:>;
(4)AsO43-中含有的孤电子对数是0,中心原子有4个共价键,所以其构型是正四面体形.原子总数相同.价电子总数相同的分子称为等电子体.AsO43-中含有5个原子,32个价电子,所以与其互为等电子体的一种分子为四氯化碳,故答案为:正四面体形;CCl4;点评:
本题考点: 晶胞的计算;不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题考查了核外电子排布、原子轨道杂化、晶体的结构及等电子体等知识,中等难度.1年前查看全部
大家在问
- 1已知双曲线方程 ,求焦点在标,离心率,渐近线方程 (1) 16x^2-9y^2=144 (2) 16x^2-9y^2=-
- 2某地理课外研究小组,对附近的山峰进行一次考察活动.请根据资料,完成1~4题:
- 3物体之间为什么会有万有引力存在?
- 4关于电磁波与机械波,下列说法正确的是 [ ] A.电磁波传播不需要介质,
- 5(2009•晋江市质检)已知:如图,从地面上的点P测得大楼的某扇窗户A的仰角为37°,再从点P测得该大楼窗户A正上方的另
- 6金属块在空气中测量2.7n,把它浸没在水中为1.7n,水没有溢出,求物体密度,
- 7出句:高卧华山披日月,只是换了日月,莫道不知日月!如有能对者,重重有赏!先以20金作为奖励.注意平仄.
- 8一锥形瓶(上窄下宽)中盛有10℃的水,现将它冷却,使水温降到0℃,这一过程中(不计水的汽化及锥形瓶的热
- 9酸和碱都能发生反应吗?产物都是盐和水吗?
- 10什么饮料富含葡萄糖
- 11体现游子怀恋故土.思念家乡的四句古诗文名句
- 12英语翻译河北省唐山市路北区体育馆道煤医里
- 13如图,在正方形ABCD中,对角线AC与BD交于点O,AE平分∠BAC于E,交BO于F.求证:EC=2FO
- 14怎么求"已知比一个数多/少百分之几的数是多少,求这个数"这样的问题
- 15车站 的英文单词
