25℃时,20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液(如图),下列说法正确的是( )
 lhy8208232022-10-04 11:39:541条回答
lhy8208232022-10-04 11:39:541条回答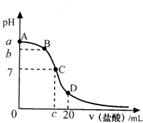 25℃时,20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液(如图),下列说法正确的是( )
25℃时,20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液(如图),下列说法正确的是( )A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.在C点,c<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+)
C.若25℃时 0.1mol/L 氨水电离度为1.33%,则b<a<12
D.在D点:c(NH4+)+c(NH3•H2O)=2c(Cl-)

已提交,审核后显示!提交回复
共1条回复
 fox_male 共回答了17个问题
fox_male 共回答了17个问题 |采纳率94.1%- 解题思路:氨水呈碱性,盐酸呈酸性,向氨水中加入盐酸,发生酸碱中和反应导致溶液的pH值降低,当盐酸和氨水的物质的量相等时,恰好生成氯化铵;当继续加盐酸时,盐酸的物质的量远远大于氨水时,溶液中以盐酸为主,溶液的PH值近似于盐酸的PH值.
溶液中根据物料守恒和电荷守恒判断溶液中离子浓度的相对大小.A、在A、C间任一点,当盐酸的量很少时,溶液中以氨水的电离为主,所以溶液中离子存在的关系可能是c(NH4+)>c(OH-)>c(Cl-)>c(H+),故A错误;B、氯化铵是强酸弱碱盐,其水溶液呈酸性,当溶液的PH=7时,氨水...
点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱中和反应中PH值图象的分析,难度不大,注意特殊点的分析,1未加盐酸溶液时,2酸碱恰好反应时,3溶液的PH=7时. - 1年前
相关推荐
- 用0.1molL-1HCl标准溶液滴定20mL0.1molL-1NH3求化学计量点的PH?NH4的Ka=5.6X10^-
用0.1molL-1HCl标准溶液滴定20mL0.1molL-1NH3求化学计量点的PH?NH4的Ka=5.6X10^-10
 兆伟1年前1
兆伟1年前1 -
 韦爵爷zhipolan 共回答了20个问题
韦爵爷zhipolan 共回答了20个问题 |采纳率90%答:按照一元强酸滴定弱碱的化学计量点的计算通式:
[H+] = [CKa]^1/2 = [(0.1/2)X5.6X10^-10]^1/2 = 5.3x10^-6 mol/L
PH = 5.281年前查看全部
- (2012•聊城一模)常温下,将0.1mol.L-1.盐酸逐滴加入到20mL0.1mol•L-1氨水中,测得溶液的pH随
 (2012•聊城一模)常温下,将0.1mol.L-1.盐酸逐滴加入到20mL0.1mol•L-1氨水中,测得溶液的pH随加入盐酸的体积变化如图所示.下列说法正确的是( )
(2012•聊城一模)常温下,将0.1mol.L-1.盐酸逐滴加入到20mL0.1mol•L-1氨水中,测得溶液的pH随加入盐酸的体积变化如图所示.下列说法正确的是( )
A.①溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.②溶液中:c(NH 4+)=c(Cl-)=c(OH-)=c(H+)
C.③溶液中:c(Cl-)+c(H+)=c(NH4+)+c(OH-)
D.滴定过程中可能出现:c(NH3H•2O)>c(NH4+)>c(OH−)>c(Cl-)>c(H+) 时桥1年前1
时桥1年前1 -
 月心百合 共回答了8个问题
月心百合 共回答了8个问题 |采纳率87.5%解题思路:根据酸碱滴定过程的图中①、②、③点的pH值来分析溶液中的溶质,并利用原子守恒和电荷守恒来分析解答.A.①溶液中的溶质为等物质的量浓度的氨水和氯化铵,氨水的电离程度大于铵根离子的水解程度,所以溶液呈碱性,c(OH-)>c(H+),根据电荷守恒的c(Cl-)<c(NH4+),故A错误;
B.②溶液呈中性,c(OH-)=c(H+),根据电荷守恒得c(Cl-)=c(NH4+),因为水的电离较微弱,所以c(Cl-)>c(OH-),故B错误;
C.③中溶质是氯化铵,溶液呈酸性,c(OH-)<c(H+),溶液呈电中性,所以c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以c(Cl-)>c(NH4+),则c(Cl-)+c(H+)>c(NH4+)+c(OH-),故C错误;
D.当溶液中氨水的量远远大于盐酸时,可能出现c(NH3H•2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D正确;
故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱混合溶液定性判断,根据物料守恒和电荷守恒来分析解答,难度中等.1年前查看全部
- 下列图象表达正确的是( )A.图①表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液
下列图象表达正确的是( )

A.图①表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液
B.图②表示常温下,两份足量、等浓度的盐酸与等量锌粉反应时,其中一份滴加了少量硫酸铜溶液
C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液
D.图④表示向醋酸溶液中滴入氨水 年骅1年前1
年骅1年前1 -
 xn8123 共回答了17个问题
xn8123 共回答了17个问题 |采纳率76.5%解题思路:A、根据NaOH在滴定开始时的pH、以及滴定终点发生突跃来判断;
B、根据原电池可加快化学反应速率,氢气的质量由锌粉的质量决定;
C、根据向CaCl2与盐酸的混合溶液中慢慢滴入Na2CO3溶液,Na2CO3首先与HCl反应放出气体二氧化碳,待完全反应后,继续与CaCl2反应生成碳酸钙沉淀.
D、根据向醋酸溶液中滴入氨水溶液中离子浓度的变化来回答;A、0.1mol•L-1NaOH溶液的pH为13,用0.1mol•L-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错;
B、锌粉与硫酸铜反应生成了铜,消耗了锌粉,锌粉、铜和盐酸构成了原电池,加快了化学反应速率,但产生的氢气减少,故B错误;
C、图象表示滴入一定量Na2CO3时开始无沉淀,至HCl完全反应后才产生沉淀,与实事相符,故C正确;
D、向醋酸溶液中滴入氨水,生成了强电解质,溶液中离子浓度增大,恰好反应后继续滴加,溶液相当于稀释,溶液中离子浓度减小,故D错误;
故选:C.点评:
本题考点: 中和滴定;化学反应速率的影响因素;强电解质和弱电解质的概念.
考点点评: 本题以图象与中和滴定、化学反应的先后顺序、原电池对化学反应速率的影响来考查学生,这些知识点是新课程改革考查的重点,明确考点“形变神不变”,做到善于抓规律、编网络来掌握即可.1年前查看全部
- 常温下,将0.1mol.L -1 .盐酸逐滴加入到20mL0.1mol•L -1 氨水中,测得溶液的pH随加入盐酸的体积
常温下,将0.1mol.L -1 .盐酸逐滴加入到20mL0.1mol•L -1 氨水中,测得溶液的pH随加入盐酸的体积变化如图所示.下列说法正确的是( ) A.①溶液中c(Cl - ) >c(N H 4 + ) >c(OH - )>c(H + ) B.②溶液中:c(NH 4 + )=c(Cl - )=c(OH - )=c(H + ) C.③溶液中:c(Cl - )+c(H + )= c(N H 4 + ) +c(OH - ) D.滴定过程中可能出现:c(NH 3 H• 2 O) >c(N H 4 + )>c(O H - )> c(Cl - )>c(H + ) 
 qyys06041年前1
qyys06041年前1 -
 阿宏 共回答了22个问题
阿宏 共回答了22个问题 |采纳率90.9%A.①溶液中的溶质为等物质的量浓度的氨水和氯化铵,氨水的电离程度大于铵根离子的水解程度,所以溶液呈碱性,c(OH - )>c(H + ),根据电荷守恒的c(Cl - )<c(NH 4 + ),故A错误;
B.②溶液呈中性,c(OH - )=c(H + ),根据电荷守恒得c(Cl - )=c(NH 4 + ),因为水的电离较微弱,所以c(Cl - )>c(OH - ),故B错误;
C.③中溶质是氯化铵,溶液呈酸性,c(OH - )<c(H + ),溶液呈电中性,所以c(NH 4 + )+c(H + )=c(Cl - )+c(OH - ),所以c(Cl - )>c(NH 4 + ),则c(Cl - )+c(H + )>c(NH 4 + )+c(OH - ),故C错误;
D.当溶液中氨水的量远远大于盐酸时,可能出现c(NH 3 H• 2 O)>c(NH 4 + )>c(OH - )>c(Cl - )>c(H + ),故D正确;
故选D.1年前查看全部
- I.常温下在20mL0.1mol∙L-1Na2CO3溶液中逐滴加入0.1mol∙L-1 HCl溶液40mL,溶
I.常温下在20mL0.1mol∙L-1Na2CO3溶液中逐滴加入0.1mol∙L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:

(1)H2CO3、HCO3-、CO32-中不能大量共存于同一溶液中的是______.
(2)实验室可用“双指示剂法”测定碳酸钠、碳酸氢钠混合溶液中各种物质的含量,操作步骤如下:
①取固体样品配成溶液;
②取25mL样品溶液加指示剂A,用0.1010mol/LNaOH标准溶液滴定至终点;
③再加指示剂B,再用0.1010mol/LNaOH标准溶液滴定至终点…
指示剂B的变色范围在pH=______左右最理想.
(3)当pH=7时,此时再滴入盐酸溶液所发生反应离子方程式是______.
(4)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=
=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______.c(
)•c(OH−)HCO −3c(
)CO 2−3
II.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A H++HA- HA-
H++HA- HA- H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
(A)0.01mol.L-1的H2A溶液
(B)0.01mol.L-1的NaHA溶液
(C)0.02mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
(D)0.02mol.L-1的NaOH与0.02mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(5)c(H+)最大的是______,c(H2A)最大的是______,c(A2-)最大的是______. sunkblue1年前1
sunkblue1年前1 -
 zsjso 共回答了21个问题
zsjso 共回答了21个问题 |采纳率81%解题思路:Ⅰ.(1)根据各含碳微粒存在的PH范围分析;
(2)加入盐酸,先用酚酞作指示,当达滴定终点时可计算碳酸钠的浓度,在用甲基橙做指示剂,当达到滴定终点时可知碳酸氢钠的浓度;
(3)pH=7时,溶液主要存在的离子是HCO3-;
(4)根据平衡常数计算;
Ⅱ.从弱电解质的电离平衡和盐类的水解平衡移动的影响因素分析.I.(1)由图象可以看出,H2CO3存在于PH<8的溶液中,CO32-存在于PH>8的溶液中,二者不能大量共存于同一溶液中,
故答案为:H2CO3、CO32-;
(2)试剂B为甲基橙,变色范围为3.1~4.4,当溶液颜色由黄色变为橙色时,pH约为4.5左右,故答案为:4.5;
(3)pH=7时,溶液主要存在的离子是HCO3-,滴入盐酸溶液所发生反应离子方程式是HCO3-+H+=H2CO3,故答案为:HCO3-+H+=H2CO3;
(4)当溶液中c(HCO3-):c(CO32-)=2:1时,根据Kh=
c(
HCO−3)•c(OH−)
c(
CO2−3)=2×10-4,
则有:c(OH-)=
2×10−4×c(C
O2−3)
c(HC
O−3)=1×10-4,
c(H+)=
1×10−14
1×10−4=1×10-10,
PH=-lg(10-10)=10,故答案为:10;
II.(5)C中的HCl与NaHA发生反应HCl+NaHA=H2A+NaCl后,得到0.01mol/LH2A和0.01mol/LNaHA的混合溶液,
D中0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合以后,发生反应NaOH+NaHA=Na2A+H2O,得到的是0.01mol/LNa2A溶液,以第一步水解为主,则c(A2-)最大,
根据相同浓度时的电离能力K1>>K2可知,C溶液中的HA-基本不电离,对溶液中c(H+)的增大贡献极小,
而由于浓度大,对H2A的电离平衡起抑制作用,致使C中c(H+)不如溶液A大,但c(H2A)大于A,
故答案为:A; C;D.点评:
本题考点: 探究碳酸钠与碳酸氢钠的性质;弱电解质在水溶液中的电离平衡;盐类水解的应用;离子共存问题.
考点点评: 本题考查较为综合,难度较大,注意双指示剂法的测定原理,为本题的易错点.1年前查看全部
- 25℃时,在20mL0.1mol•L -1 NaOH溶液中逐滴加入0.2mol•L -1 醋酸溶液,pH的变化曲线如图所
25℃时,在20mL0.1mol•L -1 NaOH溶液中逐滴加入0.2mol•L -1 醋酸溶液,pH的变化曲线如图所示,有关粒子浓度关系的比较中,不正确的是( ) A.在A点:C(Na + )>C(OH - )>C(Ac - )>C(H + ) B.在B点:C(Na + )=C(Ac - )>C(OH - )=C(H + ) C.在C点:C(Ac - )+C(HAc)=2C(Na + ) D.在C点:C(Ac - )>C(Na + )>C(H + )>C(OH - ) 
 zmhuang1年前1
zmhuang1年前1 -
 3213649 共回答了13个问题
3213649 共回答了13个问题 |采纳率76.9%A.在A点醋酸和NaOH恰好中和生成NaAc,为强碱弱酸盐,水解呈碱性,但Ac - 水解程度较小,应为c(Ac - )>c(OH - ),故A错误;
B.B点呈中性,应为C(Na + )=C(Ac - )>C(OH - )=C(H + ),故B正确;
C.C点时,n(NaOH)=0.02L×0.1mol/L=0.002mol,n(HAc)=0.02mol/L×0.02L=0.004mol,根据物料守恒可知c(Ac - )+c(HAc)=2c(Na + ),故C正确;
D.C点醋酸过量,溶液呈酸性,应存在C(Ac - )>C(Na + )>C(H + )>C(OH - ),故D正确.
故选A.1年前查看全部
- 常温下,在20mL0.1mol•L-1Na2CO3溶液中逐渐滴入0.1mol•L-1HCl溶液40mL,溶液的PH逐渐降
常温下,在20mL0.1mol•L-1Na2CO3溶液中逐渐滴入0.1mol•L-1HCl溶液40mL,溶液的PH逐渐降低,下列说法正确的是( )
A.完全反应以后,溶液呈现中性
B.当盐酸加入10mL时,溶液中:c(CO32-)=C(HCO3-)
C.在20mL0.1mol•L-1Na2CO3溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)
D.当盐酸加入20mL时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) 可口可爱1年前1
可口可爱1年前1 -
 tt甲110 共回答了21个问题
tt甲110 共回答了21个问题 |采纳率95.2%解题思路:碳酸钠的物质的量为:0.1mol/L×0.02L=0.002mol,盐酸的物质的量=0.1mol/L×0.04L=0.004mol,当二者反应时,碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,碳酸氢钠和盐酸反应生成氯化钠和二氧化碳,根据二者的物质的量可知,二者恰好反应生成氯化钠、二氧化碳和水,
A.反应后的溶液中含有部分二氧化碳,溶液为弱酸性;
B.加入10mL盐酸时,恰好反应生成碳酸氢钠,碳酸氢根离子浓度大于碳酸根离子;
C.根据碳酸钠溶液中的质子守恒进行判断;
D.加入盐酸后,溶液中存在氯离子,电荷守恒中必须含有氯离子.A.完全反应后,部分二氧化碳溶于水,导致溶液呈弱酸性,故A错误;
B.当盐酸加入20mL时,二者恰好反应生成碳酸氢钠,碳酸氢根离子水解导致溶液中NaHCO3的物质的量小于0.002mol,故B错误;
C.碳酸钠溶液中存在质子守恒,根据质子守恒得:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-),故C正确;
D.加入20mL盐酸后,溶液中含有了氯离子,根据电荷守恒可得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),故D错误;
故选C.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查了离子浓度大小的判断,题目难度中等,明确反应过程及混合液中的溶质组成为解本题关键,结合电荷守恒和物料守恒判断溶液中各离子浓度大小.1年前查看全部
大家在问
- 16(x-y)^2+3(y-x)^3 因式分解 用提公因式法
- 2设n元线性方程组AX =b,且R(A,b)=n+1,则该方程组的解的情况是什么?请说出为什么,
- 3描写荆轲易水诀别时风萧萧兮易水寒壮士一去兮不复还送别情景200字小作文
- 4八年级下数学有哪些章节(人教版)
- 5为什么内环境的三种组成成分中血浆最活跃?
- 6三个素数的乘积是105,这三个素数分别是(),(),()?
- 7漂浮在液体上的物体漂浮在液面浮力与重力相等吗
- 8求一句名言,是那位大师说的?只要你服务公众,就有活着的理由.
- 9我的语文书没带 谁知到人教版6年级上册13课 就是那个只有一个地球 的字是什么 预习要用
- 10修路队原计划每天修路3.2千米,15天可以修完.实际每天修4千米,多少天可以修完?【用比例解】
- 11用一块长为3m,宽为2m的矩形木板,在墙角处(墙角为直角)围出一个侧面均为矩形的三棱柱形谷仓,则怎样能使得其容积最大?
- 12My mother runs at sixevery morning.(对at six提问)
- 13“我想告诉你,当我听到这首歌时,我就会想你”翻译成英语怎么说啊
- 14为什么导体运动方向与磁场方向成90度时感应电动势最大?
- 15五个氧分子用化学符号表示
