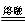某软锰矿石中二氧化锰的质量分数78%,如果其他成分不与浓盐酸反应,则150g此矿石与足量浓盐酸反应,制得的氯气在标准状况
 大力菜182022-10-04 11:39:541条回答
大力菜182022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 luckysalt 共回答了20个问题
luckysalt 共回答了20个问题 |采纳率90%- MnO2 + 4H+ + Cl- ====== Mn2+ + Cl2(气体符号) + 2H2O
氯气物质的量:150*78%/87=1.345
质量:1.345*71=94.5g - 1年前
相关推荐
- MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
(l)软锰矿、闪锌矿与硫酸共热:MnO 2 +ZnS +2H 2 SO 4 = MnSO 4 +ZnSO 4 +S↓+2H 2 O
(2)除去反应混合物中的不溶物
(3)电解混合液:MnSO 4 + ZnSO 4 +2H 2 O MnO 2 +Zn+2H 2 SO 4 下列说法不正确的是[ ]
MnO 2 +Zn+2H 2 SO 4 下列说法不正确的是[ ]A.步骤(l)中MnO 2 和H 2 SO 4 都是氧化剂
B.步骤(1)中每析出12. 8 g S沉淀共转移0.8mol电子
C.步骤(3)中电解时MnO 2 在阳极处产生
D.硫酸在生产中可循环使用 younger0071年前1
younger0071年前1 -
 四点钟 共回答了28个问题
四点钟 共回答了28个问题 |采纳率96.4%A1年前查看全部
- 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)MnCl2
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O.现将23.2g含MnO2的质量分数为75%的软锰矿石与足量10mol/L浓盐酸完全反应(杂质不参加反应).把反应后所得溶液稀释成200ml.计算:
(1)生成的Cl2的体积(标准状况).
(2)参加反应的浓盐酸的体积.
(3)稀释后溶液中MnCl2的物质的量浓度. 风中_蔷薇1年前1
风中_蔷薇1年前1 -
 185910033 共回答了20个问题
185910033 共回答了20个问题 |采纳率90%解题思路:(1)根据质量分数计算软锰矿中二氧化锰的质量,再根据n=[m/M]计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积;
(2)根据方程式计算参加反应的HCl的物质的量,再根据V=[n/c]计算参加反应的浓盐酸的体积;
(3)消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2),根据c=[n/V]计算稀释后液中MnCl2的物质的量浓度.(1)23.2g含MnO2的质量分数为75%的软锰矿石中MnO2的物质的量为:[23.2g×75%/87g/mol]=0.2mol,则:
MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O
1 1
0.2mol n(Cl2)
所以n(Cl2)=0.2mol,故V(n(Cl2)=0.2mol×22.4L/mol=4.48L,
答:标准状况下生成的Cl2的体积为4.48L;
(2)由方程式可知,参加反应的HCl的物质的量为0.2mol×4=0.8mol,故参加反应的浓盐酸的体积为[0.8mol/10mol/L]=0.08L,
答:参加反应的浓盐酸的体积是0.08L;
(3)消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2)=0.2mol,将反应后所得溶液稀释成200mL,稀释后液中MnCl2的物质的量浓度为[0.2mol/0.2L]=1mol/L,
答:稀释后液中MnCl2的物质的量浓度为1mol/L.点评:
本题考点: 化学方程式的有关计算;物质的量浓度的相关计算;氯气的实验室制法.
考点点评: 本题考查根据方程式的计算、常用化学计量数的有关计算,比较基础,旨在考查学生对基础知识的理解掌握.1年前查看全部
- 1774年瑞典化学家舍勒用软锰矿(主要成分是二氧化锰)和浓盐酸共热得到黄绿色气体.甲、乙两个同学分别采取上述反应原理,各
1774年瑞典化学家舍勒用软锰矿(主要成分是二氧化锰)和浓盐酸共热得到黄绿色气体.甲、乙两个同学分别采取上述反应原理,各制取一瓶氯气,并用其验证Cl2与水反应产物的性质.甲、乙同学采用的装置如下图所示,回答下列问题:
(1)写出实验中制备氯气的化学方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O△ .MnO2+4HCl(浓).
MnCl2+Cl2↑+2H2O△ .
(2)对于乙同学的实验装置,要停止实验,其操作顺序是______.
①停止加热②取出集气瓶盖好③将导管加装防倒吸装置后伸入到烧碱溶液中
(3)甲、乙两同学分别向收集到的氯气中加入适量的水,充分振荡后分成两份,均做了以下两个实验.实验操作、现象、结论记录如下:
请你填写下表,评价甲、乙同学实验①、②的结论(填合理或不合理):实验序号 实验操作 现象 结论 ① 加品红溶液 溶液褪色 氯气与水反应的产物有漂白性 ② 加入NaHCO3粉末 有无色气泡产生 氯气与水反应的产物具有较强的酸性
若不合理,理由是______实验序号 甲 乙 ① ②
(4)实验中甲、乙两同学均发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气.针对上述现象,甲、乙两同学对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体混合,加热
①实验b的目的是______;实验c的目的是______.
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成.由此得出影响氯气生成的原因是______. juneaszhao1年前1
juneaszhao1年前1 -
 魔羯座MM 共回答了28个问题
魔羯座MM 共回答了28个问题 |采纳率75%解题思路:(1)盐酸二氧化锰在加热条件下反应生成氯气、氯化锰和水;
(2)按照实验操作安全及尾气处理要求:乙同学停止实验应先取出集气瓶,将多余的氯气通入氢氧化钠,最后停止加热;
(3)甲同学用向上排空气法收集氯气,因为氯化氢具有挥发性,所以收集的氯气中含有大量的氯化氢,氯化氢与碳酸氢钠反应生成二氧化碳气体,对氯水成分的检验造成干扰;乙同学制备的氯气中无氯化氢不会对氯水中的氯化氢的检验造成干扰;
(4)①氯化钠固体电离产生氯离子,加入氯化钠固体,改变氯离子浓度;硫酸电离产生大量氢离子,加入浓硫酸实际改变氢离子浓度;
②依据实验现象分析实验结论.(1)实验室制备氯气的方程式为:MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O;
(2)氯气有毒不能排放到空气中,先停止加热容易发生倒吸,所以乙同学的实验装置,要停止实验,其操作顺序为:先取出集气瓶,将多余的氯气通入氢氧化钠,最后停止加热;
故答案为:②③①;
(3)甲同学用向上排空气法收集氯气,因为氯化氢具有挥发性,所以收集的氯气中含有大量的氯化氢,氯化氢与碳酸氢钠反应生成二氧化碳气体,对氯水成分的检验造成干扰;乙同学制备的氯气中无氯化氢不会对氯水中的氯化氢的检验造成干扰;
故答案为:
实验序号甲乙
①合理合理
②不合理合理因为甲同学收集的氯气中含有大量的氯化氢杂质,溶于水时也会与碳酸氢钠粉末反应而产生气泡;
(4)①b加入氯化钠固体,改变氯离子浓度;c加入浓硫酸,改变的是氢离子的浓度;
故答案为:探究氯离子浓度对反应的影响;探究氢离子浓度对反应的影响;
②a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成,由此得出影响氯气生成与氢离子浓度大小有关,故答案为:氢离子浓度大小.点评:
本题考点: 氯气的实验室制法;氯、溴、碘的性质实验.
考点点评: 本题为实验评价,题目难度中等,明确反应的原理,实验设计的目的是解题关键.1年前查看全部
- 瑞典化学家舍勒将软锰矿(主要成分MnO 2 )与浓盐酸混合加热,在世界上首先制得了氯气,反应的化学方程式为______,
瑞典化学家舍勒将软锰矿(主要成分MnO 2 )与浓盐酸混合加热,在世界上首先制得了氯气,反应的化学方程式为______,该反应中若制得氯气1mol,则被氧化的还原剂是______mol.  410年威士忌1年前1
410年威士忌1年前1 -
 天天上猫扑 共回答了17个问题
天天上猫扑 共回答了17个问题 |采纳率88.2%瑞典化学家舍勒将软锰矿(主要成分MnO 2 )与浓盐酸混合加热,在世界上首先制得了氯气,反应的原理是二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,反应的化学方程式为:MnO 2 +4HCl(浓)
△
.
MnCl 2 +Cl 2 ↑+2H 2 O,反应中4molHCl有2mol做还原剂,2mol做酸生成盐,生成1mol氯气有2mol氯化氢被氧化,
故答案为:MnO 2 +4HCl(浓)
△
.
MnCl 2 +Cl 2 ↑+2H 2 O;2.1年前查看全部
- 含MnO217.4克的软锰矿与足量的浓盐酸反应生成的氯气通入含22克NaBr的水溶液中.经过蒸发并干燥得质量为
含MnO217.4克的软锰矿与足量的浓盐酸反应生成的氯气通入含22克NaBr的水溶液中.经过蒸发并干燥得质量为
13.1克的残渣,则反应生成的Nacl的质量为多少?残渣的成分是什么? 海阔泛舟1年前1
海阔泛舟1年前1 -
 嫁不出去的老女人 共回答了24个问题
嫁不出去的老女人 共回答了24个问题 |采纳率100%2NaBr+Cl2 = 2NaCl+Br2 Δm
2*103 58.5*2 2*44.5
x 22-13.1
x=58.5*2*(22-13.1)/2/44.5=11.7g,则NaBr为13.1-11.7=1.4g
残渣为11.7g的NaCl和1.4gNaB1年前查看全部
- (2011•湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生
 (2011•湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
(2011•湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.
②IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4
(1)A中属于还原产物的是______.
(2)Ⅱ中加入MnCO3、Zn2(OH)2CO3的作用是______;
Ⅱ需要加热的原因是______;C的化学式是______.
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是______.
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是______.
(5)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是______. cfq19851年前1
cfq19851年前1 -
 tianwudml 共回答了10个问题
tianwudml 共回答了10个问题 |采纳率100%解题思路:(1)在氧化还原反应中,化合价降低元素所在的产物是还原产物;
(2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2(OH)2CO3后可以获得氧化铁和氧化铝;
(3)根据转化过程中发生的反应来确定得到的副产品;
(4)格局框图中要加入的物质可以确定工厂需要购买的化工原料;
(5)根据IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4,可知MnO2、Zn的物质的量之比为1:1来计算即可.(1)比较信息①,A与软锰矿中元素化合价的变化可知,锰元素化合价从+4价降低为+2价,所以A中还原产物为MnSO4,故答案为:MnSO4;(2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2...
点评:
本题考点: 金属的回收与环境、资源保护;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题是一道有关化工生产工艺的综合知识题目,考查角度广,难度大.1年前查看全部
- 1774年,瑞典化学家舍勒发现软锰矿石(主要成分是Mno2)与浓盐酸混合加热能制取Cl2;
1774年,瑞典化学家舍勒发现软锰矿石(主要成分是Mno2)与浓盐酸混合加热能制取Cl2;
MnO2+4HCl(浓)═MnCl2+2H2O+Cl2↑现将23.2g含MnO2的质量分数为75%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应)计算
(1)生成的Cl2的体积(标准状况).
(2)参加反应的浓盐酸的体积 还猪脚脚1年前1
还猪脚脚1年前1 -
 kenkenlove 共回答了18个问题
kenkenlove 共回答了18个问题 |采纳率100%MnO2的质量=23.2*75%=17.4g
MnO2的物质的量n=m/M=17.4/87=0.2mol
MnO2+4HCl(浓)═MnCl2+2H2O+Cl2↑
1 4 1
0.2mol n(HCl) n(Cl2)
1.n(Cl2)=0.2mol
Cl2的体积V=n*Vm=0.2*22.4=4.48L
2.n(HCl)=0.8mol
浓盐酸的体积V=n/c=0.8/12=0.667L=667mL
答:(1)生成的Cl2的体积是4.48L
(2)参加反应的浓盐酸的体积是667mL1年前查看全部
- 某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO 2 含量≥65 %,SiO 2 含量约为20%,
某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO 2 含量≥65 %,SiO 2 含量约为20%,
Al 2 O 3 含量约为4%,其余为水分;闪锌矿:ZnS含量≥ 80%,FeS、CuS、SiO 2 含量约为7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。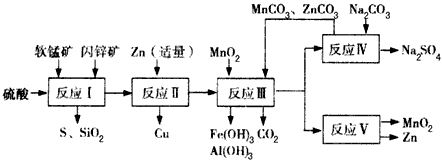
请回答下列问题:
(1)反应I后过滤所得滤液中含有MnSO 4 、ZnSO 4 、CuSO 4 、Fe 2 (SO 4 ) 3 、Al 2 (SO 4 ) 3 等。试写出反应I中生成
CuSO 4 的化学方程式_____________________。
(2)反应Ⅱ加入适量锌的作用是________________________。如果锌过量,还会进一步发生反应的离子方程式为________________________。
(3)反应V的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为____________。
(4)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要________等原料。 sadasdwqesdwqeqw1年前1
sadasdwqesdwqeqw1年前1 -
 木人美 共回答了11个问题
木人美 共回答了11个问题 |采纳率90.9%(1)MnO 2 +CuS+2H 2 SO 4 =S+MnSO 4 +CuSO 4 +2H 2 O
(2)将溶液中的硫酸铜转化为铜;Zn+Fe 2+ =Fe+Zn 2+
(3)Mn 2+ -2e - +2H 2 O=MnO 2 +4H +
(4) Na 2 CO 3 、Zn、MnO 21年前查看全部
- (2011•泰州一模)近年来高锰酸钾在饮用水和工业污水处理领域的消费增长较快.实验室可用软锰矿(主要成分MnO2)为原料
(2011•泰州一模)近年来高锰酸钾在饮用水和工业污水处理领域的消费增长较快.实验室可用软锰矿(主要成分MnO2)为原料制备高锰酸钾.其部分流程如下:

(1)实验中采用铁坩埚而不用瓷坩埚的原因是______;
(2)KOH、KClO3、MnO2共熔制得绿色K2MnO4的化学方程式KClO3+3MnO2+6KOH
KCl+3K2MnO4+3H2O,高温 .KClO3+3MnO2+6KOH;
KCl+3K2MnO4+3H2O,高温 .
(3)通入CO2,可使MnO42-发生歧化反应,生成MnO4-及MnO2,则K2MnO4完成反应时,转化为KMnO4的百分率约______(精确至0.1%)
(4)若通入CO2太多,则在加热浓缩时,会有______晶体和KMnO4晶体一起析出.
(5)在加热、浓缩、烘干的过程中温度不宜过高,其原因是______;加热时用玻璃棒不停搅拌溶液的目的是______. hh俊杰1年前1
hh俊杰1年前1 -
 jinlff99 共回答了25个问题
jinlff99 共回答了25个问题 |采纳率88%解题思路:(1)从瓷坩埚原料含有SiO2,高温下与KOH发生反应进行分析;
(2)由题意可知,KOH、KClO3、MnO2共熔制得绿色K2MnO4,根据氧化还原反应可知,还生成KCl,由元素守恒可知,还会生成H2O;
MnO2存在,高温下KClO3可能发生分解反应生成氯化钾与氧气;
(3)反应中MnO42-→MnO4-,Mn元素化合价由+6价升高为+7,化合价总共升高1价,MnO42-→MnO2,Mn元素化合价由+6价降低为+4,化合价总共降低2价,化合价升高最小公倍数为2,故MnO4-系数为2,MnO2系数为1,根据锰元素守恒可知,转化KMnO4的MnO42-占[2/3];
(4)工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4;
(5)KMnO4在加热的条件下会发生分解反应;根据玻璃棒的作用完成.(1)瓷坩埚原料含有SiO2,在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH═K2SiO3+H2O,腐蚀瓷坩埚,故不能使用瓷坩埚,而使用铁坩埚,
故答案为:在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH═K2SiO3+H2O,腐蚀瓷坩埚;
(2)由题意可知,KOH、KClO3、MnO2共熔制得绿色K2MnO4,根据氧化还原反应可知,还生成KCl,由元素守恒可知,还会生成H2O,反应方程式为KClO3+3MnO2+6KOH
高温
.
KCl+3K2MnO4+3H2O,
故答案为:KClO3+3MnO2+6KOH
高温
.
KCl+3K2MnO4+3H2O;
(3)反应中MnO42-→MnO4-,Mn元素化合价由+6价升高为+7,化合价总共升高1价,MnO42-→MnO2,Mn元素化合价由+6价降低为+4,化合价总共降低2价,化合价升高最小公倍数为2,故MnO4-系数为2,MnO2系数为1,根据锰元素守恒MnO42-系数为3,所以转化KMnO4的MnO42-占[2/3],
故K2MnO4完全反应时转化为KMnO4的百分率约[2/3]×100%=66.7%,
故答案为:66.7%;
(4)工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,在加热浓缩时,会有KHCO3晶体和KMnO4晶体一起析出,
故答案为:KHCO3;
(5)KMnO4在温度过高的条件下会发生分解反应,故在加热、浓缩、烘干的过程中温度不宜过高;使用玻璃棒搅拌,可以使溶液受热均匀,有利于蒸发溶剂,
故答案为:温度过高会导致KMnO4分解;受热均匀,有利于蒸发溶剂.点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查学生对工艺流程的理解、阅读获取信息能力、物质推断、氧化还原反应、工艺条件的控制等,难度中等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.1年前查看全部
- (2011•常州模拟)1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了
 (2011•常州模拟)1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
(2011•常州模拟)1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.请补充完善其反应的化学方程式:MnO2+4HCl(浓)
2H2O+______+Cl2↑.△ .
(2)如果需要获得干燥的氯气,可选用的干燥剂是______(填写序号).
A.碱石灰B.浓硫酸C.氢氧化钠
(3)氯气与氢氧化钠溶液反应的方程式______.
(4)如图所示,将干燥的氯气依次通过盛有干燥红纸条的集气瓶A和盛有湿润红纸条的集气瓶B.发现瓶A中的红纸没有变化,而瓶B中的红纸退色了.查阅资料:红纸条放入稀盐酸中没有变化.据此,你能获得什么结论?你能推断使红纸退色的物质可能是______;理由是______. cwen881年前1
cwen881年前1 -
 sunyq 共回答了14个问题
sunyq 共回答了14个问题 |采纳率92.9%解题思路:本题是一道信息情景题,做题的要求其实在题目中都基本告诉了,只要稍加思考即可得出答案,(1)利用了质量守恒定律中的反应前后原子种类、数目不变进行解题;(2)干燥剂有多种,常用来干燥气体的是浓硫酸;(4)从题目可知氯气与水反应生成盐酸和次氯酸,而盐酸没有漂白作用,所以是次氯酸具有漂白作用.(1)根据质量守恒定律可知反应前后原子的种类、原子的数目不变,可以推出生成物是MnCl2;
(2)干燥气体常用的是浓硫酸;
(3)题干中已经告知了反应物、生成物直接书写即可;
(4)氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.
故答案:(1)MnCl2
(2)B
(3)Cl2+2NaOH=NaCl+NaClO+H2O
(4)次氯酸 氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.点评:
本题考点: 实验探究物质的性质或变化规律;根据浓硫酸或烧碱的性质确定所能干燥的气体;书写化学方程式、文字表达式、电离方程式.
考点点评: 信息情景题看似比较难是书本没有的新知识,其实是比较容易做的题目,需要读好题目的有效的信息,提炼出来.1年前查看全部
- 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强
 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.请补充完善其反应的化学方程式:MnO2+4HCl(浓)
2H2O+MnCl2MnCl2+Cl2↑.△ .
(2)小明用上述反应制取氯气,设计了右图所示装置,请指出其中的问题,并提出改进的方法二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热,氯气有毒,应增加尾气吸收装置二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热,氯气有毒,应增加尾气吸收装置.
(3)如果需要获得干燥的氯气,可选用的干燥剂是BB(填写序号).
A.碱石灰B.浓硫酸C.氢氧化钠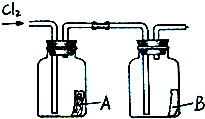
(4)如右图所示,将干燥的氯气依次通过盛有干燥红纸条的集气瓶A和盛有湿润红纸条的集气瓶B.发现瓶A中的红纸没有变化,而瓶B中的红纸退色了.据此,你能获得什么结论?
你能推断使红纸退色的物质可能是次氯酸次氯酸;理由是氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用. 啊拉丁神兔1年前1
啊拉丁神兔1年前1 -
 taivy 共回答了22个问题
taivy 共回答了22个问题 |采纳率81.8%(1)根据质量守恒定律可知反应前后原子的种类、原子的数目不变,可以推出生成物是MnCl2
(2)二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热;氯气有毒,应增加尾气吸收装置.
(3)氯气是酸性气体,所以干燥气体常用的是浓硫酸,故答案为:B
(4)氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.故答案为:次氯酸;氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.1年前查看全部
- MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
下列说法不正确的是( )
(1)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
(2)除去反应混合物中的不溶物
(3)电解混合液MnSO4+ZnSO4+2H2
MnO2+Zn+2H2SO4.电解 .
A. 步骤(1)中MnO2和H2SO4都是氧化剂
B. 步骤(1)中每析出12.8gS沉淀共转移0.8mol电子
C. 步骤(3)中电解时MnO2在阳极处产生
D. 硫酸在生产中可循环使用 fanghaifeng1年前1
fanghaifeng1年前1 -
 ayu001 共回答了25个问题
ayu001 共回答了25个问题 |采纳率96%解题思路:A.MnO2中Mn元素的化合价降低,H2SO4中各元素的化合价不变;
B.反应中S元素由-2价升高为0;
C.电解时阳极发生氧化反应;
D.由(1)、(3)可知,硫酸既参加反应,又从反应中生成.A.MnO2中Mn元素的化合价降低,H2SO4中各元素的化合价不变,则步骤(1)中MnO2是氧化剂,H2SO4是反应物,故A选;
B.反应中S元素由-2价升高为0,则每析出12.8gS沉淀共转移[12.8g/32g/mol]×(2-0)=0.8mol电子,故B不选;
C.电解时Mn元素的化合价升高,发生氧化反应,阳极发生氧化反应,则步骤(3)中电解时MnO2在阳极处产生,故C不选;
D.由(1)、(3)可知,硫酸既参加反应,又从反应中生成,所以硫酸在生产中可循环使用,故D不选;
故选A.点评:
本题考点: 金属冶炼的一般原理;氧化还原反应的电子转移数目计算;氧化还原反应.
考点点评: 本题考查金属的冶炼和氧化还原反应,明确元素的化合价变化是解答本题的关键,并熟悉氧化还原反应中的概念来解答,题目难度不大.1年前查看全部
- 高锰酸钾是锰的重要化合物和常用的氧化剂.如图所示是工业上用软锰矿制备高锰酸钾的一种工艺流程.
高锰酸钾是锰的重要化合物和常用的氧化剂.如图所示是工业上用软锰矿制备高锰酸钾的一种工艺流程.
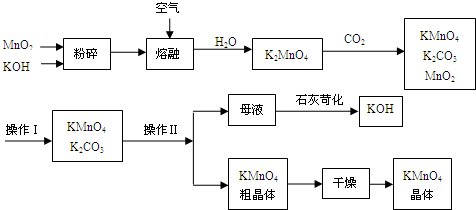
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒原理与下列物质相同的是______(填代号).
a.84消毒液(NaClO溶液)b.双氧水c.福尔马林(35%甲醛溶液)d.75%酒精
(2)高锰酸钾保存在棕色试剂瓶中,下列试剂保存不需要棕色试剂瓶的是______(填代号).
a.浓硝酸b.硝酸银 c.氯水d.烧碱
(3)上述流程中可以循环使用的物质有______、______(写化学式).
(4)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得[2/3]或0.67mol[2/3]或0.67molmol KMnO4.
(5)写出实验室用KMnO4制备气体的一个化学方程式2KMnO4
K2MnO4+MnO2+O2↑;△ .2KMnO4
K2MnO4+MnO2+O2↑;△ .
(6)操作Ⅰ的名称是______;操作Ⅱ根据KMnO4和K2CO3两物质在溶解度上的差异(溶解度数据:K2CO3 20℃时为112g,100℃时为156g;KMnO4 20℃时为6.4g,100℃时为30g)采用______(填操作步骤)、趁热过滤的方法得到KMnO4粗晶体. NOO11年前1
NOO11年前1 -
 情感维生素 共回答了18个问题
情感维生素 共回答了18个问题 |采纳率88.9%解题思路:(1)高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒;
(2)见光易分解的物质常常保存在棕色试剂瓶中;
(3)最初反应物中和最终生成物中含有的物质就能循环利用;
(4)根据氧化还原反应中得失电子守恒计算高锰酸钾和二氧化锰的比值;
(5)实验室用KMnO4制取O2,高锰酸钾受热分解生成锰酸钾、二氧化锰、氧气,据此解答;
(6)分离固体与溶液,采用过滤操作,利用KMnO4和K2CO3在溶解性上进行分离;(1)高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒.
a、84消毒液(NaClO溶液),次氯酸钠具有强氧化性,常常利用次氯酸钠的强氧化性进行杀菌消毒,故a正确;
b、双氧水具有强氧化性,常常利用双氧水的强氧化性进行杀菌消毒,故b正确;
c、福尔马林(35%甲醛溶液)是通过渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故c错误;
d、75%酒精是通过酒精渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故d错误;
故选ab;
(2)见光易分解的物质常常保存在棕色试剂瓶中.
a.浓硝酸见光分解生成二氧化氮、氧气和水,所以要保存在棕色试剂瓶中,故a错误;
b.硝酸银见光分解生成银、二氧化氮和氧气,所以要保存在棕色试剂瓶中,故b错误;
c.氯水中的次氯酸见光分解生成盐酸和氧气,所以要保存在棕色试剂瓶中,故c错误;
d.烧碱见光不分解,所以不要保存在棕色试剂瓶中,故d正确;
故选d;
(3)在开始的反应物和最终的生成物中都含有MnO2和KOH,所以二氧化锰和氢氧化钾能循环使用,
故答案为:MnO2、KOH;
(4)根据锰元素守恒知,1molMnO2生成1molK2MnO4,锰酸钾和二氧化碳反应的方程式为 3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3,根据方程式知,1molK2MnO4和二氧化碳反应生成[2/3]mol或0.67molKMnO4,
故答案为:[2/3]或0.67mol;
(5)实验室用KMnO4制取O2,高锰酸钾受热分解生成锰酸钾、二氧化锰、氧气,该反应的化学方程式是2KMnO4
△
.
K2MnO4+MnO2+O2↑,
故答案为:2KMnO4
△
.
K2MnO4+MnO2+O2↑;
(6)该操作是分离固体与溶液,是过滤操作,KMnO4和K2CO3在溶解性上不同采用热的情况下采用浓缩结晶的方式可分离,
故答案为:过滤;浓缩结晶;点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,解答本题时要充分理解图中提供的信息,只有理解了图中信息才能对问题做出正确的判断,题目难度中等.1年前查看全部
- (2009•静安区一模)高锰酸钾是常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.
(2009•静安区一模)高锰酸钾是常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.
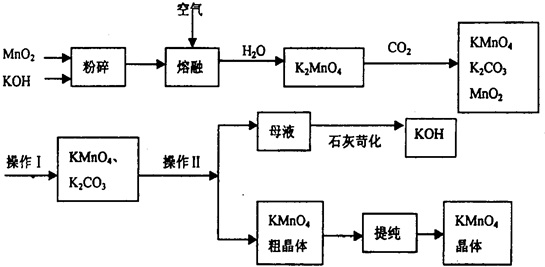
(1)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是______ (填序号)
a.浓硝酸b.硝酸银c.氯水d.烧碱
(2)K2MnO4和C02反应生成KMnO4、MnO2和K2C03的化学方程式为:______
(3)上述流程中可循环使用的物质有______ (用化学式表示,至少写2种).
(4)操作I的名称是______;用结晶法分离KMnO4、K2C03两种物质,进行该操作前需查阅的资料是______.
(5)以下是KMnO4的溶解度数据.
实验室用重结晶的方法将KMnO4粗品制成精品.需进行的操作有:配制热饱和溶液、______、过滤、洗涤、______.洗涤所需要的玻璃仪器有烧杯、玻璃棒和______;检查是否洗净的操作是______.温度(℃) O 10 20 50 60 S(g/lOOg水) 2.8 4.3 6.3 17.0 22.1  寒烟散暖1年前1
寒烟散暖1年前1 -
 helen_lee01 共回答了17个问题
helen_lee01 共回答了17个问题 |采纳率76.5%解题思路:(1)光见易分解的药品需要保存在棕色试剂瓶中.
(2)反应中K2MnO4→KMnO4,Mn元素化合价由+6价升高为+7价,共升高变化1价,K2MnO4→MnO2,Mn元素化合价由+6价降低为+4价,共降低2价,化合价升降最小公倍数为2,故KMnO4系数为2,MnO2系数为1.再根据元素守恒确定其它物质的系数,据此写出方程式.
(3)由转化关系图知KOH及MnO2会被循环利用.
(4)由工艺流程可知操作I将固体MnO2与液体分开,属于过滤.操作II是将两种可溶于性盐分离开,应该是利用物质溶解度的差异,通过浓缩结晶的方式将二者分离开.
(5)实验室用重结晶的方法将KMnO4粗品制成精品.应配制热饱和溶液、冷却晶体、过滤、洗涤、干燥.
过滤结束进行洗涤,洗涤所需要的玻璃仪器有烧杯、玻璃棒和漏斗;
晶体中主要含有杂质K2CO3,可以取第二次洗涤液,加入CaCl2溶液,检验是否含有CO32-.确定是否洗净.(1)浓硝酸、硝酸银、氯水光见易分解需要保存在棕色试剂瓶中,KOH不需要保存在棕色试剂瓶中.
故选:d.
(2)反应中K2MnO4→KMnO4,Mn元素化合价由+6价升高为+7价,共升高变化1价,K2MnO4→MnO2,Mn元素化合价由+6价降低为+4价,共降低2价,化合价升降最小公倍数为2,故KMnO4系数为2,MnO2系数为1.根据Mn元素守恒可知KMnO4系数为3,
根据K元素守恒可知K2C03系数为2,由碳元素守恒可知系数C02为2,方程式为3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2.
故答案为:3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2.
(3)由转化关系图知KOH及MnO2可以被循环利用.
故答案为:KOH、MnO2.
(4)过滤除去不溶于水的MnO2,利用溶解度的不同,采取浓缩结晶的方法使KMnO4从溶液中析出而分离出来.
故答案为:过滤;KMnO4、K2C03的溶解度随温度变化情况.
(5)实验室用重结晶的方法将KMnO4粗品制成精品.应配制热饱和溶液、冷却晶体、过滤、洗涤、干燥.过滤结束进行洗涤,洗涤所需要的玻璃仪器有烧杯、玻璃棒和漏斗.晶体中主要含有杂质K2CO3,可以取第二次洗涤液,加入CaCl2溶液,若没有白色沉淀生成,说明洗涤干净.
故答案为:冷却晶体; 干燥;漏斗;取第二次洗涤液,加入CaCl2溶液,若没有白色沉淀生成,说明洗涤干净.点评:
本题考点: 制备实验方案的设计;物质的分离、提纯的基本方法选择与应用.
考点点评: 考查物质保存与分离提纯等基本操作、氧化还原反应、对工艺流程的理解,难度中等,关键是掌握整个制备流程原理,分析流程中的转化关系.要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力.1年前查看全部
- 二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料 利用硫酸亚铁制备高
二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料 利用硫酸亚铁制备高
纯二氧化锰.流程图:
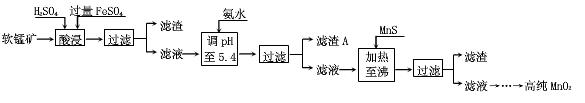
其中加热至沸的目的是什么? 冯长华1年前1
冯长华1年前1 -
 伴君ss 共回答了13个问题
伴君ss 共回答了13个问题 |采纳率92.3%加热至沸腾的目的是硫化锰反应彻底1年前查看全部
- (2014•荆州模拟)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
(2014•荆州模拟)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
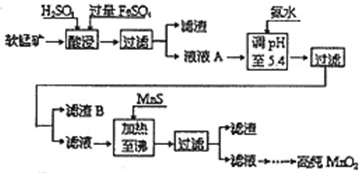
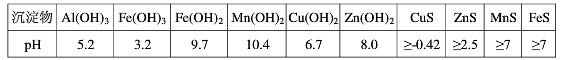
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
回答下列问题:沉淀物 Al(OH)3 Fe(OH)3
Fe(OH)2Mn(OH)2 CuS ZnS MnS FeS pH 5.2 3.2 9.7 10.4 ≥-0.42 ≥2.5 ≥7 ≥7
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的离子方程式为______.
(2)调节pH时不用氢氧化钠原因是:______,理论上,调节pH的最小值为______,滤渣B的主要成分是______.
(3)加入MnS的目的是除去______杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为______.回收废旧碱性锰电池中的锰,可向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O,该方法的优点是______. 雨惊鸿1年前1
雨惊鸿1年前1 -
 baobeiyuer 共回答了16个问题
baobeiyuer 共回答了16个问题 |采纳率87.5%解题思路:(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,则Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成;
(2)由题目信息可知,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH进行判断;
(3)加入MnS后,因为酸性条件下CuS、ZnS更难溶所以会转化为CuS、ZnS沉淀而除去Cu2+、Zn2+;
(4)由碱性锌锰干电池的电池反应式可知,Zn作负极,MnO2得电子作正极,生成MnOOH,由电荷守恒可知还生成OH-,由元素守恒可知,还有水参与反应,据此写出MnO2参与的电极反应方程式为;从工艺流程是否简单、反应产物是否产生污染物等方面进行分析.(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为:2Fe2++MnO2+4H+=Mn2++2Fe3++2H2O,故答案为:2Fe2++MnO2+4H+=Mn2++2Fe3++2H2...
点评:
本题考点: 硫酸亚铁的制备;难溶电解质的溶解平衡及沉淀转化的本质;金属的回收与环境、资源保护.
考点点评: 本题考查学生对元素及其化合物的主要性质的掌握、书写电极反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.1年前查看全部
- 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl 2 ).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.请补充完善其反应的化学方程式:MnO 2 +4HCl(浓)
2H 2 O+______+Cl 2 ↑.△ .
(2)小明用上述反应制取氯气,设计了右图所示装置,请指出其中的问题,并提出改进的方法______.
(3)如果需要获得干燥的氯气,可选用的干燥剂是______(填写序号).
A.碱石灰B.浓硫酸C.氢氧化钠
(4)如右图所示,将干燥的氯气依次通过盛有干燥红纸条的集气瓶A和盛有湿润红纸条的集气瓶B.发现瓶A中的红纸没有变化,而瓶B中的红纸退色了.据此,你能获得什么结论?
你能推断使红纸退色的物质可能是______;理由是______.
 zxzr6101年前1
zxzr6101年前1 -
 zmin99 共回答了15个问题
zmin99 共回答了15个问题 |采纳率86.7%(1)根据质量守恒定律可知反应前后原子的种类、原子的数目不变,可以推出生成物是MnCl 2
(2)二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热;氯气有毒,应增加尾气吸收装置.
(3)氯气是酸性气体,所以干燥气体常用的是浓硫酸,故答案为:B
(4)氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.故答案为:次氯酸;氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.1年前查看全部
- MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
MnO 2 和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO 2 和Zn的基本步骤为:
(1)软锰矿、闪锌矿与硫酸共热:MnO 2 +ZnS +2H 2 SO 4 =MnSO 4 +ZnSO 4 +S↓+2H 2 O
(2)除去反应混合物中的不溶物
(3)电解混合液:MnSO 4 +ZnSO 4 +2H 2 O MnO 2 +Zn+2H 2 SO 4
MnO 2 +Zn+2H 2 SO 4
下列说法不正确的是[ ]A.步骤(1)中MnO 2 和H 2 SO 4 都是氧化剂
B.步骤(1)中每析出12.8 g S沉淀共转移0.8 mol电子
C.步骤(3)中电解时MnO 2 在阳极处产生
D.硫酸在生产中可循环使用 Hello5201101年前1
Hello5201101年前1 -
 5100net 共回答了17个问题
5100net 共回答了17个问题 |采纳率82.4%A1年前查看全部
- (2013•普陀区二模)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)
(2013•普陀区二模)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体.
请回答:
(1)用软锰矿制备K2MnO4的化学方程式是______.
(2)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为______.生成0.1mol还原产物时转移电子______ 个.KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是______.
(3)KMnO4能与热的Na2C2O4(aq,硫酸酸化)反应生成Mn2+和CO2.若取用软锰矿制得的KMnO4产品0.165g,能与0.335g Na2C2O4恰好完全反应(假设杂质均不能参与反应),该产品中KMnO4的纯度为______. 小小米同学1年前1
小小米同学1年前1 -
 xuvv 共回答了24个问题
xuvv 共回答了24个问题 |采纳率91.7%解题思路:(1)反应物为KOH、KClO3、MnO2,生成物为K2MnO4(锰酸钾)和KCl、水,利用质量守恒定律书写反应方程式;
(2)K2MnO4转化为KMnO4的反应中K2MnO4→2KMnO4+MnO2,Mn元素的化合价既升高又降低,氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;
(3)利用电子守恒计算.(1)反应物为KOH、KClO3、MnO2,生成物为K2MnO4(锰酸钾)和KCl、水,该反应为6KOH+KClO3+3MnO2═3K2MnO4+KCl+3H2O,
故答案为:6KOH+KClO3+3MnO2═3K2MnO4+KCl+3H2O;
(2)K2MnO4转化为KMnO4的反应中K2MnO4→2KMnO4+MnO2,Mn元素的化合价由+6价升高为+7价,Mn元素的化合价由+6价降低为+4价,则氧化剂和还原剂的物质的量之比为1:2,生成0.1mol还原产物时转移电子0.1mol×(6-4)××NA=0.2NA或6.02×10-22,由氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,可知氧化性为KMnO4>K2MnO4>MnO2,故答案为:1:2;0.2NA或6.02×10-22;KMnO4>K2MnO4>MnO2;
(3)KMnO4能与热的Na2C2O4(aq,硫酸酸化)反应生成Mn2+和CO2,设KMnO4的纯度为x,则由电子守恒可知,[0.165gx/122.5g/mol]×(7-2)=[0.335g/134g/mol]×2×(4-3),
解得x=0.958,故答案为:0.958.点评:
本题考点: 氧化还原反应;化学方程式的有关计算.
考点点评: 本题考查氧化还原反应及其计算,明确发生的反应及反应中元素的化合价变化是解答的关键,注意(3)电子守恒的应用,题目难度中等.1年前查看全部
- MnO2和Zn是制造普通干电池的重要原料.工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)来制取:(1)将.
MnO2和Zn是制造普通干电池的重要原料.工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)来制取:(1)将...
MnO2和Zn是制造普通干电池的重要原料.工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)来制取:(1)将软锰矿.闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4==MnSO4+ZnSO4+S+2H2O(2)除去反应混合物中的不溶物(3)电解混合物:MnSO4+ZnSO4+2H2O==(电解)MnO2+Zn+2HSO4下列说法错误的是A:干电池是一种将化学能转变为电能的装置B:步骤三电解时MnO2在阳极处生成.电极反应为Mn2+-2e-+2H2O==MnO2+4H+C:步骤一每析出12.8gS沉淀共转移0.8mol电子D:步骤三的反应也可以设计成原电池 我觉得选B angelflypig1年前1
angelflypig1年前1 -
 牛肉干VS猪耳朵 共回答了22个问题
牛肉干VS猪耳朵 共回答了22个问题 |采纳率90.9%下列说法错误的是
A:干电池是一种将化学能转变为电能的装置
干电池是原电池,是一种将化学能转变为电能的装置.
B:步骤三电解时MnO2在阳极处生成.电极反应为Mn2+-2e-+2H2O==MnO2+4H+
阳极发生失去电子的反应,化合价升高.符合守恒定律.
C:步骤一每析出12.8gS沉淀共转移0.8mol电子
12.8gS的物质的量为0.4mol,化合价从-2价升高到0价,共转移0.8mol电子.
D:步骤三的反应也可以设计成原电池
步骤三的反应不是自发的氧化还原反应,不能设计成原电池 .
答案选D1年前查看全部
- (2013•资阳一模)高锰酸钾是锰的重要化合物和常用氧化剂,在实验室和医疗上有非常广泛的应用.以下是工业上用软锰矿(主要
(2013•资阳一模)高锰酸钾是锰的重要化合物和常用氧化剂,在实验室和医疗上有非常广泛的应用.以下是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程:
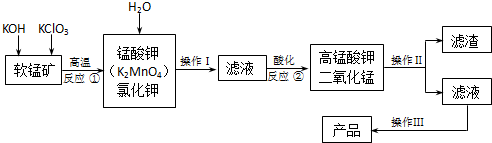
(1)操作Ⅱ的名称是______,实验室进行该操作须用到的玻璃仪器有______;
(2)反应②的产物中,氧化产物与还原产物的物质的量之比是______;
(3)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
a.稀盐酸b.稀硫酸c.稀醋酸
(4)电解锰酸钾溶液也可以制备高锰酸钾,其阴极反应式为:2H2O+2e-=2OH-+H2↑,如图,b为电源的______极,电解池的阳极反应式是______;若电解过程中收集到2.24L H2(标准状况),则得到高锰酸钾______g.(提示:阴离子放电顺序MnO42->OH-)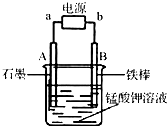
 我是小梨1年前1
我是小梨1年前1 -
 有了感觉 共回答了21个问题
有了感觉 共回答了21个问题 |采纳率95.2%解题思路:(1)软锰矿中含有不溶于水的物质,由流程图可知,通过操作Ⅰ得到滤液,因此操作Ⅰ为过滤;
(2)K2MnO4与酸发生氧化还原反应生成KMnO4和MnO2,由化合价升降相等确定氧化产物与还原产物的物质的量之比;
(3)酸性高锰酸钾溶液能氧化盐酸,因此不能选用盐酸酸化;
(4)电解锰酸钾溶液也可以制备高锰酸钾,锰的化合价升高,MnO42-在阳极放电,因此铁棒只能作阴极,所以b为负极;根据得失电子守恒计算高锰酸钾的物质的量,代入m=nM计算质量.(1)软锰矿中含有不溶于水的物质,由流程图可知,通过操作Ⅰ得到滤液,因此操作Ⅰ为过滤,过滤用到的玻璃仪器有:玻璃棒、漏斗、烧杯,
故答案为:过滤;烧杯、漏斗、玻璃棒;
(2)K2MnO4与酸发生氧化还原反应生成KMnO4和MnO2,Mn元素的化合价由+6变为+7和+4价,因此KMnO4为氧化产物,MnO2为还原产物,根据化合价升降相等可知,
氧化产物与还原产物的物质的量之比为(6-4):(7-6)=2:1,
故答案为:2:1;
(3)酸性高锰酸钾溶液能氧化盐酸生成氯气,因此不能选用盐酸酸化,
故答案为:a;
(4)电解锰酸钾溶液也可以制备高锰酸钾,锰的化合价升高,MnO42-在阳极放电,电极反应是为MnO42--e-═MnO4-,因此铁棒只能作阴极,所以b为负极;
n(H2)=[2.24L/22.4L/mol]=0.1mol,根据得失电子守恒可知,生成KMnO4的物质的量为0.1mol×2=0.2mol,m(KMnO4)=0.2mol×158g/mol=31.6g,
故答案为:负;MnO42--e-═MnO4-;31.6.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;原电池和电解池的工作原理.
考点点评: 本题考查了高锰酸钾的制备,难度一般,涉及化工生成流程和电解法制备,掌握物质的性质、氧化还原反应原理、电解原理是解题的关键.1年前查看全部
- (2011•内江三模)高锰酸钾是锸的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.
(2011•内江三模)高锰酸钾是锸的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.

(1)KMn04是______(填颜色)的晶体,其稀溶液是一种常用的消毒剂.其消毒机理与下列______(填序号)物质相似.A.75%酒精B.双氧水C.苯酚D.84消毒液(NaClO溶液)
(2)写出K2Mn04溶液中通入CO2时发生的主要反应的离子方程式______
(3)上述流程图中:①可以循环使用的物质有生石灰、二氧化碳.Mn02和______(写化学式);②KMn04粗晶体变为KMnO4纯晶伴,需经过步骤R,R为______(填实验操作名称).
(4)实际生产中,常用硫酸工业的废气(含S02)与该厂的废水(含KMnO4)按一定比例混合,以减少工业“三废”对环境的污染.写出KMnO4与SO2反应的离子方程式为______
(5)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得______mol KMn04. kqfh1年前1
kqfh1年前1 -
 yaqing 共回答了20个问题
yaqing 共回答了20个问题 |采纳率100%解题思路:(1)KMnO4有强氧化性,消毒原理与84消毒液、双氧水一样;
(2)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,所含元素化合价升高的反应物是还原剂;反应中K2MnO4→KMnO4,Mn元素化合价由+6价升高为+7价,共升高变化1价,K2MnO4→MnO2,Mn元素化合价由+6价降低为+4价,共降低2价,化合价升降最小公倍数为2,故KMnO4系数为2,MnO2系数为1.再根据元素守恒确定其它物质的系数,据此写出方程式.
(3)制备中利用的原料,在转化过程中又生成的可以循环利用;
(4)二氧化硫具有还原性和KMnO4在水溶液中发生氧化还原反应,生成硫酸和硫酸锰,依据氧化还原反应电子守恒和原子守恒配平写出;
(5)最初的原料中1mol MnO2恰好得到1mol KMnO4,由3K2MnO4+CO2=2KMnO4+K2CO3+MnO2知,1mol K2MnO4在反应中能得到[2/3] mol即0.667molKMnO4.(1)高锰酸钾晶体是深紫色,KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故选:深紫色,BD;
(2)反应中K2MnO4→KMnO4,Mn元素化合价由+6价升高为+7价,共升高变化1价,K2MnO4→MnO2,Mn元素化合价由+6价降低为+4价,共降低2价,化合价升降最小公倍数为2,故KMnO4系数为2,MnO2系数为1.根据Mn元素守恒可知KMnO4系数为3,
根据K元素守恒可知K2C03系数为2,由碳元素守恒可知系数C02为2,方程式为3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2.
故答案为:3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2.
(3)制备中利用的原料,在转化过程中又生成的可以循环利用.由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用,故答案为:KOH;
(4)二氧化硫具有还原性和KMnO4在水溶液中发生氧化还原反应,生成硫酸和硫酸锰,依据氧化还原反应电子守恒和原子守恒配平得到,5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(5)最初的原料中1mol MnO2恰好得到1mol KMnO4.由3K2MnO4+CO2=2KMnO4+K2CO3+MnO2知,1mol K2MnO4在反应中能得到[2/3]molKMnO4,即0.67mol;
故答案为:[2/3],或0.67mol;点评:
本题考点: 制备实验方案的设计;氧化还原反应.
考点点评: 本题考查常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.1年前查看全部
- 高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用 软锰矿制备高锰酸钾的一种工艺流程。
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用
 软锰矿制备高锰酸钾的一种工艺流程。
软锰矿制备高锰酸钾的一种工艺流程。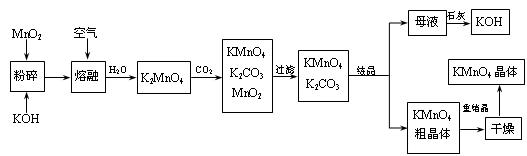
(1)KMnO 4 稀溶液是一种常用的消毒剂。其消毒机理与下列 (填序号)物质相似。
(2)写出MnO 2 、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
。
(3)向K 2 MnO 4 溶液中通入CO 2 以制备KMnO 4 ,该反应中的还原剂是: 。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、 和 (写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO 2 可制得 mol KMnO 4 。 游荡在南京1年前1
游荡在南京1年前1 -
 漫步树林 共回答了18个问题
漫步树林 共回答了18个问题 |采纳率88.9%1年前查看全部
- 二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下 某软锰矿的主要成分为M
二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下 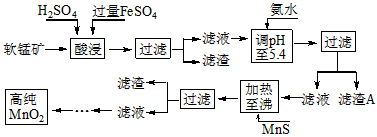
某软锰矿的主要成分为MnO 2 ,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题 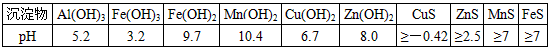
(1)硫酸亚铁在酸性条件下将MnO 2 还原为MnSO 4 ,酸浸时发生的主要反应的化学方程式为
_________________________。
(2)滤渣A的主要成分是_____________________________。
(3)加入MnS的目的是除去______________________杂质。
(4)碱性锌锰电池中,MnO 2 参与的电极反应方程式为___________________________。
(5)从废旧碱性锌锰电池中可以回收利用的物质有____________________________(写两种)。 goodleon1年前1
goodleon1年前1 -
 lbmfff 共回答了18个问题
lbmfff 共回答了18个问题 |采纳率88.9%(1)MnO 2 +2FeSO 4 +2H 2 SO 4 =MnSO 4 +Fe 2 (SO 4 ) 3 +2H 2 O
(2)Fe(OH) 3 、Al(OH) 3
(3)Cu 2+ 、Zn 2+
(4)MnO 2 +H 2 O+e - =MnO(OH)+OH - (或2MnO 2 +H 2 O+2e - =Mn 2 O 3 +2OH - )
(5)锌、二氧化锰1年前查看全部
- (10分)瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气
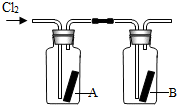
(10分)瑞典化学家舍勒在研究软锰矿(主要成分是MnO 2 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A仪器的名称是 ,所盛试剂是 。
(2)漂白粉将在U形管中产生,其化学方程式是 。
(3)此实验结果所得Ca(ClO) 2 产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
① 温度较高时氯气与消石灰反应生成Ca(ClO 3 ) 2 ,为避免此副反应的发生,可采取的措施是 。
② 试判断另一个副反应(写出此反应方程式): 。
(4)2005年以来,淮安、无锡等地发生重大液氯泄漏事故。某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列处理措施不合理的是 (请填写序号 )。
① 人员就近向地下商场或地铁转移
② 及时用毛巾包裹活性炭捂住口鼻
③ 及时戴上用烧碱溶液湿润过的口罩
④ 液氯罐中的液氯泄漏时,可将其移入新开挖的坑塘中,并加入生石灰 jiangxuan_201年前1
jiangxuan_201年前1 -
 半支555 共回答了22个问题
半支555 共回答了22个问题 |采纳率95.5%(10分)(1)分液漏斗(1分浓盐酸(1分)
(2)2Cl 2 + 2 Ca(OH) 2 =CaCl 2 + Ca(ClO) 2 + 2H 2 O(2分)(3)① 冰水冷却(2分)
② 2HCl + Ca(OH) 2 =CaCl 2 + 2H 2 O(2分) (4)①③(2分)
1年前查看全部
- (7分)二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
(7分)二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
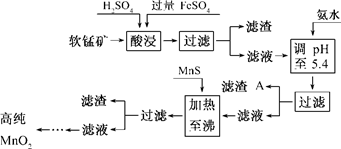
某软锰矿的主要成分为MnO 2 ,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO 2 还原为MnSO 4 ,酸浸时发生的主要反应的化学方程式为______________________________.沉淀物 pH Al(OH) 3 5.2 Fe(OH) 3 3.2 Fe(OH) 2 9.7 Mn(OH) 2 10.4 Cu(OH) 2 6.7 Zn(OH) 2 8.0 CuS ≥-0.42 ZnS ≥2.5 MnS ≥7 FeS ≥7
(2)滤渣A的主要成分为________.
(3)加入MnS的目的是除去________杂质.
(4)碱性锌锰干电池中,MnO 2 参与的电极反应方程式为__________________________.
(5)从废旧碱性锌锰干电池中可以回收利用的物质有________(写出两种). maxinyan1年前1
maxinyan1年前1 -
 kky0 共回答了17个问题
kky0 共回答了17个问题 |采纳率94.1%(1)MnO 2 +2FeSO 4 +2H 2 SO 4 ===MnSO 4 +Fe 2 (SO 4 ) 3 +2H 2 O
(2)Fe(OH) 3 、Al(OH) 3 (3)Cu 2 + 、Zn 2 +
(4)MnO 2 +H 2 O+e - ===MnOOH+OH - (5)Zn、MnO 2
(1)根据FeSO 4 在反应条件下将MnO 2 还原为MnSO 4 ,Fe 2 + 被氧化为Fe 3 + ,可以写其反应方程式2FeSO 4 +MnO 2 +2H 2 SO 4 ===MnSO 4 +Fe 2 (SO 4 ) 3 +2H 2 O。
(2)根据反应后滤液(Mn 2 + 、Fe 3 + 、Al 3 + 、Cu 2 + 、Zn 2 + 、Fe 2 + )加氨水调pH至5.4,结合题表可知滤渣A的主要成分为Fe(OH) 3 和Al(OH) 3 。
(3)根据题表可知加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu 2 + 、Zn 2 + .
(4)碱性锌锰干电池中Zn作负极,则MnO 2 作正极得电子.其电极反应式应为 MnO 2 +H 2 O+e - ===MnOOH+OH - 。
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO 2 。1年前查看全部
- 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强
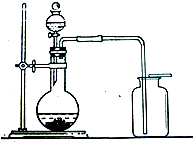 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.请补充完善其反应的化学方程式:MnO2+4HCl(浓)
2H2O+______+Cl2↑.△ .
(2)小明用上述反应制取氯气,设计了右图所示装置,请指出其中的问题,并提出改进的方法______.
(3)如果需要获得干燥的氯气,可选用的干燥剂是______(填写序号).
A.碱石灰B.浓硫酸C.氢氧化钠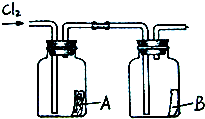
(4)如右图所示,将干燥的氯气依次通过盛有干燥红纸条的集气瓶A和盛有湿润红纸条的集气瓶B.发现瓶A中的红纸没有变化,而瓶B中的红纸退色了.据此,你能获得什么结论?
你能推断使红纸退色的物质可能是______;理由是______. yanfeng09951年前1
yanfeng09951年前1 -
 默默无盐 共回答了15个问题
默默无盐 共回答了15个问题 |采纳率93.3%解题思路:本题是一道信息情景题,做题的要求其实在题目中都基本告诉了,只要稍加思考即可得出答案:
(1)利用了质量守恒定律中的反应前后原子种类、数目不变进行解题;
(2)二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热;氯气有毒,应增加尾气吸收装置;
(3)氯气是酸性气体,所以选择酸性的干燥剂;
(4)根据盐酸没有漂白作用,所以其漂白作用的是氯气与水的生成物;(1)根据质量守恒定律可知反应前后原子的种类、原子的数目不变,可以推出生成物是MnCl2
(2)二氧化锰与浓盐酸反应的条件是加热,应将圆底烧瓶置于酒精灯上加热;氯气有毒,应增加尾气吸收装置.
(3)氯气是酸性气体,所以干燥气体常用的是浓硫酸,故答案为:B
(4)氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.故答案为:次氯酸;氯气与水反应生成盐酸和次氯酸,盐酸没有漂白作用,故是次氯酸具有漂白作用.点评:
本题考点: 实验探究物质的性质或变化规律;实验室制取气体的思路;根据浓硫酸或烧碱的性质确定所能干燥的气体;质量守恒定律及其应用.
考点点评: 信息情景题看似比较难是书本没有的新知识,其实是比较容易做的题目,需要读好题目的有效的信息,提炼出来.1年前查看全部
- 取含二氧化锰的软锰矿17.4克与足量浓盐酸反应后,将生成的氯气通入含22克溴化钠的水溶液中,经加热蒸发水分并烘干后,得质
取含二氧化锰的软锰矿17.4克与足量浓盐酸反应后,将生成的氯气通入含22克溴化钠的水溶液中,经加热蒸发水分并烘干后,得质量为·13.1克的残渣.计算:
1)生成氯化钠多少摩尔?
2)生成氯气多少升(标准状况).
3)软锰矿含二氧化锰的质量分数. toxicaria1年前1
toxicaria1年前1 -
 HLJSHEZGJCH 共回答了14个问题
HLJSHEZGJCH 共回答了14个问题 |采纳率85.7%根据 Cl2 + 2NaBr = 2NaCl+ Br2 得:
Δm 2NaCl Cl2
2NaBr -2NaCl
=89 2 22.4
22-13.1=8.9 x y x=0.2 mol y=2.24L
根据 4HCl + MnO2 = MnCl2 + 2H2O + Cl2↑
87 22.4
z 2.24
z = 8.7 8.7÷17.4=50%1年前查看全部
- 含MnO217.4克的软锰矿与足量的浓盐酸反应生成的氯气通入含22克NaBr的水溶液中.经过蒸发并干燥得质量为
含MnO217.4克的软锰矿与足量的浓盐酸反应生成的氯气通入含22克NaBr的水溶液中.经过蒸发并干燥得质量为
13.1克的残渣,则反应生成的Nacl的质量为多少?残渣的成分是什么? dinglj_lw1年前1
dinglj_lw1年前1 -
 做梦的人123 共回答了18个问题
做梦的人123 共回答了18个问题 |采纳率88.9%2NaBr + Cl2 -----> 2NaCl + Br2
m(NaCl)=58.5*(22-13.1)/(80-35.5)=11.7g
NaCl ; NaB1年前查看全部
- 在取含87%MnO2的软锰矿石与足量的浓盐酸加热反应完全后所得氯气能从溴化钠溶液中置换出8g溴 求参加反应的软锰矿石的质
在取含87%MnO2的软锰矿石与足量的浓盐酸加热反应完全后所得氯气能从溴化钠溶液中置换出8g溴 求参加反应的软锰矿石的质量和消耗HCL的物质的量
 姓温名柔1年前3
姓温名柔1年前3 -
 -空- 共回答了20个问题
-空- 共回答了20个问题 |采纳率95%4HCl---------MnO2-------Cl2-------Br2
4mol 87g 160g
x=0.2mol y=4.35g 8g
加反应的软锰矿石的质量:4.35/87%=5g
消耗HCL的物质的量0.2mol1年前查看全部
- 在硫酸过量的条件下,软锰矿和硫酸亚铁反应,制备硫酸锰的化学反应
 robertyang3261年前2
robertyang3261年前2 -
 勇敢的心ROCK 共回答了15个问题
勇敢的心ROCK 共回答了15个问题 |采纳率86.7%软锰矿主要成分为二氧化锰,二氧化锰充当氧化剂,硫酸亚铁充当还原剂,反应方程式应该为
MnO2 + 2FeSO4 + 2H2SO4 = MnSO4 + Fe2(SO4)3 + 2H2O1年前查看全部
- 取含88%二氧化锰的软锰矿石100g跟足量浓盐酸起反应,可制得氯气多少克
 不走猫步的猫1年前1
不走猫步的猫1年前1 -
 自牙买加 共回答了14个问题
自牙买加 共回答了14个问题 |采纳率85.7%解析:88%二氧化锰的软锰矿石100g含MnO2:100*88%=88(g)
MnO2 + 4HCl(浓)=加热=MnCl2 + Cl2(^) + 2H2O
88 71
88 m m=71(g) 答:略1年前查看全部
- 取含二氧化锰75%的软锰矿174g,跟足量的浓盐酸反应,能值得氯气多少克
 从业路上1年前1
从业路上1年前1 -
 壁花 共回答了12个问题
壁花 共回答了12个问题 |采纳率91.7%MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
87 71
75%*174 x
x/71=75%*174/87
x=106.5g
∴可以制的氯气106.5g1年前查看全部
- 取含MnO2的软锰矿石,27.86克,跟足量的稀盐酸反应,制得5.6L氯气(该状态下Cl2的密度为3.17g/L.MnO
取含MnO2的软锰矿石,27.86克,跟足量的稀盐酸反应,制得5.6L氯气(该状态下Cl2的密度为3.17g/L.MnO2+4HCl(浓)==MnO2+Cl2(气体)+2H2O).计算,(1)这种软锰矿石中二氧化锰的质量分数.(2)被氧化的氯化氢为多少克?
 iefam1年前1
iefam1年前1 -
 锵锵寡妇连 共回答了13个问题
锵锵寡妇连 共回答了13个问题 |采纳率92.3%5.6L氯气(该状态下Cl2的密度为3.17g/L)的物质的量 =5.6L×3.17g/L÷71g/mol=0.25mol
MnO2+ 4HCl(浓)==MnO2+Cl2(气体)+2H2O .
1mol 2mol(被氧化) 1mol
x y 0.25mol
解得 x=0.25mol y=0.50mol
种软锰矿石中二氧化锰的质量分数=0.25mol×87g/mol÷27.86g=78%
被氧化的氯化氢质量=0.50mol×36.5g/mol=18.25g1年前查看全部
- 取含Mno2的软锰矿石27.86g,跟足量浓盐酸反应,制得5.6L氯气(该状态下Cl2)密度为3.17g/L)计算:
取含Mno2的软锰矿石27.86g,跟足量浓盐酸反应,制得5.6L氯气(该状态下Cl2)密度为3.17g/L)计算:
(1)、这种软锰矿石中MnO2的质量分数?
(2)、被氧化的Hcl为多少克? 黑犬黑犬土地1年前1
黑犬黑犬土地1年前1 -
 ryoheihei 共回答了19个问题
ryoheihei 共回答了19个问题 |采纳率94.7%m(Cl2) = 3.17g/L * 5.6L = 17.75g
n(Cl2) = 17.75g / 71g/mol = 0.25mol
设软锰矿中含二氧化锰xg,则:
4HCl(浓) + MnO2 = MnCl2 + Cl2↑ + 2H2O
87g 1mol
xg 0.25mol
得:87g / xg = 1mol / 0.25mol
得:x = 21.75
(1)w(MnO2) = 21.75g / 27.86g * 100% = 78.1%
(2)氯化氢被氧化的那部分转化为氯气.
n(Cl2) = 0.25mol,所以n(HCl) = 0.25mol * 2 = 0.5mol
m(HCl) = 36.5g/mol * 0.5mol = 18.25g
答:………………………………………………1年前查看全部
- 用含MnO2的质量分数为80%的软锰矿与足量的浓盐酸反应,制取6.72LCl2(标况)至少需这种软锰矿石多少克?
用含MnO2的质量分数为80%的软锰矿与足量的浓盐酸反应,制取6.72LCl2(标况)至少需这种软锰矿石多少克?
若浓盐酸质量分数为37%密度为1.19g/cm3,反应中至少消耗这种盐酸多少毫升? lindan79831年前1
lindan79831年前1 -
 牛牛芹芹 共回答了20个问题
牛牛芹芹 共回答了20个问题 |采纳率75%二氧化锰和盐酸反应是一比四的物质的量之比,生成比例是一比一,也就是说消耗一摩尔二氧化锰就生成一摩尔氯气.6.72L氯气是0.3摩尔,需要0.3摩尔二氧化锰,除以二氧化锰的摩尔质量再除以80%就是结果,盐酸这些东西是迷惑你的1年前查看全部
- 将23.2g含MnO2的质量分数为75%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应
将23.2g含MnO2的质量分数为75%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应
生成的Cl2的体积(标准状况
参加反应的浓盐酸的物质的量.
第二问的答案是0.67L吗,如果不是是什么 一次即兴演讲1年前1
一次即兴演讲1年前1 -
 爱上Q 共回答了18个问题
爱上Q 共回答了18个问题 |采纳率72.2%23.2g含MnO2的质量分数为75%的软锰矿石中MnO2的物质的量=23.2*75%/87=0.2mol
MnO2+4HCl=MnCl2+Cl2↑+2H2O
1 4 1
0.2 x y x=0.8 y=0.2
(1)生成的Cl2的体积 0.2*22.4=4.48L
(2)参加反应的浓盐酸的物质的量:0.8mol 如果是求体积,则0.8mol/12mol/L=0.067L=67mL1年前查看全部
- 将50gMnO2质量分数为87%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应).计算
将50gMnO2质量分数为87%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应).计算
将50gMnO2质量分数为87%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应).计算:
参加反应的浓盐酸的体积
生成的氯气的体积(标准状况)
刚刚看见某位同学答了.于是顺利做出来了.但是答案一刷新就没了. mistletal1年前1
mistletal1年前1 -
 shuangjiao0536 共回答了25个问题
shuangjiao0536 共回答了25个问题 |采纳率92%MnO2 + 4HCl(浓) = MnCl2 +Cl2 +2H2O
87g 4mol 22.4L
50gx87% A B
87xA =4x50x87% A=2mol 87xB =22.4x50x87% B=11.2L
所以浓盐酸的体积V=2mol / (12mol/L)= 1/6 L
产生的氯气体积为11.2L1年前查看全部
- 8.将23.2g含MnO2的质量分数为75%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应).
8.将23.2g含MnO2的质量分数为75%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应).
(1)参加反应的浓盐酸的物质的量.
(2)生成的Cl2的体积(标准状况).
这题怎么算啊? bhula1年前1
bhula1年前1 -
 foot1211 共回答了24个问题
foot1211 共回答了24个问题 |采纳率95.8%根据化学方程式:MnO_2 + 4HCl ==== MnCl_2 + Cl_2↑ + 2H_2O
m(MnO_2)= 23.2 * 75% = 17.4g
n(MnO_2)= m(MnO_2)/M(MnO_2) = 17.4/(55+16*2) = 0.2mol
根据方程式知:
n(HCl) = 4n(MnO_2) = 0.2*4 = 0.8mol
n(Cl_2) = n(MnO_2) = 0.2mol
V(Cl_2) = n(Cl_2) * V_m = 0.2*22.4 = 4.48L1年前查看全部
- 将30gMnO2质量分数为76.6%的软锰矿石与足量的的浓盐酸反应(1)求生成的Cl2在标准状况下体积
将30gMnO2质量分数为76.6%的软锰矿石与足量的的浓盐酸反应(1)求生成的Cl2在标准状况下体积
(2)将这些Cl2全部与足量的石灰乳反应理论上能生成多少克漂白粉 wxbhzc281年前1
wxbhzc281年前1 -
 zhu5566 共回答了24个问题
zhu5566 共回答了24个问题 |采纳率95.8%MnO2+4HCl(浓)===MnCl2+2H2O+Cl2↑
87 71
30*76.6%
=22.98 x
87/22.98=71/x
x=18.75
氯气质量为18.75g
得到氯气的量为0.264mol 即 0.264*22.4=5.92L1年前查看全部
- 实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3 在高温下反应,生成锰
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3 在高温下反应,生成锰酸钾(K2MnO4)和KCl :用水溶解,滤去残渣,滤液酸化后,K2MnO4.回答 :(1)软锰矿制备K2Mno4的化学方程式是 —— (2) K2MnO4制备KMnO4的离子方程试是—— (3)若用2.5g软锰矿(含MnO2 80%)进行上诉实验,计算KMnO4的 理论产量 (4)KMnO4 能与热的经硫酸酸化的NaC2O4反应生成Mn2+(离子)和CO2,该反应方程式是—— (5)上诉值得的KMnO4 产品0.165g,恰好与0.335g 纯NaC2O4反应完全,计算该KMnO4 的纯度.
 toupiaozy1391年前0
toupiaozy1391年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 实验室用20g软锰矿与200mL12moI/L的浓盐酸反应制得标况下4,48LCl2
 kodokoja1年前1
kodokoja1年前1 -
 zjh163 共回答了16个问题
zjh163 共回答了16个问题 |采纳率87.5%我计算一下,待会发你看看.1年前查看全部
- 关于求质量分数的一个问题某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠
关于求质量分数的一个问题
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠晶体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中定容;从中取出25.00mL待测液置于锥形瓶中,再用0.0200mol·L-1 KMnO4标准溶液进行滴定,当滴入20.00mL KMnO4溶液时恰好完全反应.
试回答下列问题:
(1)配平:____MnO4-+____C2O42-+____H+ =____Mn2++____CO2↑+____H2O
(2)0.0200mol·L-1 KMnO4标准溶液应置于______(选填“酸式”或“碱式”)滴定管中;如何判断滴定终点?__________________________________________________________.
(3)你能否帮助该研究小组求得软锰矿中MnO2的质量分数?______(选填“能”或“否”).若回答“能”,请给出计算结果;若回答“否”,试说明原因________________________.
(4)若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是________.
A.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
B.滴定前尖嘴部分有气泡,滴定终点时消失
C.定容时,俯视刻度线
D.滴定前仰视读数,滴定后俯视读数
E.锥形瓶用水洗之后未用待测液润洗
希望能解释一下怎么求MnO2,以及(1)中的式子是哪一步 第五帅1年前1
第五帅1年前1 -
 wang320132 共回答了16个问题
wang320132 共回答了16个问题 |采纳率93.8%(1)配平:__2__MnO4-+__5__C2O42-+__16__H+ =__2__Mn2++__10__CO2↑+_8___H2O
(2)0.0200mol·L-1 KMnO4标准溶液应置于__酸____(选填“酸式”或“碱式”)滴定管中;如何判断滴定终点?
__溶液由无色变为淡紫色___________.
3)你能否帮助该研究小组求得软锰矿中MnO2的质量分数?___否___(选填“能”或“否”).若回答“能”,请给出计算结果;若回答“否”,试说明原因___不知道反应后总溶液量____________.
求二氧化锰结果:
(A)草酸残余量:
用(1)式方程计算,2 :5 = 0.02 *20ml :N1 *25ml ,解得N1=0.016 mol/L
也即是反应后,草酸钠的浓度为0.016
(B)参与反应的草酸钠为:m = 2.68g - 0.016 * V (v为反应后容易体积)
二氧化锰与草酸反应:MnO2 + C2O42- + 4 H+ =Mn2+ 2CO2 +2H2O
通过上式可计算,MnO2 的反应量:A :B = x :m (x为二氧化锰质量,m为草酸钠质量,A B 分别是二氧化锰和草酸钠分子量)
求得 x = A/B *m =A/B *( 2.68-0.016* v)
(C)则二氧化锰的含量为 1.20 / x = ** = 1.2*B / (A*(2.68-0.016V))
由此可见,需要知道反应后溶液量!
回答你的问题:
怎么求MnO2———如上
以及(1)中的式子是哪一步——反应掉多余的草酸!1年前查看全部
- 取含Mno2的软锰矿与足量浓盐酸反应后 将生成的CL2通入含22gNaBr的水溶液中 加热蒸发烘干 得到质量13.1g的
取含Mno2的软锰矿与足量浓盐酸反应后 将生成的CL2通入含22gNaBr的水溶液中 加热蒸发烘干 得到质量13.1g的残渣 计算生成nacl的质量
 mistletoe66991年前1
mistletoe66991年前1 -
 btdg 共回答了12个问题
btdg 共回答了12个问题 |采纳率83.3%氯气与溴化钠反应生成了氯化钠和溴,蒸发后得到的固体有两种可能:一种全部是氯化钠,一种是氯化钠与溴化钠的混合物.
(据关系式计算,1molNaBr生成1molNaCl固体质量减少80-35.5=44.5g)
设生成NaClXg
NaBr-------NaCl 减少质量
103 58.5 44.5
x (22-13.1)
58.5/x=44.5/8.9
x=11.7g1年前查看全部
- 高一离子反应在酸性溶液中,软锰矿(MnO2)和黄铜矿(CuFeS2)可以相互作用,生成铜盐、锰盐和铁盐.请写出反应的离子
高一离子反应
在酸性溶液中,软锰矿(MnO2)和黄铜矿(CuFeS2)可以相互作用,生成铜盐、锰盐和铁盐.请写出反应的离子方程式.
找不到答案.下面的是我写的...不知道对不对,若有错误,望高手指正.若无错误,请高手帮忙分析S为什么要到+6价而不是其它价态(我是靠经验和感觉写的SO4 2-...)好的追加分数
9MnO2 + 2Fe2+ + 2S2- + 20H+ ------ 9Mn2+ + 2Fe3+ + 2SO4 2- + 10H2O
回2L,在CUFES2中CU是不是+2价啊...我刚学氧化还原,只知道最简单的情形:要是CU是+1价的话,那FE就是+3价,这两个离子不是不能共存的啊.,难道固态的时候可以?所以我觉的CUFES2中CU是+2价...没变价,就不要写了... 止风静树1年前1
止风静树1年前1 -
 大唐王朝300年 共回答了28个问题
大唐王朝300年 共回答了28个问题 |采纳率96.4%你写的是有问题的.
首先,MnO2和CuFeS2都是不溶于水的.所以不能写成离子.(通常矿石都是不溶于水的,要不下场雨不就没矿石了么?这是常识哦)
第二,CuFeS2中,Cu是+1价,Fe是+3价.注意一个问题.也许老师会告诉你,Cu2+比Cu+稳定,但是注意,那是在水溶液中而不是在空气中!水溶液中稳定的原因是存在水化热.在空气中,Cu+比较稳定.而同样在空气中,Fe2+很溶液被氧化成Fe3+.另外,Cu+不能和Fe3+共存是热力学问题,而在矿石中还存在动力学问题,这不在高中学习范围内.
在酸性条件下,+4价的Mn的确可以将S氧化到+6价.所以总反应方程式是
2CuFeS2 + 17MnO2 + 36H+ = 2Cu2+ + 2Fe3+ + 17Mn2+ +4SO4 2- +18H2O1年前查看全部
- (2009•天津)瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,反应的化学方程式
(2009•天津)瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2X则X的化学式为______.△ . 鲁75991年前1
鲁75991年前1 -
 cjq0392131 共回答了18个问题
cjq0392131 共回答了18个问题 |采纳率83.3%解题思路:根据质量守恒定律可知,在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.根据化学方程式和质量守恒定律就可计算出生成物各元素的原子个数与反应物各元素的原子个数之差,然后除以2,就是X的化学式中含有的元素的原子个数.根据化学方程式可知,X的化学式中含有Mn的个数为:(1-1)÷2=0;含有Cl的个数为:(4-4)÷2=0;含有O的个数为:2÷2=1;含有H的个数为:4÷2=2.故X的化学式为H2O.
故答案为:H2O.点评:
本题考点: 有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题主要考查学生运用化学式和质量守恒定律计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 取含MnO2的软锰矿17.4g与足量浓盐酸反应后,将生成的Cl2通入含22gNaBr的水溶液中,经加热蒸发水分并烘干后
取含MnO2的软锰矿17.4g与足量浓盐酸反应后,将生成的Cl2通入含22gNaBr的水溶液中,经加热蒸发水分并烘干后
计算:(1)生成NaCl多少摩?(2)生成Cl2多少升(标准状况)?(3)软锰矿含MnO2的质量分数.(要求有过程的答案)
 maji5201年前1
maji5201年前1 -
 wangzj72 共回答了18个问题
wangzj72 共回答了18个问题 |采纳率77.8%用差量法解答
Cl2 + 2NaBr = 2NaCl + Br2 质量差
71 117 160 89
m1 m2 22-13.1=8.9g
列比例式可解得m1=7.1g m2=11.7g
再根据 MnO2-------Cl2
87 71
m3 7.1g
得m3=8.7g
所以反应生成的NaCl的质量为11.7g
生成cl2的质量为7.1g,即0.1mol,故体积为2.24L(标况)
软锰矿所含MnO2的质量分数为8.7/17.4=50%1年前查看全部
- 软锰矿制备高锰酸钾的离子方程式
 队非常的1年前1
队非常的1年前1 -
 重新崛起 共回答了16个问题
重新崛起 共回答了16个问题 |采纳率93.8%3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O↑
3MnO42-+4H+=2MnO4-+MnO2↓+2H2O
两式相加得 2MnO2+6OH-+4H+ClO3- = 2MnO4-+5H2O↑+CL-1年前查看全部
- 称取软锰矿试样0.5000g,加入0.7500gH2C2O4·2H2O及稀硫酸,加热至反应完全.过量的草酸用30.00m
称取软锰矿试样0.5000g,加入0.7500gH2C2O4·2H2O及稀硫酸,加热至反应完全.过量的草酸用30.00mL0.02000mol/L的KMnO4溶液滴定至终点,求软锰矿的氧化能力(以已知)(8分)
 c1dt1ybg1年前1
c1dt1ybg1年前1 -
 youbear 共回答了24个问题
youbear 共回答了24个问题 |采纳率91.7%哦,擅长领域还是化学的呢?!
5H2C2O4.2H2O :2KMnO4
5*126.07 2
X 30/1000*0.02 X = 5*126.07*0.02/2/1000 = 0.1891g
MnO2 :H2C2O4.2H2O
86.94 126.07
Y 0.1891 Y = 86.94*0.1891/126.07 = 0.1304g
……1年前查看全部
大家在问
- 1《留在我心底的风景》作文 600字左右
- 2黑体辐射的图像与公式是什么
- 3求一篇"我心中的太阳"作文以母爱,师爱写一篇,600字,加急!
- 4物质共有几种态,分别是什么?
- 5四年级下册英语第一课翻译成中文
- 6留在心中的风景 作文 600字
- 7将30gMnO2的质量分数为76.6%的软猛矿石与足量的浓度为12mol/L的浓盐酸完全反应(杂质不参加反应),计算:生
- 8整数是否包括负数?需权威答案.
- 9关于珍惜时间的作文400字到450字的谢谢
- 10“黑体辐射定律”
- 11用易挥发性的有机物质培养晶体时应注意什么
- 12关于珍惜时间的作文400字,
- 13轧有哪三个读音急
- 14轧有哪三个读音
- 15出轧 的 读音就是 出轧 的 轧