(2012•延边州)a的3倍是3a3a,3个a相乘的积是a3a3.
 Nick1142022-10-04 11:39:541条回答
Nick1142022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 牛牛877899 共回答了14个问题
牛牛877899 共回答了14个问题 |采纳率85.7%- 解题思路:根据乘法和乘方的意义:a的3倍是a×3;3个a相乘的积是:a×a×a=a3;据此解答即可.
a的3倍是3a,3个a相乘的积是a3.
故答案为:3a,a3.点评:
本题考点: 用字母表示数;有理数的乘方.
考点点评: 关键是区分3个a相加与3个a相乘的表示方法. - 1年前
相关推荐
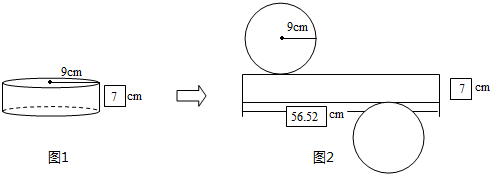
- (2014•延边州模拟)如图甲所示,平行于光滑斜面的轻弹簧劲度系数为k,一端固定在倾角为θ的斜面底端,另一端与物块A连接
 (2014•延边州模拟)如图甲所示,平行于光滑斜面的轻弹簧劲度系数为k,一端固定在倾角为θ的斜面底端,另一端与物块A连接;两物块A、B质量均为m,初始时物块均静止.现用平行于斜面向上的拉力F拉动物块B,使B做加速度为a的匀加速运动,两物块在开始一段时间内的v-t图象如图乙所示(t1时刻A、B的图线相切,t2时刻对应A图线的最高点),重力加速度为g,则( )
(2014•延边州模拟)如图甲所示,平行于光滑斜面的轻弹簧劲度系数为k,一端固定在倾角为θ的斜面底端,另一端与物块A连接;两物块A、B质量均为m,初始时物块均静止.现用平行于斜面向上的拉力F拉动物块B,使B做加速度为a的匀加速运动,两物块在开始一段时间内的v-t图象如图乙所示(t1时刻A、B的图线相切,t2时刻对应A图线的最高点),重力加速度为g,则( )
A.A达到最大速度时的位移[mgsinθ/k]
B.拉力F的最小值为mgsinθ+ma
C.A、B分离时t1=2(mgsinθ−ma) ak
D.A、B分离前,A、B和弹簧系统机械能增加,A和弹簧系统机械能增加 mi4mhg1年前1
mi4mhg1年前1 -
 a13516809505 共回答了17个问题
a13516809505 共回答了17个问题 |采纳率94.1%解题思路:A的速度最大时加速度为零,根据胡克定律求出A达到最大速度时的位移;根据牛顿第二定律求出拉力F的最小值.由图读出,t1时刻A、B开始分离,对A根据牛顿第二定律和运动学公式求解t1.根据功能关系分析能量如何转化.A、由图知,t2时刻A的加速度为零,速度最大,根据牛顿第二定律和胡克定律得:mgsinθ=kx,则得:x=[mgsinθ/k],故A正确.
B、对AB整体,根据牛顿第二定律得:F-2mgsinθ+kx=2ma,得F=2mgsinθ-kx+2ma,则知开始时F最小,此时有:2mgsinθ=kx,得F的最小值为 F=2ma,故B错误.
C、由图读出,t1时刻A、B开始分离,对A根据牛顿第二定律:kx-mgsinθ=ma
开始时有:2mgsinθ=kx0,
又x0-x=[1/2a
t21]
联立以三式得:t1=
2(mgsinθ−ma)
ak.故C正确.
D、A、B分离前,F做正功,根据功能关系得知,A、B和弹簧系统机械能增加,而A对B的压力做负功,A和弹簧系统机械能减小.故D错误.
故选:AC点评:
本题考点: 机械能守恒定律;胡克定律;牛顿第二定律.
考点点评: 从受力角度看,两物体分离的条件是两物体间的正压力为0.从运动学角度看,一起运动的两物体恰好分离时,两物体在沿斜面方向上的加速度和速度仍相等.1年前查看全部
- (2012•延边州模拟)如图中画出了氢原子的4个能级,并注明了相应的能量E.氢原子从n=4能级跃迁到n=2能级时辐射出光
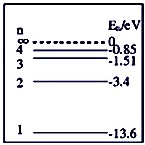 (2012•延边州模拟)如图中画出了氢原子的4个能级,并注明了相应的能量E.氢原子从n=4能级跃迁到n=2能级时辐射出光子甲,从n=3能级跃迁到n=1能级时辐射出光子乙,则下列说法中正确的是( )
(2012•延边州模拟)如图中画出了氢原子的4个能级,并注明了相应的能量E.氢原子从n=4能级跃迁到n=2能级时辐射出光子甲,从n=3能级跃迁到n=1能级时辐射出光子乙,则下列说法中正确的是( )
A.在与物质相互作用时甲光的粒子性比乙光的粒子性要显著
B.用乙光照射某种金属能发生光电效应现象,则用甲光照射该金属也一定能发生光电效应现象
C.当它们从水中射入空气中时乙光的临界角大
D.在水中甲光的光速比乙光光速大 木兰水仙1年前1
木兰水仙1年前1 -
 sf2qi 共回答了16个问题
sf2qi 共回答了16个问题 |采纳率87.5%解题思路:根据能级差比较辐射的光子频率大小,从而比较出波长的大小.根据光电效应的条件判断能否发生光电效应.由v=Cn分析光在水中速度的大小.折射率越大,频率越大.由sinC=1n分析临界角的大小.A、当氢原子从n=4的能级跃迁到n=2的能级时,辐射出光子甲,知光子甲的能量为2.55eV;
当氢原子从n=3的能级跃迁到n=1的能级时,辐射出光子乙,知光子乙能量为12.09eV.知光子乙的能量大于光子甲的能量,所以光子乙的频率大于光子甲的频率,
高频光波长短光的粒子性显著,所以在与物质相互作用时乙光的粒子性比甲光的粒子性要显著,故A错误;
B、用乙光照射某种金属能发生光电效应现象,由于光子乙的能量大于光子甲的能量,所以用甲光照射该金属不一定能发生光电效应现象,故B错误;
C、由临界角公式sinC=[1/n]分析可知,当它们从水中射入空气中时甲光的临界角大,故C错误;
D、水对乙光的折射率较大,由v=[C/n]可知,水中光束乙的速度较小.所以在水中甲光的光速比乙光光速大,故D正确;
故选:D.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 解决本题的关键知道能级跃迁所满足的规律,即Em-En=hv,以及知道发生光电效应的条件,难度不大.还要抓住折射率越大,频率越大这个知识点.1年前查看全部
- (2013•延边州模拟)两个研究性学习小组分别进行探究性的实验:
(2013•延边州模拟)两个研究性学习小组分别进行探究性的实验:
甲组:为了探究Cl2和SO2同时通入H2O中发生的反应,设计了如图1所示的实验装置.
(1)气体发生装置A中产生的气体化学式为______.
(2)装置D中发生反应的化学方程式为______;在装置D反应后所得溶液中加入BaCl2溶液,观察到的现象是______.
(3)装置C中饱和食盐水的作用是______;装置E的作用是______.
乙组:为了分别研究SO2和Cl2的性质,设计了如图2所示的实验装置.
(4)若从左端分别通入SO2和Cl2,则装置I中观察到的现象是否相同?______(填“相同”或“不相同”);当通入SO2时,装置III中发生反应的离子方程式为______,该反应中SO2表现出______性.
(5)若装置II中装有5.0mL 1.0×10-3mol•L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,则该反应的化学方程式为______.
(6)你认为乙组设计的装置是否有不足之处?______(填“有”或“无”).如果有,请写出改进方法:______ (如果无,此空不答).
 samkite1年前1
samkite1年前1 -
 非典疑似病例 共回答了22个问题
非典疑似病例 共回答了22个问题 |采纳率90.9%解题思路:(1)气体A不通过饱和食盐水,则为二氧化硫;
(2)氯气具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原反应生成氯化氢和硫酸,硫酸根离子和钡离子能生成硫酸钡沉淀;
(3)饱和食盐水能除去氯气中的氯化氢;氯气和二氧化硫都有毒,不能直接排空,要处理尾气;
(4)次氯酸和二氧化硫都有漂白性,二氧化硫和溴化铁发生氧化还原反应,失电子的反应物作还原剂;
(5)通入足量的氯气,碘完全反应,根据转移电子数目计算I元素在氧化产物中的化合价,确定产物,据此书写;
(6)最后一个装置存在安全隐患.(1)由装置图可知,B装置气体生成后通入饱和食盐水中,说明是氯气的发生装置,通过食盐水除去气体中的氯化氢气体,所以A装置产生的气体为二氧化硫,二氧化硫是易溶于水的气体,通过F通入水防止倒吸;
故答案为:SO2;
(2)氯气和二氧化硫发生氧化还原反应生成氯化氢和硫酸,反应方程式为:Cl2+SO2+2H2O═2HCl+H2SO4,硫酸和氯化钡反应生成硫酸钡白色沉淀,
故答案为:Cl2+SO2+2H2O═2HCl+H2SO4;生成白色沉淀;
(3)实验室制取的氯气中含有氯化氢,要出去氯化氢且不能溶解氯气,需要通过饱和食盐水除去氯化氢,所以C的作用是:除去氯化氢气体,减少氯气的溶解;
氯气和二氧化硫都有毒,不能直接排空,且二者都能和氢氧化钠溶液反应,E装置中含有缓冲装置,能防止倒吸,所以尾气处理中用氢氧化钠溶液吸收氯气和二氧化硫、防止倒吸,
故答案为:除去氯化氢气体,减小Cl2的溶解;防止倒吸,吸收多余的SO2或Cl2气体;
(4)氯气和水反应生成次氯酸,次氯酸和二氧化硫都能使品红溶液褪色,所以看到的现象相同;
III中铁离子具有氧化性,能和二氧化硫发生氧化反应生成硫酸和亚铁离子,离子反应方程式为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
该反应中,硫元素失电子化合价升高,所以二氧化硫作还原剂,
故答案为:相同;2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,还原;
(5)装置B中装有5.0mL 1.0mol•L-1的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,故I元素在氧化产物中的化合价为
5.0×10−2mol
1.0mol/L×0.005L=5,故氧化产物为HIO3,氯气被还原为HCl,反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;
故答案为:5Cl2+I2+6H2O=10HCl+2HIO3;
(6)尾气处理装置中,如果气体压强过大,导致塞子冲出而引起安全隐患,其处理方法为:去掉胶塞或将广口瓶的塞子换成双孔塞,另一孔插入一根直导管,
故答案为:有;去掉胶塞或将广口瓶的塞子换成双孔塞,另一孔插入一根直导管.点评:
本题考点: 探究氯水、氯气的漂白作用;探究二氧化硫与水和品红溶液的反应.
考点点评: 本题考查了探究次氯酸、二氧化硫的漂白性,明确实验原理是解本题关键,根据实验目的进行对比实验,根据物质的性质分析解答,注意F和E装置有相似性,二者都有缓冲作用,能防止倒吸,难度中等.1年前查看全部
- (2012•延边州)甲、乙、丙三个工程队完成某项工程的天数和日工资如下表:
(2012•延边州)甲、乙、丙三个工程队完成某项工程的天数和日工资如下表:
请你选择两个工程队合做这项工程,如果工期很紧,想尽快完工,应选择哪两个队合做?几天可以完工?完工后两队各得多少工资?工程队 单独完成工程所用天数 每日总工资(万元) 甲 10 18 乙 15 12 丙 20 8  颠倒快感1年前1
颠倒快感1年前1 -
 就叫梨落 共回答了16个问题
就叫梨落 共回答了16个问题 |采纳率100%因为
1
10>
1
15>
1
20,所以选甲乙两队合做.
1÷(
1
10+
1
15),
=1÷
1
6,
=6(天);
18×6=108(万元),
12×6=72(万元);
答:应选甲乙两队合做,6天可以完工,完工后甲队可得工资108万元,乙队可得工资72万元.1年前查看全部
- (2014•延边州一模)下列关于生物科学发展史的叙述中,符合事实的是( )
(2014•延边州一模)下列关于生物科学发展史的叙述中,符合事实的是( )
A.萨克斯利用天竺葵为实验材料,证明光合作用的场所是叶绿体
B.人们发现的第一种激素是由胰腺分泌的促胰液素
C.温特的实验进一步证明造成胚芽鞘弯曲的刺激确实是一种化学物质
D.坎农提出:神经-体液-免疫调节网络是机体维持稳态的主要调节机制 youxiang2221年前1
youxiang2221年前1 -
 aiyognjie 共回答了16个问题
aiyognjie 共回答了16个问题 |采纳率100%解题思路:萨克斯的实验结论是光合作用产物是淀粉;促胰液素是人们发现的第一种激素,该激素是由小肠黏膜分泌;温特通过接受尖端的琼脂块放到切去尖端胚芽鞘的一侧,证明了造成胚芽鞘弯曲的刺激确实是一种化学物质.坎农提出内环境稳态是在神经调节和体液调节的共同作用下,通过机体各种器官、系统分共合作、协调统一实现,没有提出免疫系统的作用.A、萨克斯的实验结论是光合作用产物是淀粉,A错误;
B、促胰液素是人们发现的第一种激素,该激素是由小肠黏膜分泌,B错误;
C、温特通过接受尖端的琼脂块放到切去尖端胚芽鞘的一侧,证明了造成胚芽鞘弯曲的刺激确实是一种化学物质,C正确;
D、坎农提出内环境稳态是在神经调节和体液调节的共同作用下,通过机体各种器官、系统分共合作、协调统一实现,没有提出免疫系统的作用,D错误.
故选:C.点评:
本题考点: 植物生长素的发现和作用;光合作用的发现史;稳态的生理意义.
考点点评: 本题考查的是被学生容易忽略的知识,在复习时要多注意教材的理解和记忆.1年前查看全部
- (2013•延边州)直角的 [1/6]是______度,平角的 [1/5]是______
(2013•延边州)直角的 [1/6]是______度,平角的 [1/5]是______ 度.
 kill_lenovo1年前1
kill_lenovo1年前1 -
 可爱甜玉米 共回答了15个问题
可爱甜玉米 共回答了15个问题 |采纳率93.3%解题思路:因为直角是90°,平角是180°,再根据分数乘法的意义解答.90°×[1/6]=15°;
180°×[1/5]=36°.
故答案为:15;36.点评:
本题考点: 角的度量.
考点点评: 解决本题要明确直角和平角的度数.1年前查看全部
- (2012•延边州模拟)以下说法中正确的是( )
(2012•延边州模拟)以下说法中正确的是( )
A.当分子间距离增大时,分子间作用力减小,分子势能增大
B.已知某物质的摩尔质量为M,密度为ρ,阿伏加德罗常数为NA,则该种物质的分子体积为V0=M ρNA
C.自然界一切过程能量都是守恒的,符合能量守恒定律的宏观过程都能自然发生
D.液晶既具有液体的流动性,又具有单晶体的光学各向异性的特点 老丫丫1年前1
老丫丫1年前1 -
 木木卡吗 共回答了22个问题
木木卡吗 共回答了22个问题 |采纳率86.4%解题思路:分子力做功等于分子势能的减小量;气体分子间隙远大于分子直径;宏观热现象都具有方向性;液晶既具有液体的流动性,又具有单晶体的光学各向异性的特点.A、当分子间距离增大时,分子间引力和斥力同时减小;
如果分子力的合力是引力,分子力做负功,分子势能增大;
如果分子力的合力是斥力,分子力做正功,分子势能减小;故A错误;
B、已知某物质的摩尔质量为M,密度为ρ,阿伏加德罗常数为NA,则该种物质的每个分子占据空间的体积为:
V0=
M
ρNA;如果是气体,分子间隙远大于分子直径;分子体积未知;故B错误;
C、自然界一切过程能量都是守恒的,但根据热力学第二定律,宏观热现象具有方向性,故符合能量守恒定律的宏观过程不一定能够发生;故C错误;
D、液晶既具有液体的流动性,又具有单晶体的光学各向异性的特点,故D正确;
故选:D.点评:
本题考点: * 液体的表面张力现象和毛细现象;分子间的相互作用力.
考点点评: 本题考查了分子力与分子势能的关系、阿伏加德罗常数、热力学定律、液晶等,知识点多,难度小,关键是记住基础知识.1年前查看全部
- (2013•延边州)在如图中,如果圆柱的体积为1780.38cm3,请在“□”内填入正确的数字.______、_____
(2013•延边州)在如图中,如果圆柱的体积为1780.38cm3,请在“□”内填入正确的数字.______、______、______
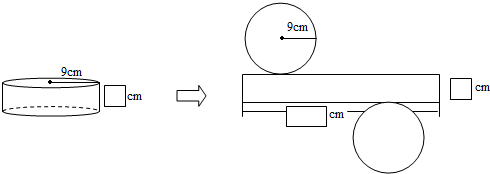
 江枫21年前1
江枫21年前1 -
 一点也不张扬 共回答了15个问题
一点也不张扬 共回答了15个问题 |采纳率100%1年前查看全部
- (2013•延边州模拟)有机物甲的分子式为C5H10O2,已知:①甲可以发生银镜反应;②甲是具有水果香味的物质;③在酸性
(2013•延边州模拟)有机物甲的分子式为C5H10O2,已知:①甲可以发生银镜反应;②甲是具有水果香味的物质;③在酸性或碱性条件下甲可以发生水解反应;则甲的可能结构有( )
A.1种
B.2种
C.3种
D.4种 逍遥醒1年前1
逍遥醒1年前1 -
 qnqnqnqq 共回答了14个问题
qnqnqnqq 共回答了14个问题 |采纳率85.7%解题思路:由①甲可以发生银镜反应,则含-CHO;②甲是具有水果香味的物质,则甲中含-COOC-;③在酸性或碱性条件下甲可以发生水解反应,为酯类物质,即甲为甲酸某酯,以此来推断甲的可能结构.有机物甲的分子式为C5H10O2,①甲可以发生银镜反应,则含-CHO;②甲是具有水果香味的物质,则甲中含-COOC-;③在酸性或碱性条件下甲可以发生水解反应,为酯类物质,即甲为甲酸某酯,
所以甲可能为HCOOCH2CH2CH2CH3、HCOOCH(CH3)CH2CH3、HCOOCH2CH(CH3)2、HCOOC(CH3)3,共4种,
故选D.点评:
本题考点: 有机物的推断;有机物的结构和性质.
考点点评: 本题考查有机物的推断,为高频考点,把握银镜反应及酯类的水解推断甲为甲酸某酯为解答的关键,注意丁醇有四种可能的结构,侧重酯、甲酸的性质及同分异构体的考查,题目难度中等.1年前查看全部
- (2014•延边州模拟)下列各组离子在常温下一定能大量共存的是( )
(2014•延边州模拟)下列各组离子在常温下一定能大量共存的是( )
A.pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+
B.在
=1012的溶液中:NH4+、NO3-、K+、Cl-c(H+) c(OH−)
C.加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl-
D.含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+ 白日倚山尽1年前1
白日倚山尽1年前1 -
 要要流流 共回答了17个问题
要要流流 共回答了17个问题 |采纳率70.6%解题思路:A、pH=0的无色溶液为酸性溶液,且不存在有色离子,亚铁离子为有色离子;
B、在
=1012的溶液为酸性溶液,四种离子之间不反应,能够共存;c(H+) c(OH−)
C、加入铝粉能放出H2的溶液为酸性或者碱性溶液,镁离子、铵离子能够与氢氧根离子反应;
D、铁离子能够与硫氰根离子反应生成络合物硫氰化铁.A、该溶液为酸性无色溶液,Fe2+为有色离子,不满足溶液无色的要求,故A错误;
B、该溶液为酸性溶液,NH4+、NO3-、K+、Cl-离子之间不反应,也不与氢离子反应,在溶液中能够大量共存,故B正确;
C、该溶液为酸性或者碱性溶液,Mg2+、NH4+能够与氢氧根离子反应,在溶液中不能大量共存,酸性溶液中NO3-、Al反应不生成氢气,故C错误;
D、Fe3+能够与SCN-离子反应生成硫氰化铁,在溶液中不能大量共存,故D错误;
故选B.点评:
本题考点: 离子共存问题.
考点点评: 本题考查了离子共存的判断,题目难度中等,注意熟练掌握离子反应发生的条件,明确常见的离子不能共存的情况,还要注意题中暗含条件的要求.1年前查看全部
- (2012•延边州模拟)如图1为长式周期表的一部分,其中的编号代表对应元素.
(2012•延边州模拟)如图1为长式周期表的一部分,其中的编号代表对应元素.
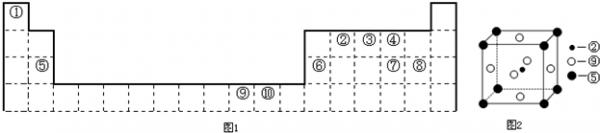
请回答下列问题:
(1)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是______.
A.分子中含有氢键
B.属于含有极性键的非极性分子
C.只含有4个σ键和1个π键
D.该氢化物分子中元素②原子采用sp2杂化
(2)科学发现,②、⑤、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构如图2所示(图中②、⑤、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为______(用对应的元素符号表示).
(3)a:比较②、③、④三种元素第一电离能大小,由小到大排列的顺序为______(用元素符号表示).
b:比较④、⑥、⑦、⑧四种元素的电负性大小,由大到小排列的顺序为______(用元素符号表示).
(4)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的X分子的结构式为______;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:______;反应过程中的离子方程式为______.
(5)⑩元素单质晶体是面心立方体,立方体的每个面5个⑩原子紧密堆砌,⑩原子半径为d cm,该金属的密度为
a2 8d3 g•cm-3.(该金属原子的质量为a g)
a2 8d3  chandou19791年前1
chandou19791年前1 -
 天空中的云 共回答了29个问题
天空中的云 共回答了29个问题 |采纳率96.6%解题思路:由元素所在周期表中的位置可知①为H,②为C,③为N,④为O,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Ni,⑩为Cu,
(1)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志,为乙烯;
(2)利用均摊法计算;
(3)a.同周期从左到右,元素的第一电离能逐渐增大,注意N原子最外层为半充满的特征;
b.根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小判断;
(4)某元素的价电子排布式为nsnnpn+1,应为2s22p3,应为N元素,与元素①形成的18电子的X分子为N2H4,与元素①形成10电子的气体分子Y为NH3,氨气通入铜盐溶液中,先生成蓝色沉淀,继续反应生成配合物;
(5)利用均摊法计算晶胞中含有的Cu原子个数,质量质量,结合ρ=[m/V]计算.由元素所在周期表中的位置可知①为H,②为C,③为N,④为O,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Ni,⑩为Cu,
(1)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志,为乙烯,结构式为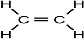 ,可知分子中含有C=C非极性键和C-H极性键,为平面形分子,含有5个σ键和1个π键,每个C形成3个σ键,为sp2杂化,
,可知分子中含有C=C非极性键和C-H极性键,为平面形分子,含有5个σ键和1个π键,每个C形成3个σ键,为sp2杂化,
故答案为:BD;
(2)晶胞中,含有Mg个数为8×[1/8]=1,Ni个数为6×[1/2]=3,N原子个数为1,则化学式为MgNi3C,
故答案为:MgNi3C;
(3)a:同周期从左到右,元素的第一电离能逐渐增大,N原子最外层为半充满结构,第一电离能大于相邻原子的第一电离能,则顺序为C<O<N,
故答案为:C<O<N;
b:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,电负性顺序为O>Cl>S>Al,故答案为:O>Cl>S>Al;
(4)某元素的价电子排布式为nsnnpn+1,应为2s22p3,应为N元素,与元素①形成的18电子的X分子为N2H4,结构式为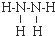 ,与元素①形成10电子的气体分子Y为NH3,氨气通入铜盐溶液中,先生成蓝色沉淀,继续反应生成配合物,反应的离子方程式为Cu2++2 NH3•H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
,与元素①形成10电子的气体分子Y为NH3,氨气通入铜盐溶液中,先生成蓝色沉淀,继续反应生成配合物,反应的离子方程式为Cu2++2 NH3•H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为: ;先生成蓝色沉淀,后沉淀溶解,溶液呈深蓝色;Cu2++2 NH3•H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
;先生成蓝色沉淀,后沉淀溶解,溶液呈深蓝色;Cu2++2 NH3•H2O=Cu(OH)2↓+2 NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(5)铜晶胞是面心立方,所以每个金晶胞中含有的原子个数=8×[1/8]+6×[1/2]=4,
每个铜晶胞中含有4个原子,原子半径为d cm,则晶胞的体积为(2
2d)3cm3,晶胞的质量为4a,
则ρ=
4a
(2
2d)3=
2a
8d3(g•cm-3),
故答案为:
2a点评:
本题考点: 位置结构性质的相互关系应用;元素电离能、电负性的含义及应用;化学键;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查位置、结构性质的相互关系以及应用,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意把握晶胞的计算,为该题的难点,也是易错点,难度中等.1年前查看全部
- (2012•延边州)蒙古包也称“毡包”,是蒙古族传统民居.如图蒙古包是由一个圆柱体和一个圆锥体组成.
 (2012•延边州)蒙古包也称“毡包”,是蒙古族传统民居.如图蒙古包是由一个圆柱体和一个圆锥体组成.
(2012•延边州)蒙古包也称“毡包”,是蒙古族传统民居.如图蒙古包是由一个圆柱体和一个圆锥体组成.
(1)这个蒙古包至少占地多少?
(2)这个蒙古包至少占了多大的空间? wuxinze1年前1
wuxinze1年前1 -
 互惠 共回答了22个问题
互惠 共回答了22个问题 |采纳率100%解题思路:(1)求蒙古包的占地面积,实际上就是求圆柱的底面积,底面直径已知,从而可以求出底面积;
(2)蒙古包所占空间就等于圆锥与圆柱的体积和,底面直径和圆锥与圆柱的高已知,从而可以求解.(1)3.14×(8÷2)2,
=3.14×16,
=50.24(平方米);
(2)[1/3]×50.24×1.2+50.24×2,
=[1/3]×60.288+100.48,
=20.096+100.48,
=120.576(立方米);
答:这个蒙古包至少占地50.24平方米;这个蒙古包至少占了120.576立方米的空间.点评:
本题考点: 圆柱的侧面积、表面积和体积;圆锥的体积.
考点点评: 此题主要考查圆的面积、圆锥和圆柱的体积计算方法,解答时要弄清楚有关数据的长度.1年前查看全部
- (2012•延边州)一个真分数的倒数一定比这个真分数大.______.(判断对错)
 可逗儿1年前1
可逗儿1年前1 -
 angela2896 共回答了26个问题
angela2896 共回答了26个问题 |采纳率80.8%解题思路:先回忆真分数的概念,再举例子证明,可得出答案.[b/a](a>b,a≠0)是真分数,真分数都小于1;真分数[b/a]的倒数是[a/b](a大于b),[a/b]是假分数,假分数都大于1 所以一个真分数的倒数一定比这个真分数大.
故填√.点评:
本题考点: 倒数的认识;分数的意义、读写及分类.
考点点评: 做此题的关键要知道:一个真分数的倒数是假分数,真分数都小于1,假分数都大于1.1年前查看全部
- (2i14•延边州模拟)近年来,莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图下列关于莽草
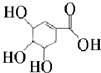 (2i14•延边州模拟)近年来,莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图下列关于莽草酸的说法不正确的是( )
(2i14•延边州模拟)近年来,莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图下列关于莽草酸的说法不正确的是( )
A.莽草酸的相对分子质量为174
B.分子中含有两种含氧官能团
C.可发生取代、加成反应及氧化反应
D.在水溶液中羟基和羧基均能电离出氢离子 四级的mm1年前1
四级的mm1年前1 -
 skyboating 共回答了19个问题
skyboating 共回答了19个问题 |采纳率84.2%解题思路:该有机物含有羟基,可发生取代、消去和氧化反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有羧基,具有酸性,可发生中和、酯化反应,以此解答.9.根据莽草酸5结构式可确定其分子式为C7H11O三,则相对分子质量为174,故9正确;
B.分子中含有羟基和羧基两种含氧官能团,故B正确;
C.分子中羟基、羧基可发生取代反应,碳碳双键可发生加成反应,羟基、碳碳双键可发生氧化反应,故C正确;
D.羟基不能电离出氢离子,故D错误.
故选D.点评:
本题考点: 有机物的结构和性质.
考点点评: 本题考查有机物的结构和性质,该题是中等难度的试题,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养.该题的关键是准确判断出分子中含有的官能团,然后结合具体官能团的结构和性质灵活运用即可,有利于培养学生的知识迁移能力和逻辑推理能力.1年前查看全部
- (2012•延边州)甲、乙、丙三个工程队完成某项工程的天数和日工资如下表:
(2012•延边州)甲、乙、丙三个工程队完成某项工程的天数和日工资如下表:
请你选择两个工程队合做这项工程,如果工期很紧,想尽快完工,应选择哪两个队合做?几天可以完工?完工后两队各得多少工资?工程队 单独完成工程所用天数 每日总工资(万元) 甲 10 18 乙 15 12 丙 20 8  linda_wu051年前1
linda_wu051年前1 -
 MADRID大樱桃 共回答了15个问题
MADRID大樱桃 共回答了15个问题 |采纳率93.3%因为[1/10>
1
15>
1
20],所以选甲乙两队合做.
1÷([1/10+
1
15]),
=1÷[1/6],
=6(天);
18×6=108(万元),
12×6=72(万元);
答:应选甲乙两队合做,6天可以完工,完工后甲队可得工资108万元,乙队可得工资72万元.1年前查看全部
- (2013•延边州)校园的林地里一共有李子树、杏树和桃树64棵,它们的棵数之比依次是1:3:4,校园里有李子树、杏树和桃
(2013•延边州)校园的林地里一共有李子树、杏树和桃树64棵,它们的棵数之比依次是1:3:4,校园里有李子树、杏树和桃树各多少棵?
 zhenyonghuming1年前1
zhenyonghuming1年前1 -
 cckjl 共回答了18个问题
cckjl 共回答了18个问题 |采纳率88.9%解题思路:根据比与分数的关系可知:李子树占了总棵数的[1/1+3+4],杏树占了总棵数的[3/1+3+4],桃树占了总棵数的[4/1+3+4],总棵数是64棵.据此解答.李子树的棵数是:
64×[1/1+3+4]=8(棵),
杏树的棵数是:
64×[3/1+3+4]=24(棵),
桃树的棵数是:
64×[4/1+3+4]=32(棵).
答:校园里有李子树8棵,杏树24棵,桃树32棵.点评:
本题考点: 按比例分配应用题.
考点点评: 本题的关键是根据比与分数的关系分别求出各种树占总棵数的几分之几,再根据分数乘法的意义列式解答.1年前查看全部
- (2013•延边州模拟)设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
(2013•延边州模拟)设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
A.常温常压下,11.2L的NO2和CO2混合气体含有NA个O原子
B.标准状况下,22.4L的乙烯中含有的共用电子对数为12NA
C.1L0.1mo1•L-1的氨水中含有0.1NA个OH-
D.以石墨为电极电解氯化铜溶液时,若阳极上失去电子NA个,则阴极质量增加32g 水仙家女1年前1
水仙家女1年前1 -
 过山鲫 共回答了16个问题
过山鲫 共回答了16个问题 |采纳率100%解题思路:A、依据气体摩尔体积的条件应用分析判断;
B、依据n=[V/22.4],计算物质的量结合乙烯分子结构计算共用电子数;
C、一水合氨是弱电解质存在电离平衡;
D、依据电解原理和电极反应,结合电子守恒计算得到;A、常温常压下,11.2LNO2和CO2混合气体物质的量不是0.5mol,故A错误;
B、标准状况下,22.4L的乙烯物质的量为1mol,乙烯分子中共用电子对数为6NA,故B错误;
C、1L0.1mo1•L-1的氨水中,一水合氨是弱电解质存在电离平衡,含有OH-小于0.1NA个,故C错误;
D、以石墨为电极电解氯化铜溶液时,若阳极上失去电子NA个物质的量为1mol,2Cl--2e-=Cl2↑,阴极得到电子生成铜,Cu2++2e-=Cu,生成铜0.5mol,质量为32g,故D正确;
故选D.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查了阿伏伽德罗常数的应用,主要是气体摩尔体积条件应用,弱电解质判断,电极原理的计算判断,题目难度中等.1年前查看全部
- (2013•延边州模拟)下列陈述Ⅰ、Ⅱ正确并有因果关系的是( )
(2013•延边州模拟)下列陈述Ⅰ、Ⅱ正确并有因果关系的是( )
A.乙酸具有酸性,乙醛中含有乙酸杂质,可加入氢氧化钠溶液洗涤、分液
B.硫酸和氢氧化钠分别属于酸和碱,电解稀硫酸或氢氧化钠溶液的产物不同
C.Fe3+有氧化性,FeCl3溶液可用于回收旧电路板中的铜
D.浓硫酸具有吸水性,浓硫酸可用于干燥氨气 没心没飞1年前1
没心没飞1年前1 -
 dsrt7 共回答了25个问题
dsrt7 共回答了25个问题 |采纳率88%解题思路:A.乙酸钠和乙醛互溶,不能用分液的方法分离;
B.用惰性电极电解稀硫酸或氢氧化钠溶液,阴极和阳极上的产物都分别为H2和O2,电解的实质都是电解水;
C.Fe3+具有氧化性,能将铜氧化为为铜离子;
D.浓硫酸具有吸水性,可用于干燥气体,但不能干燥氨气,因浓硫酸和氨气反应生成硫酸铵.A.乙酸与氢氧化钠溶液反应生成难挥发的乙酸钠,根据乙醛的沸点比较低,然后蒸馏即可分离,陈述Ⅱ错误,故A错误;
B.硫酸和氢氧化钠分别属于酸和碱,用惰性电极电解稀硫酸或氢氧化钠溶液,阳极:4OH--4e-=O2↑+H2O 阴极:2H2O+2e-=H2↑+2OH-,阴极和阳极上的产物都分别为H2和O2,电解的实质都是电解水,陈述Ⅱ错误,故B错误;
C.Fe3+具有氧化性,能将铜氧化为为铜离子,2Fe3++Cu=2Fe2++Cu2+,所以FeCl3溶液可用于回收废旧电路板中的铜,Ⅰ、Ⅱ正确有因果关系,故C正确;
D.浓硫酸具有吸水性,能用浓硫酸干燥的气体必须不与浓硫酸反应,能与浓硫酸反应的气体有:氨气、硫化氢、溴化氢、碘化氢等,浓硫酸和氨气反应生成硫酸铵,陈述Ⅱ错误,故D错误;
故选C.点评:
本题考点: 浓硫酸的性质;铁盐和亚铁盐的相互转变.
考点点评: 本题考查了物质的性质与应用,同时要区分事物间的因果关系,熟练掌握基础是解题关键,题目难度不大.1年前查看全部
- (2012•延边州)一块正方形的丝绸布料,既可以做成边长是18厘米的小方手绢,也可以都做成边长是27厘米的大方手绢,都没
(2012•延边州)一块正方形的丝绸布料,既可以做成边长是18厘米的小方手绢,也可以都做成边长是27厘米的大方手绢,都没有剩余.这块正方形丝绸布料的边长至少是______厘米.
 wanglyiyong1年前1
wanglyiyong1年前1 -
 dicky131 共回答了23个问题
dicky131 共回答了23个问题 |采纳率82.6%解题思路:根据题意,要求这块正方形丝绸布料的边长至少长多少厘米,也就是求18和27的最小公倍数,可用分解质因数的方法进行计算即可得到答案.18=2×3×3,
27=3×3×3,
18和27的最小公倍数为:2×3×3×3=54;
答:这块正方形丝绸布料的边长至少是54厘米.
故答案为:54.点评:
本题考点: 求几个数的最小公倍数的方法.
考点点评: 解答此题的关键是理解求这块正方形丝绸布料的边长至少是多少,就是求18和27的最小公倍数.1年前查看全部
- (2013•延边州)求未知数X. 5x-15=75 39:3=x:13 0.5x+1.5x=4.6.
 blueboyggh1年前1
blueboyggh1年前1 -
 周展华 共回答了17个问题
周展华 共回答了17个问题 |采纳率94.1%解题思路:①先利用等式的性质方程两边同时加上15,再同时除以5即可求解;
②根据比例基本性质,两内项之积等于两外项之积,化简方程可得3x=507,再依据等式的性质,方程两边同时除以13即可求解.
③先把方程的左边计算出来得:2x=4.6,再利用等式的性质,两边同时除以2即可求解;①5x-15=75,
5x-15+15=75+15,
5x=90,
5x÷5=90÷5,
x=18;
②39:3=x:13,
3x=507,
3x÷3=507÷3,
x=169;
③0.5x+1.5x=4.6,
2x=4.6,
2x÷2=4.6÷2,
x=2.3.点评:
本题考点: 方程的解和解方程;解比例.
考点点评: 本题考查了解方程,注意解题步骤的书写要规范,等式的性质和比例的基本性质是解方程的依据,应理解并能灵活应用.1年前查看全部
- (五上1五•延边州)甲、乙、丙一个工程队完成某项工程的天数和日工资如下表:
(五上1五•延边州)甲、乙、丙一个工程队完成某项工程的天数和日工资如下表:
请w选择两个工程队合做这项工程,如果工期很紧,想尽快完工,应选择哪两个队合做?几天可以完工?完工后两队各得多十工资?工程队 单独完成工程所用天数 每日总工资(万元) 甲 1上 18 乙 15 1五 丙 五上 8  gg小昕1年前1
gg小昕1年前1 -
 Ann_ 共回答了15个问题
Ann_ 共回答了15个问题 |采纳率93.3%因为
1
10 >
1
1少 >
1
20 ,所以选甲乙两队合做.
1÷(
1
10 +
1
1少 ),
=1÷
1
6 ,
=6(天);
1l×6=10l(万元),
12×6=72(万元);
答:应选甲乙两队合做,6天可以完工,完工后甲队可得工资10l万元,乙队可得工资72万元.1年前查看全部
- (2012•延边州)直接写出得数 900-199= 237+163= [1/4]+[1/5]= 2-[3/4]= 3+0
(2012•延边州)直接写出得数
900-199= 237+163= [1/4]+[1/5]= 2-[3/4]= 3+0.3= 0.39×10= 8.4÷4.2= 0.32= 25×4÷5= 1-[4/9]+[5/9]=  sheng_bbs1年前1
sheng_bbs1年前1 -
 我sshh不爱我 共回答了20个问题
我sshh不爱我 共回答了20个问题 |采纳率90%解题思路:900-199根据凑整法简算;
0.32=0.3×0.3,由此求解;
25×4÷5,1-[4/9]+[5/9]按照从左到右的顺序计算.
其它题目根据运算法则直接求解.900-199=701, 237+163=400, [1/4]+[1/5]=[9/20], 2-[3/4]=1[1/4], 3+0.3=3.3,
0.39×10=3.9, 8.4÷4.2=2, 0.32=0.09, 25×4÷5=20, 1-[4/9]+[5/9]=[10/9].点评:
本题考点: 整数的加法和减法;分数的加法和减法;小数的加法和减法;小数乘法;小数除法;有理数的乘方.
考点点评: 口算题目要求快速准确,能运用简算方法的要简算.1年前查看全部
- (2013•延边州)在0.27、27%、[1/4]、0.29和[1/5]这五个数中,最大的数是______,最小的数是[
(2013•延边州)在0.27、27%、[1/4]、0.29和[1/5]这五个数中,最大的数是______,最小的数是[1/5][1/5],其中相等的数是______和______.
 kof_ljx1年前1
kof_ljx1年前1 -
 donerlee 共回答了18个问题
donerlee 共回答了18个问题 |采纳率83.3%解题思路:在这五个数中有小数、有百分数、有分数要相比较这几个数的大小,都化成小数,再根据小数的大小比较方法进行比较.小数的比较方法:先看他们的整数部分,整数部分大的那个数就大;整数部分相同,十分位上的数大的那个数就大;十分位上的数相同,百分位上的数大的那个数就大…以此类推.27%=0.27,[1/4]=0.25,[1/5]=0.2,
因此,[1/5]<[1/4]<0.27=27%<0.29;
所以这五个数中最大的是0.29,最小的是[1/5],其中相等的是0.27和27%;
故答案为:0.29,[1/5],0.27,27%.点评:
本题考点: 小数大小的比较;小数、分数和百分数之间的关系及其转化.
考点点评: 本题主要是考查小数、分数、百分数的大小比较,应用的知识是小数、分数、百分数的互化.小数、分数、百分数的大小比较一般先化成小数或分数或百分数再比较.1年前查看全部
- (2013•延边州模拟)已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A的单质在常温下呈气态,
(2013•延边州模拟)已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.常温常压下,E单质是淡黄色固体,常在火山口附近沉积.
(1)B、C两种元素的元素符号:B:______;C:______.D在元素周期表中的位置为______.
(2)A2E的燃烧热△H=-a kJ•mol-1,写出A2E燃烧反应的热化学方程式:H2S(g)+[3/2]O2(g)=SO2(g)+H2O(l)△H=-akJ•mol-1H2S(g)+[3/2]O2(g)=SO2(g)+H2O(l)△H=-akJ•mol-1.
(3)CA的电子式为______;CA与水反应放出气体的化学方程式为______.
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同.回答问题:
①向丙溶液中缓慢滴加过量的乙溶液过程中发生反应的离子方程式______,______.
②向甲溶液中缓慢滴加等物质的量的丙溶液后,所得溶液中离子浓度由大到小的顺序为______.
(5)用D单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:______;由R生成Q的化学方程式:2Al(OH)3
Al2O3+3H2O△ .2Al(OH)3.
Al2O3+3H2O△ . wangyn_happy1年前1
wangyn_happy1年前1 -
 FRGG21 共回答了17个问题
FRGG21 共回答了17个问题 |采纳率88.2%解题思路:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,原子序数大于碳元素,则C为Na元素;元素D的合金是日常生活中常用的金属材料,处于第三周期,则D为Al元素;元素A的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素;常温常压下,E单质是淡黄色固体,常在火山口附近沉积,E为S元素,据此解答.A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,原子序数大于碳元素,则C为Na元素;元素D的合金是日常生活中常用的金属材料,处于第三周期,则D为Al元素;元素A的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素;常温常压下,E单质是淡黄色固体,常在火山口附近沉积,E为S元素,
(1)由上述分析可知,B为C元素、C为Na元素;D为Al元素,处于第三周期第ⅢA族,故答案为:C;Na;第三周期第ⅢA族;
(2)H2S的燃烧热△H=-a kJ•mol-1,则H2S燃烧反应的热化学方程式为:H2S (g)+[3/2] O2(g)=SO2 (g)+H2O (l)△H=-a kJ•mol-1,
故答案为:H2S (g)+[3/2] O2(g)=SO2 (g)+H2O (l)△H=-a kJ•mol-1;
(3)NaH属于离子化合物,其电子式为 ;NaH与水发生水解反应,生成NaOH与氢气,化学方程式为NaH+H2O=NaOH+H2↑,
;NaH与水发生水解反应,生成NaOH与氢气,化学方程式为NaH+H2O=NaOH+H2↑,
故答案为: ;NaH+H2O=NaOH+H2↑;
;NaH+H2O=NaOH+H2↑;
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同,则甲为Na2CO3,乙为NaAlO2,丙为NaHSO4,
①向NaHSO4溶液中缓慢滴加过量的NaAlO2溶液,过程中发生反应的离子方程式:4H++AlO2-═Al3++2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:4H++AlO2-═Al3++2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓;
②向Na2CO3溶液中缓慢滴加等物质的量的NaHSO4溶液,二者恰好反应,所得溶液为NaHCO3、Na2SO4等浓度混合溶液,HCO3-水解大于其电离程度,溶液呈碱性,故C(OH-)>C(H+),且水也电离产生H+,溶液中C(H+)>C(CO32-),水解程度比较小,故溶液中C(Na+)>C(SO42-)>C(HCO3-)>C(OH-)>C(H+)>C(CO32-),
故答案为:C(Na+)>C(SO42-)>C(HCO3-)>C(OH-)>C(H+)>C(CO32-);
(5)用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,阳极发生反应:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+CO2↑,生成难溶物R为Al(OH)3,Al(OH)3受热分解生成化合物氧化铝,反应方程式为:2Al(OH)3
△
.
Al2O3+3H2O,
故答案为:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+CO2↑;2Al(OH)3
△
.
Al2O3+3H2O.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构性质位置关系应用综合应用,涉及元素化合物推断、热化学方程式、电子式、离子浓度比较、原电池等,题目综合性较大,推断元素是解题关键,(5)中阳极反应式可以一步书写,难度中等,注意对基础知识的全面掌握.1年前查看全部
- (2012•延边州模拟)下列有关化学用语表示正确的是( )
(2012•延边州模拟)下列有关化学用语表示正确的是( )
A.硫的原子结构示意图: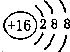
B.CS2分子的球棍模型:
C.醛基的电子式: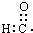
D.甲酸苯甲酯结构简式: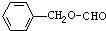
 艰难险阻1年前1
艰难险阻1年前1 -
 hao_nan_ren001 共回答了19个问题
hao_nan_ren001 共回答了19个问题 |采纳率78.9%解题思路:A.S为16号元素,原子的最外层为6个电子;
B.CS2分子为直线形;
C.醛基中氧原子的周围有8个电子;
D.甲酸苯甲酯结构简式符合书写要求.A.S为16号元素,原子的最外层为6个电子,其结构示意图为:
 ,故A错误;
,故A错误;
B.CS2分子的结构式为S=C=S,空间构型为直线形,故B错误;
C.醛基中氧原子的周围有8个电子,醛基的电子式为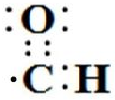 ,故C错误;
,故C错误;
D.甲酸苯甲酯结构简式符合书写要求,其结构简式: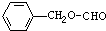 ,故D正确;
,故D正确;
故选D.点评:
本题考点: 电子式、化学式或化学符号及名称的综合.
考点点评: 本题考查化学用语,涉及电子式、原子结构示意图、结构简式、球棍模型等,注意化学用语使用的规范性即可解答,题目难度不大.1年前查看全部
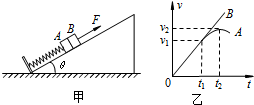
- (2012•延边州模拟)如图所示,公路上一辆汽车正以v1=10m/s的速度匀速行驶,汽车行至A点时,一人为了搭车,从距公
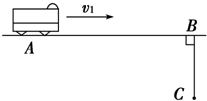 (2012•延边州模拟)如图所示,公路上一辆汽车正以v1=10m/s的速度匀速行驶,汽车行至A点时,一人为了搭车,从距公路30m的C处由静止开始正对着公路跑去,假设人先做匀加速运动,达到最大速度v2=6m/s时再做匀减速运动,司机见状途中刹车,汽车做匀减速运动,结果车和人同时到达B点停下. 已知XAB=80m,问:汽车在距A多远处开始刹车?刹车后汽车的加速度有多大?
(2012•延边州模拟)如图所示,公路上一辆汽车正以v1=10m/s的速度匀速行驶,汽车行至A点时,一人为了搭车,从距公路30m的C处由静止开始正对着公路跑去,假设人先做匀加速运动,达到最大速度v2=6m/s时再做匀减速运动,司机见状途中刹车,汽车做匀减速运动,结果车和人同时到达B点停下. 已知XAB=80m,问:汽车在距A多远处开始刹车?刹车后汽车的加速度有多大?  zba_07261年前1
zba_07261年前1 -
 夜斑斓 共回答了10个问题
夜斑斓 共回答了10个问题 |采纳率90%解题思路:应用平均速度公式、匀变速直线运动的位移公式与速度位移公式求出,汽车的位移、加速度,然后答题.人从C到B用时为t,平均速度:
.
v2=
v2
2=[6/2]=3m/s,
由平均速度公式得:sBC=
.
v2t,代入数据解得:t=[30/3]=10s,
这一时间内汽车由A开始先匀速后减速运动,最终停在B点,设车从A经时间t1开始刹车.
汽车的位移:XAB=v1t1+(10-t1)×
v1
2,代入数据解得:t1=6 s,
所以车匀速运动的距离为:x1=v1t1=10×6=60m,
加速度:a=
v21
2(x−x1),代入数据解得:a=2.5m/s2;
答:汽车在距A60m处开始刹车,刹车后汽车的加速度为2.5m/s2.点评:
本题考点: 匀变速直线运动规律的综合运用.
考点点评: 本题考查了求汽车位移、加速度问题,分析清楚汽车的运动过程是正确解题的前提与关键,应用匀变速运动规律即可正确解题.1年前查看全部
- (2012•延边州)求图中阴影部分的面积.(单位:厘米)
 烧猪仔要gg1年前1
烧猪仔要gg1年前1 -
 Lhyrain 共回答了19个问题
Lhyrain 共回答了19个问题 |采纳率89.5%解题思路:根据图所示,可把组合图形分成一个直角梯形和一个[1/4]圆,阴影部分的面积等于梯形的面积减去[1/4]圆的面积再加上[1/4]圆的面积减去三角形面积的差,列式解答即可得到答案.[(5+8+5)×5÷2-[1/4]×3.14×52]+([1/4]×3.14×52-5×5÷2),
=[18×5÷2-0.785×25]+(0.785×25-25÷2),
=[90÷2-19.625]+(19.625-12.5),
=[45-19.625]+7.125,
=25.375+7.125,
=32.5(平方厘米);
答:阴影部分的面积为32.5平方厘米.点评:
本题考点: 组合图形的面积.
考点点评: 此题主要考查的是梯形的面积公式(上底+下底)×高÷2、三角形的面积公式底×高÷2和圆的面积公式S=πr2的应用.1年前查看全部
- (2012•延边州模拟)如图甲所示,放在光滑水平面上的木块在两个水平力F1与F2的共同作用下静止不动.现保持F1不变,F
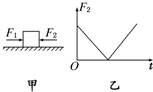 (2012•延边州模拟)如图甲所示,放在光滑水平面上的木块在两个水平力F1与F2的共同作用下静止不动.现保持F1不变,F2大小变化如图乙所示,则在此过程中,能正确描述木块运动情况的速度图象是图中的( )
(2012•延边州模拟)如图甲所示,放在光滑水平面上的木块在两个水平力F1与F2的共同作用下静止不动.现保持F1不变,F2大小变化如图乙所示,则在此过程中,能正确描述木块运动情况的速度图象是图中的( )
A.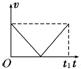
B.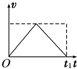
C.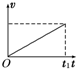
D.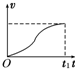
 精忠_报ff1年前1
精忠_报ff1年前1 -
 zoomoon007 共回答了20个问题
zoomoon007 共回答了20个问题 |采纳率85%解题思路:先求出合力的变化情况,然后求出加速度的变化情况,最后在分析速度的变化情况.由于木块受到两个水平力F1与F2的作用而静止不动,故两个推力相等
假设F1=F2=F
力F2逐渐减小到零再逐渐恢复到原来的大小的过程中,合力先增大到F,再减小到零,故加速度也是先增大再减小,物体先做加速度不断变大的加速运动,再做加速度不断变小的加速运动,合力变为零后做匀速直线运动,由于位移时间图象的切线的斜率表示速度,故D正确;
故选:D.点评:
本题考点: 牛顿第二定律;匀变速直线运动的图像.
考点点评: 本题关键求出合力后,确定加速度的变化情况,最后再确定物体的运动情况,并画出各种图象.1年前查看全部
- (2013•延边州模拟)海洋是一座巨大的宝藏,海水中蕴含80多种元素.氯碱工业和金属镁的制备原料都来自于海水.
(2013•延边州模拟)海洋是一座巨大的宝藏,海水中蕴含80多种元素.氯碱工业和金属镁的制备原料都来自于海水.
Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示).
(1)写出两电极的反应式:阳极______;阴极______.
(2)石棉隔膜的作用是______.
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高.20世纪80年代起,隔膜法电解工艺逐渐被离子膜电解技术取代.
(1)离子膜电解槽(如图乙所示)中⑥、⑦分别是______、______.
(2)已知一个电子的电量是1.602×10-19C,在离子膜电解饱和食盐水时电路中通过电子1.929×105C,则产生NaOH______g.
Ⅲ.如图丙是工业上生产镁的流程.
(1)写出下列反应的化学方程式:
①沉淀池中:______;
②电解:MgCl2(熔融)
Mg+Cl2↑电解 .MgCl2(熔融).
Mg+Cl2↑电解 .
(2)整个生产流程中,循环使用的物质是______.
(3)简述加热氯化镁的水合晶体使之脱水转化为无水氯化镁的操作过程:______.
 mokey88261年前1
mokey88261年前1 -
 whp不哭 共回答了21个问题
whp不哭 共回答了21个问题 |采纳率90.5%解题思路:Ⅰ.(1)用惰性电极电解氯化钠溶液,阳极是氯离子放电生成氯气,阴极是氢离子放电生成氢气;
(2)Cl2和NaOH反应生成氯化钠、次氯酸钠和水,石棉隔膜的作用阻止气体通过;
Ⅱ.(1)离子膜电解槽只允许阳离子和水分子通过;⑥为氢氧化钠,⑦为钠离子;
(2)依据电极反应和电子守恒分析计算得到;
Ⅲ.(1)①在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,得到氢氧化镁沉淀,发生复分解反应;
②电解熔融氯化镁,为氧化还原反应,生成镁和氯气;
(2)根据流程图可以看出,氯气可以循环利用;
(3)氯化镁中的镁离子易水解,在酸性环境下可以抑制水解.Ⅰ.(1)用惰性电极电解饱和食盐时,阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极氯离子失去电子,发生氧化反应,发生的方程式为:2Cl--2e-═Cl2↑,阴极是氢离子放电生成氢气,阴极发生的方程式为:2H++2e-═H2↑,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
(2)Cl2和NaOH溶液接触,发生反应2NaOH+Cl2═NaClO+NaCl+H2O,防止Cl2和NaOH反应,石棉隔膜的作用是阻止气体通过,
故答案为:阻止气体通过;
Ⅱ.(1)电解饱和食盐水,电解槽离子膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阴极是氢离子放电生成氢气,同时生成氢氧化钠,所以⑥为氢氧化钠,⑦为Na+,
故答案为:NaOH溶液;Na+;
(2)已知一个电子的电量是1.602×10-19C,若在离子膜电解饱和食盐水时通过电量1.929×105C,电子数=
1.929×105C
1.602×10−19C=1.204×1024,
1.204×1024
6.02×1023=2mol,电子物质的量为2mol,阴极电极反应为:2H++2e-=H2↑,依据化学方程式和电子守恒分析计算2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,转移电子2mol生成氢氧化钠2mol,质量为80g,
故答案为:80;
Ⅲ.(1)①把海水中的氯化镁转化成氢氧化镁沉淀,是往海水中加熟石灰,氯化镁和石灰乳的成分氢氧化钙反应MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,由于氢氧化镁不溶于水,因此可以采用过滤的方法使沉淀分离出来,因石灰乳是悬浊物,所以氢氧化镁沉淀无需标沉淀,
故答案为:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2;
②无水氯化镁在熔融状态下,通过电解得到金属镁,化学方程式为:MgCl2(熔融)
电解
.
Mg+Cl2↑,
故答案为:MgCl2(熔融)
电解
.
Mg+Cl2↑;
(2)根据流程图可以看出,氯气可以循环利用,故答案为:氯气(或Cl2);
(3)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水汽,得到无水MgCl2,
故答案为:为了防止氯化镁水解,要在氯化氢气体的氛围中进行加热.点评:
本题考点: 氯碱工业.
考点点评: 本题主要考查了氯碱工业和金属镁的制备,掌握电解饱和食盐水的反应原理和海水中镁的提取方法是解答的关键,题目难度中等.1年前查看全部
- (2013•延边州)下面各题,怎样算简便就怎样计算 51×101= [3/7]×[2/3]×[7/12]= 44×1.6
(2013•延边州)下面各题,怎样算简便就怎样计算
51×101= [3/7]×[2/3]×[7/12]= 44×1.6-0.16×40= 5.04-2.72-0.28= [1/8]÷[3/4]×[6/11]= 165×[4/7]+165×[3/7]=  bs3441年前1
bs3441年前1 -
 tuj3026 共回答了24个问题
tuj3026 共回答了24个问题 |采纳率87.5%解题思路:(1)运用乘法的分配律进行简算,
(2)直接约分进行计算即可,
(3)运用乘法的分配律,
(4)运用减法的性质进行简算,
(5)把除法化成乘法,直接约分计算即可,
(6)运用乘法的分配律进行简算.(1)51×101,
=51×(100+1),
=51×100+51×1,
=5100+51,
=5151;
(2)[3/7]×[2/3]×[7/12],
=[1/6];
(3)44×1.6-0.16×40,
=44×1.6-1.6×4,
=(44-4)×1.6,
=40×1.6,
=64;
(4)5.04-2.72-0.28,
=5.04-(2.72+0.28),
=5.04-3,
=2.04;
(5)[1/8]÷[3/4]×[6/11],
=[1/8]×[4/3]×[6/11],
=[1/11];
(6)165×[4/7]+165×[3/7],
=165×([4/7]+[3/7]),
=165×1,
=165.点评:
本题考点: 整数的乘法及应用;分数的四则混合运算;小数四则混合运算.
考点点评: 此题考查四则混合运算,要仔细观察算式的特点,灵活运用一些定律进行简便计算.1年前查看全部
- (2012•延边州)某地冬天中午的气温是3℃,傍晚的气温比中午下降了6℃,傍晚的气温是( )
(2012•延边州)某地冬天中午的气温是3℃,傍晚的气温比中午下降了6℃,傍晚的气温是( )
A.-3℃
B.3℃
C.9℃ shengwumanyou1年前1
shengwumanyou1年前1 -
 wdvvvvvv 共回答了21个问题
wdvvvvvv 共回答了21个问题 |采纳率90.5%解题思路:根据题意列出算式,然后根据有理数的减法运算进行计算即可求解.根据题意得,3-6=3+(-6)=-3℃.
故选:A.点评:
本题考点: 正、负数的运算.
考点点评: 本题主要考查了有理数的减法,熟记减去一个数等于加上这个数的相反数是解题的关键.1年前查看全部
- (2012•延边州)脱式计算,能简算的要简算. [5/11]×[7/9]+[7/9]×[6/11] 51×101 10.
(2012•延边州)脱式计算,能简算的要简算.
[5/11]×[7/9]+[7/9]×[6/11] 51×101 10.25-3.75-6.25+7.75 35×12+350÷70 3+0.7÷[([5/6]-[1/4])×24] [1/3]÷[6/5]×[9/10].  感恩如此简单1年前1
感恩如此简单1年前1 -
 白垩纪原版 共回答了18个问题
白垩纪原版 共回答了18个问题 |采纳率83.3%解题思路:(1)根据乘法分配律进行计算;
(2)101=100+1,再根据乘法分配律进行计算;
(3)根据加法交换律和结合律以及减法的性质进行计算;
(4)先算乘法和除法,再算加法;
(5)中括号里面的根据乘法分配律进行计算,再算除法,最后算加法;
(6)先算除法,再算乘法.(1)[5/11]×[7/9]+[7/9]×[6/11],
=([5/11]+[6/11])×[7/9],
=1×[7/9],
=[7/9];
(2)51×101,
=51×(100+1),
=51×100+51×1,
=5100+51,
=5151;
(3)10.25-3.75-6.25+7.75,
=(10.25+7.75)-(3.75+6.25),
=18-10,
=8;
(4)35×12+350÷70,
=420+5,
=425;
(5)3+0.7÷[([5/6]-[1/4])×24],
=3+0.7÷[[5/6]×24-[1/4]×24],
=3+0.7÷[20-6],
=3+0.7÷14,
=3+0.05,
=3.05;
(6)[1/3]÷[6/5]×[9/10],
=[5/18]×[9/10],
=[1/4].点评:
本题考点: 分数的四则混合运算;整数四则混合运算;运算定律与简便运算;小数四则混合运算;整数、分数、小数、百分数四则混合运算.
考点点评: 此题主要考查分数、整数、小数的四则混合运算的运算顺序和应用运算定律进行简便计算.1年前查看全部
- (201多•延边州一模)某湿地生态系统主要由滩涂、藻类、浮游动物和红树林等部分组成,某生物兴趣小组对该生态系统进行了调研
 (201多•延边州一模)某湿地生态系统主要由滩涂、藻类、浮游动物和红树林等部分组成,某生物兴趣小组对该生态系统进行了调研,请回答相关问题.
(201多•延边州一模)某湿地生态系统主要由滩涂、藻类、浮游动物和红树林等部分组成,某生物兴趣小组对该生态系统进行了调研,请回答相关问题.
(1)在对滩涂沙滩中的小动物类群丰富度进行研究时,常用______取样的方法进行采集调查.采集到的所有小动物______(填“能”或“不能”)构成沙滩中的一个群落.
(2)该生态系统中的植物在垂直方向1具有明显的分层现象,决定这种分层现象的主要非生物因素是______.
(个)兴趣小组根据调查到的生物类群绘制出碳循环0解,如0.
①碳在该湿地生态系统中的生物群落内部以______的形式进行传递的,在生物群落与无机环境之间的循环主要以______的形式进行的.从生态系统的组成成分看,C、多分别代表______,______.
②写出0中存在的食物链______.
(多)根据调查统计,湿地中第二营养级的同化量为个.1×109J/hm2•a,分解者分解量为6.6×108J/hm2•a,呼吸量为1.b个×109J/hm2•a,未利用能量为多.6×108J/hm2•a,那么该营养级生物用于生长发育和繁殖的能量为______J/hm2•a,能量在第二、三营养级之间传递效率为______%(小数点后保留两位数). 红茶一杯万里1年前1
红茶一杯万里1年前1 -
 七月七日寒流 共回答了20个问题
七月七日寒流 共回答了20个问题 |采纳率80%解题思路:图中C、D分别代表分解者,生产者.图中存在的食物链D→F→E→B,同化量中的能量流向:一是流向下一营养级;二是供给呼吸作用.生态系统的能量流动:生物系统中能量的输入、传递、转化和散失的过程,输入生态系统总能量是生产者固定的太阳能,传递沿食物链、食物网,散失通过呼吸作用以热能形式散失的.
特点:单向的、逐级递减的(中底层为第一营养级,生产者能量最多,其次为初级消费者,能量金字塔不可倒置,数量金字塔可倒置).能量传递效率为10%-20%,据此解答.(六)在对小动物类群丰富度进行研究时,常用取样器取样的方法进行采集调查.在一定生活环境中的所有生物种群的总和叫做生物群落,故采集到的所有小动物不能构成沙滩中的一个群落.(3)光照使植物在垂直方向上具有明显的分层现象.
(右)①碳在该湿地生态系统中的生物群落内部以有机物的形式进行传递的,在生物群落与无机环境之间的循环主要以CO3的形式进行的.从生态系统的组成成分看,C、D分别代表分解者,生产者.②由D代表生产者,以及箭头的方向可得:图中存在的食物链D→F→h→B.
(y)根据调查统计,湿地中第二营养级的同化量为右.六×六f9J/hm3•a,分解者分解量为0.0×六f8J/hm3•a,呼吸量为六.5右×六f9J/hm3•a,未利用能量为y.0×六f8J/hm3•a,那么该营养级生物用于生长发育和繁殖的能量为右.六×六f9-六.5右×六f9=六.57×六f9J/hm3•a,能量在第二、九营养级之间传递效率为(右.六×六f9-0.0×六f8-六.5右×六f9-y.0×六f8)÷右.六×六f9=六y.5%.
故答案为:
(六)取样器不能
(3)光照
(右)①有机物CO3分解者生产者②D→F→h→B
(y)六.57×六f9六y.5点评:
本题考点: 生态系统的结构;群落的结构特征;生态系统的功能.
考点点评: 本题结合食物网,考查生态系统的相关知识,意在考查考生分析题图获取有效信息的能力;能理解所学知识要点,把握知识间内在联系的能力;能运用所学知识与观点,通过比较、分析与综合等方法对某些生物学问题进行解释、推理,做出合理的判断或得出正确的结论.1年前查看全部
- (2012•延边州)已知B点在A点东偏北40°的方向上,也可以说B点在A点______偏东______方向上.
 贪吃小老虎1年前1
贪吃小老虎1年前1 -
 收沱费 共回答了20个问题
收沱费 共回答了20个问题 |采纳率95%解题思路:因为东和北之间是90°,所以B点在A点东偏北40°的方向上,也可以说B点在A点北偏东50°的方向上,据此解答即可.据分析可知:B点在A点东偏北40°的方向上,也可以说B点在A点北偏东50°的方向上;
故答案为:北,50°.点评:
本题考点: 根据方向和距离确定物体的位置.
考点点评: 此题主要考查地图上的方向辨别方法.1年前查看全部
- (2014•延边州模拟)已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )
 (2014•延边州模拟)已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )
(2014•延边州模拟)已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )
A.甲为C,X为O2
B.甲为SO2,X为NaOH溶液
C.甲为Fe,X为Cl2
D.甲为AlCl3,X为NaOH溶液 jadegarden231年前1
jadegarden231年前1 -
 richard0821 共回答了13个问题
richard0821 共回答了13个问题 |采纳率84.6%解题思路:A.C能发生连续氧化反应,且C与CO2可反应生成CO;
B.甲为SO2,X为NaOH溶液,乙为NaHSO3,丙为Na2SO3;
C.甲为Fe,X为Cl2,乙为FeCl3,乙与X不反应;
D.甲为AlCl3,X为NaOH溶液,乙为Al(OH)3,丙为NaAlO2.A.甲为C,X为O2,C
O2
CO
O2
CO2,CO2
C
C,符合上述转化,故A正确;
B.甲为SO2,X为NaOH溶液,SO2
NaOH
NaHSO3
NaOH
Na2SO3,Na2SO3
SO2
NaHSO3,符合上述转化,故B正确
C.甲为Fe,X为Cl2,乙为FeCl3,乙与X不反应,不符合上述转化,故C错误;
D.甲为AlCl3,X为NaOH溶液,AlCl3
NaOH
Al(OH)3
NaOH
NaAlO2,NaAlO2
AlCl3
Al(OH)3,故D正确;
故选C.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物的推断,侧重元素化合物性质的考查,注意把握物质的性质及转化中发生的反应为解答的关键,综合性较强,题目难度不大.1年前查看全部
- (2012•延边州)假如3a=4b(a≠0,b≠0),那么 a:b=3:4.______.(判断对错)
 fantasia1年前1
fantasia1年前1 -
 gonz 共回答了19个问题
gonz 共回答了19个问题 |采纳率89.5%解题思路:依据比例的基本性质,即两内项之积等于两外项之积,即可写出这个比例式,从而作出正确判断.因为3a=4b,
则a:b=4:3;
故答案为:错误.点评:
本题考点: 比例的意义和基本性质.
考点点评: 此题主要考查比例的基本性质的灵活应用.1年前查看全部
- (2013•延边州模拟)现将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为
(2013•延边州模拟)现将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为( )
A.1.0g
B.2.0g
C.2.5g
D.3.5g 孙聪1年前1
孙聪1年前1 -
 hopebird 共回答了19个问题
hopebird 共回答了19个问题 |采纳率84.2%解题思路:生成的气体为二氧化硫与氢气,混合气体11.2L(标准状况)物质的量为0.5mol,根据电子转移守恒计算参加反应的Zn的物质的量,再根据m=nM计算参加反应的Zn的质量,据此计算过剩的锌粉的质量.锌粉与少量浓硫酸在加热条件下充分反应,生成的气体为二氧化硫与氢气,混合气体11.2L(标准状况)物质的量为[11.2L/22.4L/mol]=0.5mol,每生成1molSO2,金属提供2mol电子,每生成1molH2,金属提供2mol电子,所以生成0.5mol的二氧化硫与氢气金属提供的电子为[0.5mol/1mol]×2mol=1mol,故参加反应Zn的物质的量为[1mol/2]=0.5mol,出参加反应Zn的质量为0.5mol×65g/mol=32.5g,故剩余的锌粉的质量为35g-32.5g=2.5g.
故答案为:C.点评:
本题考点: 化学方程式的有关计算.
考点点评: 考查学生根据方程式的计算、守恒计算等,难度不大,本题采取电子转移守恒计算,简化计算,注意守恒思想的运用.可以判断混合气体中氢气、二氧化硫的物质的量,在根据方程式计算,容易理解,但步骤繁琐.1年前查看全部
- (2012•延边州)两个质数的和是45,这两个质数是______和______.
 闲云mm鹤1年前1
闲云mm鹤1年前1 -
 syqhlw 共回答了17个问题
syqhlw 共回答了17个问题 |采纳率94.1%解题思路:两个质数的和是45,根据数和的奇偶性可知,奇数+奇数=偶数,偶数+奇数=奇数,由于除了2之外所有的质数都为奇数,而45为奇数,所以这两个质数中一定有一个为偶数,即为最小的质数2,则一个为45-2=43.由于45为奇数,
根据数和的奇偶性可知,
这两个质数中一定有一个为偶数,即为最小的质数2,
则一个为45-2=43.
故答案为:43,2.点评:
本题考点: 合数与质数.
考点点评: 本题要在了解100以内的质数及“奇数+奇数=偶数,偶数+奇数=奇数”的基础上完成.1年前查看全部
- (2013•延边州)直接写得数. 0.27+2.73= 0.25÷2.5%= 10-0.01= 0.38-0.19= 1
(2013•延边州)直接写得数.
0.27+2.73= 0.25÷2.5%= 10-0.01= 0.38-0.19= 1-50%= [9/12]×[3/9]= [5/9]÷[5/6]= [1/5]-[1/8]+[1/8]-[1/5]= [5/8]-[1/4]= [98/99]×([5/4]-25%)=  香米8081年前1
香米8081年前1 -
 喷火小八路 共回答了18个问题
喷火小八路 共回答了18个问题 |采纳率94.4%解题思路:根据小数、分数加减乘除的计算方法进行计算;
[1/5]-[1/8]+[1/8]-[1/5]根据加法交换律和结合律进行计算.0.27+2.73=3, 0.25÷2.5%=10, 10-0.01=9.99, 0.38-0.19=0.19, 1-50%=0.5,
[9/12]×[3/9]=[1/4], [5/9]÷[5/6]=[2/3], [1/5]-[1/8]+[1/8]-[1/5]=0, [5/8]-[1/4]=[3/8], [98/99]×([5/4]-25%)=[98/99].点评:
本题考点: 小数的加法和减法;分数乘法;分数除法.
考点点评: 口算时,注意运算符号和数据,然后再进一步计算.1年前查看全部
- (2012•延边州)把两个棱长是1厘米的正方体,拼成一个长方体,表面积减少了( )平方厘米.
(2012•延边州)把两个棱长是1厘米的正方体,拼成一个长方体,表面积减少了( )平方厘米.
A.4
B.2
C.8 冷千秋1年前1
冷千秋1年前1 -
 敬旋 共回答了19个问题
敬旋 共回答了19个问题 |采纳率89.5%解题思路:拼成一个最小的长方体,是用了2个棱长为1厘米的小正方体,拼组后的表面积减少了两个小正方体的面的面积.表面积减少:1×1×2=2(平方厘米),
故选:B.点评:
本题考点: 简单的立方体切拼问题.
考点点评: 最小的长方体是由棱长为1厘米的2个小正方体拼成的.1年前查看全部
- (2012•延边州模拟)将32.0g铜与100mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的
(2012•延边州模拟)将32.0g铜与100mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.待产生的气体全部释放后,向溶液中加入100mL、a mol•L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为( )
A.1.5 mol•L-1
B.15 mol•L-1
C.(a+5)mol•L-1
D.无法计算 htfd1年前1
htfd1年前1 -
 dojiyu 共回答了15个问题
dojiyu 共回答了15个问题 |采纳率100%解题思路:向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH),根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO),再根据c=[n/V]计算.向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH)=0.1L×amol/L=0.1a mol,
生成混合气体物质的量为n(NO2+NO)=[11.2L/22.4L/mol]=0.5mol,
根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO)=0.1a mol+0.5mol=(0.1a+0.5)mol,故原有硝酸的物质的量浓度为
(0.1a+0.5)mol
0.1L=(a+5)mol/L,
故选C.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查硝酸的性质、根据方程式的有关计算,难度中等,注意利用原子守恒进行的计算.1年前查看全部
- (2中13•延边州)[1/少]:[1/6]的比值是( )
(2中13•延边州)[1/少]:[1/6]的比值是( )
A.[130  black401年前1
black401年前1 -
 rex324 共回答了13个问题
rex324 共回答了13个问题 |采纳率100%解题思路:求比值的方法是用比的前项除以比的后项.据此解答.[x/9]:[x/6]=[x/9]÷[x/6]=x[x/9].
故选:C.点评:
本题考点: 求比值和化简比.
考点点评: 本题主要考查了学生对求比值方法的掌握情况.1年前查看全部
- (2012•延边州)一个数由五十个亿、六百二十三个万和四百个一组成,这个数写作______,改写成以“万”作单位的数是_
(2012•延边州)一个数由五十个亿、六百二十三个万和四百个一组成,这个数写作______,改写成以“万”作单位的数是______,四舍五入到亿位约是______.
 huzg1年前1
huzg1年前1 -
 Dancan 共回答了16个问题
Dancan 共回答了16个问题 |采纳率87.5%解题思路:(1)从高级到低级依次写出各级的数,位数不够的用“0”补足;
(2)改写时找到万位在后面点上小数点,并写上“万”字;
(3)“四舍五入”省略亿位后面的尾数时要看千万位,千万位上满5时向前一位进1,不满5时去掉.(1)这个数写作:5006230400;
(2)5006230400=500623.04万;
(3)5006230400≈50亿;
故答案为:5006230400,500623.04万,50亿.点评:
本题考点: 整数的读法和写法;整数的改写和近似数.
考点点评: 此题主要考查数的写法、改写、取近似值.写数要先分级并依次写出各位上的数;求近似数要省略“谁”后面的尾数,就把“谁”下一位上的数字进行四舍五入,还要带上计数单位.1年前查看全部
- (2013•延边州模拟)短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素
(2013•延边州模拟)短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
A.B与A只能组成BA3化合物
B.粒子半径D+>C2-
C.A、B、C三种元素可以形成离子化合物
D.E的氧化物对应的水化物一定有强的氧化性 willow8707071年前1
willow8707071年前1 -
 lordecho 共回答了19个问题
lordecho 共回答了19个问题 |采纳率73.7%解题思路:短周期中的A、B、C、D、E五种元素,原子序数依次增大,C2-与D+的核外电子数相等,结合所带电荷可知,C为O元素、D为Na;A和D,C和E分别同主族,A为非金属元素,则A为H元素、E为S元素;A与B的原子序数之和等于C的原子序数,则B的原子序数=8-1=7,故B为N元素,据此解答.短周期中的A、B、C、D、E五种元素,原子序数依次增大,C2-与D+的核外电子数相等,结合所带电荷可知,C为O元素、D为Na;A和D,C和E分别同主族,A为非金属元素,则A为H元素、E为S元素;A与B的原子序数之和等于C的原子序数,则B的原子序数=8-1=7,故B为N元素,
A.N与H能组成NH3、N2H4等多种化合物,故A错误;
B.O2-与Na+电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Na+,故B错误;
C.H、N、O三种元素可以形成硝酸铵,为离子化合物,故C正确;
D.S元素氧化物对应的水化物为亚硫酸、硫酸,浓硫酸具有强氧化性,而亚硫酸、稀硫酸没有强氧化性,故D错误,
故选C.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查位置结构性质的关系及应用,难度中等,推断元素是解题的关键,C2-与D+的核外电子数相等是推断突破口.1年前查看全部
- (2012•延边州)下列各式中,是方程的是( )
(2012•延边州)下列各式中,是方程的是( )
A.5+x=7.5
B.5+x>7.5
C.5+x
D.5+2.5=7.5 第一片-雪花1年前1
第一片-雪花1年前1 -
 popomusic 共回答了11个问题
popomusic 共回答了11个问题 |采纳率90.9%解题思路:方程是指含有未知数的等式;所以方程必须具备两个条件:①含有未知数;②等式.由此逐项进行分析再选择.A、5+x=7.5,是含有未知数的等式,是方程;
B、5+x>7.5,含有未知数,但不是等式,不是方程;
C、5+x,含有未知数,但不是等式,不是方程;
D、5+2.5=7.5,是等式,但不含有未知数,不是方程;
故选:A.点评:
本题考点: 方程的意义.
考点点评: 此题考查方程的辨识:只有含有未知数的等式才是方程.1年前查看全部
- (2012•延边州)(1)左边的圆,圆心的位置用数对表示是(______,______),这个圆的面积是______平方
(2012•延边州)(1)左边的圆,圆心的位置用数对表示是(______,______),这个圆的面积是______平方厘米.(每个小方格表示1平方厘米)
(2)右边的图案由4个三角形组成,这个图案是一个______图形,它有______条对称轴.
(3)将图案中的 (图案中最上面的三角形)绕A点按______时针方向旋转______°,可以得到
(图案中最上面的三角形)绕A点按______时针方向旋转______°,可以得到  (图案中最左面的三角形).
(图案中最左面的三角形).
 我不是男人01年前1
我不是男人01年前1 -
 russle 共回答了16个问题
russle 共回答了16个问题 |采纳率93.8%1年前查看全部
- (2012•延边州)三角形的面积一定,它的底和高( )
(2012•延边州)三角形的面积一定,它的底和高( )
A.成正比例
B.成反比例
C.不成比例
D.无法确定 俄目的1年前1
俄目的1年前1 -
 zhiyuwen_418 共回答了18个问题
zhiyuwen_418 共回答了18个问题 |采纳率88.9%解题思路:判断三角形的底和高之间成什么比例,就看这两个量是对应的比值一定,还是对应的乘积一定;如果是比值一定,就成正比例;如果是乘积一定,则成反比例.因为三角形的面积=底×高÷2,
所以:底×高=2×三角形的面积(一定),
符合反比例的意义,
所以三角形的面积一定,它的底和高成反比例,
故选:B.点评:
本题考点: 辨识成正比例的量与成反比例的量.
考点点评: 此题属于辨识成正、反比例的量,就看这两个变量是对应的比值一定,还是对应的乘积一定,再做判断.1年前查看全部
- (2014•延边州模拟)甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2014•延边州模拟)甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:co(g)+2h2(g)⇌ch3oh(g)△h1
反应Ⅱ:co2(g)+3h2(g)⇌ch3oh(g)+h2o(g)△h2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(k).
由表中数据判断△h1______0(填“<”、“=”或“>”).温度 250℃ 300℃ 350℃ k 2.041 0.270 0.012
②某温度下,将2mol co和6mol h2充入2l密闭容器中充分反应,4分钟后反应达到平衡,测得co的物质的量为0.4mol,则co的反应速率为______,此时的压强是反应前压强的______倍.
(2)反应Ⅱ的平衡常数表达式为c(h2o)c(ch3oh) c(co2)c3(h2) ,为了加快反应Ⅱ的反应速率,并且提高h2的转化率,采取的措施是______(填写正确选项的字母).c(h2o)c(ch3oh) c(co2)c3(h2)
a.增大co2的浓度 b.增大h2的浓度 c.增大压强 d.加入催化剂
(3)工业上利用co与水蒸气的反应,将***co转化为无毒的co2,书写有关热化学反应方程式______.该反应在830k下进行时,初始浓度到达平衡的时间有如下的关系:
则n为______min.co的初始浓度(mol/l) 2 4 1 3 h2的初始浓度(mol/l) 3 2 3 3 时间(min) 8 6 12 n
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池.该电池中甲醇发生反应的一极为______极、其电极反应式为______.
(5)用该电池作电源,用惰性电极电解饱和nacl溶液时,每消耗0.2mol ch3oh,阴极产生标况下气体的体积为______l. 我要裸聊1年前1
我要裸聊1年前1 -
 燕爱豆21 共回答了22个问题
燕爱豆21 共回答了22个问题 |采纳率95.5%解题思路:(1)①图表分析判断,平衡常数随温度升高减小,平衡逆向进行,正反应是放热反应;
②依据化学平衡三段式列式结合化学反应速率概念计算,压强之比等于气体物质的量之比;
(2)依据反应化学方程式结合平衡常数概念书写平衡常数表达式,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,依据影响化学反应速率和平衡的因素分析判断;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;依据图表数据分析变化规律得到n值;
(4)燃料电池中燃料在原电池负极发生氧化反应,甲醇失电子在碱溶液中生成碳酸钾;
(5)依据原电池和电解池的电极反应中电子守恒计算生成气体体积;(1)①图表分析判断,平衡常数随温度升高减小,平衡逆向进行,正反应是放热反应,△H<0;
故答案为:<;
②某温度下,将2mol CO和6mol H2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,依据化学平衡三段式列式计算;
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol) 2 6 0
变化量(mol)1.63.2 1.6
平衡量(mol) 0.42.8 1.6
CO的反应速率=
1.6mol
2L
4min=0.2mol/(L•min)
平衡状态气体压强和起始压强之比等于气体物质的量之比P(平衡):P(起始)=(0.4+2.8+1.6):(2+6)=4.8:8=0.6;
故答案为:0.2mol/(L•min),0.6;
(2)CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),反应的平衡常数K=
c(H2O)c(CH3OH)
c(CO2)c3(H2);
为了加快反应Ⅱ的反应速率,并且提高H2的转化率;
a.增大CO2的浓度,增大氢气的转化率,平衡正向进行,反应速率加快,故a符合;
b.增大H2的浓度,平衡正向进行,反应速率增大,氢气的转化率减小,故b不符合;
c.增大压强,反应速率增大,平衡正向进行,氢气转化率增大,故c符合;
d.加入催化剂改变化学反应速率不改变化学平衡,氢气转化率不变,故d不符合;
故答案为:K=
c(H2O)c(CH3OH)
c(CO2)c3(H2),a、c;
(3)反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
依据盖斯定律反应Ⅰ-反应Ⅱ得到CO(g)+H2O(g)=CO2(g)+H2(g)△H=△H1-△H2;
图表中数据保持氢气初始浓度不变,一氧化碳浓度增大一倍,达到平衡所需时间缩短4分钟,所以分析判断n=4min;
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=△H1-△H2 、4;
(4)甲醇和氧气以强碱溶液为电解质溶液的新型手机电池,燃料电池中燃料在原电池负极发生氧化反应,甲醇失电子在碱溶液中生成碳酸钾,该电池中甲醇发生反应的一极为负极,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O;
故答案为:负,CH3OH-6e-+8OH-=CO32-+6H2O;
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,CH3OH-6e-+8OH-=CO32-+6H2O,每消耗0.2mol CH3OH,转移电子1.2mol,阴极电极反应为2H++2e-=H2↑,产生标况下气体的体积=0.6mol×22.4L/mol=13.44L;
故答案为:13.44.点评:
本题考点: 化学平衡的影响因素;常见化学电源的种类及其工作原理;化学平衡常数的含义;电解原理.
考点点评: 本题考查了化学平衡影响因素分析,平衡常数计算应用,热化学方程式和原电池原理、电解池原理的计算分析应用,掌握基础是解题关键,题目难度中等.1年前查看全部
- (2013•延边州模拟)下列说法正确的是( )
(2013•延边州模拟)下列说法正确的是( )
a.2011年3月11日,日本发生大地震,并引发核电事故,核反应属于化学变化
b.玻璃和水泥都属于无机硅酸盐材料,其生产过程都需要使用石灰石
c.近期***中东部地区出现雾霾天气,pm2.5超标.pm2.5(2.5微米以下的细颗粒物)仅来自汽车尾气
d.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 夜影的影子1年前1
夜影的影子1年前1 -
 vxzhh 共回答了15个问题
vxzhh 共回答了15个问题 |采纳率86.7%解题思路:A.化学反应的最小微粒是原子;
B.从碳酸钙的性质着手分析,石灰石的主要成分是碳酸钙,高温下碳酸钙和二氧化硅能发生化学反应;
C.PM2.5主要来源是日常发电、工业生产、汽车尾气排放等;
D.浊液的分散质粒子大小大于胶体.A.核反应既不属于物理变化又不属于化学变化,故A错误;
B.生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥,所以在玻璃工业、水泥工业中都用到的原料是石灰石,故B正确;
C.PM2.5产生的主要来源,是日常发电、工业生产、汽车尾气排放等,故C错误;
D.浊液的分散质粒子大小大于胶体,大于 10-7m(即大于 100nm),故D错误.
故选B.点评:
本题考点: 无机非金属材料;分散系、胶体与溶液的概念及关系;常见的生活环境的污染及治理.
考点点评: 本题考查核反应、玻璃水泥的原料、胶体等,明确胶体的本质是解题的关键,难度不大.1年前查看全部
大家在问
- 1西蒙上课时经常朝窗外看.英文翻译成
- 2My friends, Emma Daniels, spent the summer of 1974 traveling
- 3物理学中用到大量的科学方法,下列概念的建立不属于用到“等效替代”方法的是( ) A.“质点” B.“平均速度” C.“
- 4他们喜欢春天的英语怎么说
- 5急!“考试由任课教师命题,采用闭卷形式进行,卷面成绩按百分制记分,60分为及格。” 用英文翻译怎么说!
- 6We can never catch up with the fashion because it ____ all t
- 7“先进先出”英文与英文缩写怎么说?
- 8有2006个数字(都是正整数) 任何几个数的和都没有119 问 (a1+a2+a3+a4+~a2006)的最小值是多少
- 9阅读下面的小说,完成文后问题。 几分钟后,伽西莫多用失望的眼神扫视了人们一遍,又用更加令人心碎的声音喊道:“给水喝!”
- 10英文名Ada是什么意思?请问有一些人的英文名是Ada那么它到底是什么意思呢?
- 11以Most people believe that teenagers and their parents开头 的完形填
- 1213分之1的分子,分母同时加上一个什么数以后就可以约分为3分之1
- 13将0,1mol镁铝混合物溶于100mL2mol/LH2SO4溶液中,再在混合液中滴加1mol/L的NaOH溶液,
- 14帮我做个英语题目 答案写一下 谢谢
- 15小学6年级数学关于浓度的题有浓度百分之20的盐水40克加多少浓度百分之60的盐水能混合成浓度为百分之30的浓