锌锰电池的负极是锌吗
 mouseshu2022-10-04 11:39:543条回答
mouseshu2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 hdisu 共回答了22个问题
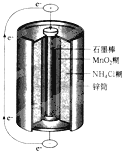
hdisu 共回答了22个问题 |采纳率90.9%- 锌锰干电池是最常见的化学电源.干电池的外壳(锌)是负极,中间的碳棒是正极,在碳棒的周围是细密的石墨和去极化剂MnO2的混合物.
在混合物周围再装入以NH4Cl溶液浸润的ZnCl2,NH4Cl和淀粉或其他填充物(制成糊状物).为了避免水的蒸发,干电池用蜡封好.干电池在使用时的电极反应为 碳极:2NH4+ + 2e- = 2NH3 + H2 +)H2 + 2MnO2 = 2MnO(OH) 锌极:Zn - 2e- = Zn2+ 总反应:Zn + 2MnO2 + 2NH4+ = 2MnO(OH) + 2NH3 + Zn2+ 从反应式看出:加MnO2是因为碳极上NH 离子获得电子产生H2,妨碍碳棒与NH 的接触,使电池的内阻增大,即产生“极化作用”.添加MnO2就能与H2反应生成MnO(OH).这样就能消除电极上氢气的集积现象,使电池畅通.所以MnO2起到消除极化的作用,叫做去极剂.此外,普通碱性干电池,也是用Zn和MnO2或HgO做反应物,但在KOH碱性条件下工作.例如汞电池是最早应用的微型电池,有Zn(负极)和HgO(正极)组成,电解质为KOH浓溶液,电极反应为 负极:Zn(s) + 2OH- Zn(s) + H2O + 2e- 正极:HgO(s) + H2O + 2e- Hg(1) + 2OH- 总反应:Zn(s) + HgO(s) ZnO(s) + Hg (1) 电动势为1.35V,特点是在有效使用期内电势稳定.另有一种氧化银电池由Zn和Ag2O组成,电解质为碱性溶液,电动势为1.5V. - 1年前
 零糖 共回答了59个问题
零糖 共回答了59个问题 |采纳率- 是。锌锰电池正极为碳棒和二氧化锰,负极为锌
- 1年前
 davidl 共回答了57个问题
davidl 共回答了57个问题 |采纳率- 不是正极吗
- 1年前
相关推荐
- 什么叫锌锰电池?什么叫碱性电池?是不是还用酸性电池?它们各有什么优缺点?
 milanyun1年前2
milanyun1年前2 -
 不是**天地斑主 共回答了13个问题
不是**天地斑主 共回答了13个问题 |采纳率92.3%锌锰电池是以二氧化锰为正极,锌为负极,氯化铵水溶液为主电解液的原电池.俗称干电池.在学术界中又称为勒克朗谢电池.
碱性电池亦称为碱性干电池、碱性锌锰电池、碱锰电池,是锌锰电池系列中性能最优的品种.碱性电池在结构上采用于普通电池相反的电极结构,增大了正负极间的相对面积,用高导电性的氢氧化钾溶液替代了氯化铵、氯化锌溶液,负极锌也由片状改变成粒状,增大了负极的反应面积.
酸性电池是电解质使用酸性水溶液的电池.常见的是铅酸蓄电池.1年前查看全部
- 锌锰电池的正负极分别是?rt
 benkey861年前1
benkey861年前1 -
 踏浪099 共回答了10个问题
踏浪099 共回答了10个问题 |采纳率80%正极为二氧化锰
负极为锌1年前查看全部
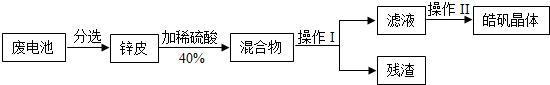
- (2013•丹徒区模拟)图1某兴趣小组回收废旧锌锰电池制备皓矾晶体(ZnSO4•xH2O),请回答下列问题:
(2013•丹徒区模拟)图1某兴趣小组回收废旧锌锰电池制备皓矾晶体(ZnSO4•xH2O),请回答下列问题:
(1)操作 I、II依次为图2中的(填字母)______.
(2)对图2中A图蒸发皿中所盛液体的量要求是______.
(3)图2中B图中的玻璃棒作用是______.
 kvkv00421年前1
kvkv00421年前1 -
 ebu8e0fo 共回答了12个问题
ebu8e0fo 共回答了12个问题 |采纳率83.3%解题思路:(1)由图1某兴趣小组回收废旧锌锰电池制备皓矾晶体,则可推测操作 I、II依次为过滤和蒸发操作;
(2)根据实验基本技能进行分析,进行蒸发时,液体不能超过蒸发皿容积的三分之二,要使用玻璃棒不断搅拌,以防液体溅出,出现大量固体时即停止加热,转移热的蒸发皿需要使用坩埚钳.
(3)图2中B图为过滤,则图中的玻璃棒作用是引流.(1)由图1某兴趣小组回收废旧锌锰电池制备皓矾晶体,则可推测操作I、II依次为过滤、蒸发操作,故答案为:B、A.
(2)进行蒸发时,液体不能超过蒸发皿容积的三分之二;
(3)图2中B图为过滤,则图中的玻璃棒作用是引流.
故答案为:
(1)B、A.
(2)液体不能超过蒸发皿容积的三分之二.
(3)引流.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;蒸发与蒸馏操作.
考点点评: 本题考查了实验操作,完成此题,可以依据已有的知识进行.1年前查看全部
- 为什么碱性锌锰电池比普通锌锰电池性能好
 翠微居士1年前1
翠微居士1年前1 -
 canoe121 共回答了15个问题
canoe121 共回答了15个问题 |采纳率93.3%因为他的负极在电池内部,且金属在碱性环境下比在普通环境更稳定1年前查看全部
- 对如图的锌锰电池,下列说法正确的是( )
对如图的锌锰电池,下列说法正确的是( ) 
A.MnO 2 是氧化剂,被氧化 B.碳棒为负极、锌筒为正极 C.放电过程中NH 4 + 向锌极移动 D.负极反应为:Zn-2e - +2OH - ═Zn(OH) 2  我也来tt1年前1
我也来tt1年前1 -
 christopher_nyk 共回答了22个问题
christopher_nyk 共回答了22个问题 |采纳率90.9%A、MnO 2 是氧化剂,氧化剂在反应中被还原,故A错误;
B、原电池中,失电子的电极锌作负极,得电子的极石墨是正极,故B错误;
C、原电池中,电解质中的阳离子NH 4 + 移向石墨电极,故C错误;
D、原电池中,负极上发生失电子的氧化反应:Zn-2e - +2OH - ═Zn(OH) 2 ,故D正确.
故选D.1年前查看全部
- 锌锰电池,干电池放电的正负极反应式、 Zn+2NH4+ =Zn+Mn2O3+2NH3+H2O 还有干电池用久了变软了的原
锌锰电池,干电池放电的正负极反应式、 Zn+2NH4+ =Zn+Mn2O3+2NH3+H2O 还有干电池用久了变软了的原因.
还有如果MnO2没有参与,干电池难于持续稳定工作,为什么. 恨ll错误7691年前1
恨ll错误7691年前1 -
 江城美景 共回答了15个问题
江城美景 共回答了15个问题 |采纳率66.7%-) Zn - 2e -----> Zn2+
+) 2MnO2 + 2e +2NH4+ -----> Mn2O3 + H2O + 2NH3
放电有H2O产生,可以溶解物质,使固体减少,体积减小.1年前查看全部
- 最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它
最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO 2 +2H 2 O+2e - ="==" 2MnO(OH)+2OH -
F极:Zn+2NH 4 Cl -2e - === Zn(NH 3 ) 2 Cl 2 +2H +
总反应式:2MnO 2 +Zn+2NH 4 Cl ="==" 2MnO(OH)+Zn(NH 3 ) 2 Cl 2
下列说法正确的是A.E极是电池的正极,发生的是氧化反应 B.F极是电池的负极,发生的是氧化反应 C.从结构上分析,锌锰电池应属于可充电电池 D.锌锰电池内部发生的氧化还原反应是可逆的  伤心说不出的痛1年前1
伤心说不出的痛1年前1 -
 iikq0 共回答了23个问题
iikq0 共回答了23个问题 |采纳率91.3%B
A错,E极是电池的正极,发生的是还原反应;B正确,F极是电池的负极,发生的是氧化反应;C错,从结构上分析,锌锰电池应属于一次性电池;D错,锌锰电池内部发生的氧化还原反应是不可逆的,因为它是一次电池;1年前查看全部
- (2014•镇江模拟)某兴趣小组回收废旧锌锰电池制备皓矾晶体(ZnSO4•xH2O).
(2014•镇江模拟)某兴趣小组回收废旧锌锰电池制备皓矾晶体(ZnSO4•xH2O).
请回答下列问题:
(1)操作 I中的玻璃棒作用是______.
(2)操作Ⅱ的过程是先给滤液加热浓缩、______、过滤.
(3)配制40%的稀硫酸的步骤有:①稀释 ②计算 ③装瓶并贴标签 ④量取,其正确的顺序为______(填序号).配制过程中,需要的玻璃仪器有量筒、烧杯、玻璃棒及______. shihengwei1年前1
shihengwei1年前1 -
 oo观首席女oo 共回答了23个问题
oo观首席女oo 共回答了23个问题 |采纳率87%解题思路:(1)根据操作Ⅰ的名称和过程来分析玻璃棒的作用;
(2)根据操作过程是将溶质从溶液中分离出来的原理来分析;
(3)根据配制溶质质量分数一定的溶液的基本步骤进行分析解答.实验室配制氢氧化钠溶液操作步骤分别是:计算、量取、溶解,根据各操作所需要使用的仪器进行分析解答.(1)操作Ⅰ是分离难溶性固体与液体的一种操作,是过滤,在过滤操作中玻璃棒的作用是引流;
(2)操作Ⅱ是浓缩结晶的过程,因为硫酸锌的溶解度受温度影响比较大,故采取降温结晶的方法;
(3)用浓硫酸配制40%的稀硫酸,先计算出所需浓硫酸和水的质量和体积,再量取浓硫酸和水的体积,然后进行溶解,最后进行装瓶并贴标签.需要用到烧杯、玻璃棒、量筒、胶头滴管等玻璃仪器.
故答案为:(1)引流; (2)降温结晶; (3)②④①③;胶头滴管.点评:
本题考点: 物质的相互转化和制备;一定溶质质量分数的溶液的配制;过滤的原理、方法及其应用;蒸发与蒸馏操作;金属的化学性质.
考点点评: 本题难度不大,明确配制一定溶质质量分数的溶液实验步骤、所需仪器等是正确解答本题的关键.1年前查看全部
- 对于如图的锌锰电池,下列说法正确的是( )
 对于如图的锌锰电池,下列说法正确的是( )
对于如图的锌锰电池,下列说法正确的是( )
A.MnO2是氧化剂,被氧化
B.碳棒为正极、锌筒为负极
C.放电过程中NH4+向锌极移动
D.负极反应为:Zn-2e-+2OH-═Zn(OH)2 Asunny1年前1
Asunny1年前1 -
 lihe5680 共回答了21个问题
lihe5680 共回答了21个问题 |采纳率85.7%解题思路:A、氧化剂在反应中被还原;
B、原电池中,失电子的电极作负极,得电子的极是正极;
C、原电池中,电解质中的阳离子移向正极;
D、原电池中,负极上发生失电子的氧化反应.A、MnO2是氧化剂,氧化剂在反应中被还原,故A错误;
B、原电池中,失电子的电极锌作负极,得电子的极石墨是正极,故B正确;
C、原电池中,电解质中的阳离子NH4+移向石墨电极,故C错误;
D、原电池中,负极上发生失电子的氧化反应:Zn-2e-+2OH-═Zn(OH)2,故D正确.
故选BD.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查原电池原理,根据原电池正负极上得失电子来分析解答即可,难度不大.1年前查看全部
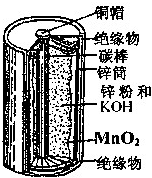
- 如图所示为普通锌锰电池(即干电池)的组成和结构示意图,其中MnO2的作用是吸收正极放出的H2,下列说法正确的是( )
 如图所示为普通锌锰电池(即干电池)的组成和结构示意图,其中MnO2的作用是吸收正极放出的H2,下列说法正确的是( )
如图所示为普通锌锰电池(即干电池)的组成和结构示意图,其中MnO2的作用是吸收正极放出的H2,下列说法正确的是( )
A.锌是正极,MnO2是负极
B.锌是负极,MnO2是正极
C.锌是正极,石墨棒是负极
D.锌是负极,石墨棒是正极 yanwenzhuo1年前1
yanwenzhuo1年前1 -
 在蒙山 共回答了14个问题
在蒙山 共回答了14个问题 |采纳率85.7%解题思路:普通锌锰电池中锌为负极,石墨为正极,MnO2的作用是吸收正极放出的H2,为电解池的重要组成部分.普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-=2NH3+H2,锌是负极,石墨棒是正极.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查常见原电池知识,为电化学重要考点,侧重点较为基础,有利于培养学生的学习积极性,难度不大,注意把握原电池的形成条件和工作原理.1年前查看全部
- 最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示:尽管这种电池的历史悠久
最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如图:
E极:2MnO 2 +2H 2 O+2e - ═2MnO(OH)+2OH -
F极:Zn+2NH 4 Cl-2e - ═Zn(NH 3 ) 2 Cl 2 +2H +
总反应式:2MnO 2 +Zn+2NH 4 Cl═2MnO(OH)+Zn(NH 3 ) 2 Cl 2
下列说法正确的是( )A.E极是电池的正极,发生的是氧化反应 B.F极是电池的负极,发生的是氧化反应 C.从结构上分析,锌锰电池应属于可充电电池 D.锌锰电池内部发生的氧化还原反应是可逆的 
 nail19631年前1
nail19631年前1 -
 飄續 共回答了19个问题
飄續 共回答了19个问题 |采纳率100%A、原电池的E极发生的是得电子的还原反应,是正极反应,故A错误;
B、原电池的F极发生失去电子的氧化反应,F电极应该是负极,故B正确;
C、从结构上分析,锌锰电池应属于一次电池,故C错误;
D、锌锰电池应属于一次电池,一次电池内部发生的氧化还原反应是不可逆的,故D错误.
故选B.1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因此得到广泛应用.锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO
碱性电池具有容量大、放电电流大的特点,因此得到广泛应用.锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO2+2H2O=2MnOOH+Zn(OH)2下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池负极反应为Zn+2OH--2e-=Zn(OH)2
C.电池工作时,电流由负极通过外电路流向正极
D.外电路中每通过0.2mol电子,锌的质量理论上减少6.5g miao02151年前1
miao02151年前1 -
 我是一棵小葱 共回答了15个问题
我是一棵小葱 共回答了15个问题 |采纳率93.3%解题思路:A、根据原电池中失电子的一极为负极判断;
B、根据负极上的反应类型书写电极反应式;
C、根据原电池工作原理中电子的流向来回答;
D、根据锌与转移电子的关系计算.A、原电池中失电子的一极为负极,Zn转化为Zn(OH)2,化合价升高失电子,做负极,故A正确;B、负极失电子,发生氧化反应,所以负极的电极反应式为:Zn-2e-+2OH-=Zn(OH)2,故B正确;C、电池工作时,电子由负极流向...
点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查原电池,理解这类题的关键是理解原电池原理,在反应中,电子从负极经外电路流向正极,同时溶液中的阴、阳离子分别不断移向负极、正极,构成闭合回路.1年前查看全部
- (14分)(1)最早使用的化学电池是锌锰电池,即大家熟悉的干电池。这种电池在使用过程中,锌外壳会逐渐变薄,最后内部糊状的
(14分)
(1)最早使用的化学电池是锌锰电池,即大家熟悉的干电池。这种电池在使用过程中,锌外壳会逐渐变薄,最后内部糊状的电解质会泄漏出来,使电器腐蚀。后来人们采用了什么方法将其改造成了防漏电池。请列举一种方法即可_____________。
这种电池还有一个缺点:即使不用,放置过久,也会失效,请说明失效的原因_________。
(2)为提高电池寿命和提高其性能,人们将电池内的电解质NH 4 Cl换成湿的KOH,并在构造上做了改进,制成了碱性锌锰电池。其总反应为:
Zn + 2MnO 2 + 2H 2 O ="===" 2MnOOH + Zn(OH) 2
写出该电池正极反应式___________。电池工作时,电子流向 (填“正”或“负”)极。
(3)二氧化锰是制造锌锰干电池的基本材料。MnO 2 的生产方法之一是以石墨为电极,电解酸化的MnSO 4 溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO 2 的理论产量为 。
(4)生产MnO 2 另一种方法:以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰。流程如下:
某软锰矿的主要成分为MnO 2 ,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:①硫酸亚铁在酸性条件下将MnO 2 还原为MnSO 4 ,酸浸时发生的主要反应的化学方程式沉淀物 Al(OH) 3 Fe(OH) 3 Fe(OH) 2 Mn(OH) 2 Cu(OH) 2 Zn(OH) 2 CuS ZnS MnS FeS pH 5.2 3.2 9.7 10.4 6.7 8.0 ≥–0.42 ≥2.5 ≥7 ≥7
为 。
②加入MnS的目的是除去 杂质。 胡孤城1年前1
胡孤城1年前1 -
 飞箭无全目 共回答了14个问题
飞箭无全目 共回答了14个问题 |采纳率85.7%(1)在外壳套上防腐金属筒或塑料筒 1分
作为电解质的NH 4 Cl的水溶液会水解使溶液显酸性2分
(2)MnO 2 +H 2 O+e - =MnOOH+OH - 2分正极 1分
(3)2H + +2e - =H 2 ↑ 2分 87g 2分
(4)①MnO 2 +2FeSO 4 +2H 2 SO 4 =MnSO 4 +Fe 2 (SO 4 ) 3 +2H 2 O 2分
②Cu 2 + Zn 2 + 各1分
略1年前查看全部
- 某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验: 普通锌锰电池的黑色物质主要成分为MnO 2
某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验: 
普通锌锰电池的黑色物质主要成分为MnO 2 、NH 4 Cl、ZnCl 2 等物质。
请回答以下问题:
(1)操作②玻璃棒的作用是_____________;
(2)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为_____________(填化学式);
(3)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为_____________(填化学式);
(4)该同学要对滤液的成分进行检验,以确认是否含有NH 4 Cl和ZnCl 2 ,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
 bbandbb1年前1
bbandbb1年前1 -
 小鱼1999 共回答了20个问题
小鱼1999 共回答了20个问题 |采纳率90%1年前查看全部
- 为什么锌锰电池的电解质溶液中有铜离子会加速电极腐蚀?
 gigizyc20041年前1
gigizyc20041年前1 -
 唉受不了了 共回答了19个问题
唉受不了了 共回答了19个问题 |采纳率94.7%锌可以将铜离子置换出来,就有了Cu单质,与锌形成原电池,锌将电子转移到Cu上参与还原反应1年前查看全部
- 有关碱性锌锰电池的碱性锌锰电池比普通锌锰电池性能好,放电电流大.试从影响反应速率的因素分析其原因
 kobe668059331年前1
kobe668059331年前1 -
 iy_51 共回答了15个问题
iy_51 共回答了15个问题 |采纳率100%碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大1年前查看全部
- 锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。

回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH 4 Cl+2MnO 2 =Zn(NH 3 ) 2 Cl 2 +2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是______,正极发生的主要反应是________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K 2 MnO 4 。操作b中,绿色的K 2 MnO 4 溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K 2 MnO 4 溶液也能得到化合物D,则阴极处得到的主要物质是 。(填化学式) 叶子_f21年前1
叶子_f21年前1 -
 蘾疍 共回答了19个问题
蘾疍 共回答了19个问题 |采纳率94.7%(1)①Zn NH 4 Cl MnO 2 +NH 4 + +e - =MnOOH+NH 3
②碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。
(2)①ZnCl 2 ;NH 4 Cl②3MnO 4 2- +2CO 2 =2MnO 4 - +MnO 2 ↓+2CO 3 2- ③H 2
(1)根据化学方程式Zn+2NH 4 Cl+2MnO 2 =Zn(NH 3 ) 2 Cl 2 +2MnOOH,锌是负极材料,氯化铵是电解质的主要成分,二氧化锰和铵根离子在正极发生反应,MnO 2 +NH 4 + +e - ="MnOOH+" NH 3 。与普通锌锰电池相比,碱性锌锰电池的优点及其理由是碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。
(2)废电池经机械分离后,加水溶解后再加稀盐酸,浓缩结晶得到氯化铵和氯化锌。氯化铵不稳定,受热易分解,所以B为氯化铵,A为氯化锌。绿色的K 2 MnO 4 溶液发生反应后生成紫色的高锰酸钾溶液和黑褐色的二氧化锰,该反应的离子方程式为3MnO 4 2- +2CO 2 =2MnO 4 - +MnO 2 ↓+2CO 3 2- 。采用惰性电极电解K 2 MnO 4 溶液,阴极氢离子得电子生成氢气。1年前查看全部
- 酸(碱)性锌锰电池的正负极反应,总反应式是什么,
酸(碱)性锌锰电池的正负极反应,总反应式是什么,
我从网上看到过不同版本,其中酸性锌锰电池负极反应式基本都一样为Zn-2e=Zn2+,但是正极和总反应式五花八门什么都有,
我们老师说的是这个:2NH4++2e=2NH3+H2
但也有资料说 的是:2MnO2+2e- +2NH4+=Mn2O3+H2O+2NH3或2MnO2+2H2O+2e→2MnO(OH)+2OH或
2MnO2+H2O+2e-=Mn2O3+2OH-酸性电池总反应式老师也没讲,不过当时我记得有这么两个式子,没参悟出来,还望各位大能之士能够为小弟解答一二,Zn2++4NH3=Zn(NH3)42+ H2+2MnO2=Mn2O3+H2o 碱性电池的正负极,总反应,希望各位道友也能写出来
1 鬼魅浓烈1年前1
鬼魅浓烈1年前1 -
 sevenjoe 共回答了18个问题
sevenjoe 共回答了18个问题 |采纳率88.9%首先,你们老师说的那个是错的.这个电池是不可能放出氢气的.2MnO2+2e- +2NH4+=Mn2O3+H2O+2NH3这个是酸性条件下的.2MnO2+2H2O+2e→2MnO(OH)+2OH和2MnO2+H2O+2e-=Mn2O3+2OH-是碱性条件下的.碱性条件:正极,MnO2+2H2O+...1年前查看全部
- (7分)锌锰电池(俗称干电池)在生活中的用量很大。锌锰电池的构造
(7分)锌锰电池(俗称干电池)在生活中的用量很大。锌锰电池的构造
如图所示。回答下列问题:
(1)锌锰电池所使用的下列材料中,属于金属材料的是 (填字
母序号)。
(2)金属制品在空气中放置易生锈,铁生锈的条件是 。废旧电池的铜帽会生成一些绿色的铜锈,其主要成分为是Cu 2 (OH) 2 CO 3 ,则铜生锈还必须有 参与。A.铜帽 B.碳棒 C.锌筒 D.密封塑料
(3)普通锌锰电池放电时发生的主要反应为:Zn+2NH 4 Cl+2MnO 2 =Zn(NH 3 ) 2 Cl 2 +2MnOOH,该反应中锰元素的化合价由+4变为 。
(4)利用废旧电池铜帽(含Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下:
(已知:Cu+H 2 O 2 +H 2 SO 4 =CuSO 4 +2H 2 O)
①过程Ⅲ中分离操作的名称是 。
②过程Ⅱ中发生反应的化学方程式为 。 樱花草881年前1
樱花草881年前1 -
 尹林光子 共回答了13个问题
尹林光子 共回答了13个问题 |采纳率100%(1)AC (2)与氧气、水同时接触 CO 2 (3)+3(4)①过滤 ②Zn+ CuSO 4 = ZnSO 4 +Cu Zn+H 2 SO 4 =ZnSO 4 +H 2 ↑
1年前查看全部
- 最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(
 最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示.尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如下:
最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示.尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e-═2MnO(OH)+2OH-
F极:Zn+2NH4Cl═Zn(NH3)2Cl2+2H++2e-
总反应式:2MnO2+Zn+2NH4Cl═2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是( )
A.E极是电池的正极,发生的是氧化反应
B.只有自发的氧化还原反应才可能设计成原电池
C.从结构上分析,锌锰电池应属于二次电池
D.锌锰干电池工作一段时间后石墨棒变细 切割瓦拉1年前1
切割瓦拉1年前1 -
 倚树而眠 共回答了20个问题
倚树而眠 共回答了20个问题 |采纳率95%解题思路:A、原电池的正极发生得电子的还原反应,E极是电池正极,发生的是还原反应;
B、依据原电池形成条件分析,活泼型不同的电极,电解质溶液,闭合回路,自发进行的氧化还原反应分析;
C、锌锰电池应属于一次电池;
D、原电池中石墨做正极不发生变化.A、依据电池反应分析,E电极是原电池的正极,是得到电子发生的还原反应,故A错误;
B、只有自发进行的氧化还原反应才可以设计成原电池,实现化学能转化为电能的变化,故B正确;
C、从结构上分析,碱性锌锰电池电池中的活性物质消耗到一定程度就不能再使用了,不能多次重复使用,锌锰电池应属于一次电池,故C错误;
D、锌锰电池中石墨做原电池的正极不发生反应,所以石墨电极不变细,故D错误.
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生一次电池锌锰电池的工作原理,可以根据原电池原理来回答,属于教材知识的考查,难度不大.1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因此得到广泛应用.锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO
碱性电池具有容量大、放电电流大的特点,因此得到广泛应用.锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO2+2H2O=2MnOOH+Zn(OH)2下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池负极反应为Zn+2OH--2e-=Zn(OH)2
C. 电池工作时,电流由负极通过外电路流向正极
D. 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g ghostfox231年前1
ghostfox231年前1 -
 billy157421 共回答了9个问题
billy157421 共回答了9个问题 |采纳率88.9%解题思路:A、根据原电池中失电子的一极为负极判断;
B、根据负极上的反应类型书写电极反应式;
C、根据原电池工作原理中电子的流向来回答;
D、根据锌与转移电子的关系计算.A、原电池中失电子的一极为负极,Zn转化为Zn(OH)2,化合价升高失电子,做负极,故A正确;
B、负极失电子,发生氧化反应,所以负极的电极反应式为:Zn-2e-+2OH-=Zn(OH)2,故B正确;
C、电池工作时,电子由负极流向正极,电流由正极通过外电路流向负极,故C错误;
D、由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则6.5gZn反应转移0.2mol电子,故D正确.
故选C.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查原电池,理解这类题的关键是理解原电池原理,在反应中,电子从负极经外电路流向正极,同时溶液中的阴、阳离子分别不断移向负极、正极,构成闭合回路.1年前查看全部
- 锌锰电池为什么隔一段时间不用也会失效
锌锰电池为什么隔一段时间不用也会失效
化学书上说:为什么锌锰干电池即使不用,放置过久,也会失效(作为电解质的NH4CL的水溶液显酸性)? 真得讓我這麽做1年前1
真得讓我這麽做1年前1 -
 iiff 共回答了10个问题
iiff 共回答了10个问题 |采纳率100%由于扩散作用,正负极物质缓慢的发生了普通的氧化还原反应,而不是电化学反应,不过最终结果都是一样的——正负极物质被消耗,Zn溶入电解质溶液中.1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO
碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO 2 +2H 2 O=2MnOOH+Zn(OH) 2 下列说法错误的是 [ ]A. 电池工作时,锌失去电子
B. 电池负极反应为Zn+2OH - -2e - =Zn(OH) 2
C. 电池工作时,电流由负极通过外电路流向正极
D. 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g 吴小屋1年前1
吴小屋1年前1 -
 xiao0719 共回答了23个问题
xiao0719 共回答了23个问题 |采纳率95.7%C1年前查看全部
- 最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),
最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO 2 +2H 2 O+2e - ==2MnO(OH)+2OH -
F极:Zn+2NH 4 Cl==Zn(NH 3 ) 2 Cl 2 +2H + +2e -
总反应式:2MnO 2 +Zn+2NH 4 Cl === 2MnO(OH)+Zn(NH 3 ) 2 Cl 2
下列说法正确的是 [ ]
[ ]A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的 装c装A1年前1
装c装A1年前1 -
 春风渡口 共回答了16个问题
春风渡口 共回答了16个问题 |采纳率81.3%B1年前查看全部
- 锌锰电池(俗称干电池)在生活中的用量很大.锌锰电池的构造如图1所示.回答下列问题:
锌锰电池(俗称干电池)在生活中的用量很大.锌锰电池的构造如图1所示.回答下列问题:

(1)锌锰电池所使用的下列材料中,属于金属材料的是______(填标号).
a.铜帽 b.碳棒 c.锌筒 d.密封塑料
(2)使用电池时是将______能转化为电能.
(3)氯化铵的提纯:氯化铵中混有二氧化锰等难溶物,提纯的实验步骤是:溶解、______、蒸发等,在溶解过程中需要用到的玻璃仪器是______(写一种).
(4)兴趣小组欲探究Zn、Cu、Ag三种金属的活动性顺序,进行了如图2实验:
①如图2所示,将四根金属丝同时插入烧杯中,则甲中发生反应的化学方程式为______,乙中的现象为______.
②通过实验现象可得出Zn、Cu、Ag活动性顺序由强到弱为______. aa62633881年前1
aa62633881年前1 -
 ntf2002 共回答了19个问题
ntf2002 共回答了19个问题 |采纳率100%解题思路:(1)金属材料包括纯金属以及它们的合金;
(2)根据能量的转化分析回答;
(3)根据氯化铵中混有二氧化锰等难溶物的提纯过程和溶解的操作分析回答;
(4)根据金属与酸、盐反应的现象分析判断金属额活泼性的大小.(1)锌锰电池所使用铜帽、碳棒、锌筒、密封塑料中,属于金属材料的是铜帽和锌筒.
(2)使用电池时是将化学能转化为电能.
(3)氯化铵的提纯:氯化铵中混有二氧化锰等难溶物,提纯的实验步骤是:溶解、过滤、蒸发等,在溶解过程中需要用到的玻璃仪器是:烧杯和玻璃棒.
(4)由图2所示可知,将四根金属丝同时插入烧杯中,则甲中锌能与硫酸反应,铜不能与硫酸反应,说明锌的活泼性大于铜,发生反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑.乙中的现象为:在锌片的表面上有红色物质生成,溶液由蓝色逐渐变成无色.银片无现象.说明铜的活泼性大于银,通过以上实验现象可得出Zn、Cu、Ag活动性顺序由强到弱为:Zn>Cu>Ag.
故答为:(1)ac;(2)化学;(3)过滤,烧杯(或玻璃棒);(4)Zn+H2SO4=ZnSO4+H2↑,Zn>Cu>Ag.点评:
本题考点: 金属材料及其应用;物质的溶解;混合物的分离方法;金属活动性顺序及其应用;物质发生化学变化时的能量变化;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题通过锌锰电池,考查了金属材料、混合物的分离、金属活动性顺序表的应用知识.难度不大,根据已有的知识即可解答.1年前查看全部
- 下列说法正确的是 A.流水、风力是一次能源,电力、蒸汽是二次能源 B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池 C
下列说法正确的是
A.流水、风力是一次能源,电力、蒸汽是二次能源 B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池 C.同周期元素形成的简单离子中,原子序数越大的离子半径越小 D.原子核外电子层数越多,原子半径一定越大  心海飞翔1年前1
心海飞翔1年前1 -
 liuxueming 共回答了13个问题
liuxueming 共回答了13个问题 |采纳率92.3%A
1年前查看全部
- 为什么普通锌锰电池正极是石墨,而碱性锌锰电池的正极是二氧化锰
 ejeqwiij1年前1
ejeqwiij1年前1 -
 beastxy 共回答了17个问题
beastxy 共回答了17个问题 |采纳率100%石墨不参加电化学反应,有良好的导电性,具有吸附性和粘着性.掺入电芯中可以提高电芯的导电性.它粘着在多孔锰粉的周围吸收一定量的电液,使电芯保持一定的水分,可充分提高锰粉的利用率,但无论普通还是碱性锌锰电池,一般正极都是MnO2,是正极的活性物质,直接参加电化学反应,电子转换效率更高,使用寿命更长.1年前查看全部
- 如图所示为普通锌锰电池(即干电池)的组成和结构示意图,其中MnO 2 的作用是吸收正极放出的H 2 ,下列说法正确的是(
如图所示为普通锌锰电池(即干电池)的组成和结构示意图,其中MnO 2 的作用是吸收正极放出的H 2 ,下列说法正确的是( ) A.锌是正极,MnO 2 是负极 B.锌是负极,MnO 2 是正极 C.锌是正极,石墨棒是负极 D.锌是负极,石墨棒是正极 
 pine_cn1年前1
pine_cn1年前1 -
 qiqiloveyong 共回答了21个问题
qiqiloveyong 共回答了21个问题 |采纳率81%普通干电池的电极分别为碳棒和锌筒,以糊状NH 4 Cl和ZnCl 2 作电解质(其中加入MnO 2 吸收H 2 ,ZnCl 2 吸收NH 3 ),电极反应可简化为:Zn-2e - =Zn 2+ ,2NH 4 + +2e - =2NH 3 +H 2 ,锌是负极,石墨棒是正极.
故选D.1年前查看全部
- 最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示:尽管这种电池的历史悠久
 最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如图:
最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如图:
E极:2MnO2+2H2O+2e-═2MnO(OH)+2OH-
F极:Zn+2NH4Cl-2e-═Zn(NH3)2Cl2+2H+
总反应式:2MnO2+Zn+2NH4Cl═2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是( )
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的 qfgj1年前1
qfgj1年前1 -
 同为天崖沦落人 共回答了19个问题
同为天崖沦落人 共回答了19个问题 |采纳率94.7%解题思路:A、原电池的正极发生得电子的还原反应;
B、原电池的负极发生失去电子的氧化反应;
C、锌锰电池应属于一次电池;
D、一次电池内部发生的氧化还原反应是不可逆的.A、原电池的E极发生的是得电子的还原反应,是正极反应,故A错误;
B、原电池的F极发生失去电子的氧化反应,F电极应该是负极,故B正确;
C、从结构上分析,锌锰电池应属于一次电池,故C错误;
D、锌锰电池应属于一次电池,一次电池内部发生的氧化还原反应是不可逆的,故D错误.
故选B.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查学生一次电池锌锰电池的工作原理,可以根据所学知识来回答,属于教材知识的考查,难度不大.1年前查看全部
- 锌锰电池的电极热反应方程式rt总反应的热化学式也行Zn+2MnO2+2H2O==2MnO(OH)+Zn(OH)2就是这个
锌锰电池的电极热反应方程式
rt
总反应的热化学式也行
Zn+2MnO2+2H2O==2MnO(OH)+Zn(OH)2就是这个方程1mol释放出的热量 mms121年前2
mms121年前2 -
 bear_wang 共回答了17个问题
bear_wang 共回答了17个问题 |采纳率100%负极:Zn-2e=Zn2+
正极:2NH4+ +2e=2NH3+H2
但是生产的 NH3与Zn2+作用,
Zn2+ +4NH3=[Zn(NH3)4]2+
产生的H2与MnO2作用
H2+2MnO2=Mn2O3+H2O,
总反应方程式:2Zn+4NH4Cl+4MnO2==[Zn(NH3)4]Cl2+ZnCl2+2Mn2O3+2H2O1年前查看全部
- 如图为普通电池(锌锰电池)示意图,请你根据图示分析:
 如图为普通电池(锌锰电池)示意图,请你根据图示分析:
如图为普通电池(锌锰电池)示意图,请你根据图示分析:
(1)将回收的废旧电池进行分离,可以得到的单质有(用化学式表示,
下同)______,氧化物有______,盐有______,
有机物有(写名称)______.
(2)小李同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶液,并检验氯
化铵中的铵根离子.设计了如下实验步骤,请你帮他完成:
实验步骤 实验现象 结论或解释 ①剥开干电池,取出碳棒周围的黑色粉末. / / ②溶解、______、洗涤(填操作名称). 得到黑色粉末和无色澄清液体 黑色粉末的成份为______ ③对黑色粉末进行______. / 得到纯净的MnO2固体 ④检验第②步中得到的无色澄清液体中是
否含铵根离子的方法是:
______.
______化学方程式为:
______ huandaolhf1年前1
huandaolhf1年前1 -
 helen_029 共回答了17个问题
helen_029 共回答了17个问题 |采纳率94.1%解题思路:(1)根据物质的分类知识和单质、氧化物、盐、有机物的定义回答.
(2)②碳棒周围的黑色粉末主要有二氧化锰、碳粉和氯化铵,因为氯化铵溶于水,所以可先溶解,再过滤,滤液为氯化铵溶液,滤渣是二氧化锰和碳粉.
③根据实验目的要制备纯净的二氧化锰,所以必须对二氧化锰中的碳粉进行处理.
④根据氯化铵溶液与碱反应可以生成氨气进行检验(1)单质是由同种元素组成的纯净物,碳、锌、铜等符合定义;氧化物是由两种元素组成的,且其中一种元素为氧元素的化合物,二氧化锰符合定义;盐是指由金属离子(或铵根离子)与酸根离子构成的化合物,氯化锌、氯化铵符合定义;有机物是大部分由C、H、O组成,淀粉符合定义.
故答案为:Cu、C、Zn; MnO2 ; NH4Cl、ZnCl2 ; 淀粉
(2)②碳棒周围的黑色粉末主要有二氧化锰、碳粉和氯化铵,因为氯化铵溶于水,所以可先溶解,再过滤,滤液为氯化铵溶液,滤渣是二氧化锰和碳粉.
③根据实验目的是要达到纯净干燥的二氧化锰,所以对滤渣进行灼烧,可以将碳粉变为二氧化碳除去,表面残留的氯化铵受热分解也除去了.
④根据氯化铵溶液与碱反应可以生成氨气,NH4Cl+NaOH═NaCl+H2O+NH3↑,氨气呈碱性且有刺激性气味,所以可以设计实验为取少量滤液于试管中,加入氢氧化钠溶液,然后检验生成的气体即可.
答案:
②过滤;二氧化锰和炭粉
③灼烧;④取样于试管中,加入氢氧化钠溶液并加热(把湿润的红色石蕊试纸放在试管口);强烈刺激性气味(或湿润的红色石蕊试纸变蓝色);NH4Cl+NaOH═NaCl+H2O+NH3↑
答案:
(1)Cu、C、Zn; MnO2 ; NH4Cl、ZnCl2 ; 淀粉
(2)
实验步骤 实验现象 结论或解释
①剥开干电池,取出碳棒周围的黑色粉末. / /
②溶解、过滤、洗涤(填操作名称). 得到黑色粉末和无色澄清液体 黑色粉末的成份为 二氧化锰和炭粉
③对黑色粉末进行 灼烧. / 得到纯净的MnO2固体
④检验第②步中得到的无色澄清液体中是
否含铵根离子的方法是:
取样于试管中,加入氢氧化钠溶液并加热.
强烈刺激性气味 化学方程式为:
NH4Cl+NaOH═NaCl+H2O+NH3↑点评:
本题考点: 金属的回收利用及其重要性;混合物的分离方法;过滤的原理、方法及其应用;证明铵盐;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题以生活中的干电池为依托,对物质的分类及物质的除杂、分离等重要知识进行了考查,考查了学生运用化学知识解决具体问题的能力.1年前查看全部
- 下列说法正确的是( )A.流水、风力是一次能源,电力、蒸汽是二次能源B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
下列说法正确的是( )
A.流水、风力是一次能源,电力、蒸汽是二次能源
B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
C.同周期元素形成的简单离子中,原子序数越大的离子半径越小
D.原子核外电子层数越多,原子半径一定越大 hmtthz1年前1
hmtthz1年前1 -
 小猪不厚道 共回答了19个问题
小猪不厚道 共回答了19个问题 |采纳率84.2%解题思路:A.一级能源是指可以从自然界直接获取的能源,如:水能、风能、太阳能、地热能、核能、化石燃料;由一级能源经过加工转换以后得到的能源,称为二级能源,例如:电能、蒸汽、煤气、汽油、柴油、水煤气、干馏煤气等;
B.一次电池是放电后不能再充电使其复原的电池,通电电池有正极、负极电解以及容器和隔膜等组成;二次电池又称为充电电池或蓄电池,是指在电池放电后可通过充电的方式使活性物质激活而继续使用的电池;
C.同周期元素形成的简单离子中,随着原子序数的增加,离子半径先减小,后增大;
D.影响的因素有三个:一是电荷数,二是核外电子数,三是电子层数.A.一级能源是指可以从自然界直接获取的能源,如:水能、风能、太阳能、地热能、核能、化石燃料;由一级能源经过加工转换以后得到的能源,称为二级能源,例如:电能、蒸汽、煤气、汽油、柴油、水煤气、干馏煤气等,故A正确;
B.一次电池是放电后不能再充电使其复原的电池,通电电池有正极、负极电解以及容器和隔膜等组成.例如普通锌锰电池、碱性锌锰电池等;二次电池又称为充电电池或蓄电池,是指在电池放电后可通过充电的方式使活性物质激活而继续使用的电池,例如铅蓄电池等,故B错误;
C.同周期元素形成的简单离子中,随着原子序数的增加,离子半径先减小,后增大,例如钠离子、镁离子、氯离子,故C错误;
D.影响的因素有三个:一是电荷数,二是核外电子数,三是电子层数,故原子核外电子层数越多,原子半径不一定越大,故D错误,
故选A.点评:
本题考点: 常见的能量转化形式;元素周期律的作用.
考点点评: 本题考查能源和电池的分类和元素周期律,难度不大.要注意平时知识的积累.1年前查看全部
- 锌锰电池问题正极反应负极反应正极材料负极材料以及电解质是什么不要复制别人的
 羿哓天1年前1
羿哓天1年前1 -
 酱拐拐 共回答了14个问题
酱拐拐 共回答了14个问题 |采纳率85.7%正极反应:2NH4(+) + 2e- ==H2↑ + 2NH3↑
负极反应:Zn - 2e- ==Zn(2+)
正极材料:碳棒
负极材料:锌皮
电解质:氯化铵、氯化锌、二氧化锰等黏糊状物质
注:括号内是原子或原子团的(价态)
绝对是我自己写的哦1年前查看全部
- 下列说法正确的是 [ ] A.镍镉电池、锂电池和锌锰电池都是二次电池
下列说法正确的是 [ ]A.镍镉电池、锂电池和锌锰电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电时正极是Pb,负极是PbO 2 冷门CP爱好者1年前1
冷门CP爱好者1年前1 -
 非凡467 共回答了16个问题
非凡467 共回答了16个问题 |采纳率100%C1年前查看全部
- 无汞锌锰电池对人体有害吗?
 狐狸飘飘1年前5
狐狸飘飘1年前5 -
 43064830 共回答了24个问题
43064830 共回答了24个问题 |采纳率100%只要你不吃下去就没问题.ps:重金属都对人体有害.密度在5以上的金属统称为重金属,如金、银、铜、铅、锌、镍、钴、镉、铬和汞等45种.从环境污染方面所说的重金属,实际上主要是指汞、镉、铅、铬以及类金属砷等生物毒性显著的重金属,也指具有一定毒性的一般重金属如锌、铜、钴、镍、锡等.目前最引起人们注意的是汞、镉、铬等.重金属随废水排出时,即使浓度很小,也可能造成危害.由重金属造成的环境污染称为重金属污染.1年前查看全部
- 阅读短文,完成文后问题.干电池是一种锌锰电池,也有人叫它“碳锌电池”,其负极是用锌做成的圆筒,做成筒状的目的是用来储存电
 阅读短文,完成文后问题.
阅读短文,完成文后问题.
干电池是一种锌锰电池,也有人叫它“碳锌电池”,其负极是用锌做成的圆筒,做成筒状的目的是用来储存电解液等化学药品;正极是一根碳棒,它的周围被二氧化锰、碳粉和氯化铵的混合剂所包围.碳棒和圆筒之间填氯化铵、氯化锌的水溶液和淀粉等组成的糊状物,称为“电糊”.电池口用沥青、松香等配成的封口物封牢.这样使得干电池便于携带.(如图所示)
(1)电池的正极是______,负极是______.
(2)干电池在放电时,电池内都要发生______,所以人们称它为______电池. zaxialian1年前1
zaxialian1年前1 -
 www126qq 共回答了21个问题
www126qq 共回答了21个问题 |采纳率90.5%解题思路:干电池是把化学能转化为电能的电源,中间的碳棒是正极,外边的锌筒是负极.(1)电池的正极是 碳棒,负极是 锌筒.
(2)干电池在放电时,电池内都要发生 化学变化,所以人们称它为 化学电池.
故本题答案为:碳棒;锌筒;化学变化;化学.点评:
本题考点: 电源及其能量转化.
考点点评: 本题考查了干电池的构造和类型.1年前查看全部
- 下列说法正确的是( )A.流水、风力是一次能源,电力、蒸汽是二次能源B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
下列说法正确的是( )
A.流水、风力是一次能源,电力、蒸汽是二次能源
B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
C.蔗糖、纤维素、淀粉、蛋白质都能燃烧且完全燃烧的产物相同
D.煤的干馏、煤的气化和液化均属于物理变化 赵春磊1年前1
赵春磊1年前1 -
 cartoonsh 共回答了19个问题
cartoonsh 共回答了19个问题 |采纳率94.7%解题思路:A.一级能源是指可以从自然界直接获取的能源,如:水能、风能、太阳能、地热能、核能、化石燃料;由一级能源经过加工转换以后得到的能源,称为二级能源,例如:电能、蒸汽、煤气、汽油、柴油、水煤气、干馏煤气等;
B.一次电池是放电后不能再充电使其复原的电池,通电电池有正极、负极电解以及容器和隔膜等组成;二次电池又称为充电电池或蓄电池,是指在电池放电后可通过充电的方式使活性物质激活而继续使用的电池;
C.蛋白质中含N元素;
D.有新物质生成的是化学变化.A.一级能源是指可以从自然界直接获取的能源,如:水能、风能、太阳能、地热能、核能、化石燃料;由一级能源经过加工转换以后得到的能源,称为二级能源,例如:电能、蒸汽、煤气、汽油、柴油、水煤气、干馏煤气等,故A正确;
B.一次电池是放电后不能再充电使其复原的电池,通电电池有正极、负极电解以及容器和隔膜等组成.例如普通锌锰电池、碱性锌锰电池等;二次电池又称为充电电池或蓄电池,是指在电池放电后可通过充电的方式使活性物质激活而继续使用的电池,例如铅蓄电池等,故B错误;
C.蛋白质中含N元素,燃烧除二氧化碳、水,还生成含N物质,而蔗糖、纤维素、淀粉完全燃烧的产物都只有二氧化碳和水,故C错误;
D.煤干馏可以得到煤焦油,煤焦油中含有甲烷、苯和氨等重要化工原料,属于化学变化;煤的气化是将其转化为可燃气体的过程,主要反应为碳与水蒸气反应生成H2、CO等气体的过程,有新物质生成,属于化学变化,故D错误.
故选A.点评:
本题考点: 煤的干馏和综合利用;清洁能源;淀粉的性质和用途;纤维素的性质和用途;氨基酸、蛋白质的结构和性质特点.
考点点评: 本题考查能源和电池的分类和有机物的性质等知识,难度不大.要注意平时知识的积累.1年前查看全部
- 怎么制作氧气?怎么过氧化氢加上锌锰电池里的东西 然后把导管塞进水利 没有气泡?吧有火星的木材放在瓶口 也不会复燃?
 imcser1年前1
imcser1年前1 -
 蓝天绿草2008 共回答了23个问题
蓝天绿草2008 共回答了23个问题 |采纳率91.3%因为锌锰电池里的二氧化锰纯度不高,使得催化过氧化氢,产生的氧气量不足,所以出现上述你说的情况.1年前查看全部
- 锌锰电池(俗称干电池)在生活中的用量很大.锌锰电池的构造如图1所示.
锌锰电池(俗称干电池)在生活中的用量很大.锌锰电池的构造如图1所示.

(1)锌锰电池所使用的下列材料中,属于金属材料的是______ (填字母序号).
A.铜帽B.碳棒C.锌筒D.密封塑料
(2)金属制品在空气中放置易生锈,铁生锈的条件是______,废旧电池铜帽会生成一些绿色的铜锈,其主要成分为是Cu2(OH)2CO3,则铜生锈还必须有______参与.
(3)利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件已略去):2Cu+2H2SO4+O2
2CuSO4+2H2O△ .
①过程III中有气体产生,反应的化学方程式为______.
②A~E中含铜、锌两种元素的物质有______ (填字母序号). 焱冰琳雪001年前1
焱冰琳雪001年前1 -
 寻觅那片海 共回答了15个问题
寻觅那片海 共回答了15个问题 |采纳率93.3%解题思路:(1)根据金属材料包含纯金属和合金进行解答;
(2)根据铁生锈的条件是与氧气和水同时接触以及质量守恒定律分析铜生锈的条件进行解答;
(3)根据化合物中各元素的化合价的代数和为0进行解答;
(4)根据过滤可用于分离难溶性固体以及锌和硫酸铜反应生成铜和硫酸锌、锌和硫酸反应生成硫酸锌和氢气进行解答.(1)金属材料包含纯金属和合金,所以属于金属材料的是铜帽、锌筒;
(2)铁生锈的条件是与氧气和水同时接触,由质量守恒定律以及铜锈其主要成分为是Cu2(OH)2CO3,可知铜锈中含有碳元素,所以铜生锈还必须有二氧化碳参与;
(3)根据化合物中各元素的化合价的代数和为0和氧元素的化合价为-2价,氢元素的化合价为+1价,可知MnOOH中锰元素的化合价为+3;
(4)①锌和硫酸铜反应生成铜和硫酸锌、锌和硫酸反应生成硫酸锌和氢气,所以过程Ⅱ中有气体发生反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑;
②废铜帽中含有铜、锌元素,溶液A中含有硫酸铜和硫酸锌,含有铜、锌元素;加入的B是锌,能与硫酸铜反应生成硫酸锌和铜,故C中含有铜和锌.
故答案为:(1)AC;
(2)与氧气、水同时接触;CO2;
(3)①Zn+H2SO4=ZnSO4+H2↑,AC.点评:
本题考点: 金属材料及其应用;金属锈蚀的条件及其防护;物质的相互转化和制备;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了金属的有关性质以及应用,完成此题,可以依据已有的知识进行.1年前查看全部
- 对如图的锌锰电池,下列说法正确的是( )
对如图的锌锰电池,下列说法正确的是( )
A.MnO2是氧化剂,被氧化
B.碳棒为负极、锌筒为正极
C.放电过程中NH4+向锌极移动
D.负极反应为:Zn-2e-+2OH-═Zn(OH)2 招菜猫1年前1
招菜猫1年前1 -
 family1 共回答了20个问题
family1 共回答了20个问题 |采纳率100%解题思路:A、二氧化锰做氧化剂得到电子,被还原发生还原反应;
B、原电池中,失电子的电极作负极,得电子的极是正极;
C、原电池中,电解质中的阳离子移向正极;
D、原电池中,负极上发生失电子的氧化反应.A、MnO2是氧化剂,氧化剂在反应中被还原,故A错误;
B、原电池中,失电子的电极锌作负极,得电子的极石墨是正极,故B错误;
C、原电池中,电解质中的阳离子NH4+移向石墨电极,故C错误;
D、原电池中,负极上发生失电子的氧化反应:Zn-2e-+2OH-═Zn(OH)2,故D正确.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池原理,根据原电池正负极上得失电子来分析解答即可,难度不大.1年前查看全部
- 如图所示为普通锌锰电池的组成和结构示意图,其中负极材料是( )
 如图所示为普通锌锰电池的组成和结构示意图,其中负极材料是( )
如图所示为普通锌锰电池的组成和结构示意图,其中负极材料是( )
A.石墨棒
B.MnO2
C.NH4Cl
D.锌筒 明天会快乐1年前1
明天会快乐1年前1 -
 xyg1j 共回答了26个问题
xyg1j 共回答了26个问题 |采纳率96.2%解题思路:普通锌锰电池中锌为负极,石墨为正极,MnO2的作用是吸收正极放出的H2,为电解池的重要组成部分.普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-=2NH3+H2,锌是负极,石墨棒是正极,故选D.
点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题以原电池原理考查了锌锰干电池的构造,为高考热点,本题较基础也联系生活实际,让学生从生活中学习化学,并用化学知识解释生活,根据原电池原理来解答即可,难度不大.1年前查看全部
- 为什么锌锰电池的正极在酸性和碱性中是不同的,为什么?
 睿91年前2
睿91年前2 -
 linxizui 共回答了15个问题
linxizui 共回答了15个问题 |采纳率100%酸性环境中的正极:
MnO2 + e + H+ = MnO(OH)
碱性环境中的正极:
MnO2 + 2e + 2H2O = Mn(OH)42-
原因是MnO(OH)在碱性环境下会继续反应,还原为+2价.1年前查看全部
- 锌锰电池的正极反应式
 guyu09071年前1
guyu09071年前1 -
 mike1229 共回答了24个问题
mike1229 共回答了24个问题 |采纳率91.7%2MnO2+2H2O+2e-=2MnOOH+2OH-1年前查看全部
- 一个关于锌锰电池放电,电池的总反应方程式式是Zn+MnO2+NH4离子=Zn 离子+Mn2O3+NH3+H2O
一个关于锌锰电池放电,电池的总反应方程式式是Zn+MnO2+NH4离子=Zn 离子+Mn2O3+NH3+H2O
锌锰电池放电,电池的总反应方程式式是Zn+MnO2+NH4离子=Zn 离子+Mn2O3+NH3+H2O在此电池放电视,正极碳棒上发生反应的物质
A Zn B 碳棒 C MnO2和NH4离子 DZn离子和NH4离子
正方向是放电,逆方向是充电。 一笑醉uu1年前1
一笑醉uu1年前1 -
 misha1973 共回答了16个问题
misha1973 共回答了16个问题 |采纳率93.8%电池放电是正极得电子,可以根据电子得失判断,MnO2在放电反应中得电子被还原,因此选C.1年前查看全部
- 水和氧化锌电解液和锌锰电池区别
 520_01291年前1
520_01291年前1 -
 四川人在重庆 共回答了13个问题
四川人在重庆 共回答了13个问题 |采纳率92.3%锌锰电池:
以二氧化锰为正极,锌为负极,氯化铵水溶液为主电解液的原电池
(2010•肇庆二模)“纸质电池”的纸片内充入的是水和氧化锌组成的电解液;纸的一边镀锌、另一边镀二氧化锰;电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH).下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化作用
C.当0.1mol Zn完全溶解时,流经电解液的电子个数为1.204×1023
D.电池正极反应式为:2MnO2+2e-+2H2O═2MnO(OH)+2OH-
最佳答案
解答:解:A、从电池反应可知,锌被氧化,失去电子,所以是负极,故A错误;
B、该电池反应中二氧化锰发生了还原反应,二氧化锰得到电子,被还原,为原电池的正极,故B错误;
C、当有0.1mol锌溶解时,失去电子数为 0.1×2×6.02×1023=1.204×1023,但电子由负极经外电路流向正极,不流经电解液,故C错误;
D、电池的正极反应式为MnO2+H2O+e-=MnO(OH)+OH-,或2MnO2+2e-+2H2O=2MnO(OH)十2OH-,故D正确.
故选D.
收起答案1年前查看全部
- 怎样将锌锰电池中,电解质中的二氧化猛提炼出来?
 wanle21年前1
wanle21年前1 -
 直到成功 共回答了13个问题
直到成功 共回答了13个问题 |采纳率92.3%过滤!
分离液体和固体1年前查看全部
- 锌锰电池正极为什么不是锌离子得电子而是铵根离子 是不是铵根离子和锌离子放电性不同呢?
 wangryi1年前1
wangryi1年前1 -
 傲月xy 共回答了15个问题
傲月xy 共回答了15个问题 |采纳率80%铵根离子和锌离子得电子能力是不同,铵根离子显酸性,本质是氢离子得电子,但与这无关.
锌锰电池中锌筒做负极,带铜帽的碳棒做正极,糊状的NH4Cl做电解质溶液,还有MnO2做吸氢剂.
真实的反应情况比较复杂,
但总反应可简化为:Zn +2NH4+==Zn2+ +2NH3 +H2
负极反应为:Zn-2e-==Zn2+,
正极反应为:2NH4+ +2e-==2NH3 +H2,
所以是负极锌筒失电子,正极NH4+得电子
真实的情况还包括:生成的NH3并没有释放出来,它与生成的锌离子结合成稳定的络合物,还有H2被MnO2吸收,2MnO2+H2=Mn2O3+H2O,但这些都不是很重要的.
重要的还是上面经过简化的反应.1年前查看全部
- 〔化学--选修2:化学与技术〕锌锰电池(俗称干电池)在生活中的用量很大.两种锌锰电池的构造如图(a)所示.回答下列问题:
〔化学--选修2:化学与技术〕
锌锰电池(俗称干电池)在生活中的用量很大.两种锌锰电池的构造如图(a)所示.回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2═Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是______,电解质的主要成分是______,正极发生的主要反应是______.
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是______.
(2)图(b)表示回收利用废旧普通锌锰电池工艺(不考虑废旧电池中实际存在的少量其他金属).
①图(b)中产物的化学式分别为A______,B______.
②操作a中得到熔块的主要成分是K2MnO4.操作b中,绿色的K2MnO4溶液反应生成紫色溶液和一种黑褐色固体,该反应的离子方程式为______.
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是______(填化学式). Best泪1年前1
Best泪1年前1 -
 legalraymond2007 共回答了13个问题
legalraymond2007 共回答了13个问题 |采纳率92.3%解题思路:(1)①根据电池反应判断正负极和电解质;二氧化锰和铵根离子在正极发生反应;
②根据碱性锌锰电池的特点分析;
(2)①根据电池的材料分析;
②根据已知反应物和产物,再利用元素守恒
③K2MnO4溶液中阴极产物的判断,根据溶液中阳离子得电子能力分析.(1)根据化学方程式Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,反应中Zn被氧化,为电池负极锌,氯化铵是电解质的主要成分,二氧化锰和铵根离子在正极发生反应,MnO2+NH4++e-=MnOOH+NH3.与普通锌锰电池相比,碱性锌锰电池的优点及其理由是碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高;
故答案为:①锌;NH4Cl;MnO2+NH4++e-=MnOOH+NH3②碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高.
(2)废电池经机械分离后,加水溶解后溶液中的成分是氯化铵,再加稀盐酸Zn溶解生成氯化锌,因此浓缩结晶得到氯化铵和氯化锌.氯化铵不稳定,受热易分解,所以B为氯化铵,A为氯化锌.绿色的K2MnO4溶液发生反应后生成紫色的高锰酸钾溶液和黑褐色的二氧化锰,该反应的离子方程式为3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-.采用惰性电极电解K2MnO4溶液,阴极氢离子得电子生成氢气.故答案为:①ZnCl2 NH4Cl②3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-l③H2点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查了化学与技术、原电池原理、电极方程式的书写,综合性较强.1年前查看全部
大家在问
- 1一本故事书,每天看全书总页数的十二分之一,看了7天后,还有100页没看,这本书共有多少页?
- 2书名:古文观止 作者:吴楚材、吴调侯
- 3(1)变成一般疑问句,(2)对划线部分进行提问
- 4右图是初中阶段常见物质的转化关系.(只省略了部分生成物)
- 51、离子是否一定能溶解在水中2、不是离子是否一定不能溶解在水中3、2H2O2==催化剂==2H2O+O2↑是不是氧化还原
- 6①饱和一元醇的通式②饱和二元醇的通式③饱和三元醇的通式④芳香一元醇的通式⑤一定量的乙醇在氧气不足的情况下燃烧,的CO,C
- 7在与铁路平行的公路上,有一个行人和一个骑自行车的人同向前进,行人每秒钟走1米,骑车人每秒钟行3米,在铁路上有一列火车从他
- 8标幺值计算中,短路电流计算中一个数有三个小数点,
- 9工业废水含氢氧化钠低于5%以下,普通槽罐车运输可以运输吗?(没有危险品运输证的)
- 10氢氧化钠是否变质
- 11药用氢氧化钠是否是危险品药用氢氧化钠(辅料)是否是危险品?
- 126分之1乘(5-3分之2)=?最好写在纸上
- 13长为1,2,3,4,5的四根木条,选其中三根组成三角形,有几种选法?为什么?
- 14地球上有几只动物?
- 15土.日.月.退.加什么字组成四个新字

