离子化合物中,离子电荷和离子半径怎样影响离子晶体的性质
 鹤顶红2022-10-04 11:39:543条回答
鹤顶红2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 娃哈哈amb 共回答了15个问题
娃哈哈amb 共回答了15个问题 |采纳率86.7%- 电荷越高,离子键越强;
半径越小,离子键越强;
离子键越强,熔点、沸点越高;硬度越大,水溶性越小. - 1年前
 墨馨 共回答了3个问题
墨馨 共回答了3个问题 |采纳率- 同一周期半径越小,电荷越大,还原性越小,离子键越强
- 1年前
 bj遗梦 共回答了3个问题
bj遗梦 共回答了3个问题 |采纳率- 构成化合物的离子,电荷数越大,半径越小,离子键就越强;相应的,晶格能就越大,晶体的熔、沸点就越高。
- 1年前
相关推荐
- 什么是离子化合物?什么是共价化合物?他们之间有什么区别
什么是离子化合物?什么是共价化合物?他们之间有什么区别
他们所形成的化合物性质如何?
 爱吃牛顿的蛤蜊1年前1
爱吃牛顿的蛤蜊1年前1 -
 我说过我想做 共回答了20个问题
我说过我想做 共回答了20个问题 |采纳率95%阴阳离子由于静电作用而结合形成的化合物叫做离子化合物;原子之间由于共用电子对形成相互作用而使原子结合成的化合物叫做共价化合物.
区别是离子化合物是电解质,而共价化合物是绝缘体,不导电.
一般金属与非金属形成的化合物是离子化合物,而两种非金属形成的是共价化合物.这与他们的失电子的能力有关.1年前查看全部
- 下列说法正确的是( )A.单质分子中一定含有共价键B.离子化合物中一定没有共价键C.由非金属元素组成的化合物不一定只含
下列说法正确的是( )
A.单质分子中一定含有共价键
B.离子化合物中一定没有共价键
C.由非金属元素组成的化合物不一定只含共价化键
D.O2、O3、O22-属于同素异形体 西充高万1年前1
西充高万1年前1 -
 将建森 共回答了16个问题
将建森 共回答了16个问题 |采纳率100%解题思路:A、稀有气体分子中不含化学键;
B、离子化合物是含有离子键的化合物;
C、氯化铵中含有离子键和共价键;
D、同素异形体是由同种元素组成的性质不同的单质.A、单质分子中不一定均含有化学键,如稀有气体分子中就不含化学键,故A错误;
B、离子化合物是含有离子键的化合物,可以含有共价键,如氢氧化钠是含有离子键和共价键的离子化合物,故B错误;
C、铵盐由非金属元素组成的化合物,其中含有离子键和共价键,由非金属元素组成的化合物不一定只含共价键,故C正确;
D、同素异形体是由同种元素组成的性质不同的单质,氧气和臭氧属于同素异形体,故D错误.
故选C.点评:
本题考点: 化学键;同素异形体.
考点点评: 本题考查学生常见的基本概念知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 下列说法中正确的是( )A.离子化合物中只存在离子键B.含有离子键的化合物一定是离子化合物C.化学键只存在于化合物中D
下列说法中正确的是( )
A.离子化合物中只存在离子键
B.含有离子键的化合物一定是离子化合物
C.化学键只存在于化合物中
D.非金属单质一定含有共价健 璐璐爱马天宇1年前1
璐璐爱马天宇1年前1 -
 marygoodgirl 共回答了17个问题
marygoodgirl 共回答了17个问题 |采纳率88.2%解题思路:A、离子化合物中可能含有共价键;
B、含有离子键的化合物一定是离子化合物;
C、化学键可能存在于单质中;
D、非金属单质不一定含有共价键.A、离子化合物中可能含有共价键,如:氢氧化钠中氢原子和氧原子之间存在共价键,故A错误.
B、离子键只存在于离子化合物中,故B正确.
C、化学键不仅存在于化合物中还可能存在于单质中,如:氢气中氢原子和氢原子之间存在共价键,故C错误.
D、非金属单质不一定存在共价键,如:稀有气体中不存在化学键,只存在分子间作用力,故D错误.
故选B.点评:
本题考点: 离子化合物的结构特征与性质;共价键的形成及共价键的主要类型.
考点点评: 本题考查了物质与化学键的关系,难度不大,易错选项是D,注意:不是所有物质都含化学键,如稀有气体中不存在化学键,只存在分子间作用力.1年前查看全部
- 与钙形成离子化合物与水反应生成可燃性气体方程式为
 qpzm20031年前1
qpzm20031年前1 -
 韩寒军师刘建燃 共回答了23个问题
韩寒军师刘建燃 共回答了23个问题 |采纳率95.7%最简单的由离子构成的电石:碳化钙CaC2,与水反应生成氢氧化钙和乙炔气,方程式为CaC2 + 2H2O == Ca(OH)2 + C2H2气体上箭头,1年前查看全部
- 化学知识+判断正误1.蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却2.怎么区分工价化合物和离子化合物啊?
 166watin1年前4
166watin1年前4 -
 于种 共回答了21个问题
于种 共回答了21个问题 |采纳率95.2%1,错误.发生液滴飞溅,是因为局部受热不均.这是没有用玻璃棒搅拌的原因.决不能加水冷却,否则可能使蒸发皿炸裂 ,应该用玻璃棒搅拌,并稍微将酒精灯移开一点.
2.1、共价化合物发生在非金属原子之间而离子化合物却发生在典型的非金属原子与典型的金属原子之间.
2、共价化合物通过共用电子对形成稳定结构,这时形成了一个整体,就是我们学过的分子.离子化合物在常温常压下是离子的堆集没有一个个的分子.(只有在蒸气状态时才有分子存在)
3、共价化合物的分子彼此间引力较小所以在常温常压下往往易于扩散,形成气体,而离子化合物都是由许多带不同电荷的离子以静电引力彼此吸引着、引力较大,所以在常温常压下往往形成固体.
离子化合物由离子键连接,没有独立结构,多为空间网状结构,如氯化钠.
质硬而脆,易分层,熔沸点较高.
共价化合物:
分子晶体:由分子间作用力连接(分子内部由共价键连接),有分子结构,一般熔沸点相对较低.
原子晶体:由共价键连接,质硬,熔沸点高
区别是:
离子化合物都是电解质,且在水溶液和熔融状态下都可以导电
共价化合物不都是电解质,若为电解质的在熔融状态下不可导电
属氧化物和水化物(碱)一般是离子化合物,如Fe2O3、MnO2、NaOH、Cu(OH)2
金属-非金属化合物一般是离子化合物,如NaCl、Mg3N2、KI
金属-非金属酸盐一般也是离子化合物,如K2SO4、CaCO3、AgNO3
非金属氧化物和水化物(酸)一般是共价化合物,如SO3、NO2、H3PO4、HIO3
非金属-非金属化合物常是共价化合物,如HCl、PCl3、SF6
金属性越强、非金属性越强,化合物的离子性越强
随着金属性逐渐减弱、非金属性逐渐减弱,化合物倾向于共价键方式结合
几个例外,AlCl3、Hg2Cl2、SnCl4、PbAc2(醋酸铅)等是共价化合物1年前查看全部
- 下列物质中含有共价键的离子化合物是( )
下列物质中含有共价键的离子化合物是( )
A. Ba(OH)2
B. CaCl2
C. H2O
D. H2 Johney19821年前2
Johney19821年前2 -
 寻觅觅不知 共回答了21个问题
寻觅觅不知 共回答了21个问题 |采纳率90.5%解题思路:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,据此分析解答.A.氢氧化钡中钡离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,为含有共价键的离子化合物,故A正确;
B.氯化钙中氯离子和钙离子之间只存在离子键,故B错误;
C.水分子中O原子和H原子之间只存在共价键,为共价化合物,故C错误;
D.氢气分子中H原子之间只存在共价键,为单质,故D错误;
故选A.点评:
本题考点: 离子化合物的结构特征与性质;共价键的形成及共价键的主要类型.
考点点评: 本题考查了化学键和化合物的关系,根据物质中存在的化学键及物质的构成元素种类数分析解答即可,题目难度不大.1年前查看全部
- 如何区分离子化合物和共价化合物RT,总说.
 想唱就唱唱得响亮1年前2
想唱就唱唱得响亮1年前2 -
 kffamu 共回答了18个问题
kffamu 共回答了18个问题 |采纳率94.4%简单的方法主要看物质的组成元素,如果物质中有金属元素,那一般都会是离子化合物,如果都是又非金属构成的,那一般是共价化合物,不过也有例外的,比如硝酸铵等.如果说的专业一点的话就是离子化合物有得电子和失电子,而共价化合物则是电子公用的.具体的由物质的电子式可以看出来.1年前查看全部
- ZnS.CuS不是电解质?不是离子化合物?
 zpzpzp881年前2
zpzpzp881年前2 -
 雪域南风 共回答了17个问题
雪域南风 共回答了17个问题 |采纳率100%ZnS、CuS是电解质,也是离子化合物.
因为它们在熔融状态下能导电,所以都是电解质.他们都是以离子键结合,所以都是离子化合物.1年前查看全部
- 某些含有原子团的离子化合物有?希详细
 sundy5731年前1
sundy5731年前1 -
 御天者 共回答了17个问题
御天者 共回答了17个问题 |采纳率76.5%碳酸根:CO3 -2价 硫酸根:SO4 -2价 氢氧根:OH -1价 硝酸根:NO3 -1价 铵根:NH4+1价 碳酸氢根:HCO3 -1价 硫酸氢根:HSO4 -1价 磷酸根:PO4 -3价 亚硝酸根:NO2 -1价 亚硫酸根:SO3 -2价 氯酸根:ClO3 -1价1年前查看全部
- 在钠 碳 硫 硅 四种元素中 可以形成离子化合物的是
在钠 碳 硫 硅 四种元素中 可以形成离子化合物的是
a 钠和碳 b 钠和硫 c 碳和硫 d 硅和碳
下列微粒结构跟氩原子结构相同的是
a 氯离子 b镁离子 c铝离子 d钾离子
核电荷数分别是下列数值的各组元素中 能形成XY2 共价化合物的是
a 1和16 b12和17 c 3和8 d6和16
下列和种元素能成离子化合物的是
a C和O b P和O c H和N d Mg和Br 伊凡1年前3
伊凡1年前3 -
 iamwsf 共回答了20个问题
iamwsf 共回答了20个问题 |采纳率85%1、a,碳化钠是不存在的因为纳形成化合物时必须失去电子,形成极性离子.而碳则是形成共价键.所以在没有其他元素参与的情况下,炭化钠是不可能存在的.除非在碳已经形成了其他的基团,如碳酸根之后,再与钠结合.
b、钠和硫.可以形成硫化钠.是离子化合物
c、都为非金属.虽然可以生成二硫化碳.但是共价化合物
d、理由同上.故此题选b
2、此题考察的是离子的结构,首先氩原子结构为288结构(即由电子层从内到外的电子数)
a、氯原子得电子变为离子为288结构.正确
b、镁原子失电子变为离子.应为28结构.错误
c、铝原子失电子变为离子.为28结构.错误
d、钾原子失电子变为离子.为288结构.正确.
故此题选a、d
3、核电荷数=原子序数
所以a、为氢原子和硫原子.可形成硫化氢(H2S)为共价化合物.正确
b、为镁和氯.形成的化合物为二氯化镁(MgCl2)为离子化合物.错误
c、为锂和氧.可形成氧化锂(LiO)过氧化锂(Li2O2)(与过氧化钠相似)超氧化锂(LiO2)都为离子化合物.错
d、碳和硫.可形成二硫化碳(CS2).共价化合物.
不过.要有XY2形的.只有D正确.故选D
4、a、碳和氧生成二氧化碳.为共价化合物
B、磷和氧.生成五氧化二磷(P2O5)共价化合物
C、氢和氮.可生成氨气(NH3).共价化合物
D、镁和溴.可生成MgBr2(溴化镁)离子化合物
故选D1年前查看全部
- 化学键中离子键与共价键的关系1.离子键与共价键的关系?2.离子化合物是不是只含有离子键?3.共价化合物可能含有离子键吗?
 xgtddfj1年前4
xgtddfj1年前4 -
 syviarunning 共回答了17个问题
syviarunning 共回答了17个问题 |采纳率88.2%离子化合物可能只有离子键,也可能有共价键,如NH4Cl
共价化合物只含有共价键1年前查看全部
- X元素的一个原子失去2个电子,电子转移到Y元素的两个原子中去,形成离子化合物,下面说法正确的是.
X元素的一个原子失去2个电子,电子转移到Y元素的两个原子中去,形成离子化合物,下面说法正确的是.
A、X的原子序数比Y大
B、X的最外层电子数比Y多
C、X的原子半径比Y大.
D、X的族序数比Y小 peonypeony1年前1
peonypeony1年前1 -
 swf1819 共回答了12个问题
swf1819 共回答了12个问题 |采纳率100%D1年前查看全部
- 离子化合物AB,阳离子比阴离子少一个电子层,1molAB含有12mol电子
离子化合物AB,阳离子比阴离子少一个电子层,1molAB含有12mol电子
该化合物的名称________
其形成过程__________________ fmjlynn1年前3
fmjlynn1年前3 -
 metrelive 共回答了12个问题
metrelive 共回答了12个问题 |采纳率91.7%阴离子-x价,阳离子+x价
且A与B的原子序数之和是 12
阳离子电荷数少于阴离子
阳离子电荷数<6
是H+或Li+ 可能性较大
化合物是
LiF ,氟化锂
形成过程就是电子式
·· ··
Li·+·F :→ Li+[:F :]-
·· ··1年前查看全部
- 只有离子化合物参加的反应才叫离子反应吗
只有离子化合物参加的反应才叫离子反应吗
为什么氢气还原氧化铜的反应不是离子反应,氧化铜不是离子化合物吗 妖艳的烟花雨1年前1
妖艳的烟花雨1年前1 -
 BK789 共回答了16个问题
BK789 共回答了16个问题 |采纳率87.5%在水溶液中,有离子参加或有离子生成的反应,属于离子反应.(不一定是离子化合物)
氢气还原氧化铜的反应不是在水溶液中进行,不属于离子反应1年前查看全部
- 在配位离子化合物中中心原子空轨道指什么(如何判断有无空轨道) 如Na+,Al+.
 nunoiss1年前1
nunoiss1年前1 -
 dearok 共回答了23个问题
dearok 共回答了23个问题 |采纳率87%中心原子空轨道指中心原子没有电子的轨道
如Na+,由于Na是第三周期元素,有spd轨道,3s轨道有1个电子,3p轨道没有电子、3d轨道也没有电子,所以有3+5=8个空轨道1年前查看全部
- 为什么高温可以使离子化合物导电离子晶体本来是不导电的,但是为什么在高温下离子晶体会导电了呢,是因为融化了产生正离子和负离
为什么高温可以使离子化合物导电
离子晶体本来是不导电的,但是为什么在高温下离子晶体会导电了呢,是因为融化了产生正离子和负离子才导电的吗?若一直都是晶体会不会导电呢? wap25111年前2
wap25111年前2 -
 一陆顺风 共回答了14个问题
一陆顺风 共回答了14个问题 |采纳率100%导电的原因是有自由移动的阴阳离子
温度达到离子化合物的熔点后,熔化而断裂离子键形成阴阳离子
不会1年前查看全部
- 氧化钠与水反应离子方程式氧化钠拆不拆?氧化钠不是离子化合物么?不拆仅仅是因为规定?
 wycdos1年前3
wycdos1年前3 -
 qzhwb888 共回答了11个问题
qzhwb888 共回答了11个问题 |采纳率90.9%不能拆,以离子状态存在的才能拆.固体氧化钠不能电离出离子.熔融状态下可以拆1年前查看全部
- 离子化合物和共价化合物的本质区别,还有辨别方法,还有为什么NaCl只有化学式而不是分子式,化学式和分子式的区别
 发飞随风1年前1
发飞随风1年前1 -
 chenini 共回答了17个问题
chenini 共回答了17个问题 |采纳率76.5%离子化合物和共价化合物的本质区别是熔融状态下是否导电,不能导电的是共价化合物,能导电的是离子化合物.
辨别方法:绝大多数的盐和强碱是离子化合物,所有的含氧酸,弱碱,弱酸是共价化合物
化学式直接表示了物质的结构,而分子式仅仅表明分子中所含元素的种类和数量,并不表示出分子的结构特点!
NaCl是离子化合物,不是分子,自然没有分子式1年前查看全部
- 已知A、B是第一周期以外的短周期元素,它们可以形成离子化合物AmBn.在此化合物中,所有离子均能形成稀有气体原子的稳定结
已知A、B是第一周期以外的短周期元素,它们可以形成离子化合物AmBn.在此化合物中,所有离子均能形成稀有气体原子的稳定结构.若A的核电荷数为a,则B的核电荷数不可能是( )
A. a+8-m-n
B. a+18-m-n
C. a+16-m-n
D. a-m-n 爱你52331年前1
爱你52331年前1 -
 dzyx 共回答了12个问题
dzyx 共回答了12个问题 |采纳率83.3%解题思路:A、B是第2或第3周期中的两种元素,它们可形成离子化合物AmBn,则X为金属元素,离子为An+,Y为非金属元素,离子为Bm-,均有稀有气体原子的电子结构,讨论金属与非金属元素是否同周期、核外电子数目相等,以此来解答.A、B是第2或第3周期中的两种元素,它们可形成离子化合物AmBn,则X为金属元素,离子为An+,Y为非金属元素,离子为Bm-,离子均有稀有气体原子的电子结构,
①若离子的核外电子数目相同,设B的原子序数为x,则a-n=x+m,即x=a-n-m;
②若金属离子、非金属离子在同周期,离子的核外电子数目相差8,则a-n+8=x+m,即x=a+8-m-n;
③若金属离子在第2周期,阴离子在第3周期,离子的核外电子数目相差16,即x=a+16-m-n;
显然不可能为a+18-m-n,
故选B.点评:
本题考点: 原子结构与元素的性质.
考点点评: 本题考查离子的关系及原子的原子序数,明确可能的存在形式是解答本题的关键,利用电子数寻找关系式即可解答.1年前查看全部
- 离子化合物都是成离子晶体吗
 轻柔羽毛1年前1
轻柔羽毛1年前1 -
 MELSONG 共回答了17个问题
MELSONG 共回答了17个问题 |采纳率94.1%答:离子化合物都是离子晶体.
离子化合物:由阳离子和阴离子构成的化合物.常见有:1、活泼金属(指第一和第二主族的金属元素)与活泼的非金属元素(指第六和第七主族的元素)之间形成的化合物(但也不全是,比如AlCl3就是共价化合物);
2、金属元素与酸根离子之间形成的化合物.(酸根离子如硫酸根离子SO42-、硝酸根离子NO3-、碳酸根离子CO32-等等);
3、铵根离子(NH4+)和酸根离子之间,或铵根离子与非金属元素之间,例如NH4Cl、NH4NO3.
离子化合物是通过离子键形成的化合物.
离子晶体:由正、负离子或正、负离子集团按一定比例通过离子键结合形成的晶体.
离子化合物都是强电解质.
(希望可以帮到您,)1年前查看全部
- 氯化铝,氯化铁是离子化合物还是共价化合物
 与君徜徉1年前12
与君徜徉1年前12 -
 zbbmmm 共回答了20个问题
zbbmmm 共回答了20个问题 |采纳率90%氯化铝和氯化铁均为共价化合物1年前查看全部
- 化学——电解质(高中知识)①强酸是共价化合物?②强碱是离子化合物?③大多数盐是离子化合物?④弱酸是共价化合物?⑤弱碱是共
化学——电解质(高中知识)
①强酸是共价化合物?
②强碱是离子化合物?
③大多数盐是离子化合物?
④弱酸是共价化合物?
⑤弱碱是共价化合物或者是离子化合物?
(氨水和氢氧化铝是共价化合物?氢氧化铁是离子化合物?)
不要过于繁琐的补充
麻烦正确简明的答案和简单的补充
氢氧化铝到底是共价化合物还是离子化合物? mengwenshaohan1年前4
mengwenshaohan1年前4 -
 mouseyao 共回答了11个问题
mouseyao 共回答了11个问题 |采纳率90.9%1.是
2.是
3.是,Pb(Ac)2,HgCl2等少数除外
4.不一定,如果是有机酸,且含多个酸性基团,可能是离子化合物,因为只要有离子键就是离子化合物
5.一水合氨是共价化合物,氢氧化铁也是共价化合物1年前查看全部
- 下列关于电解质的说法正确的是( ) A.强电解质溶液的导电性一定比弱电解质溶液的导电性强 B.强电解质都是离子化合物,
下列关于电解质的说法正确的是( ) A.强电解质溶液的导电性一定比弱电解质溶液的导电性强 B.强电解质都是离子化合物,而弱电解质都是共价化合物 C.强电解质在稀的水溶液中全部以离子的形态存在 D.水溶液中导电能力差的电解质一定是弱电解质  笑问客81361年前1
笑问客81361年前1 -
 涯恋 共回答了20个问题
涯恋 共回答了20个问题 |采纳率90%A.溶液的导电能力与离子的浓度有关,浓度越大导电能力越强,浓度越小导电能力越弱.强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物,溶液的导电能力与电解质的强弱无关,如硫酸钡是强电解质,难溶于水,离子浓度小,导电能力弱,CH 3 COOH为弱电解质,易溶于水,当乙酸浓度比较大时,离子的浓度大,导电能力强,故A错误;
B.氯化氢为强电解质,但氯化氢为共价化合物,氢氧化铝为弱电解质,但它是离子化合物,故B错误;
C.强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物.即溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物,故C正确;
D.水溶液中导电能力差的电解质不一定为弱电解质,如硫酸钡是强电解质,难溶于水,离子浓度小,导电能力弱,故D错误;
故选C.1年前查看全部
- 离子化合物在固态时为离子晶体,液态气态时呢?还是离子晶体吗?
离子化合物在固态时为离子晶体,液态气态时呢?还是离子晶体吗?
如果不是又是什么? yuleispeed1年前2
yuleispeed1年前2 -
 摄风 共回答了20个问题
摄风 共回答了20个问题 |采纳率95%物质在液态、气态时就已经不是晶体了.还谈什么离子晶体?1年前查看全部
- LiBH4是一种储氢材料,属于离子化合物.下列有关说法正确的是 A,LiBH4中B的化合价是—3 B,B与Al同主族,均
LiBH4是一种储氢材料,属于离子化合物.下列有关说法正确的是 A,LiBH4中B的化合价是—3 B,B与Al同主族,均为金属元素 C,LiBH4中存在离子键和共价键 D,Li的离子半径大于H离子半径 主要A和C不太懂
 牧师裘1年前1
牧师裘1年前1 -
 fantastic_ooo 共回答了16个问题
fantastic_ooo 共回答了16个问题 |采纳率100%A B的化合价是+3,Li是+1,而H是-1
C 正确,B-H是共价键1年前查看全部
- 什么是 共价键 离子键 极性键 非极性键 共价化合物 离子化合物 说通俗些
 闲-饮1年前5
闲-饮1年前5 -
 冰豆浆 共回答了21个问题
冰豆浆 共回答了21个问题 |采纳率90.5%1.两个或多个原子共同使用它们的外层电子,在理想情况下达到电子饱和的状态,由此组成比较稳定的化学结构叫做共价键
2.离子键阴离子,阳离子间通过静电作用形成的化学键.
3.由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的
原子一方,因而吸引电子能力较弱的原子一方相对的显正电性.这样的共价键
叫做极性共价键
4.由同种元素的原子间形成的共价键,叫做非极性键1年前查看全部
- 关于化学键的下列叙述中,正确的是( ) A.离子化合物可能含共价键 B.共价化合物可能含离子键 C.离子化合物中只含离
关于化学键的下列叙述中,正确的是( ) A.离子化合物可能含共价键 B.共价化合物可能含离子键 C.离子化合物中只含离子键 D.离子化合物中一定含有金属离子  chriszyzy1年前1
chriszyzy1年前1 -
 danta2001 共回答了13个问题
danta2001 共回答了13个问题 |采纳率92.3%A.离子化合物可能含共价键,如NaOH,故A正确;
B.共价化合物只含有共价键,故B错误;
C.离子化合物可能含有共价键,如NaOH,故C错误;
D.离子化合物不一定含有金属离子,如铵盐,故D错误.
故选A.1年前查看全部
- 离子化合物离子得失电子数如何计算,给个方法吧!
 fff8206241年前1
fff8206241年前1 -
 shlspace 共回答了17个问题
shlspace 共回答了17个问题 |采纳率94.1%只看升高或降低的,不可重复计算,与方程式系数无关,只看角标,下面举一个较复杂的例子,这个搞懂其他就OK
2Na2O2+2CO2=2Na2CO3+O2,假设1molNa2O2,则生成0.5molO2,Na2O2中每个氧原子的化合价为-1,O2中每个氧原子化合价为0,0.5molO2乘以角标2等于1,1再乘以化合价变化1,则转移1mol电子,切记只能计算得或失电子,不可重复计算1年前查看全部
- (18分)根据下图回答问题:(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离子位于8个
(18分)根据下图回答问题:
(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离
子位于8个顶点,该化合物中阳、阴离子的个数比是_______________。
(2)B图表示构成NaCl晶体的一个晶胞,通过想像与推理,可确定一个NaCl晶胞中含Na +
和Cl - 的个数分别为_______________、_______________。
(3)C图是金刚石的晶体结构,C 60 、金刚石和石墨三者的关系是_______________。
硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是_______________N A 个。二氧化硅的结构相当于在硅晶体结构中每个硅—硅单键之间插入一个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上原子数目是_______________。A.同分异构体 B.同素异形体 C.同系物 D.同位素
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为_______________,“C—C”键数为_______________。
(5)足球烯C 60 结构形如足球,如E图,则C 60 中有_______________个六边形,_______________个五边形。固态时,C 60 属于_______________ (填“离子”、“原子”或“分子”)晶体,C 60 分子中含有双键的数目是_______________。
(6)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如F图。其中含有
20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察F图,推断这个基本结构单元所含硼原子个数、键角、“B—B”键的个数依次为______________、_______________、_______________。 xuzhiwei1991111年前1
xuzhiwei1991111年前1 -
 lsy2003 共回答了20个问题
lsy2003 共回答了20个问题 |采纳率100%(1)1∶1 (2)4 4 (3)B 2 12 (3)2 3
(5)20 12 分子 30 (6)12 60° 30
(1)阳离子数=1,阴离子数=8× =1,即个数比为
=1,即个数比为 。
。
(2)Na + 个数=8× +6×
+6× =4,Cl - 个数=12×
=4,Cl - 个数=12×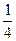 +1=4。
+1=4。
(3)由同一种元素形成的不同单质互称为同素异形体。如红磷、白磷;O 2 、O 3 等。1 mol Si原子形成4 mol Si—Si键,而1 mol Si—Si键为2 mol Si原子共用,所以1 mol Si原子实际“占有”Si—Si键为4 mol× ="2" mol,即为2N a 个。硅晶体最小环上有6个硅原子,每2个硅原子之间插入1个O原子,则共插入6个O原子,所以形成的最小环为12元环。
="2" mol,即为2N a 个。硅晶体最小环上有6个硅原子,每2个硅原子之间插入1个O原子,则共插入6个O原子,所以形成的最小环为12元环。
(4)一个正六边形中C原子数=6× =2,C—C键数=6×
=2,C—C键数=6× =3。
=3。
(5)B原子数=20×3× =12。等边三角形,键角为60°。B—B键数=20×3×
=12。等边三角形,键角为60°。B—B键数=20×3× =30。
1年前查看全部
=30。
1年前查看全部
- 分子化合物离子化合物有什么区别呢?最好别太深奥,为什么CO2是分子化合物,难道碳和氧不得失电子吗?
 chuwenmin1年前3
chuwenmin1年前3 -
 书和主人的关系 共回答了23个问题
书和主人的关系 共回答了23个问题 |采纳率100%没有分子化合价一说.只有离子化合物和共价化合物的说法.
离子化合物是指由阴阳离子相互作用而形成的化合物.一般是含有金属元素的化合物.因为一般只有金属元素的原子会失去电子带正电,成为阳离子.台NaCl、MgCl2、CuSO4等.
共价化合物是指由共用电子对形成分子的化合物.它们一般都是由非金属元素组成.因为非金属元素的原子的最外层电子数一般大于4个,因此在发生化学变化时,它们的原子一般都要得电子,谁也不愿失电子,因此具体情况是各自拿出一个电子形成一对电子,在双方原子核之间运动,叫做共用电子对.因为它们没有电子得失,因此也就不存在离子,而是以分子存在的.如CO2、H2O、SO2等.1年前查看全部
- 下图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲是发酵粉的主要成分,乙是一种常用的
下图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲是发酵粉的主要成分,乙是一种常用的化肥。B、D常温常压下是气体。请回答下列问题 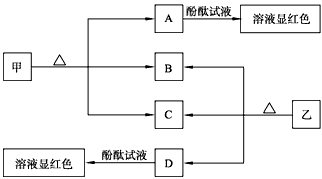
(1)甲的俗名是____________________________。
(2)A、D物质的水溶液分别滴入酚酞试液后,溶液均显红色,说明溶液均显_______性,其原理是否相同?请用必要的文字加以解释并写出离子方程式:_____________________________________。
(3)向饱和氯化钠溶液中通入气体D至饱和后,再通入足量的气体B可制得物质甲,写出该反应的化学方程式:_________________________________ qyf27771年前1
qyf27771年前1 -
 yy娜娜 共回答了20个问题
yy娜娜 共回答了20个问题 |采纳率85%1年前查看全部
- 下列叙述正确的是( ) A.共价化合物中只含有共价键 B.共价化合物中一定存在离子键 C.离子化合物中不能存在共价键
下列叙述正确的是( ) A.共价化合物中只含有共价键 B.共价化合物中一定存在离子键 C.离子化合物中不能存在共价键 D.离子化合物中只含有离子键  bonso1年前1
bonso1年前1 -
 玉树临风正版 共回答了17个问题
玉树临风正版 共回答了17个问题 |采纳率94.1%A.共价化合物中原子间以共用电子对形成化学键,所以共价化合物中只含共价键,故A正确;
B.共价化合物中移动不含离子键,含有离子键的化合物是离子化合物,故B错误;
C.离子化合物中可能含有共价键,如KOH,故C错误;
D.离子化合物中一定含有离子键,可能含有共价键,故D错误;
故选A.1年前查看全部
- 有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-
有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)现将溶液两两混合,记录现象如下:A+B→白色沉淀;2B+D→白色沉淀;C+D→蓝色沉淀则A、B、C、D的化学式分别是______、______、______、______.
 qq1096072111年前2
qq1096072111年前2 -
 jonem 共回答了23个问题
jonem 共回答了23个问题 |采纳率87%解题思路:题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH,
故答案为:AgNO3;MgCl2;CuSO4;NaOH.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质的检验和鉴别,为高频考点,把握发生的反应及习题中的信息为解答的关键,侧重分析、推断能力的考查,注意白色沉淀、蓝色沉淀为推断的突破口,题目难度不大.1年前查看全部
- 下列离子化合物中阴,阳离子间距最大的是:
下列离子化合物中阴,阳离子间距最大的是:
A.LiCL
B.NaCL.
C.KCL
D.KBr lilei01年前1
lilei01年前1 -
 拔弩 共回答了23个问题
拔弩 共回答了23个问题 |采纳率87%阳离子中钾离子的半径最大,阴离子中溴离子的半径最大,所以溴化钾中阴,阳离子间距最大
选D1年前查看全部
- NaOH离子化合物形成离子结晶是什么?这和Na2O2/Na2O离子晶体有何区别?是不是同一物质?
 tryitnow1年前1
tryitnow1年前1 -
 lisa_k 共回答了27个问题
lisa_k 共回答了27个问题 |采纳率92.6%NaOH形成的离子晶体就是氢氧化钠晶体,是由钠离子和氢氧根离子通过离子键结合成的具有规则几何外形的物质;Na2O2(过氧化钠)是由钠离子和过氧根离子通过离子键结合成的化合物;Na2O(氧化钠)是由钠离子和氧离子通过...1年前查看全部
- 下列说法正确的是( )A.离子键只存在于离子化合物中,共价键只存在于共价化合物中B.热稳定性:NH3>PH3>AsH3
下列说法正确的是( )
A.离子键只存在于离子化合物中,共价键只存在于共价化合物中
B.热稳定性:NH3>PH3>AsH3;酸性:HClO4>H2SO4>H3PO3
C.BF3和CS2分子中所有原子的最外层都是8电子稳定结构
D.钠离子的半径大于镁离子的半径,氯离子的还原性强于硫离子的还原性 bill_in1年前1
bill_in1年前1 -
 wangjian001 共回答了23个问题
wangjian001 共回答了23个问题 |采纳率73.9%解题思路:A.共价键可能存在于离子化合物中;
B.非金属氢化物的稳定性越强,其非金属性越强,其最高价氧化物的水化物酸性越强;
C.在ABn型分子中,中心原子族序数+成键电子数=8,则该反应中所有原子都达到8电子稳定结构;
D.电子层结构相同的离子,其离子半径随着原子序数的增大而减小,元素的非金属性越强,其简单阴离子的还原性越弱.A.共价键可能存在于离子化合物中,如KOH,故A错误;
B.非金属氢化物的稳定性越强,其非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>P>As,所以热稳定性:NH3>PH3>AsH3;非金属性Cl>S>P,所以酸性:HClO4>H2SO4>H3PO3,故B正确;
C.在ABn型分子中,中心原子族序数+成键电子数=8,则该反应中所有原子都达到8电子稳定结构,B原子族序数+成键电子数=3+3=6,所以B原子不能达到8电子稳定结构,故C错误;
D.电子层结构相同的离子,其离子半径随着原子序数的增大而减小,元素的非金属性越强,其简单阴离子的还原性越弱,所以钠离子的半径大于镁离子的半径,氯离子的还原性弱于硫离子的还原性,故D错误;
故选B.点评:
本题考点: 离子化合物的结构特征与性质;元素周期律的作用;原子核外电子排布.
考点点评: 本题考查了化合物和化学键的关系、元素周期律等知识点,根据物质中存在的化学键确定化合物类型,再结合元素周期律分析解答问题,题目难度不大.1年前查看全部
- 共价键必存在于共价化合物中,离子键必存在于离子化合物中
共价键必存在于共价化合物中,离子键必存在于离子化合物中
这句话怎么错了? zhuxuanyi1年前1
zhuxuanyi1年前1 -
 hwmm123 共回答了16个问题
hwmm123 共回答了16个问题 |采纳率81.3%离子化合物中也可以有共价键.
例如离子化合物NaOH,其中的OH-就是共价健.1年前查看全部
- 【高中化学】离子化合物,共价化合物?
【高中化学】离子化合物,共价化合物?
离子化合物中有共价键么?
共价化合物中有离子键么?
如何区分两者,有明确的分类么? andy710871年前4
andy710871年前4 -
 了空 共回答了19个问题
了空 共回答了19个问题 |采纳率94.7%离子化合物中有共价键么?
有,如氢氧化钠
共价化合物中有离子键么?
没有,如有离子键,就是离子化合物了.
如何区分两者,有明确的分类么?
含有离子键的化合物就是离子化合物.
只由共价键形成的化合物是共价化合物.1年前查看全部
- 硫酸 微粒组成稀硫酸H2SO4是离子化合物,不是原子构成,那是什么构成的?H2SO4分子应该是由原子构成的,分子由原子构
硫酸 微粒组成
稀硫酸H2SO4是离子化合物,不是原子构成,那是什么构成的?H2SO4分子应该是由原子构成的,分子由原子构成的吗.这到底该怎么讲 hzxsj1691年前4
hzxsj1691年前4 -
 从不QQ只版聊 共回答了15个问题
从不QQ只版聊 共回答了15个问题 |采纳率93.3%完全错了.稀硫酸是分子化合物,也就是说他的晶体结构是分子晶体,依靠分子作用力即范德瓦尔斯力.
离子化合物由正负离子之间的离子键构成的.
原子晶体由共价键组成.
这里指的是结构组成,不是指里面有没有原子1年前查看全部
- 〓NaH是一种离子化合物,它跟水反应的方程式为:NaH+H2O==NaOH+H2 ↑,
〓NaH是一种离子化合物,它跟水反应的方程式为:NaH+H2O==NaOH+H2 ↑,
反应中若有1molH2生成,则转移1mol电子 对还是错 一字花开1年前3
一字花开1年前3 -
 宫杉4649 共回答了16个问题
宫杉4649 共回答了16个问题 |采纳率87.5%对.NaH中H元素为-1价失去1个电子,为还原剂;H2O中一个+1价H得到1个电子,为氧化剂.所以反应中若有1molH2生成,则转移1mol电子1年前查看全部
- 下列叙述正确的是( ) A.单质分子中一定存在共价键 B.离子化合物中只存在离子键 C.共价化合物中只存在共价键 D.
下列叙述正确的是( ) A.单质分子中一定存在共价键 B.离子化合物中只存在离子键 C.共价化合物中只存在共价键 D.全部由非金属构成的化合物中一定不存在离子键  幽娅幽心1年前1
幽娅幽心1年前1 -
 同爱神 共回答了28个问题
同爱神 共回答了28个问题 |采纳率82.1%A、稀有气体分子中无化学键,故A错误;
B、含原子团的离子化合物中存在共价键,如NaOH中既含离子键也含共价键,故B错误;
C、仅含共价键的化合物是共价化合物,故C正确;
D、铵盐是非金属元素组成的,是由铵根里子和酸根离子构成的离子化合物,故D错误;
故选C.1年前查看全部
- 离子化合物一定是电解质吗?如果是的话,一定是强电解质吗?
 wangyu09151年前3
wangyu09151年前3 -
 starhwch 共回答了12个问题
starhwch 共回答了12个问题 |采纳率91.7%离子化合物一定是电解质,因为离子化合物的熔融态都能导电
但离子化合物不一定是强电解质,比如HgCl2、(CH3COO)2Pb都是弱电解质1年前查看全部
- 由金属元素和非金属元素组成的化合物一定是离子化合物吗
 云中鹤81061年前1
云中鹤81061年前1 -
 清and清 共回答了14个问题
清and清 共回答了14个问题 |采纳率100%周期表中金属与非金属交界处的金属常可与氯等非金属形成共价化合物,如:AlCl3、SnCl4、SbCl5、SnH4、SbH3、BiH3等.格氏试剂(RMgX,X为卤素)中的Mg—C键主要也是共价键.二烃基镁等全烃基有机金属化合物(IA族有机金属化合物除外)是共价化合物.1年前查看全部
- 离子晶体,阴阳离子,离子化合物,离子键的对应关系
 天上一彩虹1年前1
天上一彩虹1年前1 -
 fitbsky 共回答了28个问题
fitbsky 共回答了28个问题 |采纳率96.4%首先应弄清他们各自的概念:离子晶体是“晶体类型”,(常见的晶体类型有:离子晶体,分子晶体,原子晶体,金属晶体.) 离子晶体是指含有离子键的化合物.如可溶性碱,大部分盐,少量金属氧化物及“盐类”.离子晶体中当然含有阴阳离子了.离子建是一种作用力.我们经常会遇到比较物质熔沸点的问题,通常情况下:物质的熔沸点:原子晶体>离子晶体>金属晶体>分子晶体.至于金属晶体则不一定,如汞在常温下就为液态,它的熔沸点是较低的,只有几十度左右.即金属晶体熔沸点有高低差别很大.下面转讲一下离子晶体:如NaCl,NaOH均属于离子晶体,它的特点是熔融状态能导电.构成晶体的微粒为阴阳离子,且在它们当中阴阳离子是按一定规律排列的.离子晶体硬度较大,难以压缩.从组成上判断:①有无金属离子(有为离子晶体,但注意NH4Cl也为离子晶体)②熔融状态能导电,则一定位离子晶体.再说一下离子键:离子晶体要比较离子键的强弱.一般来说,阴阳离子电荷数越多,离子半径越小,则离子间的作用力就越强,其熔沸点也就越高,如:熔点:MgO>MgCl2>NaCl>CsCl.也就是比较各自的晶格能的大小与熔沸点成正比.离子化合物是指含有离子建的化合物(但也不一定只含有离子建,如“NH4Cl”就既含有离子建又含有共价建,但它是离子化合物,因为NH4+与Cl-离子形成离子键,而共价建是在氨跟例子中的N与H之间.) 如果您是高中生,那我觉得您应该看看《物质结构与性质》这本书,一定会获益匪浅.祝您成绩更上一层楼!1年前查看全部
- 高一化学里的离子化合物与共价化合物的分类标准是什么?最近被电子式的书写搞疯了
 东东的丫头1年前5
东东的丫头1年前5 -
 龙月阳 共回答了25个问题
龙月阳 共回答了25个问题 |采纳率88%活泼金属氧化物,氢化物,过氧化物,氮化物,碳化物,强碱和绝大多数盐都是离子化合物.其他都是共价的1年前查看全部
- 量子理论的N个问题,1离子化合物呈共价性所需的条件中,阴离子的半径要大,这号理解,那为什么书上说阴离子的电荷量(char
量子理论的N个问题,
1离子化合物呈共价性所需的条件中,阴离子的半径要大,这号理解,那为什么书上说阴离子的电荷量(charge实在不会翻)也要大呢?
2 SO2和SO3离子(-2假)的立体性状,即如何判断的?
3当一个分子中有5组成键电子对,并且没有孤电子对(lone pairs)时,分子的立体形状是什么样的?
4键角(bond angle)该怎么算啊?
5冰的密度为什么比水小?
6如何确定我没见过的分子的形状啊?比如BF3,PH3,CLF3,这些该怎么判断呢?
7一些比较奇怪的现象?为什么一个分子内部有4个成键电子对,0个孤电子对时形状就是正四面体(tetrahedral)?还有,电子对相对于中心原子的位子到底故不固定?如果3个成键电子对,2个孤电子对,形状就是T型,按VSEPR理论那就是说2个孤电队与成键电子对是在同一平面内,且在院子的同一边,为什么是这样的位置关系啊?
请先回答4,6,7 题
应为是从英文直接反过来的,有些词可能会翻错.
1那请问价电子数和分子的形状关系是固定的,例如3个价电子一定是平面三角形?
2孤电子对的位置如何确定?就比如水分子,假设以O原子为原点,做三维坐标轴,两个H原子相对放在XY平面内,可是根据水的形状看另两对孤对电子则是在O原子的同一边,使得两个与H的键弯曲。但为什么这两个孤对电子不会是沿Z轴排列,一个在O上,一个在O下,那么整个分子的形状就不会改变了?难道说孤对电子的位置也是固定的?
3就是SO2,和SO3(—2)的立体结构图,还有T型分子,我的习题说他们是平面的(planar),但是我用VSEPR判断出的根本就不是平面啊!
分肯定是会加的! wengzhangnn1年前1
wengzhangnn1年前1 -
 来亲普 共回答了18个问题
来亲普 共回答了18个问题 |采纳率88.9%4.键角(bond angle)是共价化合物的属性,一般的算法可以用余弦定理做.
6.可以根据VSEPR模型判断,方法:
价电子对数(n) 立体结构 范例 杂化类型
n=2 直线形 CO2 SP
n=3 平面三角形 CH2O SP2
n=4 正四面体形 CH4 SP3
判断价电子对数的方法:价电子对数= σ键数 + 孤对电子对数
如 BF3,结构式是 F-B-F 有3个 σ键,没有孤对电子,则BF3为平面三角形
I
F (且3个σ键相等也可以说是正三角形)
同理,PH3 ,P最外层有1对孤对电子对,和3个σ键,则为正四面体形(这是VSEPR模型),实际是PH3的立体结构是三角锥形(用VSEPR模型判断后要减去孤对电子对的影响,如H2O,VSEPR模型是正四面体形,但O有2对孤对电子对,所以就成了V行,其实原理很简单,就相当于孤对电子的排斥作用使直线弯曲变成V行.)
CLF3?
7.价电子有排斥作用,至于4个成键电子对,0个孤电子对时形状就是正四面体的问题我个人的看法是:4个σ键组成立体结构的稳定性应该较好,要是3个σ键,就算三角形,稳定性也是很好的.还有可能是为了能量最低化,可以想一下4个σ键如果是在同一平面的话,键角之和是360,平均也就是90,而像正四面体形键角的109.28,这样能量低.你说的T行也不一定要在用一平面(不好说,空间想象能力,想明白就行了.)
5.这和氢键有关系吧,水结成冰,氢键使之空间结构有序,导致体积增大(质量不变),所以密度减小.
(我也是高二学生,能力有限,如果你还不明白,我个人认为还是回归书本的好,选修3 物质的结构与性质》.累死了.)1年前查看全部
- 化学问题如何判断一种盐是离子化合物还是共价化合物?为什么AlCl3是工价化合物?
 一堆人的烟火1年前2
一堆人的烟火1年前2 -
 boringking 共回答了18个问题
boringking 共回答了18个问题 |采纳率100%高中范围只需要记住AlCl3是共价就够了.解释为什麽AlCl3是共价化合物需要用到大学知识,中学可以简单认为分子中含有共价键,电子只是偏移没有得失
实际上任何一种离子化合物中,离子键都带有共价性质,所以你也不能一口说谁谁谁就是离子化合物.一般那种阴离子半径大,阳离子半径小的形成共价化合物的趋势就很大,或者说离子键中含有的共价成份很大.1年前查看全部
- 求高中阶段共价化合物和离子化合物的特殊例子
求高中阶段共价化合物和离子化合物的特殊例子
阿么……像AlCl3这种看起来像离子确是共价的这种……
还有顺便问一下在做题过程中怎么判断到底是共价还是离子啊
我可能还要问关于共价化合物中稳定结构的问题 可以提高悬赏的咯 Tabuai1年前1
Tabuai1年前1 -
 fidodido111 共回答了19个问题
fidodido111 共回答了19个问题 |采纳率84.2%离子化合物是金属离子或者铵根离子与阴离子形成的.
共价化合物就是非金属阳离子与阴离子形成的.(除铵根)
除了氯化铝,其实还有硫化锌,氯化锌,其实中学阶段只需掌握氯化铝就行了.
原因是,铝处于元素周期表中金属与非金属交界线,即它已经具有一定非金属的性质了.
怎么判断离子化合物,还是共价化合物,看它定义就知道了.(^o^)/~1年前查看全部
- 下列物质属于离子化合物的是NA2O HNO3 HCL NH3
 Orange031年前1
Orange031年前1 -
 kk云少 共回答了20个问题
kk云少 共回答了20个问题 |采纳率85%选Na2O,Na2O是离子化合物
HNO3 HCl都是酸,酸都是共价化合物
NH3也是共价化合物1年前查看全部
大家在问
- 1一天小红和小亮利用温度计测量某山峰的高度,小红在山顶测的温度是-1摄氏度,小亮此时在山脚下测得的温度是身摄氏度,已知该地
- 2一项工程甲独自做十天完成乙独自做十二天完成现两队合作中途各休息若干天前后共九天完成,甲休息了几天
- 3溯洄为什么是逆流而上的意思.溯,洄,
- 4300字写景作文精彩片段+赏析急
- 5诗经-采薇(节选) 昔我往矣,杨柳依依.今我来思,雨雪霏霏.(的意思).
- 6有形容“久别的爱人重逢”的诗句吗
- 7大海水命男和大林木命女
- 8校园的冬天作文800字,内容不要有雪.
- 9如何记住拼音,如何读拼音
- 10关于留学生对提供住宿家庭要求的英语作文:宽敞.市中心;有家里聚会
- 11填空 1.只要你用心去感受生活( ) 2.一走进我们的校园( )
- 12102乘58减116怎么简便计算
- 13五年级下册数学书第12面第7题目
- 142sinx的平方-2sinxcosx化简
- 15英语翻译此生只爱帆