电极反应式是写化学方程式还是离子方程式?
 今天谁要嫁给我2022-10-04 11:39:546条回答
今天谁要嫁给我2022-10-04 11:39:546条回答
已提交,审核后显示!提交回复
共6条回复
 夜雨星辰 共回答了18个问题
夜雨星辰 共回答了18个问题 |采纳率100%- 离子方程式,因为电极反应是在电解的作用下离子的反应,虽然有一个总的方程式是化学方程式,有些不能一步完成反应,所以应该写离子方程式,才能看到完整的反应步骤.
- 1年前
 乐华 共回答了6个问题
乐华 共回答了6个问题 |采纳率- 这个不一定,取决于电极实际参加反应粒子的种类。
- 1年前
 天山之音 共回答了24个问题
天山之音 共回答了24个问题 |采纳率- 当然是离子方程式啊,要不怎能明白反应机制?总反应可写化学方程式.
- 1年前
 当记忆被封存 共回答了23个问题
当记忆被封存 共回答了23个问题 |采纳率- 一般溶液中写离子方程式。电极反应实际上是离子参与反应。
- 1年前
 柠檬骑士 共回答了8个问题
柠檬骑士 共回答了8个问题 |采纳率- 离子方程式啦~
你想想正负极电性不同自然是有一级是有电子的咯
有电子参与的方程式就明白了吧· - 1年前
 天使的号角 共回答了23个问题
天使的号角 共回答了23个问题 |采纳率- 你说的是哪种电极反应。原电池还是电解槽。
原电池肯定是离子方程式。电解槽就随便啦,什么都行,但实际最好写化学方程式,因为你要写离子方程式的话,在不熟悉的情况,也要根据化学方程式来写,这样就容易出错了。 - 1年前
相关推荐
- 电极反应式怎么判断啊?
 太爱你也许1年前1
太爱你也许1年前1 -
 ljaiwa 共回答了16个问题
ljaiwa 共回答了16个问题 |采纳率100%Al是活泼金属,失电子,为负极,所以石墨是正极 Al -- 3e =Al(3+)1年前查看全部
- Zn Al 浓硝酸 原电池电极反应式
 无敌小水怪1年前2
无敌小水怪1年前2 -
 SHIRLELY66436473 共回答了17个问题
SHIRLELY66436473 共回答了17个问题 |采纳率94.1%1、一开始,铝被钝化此时的电极方程式为:
2Al -6e- + 3H2O =Al2O3 + 6H+(为负极,铝电极)
NO3- + e- +2H+= NO2 + H2O(为正极,锌电极)
2、铝钝化以后:
Zn-2e- =Zn2+(为负极,锌电极)
NO3- + e- +2H+= NO2 + H2O(为正极,铝电极)
3、但是,当铝钝化以后表面有了氧化铝,也许不能导电了,所以可能不能形成原电池了!
4、需要实验验证.1年前查看全部
- 为什么钢铁发生吸氧腐蚀时的负极反应的电极反应式是2H2O + O2 + 4e = 4OH-
为什么钢铁发生吸氧腐蚀时的负极反应的电极反应式是2H2O + O2 + 4e = 4OH-
不应该是 2Fe-2e = Fe2+ 负极发生氧化反应啊 太阳的影子C1年前4
太阳的影子C1年前4 -
 焦作55 共回答了19个问题
焦作55 共回答了19个问题 |采纳率78.9%不管什么原因,发生吸氧腐蚀时负极反应都是2H2O + O2 + 4e = 4OH-,LZ你记住就好了1年前查看全部
- 铁-铜 (氯化铁溶液 )构成的原电池电极反应式
 fooler1年前1
fooler1年前1 -
 luo110315 共回答了21个问题
luo110315 共回答了21个问题 |采纳率95.2%总:Fe+2Fe3+=3Fe2+
+极:2Fe3+ +2e- =2Fe2+
-极:Fe-2e-=Fe2+1年前查看全部
- 在碱性条件下银锌电池的电极反应式
 百灵评论二辩1年前2
百灵评论二辩1年前2 -
 唯爱X辛 共回答了14个问题
唯爱X辛 共回答了14个问题 |采纳率100%正极:Ag
负极:Zn
电解质:OH-环境下
负极:Zn+2OH--2e=Zn(OH)2
正极:2H2O+2e-=2OH-+H2
总:Zn+2H2O=Zn(OH)2+H2
PS其实 Zn和Al 一样都是两性金属1年前查看全部
- 原电池正极石墨,负极铁 .电解质溶液:氯化钠.写出各电极反应式和电极总反应式.求教.
原电池正极石墨,负极铁 .电解质溶液:氯化钠.写出各电极反应式和电极总反应式.求教.
粒子移动和哪个先放电.比如说正极的石墨应该不会放电吧.那氢离子和钠离子移动到正极那边,哪个较易放电,为什么.负极的也要说明下. 大uu狗1年前2
大uu狗1年前2 -
 oo咪21 共回答了16个问题
oo咪21 共回答了16个问题 |采纳率93.8%1、负极:Fe-2e-=Fe2+
2、正极:O2+4e-+2H2O=4OH-
3、总反应:2Fe+O2+2H2O=2Fe(OH)2
然后:4Fe(OH)2 +O2+2H2O=4Fe(OH)3
即铁的吸氧腐蚀1年前查看全部
- 写电极反应式 (正负极式) 是用等号还是单向箭头,还是均可
 傻了吧唧二的乎的1年前1
傻了吧唧二的乎的1年前1 -
 jinxiaoyong 共回答了28个问题
jinxiaoyong 共回答了28个问题 |采纳率85.7%等号1年前查看全部
- 全国2卷的电极反应式用箭头还是等号“
全国2卷的电极反应式用箭头还是等号“
失电子写左边还是右边 beelee7271年前1
beelee7271年前1 -
 98315 共回答了15个问题
98315 共回答了15个问题 |采纳率100%等号 左边把1年前查看全部
- 氯化铜与氯化钠的混合溶液电解,电极反应式怎么写?
 海棠纹身1年前1
海棠纹身1年前1 -
 冬之浪子 共回答了21个问题
冬之浪子 共回答了21个问题 |采纳率85.7%Cu2+ +2eCL2(气体)1年前查看全部
- 急求! 高中化学原电池甲醇燃料电池强碱为电解质电极反应式,总方程式!
 gege5201年前4
gege5201年前4 -
 yymamaha 共回答了22个问题
yymamaha 共回答了22个问题 |采纳率95.5%正极 O2 + 2H2O + 4e- = 4OH-
负极 CH3OH + 8OH- - 6e- = (CO3)2- + 6H2O
总反应 2CH3OH + 3O2 + 4OH- = 2(CO3)2- + 6H2O1年前查看全部
- 电解时Cu 做阴极C 做阳极电解液是CuSO4电极反应式
 a769351年前2
a769351年前2 -
 情场浪子vv 共回答了14个问题
情场浪子vv 共回答了14个问题 |采纳率100%阳极反应式:2H2O - 4e- = O2↑ + 4H+
阴极反应式:Cu2+ + 2e- = Cu
总反应:2Cu2+ + 2H2O = 4H+ + 2Cu + O2↑1年前查看全部
- 电解时,电极的正负极判断和电极反应式
电解时,电极的正负极判断和电极反应式
具体点的.. lwj33061年前1
lwj33061年前1 -
 方程无无解gg 共回答了14个问题
方程无无解gg 共回答了14个问题 |采纳率92.9%电解时,电池正极所连接的一极是阳极(类似于负极).
电极反应式:不同的电解反应是不同的,我无法解答,你说个具体的反应吧1年前查看全部
- 高中化学比较特殊的该记的原电池电极反应式?
 zouhfsss1年前1
zouhfsss1年前1 -
 uu珞珈 共回答了18个问题
uu珞珈 共回答了18个问题 |采纳率88.9%1.Zn-Cu原电池型,电解质是稀硫酸或硫酸铜
2.Al-Mg,电解质是NaOH
3.铅蓄电池,Pb为负极,PbO2为正极,电解质稀硫酸
4.氢氧燃料电池,氢气为负极,氧气为正极
5.甲醇燃料电池,KOH为电解质,不生成二氧化碳,而是碳酸根
6.普通碱性电池,Zn为负极,MnO2为正极,碱液为电解质,生成Zn(OH)2和MnO(OH)
基本上就只这些类型的,其他的都是衍生出来的,重点为前三个,但后面的也有考到1年前查看全部
- 铁在中性,碱性或酸性溶液中被腐蚀的电极反应式
铁在中性,碱性或酸性溶液中被腐蚀的电极反应式
如题 吉他圣手1年前1
吉他圣手1年前1 -
 泮非涯 共回答了18个问题
泮非涯 共回答了18个问题 |采纳率100%中性,碱性:3O2+12e-(电子)=6O2-
4FE-12e-+6O2-+6H2O=4FE(OH)3
酸性:Fe-2e-====Fe2+
2H+ +2e-==== H21年前查看全部
- 氢氧燃料电池,电解质是氯化钠的电极反应式
 mylnesochen1年前1
mylnesochen1年前1 -
 多爱我一点 共回答了19个问题
多爱我一点 共回答了19个问题 |采纳率94.7%2H2-4eˉ=4H(阳离子),正极为:O2+4eˉ+2H2O=4OHˉ1年前查看全部
- 用锌棒、石墨和氯化铜溶液组成的原电池,电极上发生的电极反应式?
 weilei05221年前3
weilei05221年前3 -
 liyuhao_116 共回答了18个问题
liyuhao_116 共回答了18个问题 |采纳率100%总反应:Zn+Cucl2=Zncl2+Cu正负极反应的知道分吗?1年前查看全部
- 用铜和碳作电极(用导线相连) 稀盐酸作电解质溶液 所形成的原电池 其电极反应式是(各电极的和总的)?
用铜和碳作电极(用导线相连) 稀盐酸作电解质溶液 所形成的原电池 其电极反应式是(各电极的和总的)?
急 mb42031年前1
mb42031年前1 -
 feifei0851 共回答了25个问题
feifei0851 共回答了25个问题 |采纳率92%这个装置不会构成原电池1年前查看全部
- N2H4+2H2O2==N2+4H2O 写出电极反应式
 惠州mm1年前1
惠州mm1年前1 -
 yxzh1978 共回答了19个问题
yxzh1978 共回答了19个问题 |采纳率89.5%负极:N2H4-4e-==N2+4H+
正极:2H++H2O2==2H2O1年前查看全部
- 用铁和铝作电极氯化钠作电解质的原电池的电极反应式
 rose花花1年前1
rose花花1年前1 -
 旁观者--我 共回答了13个问题
旁观者--我 共回答了13个问题 |采纳率100%负极:2Fe - 4 e- === 2Fe2+
正极:O2 +4e- + 2H2O === 4OH-
因为铝表面有氧化膜(钝化了)1年前查看全部
- 电解NaCl溶液的装置如图所示,下列说法不正确的是( ) A.铁电极上的电极反应式为Fe-2e - =Fe 2+ B.
电解NaCl溶液的装置如图所示,下列说法不正确的是( ) A.铁电极上的电极反应式为Fe-2e - =Fe 2+ B.溶液中Na + 向铁电极方向移动 C.通电一段时间后,可看到铁电极附近溶液变红 D.通电一段时间后,可看到试管中溶液变蓝 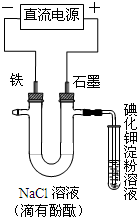
 iudx6k1年前1
iudx6k1年前1 -
 babysmile_tianya 共回答了20个问题
babysmile_tianya 共回答了20个问题 |采纳率95%A、铁为阴极,不参与电极反应,在阴极上发生还原反应,H + 离子放电生成氢气,阴极反应为:2H + +2e - ═H 2 ↑,或2H 2 O+2e - ═H 2 ↑+2OH - ,故A错误;
B、电解池中阳离子向阴极移动,阴离子向阳极移动,铁为阴极,溶液中Na + 向铁电极方向移动,故B正确;
C、电解氯化钠溶液,阴极反应为:2H + +2e - ═H 2 ↑,或2H 2 O+2e - ═H 2 ↑+2OH - ,阴极附近呈碱性,加入酚酞变红色,通电一段时间后,可看到铁电极附近溶液变红,故C正确;
D、电解氯化钠溶液,阴极反应为:2H + +2e - ═H 2 ↑,或2H 2 O+2e - ═H 2 ↑+2OH - ,阳极发生的反应为:2Cl - -2e - ═Cl 2 ↑,总反应为:2NaCl+2H 2 O
通电
.
2NaOH+Cl 2 ↑+H 2 ↑,反应后溶液呈碱性,加入酚酞呈红色,故D正确;
故选A.1年前查看全部
- 关于原电池的问题,进来看看铜和铝电极同时插入浓硝酸中,铝片上的电极反应式是,我想问一下这怎么写啊,给过程好不好.谢
 lhy_17261年前1
lhy_17261年前1 -
 ngdabr 共回答了22个问题
ngdabr 共回答了22个问题 |采纳率77.3%因为Al会在浓硝酸中钝化,所以 Cu是负极,Al是正极.负极:Cu - 2e- = Cu2+;正极:4 H+ + 2 NO3- + 2 e- = 2 NO2↑ + 2 H2O 总反应:Cu + 4 H+ + 2 NO3- = Cu2+ + 2 NO2↑ + 2 H2O.写正极反应的方法是,先写出总反...1年前查看全部
- 试分析电解饱和食盐水时,在阳极、阴极的电极反应式
试分析电解饱和食盐水时,在阳极、阴极的电极反应式
(1)写出电解反应的总化学方程式
(2)若有1mol氯化钠发生反应,则产生的各种电解产物的物质的量分别是多少? 不善于聊天1年前1
不善于聊天1年前1 -
 xuanzc10 共回答了22个问题
xuanzc10 共回答了22个问题 |采纳率90.9%阳极:2Cl-—2e-=Cl2↑(2个氯离子失去2个电子)
阴极:2H++2e-=H2↑(2个氢离子得到2个电子)
(1)2NaCl+2H2O=2NaOH+H2↑+Cl2↑(等号上写通电)
(2)1molNaOH 0.5molH2 0.5molCl21年前查看全部
- N2H4-空气燃料电池放电时负极点的电极反应式是
 看世界呼啸而过1年前1
看世界呼啸而过1年前1 -
 adrenalinrush 共回答了28个问题
adrenalinrush 共回答了28个问题 |采纳率100%N2h4 - 4e == N2 + 4 H+1年前查看全部
- 氢氧燃料电池在中性条件下的电极反应式
氢氧燃料电池在中性条件下的电极反应式
是中性,不是酸碱性哦!麻烦, jiashusheng1年前2
jiashusheng1年前2 -
 foreved 共回答了14个问题
foreved 共回答了14个问题 |采纳率85.7%电极写法为:
Pt|H2(g)|H2O(|)|O2(g)|Pt
负极失去电子:2H2 - 4e- == 4H+
正极得到电子:O2 + 4e- + 2H2O === 4OH-
总反应:2H2 + O2 = 2H2O1年前查看全部
- 人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn + 2OH- - 2e- = ZnO + H2↑
人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn + 2OH- - 2e- = ZnO + H2↑,Ag2O + H2O + 2e- = 2Ag+ 2OH-.
据此判断氧化银是( )
A、负极,并被氧化 B、正极,并被还原
C、负极,并被还原 D、正极,并被氧化 meimei1217261年前1
meimei1217261年前1 -
 暖意之殇 共回答了13个问题
暖意之殇 共回答了13个问题 |采纳率92.3%Ag2O应该是正极,Ag2O + H2O + 2e- = 2Ag+ 2OH- 这上面是得到电子,被还原
所以选B1年前查看全部
- 有关燃料是C2H5OH通入氧气的电极反应式
 GeoSunne1年前1
GeoSunne1年前1 -
 ZTmosquito 共回答了12个问题
ZTmosquito 共回答了12个问题 |采纳率83.3%负极:C2H5OH - 12e- + 16OH- == 2CO3^2- + 11H2O
正极:O2 + 4e- + 2H2O == 4OH-
总反应式:C2H5OH + 3O2 + 4OH- == 2CO3^2- + 5H2O1年前查看全部
- 乙醇燃料电池的电极反应式,电解质分别为H2SO4,KOH,O2-
 lllya1年前0
lllya1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 电解池与原电池对于这个问题我也是一知半解,不能确定电极反应式,主要问题在于对电极反应的物质判断不够明确,也还请老师指点迷
电解池与原电池
对于这个问题我也是一知半解,不能确定电极反应式,主要问题在于对电极反应的物质判断不够明确,也还请老师指点迷津 望淮溪1年前2
望淮溪1年前2 -
 aifeidexuan121 共回答了24个问题
aifeidexuan121 共回答了24个问题 |采纳率83.3%你的老师肯定会跟你讲放电顺序,记住这个顺序,在写电极式最需要注意的就是溶液自身酸碱性1年前查看全部
- 高一电极反应式(求大神)原料有:铁 铝 家庭常用的漂白水 食盐 氢氧化钠 请分别写出正负极上的电极反应式及总反应式好的一
高一电极反应式(求大神)
原料有:铁 铝 家庭常用的漂白水 食盐 氢氧化钠
请分别写出正负极上的电极反应式及总反应式
好的一定会采纳 lulibao1年前1
lulibao1年前1 -
 dickens06531 共回答了15个问题
dickens06531 共回答了15个问题 |采纳率86.7%铝作负极,铁作正极,氢氧化钠作电解液.
负极:Al-3e=Al3+
正极:2H2O + e = H2 + 2OH-
总反应:2Al+2NaOH+2H2O=2NaAlO2+3H21年前查看全部
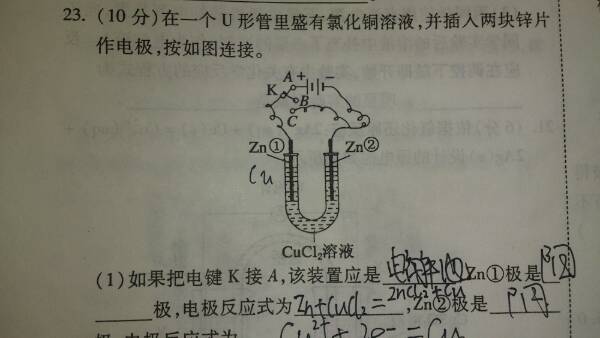
- 这道题中第三个空的电极反应式为什么错,答案为什么是zn-2e=zn离子
这道题中第三个空的电极反应式为什么错,答案为什么是zn-2e=zn离子

补充图片
 心呢1年前1
心呢1年前1 -
 lvbfb 共回答了20个问题
lvbfb 共回答了20个问题 |采纳率95%问的是电极反应式,是电极上发生的反应,不是总反应式!
Zn与正极相连,是阳极,被氧化,Zn-2e-=Zn2+
Cu是阴极,Cu2+得到电子形成Cu.Cu2+ +2e-=Cu1年前查看全部
- 铝为阳极,浓硫酸为电解液,如果可以,电极反应式是什么
 野狼20311年前4
野狼20311年前4 -
 行而上玄 共回答了16个问题
行而上玄 共回答了16个问题 |采纳率81.3%应该会发生钝化反应,除非电压高到一定程度,否则几乎不反应.
如果高电压强行电解,电解生成硫酸铝和二氧化硫.1年前查看全部
- 写出KCl溶液和AgNO3溶液的电极反应式(阳极反应式和阴极反应式)和电解反应方程式
 s1o2s31年前0
s1o2s31年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 为什么熔融碳酸盐(如:熔融K2CO3)环境下电极反应式
为什么熔融碳酸盐(如:熔融K2CO3)环境下电极反应式
熔融碳酸盐(如:熔融K2CO3)环境下电极反应式:
O2+2CO2+4e-=2CO .
为什么是这样? winshoes461年前1
winshoes461年前1 -
 zhangbai5 共回答了15个问题
zhangbai5 共回答了15个问题 |采纳率80%阴 极:O2 + 2CO2 + 4e-→2CO32-
阳 极:2H2 + 2CO32-→ 2CO2 + 2H2O + 4e-
总反应:O2 + 2H2 → 2H2O1年前查看全部
- 有人还将还原的电极反应式写为 这两种写法反映了反应条件有什么区别
有人还将还原的电极反应式写为 这两种写法反映了反应条件有什么区别
还可以将还原的电极(正极) 的电极反应写为:
O2+4H++4e- =2H2O zgjscz1年前3
zgjscz1年前3 -
 韩俊熙 共回答了17个问题
韩俊熙 共回答了17个问题 |采纳率100%在这种情况下,说明在它的介质中不能产生H2↑.
例如:有人设计以Pt和Zn为电极材料,埋入人体内作为作为某种心脏病人的心脏起搏器的能源.它依靠跟人体内体液中含有一定浓度的溶解氧、H+和Zn2+进行工作,试写出该电池的两极反应式.
解析:金属铂是相对惰性的,金属锌是相对活泼的,所以锌是负极,Zn失电子成为Zn2+,而不是ZnO或Zn(OH)2,因为题目已告诉H+参与作用.正极上O2得电子成为负二价氧,在H+作用下肯定不是O2-、OH-等形式,而只能是产物水,体液内的H+得电子生成H2似乎不可能.故发生以下电极反应:
负极:2Zn-4e-= 2Zn2+,正极:O2 + 4H+ + 4e- = 2H2O .1年前查看全部
- 用铜和硫酸铜溶液、银和硝酸银溶液设计一个原电池,这个原电池的负极 是______,电极反应式是______;正极是__
用铜和硫酸铜溶液、银和硝酸银溶液设计一个原电池,这个原电池的负极是______,电极反应式是______;正极是______,电极反应式是______.
 al46781年前1
al46781年前1 -
 snow20070226 共回答了9个问题
snow20070226 共回答了9个问题 |采纳率77.8%解题思路:用铜和硫酸铜、银和硝酸银溶液设计一个原电池,较活泼的金属铜作负极,电解质溶液选含有相同离子的盐溶液,负极上失电子发生氧化反应;较不活泼的金属银作正极,电解质溶液选用含有相同离子的盐溶液,正极上银离子得电子发生还原反应,根据得失电子写出相应的电池反应式和电极反应式.用铜和硫酸铜、银和硝酸银溶液设计一个原电池,较活泼的金属铜作负极,负极上失电子发生氧化反应;较不活泼的金属银作正极,正极上银离子得电子发生还原反应,所以电池反应式为:Cu+2Ag+=Cu2++2Ag;
负极上铜失电子发生氧化反应生成铜离子进入溶液,所以电极反应式为:Cu-2e-=Cu2+,
正极上银离子得电子发生还原反应生成银单质,所以电极反应式为:2Ag++2e-=2Ag,
故答案为:铜;Cu-2e-=Cu2+;银;2Ag++2e-=2Ag.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理及电极反应式的书写,根据“负极上失电子发生氧化反应,正极上得电子发生还原反应”来分析解答即可,难度不大.1年前查看全部
- 锂离子电池已经成为第一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为:
锂离子电池已经成为第一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为:
负极反应:C6Li-xe-═C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料);
正极反应:Li1-xMO2+xLi++xe-═LiMO2(LiMO2表示含锂的过渡金属氧化物).
下列有关说法正确的是( )
A. 锂离子电池充电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2
B. 电池反应中,锂、锌、银、铅各失去1 mol 电子,金属锂所消耗的质量最大
C. 锂离子电池放电时电池内部Li+向负极移动
D. 锂离子电池充电时阴极反应为C6Li1-x+xLi+-xe-═C6Li 光比霜雪1年前1
光比霜雪1年前1 -
 最后悔爱谁555 共回答了15个问题
最后悔爱谁555 共回答了15个问题 |采纳率93.3%解题思路:A.充电时电池反应式为放电电池反应式相反;
B.根据m=nM计算其质量;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反.A.充电时电池反应式为放电电池反应式相反,放电时电池反应式为C6Li+Li1-xMO2=C6Li1-x+LiMO2,则充电时电池反应式为C6Li1-x+LiMO2=C6Li+Li1-xMO2,故A正确;
B.电池反应中,锂、锌、银、铅各失去1 mol 电子,消耗这几种金属的物质的量分别是1mol、0.5mol、1mol、0.5mol,根据m=nM知,消耗其质量分别是7g、32.5g、108g、103.5g,所以消耗Li质量最小,故B错误;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动,所以Li+向正极移动,故C错误;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反,则电极反应式为C6Li1-x+xLi++xe-═C6Li,故D错误;
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池原理,明确蓄电池中正负极与阳极、阴极电极反应式关系是解本题关键,结合电池内部阴阳离子移动方向即可解答,题目难度不大.1年前查看全部
- 请回答下列问题.(1)钢铁的电化学腐蚀原理如图1所示:写出石墨电极的电极反应式______;该腐蚀的总反应的化学方程式_
 请回答下列问题.
请回答下列问题.
(1)钢铁的电化学腐蚀原理如图1所示:
写出石墨电极的电极反应式______;
该腐蚀的总反应的化学方程式______.
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图2所示:
①A电极的电极反应式是______.
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为4.48g,则电镀时电路中通过的电子为______mol.
(3)如图3装置所示,C、D、E、F、G、H、X、Y都是惰性电极,甲、乙、丙中均为500mL 0.2mol/L的溶液(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,H极附近溶液变红.请回答:①A电极为______极(填“正”或“负”)
②若C极产生1.12L气体(标准状况),F极析出金属的质量为______g.
③通电一段时间后,发现Y极附近颜色加深,原因是______. fenfen7131年前1
fenfen7131年前1 -
 coolbilly 共回答了19个问题
coolbilly 共回答了19个问题 |采纳率94.7%解题思路:(1)钢铁发生吸氧腐蚀,石墨为正极,正极氧气得电子被还原生成OH-;负极上Fe失电子生成亚铁离子,总反应为Fe与氧气、水反应生成氢氧化亚铁;
(2)①电镀时镀层金属作阳极,待镀金属作阴极;
②根据金属质量和转移电子之间的关系式计算;
(3)①将直流电源接通后,H极附近呈红色,可知道氢离子在该电极放电,所以H即是阴极,并得到其他各个电极的名称;
②根据电极方程式结合电子守恒计算;
③氢氧化铁胶体粒子吸附正电荷.(1)钢铁发生吸氧腐蚀,石墨为正极,氧气得电子被还原生成OH-,方程式为O2+2H2O+4e-═4OH-,负极上Fe失电子生成亚铁离子,总反应为Fe与氧气、水反应生成氢氧化亚铁,该腐蚀的总反应的化学方程式2Fe+2H2O+O2=2Fe(OH)2;
故答案为:O2+2H2O+4e-═4OH-;2Fe+2H2O+O2=2Fe(OH)2;
(2)①电镀时镀层金属作阳极,待镀金属作阴极,则A极为Cu,其电极反应式为:Cu-2e-=Cu2+;
故答案为:Cu-2e-=Cu2+;
②阳极上铜质量减少,阴极上铜质量增加,二者质量差为4.48g时,阴极上析出铜的质量为2.24g,根据铜和转移电子之间的关系式知,转移电子的物质的量=[2.24g/64g/mol]×2=0.07mol,
故答案为:0.07;
(3)将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极;
①由以上分析可知,A电极是电源的正极,
故答案为:正;
②若C极产生1.12L气体(标准状况)即0.05mol,C的电极方程式为:4OH--4e-=O2↑+2H2O,则转移的电子为0.2mol,F极的电极方程式为:Ag++e-=Ag,已知硝酸银溶液为500mL 0.2mol/L,则F极析出金属为0.1mol,所以析出银的质量为10.8g;
故答案为:10.8;
③在甲池中,电解硫酸铜的过程中,铜离子逐渐减少,导致溶液颜色变浅,Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷,
故答案为:氢氧化铁胶体粒子带正电荷.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,明确原电池的构成条件是解本题关键,注意把握电子守恒在计算中的应用,题目难度中等.1年前查看全部
- 铁和石墨棒做电极,电解质溶液是氯化钠所构成的原电池,电极反应式怎么写?
 lzchengneng1年前2
lzchengneng1年前2 -
 广东青少 共回答了15个问题
广东青少 共回答了15个问题 |采纳率100%这个不一定,请你告诉我铁是阳极还是阴极 .在线等你1年前查看全部
- Zn-Cu-H2SO4原电池.写出反映现象;电极反应式;判断电子,电流流动方向;溶液中离子移动方向
Zn-Cu-H2SO4原电池.写出反映现象;电极反应式;判断电子,电流流动方向;溶液中离子移动方向
溶液中H浓度变化;溶液的颜色变为蓝色吗?原电池能加快反应速率吗? ywh3691年前1
ywh3691年前1 -
 xj小鸡 共回答了18个问题
xj小鸡 共回答了18个问题 |采纳率94.4%铜上有气泡,锌片质量减少
电子从锌片经过导线流到铜片 电流同
阳极 2H+ +2e = H2(气体)
阴极 Zn - 2e = Zn2+
H浓度减小,不变蓝
可以加快反应速率1年前查看全部
- 铁和铜形成的原电池,电解质溶液是稀硫酸,电极反应式
铁和铜形成的原电池,电解质溶液是稀硫酸,电极反应式
如果电解质是浓硝酸呐? gloria03781年前1
gloria03781年前1 -
 romanfr 共回答了16个问题
romanfr 共回答了16个问题 |采纳率100%根据金属的活动性,可知,在铁铜稀硫酸形成的原电池中,铁为负极,铜为正极.所以电极反应式,铁极为:Fe-2e- = Fe2+,铜极:H+ -2e- = H2
如果变为浓硝酸,因为铁发生钝化,所以负极为铜,正极为铁极.电极反应式为
铁极:2NO3- +4H+ + 2e- = 2NO2 + 2H2O 铜极:Cu - 2e- = Cu2+1年前查看全部
- 在铜-锌原电池中,理论上应观察到的现象是:铜片上:______锌片上:______.此时原电池的电极反应式是:正极:__
在铜-锌原电池中,理论上应观察到的现象是:铜片上:______锌片上:______.此时原电池的电极反应式是:正极:______负极:______.但在实际实验中,锌片上也有______、表面变黑等现象,其原因是______.
在相同温度下,同样大小的混有碳粒等杂质的锌比纯锌与同浓度同体积的稀硫酸反应的速率______(选填“要快”、“要慢”、“相等”、“无法确定”),其微观解释是______. 最后一个大佬1年前1
最后一个大佬1年前1 -
 nnbestgame 共回答了15个问题
nnbestgame 共回答了15个问题 |采纳率86.7%解题思路:根据得失电子判断电极反应现象并写出电极反应式;
根据实验现象分析形成此现象的原因;
在相同条件下,通过对比实验,判断含杂质的锌与纯锌哪个反应快,根据同性电荷、异性电荷的关系分析.该原电池中,铜片上,氢离子得电子生成氢气,所以看到的现象是:表面产生大量气泡;锌片上,锌失去电子生成锌离子进入溶液,锌片逐渐溶解,所以看到的现象是:表面无气泡,但锌片逐渐溶解;铜片作正极,锌片作负极,正极上的电极反应式为:2H++2e-=H2↑;负极上的电极反应式为:Zn-2e-=Zn2+;
但在实际实验中,由于锌不纯,混有碳等杂质,锌、碳、稀硫酸构成微小的原电池,且锌、碳混在一起,所以看到锌片上有气泡、表面变黑等现象;
在相同条件下,粗锌比纯锌反应速率快,氢离子在锌片上得电子生成氢气,首先要克服锌离子对它的排斥力,在在铜片上得电子生成氢气,而是通过静电引力,相对叫容易些,所以在相同条件下纯锌比纯锌反应速率快.
故答案为:表面产生大量气泡;表面无气泡,但锌片逐渐溶解;2H++2e-=H2↑;Zn-2e-=Zn2+;气泡;锌不纯,混有碳等杂质,本身在稀硫酸中形成许多微电池;要快;氢离子不需要克服锌离子对它的排斥力到锌片上得电子,而是通过静电引力到铜片上得电子.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池的正负极的判断及电极反应式的书写等知识点,写电极反应式时要注意电解质溶液的成分,电解质溶液不同,电极反应式可能不同,如氢氧燃料电池中电解质为酸或碱时,电极反应式就不同.1年前查看全部
- 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池,写出电极反应式.
 hansonleon1年前0
hansonleon1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 关于电解 粗铜精炼时粗铜精炼时,与电源正极相连的是纯铜 电极反应式为Cu -2e——Cu2+为什么是错的?错在哪里?
 帅帅滴法拉利1年前1
帅帅滴法拉利1年前1 -
 yongyuanxingfu 共回答了20个问题
yongyuanxingfu 共回答了20个问题 |采纳率95%粗铜精炼时与电源正极相连的是粗铜而不是纯铜.
电极反应式正确.1年前查看全部
- Zn.Cu和H2SO4组成的原电池的电极反应式 负极:正极:
 彻底hpl1年前1
彻底hpl1年前1 -
 blueyong 共回答了18个问题
blueyong 共回答了18个问题 |采纳率88.9%2H+ + 2e- =H2 Zn-2e- =Zn2+1年前查看全部
- 电解尿素( CO(NH2)2 )的碱性溶液制氢的装置中,电解时,阴极、阳极的电极反应式分别是什么?
 More20031年前1
More20031年前1 -
 韩庚加油 共回答了10个问题
韩庚加油 共回答了10个问题 |采纳率80%阳极:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
阴极:6H2O + 6e-= 3H2↑ +6OH-1年前查看全部
- 电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应式是:Zn+2OH ― ―2e - =Zn
电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应式是:Zn+2OH ― ―2e - =ZnO+H 2 O;Ag 2 O+H 2 O+2e - =2Ag+2OH - 。总反应式为:Ag 2 O+Zn=2Ag+ZnO,下列说法正确的是()
A.Zn为正极,Ag 2 O为负极 B.Zn为负极,Ag 2 O为正极 C.原电池工作时,正极区溶液PH值减小 D.原电池工作时,负极区溶液PH值增大  do_i_wanna1年前1
do_i_wanna1年前1 -
 cocomei 共回答了17个问题
cocomei 共回答了17个问题 |采纳率82.4%B
从电极反应式可以看出:Zn失电子为负极,且该区消耗OH - 溶液PH值减小;Ag 2 O得电子为正极,且该区产生OH - 溶液PH值增大。1年前查看全部
- 铜银硝酸银原电池电极反应式是什么?
 xiaolan05041年前1
xiaolan05041年前1 -
 Adi10 共回答了13个问题
Adi10 共回答了13个问题 |采纳率92.3%原电池中负极氧化,正极还原,该原电池中负极锌被氧化,方程Zn-2e—=Zn2+,正极则是电解质溶液中银离子被还原,方程Ag++e—=Ag,1年前查看全部
- 老师说可以用电解醋酸钠来制取甲烷,我想问怎么制取,写出电极反应式?
 njtantan1年前1
njtantan1年前1 -
 2007nowhereman 共回答了24个问题
2007nowhereman 共回答了24个问题 |采纳率83.3%以前的课本有醋酸钠与氢氢化钠(固体)在加热下生成CH4,机理是脱羧反应.电解好象看到过.但具体怎么反应想不起来.C2H6好象也可以电解出来 .1年前查看全部
- 帮帮忙~~~HAc/H2这个电极的电极反应式怎么写~~~
 小唐的麻辣烫1年前1
小唐的麻辣烫1年前1 -
 h2785 共回答了13个问题
h2785 共回答了13个问题 |采纳率92.3%2HAc(aq) + 2e- = 2Ac-(aq) + H2(g)1年前查看全部
大家在问
- 1reflection在几何中是什么意思,反射?和轴对称有什么区别?
- 2胃痛的英语
- 3居住的英文单词只写单词!
- 4这个单词英文怎么拼
- 51+3分之1=()-16分之1=( )乘以1又7分之5=( )除以2=( )乘以2分之3=( )
- 6水在细胞中以什么形式存在?
- 7下列全是形声字的一组是A.兀 立 晨 手 升B.矗 苗 妈 清 初C.本 末 束 从 歪D.闷 楼 想 岗 披
- 8五个工人加工735个零件,2天加工了135个零件,已知这2天中有1个人因事请假一天,照这样的工作效率如果以后几天中无人请
- 9在词组中是不是要用动词原型
- 10英语翻译我鼓气勇气和一个女孩要微信号,她很开朗,说微信号是 什么什么 to,我说,.她说翻译过来是十八岁的房间,.我一脸
- 11图书馆开馆,小红3天去一次,小灵4天去一次,小红和小灵在图书馆相遇后,经过几天后她们会在图书馆再次相遇?
- 12新图书馆开馆了,小红每3天去一次,小刚每4天去一次,小红和小刚某天在图书馆相遇后,请问经过多少天再次相遇
- 13已知抛物线的顶点为原点,焦点F与圆x²+y²-2y=0的圆心重合.
- 14一般的二次函数题二次函数y=2(x-1)平方+1先向左平移1个单位,再向上平移1个单位后,得解析式为y=2x平方+bx+
- 15已知一个直角三角形周长是30厘米,面积是30平方厘米,这个三角形斜边的长?应用勾股定理的方法
