碘酸根在酸性环境下被亚硫酸氢根还原为碘离子的离子方程式,
 damaodie2022-10-04 11:39:542条回答
damaodie2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 征询 共回答了25个问题
征询 共回答了25个问题 |采纳率92%- 是这样,(IO3-)+3(HSO3-)====(I-)+3(SO42-)+3H+
你把该小写的小写,该大写的大写就好了 - 1年前
 wkwhy 共回答了94个问题
wkwhy 共回答了94个问题 |采纳率- (IO3-)+3(HSO3-)====(I-)+3(SO42-)+3H+
- 1年前
相关推荐
- 碘酸(HI)是强酸还是弱酸
 我是灰灰11年前1
我是灰灰11年前1 -
 fairy_Fhuang 共回答了20个问题
fairy_Fhuang 共回答了20个问题 |采纳率90%HI 氢碘酸,强酸
HIO3 碘酸,pKa = 0.75,中强酸,严格来讲,属于弱酸的范畴.但一般视为强酸1年前查看全部
- 关于溴酸,氯酸,碘酸的氧化性他们三个谁的氧化性强?拜托用通俗的语言说~是ClO3 BrO3 IO3不是氢氯酸
 heart-bay1年前2
heart-bay1年前2 -
 dasha508 共回答了20个问题
dasha508 共回答了20个问题 |采纳率90%楼上的我无语
卤素在负一价态貌似没有氧化性,他们不能降价了.
HBRO3>HCLO3>HIO3
这是在主族非金属元素里面可以看到的次级周期性现象,可以解释为d轨道的全满使溴的核外电子对核的屏蔽减少,即电正性增强,氧化性也增强;另外氯的半径比较小,使得其与氧原子间可以形成较强的d-p配键,又减弱了其氧化性.至于氯酸的比碘酸的强是元素电负性递减的正常现象,因此只有溴酸例外了.
同样的情况出现在氧族元素中,硒酸氧化性强于硫酸.(引用别人的,1年前查看全部
- 碘酸根有哪些性质?越详细越好、、
 hy87998971年前3
hy87998971年前3 -
 心肠COOL 共回答了12个问题
心肠COOL 共回答了12个问题 |采纳率83.3%IO3- + 5I- +6H+ ==3I2 + 3H2O,这是最常见的性质,中学里与IO3-有关的方程式就是这个.
由于IO3-中的碘+5价,所以主要表现的是氧化性.1年前查看全部
- 如何检验碘酸根利用KI淀粉试纸及厨房日常用品可以检验食盐中是否含有碘酸根,请用化学方程式说明反应原理.
 yyyy老大1年前1
yyyy老大1年前1 -
 summercheng 共回答了22个问题
summercheng 共回答了22个问题 |采纳率90.9%原理应该是这样的:
KIO3 + 5KI +6CH3COOH = 3I2 +3H2O +6CH3COOK
实际上是利用厨房里的食醋(乙酸),这是题目的要求中提到的,发生归中反应,得到碘单质后再用淀粉,看到蓝色.1年前查看全部
- 氯气可以跟碘化钾溶液发生置换反应,过量的氯气还可以把碘氧化为碘酸,化学方程式为:
氯气可以跟碘化钾溶液发生置换反应,过量的氯气还可以把碘氧化为碘酸,化学方程式为:
复制搜索
氯气可以跟碘化钾溶液发生置换反应,过量的氯气还可以把碘氧化为碘酸,化学方程式为:5CL2+I2+6H2O=2HIO3+10HCL.点算是一种无色晶体,极易溶于水。现有一瓶无色溶液,其中含有Br-和I-,请用氯水,四氯化碳和试管,设计一个简单实验,证明该无色溶液中确实含有Br-和I-,写出实验步骤和现象。 看的真累1年前3
看的真累1年前3 -
 土默川的狼 共回答了35个问题
土默川的狼 共回答了35个问题 |采纳率91.4%发生置换反应:2KI+Cl2=2KCl+I2
氧化为碘酸:I2+5Cl2+6H2O=10HCl+2HIO3
I-还原性比Br-强,所以I-先被还原.
⑴先取少量无色溶液于试管中,加入少量CCl4,然后逐滴加氯水,边加边振荡,见到CCl4层中有淡紫色出现,即可证明原溶液中有I-.此时I2刚刚出现,Br-还未被氧化.
⑵ 静置、分层,取上层清液于另一支试管.上层溶液含I-,Br-.
⑶ 向取出的清液中加入过量氯水,再加入CCl4,振荡、静置、分层,可见CCl4层显橙色,证明原溶液中有Br-.过量氯水将I-氧化为碘酸,Br-氧化为Br2.由于Br2易溶于CCl4,碘酸易溶于水,所以在CCl4层中可以看到Br2的颜色.1年前查看全部
- 加碘食盐中碘元素以碘酸根(IO 3 - )的形式存在.已知在酸性条件下,IO 3 - 离子能跟碘离子(I - )发生反应
加碘食盐中碘元素以碘酸根(IO 3 - )的形式存在.已知在酸性条件下,IO 3 - 离子能跟碘离子(I - )发生反应生成(I 2 ),I 2 能使淀粉变蓝色.现提供下列实际和生活中常见的物质:①碘化钾溶液(KI=K + +I - )②食醋③食糖④白酒⑤淀粉⑥纯碱,通过实验要证明加碘食盐中存在IO 3 - 离子,必须选用的试剂和物质是( ) A.①⑤⑥ B.①②③ C.①②⑤ D.②④⑥  颜泽1年前1
颜泽1年前1 -
 fxcf854 共回答了8个问题
fxcf854 共回答了8个问题 |采纳率100%碘化钾溶液能提供碘离子,食醋能提供酸性环境,淀粉能提供反应物.观察选项,故选C.1年前查看全部
- 已知:碘(I)元素有-1、+1、+3、+5、+7等多种化合价,碘酸碘是带正电荷的碘离子和碘酸根(IO3−)离子构成.你认
已知:碘(I)元素有-1、+1、+3、+5、+7等多种化合价,碘酸碘是带正电荷的碘离子和碘酸根(IO3−)离子构成.你认为它的化学式可能是下列中的( )
A. I2O5
B. I2O7
C. I4O5
D. I4O9 南欣儿1年前1
南欣儿1年前1 -
 菲流星 共回答了16个问题
菲流星 共回答了16个问题 |采纳率100%解题思路:根据,碘酸碘是带正电荷的碘离子和碘酸根(IO3-)离子构成,根据碘(I)元素的化合价及4个选项可知,带正电荷的碘离子可能为+1价或+3价,依此确定碘酸碘的化学式.碘酸碘是带正电荷的碘离子和碘酸根(IO3-)离子构成,根据碘(I)元素的化合价可知,带正电荷的碘离子可能为+1价或+3价,
若为+1价,则化学式为IIO3,即I2O3,
若为+3价,则化学式为I(IO3)3,即I4O9,
故选D.点评:
本题考点: 根据化合价正确书写化学式(分子式).
考点点评: 本题考查根据化合价书写化学式,难度不大.要注意阳离子所带的正电荷总数等于阴离子所带的负电荷总数.1年前查看全部
- 部分市售食盐中添加了一种碘酸的钾盐(其中碘的化合价是+5)则此盐的化学式是什么
部分市售食盐中添加了一种碘酸的钾盐(其中碘的化合价是+5)则此盐的化学式是什么
有助于回答者给出准确的答案 missw1年前2
missw1年前2 -
 issacfeel 共回答了15个问题
issacfeel 共回答了15个问题 |采纳率93.3%KI031年前查看全部
- 加碘食盐中碘元素以碘酸根(IO3-)的形式存在.已知在酸性条件下,IO3-离子能跟碘离子(I-)发生反应生成碘(I2),
加碘食盐中碘元素以碘酸根(IO3-)的形式存在.已知在酸性条件下,IO3-离子能跟碘离子(I-)发生反应生成碘(I2),碘能使淀粉变色.现提供下列试剂和生活中常见的物质:①碘化钾溶液(溶液中含有I-) ②白醋 ③白糖 ④白酒 ⑤纯碱 ⑥淀粉.欲通过实验证明加碘食盐中存在碘酸根离子,必须选用的试剂和物质是( )
A.①②⑥
B.①②③
C.①⑤⑥
D.②④⑤ chjmgr1年前1
chjmgr1年前1 -
 danfeiyan 共回答了22个问题
danfeiyan 共回答了22个问题 |采纳率90.9%根据题中信息“在酸性条件下,IO3-离子能跟碘离子(I-)发生反应生成(I2)”可知所需物质有碘酸根、碘离子、酸性物质,对比选项白醋呈酸性,碘化钾溶液中含有碘离子,所以有①②;根据信息“I2遇淀粉变蓝色”可知需要淀粉.所以必须的试剂和物质是①②⑥
故选A1年前查看全部
- 化学方程式1.氯气通入含碘水溶液中 蓝色消失 生成碘酸2.停止通入氯气加入过氧化氢 又出现蓝色并有气泡
 墙外等杏人1年前4
墙外等杏人1年前4 -
 udkp 共回答了21个问题
udkp 共回答了21个问题 |采纳率95.2%5 Cl2+I2+6H2O=12H+ +2 IO3-+10Cl-
2HIO3+5H2O2=5I2+6H2O+5O21年前查看全部
- HNO3为什么叫硝酸不叫氮酸?H2SO4硫酸H2CO3碳酸H2SiO3硅酸H3PO4磷酸HClO3氯酸HIO3碘酸H3B
HNO3为什么叫硝酸不叫氮酸?
H2SO4硫酸H2CO3碳酸H2SiO3硅酸H3PO4磷酸HClO3氯酸HIO3碘酸H3BO3硼酸HBrO3溴酸,这些含氧酸中心元素是什么就叫什么酸,那为什么HNO3中心元素是氮,不叫氮酸反而叫硝酸呢?
 地平线外的七里香1年前1
地平线外的七里香1年前1 -
 老路西法尔 共回答了20个问题
老路西法尔 共回答了20个问题 |采纳率90%你写成氮酸是没有错的,但为了区别H2CO3碳酸的发音就没有用氮酸的发音.很容易让人误解.另个,硝酸最原始的制作方法是通过硝石(一种矿物资质)中煅烧后的粉末溶入水后提取来的,这种液体呈酸性.所以,在当时就被称为硝酸了.之后一致沿用.1年前查看全部
- 1.已知碘元素有-1、+1、+3、+5、+7等多种化合价,碘酸碘是由带正电荷的碘离子和负一价的碘酸根(IO3).那么它的
1.已知碘元素有-1、+1、+3、+5、+7等多种化合价,碘酸碘是由带正电荷的碘离子和负一价的碘酸根(IO3).那么它的化学式是什么?
2.已知硅酸盐中硅元素的化合价为+4价,则它的化学式是什么?
3.下列物质均含有氮元素,他们按下列顺序排列:A.NH3 B.N2 C.NO D.X E.HNO3,问根据这种排列规律,X可能是_________ 弗麦田的瞳孔1年前1
弗麦田的瞳孔1年前1 -
 林影忆 共回答了20个问题
林影忆 共回答了20个问题 |采纳率95%1 碘酸碘 --- I[IO3]3 ,即I4O9, 是双价态.
参考KIO3化合价情况
2 H2SiO3偏硅酸 原硅酸H4SiO4 [Si化学性质类似于C]
类似的有Zn,Al
3 X为NO2或N2O4
N化合价依次为-3. 0 .+2 .+4. +71年前查看全部
- 锌和碘酸反应有氢气生成吗?
 00000201年前1
00000201年前1 -
 Earbshaw_Wu 共回答了12个问题
Earbshaw_Wu 共回答了12个问题 |采纳率100%其实只要判断氧化还原性强弱便可以作出判断.
IO3(-)氧化性远大于H(+),因此起氧化性的是前者,方程式如下:
3Zn + IO3(-) + 6H(+) = 3Zn(2+) + I(-) + 3H2O
因此氢气很难生成1年前查看全部
- 碘离子与碘酸根在中性条件下是否反应,现象是什么.
 szdhergkj1年前4
szdhergkj1年前4 -
 swedee 共回答了16个问题
swedee 共回答了16个问题 |采纳率100%不反应,在酸性条件下碘酸根离子才显现强酸性,将碘离子氧化为单质碘1年前查看全部
- 碘单质与亚硫酸氢根反应生成碘酸根,可以吗,求方程式
 y1nf0x1年前3
y1nf0x1年前3 -
 我爱妹儿 共回答了27个问题
我爱妹儿 共回答了27个问题 |采纳率92.6%不可以
I2 +HSO3- + H2O ==3H+ +(SO4)2- + 2I-
是生成碘离子 I-,不是碘酸根,碘酸根是IO3-1年前查看全部
- 氯水可以和碘化钾溶液发生置换反应,过量的氯水还可以把碘氧化为碘酸(HIO3),化学方程式为5CI2+ I2 (碘单质)+
氯水可以和碘化钾溶液发生置换反应,过量的氯水还可以把碘氧化为碘酸(HIO3),化学方程式为5CI2+ I2 (碘单质)+6水=2HIO3+10HCI .碘酸是一种无色晶体,极易溶于水.现有一瓶无色溶液,其中含有Br离子和碘离子,请用氯水,四氯化碳和试管,设计一个简单的实验,证明该无色溶液中确实还有Br离子和碘离子,写出实验步骤和现象.
(1)
(2)
(3) jibin_12341年前3
jibin_12341年前3 -
 23f32sauy 共回答了23个问题
23f32sauy 共回答了23个问题 |采纳率91.3%向该溶液中缓慢加入氯水直至过量.如果出现下述现象,则该溶液中含有溴离子和碘离子.加入氯水的过程中,溶液先变成褐色,然后褐色消失,溶液为无色,最后变为橙色.解释:若有溴离子和碘离子,加入氯水;因为还原性碘离子比溴离子强,所以氯气先和碘离子反应,生成碘单质,就形成碘水,溶液为褐色.然后氯单质和碘水反应生成物色的碘酸,溶液为无色.最后氯气和溴离子反应生成溴单质,形成溴水,溶液为橙色.实验步骤就是三步加氯水,现象就是先变成褐色,然后褐色消失,溶液为无色,最后变为橙色.1年前查看全部
- 加碘食盐中的碘元素以碘酸根(IO3-)形式存在.已知在酸性条件下,IO3-能跟碘离子(I-)发生反应生成碘(I2),I2
加碘食盐中的碘元素以碘酸根(IO3-)形式存在.已知在酸性条件下,IO3-能跟碘离子(I-)发生反应生成碘(I2),I2能使淀粉变蓝色.现提供下列试剂和生活中常见的物质:①碘化钾溶液(KI =K++I-);②食醋;③食糖;④白酒;⑤淀粉;⑥纯碱.通过实验要证明加碘盐中存在10:7,必须选用的试剂和物质是………………………………………( )
A.①⑤⑥ B.①②③ C.①②⑤ D.②④⑥
为什么? jjww的人1年前4
jjww的人1年前4 -
 YESPEACE 共回答了23个问题
YESPEACE 共回答了23个问题 |采纳率91.3%C
据题意,一定要使用信息--“酸性条件下,IO3-能跟碘离子(I-)发生反应生成碘(I2),I2能使淀粉变蓝色”
所以,需要KI,即①,需要酸性条件,即②,需要淀粉,即⑤1年前查看全部
- 写出高碘酸H5IO6和MnSO4反应生成 碘酸 高锰酸 和硫酸的离子方程式
 幽浮xcom1年前3
幽浮xcom1年前3 -
 allen_hyw 共回答了22个问题
allen_hyw 共回答了22个问题 |采纳率95.5%5H5IO6+2MnSO4=5HIO3+2HMnO4+2H2SO4+7H2O
MnSO4为固体
5(IO6)5- + 2MnSO4 + 14H+ = 5IO3- + 2MnO4- + 7H2O + 2(SO4)2-
MnSO4为溶液
5(IO6)5- + 2Mn2+ + 14H+ = 5IO3- + 2MnO4- + 7H2O1年前查看全部
- 碘酸(HIO3)是强酸吗?如果不是强酸 为什么06年黄冈题中:5HIO4 + 2Mn2+ + 3H2O = 2MnO4-
碘酸(HIO3)是强酸吗?
如果不是强酸 为什么06年黄冈题中:5HIO4 + 2Mn2+ + 3H2O = 2MnO4- + 5IO3- + 11H+
HIO3被拆开写了 这样对吗?? edyxli1年前4
edyxli1年前4 -
 wuyu0775 共回答了12个问题
wuyu0775 共回答了12个问题 |采纳率83.3%楼主...咱教你个办法快速判断含氧酸的强弱
将含氧酸改写成 (OH)mXOn的形式
例如 H2CO3 改写成 (OH)CO
根据n的值的判断含氧酸的强弱
如果n=0,则为极弱酸 如 HClO -----(OH)Cl
如果n=1,则为弱酸 如 H2SiO3 ----(OH)2SiO
如果n=2,则为强酸 如 H2SO4 ---- (OH)2SO2
如果n=3,则为超强酸 如 HClO4 ---- (OH)ClO31年前查看全部
- 加碘食盐中碘元素以碘酸根(IO 3 - )的形式存在。已知在酸性条件下IO 3 - 能跟I - 发生反应生成I 2 ,I
加碘食盐中碘元素以碘酸根(IO 3 - )的形式存在。已知在酸性条件下IO 3 - 能跟I - 发生反应生成I 2 ,I 2 能使淀粉变成蓝色。现提供下列试剂和生活中常见的物质:①碘化钾溶液(KI==K + +I - );②食醋;③食糖;④白酒;⑤淀粉;⑥纯碱。要通过实验证明加碘食盐中存在IO 3 - ,必须选用的试剂和物质是 [ ]A.①⑤⑥
B.①②③
C.①②⑤
D.②④⑥ i4nzk1年前1
i4nzk1年前1 -
 夜黑赏花人 共回答了17个问题
夜黑赏花人 共回答了17个问题 |采纳率94.1%C1年前查看全部
- 碘酸根与硫代硫酸钠反应方程式
 极品猪头爱小兔1年前2
极品猪头爱小兔1年前2 -
 青菜萝卜头 共回答了13个问题
青菜萝卜头 共回答了13个问题 |采纳率92.3%硫代硫酸钠是个中等强度的还原剂,但碘酸根在中性或碱性条件下很难实现氧化性,所以反应条件需要H+
4IO3[-] + 3S2O3[2-] + 3H2O === 4I- + 6SO4[2-] + 6H+
反应结果会产生氢离子,所以只需要原反应溶液稍微呈酸性,后面越来越快
实际上由于S2O3[2-]离子在酸性条件下也会分解生成单质硫沉淀,这个常温下不容易被氧化,所以溶液在反应过程中总会有些浑浊1年前查看全部
- 碘酸根和亚硫酸氢根反应离子方程式
 雅策君1年前2
雅策君1年前2 -
 yogurtsky 共回答了22个问题
yogurtsky 共回答了22个问题 |采纳率81.8%2IO3- +5HSO3- =3HSO4-+2SO42-+H2O+I2
也可以写成5个SO42-和3个H+呢1年前查看全部
- 求一化学方程式请告诉我碘酸根IO3-与亚硫酸氢钠NaHSO3反应的化学方程式于离子方程式.
 忍顾来时路1年前1
忍顾来时路1年前1 -
 077110086 共回答了23个问题
077110086 共回答了23个问题 |采纳率87%IO3-显示氧化性
HSO3-显示还原性
因此,2IO3- + 5 HSO3- = 5 SO42- + I2 !+ H2O+3H+1年前查看全部
- (2003•邵阳)为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘盐,简称碘盐.所谓碘盐就是在食盐中加入一定量的碘酸
(2003•邵阳)为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘盐,简称碘盐.所谓碘盐就是在食盐中加入一定量的碘酸钾(KIO3).1000g碘盐中约含20mg碘.计算:
(1)2000g碘盐中含有碘酸钾多少mg?
(2)儿童每天约需0.1mg碘,假设这些碘主要是从碘盐中摄取的,则儿童每天需要食盐多少克? ribbon1231年前1
ribbon1231年前1 -
 polaris1314 共回答了20个问题
polaris1314 共回答了20个问题 |采纳率85%解题思路:(1)由题意,所谓碘盐就是在食盐中加入一定量的碘酸钾(KIO3),1000g碘盐中约含20mg碘,则2000g碘盐中含碘40mg,由化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
(2)1000g碘盐中约含20mg碘,儿童每天约需0.1mg碘,据此进行分析解答.(1)由题意,所谓碘盐就是在食盐中加入一定量的碘酸钾(KIO3),1000g碘盐中约含20mg碘,则2000g碘盐中含碘40mg,则2000g碘盐中含有碘酸钾的质量为40mg÷([127/39+127+16×3]×100%)≈67.4mg.
(2)1000g碘盐中约含20mg碘,儿童每天约需0.1mg碘,则儿童每天需要食盐[0.1mg/20mg]×1000g=5g.
故答案为:(1)2000g碘盐中含有碘酸钾67.4mg;(2)儿童每天需要食盐5g.点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 已知:碘(I)元素有-1、+1、+3、+5、+7等多种化合价,碘酸碘是带正电荷的碘离子和碘酸根(IO3−)离子构成.你认
已知:碘(I)元素有-1、+1、+3、+5、+7等多种化合价,碘酸碘是带正电荷的碘离子和碘酸根(IO3−)离子构成.你认为它的化学式可能是下列中的( )
A. I2O5
B. I2O7
C. I4O5
D. I4O9 舟结伦1年前2
舟结伦1年前2 -
 fangdan2007 共回答了20个问题
fangdan2007 共回答了20个问题 |采纳率90%解题思路:根据,碘酸碘是带正电荷的碘离子和碘酸根(IO3-)离子构成,根据碘(I)元素的化合价及4个选项可知,带正电荷的碘离子可能为+1价或+3价,依此确定碘酸碘的化学式.碘酸碘是带正电荷的碘离子和碘酸根(IO3-)离子构成,根据碘(I)元素的化合价可知,带正电荷的碘离子可能为+1价或+3价,
若为+1价,则化学式为IIO3,即I2O3,
若为+3价,则化学式为I(IO3)3,即I4O9,
故选D.点评:
本题考点: 根据化合价正确书写化学式(分子式).
考点点评: 本题考查根据化合价书写化学式,难度不大.要注意阳离子所带的正电荷总数等于阴离子所带的负电荷总数.1年前查看全部
- 新型的乙醇电池结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全。已知电池总反
新型的乙醇电池结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全。已知电池总反应式为C 2 H 5 OH+3O 2 →2CO 2 +3H 2 O。下列说法不正确的是 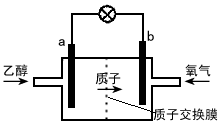 [ ]
[ ]A.a极为电池的负极,该电极发生氧化反应
B.电池工作时电流由b极沿导线经灯泡到a极
C.电池正极的电极反应式为O 2 +2H 2 O+4e - →4OH -
D.电池工作时,1mol乙醇被氧化转移12mol电子 xdict20061年前1
xdict20061年前1 -
 stapchyjh 共回答了19个问题
stapchyjh 共回答了19个问题 |采纳率78.9%C1年前查看全部
- 高碘酸和硫酸锰在溶液中反应生成高锰酸和碘酸和硫酸,求离子方程式
 狼籍填鸭1年前1
狼籍填鸭1年前1 -
 lullabys 共回答了20个问题
lullabys 共回答了20个问题 |采纳率90%5HIO4+2MnSO4+3H2O==2H2SO4+5HIO3+2HMnO4
5IO4- + 2Mn2+ +3H2O==6H+ + 5IO3- + 2MnO4-1年前查看全部
- 氢叠碘酸什么是氢叠碘酸?主要的性质是什么?
 jnpo2fcph3f7c1年前1
jnpo2fcph3f7c1年前1 -
 房子多的想出租 共回答了24个问题
房子多的想出租 共回答了24个问题 |采纳率83.3%就是叠碘化氢,强氧化剂,杀菌1年前查看全部
- 请问碘酸和氢碘酸能反应吗,如果能,请写出方程式,不能,请说明理由
请问碘酸和氢碘酸能反应吗,如果能,请写出方程式,不能,请说明理由
还有,氢碘酸和碘单质能反应吗? lars761年前5
lars761年前5 -
 邓超超 共回答了15个问题
邓超超 共回答了15个问题 |采纳率86.7%能.
反应方程式:
HIO3+5HI=3H2O+3I2
离子方程式:
6H+十5I-十IO3- =3H2O+3I2
氢碘酸的碘离子可以和I2结合,形成缔合离子I3-,可以增加碘单质的溶解度.
I-十I2=I3-1年前查看全部
- 碘离子和碘酸根的反应为什么不生成亚典酸根 氧化还原反应不是邻价转化吗
碘离子和碘酸根的反应为什么不生成亚典酸根 氧化还原反应不是邻价转化吗
与反应的用量有关吗 鸢飞的梦1年前3
鸢飞的梦1年前3 -
 may的小勺 共回答了19个问题
may的小勺 共回答了19个问题 |采纳率100%因为碘离子的还原性太强了 而亚碘酸根也具有氧化性 不稳定 所以继续发生氧化还原反应 生成碘
这个应该是特例 老师会重点说明的吧1年前查看全部
- 碘酸钾中碘元素呈+5价且碘酸根由碘元素组成,碘酸根离子带一个单位的负电荷,则碘酸钾的化学式是_.
碘酸钾中碘元素呈+5价且碘酸根由碘元素组成,碘酸根离子带一个单位的负电荷,则碘酸钾的化学式是_.
书上答案是:KIO3.(3是小的.)为什么这样做? weldonruan1年前2
weldonruan1年前2 -
 783405 共回答了21个问题
783405 共回答了21个问题 |采纳率90.5%碘显正5价,碘酸根离子中必有氧,因为只有含氧酸中非金属元素才显正价,而氧一定显负2价,碘酸根离子显负1价,可列方程,设氧离子数为x,-2x+5=-1,解得x=3,则碘酸根离子化学式是IO3-
我的回答更好,因为032477aa没给你解释碘酸根为什么含氧1年前查看全部
- 高锰酸钾能把碘单质氧化成碘酸吗
 悠悠孤单H1年前3
悠悠孤单H1年前3 -
 见面搞活 共回答了13个问题
见面搞活 共回答了13个问题 |采纳率100%高碘酸了
一般来说只考虑到碘单质,因为这个才是主要的,别的氧化剂基本上都能氧化到正价,但是只考虑碘单质,除非题里有特殊说明1年前查看全部
- 氯水与碘水反应为什么是生成盐酸和碘酸
 小答1年前1
小答1年前1 -
 wskkfqp 共回答了18个问题
wskkfqp 共回答了18个问题 |采纳率100%不是、生成盐酸和次碘酸1年前查看全部
- 碘酸根怎样不用碘离子生成碘单质
 zhoulu9191年前1
zhoulu9191年前1 -
 小板栗123 共回答了10个问题
小板栗123 共回答了10个问题 |采纳率90%工业生产上大量制备I2,是以经过浓缩的NaIO3为原料,用NaHSO3进行还原:
2IO3- + 5HSO3- = 3HSO4- + 2SO42- + I2 + H2O1年前查看全部
- A高温会导致碘的损失,B碘酸钾可氧化钠,C可用淀粉检验碘盐中的碘酸钾,D该碘盐中碘酸的含量为20到50mg/kg
a高温会导致碘的损失,b碘酸钾可氧化钠,c可用淀粉检验碘盐中的碘酸钾,d该碘盐中碘酸的含量为20到50mg/kg
这是一题选择题,正确答案选a.题中还告诉一个信息就是碘盐包装上的部分说明3***5mg/kg.
首先,我记得老师说过氯溴碘的熔沸点是逐渐大,且碘是固.如果我这句话没记错,那为什么高温会影响它呢.其次,我希望你可以把剩下的答案一一描述里有好吗.计算的d最好详细些. jiangxia19991年前1
jiangxia19991年前1 -
 黑侠007 共回答了22个问题
黑侠007 共回答了22个问题 |采纳率100%碘单质会升华1年前查看全部
- 为什么碘盐中是碘酸根而不是次碘酸根?急!谢谢!
为什么碘盐中是碘酸根而不是次碘酸根?急!谢谢!
如题,谢谢大家了! 01b21年前4
01b21年前4 -
 梦泽深 共回答了23个问题
梦泽深 共回答了23个问题 |采纳率95.7%次碘酸根很不稳定(容易从次氯酸不稳定推之),易分解.而碘酸根稳定,在高温时才容易分解.此外,碘酸钾口感较好,其他的碘化物口感较差.1年前查看全部
- 碘化钾分别与高锰酸根,碘酸根的化学反应方程式
碘化钾分别与高锰酸根,碘酸根的化学反应方程式
有这样的一道题
知道的帮帮忙 liuxing9991年前1
liuxing9991年前1 -
 xxITE展览ll 共回答了19个问题
xxITE展览ll 共回答了19个问题 |采纳率84.2%6KI+2KMnO4+6H2SO4=3I2+2MnSO4+6H2O+4K2SO4
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O1年前查看全部
- 已知:碘(I)元素有-1、+1、+3、+5、+7等多种化合价,碘酸碘是带正电荷的碘离子和碘酸根(IO3−)离子构成.你认
已知:碘(I)元素有-1、+1、+3、+5、+7等多种化合价,碘酸碘是带正电荷的碘离子和碘酸根(IO3−)离子构成.你认为它的化学式可能是下列中的( )
A. I2O5
B. I2O7
C. I4O5
D. I4O9 人之初_爱之深1年前4
人之初_爱之深1年前4 -
 葛利高里 共回答了13个问题
葛利高里 共回答了13个问题 |采纳率92.3%解题思路:根据,碘酸碘是带正电荷的碘离子和碘酸根(IO3-)离子构成,根据碘(I)元素的化合价及4个选项可知,带正电荷的碘离子可能为+1价或+3价,依此确定碘酸碘的化学式.碘酸碘是带正电荷的碘离子和碘酸根(IO3-)离子构成,根据碘(I)元素的化合价可知,带正电荷的碘离子可能为+1价或+3价,
若为+1价,则化学式为IIO3,即I2O3,
若为+3价,则化学式为I(IO3)3,即I4O9,
故选D.点评:
本题考点: 根据化合价正确书写化学式(分子式).
考点点评: 本题考查根据化合价书写化学式,难度不大.要注意阳离子所带的正电荷总数等于阴离子所带的负电荷总数.1年前查看全部
- 氯水将碘氧化成碘酸根的方程式是什么
 maliii131年前1
maliii131年前1 -
 JENNIFERLU 共回答了12个问题
JENNIFERLU 共回答了12个问题 |采纳率83.3%3Cl2 + I- + 3H2O == 6Cl- + IO3- + 6H+1年前查看全部
- 请问下苯甲醚加氢碘酸水解后与三氯化铁反应产生的物质什么颜色
 tanmoon20001年前1
tanmoon20001年前1 -
 dcr3333333 共回答了20个问题
dcr3333333 共回答了20个问题 |采纳率95%苯甲醚与氢溴酸或氢碘酸一起加热,发生碳-氧键断裂,生成酚和卤代甲烷,苯酚与FeCl3显紫色.1年前查看全部
- 某同学检测刚从小商店买回的食盐是否是加碘食盐[加碘食盐中的碘元素以碘酸钾(KIO 3 )形式存在].经过查阅资料得知碘酸
某同学检测刚从小商店买回的食盐是否是加碘食盐[加碘食盐中的碘元素以碘酸钾(KIO 3 )形式存在].经过查阅资料得知碘酸钾(KIO 3 )在酸性条件下能与KI溶液发生反应生成碘(I 2 ),I 2 遇淀粉变蓝色.现提供下列试剂和生活中常见的物质:①米汤、②纯碱、③KI溶液、④白糖、⑤白酒、⑥白醋.该同学进行检验必须用到的试剂和物质是( ) A.①③④ B.①③⑥ C.②④⑥ D.①④⑤  pctree_d1年前1
pctree_d1年前1 -
 风过水无痕598 共回答了17个问题
风过水无痕598 共回答了17个问题 |采纳率94.1%根据题中信息“碘酸钾(KIO 3 )在酸性条件下能与KI溶液发生反应生成碘(I 2 )”可知所需物质有碘酸钾、KI、酸性物质,对比选项白醋呈酸性,所以有③⑥;根据信息“I 2 遇淀粉变蓝色”可知需要淀粉,分析选项知米汤的成分是淀粉.
故选B1年前查看全部
- 碘酸根可以跟亚硫酸氢根共存吗
 sjpaihj1年前1
sjpaihj1年前1 -
 vv2235 共回答了17个问题
vv2235 共回答了17个问题 |采纳率88.2%碘酸根是典型的氧化剂,而亚硫酸氢根是典型的还原剂,因此不能共存.1年前查看全部
- 加碘食盐中碘元素以碘酸根(IO3-)的形式存在.已知在酸性条件下,IO3-离子能跟碘离子(I-)发生反应生成(I2),I
加碘食盐中碘元素以碘酸根(IO3-)的形式存在.已知在酸性条件下,IO3-离子能跟碘离子(I-)发生反应生成(I2),I2能使淀粉变蓝色.现提供下列实际和生活中常见的物质:①碘化钾溶液(KI=K++I-)、②食醋、③食糖、④白酒、⑤淀粉、⑥纯碱,通过实验要证明加碘食盐中存在IO3-离子,必须选用的试剂和物质是( )
A. ①⑤⑥
B. ①②③
C. ①②⑤
D. ②④⑥ 花儿真红1年前1
花儿真红1年前1 -
 就看看_kk 共回答了26个问题
就看看_kk 共回答了26个问题 |采纳率96.2%解题思路:已知在酸性条件下,IO3-离子能跟碘离子(I-)发生反应生成(I2),I2能使淀粉变蓝色.可以根据这些条件正确的选择物质.碘化钾溶液能提供碘离子,食醋能提供酸性环境,淀粉能提供反应物.观察选项,故选C.
点评:
本题考点: 加碘盐的检验;科学探究的意义.
考点点评: 解答本题要根据物质的性质选择合适的物质进行实验,要求同学们加强对物质性质的记忆,以便灵活应用.1年前查看全部
- 碘和碘酸根在酸性,中性溶液中反应方程式
 lynn30031年前1
lynn30031年前1 -
 ymyee狼 共回答了18个问题
ymyee狼 共回答了18个问题 |采纳率94.4%酸性溶液
5I- + IO3- + 6H+ == 3I2 + 3H2O
中性溶液
5I- + IO3- + 3H2O== 3I2 + 6OH-1年前查看全部
- 向氢氧化铁中加氢碘酸溶液的离子方程式/
 li_woofer1年前3
li_woofer1年前3 -
 njliuhj 共回答了26个问题
njliuhj 共回答了26个问题 |采纳率88.5%首先,氢碘酸是强酸,可溶解氢氧化铁,离子方程式为:
2Fe(OH)3 + 6H+ = 2Fe3+ + 6H2O
然后,Fe3+又可把氢碘酸中的碘离子氧化成碘,离子方程式为:
2Fe3+ + 2I- = 2Fe2+ + I2
将上述两个离子方程式合并为:
2Fe(OH)3 + 6H+ + 2I- = 2Fe2+ + I2 + 6H2O1年前查看全部
- 加碘食盐中碘元素以碘酸根(IO3-)的形式存在.已知在酸性条件下,IO3-离子能跟碘离子(I-)发生反应生成碘(I2),
加碘食盐中碘元素以碘酸根(IO3-)的形式存在.已知在酸性条件下,IO3-离子能跟碘离子(I-)发生反应生成碘(I2),碘能使淀粉变色.现提供下列试剂和生活中常见的物质:①碘化钾溶液(溶液中含有I-) ②白醋 ③白糖 ④白酒 ⑤纯碱 ⑥淀粉.欲通过实验证明加碘食盐中存在碘酸根离子,必须选用的试剂和物质是( )
A. ①②⑥
B. ①②③
C. ①⑤⑥
D. ②④⑤ 晒月亮S1年前1
晒月亮S1年前1 -
 杨尚樵 共回答了18个问题
杨尚樵 共回答了18个问题 |采纳率83.3%解题思路:本题是信息给予题,可根据题中的信息“已知在酸性条件下,IO3-离子能跟碘离子(I-)发生反应生成(I2),I2能使淀粉变蓝色”及完成化学反应所需的物质的成分进行分析.根据题中信息“在酸性条件下,IO3-离子能跟碘离子(I-)发生反应生成(I2)”可知所需物质有碘酸根、碘离子、酸性物质,对比选项白醋呈酸性,碘化钾溶液中含有碘离子,所以有①②;根据信息“I2遇淀粉变蓝色”可知需要淀粉.所以必须的试剂和物质是①②⑥
故选A点评:
本题考点: 加碘盐的检验.
考点点评: 本题比较简单,主要考查学生获取信息的能力及对常见生活物质的成分的判断.1年前查看全部
- (2010•和平区一模)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸
(2010•和平区一模)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.
问题1 工业生产碘酸钾的流程如下:
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同.请写出反应器中发生反应的化学方程式:______;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是______.
问题2 已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2温度/℃ 20 40 60 80 KIO3g/100g水 8.08 12.6 18.3 24.8
=2I-+S4O 2−3
.O 2−6
(1)测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.则加碘食盐样品中的碘元素含量是[1270/3W][1270/3W]mg/kg(以含w的代数式表示).
(2)学生乙又进行了下列实验:
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示______.操作步骤 实验现象 取1g纯净的NaCl,加3mL水配成溶液. 溶液无变化 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. 溶液无变化 然后再滴入1滴1mol/L的H2SO4,振荡. 溶液变蓝色
②根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:______(填“偏大”、“偏小”或“正确”).
其原因是______. wwy1987221年前1
wwy1987221年前1 -
 ff11gg 共回答了18个问题
ff11gg 共回答了18个问题 |采纳率88.9%解题思路:问题1
(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低60价,故I2系数为6,根据元素守恒配平KClO3、H2O、KH(IO3)2的系数;
(2)由表中数据可知温度越高,KIO3溶解度越大,从溶液中获得晶体需要蒸发结晶;
问题2
(1)根据硫代硫酸钠与碘酸钾的关系式计算碘酸钾的物质的量,再根据质量分数公式计算碘的含量;
(2)①酸性条件下,碘离子被氧气氧化生成碘单质;
②过量的碘离子易被空气氧化生成碘单质.(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低共60价,故I2系数为6,根据氯元素守恒可知KClO3系数为11,根据碘元素守恒可知KH(IO3)2的系数为6,根据氢元素守恒可知H2O、系数为3,检查氧元素守恒,故方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)由表中数据可知温度越高,KIO3溶解度越大,从溶液中获得KIO3晶体需要蒸发结晶,故答案为:蒸发结晶;
(1)设碘酸钾的物质的量为x.
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O①; I2+2S2O3 2-=2I-+S4 O62-②,将方程式②×3+①得
IO3-+6H++6S2O32-=I-+3S4O62-+3H2O
16
x2.0×10-3mol/L×0.01L
x=
2.0×10−3mol/L×0.01L×1
6=[1/3×10−5mol,根据碘原子守恒知,碘元素的质量=
1
3×10−5mol/L×127g/mol=4.23×10-4g,所以碘元素的质量分数=
1.27×10−3
3
w]×100%=[1270/3W]mg/kg,
故答案为:[1270/3W];
(2)①酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:4I-+4H++O2=2I2+2H2O,故答案为:4I-+4H++O2=2I2+2H2O;
②酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质,导致测定结果偏大,故答案为:偏大,过量的I-会被空气中的O2氧化为I2.点评:
本题考点: 化学实验方案的评价;离子方程式的书写;氧化还原反应;中和滴定.
考点点评: 本题考查了氧化还原反应方程式的配平及有关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量,为易错点.1年前查看全部
- 常温下,pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01mol/L的碘酸(
常温下,pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性.
请回答下列问题:
(1)高碘酸是______(填“强酸”或“弱酸”),理由是______.
(2)0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合所得溶液中IO3-与Na+的浓度关系是______(填“大于”、“小于”或“等于”).
(3)已知高碘酸和硫酸锰在溶液中反应生成高锰酸、碘酸和硫酸,此反应中的还原剂是______(写化学式),该反应的离子方程式为______. mengfan1501年前1
mengfan1501年前1 -
 christy蓝薇 共回答了15个问题
christy蓝薇 共回答了15个问题 |采纳率86.7%解题思路:(1)pH=2的高碘酸溶液与pH=12的NaOH溶液中氢离子浓度和氢氧根离子的浓度相等,氢氧化钠是强碱,讨论高碘酸分别为强酸或弱酸,根据反应后溶液的酸碱性判断;
(2)由0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性,说明碘酸(HIO3)或高锰酸(HMnO4)都是强酸,0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,两者恰好完全反应,生成碘酸钠,是强酸强碱盐,溶液呈中性,c(H+)=c(OH-),电荷守恒知,c(IO3-)+c(OH-)=c(H+)+c(Na+),所以液中IO3-与Na+的浓度相等;
(3)高碘酸和硫酸锰在溶液中反应生成高锰酸、碘酸和硫酸,根据化合价的变化结合氧化还原反应得失电子数目相等书写离子方程式.(1)pH=2的高碘酸溶液与pH=12的NaOH溶液中氢离子浓度和氢氧根离子的浓度相等,氢氧化钠是强碱,等体积混合时,若溶液呈中性,说明氢离子和氢氧根离子恰好反应,高碘酸是强酸,但实际上混合溶液呈酸性,这说明高碘酸又电离出部分氢离子,所以高碘酸是弱酸,
故答案为:弱酸;pH=2的高碘酸电离出的c(H+)和pH=2的NaOH溶液电离出的c(OH-)相等,且两者体积相等,但所得溶液显酸性,则高碘酸必定是不完全电离,所以高碘酸是弱酸;
(2)由0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性,说明碘酸(HIO3)或高锰酸(HMnO4)都是强酸,0.01mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,两者恰好完全反应,生成碘酸钠,是强酸强碱盐,溶液呈中性,c(H+)=c(OH-),电荷守恒知,c(IO3-)+c(OH-)=c(H+)+c(Na+),所以液中IO3-与Na+的浓度相等,故答案为:等于;
(3)高碘酸和硫酸锰在溶液中反应生成高锰酸、碘酸和硫酸,反应中Mn元素的化合价升高,则MnSO4为还原剂,在酸性条件下高碘酸和锰离子发生氧化还原反应生成生成高锰酸、碘酸和硫酸,所以离子方程式为2Mn2++5HIO4+3H2O═2MnO4-+5IO3-+11H+,故答案为:MnSO4;2Mn2++5HIO4+3H2O═2MnO4-+5IO3-+11H+.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱混合反应以及氧化还原反应,题目难度中等,解答本题时注意判断酸碱溶液中氢离子和氢氧根离子的物质的量关系,根据反应后溶液的酸碱性判断,本题易错点为(2),注意电解质强弱的判断.1年前查看全部
- 酸最多有几元?原碘酸H7IO7是7元酸吗?有没有更高元的酸?
 朵朵白云飘1年前1
朵朵白云飘1年前1 -
 赌坊066号 共回答了20个问题
赌坊066号 共回答了20个问题 |采纳率90%这个在有机化学中是可以有很多的,加入说有一个很长的炭链,每增加一个羧基就成为(n+1)元酸,到底能有多少,我还没有看见有人统计过.
原碘酸估计不能存在,通常高碘酸称作三缩原碘酸,也就是原碘酸脱掉三分子的水的产物.如果存在的话,它就是一个七元酸.1年前查看全部
大家在问
- 1把200千克的橘子和苹果配成水果拼盘出售,每千克2.7元,已知橘子和苹果的重量比是3:2,单价比是5比6,求橘子
- 2若关于x的方程(ax+b)(d-cx)=m(ac≠0)的二次项系数是ac,则常数项为( )
- 3( )comes before ( ) A Tuesday ; wednesday B Thursday ; wedne
- 4如图,△ABC中,D是BC边的中点,E、F分别是AB、AC边上的点,且∠EDF=90°,求证:BE+AF>EF
- 5l like this pair of football boots could l_____please A try
- 6如果地球磁场突然消失、改变或混乱,会不会使地球上的磁铁暂时失去磁性?
- 7帮我用几何画板画个图吧y=6.406sin(2π/224.701x+0.03)和y=6.406sin(2π/224.70
- 8文言文中的词类活用,判断句式和倒装句式是什么?
- 9HF和Na2CO3(aq)反应生成什么?(请写出方程式,并说明为什么是这样反应,)
- 10函数y=lgsin(2x+π3)的单调递减区间为______.
- 11我的烦恼600字作文
- 12如图反比例函数Y=-4/X的图像与直线Y=-1/3X的交点为A、B
- 13they often _____ (visit) our factory last year .
- 14若(1+2x)100=a0+a1(x-1)+a2(x-1)2+……+a100(x-1)100,那么:a1+a3+a5+…
- 15下雨天小刚在家中看到一束光亮后又听到一声猛烈的雷声他能否测出打雷的地方到这里多远经过思考小刚找出
