6.5克锌与稀盐酸反应生成0.19克的氢气,问含杂质可能是什么,A---Mg,B----Fe,C-----Na,D--C
 yy之王者归来2022-10-04 11:39:541条回答
yy之王者归来2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 landlordlxh 共回答了16个问题
landlordlxh 共回答了16个问题 |采纳率93.8%- D
6.5g锌即为0.1mol,如果是纯净物即生成0.1mol氢气,即0.2g.现生成氢气不足0.1mol,即杂质生成氢气的相对原子量比要大于锌或杂质与盐酸反应不产生氢气或杂质不与盐酸反应.(同时,要注意杂质可不可能与水反应,有的题会涉及到水的因素,如Na.) - 1年前
相关推荐
- 烧杯中有50克硫酸铜溶液加入6.5克锌恰好完全反应,求铜的质量!急!
 功城1年前2
功城1年前2 -
 寻找心灵的空间 共回答了1个问题
寻找心灵的空间 共回答了1个问题 |采纳率6、4g1年前查看全部
- 用锌与足量稀硫酸反应制取氢气,若耗锌6.5克
用锌与足量稀硫酸反应制取氢气,若耗锌6.5克
所得氢气与足量氯气反应,可以生成氯化氢多少克?
我算的是7.2,怎么答案是7.3呢? flame_9111年前6
flame_9111年前6 -
 昨岸天堂 共回答了16个问题
昨岸天堂 共回答了16个问题 |采纳率93.8%如题目所说,消耗6.5克锌,根据方程式计算会产生0.2克氢气
0.2克氢气再与足量氯气反应根据方程式
H2 + Cl2 = 2HCl
氯化氢的相对分子质量36.5
计算可得生成氯化氢7.3克
你应该是在计算氯化氢的相对分子质量的时候算错了1年前查看全部
- 实验室用金属锌与稀硫酸反应制取氢气,反应还生成硫酸锌(65),试写出该反应的化学方程式.用6.5克锌与100克溶质质量分
实验室用金属锌与稀硫酸反应制取氢气,反应还生成硫酸锌(65),试写出该反应的化学方程式.用6.5克锌与100克溶质质量分数为百分之十的稀硫酸反应1.最多能制取多少氢气2.反应后所得溶液的总质量是多少?溶质是何物质?
 aa_19701年前1
aa_19701年前1 -
 网站先锋 共回答了24个问题
网站先锋 共回答了24个问题 |采纳率91.7%Zn+H2SO4=ZnSO4+H2(气体箭头)
65 98
6.5g x g
65*x=98*6.5 x=9.8g 现在的硫酸溶液含100*10%=10g硫酸,足以耗尽锌,硫酸有剩余.
那么 Zn+H2SO4=ZnSO4+H2(气体箭头)
65 2
6.5g y g
65*y=6.5*2 y=0.2g
制得最多0.2g氢气.
反应根据质量守恒原理,溶液总质量是反应物总质量减氢气的质量,就是100+6.5-0.2=106.3g
溶质有多余的硫酸还有硫酸锌.1年前查看全部
- 求6.5克含杂质的质量分数为20%的锌与足量的稀硫酸反应后,生成氢气的质量为多少?(杂质不与硫酸反应) 求6.5克含杂质
求6.5克含杂质的质量分数为20%的锌与足量的稀硫酸反应后,生成氢气的质量为多少?(杂质不与硫酸反应) 求6.5克含杂质的质量分数为20%的锌与足量的稀硫酸反应后,生成氢气的质量为多少?(杂质不与硫酸反应)!(要根据格式算)要详细哦.
 停不了的薯片1年前1
停不了的薯片1年前1 -
 大P虫 共回答了27个问题
大P虫 共回答了27个问题 |采纳率96.3%锌的质量=6.5×(1-20%)=5.2克
设生成氢气的质量为X
Zn+H2SO4=ZnSO4+H2
65 2
5.2g X
65/2=5.2g/x
x=0.16g
生成氢气的质量为0.16g1年前查看全部
- 6.5克锌与100克稀硫酸恰好完全反应。试回答:
6.5克锌与100克稀硫酸恰好完全反应。试回答:
1.反应后溶液的溶质化学式是_____。
2.稀硫酸中溶质的质量和容积的质量?
反应后溶液的质量是多少?
帮帮我?说一下丶 守护5只爱在在1年前2
守护5只爱在在1年前2 -
 282713336 共回答了277个问题
282713336 共回答了277个问题 |采纳率19.1%设反应后生成氢气质量为X。反应硫酸质量为Y。生成硫酸锌质量Z Zn + H2SO4 = ZnSO4 + H2↑ 65 98 161 2 6.5克 Y Z X X=0.2克 Y=9.8克 Z=16.1克 (1)反应后溶质为ZnSO4 (2)稀硫酸中溶质质量为9.8克 溶剂质量为100-9.8=90.2克 (3)反应后溶液质量为6。5.+100-0.2=106.3克1年前查看全部
- (6分)锌与盐酸(HCl)反应生成氢气和氯化锌。实验室里用6.5克锌与足量盐酸反应,可制得氢气和氯化锌的质量各是多少?
 小猫头儿1年前1
小猫头儿1年前1 -
 xu3m 共回答了18个问题
xu3m 共回答了18个问题 |采纳率100%氢气0.2g 氯化锌13.6g
1年前查看全部
- 若6.5克锌与100克稀硫酸恰好完全反应……急!
若6.5克锌与100克稀硫酸恰好完全反应……急!
若6.5克锌与100克稀硫酸恰好完全反应,则该稀硫酸中,溶质的化学式为
——,其质量为——,溶剂的化学是为——,其质量为——. hcl14411年前1
hcl14411年前1 -
 tysqwxh 共回答了15个问题
tysqwxh 共回答了15个问题 |采纳率80%H2SO4;9.8克;H2O;90.2克.1年前查看全部
- 已知6.5克锌与100克稀硫酸恰好完全反应据以上所给你都能通过进行计算获得有关的哪些数据?(锌:65 氢:1 硫:32
已知6.5克锌与100克稀硫酸恰好完全反应据以上所给你都能通过进行计算获得有关的哪些数据?(锌:65 氢:1 硫:32 氧:16)
 愚慧阁1年前2
愚慧阁1年前2 -
 走路我一个 共回答了18个问题
走路我一个 共回答了18个问题 |采纳率94.4%设生成氢气的质量为x,生成硫酸锌的质量为y,消耗硫酸的质量为z
Zn + H2S04 = H2↑ + ZnSO4
解得x=0.2,y=16.1,z=9.8
产生氢气的质量为0.2g
硫酸的质量分数=9.8/100*100%=9.8%
生成硫酸锌的质量为16.1g
那么反应后溶液的总质量为100+6.5-0.2=106.3g
那么生成硫酸锌的质量分数为16.1/106.3*100%=15.1%1年前查看全部
- 一位学生要用天平称量6.5克药品,在称量中发现指针向左偏转,这时他应该( )
一位学生要用天平称量6.5克药品,在称量中发现指针向左偏转,这时他应该( )
A.移动游码
B.减少药品
C.向右盘中加砝码
D.调节天平的平衡螺母 zdcxc1年前1
zdcxc1年前1 -
 木子-草人云 共回答了19个问题
木子-草人云 共回答了19个问题 |采纳率94.7%解题思路:使用托盘天平称量药品时应遵循“左物右码”,天平指针偏左,说明药品质量大于砝码质量,应减少药品.一位学生要用天平称量6.5克药品,步骤是:调节天平平衡,先向右边托盘添加砝码和拨动游码,然后向左边托盘添加食盐直至天平平衡;在称量中发现指针向左偏转,说明药品的质量大于需要的质量,应减少药品.
故选:B.点评:
本题考点: 称量器-托盘天平.
考点点评: 托盘天平的使用是化学的基本操作之一,是中考考查的热点,掌握天平的使用步骤、注意事项、误差分析等是正确解答此类题的关键.1年前查看全部
- 6.5克的镁和20mL质量分数为0.37(密度为1.19g/cm2)的浓盐酸反应在标况下课生成多少升氢气?若只收集到..
6.5克的镁和20mL质量分数为0.37(密度为1.19g/cm2)的浓盐酸反应在标况下课生成多少升氢气?若只收集到...
6.5克的镁和20mL质量分数为0.37(密度为1.19g/cm2)的浓盐酸反应在标况下课生成多少升氢气?若只收集到2.2L问氢气的产率是多少? 法ww11年前1
法ww11年前1 -
 snoopy5917 共回答了24个问题
snoopy5917 共回答了24个问题 |采纳率95.8%题中给出的镁为0.271摩尔,盐酸中含HCl0.24摩尔,Mg + 2HCl =MgCl2 + H2故镁过量,HCl反应完全,由HCl计算得生成氢气=0.24*1*22.4/2=2.688 L
若只收集到2.2 L氢气则产率=2.2/2.688=81.85%1年前查看全部
- 把6.5克锌加入足量硫酸溶液中,锌完全全反应.求生成氢气的体积
把6.5克锌加入足量硫酸溶液中,锌完全全反应.求生成氢气的体积
可以有过程吗? 谢谢了。 shifengwenwen1年前4
shifengwenwen1年前4 -
 adria 共回答了20个问题
adria 共回答了20个问题 |采纳率80%设生成氢气的质量为a
化学方程式为Zn+H2SO4==H2+ZnSO4
65 2
6.5g a
65/6.5g=2/a
a=6.5g*2/65=0.2g
所以生成的氢气质量为0.2g
又因为氢气密度约为0.089g/L
V氢气=m氢气/密度=0.2g/0.089g/L=2.24L
答:生成氢气体积约为2.24L
(注:化学方程式的氢气后面要加箭头.计算体积时最后一步用约等号)1年前查看全部
- 某不纯锌块6.5克,与足量盐酸完全反应放出氢气0.18克,则锌块中含有的杂质可能是( )
某不纯锌块6.5克,与足量盐酸完全反应放出氢气0.18克,则锌块中含有的杂质可能是( )
A. Mg
B. Al
C. Fe
D. Cu 留个人给我1年前3
留个人给我1年前3 -
 狮子不惊 共回答了18个问题
狮子不惊 共回答了18个问题 |采纳率100%解题思路:金属与酸发生置换反应的条件:(1)对金属的要求:必须是金属活动性顺序中排在氢以前的金属;(2)对酸的要求:这里所指的酸并不是所有的酸,主要是指稀盐酸和稀硫酸.
金属与酸反应产生H2的规律:
(1)H2的质量=金属的质量×[金属在化合物中的化合价/该金属的相对原子质量]
(2)等质量的几种金属与足量酸反应产生的H2质量与[金属在化合物中的化合价/该金属的相对原子质量]的值成正比,该值越大,产生的H2质量越多,该值越小,产生的H2质量越小.6.5克纯锌片放在足量的稀盐酸中 放出的氢气是0.2克,存在杂质导致生成的氢气的质量减少,即相同质量金属杂质比锌生成的氢气质量少;
化学方程式 [金属在化合物中的化合价/该金属的相对原子质量]
Zn+2HCl═ZnCl2+H2↑ [2/65]
Mg+2HCl═MgCl2+H2↑[1/12]
2Al+6HCl═2AlCl3+3H2↑ [1/9]
Fe+2HCl═FeCl2+H2↑[1/28]
[1/9]>[1/12]>[1/28]>[2/65],所以相同质量的锌、镁、铝、铁与足量的盐酸反应,生成氢气的质量大小为铝>镁>铁>锌;
而铜不与盐酸反应;
故选D.点评:
本题考点: 金属的化学性质;含杂质物质的化学反应的有关计算;酸的化学性质;根据化学反应方程式的计算.
考点点评: 相同质量的金属镁、铝、锌、铁与足量盐酸反应放出氢气的质量由大到小的顺序为铝>镁>铁>锌.1年前查看全部
- 某锌样品6.5克与足量稀硫酸完全反应后生成氢气0.195克,则其所含杂质不可能是?
某锌样品6.5克与足量稀硫酸完全反应后生成氢气0.195克,则其所含杂质不可能是?
A铁B镁 C铝 铜 afei7851年前1
afei7851年前1 -
 贝二妞 共回答了24个问题
贝二妞 共回答了24个问题 |采纳率87.5%选A铁B镁 C铝
Zn+H2SO4===ZnSO4+H2
6.5克纯锌与稀硫酸完全反应后生成氢气0.2克
而现在生成氢气比0.2g少
所以这种杂质或者与硫酸不反应
或者它的相对分子量大于锌[即大于65]
反应生成的氢气才会少
备选答案中只有铜才能让Zn放出气体少于0.2g.
因为Cu于H2SO4不反应不放出氢气
所以答案选ABC1年前查看全部
- 将6.5克锌粒加入50克稀硫酸溶液中,恰好完全反应,求生成氢气的质量为多少克?(2)硫酸的溶质的质量分数?
 nila211年前1
nila211年前1 -
 motodik 共回答了9个问题
motodik 共回答了9个问题 |采纳率100%1.每65克锌生成2克氢气,所以6.5克生成0.2克氢气.
2.每65克锌要和98克H2SO4反应,所以50克硫酸中含9.8克H2SO4,质量分数就是9.8除以50再乘以百分之一百,也就是19.6%.1年前查看全部
- 将6.5克锌粒加入50克硫酸溶液中,恰好完全反应.求;
将6.5克锌粒加入50克硫酸溶液中,恰好完全反应.求;
(1)生成氢气的质量为多少克?
(2)硫酸溶液的溶质的质量分数?
(3)反应后所得溶液中溶质的质量分数? hy_80801年前1
hy_80801年前1 -
 fort_gg 共回答了17个问题
fort_gg 共回答了17个问题 |采纳率100%解题思路:由锌的质量和稀硫酸的质量根据锌与硫酸反应的化学方程式可以计算出生成氢气的质量和硫酸溶液中溶质的质量分数.设生成氢气的质量为x,硫酸溶液中溶质的质量为y,反应后所得溶液中溶质硫酸锌的质量为z.
Zn+H2SO4=ZnSO4+H2↑
65981612
6.5g yzx
[65/6.5g]=[2/x] [65/6.5g]=[98/y] [65/6.5g]=[161/z]
x=0.2g,y=9.8g,z=16.1g
稀硫酸中溶质质量分数为[9.8g/50g]×100%=19.6%;
所得溶液的质量为6.5g+50g-0.2g=56.3g
所得溶液中溶质质量分数为[16.1g/56.3g]×100%=29%
答:(1)生成氢气的质量为0.2g.
(2)硫酸溶液中溶质的质量分数为19.6%.
(3)反应后所得溶液中溶质的质量分数为29%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查含杂质物质的化学方程式的计算和溶质质量分数的计算,难度较大.1年前查看全部
- 一桶咖啡共500克,冲一杯咖啡要用45克咖啡和6.5克方糖。這桶咖啡最多能冲多少杯?
 睡觉不关灯1年前6
睡觉不关灯1年前6 -
 ckonly1 共回答了1个问题
ckonly1 共回答了1个问题 |采纳率100%111年前查看全部
- 初二化学:锌与盐酸反应生成氢气和氯化锌,实验室利用6.5克锌与足量盐酸反应,可制得氢气和氯化锌各是多
初二化学:锌与盐酸反应生成氢气和氯化锌,实验室利用6.5克锌与足量盐酸反应,可制得氢气和氯化锌各是多
少? 让不让人活1年前3
让不让人活1年前3 -
 song505 共回答了22个问题
song505 共回答了22个问题 |采纳率86.4%设氢气质量为x,氯化锌的质量为y
Zn+HCl=H2↑+ZnCl2
65 2 136
6.5g x y
65/6.5g=2/x=136/y
x=0.2g y=13.6g
答:可制得氢气0.2g、氯化锌13.6g.1年前查看全部
- 蛋糕店做一种奶油蛋糕,每个要用6.5克奶油.5O克奶油最多可以做多少个这样的蛋糕?
 superzypower1年前3
superzypower1年前3 -
 lyfpei 共回答了17个问题
lyfpei 共回答了17个问题 |采纳率76.5%7个.1年前查看全部
- 6.5克锌于100克稀硫酸恰好完全反应
6.5克锌于100克稀硫酸恰好完全反应
完全反应后,所得溶液质量多少克,
溶质的化学式是什么,其质量为多少克?
溶剂的化学式是什么,其质量为多少克? 黄昏落暮1年前7
黄昏落暮1年前7 -
 巴夺 共回答了13个问题
巴夺 共回答了13个问题 |采纳率100%Zn+H2SO4=ZnSO4+H2
因为Zn=6.5g,所以需要H2SO4=9.8克
生成氢气0.2g,ZnSO4=16.1g
因此:所得溶液=100+6.5-0.2=106.3g
r最后的溶质为ZnSO4,质量为16.1g
溶剂是水 质量为=106.3-16.1=90.21年前查看全部
- 6.5克锌粒与93.7稀硫酸恰好完全反应.请计算:
6.5克锌粒与93.7稀硫酸恰好完全反应.请计算:
(1)可产生氢气的质量是多少克?
(2)反应后所得溶液中溶质的质量分数. 青岛兰兰1年前1
青岛兰兰1年前1 -
 up2sky 共回答了24个问题
up2sky 共回答了24个问题 |采纳率91.7%解题思路:根据题中的叙述列出化学方程式,再依据所给数据和设出的数据找出比例关系进行解答,最后将解出的答案进行总结即可.6.5是纯锌的质量,而93.7是溶液的质量,所以可以直接使用6.5,而不可以用93.7带入化学方程式计算.(1)设可产生氢气的质量为x,ZnSO4质量为y.
Zn+H2SO4=ZnSO4+H2↑
651612
6.5gyx
[65/6.5g=
161
y=
2
x]
x=0.2g
y=161.g
(2)反应后所得溶液中溶质的质量分数=[16.1g/6.5g+93.7g−0.2g]×100%=16.1%
答:(1)产生氢气的质量是0.2g;
(2)反应后所得溶液中溶质的质量分数为16.1%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 在解此类题时,首先书写化学方程式,然后在列出比例关系解答相关数据,最后进行总结即可.1年前查看全部
- 一、6.5克锌与50克稀硫酸正好完全反应,
一、6.5克锌与50克稀硫酸正好完全反应,
1、求硫酸溶液的质量分数是多少
2、反应后溶液的质量分数是多少
二、把100克质量分数为百分之7.3的稀盐酸加到盛有m克纯净锌片的烧杯恰好完全反应
1、m是多少
2、收集到的氢气质量
3、放出气体后,烧杯中剩余物体质量 摘蔬1年前1
摘蔬1年前1 -
 五米阳光 共回答了15个问题
五米阳光 共回答了15个问题 |采纳率93.3%Zn+H2SO4=ZnSO4+H2
65 98 161
6.5 m n
m=98×6.5/65=9.8g
质量分数=9.8/50=0.196=19.6%
n=161×6.5/65=16.1g
反应后溶液是ZnSO4的水溶液
原硫酸中水的质量为50-9.8g=40.2g
质量分数16.1/(16.1+40.2)=0.286=28.6%
盐酸的质量=100×7.3%=7.3g
Zn+2HCl=ZnCl2+H2
65 73 136 2
m 7.3 x n
m=7.3×65/73=6.5g
氢气的质量n=7.3×2/73=0.2g
少杯中剩余物质为水和氯化锌
x=136×7.3/73=13.6g
盐酸中水的质量为100-7.3=92.7g
烧杯剩余质量=13.6+92.7=106.3g1年前查看全部
- 用6.5克锌跟50克稀硫酸恰好完全反应,求生成后物的溶质的质量分数
 迷途小生1年前3
迷途小生1年前3 -
 永福寺 共回答了15个问题
永福寺 共回答了15个问题 |采纳率86.7%答案错的,应该是28.5%1年前查看全部
- 把6.5克锌放入足量盐酸中,锌完全反应,求生成氢气的体积.答案上写了个化学方程式,在锌下面写了1摩尔,又在下面写了个0.
把6.5克锌放入足量盐酸中,锌完全反应,求生成氢气的体积.答案上写了个化学方程式,在锌下面写了1摩尔,又在下面写了个0.1摩尔,在氢气下面写22.4L,又在下面写V(H2),
 venlong1年前1
venlong1年前1 -
 祚10 共回答了12个问题
祚10 共回答了12个问题 |采纳率91.7%这是过程,你一交叉相乘就做出来了,V(H2)是要计算的结果,Zn下面的1mol表示跟氢气下面的22.4升表示1molZn反应生成1mol氢气也就是22.4升氢气,Zn下面写0.1mol是因为题目说是6.5克的Zn参加反应,相应的H2下面的V(H2)表示此时生成的氢气的体积
所以交叉相乘V(H2)=0.1X22.4÷1=2.24升1年前查看全部
- 6.5克锌和50克稀硫酸恰好完全反应.求:(1)稀硫酸中溶质、溶剂的质量
6.5克锌和50克稀硫酸恰好完全反应.求:(1)稀硫酸中溶质、溶剂的质量
2)所得溶液的质量
(3)所得溶液中溶质和溶剂的质量 gjacky1年前4
gjacky1年前4 -
 铺张浪费 共回答了15个问题
铺张浪费 共回答了15个问题 |采纳率86.7%设硫酸溶液中溶质的质量为x,反应生成H2的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
6.5g x y
65/6.5=98/x
65/6.5=2/y
x=9.8g
y=0.2g
硫酸溶液中溶质的质量分数=9.8/50*100%=18.6%
所得溶液的质量=6.5+50-0.2=56.3g
答:反应生成氢气的质量是0.2g,硫酸溶液中溶质的质量分数是18.6%,反应后所得溶液的质量是56.3g.1年前查看全部
- 把6.5克锌放如足量的盐酸中,完全反应.计算6.5克锌的物质的量
 西汉游侠1年前4
西汉游侠1年前4 -
 xujunhang 共回答了13个问题
xujunhang 共回答了13个问题 |采纳率100%n=m/M=6.5/65=0.1mol1年前查看全部
- 小明同学取6.5克的锌,加入100克稀硫酸,两者恰好完全反应.请回答下列问题.
小明同学取6.5克的锌,加入100克稀硫酸,两者恰好完全反应.请回答下列问题.
(1)锌与稀硫酸反应的化学方程式是
(2)100克稀硫酸中,溶质是 (用化学式表示),溶剂是 ,溶液中溶质的质量分数是
(3)完全反应后所得溶液中的溶质是 (用化学方程式表示) ,溶质的质量是 ,溶液的质量是 .该溶液中溶质的质量分数是 .(计算结果保留到0.1%) 毛虫090081年前1
毛虫090081年前1 -
 3218131 共回答了23个问题
3218131 共回答了23个问题 |采纳率91.3%1、Zn+H2SO4==ZnSO4+H2↑
2、H2SO4 H2O 能与6.5锌完全反应,根据1、中的化学反应.锌和硫酸是1:1反应的.锌的物质的量为6.5÷65=0.1mol .硫酸也是0.1mol=0.1×98=9.8g 质量分数=(用溶质的质量除以溶液的质量)9.8÷100=9.8%
3、根据1、的化学反应方程式,得知得到的溶液的溶质是ZnSO4 .根据方程式得知 与锌也是1:1.所以溶质的 质量(ZnSO4)=0.1×(65+96)=16.1.质量分数为【16.1÷(16.1+(100-9.8){这是是在稀硫酸的溶剂水})=16.7%1年前查看全部
- 50克稀盐酸和6.5克锌完全反应,求1:生成氢气多少克?2:稀硫酸中溶质的质量分数?3:
50克稀盐酸和6.5克锌完全反应,求1:生成氢气多少克?2:稀硫酸中溶质的质量分数?3:
50克稀盐酸和6.5克锌完全反应,求1:生成氢气多少克?2:稀硫酸中溶质的质量分数?3:所得溶液中溶质的质量分数? 少数派031年前1
少数派031年前1 -
 卡卡33 共回答了18个问题
卡卡33 共回答了18个问题 |采纳率94.4%前是稀盐酸,后是稀硫酸,前后应统一,下面以稀盐酸进行计算.
1、设生成氢气的质量为X
Zn + 2HCl = ZnCl2 + H2↑
65 2
6.5g X
X=0.2g
2、设稀盐酸中含氯化氢的质量为Y
Zn + 2HCl = ZnCl2 + H2↑
65 73
6.5g Y
Y=7.3g
稀盐酸中溶质的质量分数=7.3g/50g*100%=14.6%
3、设生成氯化锌的质量为Z
Zn + 2HCl = ZnCl2 + H2↑
65 136
6.5g Z
Z=13.6g
所得溶液中溶质的质量分数=13.6g/(6.5g+50g-0.2g)*100%=24.2%
答1:生成氢气0.2克;2: 稀盐酸中溶质的质量分数14.6%3: 所得溶液中溶质的质量分数24.2%.
希望我的回答能对你的学习有帮助!1年前查看全部
- (4分)将6.5克锌放入足量的稀硫酸里充分反应。
(4分)将6.5克锌放入足量的稀硫酸里充分反应。
(1)写出反应的离子方程式
(2)生成标准状况下的H 2 多少升? neuf1年前1
neuf1年前1 -
 网事1970 共回答了21个问题
网事1970 共回答了21个问题 |采纳率95.2%(4分)
(1)Zn+H + +=Zn 2+ + H 2 ↑
(2)2.24L
1年前查看全部
- 急!九年级化学:6.5克锌和50克稀硫酸恰好完全反应.求:(1)稀硫酸中溶质、溶剂的质量
急!九年级化学:6.5克锌和50克稀硫酸恰好完全反应.求:(1)稀硫酸中溶质、溶剂的质量
(2)所得溶液的质量
(3)所得溶液中溶质和溶剂的质量
请写出解题步骤!谢谢! 58167881年前6
58167881年前6 -
 guhuz 共回答了13个问题
guhuz 共回答了13个问题 |采纳率100%设稀硫酸中溶质的质量为X1
生成氢气的质量为X2
Zn + H2SO4 === ZnSO4 + H2↑
65 98 2
6.5g X1 X2
求出X1===9.8g
X2===0.2g
(1)所以稀硫酸中溶质的质量为9.8g
溶剂的质量的质量为:
50g---9.8g===40.2g
(2)根据质量守恒定律:
所得溶液的质量为:
50g + 6.5g --0.2g===56.3g
(3) 设生成硫酸锌的质量为X3
Zn + H2SO4 === ZnSO4 + H2↑
65 161
6.5g X3
求出x3===16.1g
所得溶液中溶质的质量为16.1g
则所得溶液中溶剂的质量为
56.3g---16.1g===40.2g1年前查看全部
- 题目是 烧杯中有50克硫酸铜溶液加入6.5克锌恰好完全反应
题目是 烧杯中有50克硫酸铜溶液加入6.5克锌恰好完全反应
(1)反应后生成铜的质量
(2)反应后溶液中溶质的质量分数
计算保留一位小数 急求 功城1年前0
功城1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 用6.5克锌与足量的稀硫酸反应.
 用6.5克锌与足量的稀硫酸反应.
用6.5克锌与足量的稀硫酸反应.
(1)生成H2的质量为多少?
(2)所得H2在标准状况下体积的表达式为______(标准状况下22.4LH2重2g).
(3)“足量的锌与245克稀硫酸反应,生成氢气的质量是多少?”计算此题时,除题中所给
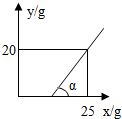
数据必须使用外,还缺少一个______的数据.若用a表示此数据,则生成H2的质量为______g.将所得溶液取W克,在t℃时恒温蒸发水分,随水分的蒸发克数(x)与析出固体质量(y)的关系如图所示,则原溶液是______溶液(填“饱和”或“不饱和”);t℃时该物质饱和溶液中溶质的质量分数为______.(α=45°) linlaner1年前1
linlaner1年前1 -
 learn-to-feel 共回答了21个问题
learn-to-feel 共回答了21个问题 |采纳率90.5%解题思路:(1)写出化学方程式并代入锌的质量计算氢气的质量.
(2)根据括号中的信息列出关系式.
(3)对溶液来说,参加化学反应的物质的质量是指溶质的质量;如果是饱和溶液,一旦水分被蒸发,溶质就会立即析出.(1)设生成的H2质量为X.
Zn+H2SO4═ZnSO4+H2↑
65 2
6.5克X
[65/2]═[6.5克/X]
得:X=0.2克
(2)根据括号中的信息可知,故答案为:22.4L×0.2 g/2g.
(3)对溶液来说,参加化学反应的物质的质量是指溶质的质量,因此缺少硫酸溶液中溶质的质量分数,设生成氢气的质量为Y.
Zn+H2SO4═ZnSO4+H2↑
98 2
245a Y
[98/2]═[245a/Y]
得:Y=5a
如果是饱和溶液,一旦水分被蒸发,溶质就会立即析出,从图象可以看出,刚开始一段时间,虽然水分被蒸发,但是溶质没有析出,说明溶液不是饱和溶液.
∵α=45°,对应的直角三角形是等腰直角三角形.∴从图象可以看出蒸发掉20克水,析出固体的质量是20克,也就是说20克溶质和20克水组成的溶液就是饱和溶液,因此饱和溶液中溶质的质量分数=[20克/20克+20克]×100%═50%.
故答案为:硫酸溶液的质量分数;5a; 不饱和; 50%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 学会分析图象的方法,一般看转折点和图象的走势,注意计算的格式和规范性.1年前查看全部
- 6.5克锌与一定量的浓硫酸完全反应,生成混合气体质量3.92克 至少需1mol/L的NaOH溶液多少毫升完全吸收so2
 可可团团1年前2
可可团团1年前2 -
 kkcc001 共回答了15个问题
kkcc001 共回答了15个问题 |采纳率100%混合气体的平均摩尔质量为3.92/0.1=39.2克/摩尔
二氧化硫与氢气的物质的量比为(39.2-2)/(64-39.2)=372/248
二氧化硫的物质的量0.1×372/(372+248)=0.06摩尔
根据NaOH+SO2=NaHSO3
至少需1mol/L的NaOH溶液60毫升.1年前查看全部
- 今有含杂质10%的锌粒6.5克,含纯锌多少克?若与足量的硫酸反应,可产生多少克氢气?
今有含杂质10%的锌粒6.5克,含纯锌多少克?若与足量的硫酸反应,可产生多少克氢气?
这些氢气在标准状况下体积是多少?
(标准状况下氢气的密度为0.0899g/L)
--------------------------------------------------------------- leafa1年前1
leafa1年前1 -
 kequ 共回答了22个问题
kequ 共回答了22个问题 |采纳率100%ZN+H2SO4=ZNSO4+H2
65 2
6.5 X=0.2
0.2/2=0.1MOL
0.1*22.4=2.24L
2.24*0.0899=0.2G
氢气0.2克
氢气在标准状况下的体积2.24升1年前查看全部
- 某锌粒样品6.5克与足量稀硫酸完全反应后产生氢气0.195可克.所含杂质可能是什么
某锌粒样品6.5克与足量稀硫酸完全反应后产生氢气0.195可克.所含杂质可能是什么
请说明理由 南京形象差点1年前1
南京形象差点1年前1 -
 nuerhachi 共回答了15个问题
nuerhachi 共回答了15个问题 |采纳率93.3%6.5g纯锌与足量稀硫酸反应生成0.2g氢气,所以
所含杂质可能使位于金属活动序氢以后的金属,不与硫酸反应,或是原子量比锌大的活泼金属.1年前查看全部
- 把6.5克Zn放入足量的盐酸中,Zn完全反应 反应过程中转移多少mol 电子
 绛紫雪1年前1
绛紫雪1年前1 -
 只发烂帖 共回答了22个问题
只发烂帖 共回答了22个问题 |采纳率86.4%0.2mol
0 +2
Zn+2HCl=ZnCl2+H2↑
1mol Zn 2mol e
(6.5/65)mol -> 0.2mol1年前查看全部
- 6.5克不纯的锌片和总量的稀硫酸反应后放出0.22克氢气,则锌片中含有的杂质不可能是:
6.5克不纯的锌片和总量的稀硫酸反应后放出0.22克氢气,则锌片中含有的杂质不可能是:
A:Fe B:Cu C:Mg D:Al dorid5211年前1
dorid5211年前1 -
 沈家洛洛 共回答了23个问题
沈家洛洛 共回答了23个问题 |采纳率91.3%6.5克不纯的锌片和总量的稀硫酸反应后放出0.22克氢气 在酸充足的条件下6.5g纯锌最多也只能生成0.2g氢气 题中说放出0.22g氢气 显然等质量的杂质与酸反应放出的氢气质量要比锌放出的氢气质量多 在下面选项中只有B项铜不和酸发生反应 所以不可能 另外三种金属在质量相同酸足量情况下生成的氢气质量都比锌多
选择B1年前查看全部
- 化学里求电量的公式是什么?锌板和铜板用导线相连后浸入稀硫酸中,形成的原电池工作一段时间后,锌板质量减少6.5克,试求:(
化学里求电量的公式是什么?
锌板和铜板用导线相连后浸入稀硫酸中,形成的原电池工作一段时间后,锌板质量减少6.5克,试求:(1)可收集氢气于标准状况下体积是多少毫升?2240ml(2)此时通过导线的电量为多少库伦?
(e=1.6*10^-19)答案:1.93*10^4库伦
第二问这种的公式是什么?怎么求 应该比较简单 是个物理的公式吧 .对物理一窍不通. angie8981年前1
angie8981年前1 -
 豫O0001 共回答了14个问题
豫O0001 共回答了14个问题 |采纳率100%这也不是什么公式:(e=)表示1个电子所带的电量为1.6*10^-19库伦.
此题:在电池工作室锌板质量减少 6.5克,说明有0.1mol Zn参与反应,失去0.2mol电子.
这样在导线中就流过了0.2mol的电子,计算成电量则需乘以阿伏伽德罗常数(NA=6.02 *10^23 ),再乘以每个电子所带的电量1.6*10^-19库伦.就可以了.
即:0.2 * 6.02 *10^23 * 1.6*10^-19 库伦 .1年前查看全部
- 某锌样品6.5克与足量稀硫酸完全反应后生成氢气0.195克,则其所含杂质不可能是?
某锌样品6.5克与足量稀硫酸完全反应后生成氢气0.195克,则其所含杂质不可能是?
A铁B镁 C铝D 铜 为什么 昙花一笑1年前1
昙花一笑1年前1 -
 打赤脚 共回答了22个问题
打赤脚 共回答了22个问题 |采纳率86.4%A铁B镁 C铝
6.5克纯锌与稀硫酸完全反应后生成氢气0.2克,所以这种杂质或者与硫酸不反应,或者它的分子量大于锌,反应生成的氢气少,备选答案中只有铜符合条件.1年前查看全部
- 如题:6.5克不纯的锌与足量稀硫酸反应,生成氢气0.21克,已知这种锌可能含有Fe,Cu,Mg,Al 中的一种或几种杂质
如题:6.5克不纯的锌与足量稀硫酸反应,生成氢气0.21克,已知这种锌可能含有Fe,Cu,Mg,Al 中的一种或几种杂质,则下列说法正确的是:
A、 肯定含有Mg
B 、肯定同时含有Mg,Al,Fe
C、 可能含有Mg,Al
D 、可能同时含有Fe,Cu,Mg,Al geometry1年前15
geometry1年前15 -
 1d453119f8156e10 共回答了29个问题
1d453119f8156e10 共回答了29个问题 |采纳率89.7%如果6.5g为纯Zn的时候,对应的应该是0.2g氢气.现在多产生了0.01g的氢气.
那么其中的杂质就应该是与Zn等物质量时,可以产生等量氢气或者更多氢气的物质.而且这种物质相对原子量应该比Zn小.
举例.3.25g的Zn产生0.1g,杂质中剩下的3.25g为Mg,而3.25g Mg的物质量大于0.05mol,所以产生的氢气也大于0.1g,因此,产生的氢气会大于纯锌时的o.2g
A和B都太绝对,不是肯定的.应该是只要有Mg存在就有可能.C显然对.因为Mg、Al是可以存在的.
答案D中,包含Mg可以时已知成立,而其他几项的微量存在都不会对结果产生过大的影响,况且用了“可能”二字,而这种情况理论上的确可以存在.因此选择CD.1年前查看全部
- 把6.5克Zn放入足量的盐酸中,Zn完全反应.计算:(1)6.5克Zn的物的量多少?(2)能加反应的HCI的物质的量多少
把6.5克Zn放入足量的盐酸中,Zn完全反应.计算:(1)6.5克Zn的物的量多少?(2)能加反应的HCI的物质的量多少?
(3)生成的H2的体积(标准状态)是多少? awei8199881年前3
awei8199881年前3 -
 无悔这E生 共回答了27个问题
无悔这E生 共回答了27个问题 |采纳率81.5%1、n=m/M即n=6.5/65=0.1mol
2、Zn + 2Hcl = ZnCl2 + H2
1molZn与2molHcl(盐酸)反应生成1molZnCl和1molH2(氢气),
即反应了0.2mol盐酸,生成0.1摩尔氢气
3、一摩尔气体标况下体积为22.4升,所以氢气体积为2.24升1年前查看全部
- 某元素R的原子最外层有5个电子,6.5克R单质完全氧化后生成14.2克氧化物,R原子核内的质子数比中子数少1个,
 2383031年前2
2383031年前2 -
 我是lanana 共回答了19个问题
我是lanana 共回答了19个问题 |采纳率100%首先判断是第五主族元素
有N P 等
14.2-6.5=7.3,大约是3摩尔氧元素
初步判断是P1年前查看全部
- 在含19.6克纯硫酸的硫酸溶液中 分别加入6.5克锌与a克碳酸钠 最终余下溶
在含19.6克纯硫酸的硫酸溶液中 分别加入6.5克锌与a克碳酸钠 最终余下溶
溶液质量相等 请问a数值为多少? oka274391年前1
oka274391年前1 -
 善边弧 共回答了23个问题
善边弧 共回答了23个问题 |采纳率78.3%要假设CO2全部挥发
H2SO4+Zn=H2+ZnSO4
1 1 1
9.8 6.5 0.2
为此溶液增加质量6.3g
Na2CO3+H2SO4=Na2SO4+H2O+CO2
1 1 1 1 1
106 44
6.3/(106-44)=6.3/62=0.102
0.102*106=10.81g
a=10.81g1年前查看全部
- 某不纯锌块6.5克,与足量盐酸完全反应放出氢气0.18克,则锌块中含有的杂质可能是( )
某不纯锌块6.5克,与足量盐酸完全反应放出氢气0.18克,则锌块中含有的杂质可能是( )
A. Mg
B. Al
C. Fe
D. Cu 爱得连线1年前1
爱得连线1年前1 -
 shelleydong 共回答了24个问题
shelleydong 共回答了24个问题 |采纳率91.7%解题思路:金属与酸发生置换反应的条件:(1)对金属的要求:必须是金属活动性顺序中排在氢以前的金属;(2)对酸的要求:这里所指的酸并不是所有的酸,主要是指稀盐酸和稀硫酸.
金属与酸反应产生H2的规律:
(1)H2的质量=金属的质量×[金属在化合物中的化合价/该金属的相对原子质量]
(2)等质量的几种金属与足量酸反应产生的H2质量与[金属在化合物中的化合价/该金属的相对原子质量]的值成正比,该值越大,产生的H2质量越多,该值越小,产生的H2质量越小.6.5克纯锌片放在足量的稀盐酸中 放出的氢气是0.2克,存在杂质导致生成的氢气的质量减少,即相同质量金属杂质比锌生成的氢气质量少;
化学方程式 [金属在化合物中的化合价/该金属的相对原子质量]
Zn+2HCl═ZnCl2+H2↑ [2/65]
Mg+2HCl═MgCl2+H2↑ [1/12]
2Al+6HCl═2AlCl3+3H2↑ [1/9]
Fe+2HCl═FeCl2+H2↑ [1/28]
[1/9]>[1/12]>[1/28]>[2/65],所以相同质量的锌、镁、铝、铁与足量的盐酸反应,生成氢气的质量大小为铝>镁>铁>锌;
而铜不与盐酸反应;
故选D.点评:
本题考点: 金属的化学性质;含杂质物质的化学反应的有关计算;酸的化学性质;根据化学反应方程式的计算.
考点点评: 相同质量的金属镁、铝、锌、铁与足量盐酸反应放出氢气的质量由大到小的顺序为铝>镁>铁>锌.1年前查看全部
- 把6.5克的一锌放入足量的盐酸中,锌完全反应.计算(1)6.5zn的物质的量 (2)生成hz的体积
把6.5克的一锌放入足量的盐酸中,锌完全反应.计算(1)6.5zn的物质的量 (2)生成hz的体积
把6.5克的一锌放入足量的盐酸中,锌完全反应.计算(1)6.5zn的物质的量
(2)生成hz的体积(标准状态下) 菲嘟嘟1年前1
菲嘟嘟1年前1 -
 七月神仙 共回答了22个问题
七月神仙 共回答了22个问题 |采纳率90.9%(1)n = 5.6/56 = 0.1 mol
(2)V = 0.1*22.4 = 2.24 L1年前查看全部
- 6.5克锌可以跟100克硫酸溶液恰好完全反应,计算100克这种硫酸稀释成百分之20的硫酸,需要加水多少克
 bkizc1年前1
bkizc1年前1 -
 yzdgb 共回答了16个问题
yzdgb 共回答了16个问题 |采纳率93.8%Zn+H2SO4=ZnSO4+H2
65 98
6.5 X
X=9.8g
该硫酸的质量分数=9.8/100=9.8%
原来硫酸的质量分数比20%小,需要加入比20%浓度大的硫酸,不能加水.1年前查看全部
- 298K时,6.5克液体苯在弹式量热计中完全燃烧,放热272.3KJ.求该反应的△rUm标准 和△rHm标准
298K时,6.5克液体苯在弹式量热计中完全燃烧,放热272.3KJ.求该反应的△rUm标准 和△rHm标准
顺便问下△rUm标准 是什么? 飘飘何所似1年前1
飘飘何所似1年前1 -
 毓见倾心 共回答了18个问题
毓见倾心 共回答了18个问题 |采纳率88.9%“在弹式量热计中”是指该过程为恒容过程,放出的热量为恒容反应热Qv
热力学能变ΔU=Qv(U是热力学能或称内能)
△rUm标准是指反应进度为1mol时化学反应的标准摩尔反应热力学能变(单位是kJ/mol,而ΔU的单位是kJ).
C6H6(l) + 7.5O2(g) → 6CO2(g) + 3H2O(l) Qv
根据题目,放热272.3KJ,即Qv=-272.3KJ(Q的符号放热为负,吸热为正),即ΔU=-272.3KJ ;该反应中6.5克液体苯的物质的量=6.5/78=0.083mol.
△rUm标准=ΔU/n=-272.3KJ /0.083=-3267.6kJ/mol
因为H=U+PV,所以ΔH=ΔU+Δ(PV)=ΔU+ΔnRT,
则△rHm标准=△rUm标准+ΔnRT,Δn指反应前后气体物质的量之差(压强对液体和固体影响非常小,可忽略),在此Δn=6-7.5=-1.5mol,T=298K,R=8.314J/(mol*K)
所以△rHm标准=△rUm标准+ΔnRT=-3267.6-1.5*8.314*298/1000=-3271.3kJ/mol1年前查看全部
- 在20℃时,1.5克某固体某固体最多能配制成6.5克饱和溶液.则20℃时该物质的溶解度是( ).
 酣子1年前1
酣子1年前1 -
 镭之极光 共回答了16个问题
镭之极光 共回答了16个问题 |采纳率93.8%温度相同,同一种物质的饱和溶液,质量分数是相等的.
1.5/6.5=s/(100+s) s=301年前查看全部
- 实验室可用锌粒和稀硫酸(H2SO4)反应制取得到硫酸锌(ZnSO4)和最轻的气体氢气.若用去6.5克锌,则得到多
 tonton20501年前4
tonton20501年前4 -
 可爱kk兔子 共回答了21个问题
可爱kk兔子 共回答了21个问题 |采纳率85.7%问题也没啊?》
是不是H2so4+Zn=So4zn+H2
设H2为x克.
104.5+6.5=161+2x
x=2.51年前查看全部
- 6.5克锌粉加入过量的20%的稀盐酸充分反应后滤除106.3克溶液 求(1)反应中生成氢气的质量是多少
6.5克锌粉加入过量的20%的稀盐酸充分反应后滤除106.3克溶液 求(1)反应中生成氢气的质量是多少
(2)加入硫酸溶液的质量为多少克.
(3)反应后溶液中剩余的硫酸溶液中硫酸的质量为多少克. 细菊灵生1年前1
细菊灵生1年前1 -
 魔力多多 共回答了17个问题
魔力多多 共回答了17个问题 |采纳率100%(1)m(H2)=2*6.5/65=0.2g
(2)m(H2SO4溶液)=106.3+0.2-6.5=100g
(3)m(H2SO4)=100*20%-98*6.5/65=10.2g1年前查看全部
大家在问
- 1心思如此(),手法那么(),风格这样()的小偷.在括号里填上正确搭配的词语
- 2初二英语Spring is coming.Flowers start to come out ang the world
- 3动物与植物的重要区别就在于_____
- 4求教,泰勒公式将F(x)在x0处展开时,是只针对在x0极小领域内的x,还是所有定义域内的x
- 5求具有以下性质的一切三位数A,用A的数码的各种重排所得到的一切数的算术平均值仍等于A
- 6苏教版七年级下册数学补充习题77页小结与思考
- 7汉语译成英语:你的英语(说得)怎么样?
- 8已知复数z满足2|z-3-3i|=|z|,则|z|的取值范围是
- 9已知sin(α-45°)=三分之一,则cos(45°+α)的值等于
- 10解方程①、2(10-0.5x)=-(3x+4)②、解方程:[x−1/2−2=−x+25].
- 11解一元一次方程练习题(1)3(x-2)=2-5(x-2); ( 2 ) 2(x+3)5(1-x)=3(x-1); (3)
- 12英语句子成分分析try to wake him up .try your best to wake him up .yo
- 13木欣欣以向荣.以是什么用法?
- 14需求规律说明( ).需求规律说明( ).A.生产技术提高会使商品的供给量增加B.政府鼓励某商品的生产,因而该商品供给量增
- 15Here is a funniy joke to wish you a hanppy Mother's Day.这个句子
