用价电子层互斥理论求FCl4的空间构型,本人猜想这里氯做为中心原子,最后是变形四面体不知对不对
 光道也2022-10-04 11:39:543条回答
光道也2022-10-04 11:39:543条回答先说一下我的思路,因为F是第二周期的,最外层只有8个电子,而这里有11个价电子,所以CL作为中心原子,采用sp3d2杂化,因为有一个单电子,所以两边排斥不同,是变形四面体。

已提交,审核后显示!提交回复
共3条回复
 比白黑点的黑 共回答了18个问题
比白黑点的黑 共回答了18个问题 |采纳率94.4%- 前面对,后面错
中心的Cl有7个价电子,提供4个作σ bond,剩下1组lone pair和一个单电子
所以总供是六配位,六配位的原形是八面体
再来要考虑将孤对电子和单电子放入equatorial(赤道位,即平行四边形那四颗)或是axial(轴位,就上下那两颗)
第一颗放进去时没有差,因为八面体是全对称,不管放哪边都会变四角锥,
第二颗一般会放在轴位,因为电子对的密度高,为了减少排斥力会优先选择比较不挤的轴位
因此会形成平行四边形,但两个轴位的电子密度不同(电子对,单电子)所以会略为变形
原子不会在同一平面上,而是略向单电子的那面凹向 - 1年前
 小咕噜1006 共回答了11个问题
小咕噜1006 共回答了11个问题 |采纳率- 你说的基本上都对。中心原子Cl成键后形成4个σ键,一对孤对电子,还有一个单电子,采用sp3d2杂化,整体上是八面体构型。孤对电子和单电子可能在邻位和对位,所以两种构型应该都存在。
- 1年前
 s1000 共回答了6个问题
s1000 共回答了6个问题 |采纳率- Cl做中心原子,最外层7个电子,给F一个,给剩下的Cl三个,还剩下3个,是一个半的电子对,取整是两个,1+3+2=6故而是sp3d2杂化,变形四面体,楼主V5!
- 1年前
相关推荐
- Ge的价电子层电子排布式怎么写?
Ge的价电子层电子排布式怎么写?
到底要不要写出3d10 woshixingyunde1年前1
woshixingyunde1年前1 -
 luyang37820 共回答了23个问题
luyang37820 共回答了23个问题 |采纳率87%2s(1)前面的确实是被省略了这是它的价电子排布如果不省略全部都写上叫做电子排布
这就是cu的特殊性因为这样的排布满足全满会更稳定满足能量最低原理就比如说24号元素它也是3d(5)4s(1)满足的是半满更稳定一般在我们的接触范围内这两个元素是特殊的其他元素还是按正常顺序来写的懂了吗1年前查看全部
- 书上说的“过度金属的原子或离子由于其价电子层的部分d轨道和s,p轨道是空轨道,因而很容易与有孤对电子的分子形成配位键”假
书上说的“过度金属的原子或离子由于其价电子层的部分d轨道和s,p轨道是空轨道,因而很容易与有孤对电子的分子形成配位键”假设过度金属在第四周期,则它指的s,d,p是4s,4d,4p,还是3d ,4s,4p
 bangsc1101年前2
bangsc1101年前2 -
 阳光小帅 共回答了14个问题
阳光小帅 共回答了14个问题 |采纳率85.7%应该是3d,4s,4p,配位的时候好像是这个规律1年前查看全部
- Ti元素的基态原子的价电子层的电子排布式为?
 kenan8607021年前3
kenan8607021年前3 -
 cbliangen 共回答了20个问题
cbliangen 共回答了20个问题 |采纳率85%这个20分?元素周期表查一查不就知道了?全部写给你吧 1s2 2s2 2p6 3s2 3p6 3d2 4s2,最后两项为价电子排布式!1年前查看全部
- 怎样利用中心原子价电子层对数判断二氧化硅中硅的杂化轨道?
怎样利用中心原子价电子层对数判断二氧化硅中硅的杂化轨道?
用公式计算得出4除以2等于2,应该是sp杂化,但实际上他是sp3杂化,这是为什么?
氧作为配位原子用公式计算时不是算为零吗?中心价层电子对数不就等于硅的价电子数除以2吗? hdzlp1年前4
hdzlp1年前4 -
 涩擎邝 共回答了23个问题
涩擎邝 共回答了23个问题 |采纳率78.3%SiO2是原子晶体,没有单个的分子,公式只适用于分子.结构上是一个Si和4个O连接的四面体,一个O和2个SI连接.1年前查看全部
- 什么是价电子层?
 cx4121年前1
cx4121年前1 -
 如果的果 共回答了15个问题
如果的果 共回答了15个问题 |采纳率86.7%对主族来说就是最外层电子
对副族等还可能包括次外层电子如铁的三价就是指失去了最外层电子外,还失去了次外层的一个电子1年前查看全部
- 价电子层d层电子数怎么知道比如问Mn2+价电子层d层电子数 怎么分析
 dreamerlq1年前1
dreamerlq1年前1 -
 wshsm 共回答了17个问题
wshsm 共回答了17个问题 |采纳率88.2%先要写出 原子的电子排布
Mn是 3d5 4s2
失去2个电子,则Mn2+是 3d5
先失去最外层的4s电子1年前查看全部
- 问关于价电子层结构式的一个小问题
问关于价电子层结构式的一个小问题
按图示所说的4s3d的写法吗?
还是先写3d,再写4s?
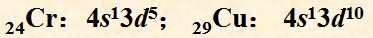
 juanzi_p1年前1
juanzi_p1年前1 -
 匣儿 共回答了18个问题
匣儿 共回答了18个问题 |采纳率72.2%一般是写4s3d,但是也见有的资料上写的是3d4s.
我认为4s写前面更恰当一点.一方面是由于能级交错,另一方面,按照原子核外排布的能量最低原则,电子是先填满4s的.1年前查看全部
- 关于铜的化合价的问题铜的价电子层为 3d10 4s1,为什么它常显+2价,而不是+1价,+2价的铜离子最外层电子数为17
关于铜的化合价的问题
铜的价电子层为 3d10 4s1,为什么它常显+2价,而不是+1价,+2价的铜离子最外层电子数为17,难道17也相对稳定吗,如果复制别人的,也请复制有价值的, luckwgc1年前4
luckwgc1年前4 -
 逗ww你 共回答了16个问题
逗ww你 共回答了16个问题 |采纳率100%固态时+1价是稳定的.但是湿态时+2价的铜离子会水合成Cu[H2O]4二价阳离子,这个离子比+1价的铜离子更稳定.
这就是为什么可以看到固体的氧化亚铜Cu2O,却在溶液中看不到+1价的铜离子.1年前查看全部
- 价层电子,亚层,价电子层,电子组态,电子分布,简并轨道(是l吗)以上麻烦形象地介绍下.还有怎么判断电负性的大小?解答出来
价层电子,亚层,价电子层,电子组态,电子分布,简并轨道(是l吗)以上麻烦形象地介绍下.还有怎么判断电负性的大小?解答出来的感激不尽啊!
 淡妆妹妹1年前1
淡妆妹妹1年前1 -
 枫叶再次红 共回答了18个问题
枫叶再次红 共回答了18个问题 |采纳率88.9%一般最外层和次外层作为价电子层,层上的电子称为价层电子,亚层应该是次外层,电子组态和电子分布应该是一回事,都是指电子在各层分布情况,前者必须精确到角量子数级别,简并轨道是指能量相等的不同轨道,电负性大小有表可查1年前查看全部
- 根据电子步入原子轨道的顺序写出35号元素完整的电子层结构,指出其具体价电子层结构,所在的周期,在哪个分区,所在的族号
 若梅雪1年前3
若梅雪1年前3 -
 姻如烟 共回答了18个问题
姻如烟 共回答了18个问题 |采纳率100%这个真不知道!
不好意思了!1年前查看全部
- 短周期元素R的原子核外电子数等于核内中子数,该元素单质7.2g与氧气充分反应可生成12g化合物RO,则该元素的价电子层是
短周期元素R的原子核外电子数等于核内中子数,该元素单质7.2g与氧气充分反应可生成12g化合物RO,则该元素的价电子层是( )
A.1s2
B.2s2
C.3s2
D.4s2 研究mm1年前1
研究mm1年前1 -
 一依不舍 共回答了24个问题
一依不舍 共回答了24个问题 |采纳率95.8%解题思路:单质7.2g与氧气充分反应可生成12g化合物RO,则可知m(O)=12g-7.2g=4.8g,n(R)=n(O)=[4.8g/16g/mol]=0.3mol,则M(R)=[7.2g/0.3mol]=24g/mol,R的原子核外电子数等于核内中子数,则R应为Mg元素,以此解答该题.单质7.2g与氧气充分反应可生成12g化合物RO,
则可知m(O)=12g-7.2g=4.8g,n(R)=n(O)=[4.8g/16g/mol]=0.3mol,
则M(R)=[7.2g/0.3mol]=24g/mol,质量数为24,R的原子核外电子数等于核内中子数,
则R的质子数应为12,应为Mg元素,原子核外有3个电子层,最外层电子数为2,应为3s2,
故选:C.点评:
本题考点: 原子核外电子排布;原子结构与元素的性质.
考点点评: 本题考查元素的推断,侧重于学生的分析能力和计算能力的考查,从质量的角度计算元素的摩尔质量为解答该题的关键,难度不大,注意把握原子核外电子的排布规律.1年前查看全部
- 1.怎样通过氧原子的价电子层结构理解氢气和氧气化合生成的分子是H2O而不是其他组成?2.怎样理解Cl2、Br2、I2的键
1.怎样通过氧原子的价电子层结构理解氢气和氧气化合生成的分子是H2O而不是其他组成?2.怎样理解Cl2、Br2、I2的键能依次下降,键长依次增大?3.已知N-N、N--N、N---N键能之比为1.00:2.17:4.90,而C-C、C--C、C---C键能之比为1.00:1.77:2.34,如何用这些数据理解氮分子不容易发生加成反应而乙烯和乙炔容易发生加成反应?
 forjia1231年前2
forjia1231年前2 -
 angel98 共回答了16个问题
angel98 共回答了16个问题 |采纳率100%1 氧原子 外层电子排布 2 6,氢原子 外层 1; 根据稳定性原理 氧原子最外层得到两个电子形成八电子结构,氢原子外层为0电子,这时两种原子都达到最稳定结构(最外层空壳 半满 全满 都成为最稳定状态),所以是一个氧两个氢构成最稳定的水;
2 应该是 键长依次增大,导致键能依次下降;由于三种原子半径增大,会导致相互之间成键越来越长,你应该了解 相同结构的情况下,键长越长了键能会越弱.
3 同2 原理.至于第三个,目前你在高中阶段只能暂时这样理解,事实上,这是由于双键三键的组成以及成单电子等多方面的原因.你做题的时候只需要回答由于键能不同导致.1年前查看全部
- 已知某元素的原子序数是25,写出该元素原子的价电子层结构式,并指出该元素所属的周期和族.
已知某元素的原子序数是25,写出该元素原子的价电子层结构式,并指出该元素所属的周期和族.
怎么看是主族还是副族 、族序数怎么看, haoerguai1年前2
haoerguai1年前2 -
 liangmianren 共回答了24个问题
liangmianren 共回答了24个问题 |采纳率83.3%核外电子的排布依次是 2 8 13 2,该元素位于第四周期第VIIB族.
中学阶段只对主族有要求,能把里面的电子排满,再排外面的电子的为主族元素,主族元素最外层电子数就是主族的族序数.1年前查看全部
- 化学高手请进--价电子层结构每一个符号代表的意义是什么?
化学高手请进--价电子层结构每一个符号代表的意义是什么?
价电子层结构每一个符号代表的意义是什么(包括里面的数字和上下标,还有里面的幂所代表的是什么)! 路西佛1年前1
路西佛1年前1 -
 liangxia99 共回答了16个问题
liangxia99 共回答了16个问题 |采纳率68.8%主量子数:n 1、2、3.即我们平常所说的第几层
角量子数:l 0、1.(n-1)指的是亚层,分别用符号s、p、d、f.表示 显示的是电子云的形状
磁量子数 0、正负1正负2.正负n表示的是电子云的排列方向
自旋量子数m 正负1/2指得是电子的自旋状态
幂指的是该亚层的电子数1年前查看全部
- (2014•长葛市三模)A、B、C、D是前四周期原予序数依次增大的四种元素,其中A和B原子的价电子层中未成对电子均只有1
 (2014•长葛市三模)a、b、c、d是前四周期原予序数依次增大的四种元素,其中a和b原子的价电子层中未成对电子均只有1个,并且a-和b+的电子数相差为8;c和d与b位于同一周期,c和d的价电子层中的未成对电子数分别为4和2,且原子序数相差为2.
(2014•长葛市三模)a、b、c、d是前四周期原予序数依次增大的四种元素,其中a和b原子的价电子层中未成对电子均只有1个,并且a-和b+的电子数相差为8;c和d与b位于同一周期,c和d的价电子层中的未成对电子数分别为4和2,且原子序数相差为2.
回答下列问题:
(1)四种元素中第一奄离能最小的是______,电负性最大的是______(填元素符号),c的价电子排布式为______.
(2)a的气态氢化物的熔沸点比下周期同主族元素气态氢化物高,原因是______.
(3)a-、b+和c3+三种离予组成化合物b3ca6,其中化学键的类型有______;该化合物中存在一个复杂离子,该离子的化学式为______.
(4)d的单质粉末在co气流中轻微加热,生成无色挥发性液态d(c0)4,呈四面体构型.423k时,d(c0)4分解为d和co,从而制得***的d粉末.d(c0)4的晶体类型是______;推测d(co)4易溶于下列______溶剂中(填序号).
a.水b.四氯化碳c.苯d.硫酸镍溶液
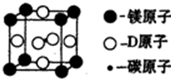
(5)据报道,只含碳、镁和d三种元素的晶体具有超导性.该晶体的晶胞结构如图,试写出该晶体的化学式______.晶体中每个镁原子周围距离最近的d原子有______个. lhl7871年前1
lhl7871年前1 -
 李小佛都 共回答了20个问题
李小佛都 共回答了20个问题 |采纳率85%解题思路:前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素,结合物质结构和性质解答.前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素,
(1)同一周期中,金属的金属性随着原子序数增大而减弱,所以金属性最强的是K元素,非金属性最强的是F元素,C是Fe元素,其价电子排布式为3d64s2,
故答案为:K;F;3d64s2;
(2)A的氢化物是HF,HF分子之间存在氢键,氢键的存在导致其沸点升高,所以HF的沸点高于HCl,故答案为:HF分子之间可以形成氢键;
(3)A-、B+和C3+三种离予组成化合物K3FeF6,该化学式中钾离子和[FeF6]3-之间存在离子键,Fe原子和F原子之间存在配位键,该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3-,
故答案为:离子键、配位键;[FeF6]3-;
(4)分子晶体的熔沸点较低,D(C0)4的熔沸点较低,所以为分子晶体;
Ni(C0)4呈四面体构型说明该物质为非极性分子,根据相似相溶原理知,Ni(CO)4易溶于四氯化碳和苯,故选bc,
故答案为:分子晶体;bc;
(5)该晶胞中镁原子个数=8×[1/8]=1,C原子个数=1,Ni原子个数=6×[1/2]=3,所以该物质的化学式为MgCNi3,晶体中每个镁原子周围距离最近的Ni原子个数=3×8×[1/2]=12,故答案为:MgCNi3;12.点评:
本题考点: 晶胞的计算;元素电离能、电负性的含义及应用;化学键;氢键的存在对物质性质的影响.
考点点评: 本题考查了物质结构和性质,涉及晶胞的计算、配位键、氢键等知识点,正确推断元素是解本题关键,熟悉前36号元素原子结构,再结合物质结构和性质的关系解答,题目难度中等.1年前查看全部
- 价电子层与价层电子一样不?什么区别?
 elaine_tai1年前1
elaine_tai1年前1 -
 马越潭溪 共回答了26个问题
马越潭溪 共回答了26个问题 |采纳率76.9%价电子层,是原子最外层电子所在的轨道.
价层电子则是在原子最外围的电子,它在价电子层上.
就好比说,电子层是一层一层的楼房的话,价电子层就是顶层,而夹层电子就是住在顶层的人.1年前查看全部
- 价电子层排布为ns1的元素都是碱金属元素 这句话对吗?
 nn莲1年前2
nn莲1年前2 -
 我郁闷着 共回答了14个问题
我郁闷着 共回答了14个问题 |采纳率100%不对 氢也是1年前查看全部
- A~G是前四周期原子序数依次增大的七种元素.A、C的价电子层中未成对电子数都是2;D+与C的简单离子具有相同离子结构;E
 A~G是前四周期原子序数依次增大的七种元素.A、C的价电子层中未成对电子数都是2;D+与C的简单离子具有相同离子结构;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G为周期表第11列元素.回答下列问题:
A~G是前四周期原子序数依次增大的七种元素.A、C的价电子层中未成对电子数都是2;D+与C的简单离子具有相同离子结构;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G为周期表第11列元素.回答下列问题:
(1)写出元素B的符号:______.
(2)写出元素F的M层电子排布图:______.
(3)G的硫酸盐与氨水反应可形成G(NH3)42+,1mol该配离子中含有σ键的数目为______.向该配合物溶液中加入乙醇,得到物质的化学式为______;
(4)含有A、C元素的化合物甲醛(H2C=O)经氧化可得到甲酸,在Ni催化作用下加氢可得甲醇(CH3OH),二者酯化可得到甲酸甲酯,甲酸甲酯分子中碳原子的杂化轨道类型有______;甲醇分子内的O-C-H键角______(填“大于”“等于”或“小于”)甲醛分子内的O-C-H键角;通常状况下,甲醛为气体,甲醇为液体,解释二者沸点差异的原因______
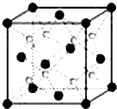
(5)C和D形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为______.在一个阴离子周围距其最近的所有阳离子构成的几何体为______.已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶体中阴阳离子间最近的距离为
×3 4 3 248 ρ•NA cm. (用含ρ、NA的计算式表示)
×3 4 3 248 ρ•NA  liliang3331年前1
liliang3331年前1 -
 abusan 共回答了15个问题
abusan 共回答了15个问题 |采纳率93.3%解题思路:A~G是前四周期原子序数依次增大的七种元素,G为周期表第11列元素,则G为Cu元素;A、C的价电子层中未成对电子数都是2,价电子层排布为ns2np2或ns2np4,E核外的s、p能级的电子总数相等,结合原子序数可知,其核外电子排布为1s22s22p63s2,则E为Mg;F与E同周期且第一电离能比E小,原子序数大于Mg,则F为Al;D+与C的简单离子具有相同离子结构,结合价层电子排布,可以推知C为O元素、D为Na、A为碳元素,B元素原子序数介于碳、氧之间,则B为N元素,据此解答.A~G是前四周期原子序数依次增大的七种元素,G为周期表第11列元素,则G为Cu元素;A、C的价电子层中未成对电子数都是2,价电子层排布为ns2np2或ns2np4,E核外的s、p能级的电子总数相等,结合原子序数可知,其核外电子排布为1s22s22p63s2,则E为Mg;F与E同周期且第一电离能比E小,原子序数大于Mg,则F为Al;D+与C的简单离子具有相同离子结构,结合价层电子排布,可以推知C为O元素、D为Na、A为碳元素,B元素原子序数介于碳、氧之间,则B为N元素,
(1)由上述分析可知,B为N元素,故答案为:N;
(2)元素F为Al,其M层电子排布图为: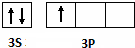 ,故答案为:
,故答案为: ;
;
(3)硫酸铜与氨水反应可形成Cu(NH3)42+,N-H键及配位键属于σ键,1mol该配离子中含有σ键为16mol,σ键的数目为16NA,向该配合物溶液中加入乙醇,形成得到物质的化学式为[Cu(NH3)4]SO4•H2O,
故答案为:16NA;[Cu(NH3)4]SO4•H2O;
(4)甲酸甲酯(HCOOCH3)中,HCOO-中C原子成3个σ键,没有孤电子对,C原子采取sp2杂化,甲基中C原子成4个σ键,采取sp3杂化,分子中碳原子的杂化轨道类型有sp2、sp3;
甲醛分子内C原子没有孤电子对,而甲醇分子中O原子含有2对孤电子对,孤电子对之间的排斥大于成键电子对之间的排斥,故甲醇分子内的O-C-H键角小于甲醛分子内的O-C-H键角;
甲醇分子之间形成氢键,而甲醛分子之间无氢键,故通常状况下,甲醛为气体,甲醇为液体,
故答案为:sp2、sp3;小于;甲醇分子之间形成氢键,而甲醛分子之间无氢键;
(5)晶胞中黑色球数目=8×[1/8]+6×[1/2]=4,小白色球数目为8,该物质为Na2O,小白色球为Na+离子,黑色球为O2-离子,由晶胞结构可知,每个Na+离子周围有4个O2-,该晶体中阳离子的配位数为4;
以晶胞中上面心O2-离子为研究对象,距一个O2-周围最近的Na+离子有8个,位于晶胞中上层4个Na+及上面晶胞中的下层4个Na+,8个Na+离子构成的几何体为立方体结构;
该晶胞质量=4×[62
NAg,该晶胞的密度为ρ g•cm-3,则晶胞边长=
3
4×
62
NAg
ρ g•cm−3/]=
3
248
ρ•NA
cm,每个Na+离子与周围有4个O2-离子形成正四面体结构,如图所示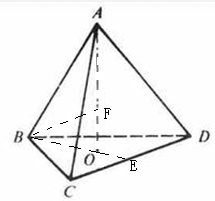 ,F为Na+离子,A、B、C、D为O2-离子,令晶体中阴阳离子间最近的距离为r,即FA长=r,根据体积关系可知,AO长=4OF长,故FA长=3OF长,故AO长=r+[1/3]×r=[4/3]r,设BC长为a,BO长=[2/3]×(
,F为Na+离子,A、B、C、D为O2-离子,令晶体中阴阳离子间最近的距离为r,即FA长=r,根据体积关系可知,AO长=4OF长,故FA长=3OF长,故AO长=r+[1/3]×r=[4/3]r,设BC长为a,BO长=[2/3]×(点评:
本题考点: 晶胞的计算;位置结构性质的相互关系应用.
考点点评: 该题以“周期表中元素的推断”为载体,考查物质结构与性质,涉及核外电子排布、化学键、配合物、晶胞计算,(5)中晶胞计算为易错点、难点,需要学生具备一定空间想象及数学计算能力,注意利用均摊法进行计算,难度较大.1年前查看全部
- 价电子层为ns2np6的微粒,其对应元素一定不是( )
价电子层为ns2np6的微粒,其对应元素一定不是( )
A.s区元素
B.d区元素
C.p区元素
D.主族元素 落落爱花1年前1
落落爱花1年前1 -
 飞叉叉的 共回答了19个问题
飞叉叉的 共回答了19个问题 |采纳率94.7%解题思路:s区包含ⅠA、ⅡA族,d区包含ⅢB~ⅦB族、Ⅷ族,p区包含ⅢA~ⅦA、零族元素,价电子层为ns2np6 的微粒,若为中性原子,为零族元素,若为阴离子,元素原子外围电子排布为ns2npx,若为阳离子,元素原子外围电子排布为(n+1)sx.价电子层为ns2np6 的微粒,若为阳离子,元素原子外围电子排布为(n+1)sx,为ⅠA或ⅡA族元素,属于s区元素,若为中性原子,为零族元素,为阴离子,元素原子外围电子排布为ns2npx,属于p区元素,该元素可能为主族元素、也可能是零族元素,d区元素原子的外围电子排布为ndy(n+1)sx,且y≠10,该元素一定不属于d区,
故选:B.点评:
本题考点: 位置结构性质的相互关系应用;原子核外电子排布.
考点点评: 本题考查结构与物质关系、元素周期表等,难度不大,为易错题目,学生容易忽略微粒电性问题按电中性原子解答.1年前查看全部
- 周期表上元素的“外围电子排布”简称“价电子层”
周期表上元素的“外围电子排布”简称“价电子层”
“外围电子排布”是指什么,是最外层电子吗? 石易1年前2
石易1年前2 -
 mituyang555 共回答了12个问题
mituyang555 共回答了12个问题 |采纳率83.3%就是每个电子层里的电子排布顺序,叫做电子亚层.分别用1、2、3、4、5、6、7等数字表示K、L、M、N、O、P、Q等电子层,用s、p、d、f等符号分别表示各电子亚层,并在这些符号右上角用数字表示各亚层上电子的数目.1年前查看全部
- 下列说法正确的是( )A.在元素周期表中,每个纵列的价电子层的电子总数一定相等B.在元素周期表中,s区,d区和ds区的
下列说法正确的是( )
A.在元素周期表中,每个纵列的价电子层的电子总数一定相等
B.在元素周期表中,s区,d区和ds区的元素都是金属
C.键能是气态基态原子形成化学键释放的最低能量
D.键长越长,往往键能越大,表明共价键越稳定 AndyLeelkd1年前1
AndyLeelkd1年前1 -
 DinOKain 共回答了16个问题
DinOKain 共回答了16个问题 |采纳率81.3%解题思路:A.过渡元素中一些族中价层电子数不一定相等;
B.s区中氢元素属于非金属元素;
C.键能是气态基态原子形成化学键释放的最低能量;
D.键长越长,往往键能越小,共价键越不稳定.A.同主族元素的价电子层的电子总数一定相等,但过渡元素中一些族中价层电子数不一定相等,故A错误;
B.d区和ds区的元素都是金属,但s区中氢元素属于非金属元素,故B错误;
C.键能是气态基态原子形成化学键释放的最低能量,故C正确;
D.键长越长,往往键能越小,共价键越不能稳定,键长越短,往往键能越大,共价键越稳定,故D错误;
故选C.点评:
本题考点: 元素周期表的结构及其应用;键能、键长、键角及其应用.
考点点评: 本题考查元素周期表、结构性质位置关系、键参数等,难度不大,注意掌握元素周期表的整体结构,注意一些特殊性.1年前查看全部
- 什么是价电子层构型
 大波罗1年前3
大波罗1年前3 -
 soccer13 共回答了22个问题
soccer13 共回答了22个问题 |采纳率90.9%价电子指原子核外电子中能与其他原子相互作用形成化学键,跟元素化合价有关的电子,这些电子所处的电子层,一般是最外层了.价电子层的电子排布与组成成为价电子层构型.1年前查看全部
- 按照构造原理写出35号元素的基态原子的电子排布式:( );其价电子层为( ),其所在主族的价电子层为( );最高化合价为
按照构造原理写出35号元素的基态原子的电子排布式:( );其价电子层为( ),其所在主族的价电子层为( );最高化合价为( ),最低化合价为( )
 lansemantianxin1年前5
lansemantianxin1年前5 -
 whroadman 共回答了17个问题
whroadman 共回答了17个问题 |采纳率100%电子排布式:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
价电子层为:4s2 4p5
其所在主族的价电子层为:4s2 4p5
最高正价为:+7
最低负价位:-11年前查看全部
- 外围电子排布又叫价电子层,价电子层上的电子总数是否等于价电子数?若不等是否有通用规则
 ichbinty1年前1
ichbinty1年前1 -
 神话围击 共回答了19个问题
神话围击 共回答了19个问题 |采纳率78.9%价电子数是能与其它原子相互作用形成化学键的电子.
主族元素的价电子就是主族元素原子的最外层电子;过渡元素的价电子不仅是最外层电子,次外层电子及某些元素的倒数第三层电子也可成为价电子.1年前查看全部
- 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
(1)b、c、d中第一电离能最大的是______(填元素符号),e的价层电子排布图为______.
(2)a和其它元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为______;分子中既含有极性共价键、又含有非极性共价键的化合物是______(填化学式,写出两种).
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是______;酸根呈三角锥结构的酸是______.(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为______.
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示).该化合物中阴离子为______,阳离子中存在的化学键类型有______;该化合物加热时首先失去的组分是______,判断理由是______.
 sunskylxp1年前1
sunskylxp1年前1 -
 heroacoco 共回答了17个问题
heroacoco 共回答了17个问题 |采纳率82.4%解题思路:周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则a为H元素;
c的最外层电子数为其内层电子数的3倍,最外层电子数不超过8个,则c是O元素;
b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;
e的最外层只有1个电子,但次外层有18个电子,则e原子核外电子数为2+8+18+1=29,为Cu元素;
d与c同族,且原子序数小于e,所以d为S元素,
(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,同一主族元素中,元素第一电离能随着原子序数增大而减小;e的价层电子为3d、4s电子;
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子为NH3,根据价层电子对互斥理论确定该分子的中心原子的杂化方式;
分子中既含有极性共价键、又含有非极性共价键的化合物有双氧水和肼;
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是亚硝酸;酸根呈三角锥结构,说明该酸根离子价层电子对个数是4且含有一个孤电子对;
(4)该晶胞中c离子个数=1+8×[1/8]=2,e离子个数4,所以e和c形成的一种离子化合物化学式为Cu2O,据此判断e离子的电荷;
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,说明该阴离子价层电子对个数是4且不含孤电子对;阳离子呈轴向狭长的八面体结构,根据图知,其阳离子中铜离子配位数是8,在八面体上下顶点上分子含有两个共价键且含有两个孤电子对,为水分子,有两个,正方形平面上四个顶点上分子含有3个共价键且含有一个孤电子对,所以为氨气分子,有4个;
阳离子中存在共价键和配位键;H2O和Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O.周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则a为H元素;
c的最外层电子数为其内层电子数的3倍,最外层电子数不超过8个,则c是O元素;
b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;
e的最外层只有1个电子,但次外层有18个电子,则e原子核外电子数为2+8+18+1=29,为Cu元素;
d与c同族,且原子序数小于e,所以d为S元素,
(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,同一主族元素中,元素第一电离能随着原子序数增大而减小,所以b、c、d元素第一电离能最大的是N元素;e的价层电子为3d、4s电子,其价层电子排布图为 ,
,
故答案为:N; ;
;
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子为NH3,该分子的中心原子含有3个共价单键和一个孤电子对,所以N原子的杂化方式为sp3;
分子中既含有极性共价键、又含有非极性共价键的化合物有H2O2和N2H4,
故答案为:sp3;H2O2和N2H4;
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是HNO2、HNO3;酸根呈三角锥结构的酸是H2SO3,故答案为:HNO2、HNO3;H2SO3;
(4)该晶胞中c离子个数=1+8×[1/8]=2,e离子个数4,该晶胞中氧离子和铜离子个数之比=2:4=1:2,所以e和c形成的一种离子化合物化学式为Cu2O,则e离子的电荷为+1,故答案为:+1;
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,说明该阴离子价层电子对个数是4且不含孤电子对,为SO42-;
阳离子呈轴向狭长的八面体结构,根据图知,其阳离子中铜离子配位数是8,在八面体上下顶点上分子含有两个共价键且含有两个孤电子对,为水分子,有两个,正方形平面上四个顶点上分子含有3个共价键且含有一个孤电子对,所以为氨气分子,有4个,所以阳离子中含有配位键和共价键;
H2O和Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O,
故答案为:SO42-;共价键和配位键;H2O;H2O和Cu2+的配位键比NH3与Cu2+的弱.点评:
本题考点: 晶胞的计算;元素电离能、电负性的含义及应用;极性键和非极性键;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查物质结构和性质,侧重考查学生空间想象能力、知识运用能力,涉及晶胞计算、配合物、原子结构等知识点,综合性较强,采用均摊法、价层电子对互斥理论等理论分析解答,题目难度中等,注意:配位键也属于共价键.1年前查看全部
- 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8
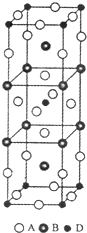 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2.
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2.
回答下列问题:
(1)D2+的价层电子排布图为______.
(2)四种元素中第一电离能最小的是______,电负性最大的是______(填元素符号).
(3)A、B和D三种元素组成的化合物的一个晶胞如图所示.则该化合物的化学式为______;
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有______;该化合物中存在一个复杂离子,该离子的化学式为______,配体是______. fish1671年前1
fish1671年前1 -
 吾之最爱 共回答了14个问题
吾之最爱 共回答了14个问题 |采纳率100%解题思路:前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素,结合物质结构和性质解答.前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素,
(1)D2+的价层电子为3d电子,根据能量最低原理、保里不相容原理及洪特规则知,其价电子排布图为 ,
,
故答案为 ;
;
(2)元素的金属性越强其第一电离能越小,元素的非金属性越强,其电负性越大,这四种元素中金属性最强的是K元素,非金属性最强的元素是F,所以第一电离能最小的是K,电负性最大的是F,
故答案为:K;F;
(3)该晶胞中A原子个数=16×
1
4+4×
1
2+2=8,B原子个数=8×[1/4]+2=4,D原子个数=8×[1/8]+1=2,所以该化合物的化学式为K2NiF4,故答案为:K2NiF4;
(4)A-、B+和C3+三种离子组成的化合物的K3FeF6,该物质中阴阳离子间存在离子键,铁原子和氟原子间存在配位键,该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3-,配位体是F-,故答案为:离子键和配位键;[FeF6]3-;F-.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查物质结构和性质,正确推断元素是解本题关键,难度中等,注意化学式的确定中,各中原子被几个晶胞共用,为易错点,难点是(3)的计算.1年前查看全部
- 下列说法正确的是A在元素周期表中 每个总行的价电子层的电子总数一定相等 B在元素周期表中S区 D区ds区的元素是金属元素
下列说法正确的是
A在元素周期表中 每个总行的价电子层的电子总数一定相等
B在元素周期表中S区 D区ds区的元素是金属元素
c无论原子种类是否相同 基态原子的能量总是低于激发态原子的能量
d激发态原子的能量较高极易失去电子表现出较强还原性
纵行 MS选A D 蘸水木棉花1年前2
蘸水木棉花1年前2 -
 千机线 共回答了12个问题
千机线 共回答了12个问题 |采纳率91.7%A是不正确的,每行是不等的,每列才相等.
C也不正确,有的基态是不稳定的,容易到激发态,如激光.
正确的是:D.
如果是纵行的话,A就是正确的.
D有一点小问题,激发态原子不一定失去电子表现出较强还原性,也可能得到电子表现出较强氧化性.
这样看来,应该选择:A.1年前查看全部
- C的内层电子总数是最外层电子总数的5倍,E的基态原子价电子层的次外层某一能级上只有2个电子,他们分别是
 hy7612231年前3
hy7612231年前3 -
 xyx2002426 共回答了13个问题
xyx2002426 共回答了13个问题 |采纳率92.3%C是Mg,内层是最外层的5倍,那么最外层只能是1或2,如果是1,内层是5,不存在,如果是2,内层是10,即2和8,所以是Mg
E信息不足,推不出来.
希望对你有所帮助!1年前查看全部
- 二氯化硫(S2Cl2)的价电子层满足最外层为8的电子结构吗.
 ss28561年前1
ss28561年前1 -
 naxnax 共回答了26个问题
naxnax 共回答了26个问题 |采纳率80.8%满足
Cl的最外层有七个电子
S最外层有六个电子
二氯化硫以 Cl-S-S-Cl 的形式成键1年前查看全部
- 外围电子总数=价电子层电子总数=价电子数=元素的最高化合价是否正确
外围电子总数=价电子层电子总数=价电子数=元素的最高化合价是否正确
概念我清楚:价电子数是能与其它原子相互作用形成化学键的电子;外围电子是在化学变化中可发生变化的能级上的电子,外围电子排布简称价电子层;价电子层中的电子叫价电子.应有“外围电子总数=价电子层电子总数=价电子数=元素的最高化合价”,但第八族、1B、11B族的外围电子总数分别是8~12,难道价电子数也是这些数值?我没见过元素体现+9~+12价的化合物啊? longpulin1年前2
longpulin1年前2 -
 我爱小雨霏霏 共回答了22个问题
我爱小雨霏霏 共回答了22个问题 |采纳率81.8%最高只有+8价.1年前查看全部
- p元素的成键问题p的价电子层有5个电子,其中2s上的两个已经配对,怎么sp3杂化时会出现4个σ键(PH4+),而且没有孤
p元素的成键问题
p的价电子层有5个电子,其中2s上的两个已经配对,怎么sp3杂化时会出现4个σ键(PH4+),而且没有孤对电子,孤对电子哪去了? qqfull1年前2
qqfull1年前2 -
 和鱼在一起 共回答了11个问题
和鱼在一起 共回答了11个问题 |采纳率90.9%一对孤对电子就是P与H+离子之间公用,就是配位键.1年前查看全部
大家在问
- 1有一交流电其瞬时电压表达式为e=(314t+30°)V,求该交流电的电压最大值,有效值,频率,周期,角频率和初相位.
- 22.5×(9.99+9.99+9.99+9.99) 能简算
- 3关于抛物线及导数的一道题P为抛物线y=x^2的一点 当P到x+y+2=0距离最小时,答案上说是抛物线在P处的切线斜率为-
- 4填空题(不写过程)When we saw him yesterday ,he ( )(breathe)heavily i
- 5以椭圆x^2/a^2+y^2/b^2=1(a>b>0)的左焦点F1作x轴的垂线与椭圆交于点P,F2为右焦点,角F1PF2
- 6植物离光源越近,光照就越强,产生的气泡数就越多,也就是光合作用越强,即:
- 7用统计表表示的数量,还可以用 ___ 来表示.
- 83²-1²=8*1,5²-3²=8*2,7²-5²=8*3.
- 9如图L1和L2是两只相同的小灯泡 A B是电流或者是电压表 闭合开关S后 两灯都能发光
- 101 2 3 4 5=200用加减乘除四则运算符号及括号填入下式,使等式成立.
- 11星期天我们来到刚建成的,崭新的儿童公园。用修改符号修改下列病句
- 12化学实验要求规范进行操作,以确保安全.下列跟酒精灯有关的操作正确的是( )
- 13(6x-40)\8=5x-8解方程要全过程
- 14小石潭记 三峡小石潭记第二段文字与第一段中哪一句相照应三峡中素湍绿潭 回清倒影运用了什么表达方式
- 15英语难 题补充词语1Brushing t_____ twice can help you to be healthy.2
