氮化钠与盐酸反应生成什么?
 dbdbdbdd2022-10-04 11:39:543条回答
dbdbdbdd2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 vv阿照 共回答了17个问题
vv阿照 共回答了17个问题 |采纳率94.1%- Na3N+3HCl=3NaCl+NH3
若盐酸足量,Na3N+4HCl=3NaCl+NH4Cl - 1年前
 bksuliang 共回答了9个问题
bksuliang 共回答了9个问题 |采纳率- 硝酸+NaCl+氢气(本人猜的)
- 1年前
 kc17 共回答了31个问题
kc17 共回答了31个问题 |采纳率- 反应吗?不反应吧!
- 1年前
相关推荐
- 1、已知氮化钠在熔融时能导电,与水作用有NH3产生,试回答:(1)与水反应的化学方程式
1、已知氮化钠在熔融时能导电,与水作用有NH3产生,试回答:(1)与水反应的化学方程式
(2)与盐酸反应生成 种盐,
现有A、B、C、D四种元素,A、B同周期,A、B可形成两种无色无味的气体AB和AB2.D在B的下一周期,其最高价氧化物的水化物是二元强酸,D、C可形成离子化合物CD,D离子比C离子多一个电子层.据此可知:(1)这四种元素分别是 (2)化合物CD为 xhwf1年前3
xhwf1年前3 -
 啦小 共回答了20个问题
啦小 共回答了20个问题 |采纳率100%1.Na3N+3H2O=3NaOH+NH3(此处有上升箭头)
2.与盐酸反应生成NaCl+氨气(类似上面那个,都是复分解,无电子转移)
A是N,B是O,C是Mg,D是S
CD是MgS1年前查看全部
- 氮化钠与盐酸反应生成几种盐,分别是什么.
氮化钠与盐酸反应生成几种盐,分别是什么.
氮化钠的电子式怎么书写 medivh1年前1
medivh1年前1 -
 gavinlovewife 共回答了14个问题
gavinlovewife 共回答了14个问题 |采纳率85.7%2中 NH4Cl NaCl
Na3N+4HCl=NaCl+NH4Cl
氮化钠的电子式
--------Na+
--------*.
Na+[*.N:]3-
--------*.
--------Na+1年前查看全部
- (2012•虹口区二模)氮化钠(Na3N)和氢化钙(CaH2)均属于离子化合物,微粒结构和化学性质方面均存在某种相似性.
(2012•虹口区二模)氮化钠(Na3N)和氢化钙(CaH2)均属于离子化合物,微粒结构和化学性质方面均存在某种相似性.下列与之相关的分析正确的是( )
A.离子半径的大小:Na+>N3-
B.构成这两种化合物的化学键只有离子键,没有共价键
C.它们与水发生的反应均属于氧化还原反应
D.将两者组成的固体混合物溶于足量盐酸中可以获得三种不同的盐 csnm20081年前1
csnm20081年前1 -
 猫咪吃小鱼1 共回答了11个问题
猫咪吃小鱼1 共回答了11个问题 |采纳率100%解题思路:A.电子层结构相同的离子,离子半径随着原子序数的增大而减小;
B.活泼非金属元素和活泼金属元素之间存在离子键;
C.根据元素化合价是否变化进行判断;
D.根据物质之间发生的反应判断.A.钠离子和氮离子的电子层结构相同,钠元素的原子序数大于氮,所以离子半径:N3->Na+,故A错误;
B.氮化钠和氢化钙中只存在金属元素和非金属元素之间的离子键,不存在非金属元素之间的共价键,故B正确;
C.Na3N+3H2O=3NaOH+NH3↑,CaH2+H2O=Ca(OH)2+H2↑,根据方程式知,氮化钠和水反应不是氧化还原反应,故C错误;
D.两者组成的固体混合物溶于足量盐酸中发生Na3N+3H2O=NH3+3NaOH①、NH3+HCl=NH4Cl②、NaOH+HCl=NaCl+H2O③、CaH2+H2O=Ca(OH)2+H2↑④
、Ca(OH)2+2HCl=CaCl2+2H2O⑤,所以生成三种盐,故D正确;
故选BD.点评:
本题考点: 化学键;微粒半径大小的比较.
考点点评: 本题考查物质的结构性质、基本概念等知识点,明确物质之间的反应是解本题关键,难度不大.1年前查看全部
- 高中化学氮化钠是科学家制备的一种重要化合物,它与水作用可以产生氨气1.该化合物是由___键形成2.Na3N与盐酸反应生成
高中化学
氮化钠是科学家制备的一种重要化合物,它与水作用可以产生氨气
1.该化合物是由___键形成
2.Na3N与盐酸反应生成____种盐,其化学是为______
3.Na3N与水反应属于什么反应类型
4.比较Na+与 N3- 的 半径 霜渔1年前1
霜渔1年前1 -
 hcjlj 共回答了22个问题
hcjlj 共回答了22个问题 |采纳率86.4%离子
2 NH4Cl和NaCl
复分解反应(非氧化还原反应、水解反应)
Na+1年前查看全部
- 氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O→NaOH+NH3
NaH+H2O→NaOH+H2
有关它们的叙述正确的是( )
A.离子半径:N3->Na+>H+
B.与水反应都是氧化还原反应
C.与盐酸反应都只生成一种盐
D.两种化合物中的阴阳离子均具有相同的电子层结构 mgxwy1年前1
mgxwy1年前1 -
 wjh528 共回答了20个问题
wjh528 共回答了20个问题 |采纳率85%解题思路:A.电子层越多,半径越大,电子层一样,核电荷数越多,半径越小;
B.有元素化合价变化的反应是氧化还原反应;
C.氮化钠和盐酸反应会生成氯化钠、氯化铵两种盐,氢化钠与盐酸反应会生成氯化钠,据此解答;
D.NaH中,钠离子2个电子层,氢负离子只有1个电子层.A.电子层越多,半径越大,所以氢离子半径最小,电子层一样,核电荷数越多,半径越小,所以Na+<N3-,即N3->Na+>H+,故A正确;
B.Na3N+H2O→NaOH+NH3 该反应中没有元素化合价发生变化,不属于氧化还原反应,故B错误;
C.氮化钠和盐酸反应会生成氯化钠、氯化铵两种盐,氢化钠与盐酸反应会生成氯化钠,故C错误;
D.NaH中,钠离子2个电子层,氢负离子只有1个电子层,电子层结构不同,故D错误;
故选:A.点评:
本题考点: 钠的重要化合物.
考点点评: 本题考查了钠及其化合物的性质,涉及离子半径大小比较、氧化还原反应的判断、原子结构的判断,题目难度不大,把握氧化还原反应的规律,准确判断元素的化合价是解题关键.1年前查看全部
- (2012•崇明县二模)氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3↑,NaH+H2O
(2012•崇明县二模)氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3↑,NaH+H2O→NaOH+H2↑.有关Na3N和NaH的叙述正确的是( )
A.离子半径:Na+>N3->H+
B.加热熔化时,都只破坏离子键
C.与盐酸反应都只生成一种盐
D.与水反应都是氧化还原反应 深a深a深a1年前1
深a深a深a1年前1 -
 laofat 共回答了14个问题
laofat 共回答了14个问题 |采纳率78.6%A、电子层结构相同,核电荷数越大离子半径越小,离子半径Na+<N3-,氢离子半径最小,故离子半径N3->Na+>H+,故A错误;
B、由方程式可知,Na3N和NaH发生水解反应,二者都属于离子化合物,热熔化时,都只破坏离子键,故B正确;
C、Na3N与盐酸反应生成氯化钠与氯化铵,故C错误;
D、Na3N和NaH在水中发生水解反应,元素化合价未发生变化,属于非氧化还原反应,故D错误;
故选:D.1年前查看全部
- 氮化钠与水的反应方程式
 46除以21年前1
46除以21年前1 -
 是名 共回答了18个问题
是名 共回答了18个问题 |采纳率94.4%Na3N+3H2O=3NaOH+NH3↑1年前查看全部
- 氮化钠与水的反应属于什么反应
 亲属二号1年前1
亲属二号1年前1 -
 lanairen 共回答了18个问题
lanairen 共回答了18个问题 |采纳率88.9%属于水解反应,复分解反应
Na3N+3H2O=NH3+3NaOH1年前查看全部
- 氮化钠(Na 3 N)是科学家们制备的一种重要化合物,它与水作用的产物之一为NH 3 。请回答下列问题:
氮化钠(Na 3 N)是科学家们制备的一种重要化合物,它与水作用的产物之一为NH 3 。请回答下列问题:
(1)Na 3 N是由______键形成的化合物,写出它的电子式:_______。
(2)Na 3 N与水反应属于__________ (填基本反应类型),写出该反应的化学方程式:_____________。
(3)Na + 与N 3- 的半径关系是Na + _____(填“>”、“<” 或“=”)N 3- 。
(4)写出Na 3 N与盐酸的反应的化学方程式:______________________。 37花花1年前0
37花花1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (1)氮化钠(Na2N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
(1)氮化钠(Na2N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
(1)Na2N的电子式______;该化合物是由______键形成的;
(2)Na2N与盐酸反应生成______种盐;
(3)Na2N与水的反应属于______反应. 飞飞小ww1年前1
飞飞小ww1年前1 -
 baibaihh 共回答了18个问题
baibaihh 共回答了18个问题 |采纳率83.3%解题思路:(1)氮化钠为离子化合物,根据离子化合物的电子式书写方法写出其电子式;
(2)根据氮化钠与水的反应,判断氮化钠与盐酸反应产物;
(3)根据原子守恒,判断出氮化钠与与水反应产物,写出反应的化学方程式.(1)钠元素和氮元素分别是活泼的金属和活泼的非金属,所以二者形成的化学键是离子键,Na3N的电子式为:,故答案为:;离子;(2)氮化钠和水反应生成氨气,则根据原子守恒可判断,另外一种生成物应该是氢氧化钠,反...
点评:
本题考点: 电子式;化学键.
考点点评: 本题考查化学键的有关判断、电子式的书写及化学反应类型判断,题目难度不大,注意掌握电子式的书写方法,明确常见反应类型及判断方法,本题是基础性试题的考查,注重能力的考查,该题有利于巩固学生对教材基础知识的理解,培养学生的规范答题能力,提高学习效率.1年前查看全部
- 氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3.请回答下列问题:(1)写出NH3的
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3.请回答下列问题:(1)写出NH3的
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3.请回答下列问题:
(1)写出NH3的电子式______该化合物是由______键形成的.
(2)Na3N的电子式是______,该化合物是由______键形成的.
(3)Na3N与水的反应的方程式______
*(4)、Na3N与盐酸反应生成______种盐,其电子式分别是______,______.
 kaixinyu00201年前1
kaixinyu00201年前1 -
 骑蚂蚁赛大奔 共回答了16个问题
骑蚂蚁赛大奔 共回答了16个问题 |采纳率87.5%(1)氮原子和氢原子通过共价键形成氨气,氨气为共价化合物,电子式为: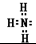 ,
,
故答案为: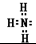 ;共价;
;共价;
(2)钠元素和氮元素分别是活泼的金属和活泼的非金属,所以二者形成的化学键是离子键,Na3N的电子式为: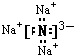 ,
,
故答案为: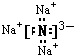 ;离子;
;离子;
(3)Na3N电离出Na+、N3-,H2O电离出H+、OH-,N3-和H+结合成为NH3,Na+与OH-结合成为NaOH,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,
故答案为:Na3N+3H2O=3NaOH+NH3↑;
(4)氮化钠和水反应生成氨气,则根据原子守恒可判断,另外一种生成物应该是氢氧化钠,所以氮化钠和盐酸反应的生成物应该是氯化钠和氯化铵,共计是2种盐,氯化钠和氯化铵都是离子化合物,氯化钠的电子式为: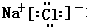 ,氯化铵的电子式为:
,氯化铵的电子式为: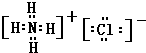 ,
,
故答案为:2;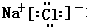 ;
;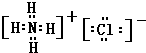 .
1年前查看全部
.
1年前查看全部
- 氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3.请回答下列问题:
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3.请回答下列问题:
(1)Na3N的电子式是______,该化合物是由______键形成的.
(2)Na3N与盐酸反应生成______种盐,其电子式是______.
(3)比较Na3N中两种微粒的半径:r(Na+)______r(N3-)(填“>”、“=”或“<”). bosiju321年前1
bosiju321年前1 -
 龙腾四海1976 共回答了18个问题
龙腾四海1976 共回答了18个问题 |采纳率94.4%解题思路:(1)根据氮化钠(Na3N)与水作用可产生NH3知,氮化钠(Na3N)能电离出自由移动的钠离子和N3-,由此判断氮化钠是离子化合物;根据离子化合物的电子式书写规则书写即可;活泼金属和活泼非金属之间存在离子键.
(2)先写氮化钠和水反应的方程式,再写生成物和酸反应的方程式,两式相加即可得出氮化钠和盐酸反应的方程式;根据离子化合物的电子式书写规则书写即可.
(3)具有相同电子层结构的离子,核电荷数与离子半径成反比.(1)Na3N电离出Na+、N3-,H2O电离出H+、OH-,N3-和H+结合成为NH3,Na+与OH-结合成为NaOH,所以Na3N为离子化合物,是由离子键结合形成的,其电子式为:
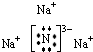 .
.
故答案为: ,离子键.
,离子键.
(2)氮化钠和水反应生成氨气和氢氧化钠,Na3N+3H2O=NH3+3NaOH①
氨气和盐酸反应生成氯化铵:NH3+HCl=NH4Cl②
氢氧化钠和盐酸反应生成氯化钠和水:NaOH+HCl=NaCl+H2O③
通过方程式知,生成的盐有NaCl、NH4Cl,所以生成两种盐.
其电子式分别为: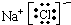 和
和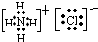
故答案为:2;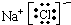 、
、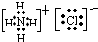 .
.
(3)Na+与N3-属电子层结构相同的粒子,核电荷数越大半径越小,故Na+的核电荷数大而N3-半径小,r(Na+)<r(N3-).
故答案为:<.点评:
本题考点: 化学键;电子式;微粒半径大小的比较.
考点点评: 本题考查了化学键、电子式的书写及离子半径大小的比较等知识点,相同电子层结构的离子,核电荷数与离子半径成反比,核电荷数越大,半径越小;本题难度不大,注意基础知识的总结.1年前查看全部
- 氮化钠与水反应生成氨气的反应是什么反应?
氮化钠与水反应生成氨气的反应是什么反应?
重难点上说是复分解……但是我怎么看都不像啊……
为什么?
量子海洋……好像不是两种单质生成两种单质吧% 一个人想你1年前3
一个人想你1年前3 -
 andy_sk228 共回答了20个问题
andy_sk228 共回答了20个问题 |采纳率100%是复分解反应,因为两种化合物反应生成了另外两种化合物,而且化合价都没有发生变化
Na3N + 3H20 === 3NaOH + NH3↑
其实和氧化钠跟水反应没有本质上的区别
PS.我打错了1年前查看全部
- 氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3,NaH+H2O→NaOH+H2↑.有关N
氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3,NaH+H2O→NaOH+H2↑.有关Na3N和NaH的
氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3,NaH+H2O→NaOH+H2↑.有关Na3N和NaH的叙述正确的是( )
A.离子半径:Na+>N3->H+
B.与水反应都是氧化还原反应
C.与盐酸反应都只生成一种盐
D.加热熔化时,都只破坏离子键
 电之驴1年前1
电之驴1年前1 -
 carpon 共回答了17个问题
carpon 共回答了17个问题 |采纳率88.2%A、电子层越多,半径越大,所以氢离子半径最小,电子层一样,核电荷数越多,半径越小,所以Na+<N3-,即N3->Na+>H+,故A错误;
B、反应Na3N+3H2O=3NaOH+NH3中镁有元素化合价变化,不是氧化还原反应,故B错误;
C、氮化钠和盐酸反应会生成氯化钠、氯化铵两种盐,氢化钠与盐酸反应会生成氯化钠,故C错误;
D、氮化钠和氢化钠中只含有离子键,加热熔化时,钠离子和氮离子以及钠离子和氢离子之间的离子键断开,故D正确.
故选D.1年前查看全部
- Na3N氮化钠是离子还是共价化合物?
 c483201年前1
c483201年前1 -
 韶能沦落人 共回答了19个问题
韶能沦落人 共回答了19个问题 |采纳率94.7%是离子化合物,由N3-离子和Na+构成,只能以固体形式存在,因为N3-在水溶液中不稳定,会变成NH31年前查看全部
- 氮元素与钠元素可形成一种重要的物质氮化钠(Na3N),它与水剧烈反应生成NaOH和NH3.回答下
氮元素与钠元素可形成一种重要的物质氮化钠(Na3N),它与水剧烈反应生成NaOH和NH3.回答下
(1)Na3N为_化合物.(2)NaOH固体中存在的化学键是—、(3)NH3的电子式为—(4)用电子式表示H2O分子的形成过程. 倾城_绝恋1年前1
倾城_绝恋1年前1 -
 vgp11c8vh5025 共回答了14个问题
vgp11c8vh5025 共回答了14个问题 |采纳率100%(1)Na3N为_离子化合物.(2)NaOH固体中存在的化学键是离子键和共价键—、(3)NH3的电子式为—(4)用电子式表示H2O分子的形成过程.1年前查看全部
- 氮化钠电子式
 yanxiaolong20051年前1
yanxiaolong20051年前1 -
 枳or橘 共回答了10个问题
枳or橘 共回答了10个问题 |采纳率100%描述一下吧.[ N ]^3- .氮原子上下左右各有两个点.在这个符号的上下左右中的任意三面写下三个Na^+1年前查看全部
- 氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水反应可生成NH3.请回答下列问题:
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水反应可生成NH3.请回答下列问题:
(1)Na3N的电子式为______,由______键形成.
(2)Na3N与盐酸反应生成两种盐,其电子式分别是______,______.
(3)Na3N与水的反应属于______(填基本反应类型)反应.
(4)比较Na3N中两种粒子的半径:r(Na+)______r(N3-)(填“>”“=”或“<”). 庶人1年前1
庶人1年前1 -
 fayeflying985 共回答了17个问题
fayeflying985 共回答了17个问题 |采纳率94.1%解题思路:(1)根据氮化钠(Na3N)与水作用可产生NH3知,氮化钠(Na3N)能电离出自由移动的钠离子和N3-,由此判断氮化钠是离子化合物;根据离子化合物的电子式书写规则书写即可;活泼金属和活泼非金属之间存在离子键.
(2)先写氮化钠和水反应的方程式,再写生成物和酸反应的方程式,两式相加即可得出氮化钠和盐酸反应的方程式;根据离子化合物的电子式书写规则书写即可.
(3)Na3N与水的反应生成氢氧化钠和氨气属于复分解反应;
具有相同电子层结构的离子,核电荷数与离子半径成反比.(1)Na3N电离出Na+、N3-,H2O电离出H+、OH-,N3-和H+结合成为NH3,Na+与OH-结合成为NaOH,所以Na3N为离子化合物,是由离子键结合形成的,其电子式为:
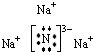 .
.
故答案为: ,离子键;
,离子键;
(2)氮化钠和水反应生成氨气和氢氧化钠,Na3N+3H2O=NH3+3NaOH①
氨气和盐酸反应生成氯化铵:NH3+HCl=NH4Cl②
氢氧化钠和盐酸反应生成氯化钠和水:NaOH+HCl=NaCl+H2O③
通过方程式知,生成的盐有NaCl、NH4Cl,所以生成两种盐.
其电子式分别为: 和
和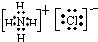
故答案为:2; 、
、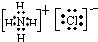 ;
;
(3)Na3N与水的反应Na3N+3H2O=NH3+3NaOH,属于复分解反应;
故答案为:复分解反应;
(4)Na+与N3-属电子层结构相同的粒子,核电荷数越大半径越小,故Na+的核电荷数大而N3-半径小,r(Na+)<r(N3-).
故答案为:<.点评:
本题考点: 钠的重要化合物;电子式.
考点点评: 本题考查了化学键、电子式的书写及离子半径大小的比较等知识点,相同电子层结构的离子,核电荷数与离子半径成反比,核电荷数越大,半径越小;本题难度不大,注意基础知识的总结.1年前查看全部
- 氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
(1)Na3N的电子式______,该化合物是由______键形成的.
(2)Na3N与盐酸反应生成______种盐.
(3)Na3N与水的反应属于______反应. c80nmli1年前1
c80nmli1年前1 -
 胡萝卜0916 共回答了23个问题
胡萝卜0916 共回答了23个问题 |采纳率87%解题思路:氮化钠为离子化合物,可与盐酸反应生成氯化钠和氯化铵,与水反应生成氢氧化钠和氨气,以此解答该题.(1)钠元素和氮元素分别是活泼的金属和活泼的非金属,所以二者形成的化学键是离子键,Na3N的电子式为:
 ,
,
故答案为: ;离子;
;离子;
(2)氮化钠和水反应生成氨气和氢氧化钠,Na3N+3H2O=NH3+3NaOH,
氨气和盐酸反应生成氯化铵:NH3+HCl=NH4Cl,
氢氧化钠和盐酸反应生成氯化钠和水:NaOH+HCl=NaCl+H2O,
根据反应方程式知,生成的盐有:NaCl、NH4Cl,所以生成两种盐,
故答案为:2;
(3)氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,
故答案为:复分解.点评:
本题考点: 钠的重要化合物.
考点点评: 本题考查钠的化合物,为高频考点,侧重于基础性试题的考查,试题基础性强,注重能力的考查,该题有利于巩固学生对教材基础知识的理解,培养学生的规范答题能力,提高学习效率,难度不大.1年前查看全部
- 氮化钠(Na 3 N)是科学家制备的一种重要的化合物,它与水作用可产生NH 3 。请回答下列问题:
氮化钠(Na 3 N)是科学家制备的一种重要的化合物,它与水作用可产生NH 3 。请回答下列问题:
(1)Na 3 N的电子式是_________________,该化合物是由____________键形成的。
(2)Na 3 N与盐酸反应生成_____________种盐,其电子式是___________________。
(3)比较Na 3 N中两种微粒的半径:r(Na + )__________r(N 3- )(填“>”.“=”或“<”)。 springcomnet1年前0
springcomnet1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 氮化钠(Na3N)的电子式是什么?它是共价化合物还是离子化合物?
 快乐甜心1年前1
快乐甜心1年前1 -
 jiushiwo246 共回答了14个问题
jiushiwo246 共回答了14个问题 |采纳率85.7%看看这个吧,是离子化合物1年前查看全部
- 氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3
1.该化合物由----键形成的
2.与水反应属于----反应 sadfgjkealsthrth1年前2
sadfgjkealsthrth1年前2 -
 蓝色的XXX 共回答了21个问题
蓝色的XXX 共回答了21个问题 |采纳率81%离子键!
复分解反应!
不是氧化还原反应!因为各元素的化合价均未发生变化!1年前查看全部
- 氮化钠通入稀盐酸反应生成什么?
 coolyc1年前3
coolyc1年前3 -
 0pp1965 共回答了10个问题
0pp1965 共回答了10个问题 |采纳率100%氮化钠与盐酸反应是发生以下方式:Na3N+3HCl=3NaCl+NH3,NH3+HCl=NH4Cl 总反应是:Na3N+4HCl=3NaCl+NH4Cl1年前查看全部
- 氮化钠通入稀盐酸反应生成什么?
 黑哪1年前3
黑哪1年前3 -
 流得滑88 共回答了19个问题
流得滑88 共回答了19个问题 |采纳率84.2%氮化钠与盐酸反应是发生以下方式:Na3N+3HCl=3NaCl+NH3,NH3+HCl=NH4Cl 总反应是:Na3N+4HCl=3NaCl+NH4Cl1年前查看全部
- 氮化钠与水反应为什么是复分解反应?求大神帮助
氮化钠与水反应为什么是复分解反应?求大神帮助
它们好象不是酸、碱、盐之间的反应.
 江南楼宇1年前1
江南楼宇1年前1 -
 windabc123 共回答了23个问题
windabc123 共回答了23个问题 |采纳率95.7%这个反应应该不叫复分解反应,应该属于氧化还原反应更准确点.1年前查看全部
- 氮化钠是科学家制备的一种重要化合物 比较Na3N中两微粒的半径
氮化钠是科学家制备的一种重要化合物 比较Na3N中两微粒的半径
r(Na+)___________r(N3-)请详细说明理由 网上捕快1年前1
网上捕快1年前1 -
 太上忘情_梦中花 共回答了13个问题
太上忘情_梦中花 共回答了13个问题 |采纳率84.6%应该是小于吧.
它们具有相同的电子构型:2 8
钠中质子更多,对核外电子吸引力更大,半径就更小1年前查看全部
- 氮化钠(Na3N),与水作用产生NH3,它的电子式是____,是由_____什么键构成 (判断依据是什么?)
 310170021年前1
310170021年前1 -
 cicino4 共回答了22个问题
cicino4 共回答了22个问题 |采纳率95.5%..
Na:N:Na 离子键,电负性差值大于1.7
..
Na1年前查看全部
- 氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3
ANa3N是离子化合物
BNa原子失去3个电子形成钠离子,氮原子得到3个电子形成带3个单位负电荷的氮离子
C.Na3N能与盐酸反应生成NaCl和NH3
B为什么错C的方程式是什么? 飘曳781年前3
飘曳781年前3 -
 戚斯泥 共回答了17个问题
戚斯泥 共回答了17个问题 |采纳率88.2%B不对吧,我认为应该是3个Na原子各失去一个电子,N原子得到三个电子
Na3N+3HCL=3NaCl+NH31年前查看全部
- 为什么说"碱金属里面只有锂可以生成氮化物",不是有氮化钠吗?
 vieri0011年前1
vieri0011年前1 -
 Captain2008 共回答了25个问题
Captain2008 共回答了25个问题 |采纳率80%碱金属中,只有Li才能直接与N2反应生成Li3N(Li在N2中燃烧即可),其他碱金属均不能直接与N2反应,相应氮化物只能用间接方法制备.例如,Na3N是通过用金属Na还原叠氮化钠NaN3得到的.
你给的那句话是不严格的,应该说“碱金属里面只有锂可以直接生成氮化物”1年前查看全部
大家在问
- 1宋代南方人的主食是 [ ] A.米饭
- 2描写月亮的诗句,两句
- 3比较生物膜法和活性污泥法的优缺点?
- 4在抛物线y=x^2+4x+3上找一点M,使∠AME=90°,其中A(-4,3) E(-1,0)
- 5大家帮帮忙吧!要写出合适的成语.抢时间 破折号 后面是什么?急急急!
- 6某商场的冰箱按原价的八折销售,如果要销售的总收入不变,那么销售量应增加百分之多少?
- 7(崭新、缩短、沉闷、甜蜜)反义词是什么
- 8某小学占地8000平方米,其中绿地面积65%,其余为教学楼和道路,小学的绿地面积有多少平方米?教学楼和
- 9中子星是恒星演变最后一形式(1)一密度均匀,以角速度ω绕自身的几何对称轴转动.若维持其表面物质作圆周运动的力只有万有引力
- 10X-100=(Y+Z)×2/13 y-100=(x+z)×9/16 z-90=(x+y)×1/3
- 11三年级(2)班有37名同学参加比赛,其中参加数学竞赛的有28人,参加作文竞赛的有30人。既参加数学竞赛又参加作文竞赛的有
- 12在农田中长期使用某种农药,会发现这种农药的灭虫效果越来越差,试用达尔文的自然选择学说解释这种现象
- 13seasons in china 英语作文
- 14(2014•威海)下列属于相对性状的是( )
- 15“这本书起着承上启下的作用”用英语怎么说?
